Таксоиды, способы их получения и фармацевтическая композиция на их основе
Формула / Реферат
1. Таксоиды общей формулы (I)
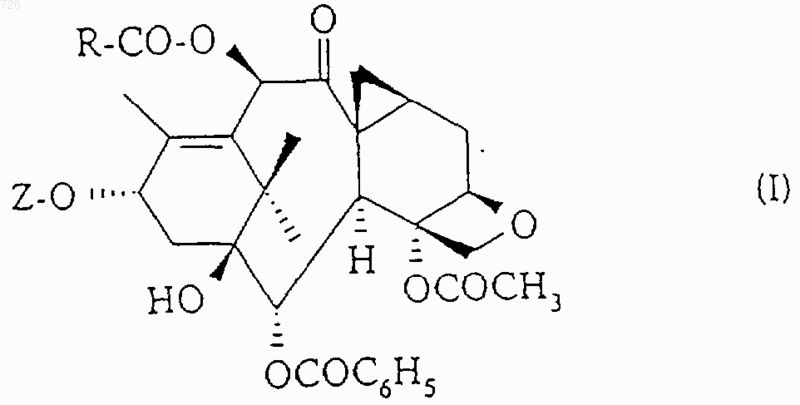
в которой R означает циклопропил, циклопентил, фенил, пирид-2-ил, тиен-2-ил или фур-2-ил;
Z означает радикал общей формулы (II)
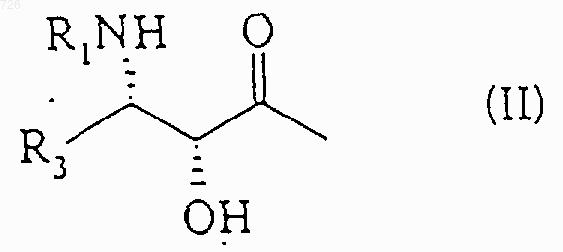
в которой R1 означает
бензоильный радикал
или радикал R2-O-CO-, в котором R2 означает трет.-бутильный радикал, и R3 означает изобутильный, изобутенильный, бутенильный, циклогексильный, фенильный, фур-2-ильный, фур-3-ильный, тиен-2-ильный, тиен-3-ильный, тиазол-2-ильный, тиазол-4-ильный или тиазол-5-ильный радикал.
2. Способ получения таксоидов по п.1, заключающийся в том, что соединение общей формулы (III)

в которой R1 и R3 имеют указанное в п.1 значение, и либо R6 означает атом водорода, а R7 означает защитную для гидроксильной функции группу, либо R6 и R7 вместе образуют насыщенный пяти- или шестичленный гетероцикл,
этерифицируют с помощью кислоты общей формулы (IV)
R-CO-OH (IV)
в которой R имеет вышеуказанное значение,
или с помощью производного этой кислоты, такого как галоидангидрид, симметричный ангидрид или смешанный ангидрид, с получением соединения общей формулы (V)
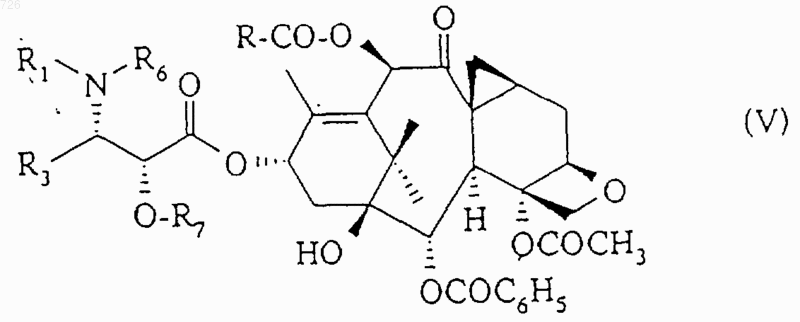
в которой R1, R3, R6 и R7 имеют вышеуказанное значение,
затем защитные группы R7 или R6 и R7 заменяют атомами водорода.
3. Способ по п.2, отличающийся тем, что этерификацию осуществляют с помощью кислоты общей формулы (IV) в присутствии конденсационного агента и агента активации в органическом растворителе при температуре от - 10 до 90шС.
4. Способ по п.2, отличающийся тем, что этерификацию осуществляют с помощью кислоты общей формулы (IV) в форме симметричного ангидрида, работая в присутствии агента активации в органическом растворителе при температуре от 0 до 90шС.
5. Способ по п.2, отличающийся тем, что этерификацию осуществляют с помощью кислоты общей формулы (IV) в форме галоидангидрида или в форме смешанного ангидрида с алифатической или ароматической кислотой, возможно, получаемого in situ, в присутствии основания, работая в органическом растворителе при температуре от 0 до 80шС.
6. Способ по п.2, отличающийся тем, что когда R6 означает атом водорода и R7 означает защитную для гидроксильной функции группу, защитную группу заменяют атомом водорода с помощью неорганической или органической кислоты, используемой индивидуально или в смеси, работая в органическом растворителе, выбираемом среди спиртов, простых и сложных эфиров, алифатических углеводородов, алифатических галогенированных углеводородов, ароматических углеводородов или нитрилов, при температуре от - 10 до 60шС.
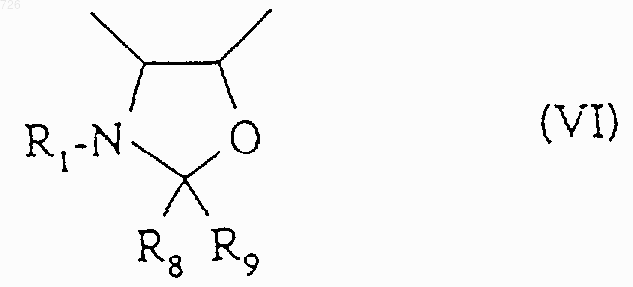
7. Способ по п.2, отличающийся тем, что когда R6 и R7 образуют оксазолидиновый цикл общей формулы (VI)
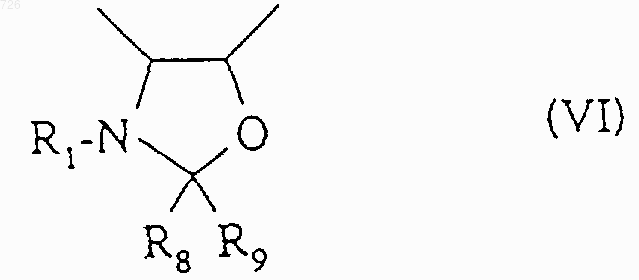
в которой R1 означает трет.-бутоксикарбонильный радикал, R8 и R9, одинаковые или разные, означают алкильный радикал или аралкильный радикал или арильный радикал, или R8 означает тригалогенметильный радикал или фенильный радикал, замещенный тригалогенметильным радикалом, a R9 означает атом водорода, или R8 и R9 вместе образуют 4-7-членный цикл,
замену защитных групп R6 и R7 атомами водорода осуществляют путем обработки сложного эфира общей формулы (V) неорганической или органической кислотой, возможно, в органическом растворителе, с получением продукта общей формулы (VII)
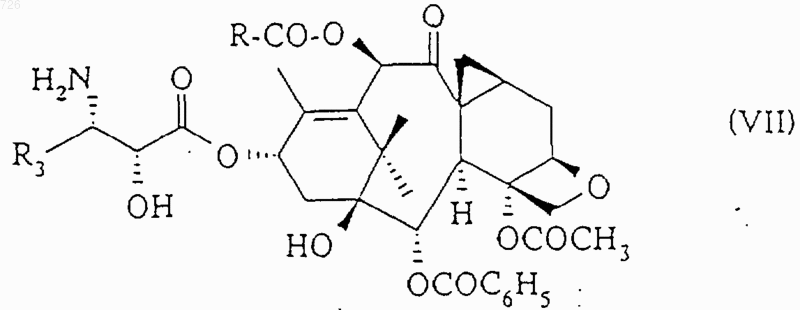
в которой R3 имеет вышеуказанное значение,
который ацилируют с помощью бензоилхлорида
или продукта общей формулы (VIII)
R2-O-CO-X (VIII)
в которой R2 имеет вышеуказанное значение, а Х означает атом галогена или группу -О-R2 или -О-СО-О-R2,
с получением продукта общей формулы (I), в которой Z означает радикал общей формулы (II).
8. Способ по п.2, отличающийся тем, что когда R6 и R7 образуют оксазолидиновый цикл общей формулы (VI)
в которой R1 означает бензоильный радикал или радикал R2-O-СО-, в котором R2 имеет вышеуказанное значение, R8 означает атом водорода или алкоксильный радикал с 1-4 атомами углерода или фенильный радикал, замещенный одним или несколькими алкоксильными радикалами с 1-4 атомами углерода, и R9 означает атом водорода, замену защитной группы, образуемой R6 и R7, атомами водорода осуществляют в присутствии неорганической или органической кислоты, используемой индивидуально или в смеси, в стехиометрическом или каталитическом количестве, работая в органическом растворителе при температуре от - 10 до 60шС.
9. Способ получения таксоидов общей формулы (I), в которой Z означает радикал общей формулы (II), заключающийся в том, что производное баккатина-III формулы (XI)
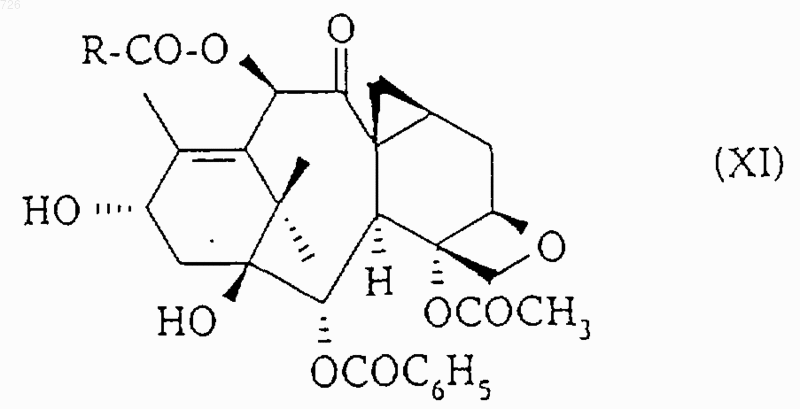
этерифицируют с помощью кислоты общей формулы (X)
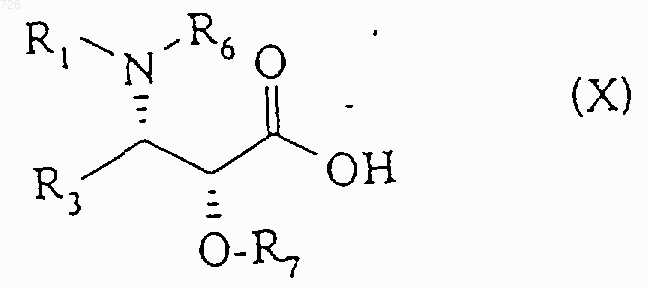
в которой R1, R3 имеют указанное в п.1 значение, R6 и R7 имеют указанное в п.2 значение,
или с помощью производного этой кислоты, такого как галоидангидрид, симметричный ангидрид или смешанный ангидрид, с последующей заменой защитных групп R7 или R6 и R7 атомами водорода.
10. Способ по п.9, отличающийся тем, что этерификацию осуществляют по способу согласно любому из пп.3, 4 или 5.
11. Способ по п.9, отличающийся тем, что защитные группы R7 или R6 и R7 заменяют атомами водорода в условиях по п.6.
12. Фармацевтическая композиция, отличающаяся тем, что она содержит, по крайней мере, одно соединение по любому из пп.1-3, в котором Z означает радикал общей формулы (II), в ассоциации с одним или несколькими фармацевтически приемлемыми продуктами, которые являются инертными или фармакологически активными.
Текст
1 Настоящее изобретение относится к новым таксоидам общей формулы (I) в которой R означает циклопропил, циклопентил, фенил, пирид-2-ил, тиен-2-ил или фур-2-ил,Z означает радикал общей формулы (II) в которой R1 означает бензоильный радикал или радикал R2-О-СО-, в котором R2 означает трет.бутильный радикал, и R3 означает изобутильный, изобутенильный, бутенильный, циклогексильный, фенильный, фур-2-ильный, фур-3 ильный, тиен-2-ильный, тиен-3-ильный, тиазол 2-ильный, тиазол-4-ильный или тиазол-5 ильный радикал. Из соединений, описанных в уровне техники, можно назвать описанные в патенте Франции 2 698 871 соединения, содержащие циклопропильную группу в положении 7-8 и содержащие в положении 10 либо гидроксильную группу, либо ацетильную группу, причем все другие заместители аналогичны заместителям настоящего изобретения. В патенте США 5 254 580 описываются соединения, содержащие циклопропильную группу в положении 7-8 и содержащие в положении 10 группу -OCOR, -OCOOR, Н, ОН или СО. Все эти производные отличаются от производных настоящего изобретения. Продукты общей формулы (I), в которой Z означает радикал общей формулы (II), обладают ценными противоопухолевыми и антилейкемическими свойствами. Согласно изобретению, продукты общей формулы (I), в которой Z означает радикал общей формулы (II), могут быть получены путем этерификации продукта общей формулы (III)R7 означает защитную для гидроксильной функции группу, либоR6 и R7 вместе образуют насыщенный пяти- или шестичленный гетероцикл,с помощью кислоты общей формулы (IV) 2 или с помощью производного этой кислоты,такого как галоидангидрид, симметричный ангидрид или смешанный ангидрид,с получением продукта общей формулы (V) в которой R1, R3, R6 и R7 имеют вышеуказанное значение, с последующей заменой защитных групп R7 или R6 и R7 атомами водорода. Этерификацию с помощью кислоты общей формулы (IV) можно проводить в присутствии конденсационного агента (карбодиимид, реакционноспособный карбонат) и агента активации(простые и сложные эфиры, кетоны, нитрилы,алифатические углеводороды, алифатические галогенированные углеводороды, ароматические углеводороды) при температуре от 10 до 90 С. Этерификацию также можно осуществлять при использовании кислоты общей формулы(IV) в форме симметричного ангидрида, работая в присутствии агента активации (аминопиридины) в органическом растворителе (простые и сложные эфиры, кетоны, нитрилы, алифатические углеводороды, алифатические галогенированные углеводороды, ароматические углеводороды) при температуре от 0 до 90 С. Этерификацию также можно осуществлять при использовании кислоты общей формулы(IV) в форме галоидангидрида или смешанного ангидрида с алифатической или ароматической кислотой, возможно, получаемого in situ, в присутствии основания (третичный алифатический амин), работая в органическом растворителе(простые и сложные эфиры, кетоны, нитрилы,алифатические углеводороды, алифатические галогенированные углеводороды, ароматические углеводороды) при температуре от 0 до 80 С. Когда R6 означает атом водорода, R7 представляет собой предпочтительно метоксиметильный,1-этоксиэтильный,бензилоксиметильный, триметилсилильный, триэтилсилильный, -триметилсилилэтоксиметильный,бензилоксикарбонильный или тетрагидропиранильный радикал. Когда R6 и R7 вместе образуют гетероцикл,то он предпочтительно представляет собой оксазолидиновый цикл, возможно, монозамещенный или гемдизамещенный в положении 2. Замену защитных групп R7 и/или R6 и R7 атомами водорода можно осуществлять в зависимости от их природы следующим образом: 1) когда R6 означает атом водорода, и R7 означает защитную для гидроксильной функции группу, замену защитных групп атомами водорода осуществляют с помощью неорганической кислоты (соляная кислота, серная кислота, фто 3 роводородная кислота) или органической кислоты (уксусная кислота, метансульфокислота,трифторметансульфокислота, п-толуолсульфокислота), используемой индивидуально или в виде смеси, работая в органическом растворителе, выбираемом среди спиртов, простых и сложных эфиров, алифатических углеводородов, алифатических галогенированных углеводородов, ароматических углеводородов или нитрилов, при температуре от 10 до 60 С; 2) когда R6 и R7 образуют оксазолидиновый цикл общей формулы (VI)R1 означает трет.бутоксикарбонильный радикал, R8 и R9, одинаковые или разные, означают алкильный радикал или аралкильный радикал или арильный радикал, или R8 означает тригалогенметильный радикал или фенильный радикал, замещенный тригалогенметильным радикалом, a R9 означает атом водорода, или R8 и R9 вместе образуют 4-7 членный цикл, замену защитных групп R6 и R7 атомами водорода осуществляют путем обработки сложного эфира общей формулы (V) неорганической или органической кислотой, возможно, в органическом растворителе, таком как спирт, получают продукт общей формулы (VII) в которой R3 имеет вышеуказанное значение,который ацилируют с помощью бензоилхлорида,или продукта общей формулы (VIII)(VIII),в которой R2 имеет вышеуказанное значение, а Х означает атом галогена (фтор, хлор) или группу -ОR2 или -О-СО-О-R2,с получением продукта общей формулы (I), в которой Z означает радикал общей формулы(II). Предпочтительно, продукт общей формулы (V) обрабатывают муравьиной кислотой при температуре около 20 С с получением продукта общей формулы (VII). Предпочтительно, ацилирование продукта общей формулы (VII) с помощью бензоилхлорида, или продукта общей формулы (VIII) осуществляют в инертном органическом растворителе, выбираемом среди сложных эфиров, таких как этилацетат, изопропилацетат или нбутилацетат, и алифатических галогенированных углеводородов, таких как дихлорметан или 1,2-дихлорэтан, в присутствии неорганического основания, такого как бикарбонат натрия, или 4 органического основания, такого как триэтиламин. Реакцию проводят при температуре от 0 до 50 С, предпочтительно около 20 С; 3) когда R6 и R7 образуют оксазолидиновый цикл общей формулы (VI) в которой R1 означает бензоильный радикал или радикал R2-O-СО-, в котором R2 имеет вышеуказанное значение, R8 означает атом водорода или алкоксильный радикал с 1-4 атомами углерода или фенильный радикал, замещенный одним или несколькими алкоксильными радикалами с 1-4 атомами углерода, и R9 означает атом водорода,замену образуемой R6 и R7 защитной группы атомами водорода осуществляют в присутствии неорганической кислоты (соляная кислота, серная кислота) или органической кислоты(уксусная кислота, метансульфокислота, трифторметансульфокислота,н-толуолсульфокислота), используемой индивидуально или в смеси, в стехиометрическом или каталитическом количестве, работая в органическом растворителе, выбираемом среди спиртов, простых и сложных эфиров, алифатических углеводородов, алифатических галогенированных углеводородов и ароматических углеводородов, при температуре от 10 до 60 С, предпочтительно при 15-30 С. Продукты общей формулы (III) могут быть получены в условиях, описанных в международной заявке 94/13654. Продукты общей формулы (III) также могут быть получены путем этерификации производного баккатина-III формулы (IX) с помощью кислоты общей формулы (X) в которой R1, R3, R6 и R7 имеют вышеуказанное значение,или с помощью производного этой кислоты,такого как галоидангидрид, симметричный ангидрид или смешанный ангидрид, затем заменяют ацетокси-радикал в положении 10 на гидроксильный радикал. Этерификацию осуществляют в условиях,аналогичных таковым, описанным выше для этерификации продукта общей формулы (III) с помощью кислоты общей формулы (IV). 5 Замену ацетокси-радикала в положении 10 гидроксильным радикалом обычно осуществляют с помощью иодида цинка. Продукт формулы (IX) может быть получен в условиях, описанных в международной заявке 94/13654, путем воздействия галогенида щелочного металла (иодид натрия, фторид калия) или азида щелочного металла (азид натрия) или четвертичной аммониевой соли или фосфата щелочного металла на 2-бензоилокси 4,10-диацетокси-1,13-дигидрокси-5,20 эпокси-7-трифторметилсульфонилокси-9-оксотакс-11-ен. Продукты общей формулы (I), в которой Z означает радикал общей формулы (II), могут быть также получены путем этерификации продукта общей формулы (XI) в которой R имеет вышеуказанное значение,с помощью кислоты общей формулы (X) в которой R1, R3, R6 и R7 имеют указанное выше значение,или с помощью производного этой кислоты, такого как галоидангидрид, симметричный ангидрид или смешанный ангидрид, с получением продукта общей формулы (V), защитные группы которого R7 или R6 и R7 заменяют атомами водорода в вышеописанных условиях. Продукты общей формулы (XI), т.е. продукты общей формулы (I), в которой Z означает атом водорода, могут быть получены путем этерификации продукта формулы (XII) в которой Z1 означает защитную для гидроксильной функции группу, такую как силилированный радикал, например, как триэтилсилильный радикал,с помощью кислоты общей формулы (IV) или производного этой кислоты, такого как галоидангидрид или симметричный ангидрид или смешанный ангидрид, в вышеописанных условиях для этерификации продукта общей формулы (III) с помощью кислоты общей формулы(IV) или производного этой кислоты, с последующей заменой защитной группы Z1 атомом 6 водорода в условиях, в которых не затрагивается остальная часть молекулы. Продукт общей формулы (XII) может быть получен в условиях, описанных в международной заявке 94/13654. Новые продукты общей формулы (I), получаемые путем осуществления способа согласно изобретению, можно очищать известными методами, такими как кристаллизация или хроматография. Продукты общей формулы (I), в которой Z означает радикал общей формулы (II), обладают ценными биологическими свойствами. Измерение биологической активности ин витро осуществляли на тубулине, извлекаемом из головного мозга свиньи, по методу M.L. Shelanski и др., Proc. Natl. Acad. Sci. USA, 70, 765768 (1973). Изучение деполимеризации микротрубочек до тубулина осуществляют по методуG. Chauviere и др., С. R. Acad. Sci., 293, серия II,501-503 (1981). При этом изучении продукты общей формулы (I), в которой Z означает радикал общей формулы (II), показали себя, по меньшей мере, такими же активными, как и таксол и таксотер. При исследовании ин виво, продукты общей формулы (I), в которой Z означает радикал общей формулы (II), показали себя активными на мыши, которой трансплантирована меланома В 16, в дозах, составляющих от 1 до 10 мг/кг при интераперитонеальном введении, а также на других жидких или твердых опухолях. Новые продукты обладают противоопухолевой активностью, более конкретно, активностью в отношении опухолей, которые устойчивы к таксолу или таксотеру. К таким опухолям относятся опухоли ободочной кишки, которые имеют повышенную экспрессию гена mdr 1(ген устойчивости к многочисленным лекарственным средствам). Устойчивость к многочисленным лекарственным средствам представляет собой обычный термин, относящийся к устойчивости опухоли к лечебным продуктам разных структур и разных механизмов действия. Таксоиды вообще известны тем, что они в высокой степени распознаются экспериментальными опухолями, такими как P388/DOX, линия клеток, выбираемая по ее устойчивости к диксорубицину (DOX) и которая сверхэкспрессирует ген mdr 1. Протокол эксперимента Линии Р 388 и P388/DOX лейкемических клеток мышей растили в культуральной средеP388/DOX, добавляли доксорцбицин (1 мкг/мл). Клетки Р 388/СРТ 5 представляют собой стабильный, резистентный к камптотецину субклон, выделенный на мягком агаре и получен 7 ный из линии клеток Р 388 СРТО.3 (1). Клетки выращивали в той же среде, что и клетки Р 388. Условия получения линии клеток N417 мелкоклеточного рака легких человека описаны в работе Carney et al. (2). Клетки KB эпидермальной карциномы человека растили в модифицированной Дульбекко среде Игла с добавлением 2 мМ глутамина и 10% бычьей эмбриональной сыворотки. Линию клеток SV1Ras4 после трансформации эмбриональных клеток DBA2 мыши большим Т-антигеном и VHa-rasонкогеном вируса SV40 (3). Линию клеток Т 24 рака мочевого пузыря человека растили в среде МакКоу 5 а, обогащенной 2 мМ L-глутамином и 10% эмбриональной бычьей сывороткой. Клетки линии Саlс 18 рака молочной железы человека и клетки Саlс 18/АМ с приобретенной резистентностыо к mAMSA культивировали в виде монослоя в модифицированной Дульбекко среде Игла, обогащенной 10% эмбриональной бычьей сывороткой (4). Клетки линии НСТ 116 аденокарциномы прямой кишки человека культивировали в среде Фишера CMRL-1066 (50/50 по объему) с добавлением 2 мМ L-глутамина, 4 мМCaCl2, 20 мкг/мл гентамицина и 10% (по объему) эмбриональной бычьей сыворотки (5). Уровни ДНК, РНК и белкового синтеза в клетках Р 388 в фазе экспоненциального роста определяли по уровню включения радиоактивных предшественников (6). Обработку клеток лекарственными препаратами производили в течение 3 ч, ставя по 4 параллельные пробы для каждой концентрации. Результаты выражали в процентах включившейся радиоактивной метки относительно контролей и представляли собой средние значения, по меньшей мере, двух независимых определений. Концентрацию лекарственных препаратов,вызывающую 50% ингибирование роста (IC50),определяли на основании 2 или трех независимых экспериментов, поставленных в 96 луночных микрокультуральных планшетах. Клетки высевали в концентрации 3 х 104 - 3 х 105 клеток/мл (0,2 мл/лунку) и культивировали в течение 96-120 ч в присутствии различных концентраций лекарственных препаратов (по 4 определения на каждую точку). После этого клетки культивировали в течение 16 ч в присутствии 0,02% нейтрального красного. Затем клетки промывали и лизировали, добавляя 1% SDS. Включение метки, отражающее рост клеток и их жизнеспособность, оценивали, измеряя спектрофотометрически оптическую плотность в каждой лунке при длинах волн 540 и 346 нм. Следующие примеры иллюстрируют настоящее изобретение. Пример 1. К раствору 62 мг пиридин-2-карбоновой кислоты в 25 см 3 безводного этилацетата, поддерживаемому в атмосфере аргона и при перемешивании, при температуре около 20 С добавляют 380 мг 4-ацетокси-2-бензоилокси 000726 1,10-дигидрокси-5,20-эпокси-7,8 метилен-9-оксо-19-нор-такс-11-ен-13-ил(2R,4S,5R)-3-трет.-бутоксикарбонил-2-(4 метоксифенил)-4-фенил-1,3-оксазолидин-5 карбоксилата, 25 мг 4-диметиламинопиридина,0,5 г молекулярного сита 4 и 151 мг N,N'дициклогексилкарбодиимида. Реакционную смесь выдерживают при перемешивании в течение 16 ч при температуре около 20 С, затем добавляют 20 мг пиридин-2-карбоновой кислоты,8 мг 4-диметиламинопиридина, 100 мг молекулярного сита 4 и 50 мг N,N'дициклогексилкарбодиимида и снова выдерживают при перемешивании в течение четырех часов. Реакционную смесь фильтруют через снабженное целитом фриттированное стекло. Фриттированное стекло промывают с помощью 100 см 3 этилацетата, фильтраты объединяют,промывают последовательно с помощью 15 см 3 водного насыщенного раствора гидрокарбоната натрия и 5 раз по 10 см 3 дистиллированной водой, сушат над сульфатом магния, отфильтровывают и концентрируют досуха при пониженном давлении (2,7 кПа) при 40 С. Получают 715 мг воздушной массы белого цвета, которую очищают путем хроматографии на 40 г диоксида кремния (0,04-0,063 мм), содержащихся в колонке диаметром 2 см (элюирующее средство: смесь дихлорметана с метанолом в объемном соотношении 99:1), собирая фракции по 10 см 3. Фракции, содержащие только целевой продукт,объединяют и концентрируют досуха при пониженном давлении (2,7 кПа) при 40 С. Таким образом получают 297 мг 4-ацетокси-2 бензоилокси-5,20-эпокси-1-гидрокси-7,8 метилен-9-оксо-10-(пирид-2-ил-карбонил)окси-19-нор-такс-11-ен-13-ил-(2R,4S,5R)-3-трет.бутоксикарбонил-2-(4-метоксифенил)-4-фенил 1,3-оксазолидин-5-карбоксилата в виде воздушной массы белого цвета. 290 мг 4-ацетокси-2-бензоилокси-5,20-эпокси-1-гидрокси-7,8-метилен-9-оксо 10-(пирид-2-ил-карбонил)окси-19-нор-такс-11 ен-13-ил-(2R,4S,5R)-3-трет.-бутоксикарбонил 2-(4-метоксифенил)-4-фенил-1,3-оксазолидин-5 карбоксилата растворяют в 5,7 см 3 0,1 н этанольного раствора хлороводорода. Таким образом полученный раствор перемешивают в течение 1 ч при температуре около 20 С, затем концентрируют досуха при пониженном давлении(2,7 кПа) при температуре около 40 С. Остаточное твердое вещество растворяют в 50 см 3 дихлорметана и полученный раствор промывают последовательно 2 раза по 3 см 3 водного насыщенного раствора гидрокарбоната натрия и 3 раза по 5 см 3 дистиллированной воды, сушат над сульфатом магния, отфильтровывают и концентрируют досуха при пониженном давлении (2,7 кПа) при 40 С. Получают 270 мг воздушной массы белого цвета, которую очищают путем хроматографии на 30 г диоксида кремния(0,04-0,063 мм), содержащихся в колонке диаметром 2 см (элюирующее средство: смесь дихлорметана с метанолом в объемном соотношении 99:1), собирая фракции по 10 см 3. Фракции,содержащие только целевой продукт, объединяют и концентрируют досуха при пониженном давлении (0,27 кПа) при температуре 20 С в течение 16 ч. Таким образом получают 189 мг 4-ацетокси-2-бензоилокси-5,20-эпокси-1 гидрокси-7,8-метилен-9-оксо-10-(пирид-2 ил-карбонил)окси-19-нор-такс-11-ен-13-ил(2R,3S)-3-трет.-бутоксикарбониламино-2 гидрокси-3-фенил-пропионата в виде воздушной массы белого цвета, характеристики которого следующие: вращательная способность: []D20 = 24 (с-ОСОС 6 Н 5 (-Н в положении 3 и Н в положении 5) и -C5H4N (-Н в положении 5)], 7.60 [т, J=7.5,1H: -OCOC6H5 (-H в положении 4)], 7.85 [д, J=8 и 1.5, 1H: -C5H4N (-Н в положении 4)], 8.11 [д,J=8, 1H: -C5H4N (-H в положении 3)], 8.15 [д,J=7.5, 2 Н: -ОСОС 6 Н 5 (-Н в положении 2 и -Н в положении 6)], 8.80 [уш.д, J=4.5, 1H: -C5H4N (-H в положении 6)]. 4-ацетокси-2-бензоилокси-1,10 дигидрокси-5,20-эпокси-7,8-метилен-9-оксо 19-нор-такс-11-ен-13-ил-(2R,4S,5R)-3-трет.бутоксикарбонил-2-(4-метоксифенил-4-фенил 1,3-оксазолидин-5-карбоксилат может быть получен следующим образом. К раствору 5,5 г 2-бензоилокси-4,10 диацетокси 5,20-эпoкcи-1-гидpoкcи-7,8 метилен-9-оксо-19-нор-такс-11-ен-13-ил(2R,4S,5R)-3-трет.-бутоксикарбонил-2-(4-метоксифенил)-4-фенил-1,3-оксазолидин-5 карбоксилата в 200 см 3 безводного метанола,поддерживаемому в атмосфере аргона и при перемешивании, при температуре около 20 С добавляют 20 г молекулярного сита 4 в по 000726 10 рошке и 9,3 г иодида цинка. Реакционную среду перемешивают в течение трех дней при температуре около 20 С, затем добавляют еще 3,72 г иодида цинка и 4 г молекулярного сита 4 и перемешивают в течение 24 ч при температуре около 20 С. Реакционную смесь фильтруют через снабженное целитом фриттированное стекло. Фриттированное стекло промывают с помощью 100 см 3 дихлорметана и фильтраты объединяют и выливают в 200 см 3 дистиллированной воды. Двухфазную смесь перемешивают в течение 30 мин, затем водную фазу отделяют декантацией и снова экстрагируют 3 раза по 200 см 3 дихлорметаном. Органические фазы объединяют, промывают 50 см 3 дистиллированной воды, сушат над сульфатом магния, отфильтровывают и концентрируют досуха при пониженном давлении (2,7 кПа) при 40 С. Получают 5,3 г воздушной массы белого цвета, которую очищают путем хроматографии на 160 г диоксида кремния (0,04-0,063 мм), содержащихся в колонке диаметром 3,8 см (элюирующее средство: смесь дихлорметана с метанолом в объемном соотношении 99:1), собирая фракции по 100 см 3. Фракции, содержащие только целевой продукт,объединяют и концентрируют досуха при пониженном давлении (2,7 кПа) при 40 С. Таким образом получают 3,7 г воздушной массы белого цвета, которую снова очищают путем хроматографии на 175 г диоксида кремния (0,040,063 мм), содержащихся в колонке диаметром 3,8 см (элюирующее средство: смесь дихлорметана с метанолом в объемном соотношении 99,6:0,4), собирая фракции по 50 см 3. Фракции,содержащие только целевой продукт, объединяют и концентрируют досуха при пониженном давлении (2,7 кПа) при 40 С. Таким образом получают 1,78 г 4-ацетокси-2-бензоилокси 1,10-дигидрокси-5,20-эпокси-7,8 метилен-9-оксо-19-нор-такс-11-ен-13-ил(2R,4S,5R)-3-трет.-бутоксикарбонил-2-(4 метоксифенил)-4-фенил-1,3-оксазолидин-5 карбоксилата в виде воздушной массы белого цвета. 2-бензоилокси-4,10-диацетокси-5,20 эпокси-1-гидрокси-7,8-метилен-9-оксо-19 нор-такс-11-ен-13-ил-(2R,4S,5R)-3-трет.бутоксикарбонил-2-(4-метоксифенил)-4-фенил 1,3-оксазолидин-5-карбоксилат может быть получен следующим образом. К раствору 4,01 г (2R,4S,5R)-3-трет.бутоксикарбонил-2-(4-метоксифенил)-4-фенил 1,3-оксазолидин-5-карбоновой кислоты в 190 см 3 безводного этилацетата, поддерживаемому в атмосфере аргона и при перемешивании, при температуре около 20 С добавляют 4,75 г 2 бензоилокси-4,10-диацетокси-1,13-дигидрокси-5,20-эпокси-7,8-метилен-9-оксо 19-нор-такс-11-ена, 0,5 г 4-диметиламинопиридина и 3,01 г N,N'-дициклогексилкарбодиимида. Реакционную смесь перемеши 11 вают в течение двух часов при температуре около 20 С, затем фильтруют через снабженное целитом фриттированное стекло. Фриттированное стекло промывают 2 раза по 50 см 3 этилацетатом, и фильтраты объединяют, промывают 5 раз по 50 см 3 дистиллированной водой, сушат над сульфатом магния, отфильтровывают и концентрируют досуха при пониженном давлении (2,7 кПа) при 40 С. Получают 9,67 г воздушной массы желтого цвета, которую обрабатывают с помощью 70 см 3 диизопропилового эфира. Полученную суспензию перемешивают в течение 1 ч при температуре около 20 С, затем фильтруют через фриттированное стекло. Фриттированное стекло промывают 2 раза по 20 см 3 диизопропиловым эфиром и фильтраты объединяют и концентрируют досуха при пониженном давлении (2,7 кПа) при 40 С. Получают 8,09 г воздушной массы желтого цвета, которую очищают путем хроматографии на 250 г диоксида кремния (0,063-0,2 мм), содержащихся в колонке диаметром 3,8 см (элюирующее средство: смесь дихлорметана с метанолом в объемном соотношении 99:1), собирая фракции по 100 см 3. Фракции, содержащие только целевой продукт,объединяют и концентрируют досуха при пониженном давлении (2,7 кПа) при 40 С. Таким образом получают 7,23 г 2-бензоилокси 4,10-диацетокси-5,20-эпокси-1-гидрокси 7,8-метилен-9-оксо-19-нор-такс-11-ен-13 ил-(2R,4S,5R)-3-трет.-бутоксикарбонил-2-(4 метоксифенил)-4-фенил-1,3-оксазолидин-5 карбоксилата в виде воздушной массы белого цвета.(2R,4S,5R)-3-трет.-бутоксикарбонил-2-(4 метоксифенил)-4-фенил-1,3-оксазолидин-5 карбоновая кислота может быть получена следующим образом. Раствор 10,0 г метил-(2R,3S)-3-трет.бутоксикарбонил-амино-2-гидрокси-3-фенилпропионата и 0,25 г пиридиний-птолуолсульфоната в 200 см 3 толуола дегидратируют путем отгонки 20 см 3 растворителя. Добавляют 6,34 см 3 п-метоксибензальдегиддиметилацеталя в течение 5 мин к реакционной смеси, нагретой до кипения. Во время добавления отгоняют 50 см 3 растворителя,затем отгоняют еще 100 см 3 растворителя. После охлаждения до температуры около 20 С в течение 10 мин добавляют 80 см 3 циклогексана. Смесь охлаждают до 0-5 С. Полученную кашицу фильтруют через фриттированное стекло и осадок после фильтрации промывают с помощью 40 см 3 циклогексана, затем высушивают при пониженном давлении при температуре около 20 С. Таким образом получают с выходом 74% 10,39 г 12 ИК-спектр (в виде таблетки с КBr): характеристические полосы поглощения при 31003000, 2980, 2960, 2930, 2910, 2840, 1740, 1700,1614, 1514, 1460, 1435, 1390, 1370, 1245, 1175,1165, 816, 760 и 700 см-1; 1 Н-ЯМР-спектр (400 МГц; дейтерохлороформ; температура: 50 С; химические сдвигив м.д.; константы связывания J в Гц): 1.11 (с,9 Н), 3.60 (с, 3 Н), 3.82 (с, 3 Н), 4.58 (д, J=5, 1 Н),5.42 (уш.д, J=5, 1 Н), 6.38 (уш.с, 1 Н), 6.92 (д,J=7.5, 2 Н), 7.30-7.45 (м, 7 Н). К раствору 3,0 г вышеполученного продукта в 27 см 3 метанола добавляют 14 см 3 водного раствора, содержащего 0,31 г моногидрата гидроксида лития. Перемешивают в течение двух часов при температуре около 20 С. Метанол удаляют путем отгонки при пониженном давлении, затем добавляют 40 см 3 дихлорметана. При интенсивном перемешивании реакционную смесь подкисляют путем добавления 1 н соляной кислоты до рН=1. После декантации, водную фазу экстрагируют 2 раза по 40 см 3 дихлорметаном. Объединенные органические фазы сушат над сульфатом натрия. После фильтрации и выпаривания растворителя получают с выходом 94,5% 2,88 г (2R,4S,5R)-3-трет.бутоксикарбонил-2-(4-метоксифенил)-4-фенил 1,3-оксазолидин-5-карбоновой кислоты, характеристики которой следующие: ИК-спектр (в виде таблетки с КBr): характеристические полосы поглощения при 33252675, 2980, 2955, 2935, 2845, 1755, 1700, 1615,1590, 1515, 1460, 1250, 1175, 1030, 835, 765 и 705 см-1; 1 Н-ЯМР-спектр (250 МГц; дейтерохлороформ; химические сдвигив м.д.; константы связывания J в Гц): 1.08 (с, 9 Н), 3.82 (с, 3 Н), 4.61(д, J=5, 1 Н), 5.42 (уш.д, J=5, 1 Н), 6.38 (уш.с, 1 Н),6.92 (д, J=7.5, 2 Н), 7.30-7.45 (м, 7 Н). 2-бензоилокси-4,10-диацетокси-1,13-дигидрокси-5,20-экопси-7,8-метилен-9 оксо-19-нор-такс-11-ен может быть получен следующим образом. К раствору 3,.85 г 2-бензоилокси-4,10 диацетокси-1,13-дигидрокси-5,20-эпокси-9 оксо-7-трифторметилсульфонилокси-такс-11 ена в смеси из 75 см 3 ацетонитрила и 7,5 см 3 безводного тетрагидрофурана, поддерживаемому в атмосфере аргона и при перемешивании,при температуре около 20 С добавляют 1,9 г молекулярного сита 4 в порошке и 5,8 г хлорида натрия. Реакционную смесь перемешивают в течение 30 мин при температуре около 20 С,затем нагревают до температуры кипения с обратным холодильником (75 С) и кипятят с обратным холодильником в течение 2,5 ч. После охлаждения до температуры около 20 С, реакционную смесь фильтруют через фриттированное стекло. Фриттированное стекло промывают 3 раза по 80 см 3 дихлорметаном, фильтраты объединяют, промывают последовательно 25 13 см 3 водного насыщенного раствора гидрокарбоната натрия и 2 раза по 25 см 3 дистиллированной водой, сушат над сульфатом магния, отфильтровывают и концентрируют досуха при пониженном давлении (2,7 кПа) при 40 С. Получают 3,5 г воздушной массы белого цвета,которую очищают путем хроматографии на 140 г диоксида кремния (0,063-0,2 мм), содержащихся в колонке диаметром 3,5 см (элюирующее средство: смесь дихлорметана с метанолом в объемном соотношении 99:1), собирая фракции по 50 см 3. Фракции, содержащие только целевой продукт, объединяют и концентрируют досуха при пониженном давлении (2,7 кПа) при 40 С. Таким образом получают 2,7 г 2 бензоилокси-4,10-диацетокси-1,13 дигидрокси-5,20-эпокси-7,8-метилен-9-оксо 19-нор-такс-11-ена в виде воздушной массы белого цвета. 2-бензоилокси-4,10-диацетокси-1,13-дигидрокси-5,20-эпокси-9-оксо-7 трифторметилсульфонилокси-такс-11-ен может быть получен следующим образом. К раствору 0,59 г 2-бензоилокси-4,10 диацетокси-5,20-эпокси-9-оксо-1,7,13 тригидрокси-такс-11-ена (баккатин-III) в 50 см 3 дихлорметана, поддерживаемому в атмосфере аргона и при перемешивании, при температуре около 20 С добавляют 0,32 см 3 безводного пиридина, затем при температуре около 20 С прикапывают 0,25 см 3 ангидрида трифторметансульфокислоты. Реакционную среду затем кипятят с обратным холодильником (40 С) в течение трех часов, затем добавляют 0,08 см 3 ангидрида трифторметансульфокислоты и продолжают кипятить с обратным холодильником в течение 1 ч. После охлаждения до температуры около 20 С реакционную среду выливают в смесь из 50 см 3 дихлорметана и 20 см 3 дистиллированной воды. Органическую фазу отделяют путем декантации, промывают последовательно 10 см 3 водного 1 н раствора соляной кислоты и 2 раза по 10 см 3 дистиллированной водой, сушат над сульфатом магния, отфильтровывают и концентрируют досуха при пониженном давлении (2,7 кПа) при 40 С. Получают 0,75 г воздушной массы белого цвета, которую очищают путем хроматографии на 60 г диоксида кремния(0,063-0,2 мм), содержащихся в колонке диаметром 2,5 см (элюирующее средство: смесь дихлорметана с метанолом в объемном соотношении 98,5:1,5), собирая фракции по 20 см 3. Фракции, содержащие только целевой продукт,объединяют и концентрируют досуха при пониженном давлении (2,7 кПа) при 40 С. Таким образом получают 0,675 г 2-бензоилокси-4,10-диацетокси-1,13-дигидрокси-5,20 эпокси-9-оксо-7-трифторметилсульфонилокситакс-11-ена в виде воздушной массы белого цвета. 2-бензоилокси-4,10-диацетокси-5, 20 эпокси-9-оксо-1,7,13-тригидрокси-такс-11 ен (баккатин-III) может быть получен следующим образом. К раствору 293,9 г 10-дезацетилбаккатина-III в 2,7 л пиридина в течение 1 ч 20 мин добавляют 182 г триэтилсилилхлорида. Полученный раствор перемешивают в течение 40 ч при температуре 5 С. Затем добавляют 360 г уксусного ангидрида, поддерживая температуру 5 С. Полученную суспензию перемешивают в течение 48 ч при 20 С, затем выливают в 40 л воды со льдом. Выпавший осадок отделяют фильтрованием, затем промывают 8 раз по 2 л воды и, наконец, растворяют в 3 л этилацетата. Органическую фазу сушат над сульфатом магния. После отфильтровывания и концентрирования при пониженном давлении полученный продукт кристаллизуют из диизопропилового эфира. Таким образом получают с выходом 77% 7-триэтилсилил-баккатин-III,характеристики которого следующие: т. пл.: 254 С; 1 Н-ЯМР-спектр (400 МГц; дейтерохлороформ;в м.д.): 0.58 (м, 6 Н: СН 2 этила), 0.92 (т,J=7.5 Гц, 9 Н: СН 3 этила), 1.02 (с, 3 Н: СН 3), 1.18-ОСОС 6 Н 5, Н в пара-положении), 8.10 (д, J=8.5 Гц, 2 Н: -ОСОС 6 Н 5, Н в орто-положении). К раствору 350 мг 7-триэтилсилилбаккатина-III в 3 см 3 ацетонитрила и 2,4 см 3 пиридина добавляют 2,3 г трифторуксусной кислоты. Перемешивают в течение 48 ч при 50 С. После охлаждения, реакционную смесь обрабатывают с помощью 50 см 3 дихлорметана, промывают 2 раза по 5 см 3 дистиллированной водой, 10 см 3 1 н соляной кислоты и 2 раза по 5 см 3 дистиллированной водой и сушат над сульфатом магния. После отфильтровывания и концентрирования досуха при пониженном давлении получают 330 мг продукта, который очищают путем хроматографии на 30 г диоксида кремния,содержащихся в колонке диаметром 2 см, элюируя смесью дихлорметана с метанолом в объемном соотношении 99:1. Первые 300 см 3 элюата удаляют. Следующие 275 см 3 после концентрирования досуха дают 235 мг баккатина-III в виде воздушной массы белого цвета. Выход составляет 83%. 15 Пример 2. Следуя методике примера 1, но исходя из 270 мг 4-ацетокси-2-бензоилокси-1,10 дигидрокси-5,20-эпокси-7,8-метилен-9-оксо 19-нор-такс-11-ен-13-ил-(2R,4S,5R)-3-трет.бутоксикарбонил-2-(4-метоксифенил)-4-фенил 1,3-оксазолидин-5-карбоксилата и 46 мг тиофен 2-карбоновой кислоты, получают 230 мг 4 ацетокси-2-бензоилокси-5,20-эпокси-1,гидрокси-7,8-метилен-9-оксо-10-(тиен-2-илкарбонил)окси-19-нор-такс-11-ен-13-ил(2R,4S,5R)-3-трет.-бутоксикарбонил-2-(4 метоксифенил)-4-фенил-1,3-оксазолидин-5 карбоксилата в виде воздушной массы белого цвета. Следуя методике примера 1, но исходя из 225 мг 4-ацетокси-2-бензоилокси-5,20 эпокси-1-гидрокси-7,8-метилен-9-оксо-10(тиен-2-ил-карбонил)окси-19-нор-такс-11-ен 13-ил-(2R,4S,5R)-3-трет.-бутоксикарбонил-2(4-метоксифенил)-4-фенил-1,3-оксазолидин-5 карбоксилата, получают 151 мг 4-ацетокси-2 бензоилокси-5,20-эпокси-1-гидрокси-7,8 метилен-9-оксо-10-(тиен-2-ил-карбонил)окси 19-нор-такс-11-ен-13-ил-(2R,3S)-3-трет.бутоксикарбониламино-2-гидрокси-3-фенилпропионата в виде воздушной массы белого цвета, характеристики которого следующие: вращательная способность: []D20 = 23 (с 16 Пример 3. Следуя методике примера 1, но исходя из 270 мг 4-ацетокси-2-бензоилокси-1,10 дигидрокси-5,20-эпокси-7,8-метилен-9-оксо 19-нор-такс-11-ен-13-ил-(2R,4S,5R)-3-трет.-бутоксикарбонил-2-(4-метоксифенил)-4-фенил 1,3-оксазолидин-5-карбоксилата и 0,038 см 3 циклопентанкарбоновой кислоты, получают 187 мг 4-ацетокси-2-бензоилокси-10-циклопентилкарбонилокси-5,20-эпокси-1-гидрокси 7,8-метилен-9-оксо-19-нор-такс-11-ен-13 ил-(2R,4S,5R)-3-трет.-бутоксикарбонил-2-(4 метоксифенил)-4-фенил-1,3-оксазолидин-5 карбоксилата в виде воздушной массы белого цвета. Следуя методике примера 1, но исходя из 182 мг 4-ацетокси-2-бензоилокси-10 циклопентилкарбонилокси-5,20-эпокси-1 гидрокси-7,8-метилен-9-оксо-19-нор-такс-11eн-13-ил-(2R,4S,5R)-3-трет.-бутоксикарбонил 2-(4-метоксифенил)-4-фенил-1,3-оксазолидин-5 карбоксилата, получают 100 мг 4-ацетокси-2 бензоилокси-10-циклопентилкарбонилокси 5,20-эпокси-1-гидрокси-7,8-метилен-9 оксо-19-нор-такс-11-ен-13-ил-(2R,3S)-3-трет.бутоксикарбониламино-2-гидрокси-3-фенилпропионата в виде воздушной массы белого цвета, характеристики которого следующие: вращательная способность: []D20 = 40 (с 17 Пример 4. Следуя методике примера 1, но исходя из 270 мг 4-ацетокси-2-бензоилокси-1,10 дигидрокси-5,20-эпокси-7,8-метилен-9-оксо 19-нор-такс-11-ен-13-ил-(2R,4S,5R)-3-трет.бутоксикарбонил-2-(4-метоксифенил)-4-фенил 1,3-оксазолидин-5-карбоксилата и 0,028 см 3 циклопропанкарбоновой кислоты, получают 110 мг 4-ацетокси-2-бензоилокси-10-циклопропилкарбонилокси-5,20-эпокси-1-гидрокси-7,8-метилен-9-оксо-19-нор-такс-11-ен-13-ил(2R,4S,5R)-3-трет.-бутоксикарбонил-2-(4 метоксифенил)-4-фенил-1,3-оксазолидин-5 карбоксилата в виде воздушной массы белого цвета. Следуя методике примера 1, но исходя из 110 мг 4-ацетокси-2-бензоилокси-10 циклопропилкарбонилокси-5,20-эпокси-1 гидрокси-7,8-метилен-9-оксо-19-нор-такс-11 ен-13-ил-(2R,4S,5R)-3-трет.-бутоксикарбонил 2-(4-метоксифенил)-4-фенил-1,3-оксазолидин-5 карбоксилата, получают 62 мг 4-ацетокси-2 бензоилокси-10-циклопропилкарбонилокси-5,20-эпокси-1-гидрокси-7,8-метилен-9-оксо 19-нор-такс-11-ен-13-ил-(2R,3S)-3-трет.бутилкарбониламино-2-гидрокси-3-фенил-пропионата в виде воздушной массы белого цвета,характеристики которого следующие: вращательная способность: []D20 = 35 (с[д, J=7.5, 2 Н: -ОСОС 6 Н 5 (-Н в положении 2 и Н в положении 6)]. Пример 5. Следуя методике примера 1, но исходя из 280 мг 4-ацетокси-2-бензоилокси-1,10 000726 дигидрокси-5,20-эпокси-7,8-метилен-9-оксо 19-нор-такс-11-ен-13-ил-(2R,4S,5R)-3-трет.-бутоксикарбонил-2-(4-метоксифенил)-4-фенил 1,3-оксазолидин-5-карбоксилата и 41.5 мг фуран-2-карбоновой кислоты, получают 201 мг 4 ацетокси-2-бензоилокси-5,20-эпокси-10(фур-2-ил-карбонил)окси-1-гидрокси-7,8 метилен-9-оксо-19-нор-такс-11-ен-13-ил(2R,4S,5R)-3-трет.-бутоксикарбонил-2-(4 метоксифенил)-4-фенил-1,3-оксазолидин-5 карбоксилата в виде воздушной массы белого цвета. Следуя методике примера 1, но исходя из 197 мг 4-ацетокси-2-бензоилокси-5,20 эпокси-10-(фур-2-ил-карбонил)окси-1 гидрокси-7,8-метилен-9-оксо-19-нор-такс-11 ен-13-ил-(2R,4S,5R)-3-трет.-бутоксикарбонил 2-(4-метоксифенил)-4-фенил-1,3-оксазолидин-5 карбоксилата, получают 137 мг 4-ацетокси-2 бензоилокси-5,20-эпокси-10-(фур-2-ил-карбонил)-окси-1-гидрокси-7,8-метилен-9-оксо 19-нор-такс-11-ен-13-ил-(2R,3S)-3-трет.бутоксикарбониламино-2-гидрокси-3-фенилпропионата в виде воздушной массы белого цвета, характеристики которого следующие: вращательная способность: []D20 = 19 (с(д, J=7.5, 1 Н: -Н в положении 2), 6.29 (уш.т, J=9,1 Н: -Н в положении 13), 6.53 (с, 1 Н: -Н в положении 10), 6.56 [дд, J=5 и 1.5, 1 Н: -С 4 Н 3O (-Н в положении 4)], 7.26 [д, J=4, 1 Н: -С 4 Н 3O (-H в положении 3)], 7.25-7.45 (м, 5 Н: -C6H5 в положении 3'), 7.51 [т, J=7.5, 2 Н: -ОСОС 6 Н 5 (-Н в положении 3 и Н в положении 5)], 7.61 [т, J=7.5,1 Н: -ОСОС 6 Н 5 (-Н в положении 4)], 7.64 [уш.с,1 Н: -С 4 Н 3O (-Н в положении 5)], 8.15 [д, J=7.5,2 Н: -ОСОС 6 Н 5 (-Н в положении 2 и Н в положении 6)]. Пример 6. Следуя методике примера 1, но исходя из 280 мг 4-ацетокси-2-бензоилокси-1,10 дигидрокси-5,20-эпокси-7,8-метилен-9-оксо 19 19-нор-такс-11-ен-13-ил-(2R,4S,5R)-3-трет.бутоксикарбонил-2-(4-метоксифенил)-4-фенил 1,3-оксазолидин-5-карбоксилата и 45 мг бензойной кислоты, получают 190 мг 4-ацетокси 2,10-дибензоилокси-5,20-эпокси-1 гидрокcи-7,8-метилен-9-оксо-19-нор-такс-11 ен-13-ил-(2R,4S,5R)-3-трет.-бутоксикарбо-нил 2-(4-метоксифенил)-4-фенил-1,3-оксазо-лидин 5-карбоксилата в виде воздушной массы белого цвета. Следуя методике примера 1, но исходя из 190 мг 4-ацетокси-2,10-дибензоилокси 5,20-эпокси-1-гидрокси-7,8-метилен-9 оксо-19-нор-такс-11-ен-13-ил-(2R,4S,5R)-3 трет.-бутоксикарбонил-2-(4-метоксифенил)-4 фенил-1,3-оксазолидин-5-карбоксилата, получают 120 мг 4-ацетокси-2,10-дибензоилокси-5,20-эпокси-1-гидрокси-7,8-метилен 9-оксо-19-нор-такс-11-ен-13-ил-(2R,3S)-3 трет.-бутоксикарбониламино-2-гидрокси-3 фенил-пропионата в виде воздушной массы белого цвета, характеристики которого следующие: вращательная способность: []D20 = 28 (с(-Н в положении 3 и Н в положении 5)], 7.557.65 [м, 2 Н: -ОСОС 6 Н 5 (-Н в положении 4)], 8.09 и 8.17 [2 д, J=7.5, 2 Н каждый: -ОСОС 6 Н 5 (-Н в положении 2 и Н в положении 6)]. Пример 7. Следуя методике примера 1, но исходя из 300 мг 4-ацетокси-2-бензоилокси-1,10 дигидрокси-5,20-эпокси-7,8-метилен-9-оксо 19-нор-такс-11-ен-13-ил-(2R,4S,5R)-3-трет.-бутоксикарбонил-2-(4-метоксифенил)-4-фенил 1,3-оксазолидин-5-карбоксилата и 0,686 см 3 ангидрида 3-метил-пропен-2-овой кислоты, получают 237 мг 4-ацетокси-2-бензоилокси-5, 000726 20-эпокси-1-гидрокси-10-(3-метил-пропен-2 оил)окси-7,8-метилен-9-оксо-19-нор-такс-11 ен-13-ил-(2R,4S,5R)-3-трет.-бутоксикарбонил 2-(4-метоксифенил)-4-фенил-1,3-оксазолидин-5 карбоксилата в виде воздушной массы белого цвета. Следуя методике примера 1, но исходя из 270 мг 4-ацетокси-2-бензоилокси-5,20 эпокси-1-гидрокси-10-(3-метил-пропен-2 оил)окси-7,8-метилен-9-оксо-19-нор-такс-11 ен-13-ил-(2R,4S,5R)-3-трет.-бутоксикарбонил 2-(4-метоксифенил)-4-фенил-1,3-оксазолидин-5 карбоксилата, получают 192 мг 4-ацетокси-2 бензоилокси-5,20-эпокси-1-гидрокси-10-(3 метил-пропен-2-оил)окси-7,8-метилен-9-оксо 19-нор-такс-11-ен-13-ил-(2R,3S)-3-трет.бутоксикарбониламино-2-гидрокси-3-фенилпропионата в виде воздушной массы белого цвета, характеристики которого следующие: вращательная способность: []D20 = 34 (с[д, J=7.5, 2 Н: -OCOC6H5 (-Н в положении 2 и Н в положении 6)]. Пример 8. Следуя методике примера 1, но исходя из 220 мг 4-ацетокси-2-бензоилокси-1,10 дигидрокси-5,20-эпокси-7,8-метилен-9-оксо 19-нор-такс-11-ен-13-ил-(2R,4S,5R)-3-трет.-бутоксикарбонил-2-(4-метоксифенил)-4-фенил 1,3-оксазолидин-5-карбоксилата, получают 100 мг 4-ацетокси-2-бензоилокси-10-xлopaцeтoкcи-5,20-эпокси-1-гидрокси-7,8-метилен 9-оксо-19-нор-такс-11-ен-13-ил-(2R,4S,5R)-3 трет.-бутоксикарбонил-2-(4-метоксифенил)-4 21 фенил-1,3-оксазолидин-5-карбоксилата в виде воздушной массы белого цвета. Следуя методике примера 1, но исходя из 155 мг 4-ацетокси-2-бензоилокси-10 хлорацетокси-5,20-эпокси-1-гидрокси-7,8 метилен-9-оксо-19-нор-такс-11-ен-13-ил(2R,4S,5R)-3-трет.-бутоксикарбонил-2-(4 метоксифенил)-4-фенил-1,3-оксазолидин-5 карбоксилата, получают 64 мг 4-ацетокси-2 бензоилокси-10-хлорацетокси-5,20-эпокси 1-гидрокси-7,8-метилен-9-оксо-19-нор-такс 11-ен-13-ил-(2R,3S)-3-трет.-бутоксикарбониламино-2-гидрокси-3-фенил-пропионата в виде воздушной массы белого цвета, характеристики которого следующие: вращательная способность: []D20 = 39 (с-OCOC6H5 (-Н в положении 4)], 8.16 [д, J=7.5,2 Н: -ОСОС 6 Н 5 (-Н в положении 2 и Н в положении 6)]. Пример 9. Следуя методике примера 7, но исходя из 300 мг 4-ацетокси-2-бензоилокси-1,10 дигидрокси-5,20-эпокси-7,8-метилен-9-оксо 19-нор-такс-11-ен-13-ил-(2R,4S,5R)-3-трет.-бутоксикарбонил-2-(4-метоксифенил)-4-фенил 1,3-оксазолидин-5-карбоксилата и 52,4 мг этоксикарбонилуксусной кислоты, получают 180 мг 4-ацетокси-2-бензоилокси-5,20-эпокси-10 этоксикарбонилацетокси-1-гидрокси-7,8 метилен-9-оксо-19-нор-такс-11-ен-13-ил-(2R,4S,5R)-3-трет.-бутоксикарбонил-2-(4-метоксифенил)-4-фенил-1,3-оксазолидин-5-карбоксилата в виде воздушной массы белого цвета. Следуя методике примера 7, но исходя из 190 мг 4-ацетокси-2-бензоилокси-5,20 эпокси-10-этоксикарбонилацетокси-1 000726 гидрокси-7,8-метилен-9-оксо-19-нор-такс-11 ен-13-ил-(2R,4S,5R)-3-трет.-бутоксикарбонил 2-(4-метоксифенил)-4-фенил-1,3-оксазолидин-5 карбоксилата, получают 73 мг 4-ацетокси-2 бензоилокси-5,20-эпокси-10-этоксикарбонилацетокси-1-гидрокси-7,8-метилен-9-оксо-19 нор-такс-11-ен-13-ил-(2R,3S),3-трет.-бутоксикарбониламино-2-гидрокси-3-фенил-пропионата в виде воздушной массы белого цвета, характеристики которого следующие: вращательная способность: []D20 = 28 (с-ОСОС 6 Н 5 (-Н в положении 4)], 8.18 [д, J=7.5,2 Н: -OCOC6H5 (-Н в положении 2 и H в положении 6)]. Пример 10. Следуя методике примера 1, но исходя из 300 мг 4-ацетокси-2-бензоилокси-1,10 дигидрокси-5,20-эпокси-7,8-метилен-9-оксо 19-нор-такс-11-ен-13-(2R,4S,5R)-3-трет.-бутоксикарбонил-2-(4-метоксифенил)-4-фенил-1,3 оксазолидин-5-карбоксилата и 584 мг ангидрида акриловой кислоты, получают 160 мг 4 ацетокси-10-акрилоилокси-2-бензоилокси-5,20-эпокси-1-гидрокси-7,8-метилен-9-оксо 19-нор-такс-11-ен-13-ил-(2R,4S,5R)-3-трет.бутоксикарбонил-2-(4-метоксифенил)-4-фенил 1,3-оксазолидин-5-карбоксилата в виде воздушной массы белого цвета. Следуя методике примера 1, но исходя из 196 мг 4-ацетокси-10-акрилоилокси-2 бензоилокси-5,20-эпокси-1-гидрокси-7,8 метилен-9-оксо-19-нор-такс-11-ен-13-ил(2R,4S,5R)-3-трет.-бутоксикарбонил-2-(4 23 метоксифенил)-4-фенил-1,3-оксазолидин-5 карбоксилата, получают 113 мг 4-ацетокси 10-акрилоилокси-2-бензоилокси-5,20 эпокси-1-гидрокси-7,8-метилен-9-оксо-19 нор-такс-11-ен-13-ил-(2R,3S)-3-трет.-бутоксикарбониламино-2-гидрокси-3-фенил-пропионата в виде воздушной массы белого цвета, характеристики которого следующие: вращательная способноcть: []D20 = 39 (с-ОСОС 6 Н 5 (-Н в положении 3 и Н в положении 5)], 7.63 [т, J=7.5, 1H: -ОСОС 6 Н 5 (-Н в положении 4)], 8.17 [д, J=7.5, 2 Н: -ОСОС 6 Н 5 (-Н в положении 2 и Н в положении 6)]. Пример 11. Следуя методике примера 1, но исходя из 250 мг 4-ацетокси-2-бензоилокси-1,10 дигидрокси-5,20-эпокси-7,8-метилен-9-оксо 19-нор-такс-11-ен-13-ил-(2R,4S,5R)-3-трет.-бутоксикарбонил-2-(4-метоксифенил)-4-фенил 1,3-оксазолидин-5-карбоксилата и 41 мг пиридин-3-карбоновой кислоты, получают 269 мг 4-ацетокси-2-бензоилокси-5,20-эпокси-1 гидрокси-7,8-метилен-9-оксо-10-(пирид-3 ил-карбонил)окси-19-нор-такс-11-ен-13-ил(2R,4S,5R)-3-трет.-бутоксикарбонил-2-(4 метоксифенил)-4-фенил-1,3-оксазолидин-5 карбоксилата в виде воздушной массы белого цвета. Следуя методике примера 1, но исходя из 264 мг 4-ацетокси-2-бензоилокси-5,20 эпокси-1-гидрокси-7,8-метилен-9-оксо-10(пирид-3-ил-карбонил)окси-19-нор-такс-11-ен 13-(2R,4S,5R)-3-трет.-бутоксикарбонил-2-(4 метоксифенил)-4-фенил-1,3-оксазолидин-5 карбоксилата, получают 169 мг 4-ацетокси-2 бензоилокси-5,20-эпокси-1-гидрокси-7,8 000726 метилен-9-оксо-10-(пирид-3-ил-карбонил)окси-19-нор-такс-11-ен-13-ил-(2R,3S)-3-трет.бутоксикарбониламино-2-гидрокси-3-фенилпропионата в виде воздушной массы белого цвета, характеристики которого следующие: вращательная способность: []D20 = 25 (с[д, J=1.5, 1 Н: -OCOC5H4N (-Н в положении 2)]. Пример 12. Следуя методике примера 1, но исходя из 250 мг 4-ацетокси-2-бензоилокси-1,10 дигидрокси-5,20-эпокси-7,8-метилен-9-оксо 19-нор-такс-11-ен-13-ил-(2R,4S,5R)-3-трет.-бутоксикарбонил-2-(4-метоксифенил)-4-фенил 1,3-окcазолидин-5-карбоксилата и 42 мг тиофен 3-карбоновой кислоты, получают 180 мг 4 ацетокси-2-бензоилокси-5,20-эпокси-1 гидрокси-7,8-метилен-9-оксо-10-(теноил 3)окси-19-нор-такс-11-ен-13-ил-(2R, 4S, 5R)-3 трет.-бутоксикарбонил-2-(4-метоксифенил)-4 фенил-1,3-оксазолидин-5-карбоксилата в виде воздушной массы белого цвета. Следуя методике примера 1, но исходя из 175 мг 4-ацетокси-2-бензоилокси-5,20 эпокси-1-гидрокси-7,8-метилен-9-оксо-10(теноил-3)окси-19-нор-такс-11-ен-13-ил(2R,4S,5R)-3-трет.-бутоксикарбонил-2-(4 метоксифенил)-4-фенил-1,3-оксазолидин-5 карбоксилата, получают 102 мг 4-ацетокси-2 бензоилокси-5,20-эпокси-1-гидрокси-7,8 метилен-9-оксо-10-(теноил-3)окси-19-нортакс-11-ен-13-ил-(2R,3S)-3-трет.-бутоксикар 25 бониламино-2-гидрокси-3-фенил-пропионата в виде воздушной массы белого цвета, характеристики которого следующие: вращательная способность: []D20 = 16 (с(-H в положении 2)]. Пример 13. Следуя методике примера 1, но исходя из 300 мг 4-ацетокси-2-бензоилокси-1,10 дигидрокси-5,20-эпокси-7,8-метилен-9-оксо 19-нор-такс-11-ен-13-ил-(2R,4S,5R)-3-трет.-бутоксикарбонил-2-(4-метоксифенил)-4-фенил 1,3-оксазолидин-5-карбоксилата и 713 мг ангидрида винилуксусной кислоты, получают 114 мг 4-ацетокси-10-аллилкарбонилокси-2-бензоилокси-5,20-эпокси-1-гидрокси-7,8 метилен-9-оксо-19-нор-такс-11-ен-13-ил(2R,4S,5R)-3-трет.-бутоксикарбонил-2-(4 метоксифенил)-4-фенил-1,3-оксазолидин-5 карбоксилата в виде воздушной массы белого цвета. Ангидрид винилуксусной кислоты может быть получен следующим образом. К раствору 3,42 г N,N'-дициклогексилкарбодиимида в 20 см 3 дихлорметана,поддерживаемому в атмосфере аргона и при перемешивании, при температуре около 20 С прикапывают 2,8 см 3 винилуксусной кислоты. Реакционную среду перемешивают в течение трех дней при температуре около 20 С, затем фильтруют через снабженное целитом фриттированное стекло. Фриттированное стекло промывают 2 раза по 10 см 3 дихлорметаном, фильтраты объединяют и концентрируют досуха при 26 пониженном давлении (2,7 кПа) при 40 С. Таким образом получают 2,96 г ангидрида винилуксусной кислоты в виде масла желтого цвета. Следуя методике примера 1, но исходя из 140 мг 4-ацетокси-10-аллилкарбонилокси-2 бензоилокси-5,20-эпокси-1-гидрокси-7,8 метилен-9-оксо-19-нор-такс-11-ен-13-ил(2R,4S,5R)-3-трет.-бутоксикарбонил-2-(4 метоксифенил)-4-фенил-1,3-оксазолидин-5 карбоксилата, получают 80 мг 4-ацетокси-10 аллилкарбонилокси-2-бензоилокси-5,20 эпокси-1-гидрокси-7,8-метилен-9-оксо-19 нор-такс-11-ен-13-ил-(2R,3S)-3-трет.-бутоксикарбониламино-2-гидрокси-3-фенил-пропионата в виде воздушной массы белого цвета, характеристики которого следующие: вращательная способность: []D20 = 34 (с-ОСОС 6 Н 5 (-H в положении 3 и -H в положении 5)], 7.62 [т, J=7.5, 1H: -ОСОС 6 Н 5 (-H в положении 4)], 8.15 [д, J=7.5, 2 Н: -ОСОС 6 Н 5 (-H в положении 2 и -H в положении 6)]. Пример 14. Следуя методике примера 1, но исходя из 300 мг 4-ацетокси-2-бензоилокси-1,10 дигидрокси-5,20-эпокси-7,8-метилен-9-оксо 19-нор-такс-11-ен-13-ил-(2R,4S,5R)-3-трет.-бутоксикарбонил-2-(4-метоксифенил)-4-фенил 1,3-оксазолидин-5-карбоксилата и 45 мг фуран 3-карбоновой кислоты, получают 282 мг 4 ацетокси-2-бензоилокси-5,20-эпокси-10(фуроил-3)окси-1-гидрокси-7,8-метилен-9 оксо-19-нор-такс-11-ен-13-ил-(2R,4S,5R)-3 трет.-бутоксикарбонил-2-(4-метоксифенил)-4 фенил-1,3-оксазолидин-5-карбоксилата в виде воздушной массы белого цвета. 27 Следуя методике примера 1, но исходя из 282 мг 4-ацетокси-2-бензоилокси-5,20 эпокси-10-(фуроил-3)окси-1-гидрокси-7,8 метилен-9-оксо-19-нор-такс-11-ен-13-ил(2R,4S,5R)-3-трет.-бутоксикарбонил-2-(4 метоксифенил)-4-фенил-1,3-оксазолидин-5 карбоксилата, получают 143 мг 4-ацетокси-2 бензоилокси-5,20-эпокси-10-(фуроил-3)окси 1-гидрокси-7,8-метилен-9-оксо-19-нор-такс 11-ен-13-(2R,3S)-3-трет.-бутоксикарбониламино-2-гидрокси-3-фенил-пропионата в виде воздушной массы белого цвета, характеристики которого следующие: вращательная способность: []D20 = 26 (с-ОСОС 4 Н 3 О (-Н в положении 5)], 7.53 [т, J = 7.5,2 Н: -OCOC6H5 (-Н в положении 3 и -Н в положении 5)], 7.63 [т, J=7.5, 1H: -ОСОС 6 Н 5 (-Н в положении 4)], 8.09 [уш.с, 1H: -ОСОС 4 Н 3O (-Н в положении 2)], 8.17 [д, J=7.5, 2 Н: -ОСОС 6 Н 5 (-Н в положении 2 и -Н в положении 6)]. Пример 15. Следуя методике примера 1, но исходя из 300 мг 4-ацетокси-2-бензоилокси-1,10 дигидрокси-5,20-эпoкcи-7,8-метилен-9-оксо 19-нор-такс-11-ен-13-ил-(2R,4S,5R)-3-трет.-бутоксикарбонил-2-(4-метоксифенил)-4-фенил 1,3-оксазолидин-5-карбоксилата и 50 мг пиридин-4-карбоновой кислоты, получают 296 мг 4-ацетокси-2-бензоилокси-5,20-эпокси-1 гидрокси-7,8-метилен-9-оксо-10-(пирид-4 ил-карбонил)окси-19-нор-такс-11-ен-13-ил(2R,4S,5R)-3-трет.-бутоксикарбонил-2-(4 метоксифенил)-4-фенил-1,3-оксазолидин-5 карбоксилата в виде воздушной массы белого цвета. Следуя методике примера 1, но исходя из 296 мг 4-ацетокси-2-бензоилокси-5,20 эпокси-1-гидрокси-7,8-метилен-9-оксо-10 000726(пирид-4-ил-карбонил)окси-19-нор-такс-11-ен 13-ил-(2R,4S,5R)-3-трет.-бутоксикарбонил-2(4-метоксифенил)-4-фенил-1,3-оксазолидин-5 карбоксилата, получают 159 мг 4-ацетокси-2 бензоилокси-5,20-эпокси-1-гидрокси-7,8 метилен-9-оксо-10-(пирид-3-ил-карбонил)окси-19-нор-такс-11-ен-13-ил-(2R,3S)-3 трет.-бутоксикарбониламино-2-гидрокси-3-фенил-пропионата в виде воздушной массы белого цвета, характеристики которого следующие: вращательная способность: []D20 = 23-OCOC5H4N (-H в положении 2 и -Н в положении 6)]. Новые продукты общей формулы (I), в которой Z означает радикал общей формулы (II),проявляют значительную ингибирующую активность в отношении анормальной пролиферации клеток и обладают терапевтическими свойствами, позволяющими лечить заболевания с патологическими состояниями, связанными с анормальной пролиферацией клеток. Патологические состояния представляют собой анормальную пролиферацию злокачественных или незлокачественных клеток различных тканей и/или органов, к которым относятся, не исчерпывающим образом, мышечные, костные или соединительные ткани, кожа, головной мозг,легкие, половые органы, лимфатические или почечные системы, клетки груди или клетки крови, печень, органы пищеварения, поджелудочная железа и щитовидные железы или надпочечники. Эти патологические состояния также могут представлять собой псориаз, твердые 29 опухоли, раковые заболевания яичника, женской груди, головного мозга, простаты, ободочной кишки, желудка, почек или тестикул, саркому Капоши, холангиокарциному, хориокарциному, невробластому, опухоль Вильмса, болезнь Ходжкина, меланомы, множественные миеломы, лимфоцитарные хронические лейкемии, гранулоцитарные острые или хронические лимфомы. Новые продукты согласно изобретению особенно пригодны для лечения рака яичника. Продукты согласно изобретению можно использовать для предотвращения или замедления возникновения или повторного возникновения патологических состояний или для лечения этих патологических состояний. Продукты согласно изобретению можно вводить больному в различных формах, годных для выбранного пути введения, которым предпочтительно является парентеральный путь введения. Введение парентеральным путем включает внутривенное, интраперитональное, внутримышечное или подкожное введение. В особенности предпочтительным является введение интраперитональным или внутривенным путем. Настоящее изобретение также относится к фармацевтическим композициям, содержащим,по крайней мере, один продукт общей формулы(I), в которой Z означает радикал общей формулы (II), в достаточном количестве, пригодном для применения в терапии человека или животного. Композиции можно получать обычными методами, используя одну или несколько добавок, носителей или эксципиентов, которые являются фармацевтически приемлемыми. К пригодным носителям относятся разбавители, стерильные водные среды и различные нетоксичные растворители. Композиции предпочтительно находятся в форме водных растворов или суспензий, растворов для инъекций, которые могут содержать эмульгаторы, красители, консерванты или стабилизаторы. Выбор добавок или экоципиентов зависит от растворимости и химических свойств продукта, конкретного способа введения и от установившейся фармацевтической практики. Для парентерального введения используют стерильные водные или неводные растворы или суспензии. Для приготовления неводных растворов или суспензий можно использовать природные растительные масла, такие как оливковое масло, кунжутное масло или парафиновое масло, или сложные органические эфиры для инъекций, такой как этилолеат. Стерильные водные растворы могут представлять собой раствор фармацевтически приемлемой соли в воде. Водные растворы пригодны для внутривенного введения при условии, если установлено необходимое значение рН и обеспечена его изотоничность, например, с помощью достаточного количества хлорида натрия или глюкозы. Стерилизацию можно осуществлять путем нагрева 000726 30 ния или любым другим способом, который не ухудшает свойств композиции. Само собой разумеется, что все продукты,входящие в композицию согласно изобретению,должны быть чистыми и нетоксичными в используемых количествах. Композиции могут содержать, по крайней мере, 0,01% терапевтически активного продукта. Количество активного продукта в композиции является таким, чтобы можно было назначать нужную дозировку. Предпочтительно,композиции получают таким образом, чтобы разовая доза содержала около 0,01-1000 мг активного продукта для введения парентеральным путем. Терапевтическое лечение можно осуществлять одновременно с другим терапевтическим лечением, включающим использование цитостатических лекарственных средств, моноклональных антител, иммунологической терапии или рентгенотерапии или модификаторов биологических ответов. Модификаторы ответов включают, без ограничения, лимфокины и цитокины, такие как интерлейкины, интерфероны(,или ) и фактор некроза опухоли. Другими химиотерапевтическими агентами, пригодными для лечения нарушений, возникающих вследствие анормальной пролиферации клеток, являются, без ограничения, алкилирующие агенты, такие как горчичные газы, например, мехлоретамин, циклофосфамид, мелфалан и хлорамбуцил; алкилсульфонаты, такие как бисульфан; нитрозомочевины, такие как кармустин, ломустин,семустин и стрептозоцин; триазены, такие как дакарбазин; антиметаболиты, такие как аналоги фолиевой кислоты, например, метотрексат; аналоги пиримидина, такие как флуороурацил и цитарабин; аналоги пуринов, такие как меркаптопурин и тиогуанин; природные продукты,такие как алкалоиды vinca, например, винбластин, винкристин и виндезин; эпиподофиллотоксины, такие как этопосид и тенипосид; антибиотики, такие как дактиномицин, даунорубицин, доксорубицин, блеомицин, пликамицин и митомицин; ферменты,такие какLаспарагиназа; различные агенты, такие как координационные комплексы платины, например,как цисплатин; замещенные мочевины, такие как гидроксимочевина; производные метилгидразина, такие как просарбазин; адренокортикоидные супрессоры, такие как митотан и аминоглутетимид; гормоны и антагонисты, такие как адренокортикостероиды, например, преднизон; прогестины, такие как гидроксипрогестеронкапроат, метоксипрогестеронацетат и мегестролацетат; эстрогены, такие как диэтилстильбестрол и этинилэстрадиол; антиэстрогены, такие как тамоксифен; андрогены, такие как тестостеронпропионат и флуоксиместрон. Дозами, используемыми для осуществления лечения согласно изобретению, являются такие, которые позволяют осуществлять профи 31 лактику или получать максимум терапевтического ответа. Дозы изменяются в зависимости от формы введения, конкретно выбранного продукта и присущих излечиваемому субъекту характеристик. Вообще, дозы представляют собой такие, которые терапевтически эффективны для лечения нарушений, возникающих вследствие анормальной пролиферации клеток. Продукты согласно изобретению можно вводить настолько часто, насколько необходимо для достижения желаемого терапевтического эффекта. У некоторых больных быстро может возникать ответная реакция на относительно сильные или слабые дозы, после чего необходимы слабые поддерживающие дозы или можно отказаться от их введения. Обычно слабые дозы используют в начале лечения и, если необходимо, вводят все более и более усиливающиеся дозы до достижения оптимального эффекта. В случае других больных может оказаться необходимым введение поддерживающих доз 1-8 раз в день, предпочтительно 1-4 раза, в зависимости от физиологических потребностей конкретного больного. Также можно для некоторых больных вводить лекарственное средство только два раза в день. В случае человека дозы обычно составляют 0,01-200 мг/кг. Для введения интраперитональным путем дозы обычно составляют 0,1-100 мг/кг и предпочтительно 0,5-50 мг/кг и еще более предпочтительно 1-10 мг/кг. Для введения внутривенно дозы обычно составляют 0,1-50 мг/кг и предпочтительно 0,1-5 мг/кг и еще более предпочтительно 1-2 мг/кг. Разумеется, что для выбора наиболее соответствующей дозировки нужно учитывать путь введения, массу больного, общее состояние его здоровья, его возраст и все факторы, которые могут влиять на эффективность лечения. Следующий пример иллюстрирует композицию согласно изобретению. Пример. 40 мг полученного в примере 1 продукта растворяют в 1 см 3 Эмульфора EL 620 и 1 см 3 этанола, затем раствор разбавляют путем добавления 18 см 3 физиологической сыворотки. Композицию вводят методом перфузии в течение 1 ч путем введения ее в физиологический раствор. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Таксоиды общей формулы (I)Z означает радикал общей формулы (II)R1 означает бензоильный радикал или радикал R2-O-CO-, в котором R2 означает трет.-бутильный радикал, и R3 означает изобутильный, изобутенильный, бутенильный,циклогексильный, фенильный, фур-2-ильный,фур-3-ильный, тиен-2-ильный, тиен-3-ильный,тиазол-2-ильный, тиазол-4-ильный или тиазол 5-ильный радикал. 2. Способ получения таксоидов по п.1, заключающийся в том, что соединение общей формулы (III) в которой R1 и R3 имеют указанное в п.1 значение, и либо R6 означает атом водорода, а R7 означает защитную для гидроксильной функции группу, либо R6 и R7 вместе образуют насыщенный пяти- или шестичленный гетероцикл,этерифицируют с помощью кислоты общей формулы (IV)(IV) в которой R имеет вышеуказанное значение,или с помощью производного этой кислоты, такого как галоидангидрид, симметричный ангидрид или смешанный ангидрид, с получением соединения общей формулы (V) в которой R1, R3, R6 и R7 имеют вышеуказанное значение,затем защитные группы R7 или R6 и R7 заменяют атомами водорода. 3. Способ по п.2, отличающийся тем, что этерификацию осуществляют с помощью кислоты общей формулы (IV) в присутствии конденсационного агента и агента активации в органическом растворителе при температуре от 10 до 90 С. 4. Способ по п.2, отличающийся тем, что этерификацию осуществляют с помощью кислоты общей формулы (IV) в форме симметричного ангидрида, работая в присутствии агента активации в органическом растворителе при температуре от 0 до 90 С. 5. Способ по п.2, отличающийся тем, что этерификацию осуществляют с помощью кислоты общей формулы (IV) в форме галоидан 33 гидрида или в форме смешанного ангидрида с алифатической или ароматической кислотой,возможно, получаемого in situ, в присутствии основания, работая в органическом растворителе при температуре от 0 до 80 С. 6. Способ по п.2, отличающийся тем, что когда R6 означает атом водорода и R7 означает защитную для гидроксильной функции группу,защитную группу заменяют атомом водорода с помощью неорганической или органической кислоты, используемой индивидуально или в смеси, работая в органическом растворителе,выбираемом среди спиртов, простых и сложных эфиров, алифатических углеводородов, алифатических галогенированных углеводородов,ароматических углеводородов или нитрилов,при температуре от 10 до 60 С. 7. Способ по п.2, отличающийся тем, что когда R6 и R7 образуют оксазолидиновый цикл общей формулы (VI)R1 означает трет.-бутоксикарбонильный радикал, R8 и R9, одинаковые или разные, означают алкильный радикал или аралкильный радикал или арильный радикал, или R8 означает тригалогенметильный радикал или фенильный радикал, замещенный тригалогенметильным радикалом, a R9 означает атом водорода, или R8 и R9 вместе образуют 4-7-членный цикл,замену защитных групп R6 и R7 атомами водорода осуществляют путем обработки сложного эфира общей формулы (V) неорганической или органической кислотой, возможно, в органическом растворителе, с получением продукта общей формулы (VII) в которой R3 имеет вышеуказанное значение,который ацилируют с помощью бензоилхлорида или продукта общей формулы (VIII)(VIII) в которой R2 имеет вышеуказанное значение, а Х означает атом галогена или группу -О-R2 или-О-СО-О-R2,с получением продукта общей формулы(I), в которой Z означает радикал общей формулы (II). 8. Способ по п.2, отличающийся тем, что когда R6 и R7 образуют оксазолидиновый цикл общей формулы (VI) в которой R1 означает бензоильный радикал или радикал R2-O-СО-, в котором R2 имеет вышеуказанное значение, R8 означает атом водорода или алкоксильный радикал с 1-4 атомами углерода или фенильный радикал, замещенный одним или несколькими алкоксильными радикалами с 1-4 атомами углерода, и R9 означает атом водорода, замену защитной группы, образуемойR6 и R7, атомами водорода осуществляют в присутствии неорганической или органической кислоты, используемой индивидуально или в смеси, в стехиометрическом или каталитическом количестве, работая в органическом растворителе при температуре от 10 до 60 С. 9. Способ получения таксоидов общей формулы (I), в которой Z означает радикал общей формулы (II), заключающийся в том, что производное баккатина-III формулы (XI) этерифицируют с помощью кислоты общей формулы (X) в которой R1, R3 имеют указанное в п.1 значение, R6 и R7 имеют указанное в п.2 значение,или с помощью производного этой кислоты, такого как галоидангидрид, симметричный ангидрид или смешанный ангидрид, с последующей заменой защитных групп R7 или R6 и R7 атомами водорода. 10. Способ по п.9, отличающийся тем, что этерификацию осуществляют по способу согласно любому из пп.3, 4 или 5. 11. Способ по п.9, отличающийся тем, что защитные группы R7 или R6 и R7 заменяют атомами водорода в условиях по п.6. 12. Фармацевтическая композиция, отличающаяся тем, что она содержит, по крайней мере, одно соединение по любому из пп.1-3, в котором Z означает радикал общей формулы(II), в ассоциации с одним или несколькими фармацевтически приемлемыми продуктами,которые являются инертными или фармакологически активными.
МПК / Метки
МПК: A61K 31/335, C07D 305/14
Метки: композиция, получения, таксоиды, основе, способы, фармацевтическая
Код ссылки
<a href="https://eas.patents.su/18-726-taksoidy-sposoby-ih-polucheniya-i-farmacevticheskaya-kompoziciya-na-ih-osnove.html" rel="bookmark" title="База патентов Евразийского Союза">Таксоиды, способы их получения и фармацевтическая композиция на их основе</a>
Предыдущий патент: Запоминающее устройство для секретных данных и способ считывания секретных данных
Следующий патент: Система распределения трехфазной нагрузки
Случайный патент: Применение полиэфиров на основе простого эфира и сложного эфира для ротационного формования






















