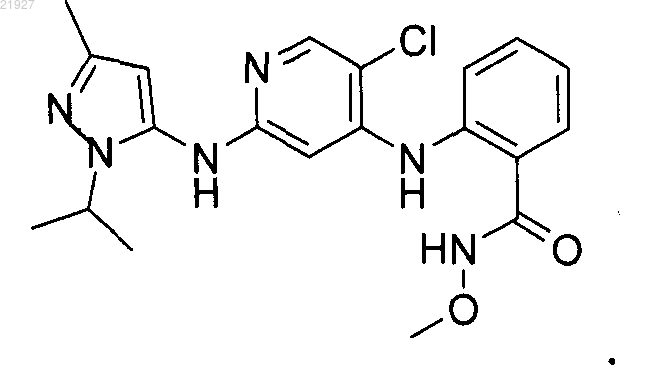
2-[(5-хлор-2-{[3-метил-1-(1-метилэтил)-1н-пиразол-5-ил]амино}-4-пиридинил)амино]-n-(метилокси)бензамид в качестве ингибиторов fak и содержащая его фармацевтическая композиция
Номер патента: 21927
Опубликовано: 30.09.2015
Авторы: Меллинджер Марк, Фейт Томас Х., Пэн Синь, Се Жэнь, Линь Хун, Адамс Джерри Лерой, Каспарек Иржи, Джонсон Нейл В.
Формула / Реферат
1. Соединение 2-[(5-хлор-2-{[3-метил-1-(1-метилэтил)-1H-пиразол-5-ил]амино}-4-пиридинил)амино]-N-(метилокси)бензамид или его фармацевтически приемлемая соль.
2. Соединение по п.1, представляющее собой 2-[(5-хлор-2-{[3-метил-1-(1-метилэтил)-1H-пиразол-5-ил]амино}-4-пиридинил)амино]-N-(метилокси)бензамид.
3. Фармацевтическая композиция для лечения злокачественной опухоли, содержащая терапевтически эффективное количество соединения по п.1 или 2 и фармацевтически приемлемый эксципиент.
4. Способ получения фармацевтической композиции по п.3, включающий приведение соединения по п.1 в контакт с фармацевтически приемлемым эксципиентом.
5. Применение соединения по п.1 для ингибирования активности FAK у нуждающегося в этом пациента.
6. Применение по п.5, где пациентом является человек.
7. Фармацевтическая композиция по п.3, где композиция находится в форме таблетки.
8. Способ лечения злокачественной опухоли, включающий введение нуждающемуся в этом пациенту фармацевтически эффективного количества соединения по п.1 или 2.
9. Способ по п.8, где указанная злокачественная опухоль выбрана из опухоли кожи, молочной железы, головного мозга, карциномы шейки матки, карциномы семенников, астроцитарной, колоректальной, эндометрия, пищевода, желудка, головы и шеи, гепатоцеллюлярной, ларингеальной, легких, полости рта, яичников, предстательной железы, щитовидной железы, саркомы, лимфомы, мезотелиомы, желудочно-кишечного тракта: желудка, поджелудочной железы, тонкого кишечника, толстого кишечника; почек, мочевого пузыря и мочеиспускательного канала, печени, костей, саркомы Юинга, злокачественной лимфомы, множественной миеломы, злокачественной гигантоклеточной хордомы, мультиформной глиобластомы, спинного мозга, матки, шейки матки, плоскоклеточной карциномы и гематологических нарушений.
10. Моногидрохлоридная соль соединения
Текст
FAK И СОДЕРЖАЩАЯ ЕГО ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ Настоящее изобретение относится к соединению формулы или к его фармацевтически приемлемой соли. Кроме того, изобретение относится к фармацевтической композиции для лечения злокачественной опухоли, содержащей указанное соединение, к способу получения указанной фармацевтической композиции, применению заявленного соединения для ингибирования активности FAK и к способу лечения злокачественной опухоли. Область техники, к которой относится изобретение Настоящее изобретение относится к классу пиразолиламинопиридинов, которые ингибируют киназу фокальной адгезии (FAK), а также к их композициям. Соединения по настоящему изобретению пригодны для лечения пролиферативных заболеваний, включающих в качестве неограничивающих примеров злокачественную опухоль. Предшествующий изобретению уровень техники Тирозинкиназы играют важную роль в регуляции множества клеточных процессов, включая клеточную пролиферацию, выживание клеток и клеточную миграцию. Известно, что во многих злокачественных опухолях человека определенные тирозинкиназы активируются мутациями или аномально экспрессированы. Например, выявлено, что при раке молочной железы, раке легких, злокачественной опухоли головного мозга, плоскоклеточном раке, раке желудка и других злокачественных опухолях человека мутирован и/или сверхэкспрессирован рецептор эпидермального фактора роста (EGFR). Показано, что клиническое значение при лечении злокачественных опухолей с мутированным и/или сверхэкспрессированным EGFR имеют селективные ингибиторы тирозинкиназной активности EGFR. Таким образом, для лечения пролиферативных заболеваний, таких как злокачественная опухоль, пригодны селективные ингибиторы конкретной тирозинкиназы.FAK (кодируемая геном PTK2) представляет собой нерецепторную тирозинкиназу, объединяющую сигналы от рецепторов интегринов и факторов роста. Опубликовано, что FAK играет роль в регуляции выживания, роста, миграции и инвазии клеток (McLean et al., 2005, Nat. Rev. Cancer 5:505-515). Кроме того, FAK регулируется и активируется посредством фосфорилирования нескольких остатков тирозина. Сверхэкспрессия мРНК и/или белка FAK зарегистрирована при многих солидных опухолях человека,включая в качестве неограничивающих примеров злокачественные опухоли молочной железы, толстой кишки, щитовидной железы, легкого, яичника и предстательной железы; но также включая злокачественные опухоли гематологического происхождения, включая в качестве неограничивающих примеров лейкоз, такой как острый миелолейкоз (AML). (Owens et al., 1995, Cancer Research 55: 2752-2755; Agochiya et al., 1999, Oncogene 18:5646-5653; Gabarro-Niecko et al., 2003, Cancer Metastasis Rev. 22:359-374; Recher et al., 2004, Cancer Research 64:3191-3197; Zhao and Guan, 28:35-49, 2009, Cancer Metastasis Rev.). Более существенно, что существуют доказательства того, что содержание фосфорилированной FAK в злокачественных тканях по сравнению с нормальными увеличено (Grisaru-Granovsky et al., 2005, Int. J.Cancer 113: 372-378) и может служить прогностическим маркером метастазирования. При злокачественных опухолях на поздних стадиях и метастазирующих злокачественных опухолях у человека явно вовлечена активность FAK (Zhao and Guan, 28:35-49, 2009, Cancer Metastasis Rev.). Показано, что удаление FAK посредством РНКи или экспрессия доминантно-негативной FAK вызывает утрату адгезионной способности и гибель клеток в клеточных линиях молочной железы и меланомы человека и увеличивает опосредованный доцетакселом апоптоз клеток рака яичников (Beviglia etCancer Res. 11:8829-8836). Однако выявлено, что ингибирование FAK в нормальных фибробластах или иммортализованных клетках молочной железы (MCF10A) человека не вызывает утрату адгезионной способности или апоптоза (Xu et al., 1996 Cell Growth and Diff 7:413-418). В модели на сингенных крысах также показано, что ингибирование FAK посредством экспрессии доминантно-негативной формы уменьшает рост опухоли и устраняет метастазирование клеток аденокарциномы молочной железы в легкие (van Nimwegen et al., 2005, Cancer Res. 65:4698-4706). Аналогично, ингибирование FAK посредством кшРНК в модели на сингенных мышах ингибировало метастазирование в легкие и снижало летальность на 40% (Mitra et al., 2006, Oncogene 25: 4429-4440). В этом исследовании транзиторная реэкспрессия FAK дикого типа, но не FAK без киназной активности, обращала фенотипы, обусловленные кшРНК. Ингибирование FAK посредством экспрессии доминантно-негативной формы в клетках карциномы мышей 4 Т 1 уменьшало рост опухоли и ангиогенез у мышей (Mitra et al., 2006, Oncogene 25:5969-5984). Кроме того,утрата каталитической активности FAK (реконструкция клеток FAK-/- с FAK без киназной активности) снижала рост опухолей v-Src у мышей и снижала ангиогенез. Таким образом, существуют убедительные доказательства, чтобы полагать, что ингибирование активности FAK индуцирует апоптоз, утрату адгезионной способности, ингибирование роста и миграции клеток и что такое ингибирование снижает ангиогенез. Таким образом, соединения, ингибирующие активность FAK, могли бы быть пригодными для лечения злокачественной опухоли. Сущность изобретения Настоящее изобретение относится к соединению формулы или к его фармацевтически приемлемой соли. В дополнительном варианте осуществления настоящее изобретение относится к фармацевтической композиции для лечения злокачественной опухоли, содержащей а) 2-[(5-хлор-2-[3-метил-1-(1-метилэтил)-1H-пиразол-5-ил]амино-4-пиридинил)амино]-N-(метилокси)бензамид или его фармацевтически приемлемую соль иb) фармацевтически приемлемый эксципиент. В дополнительном варианте осуществления настоящее изобретение относится к способу получения указанной фармацевтической композиции, включающему приведение 2-[(5-хлор-2-[3-метил-1-(1 метилэтил)-1H-пиразол-5-ил]амино-4-пиридинил)амино]-N-(метилокси)бензамида в контакт с фармацевтически приемлемым эксципиентом. В дополнительном варианте осуществления настоящее изобретение относится к способу лечения пролиферативного заболевания, такого как злокачественная опухоль, включающему введение нуждающемуся в этом пациенту фармацевтически эффективное количество 2-[(5-хлор-2-[3-метил-1-(1 метилэтил)-1H-пиразол-5-ил]амино-4-пиридинил)амино]-N-(метилокси)бензамида. Подробное описание изобретения В одном аспекте настоящее изобретение относится к соединению 2-[(5-хлор-2-[3-метил-1-(1 метилэтил)-1H-пиразол-5-ил]амино-4-пиридинил)амино]-N-(метилокси)бензамиду формулы или к его фармацевтически приемлемой соли. Специалистам в данной области понятно, что можно получать фармацевтически приемлемые соли заявленного соединения. Более конкретно, поскольку заявленное соединение содержит основную функциональную группу, оно при обработке подходящей кислотой способно к формированию фармацевтически приемлемой соли. Подходящие кислоты включают фармацевтически приемлемые неорганические кислоты и органические кислоты. Характерные фармацевтически приемлемые кислоты включают соляную кислоту, бромистый водород, азотную кислоту, серную кислоту, сульфоновую кислоту, фосфорную кислоту, уксусную кислоту, гидроксиуксусную кислоту, фенилуксусную кислоту, пропионовую кислоту,масляную кислоту, валериановую кислоту, малеиновую кислоту, акриловую кислоту, фумаровую кислоту, яблочную кислоту, малоновую кислоту, винную кислоту, лимонную кислоту, салициловую кислоту,бензойную кислоту, дубильную кислоту, муравьиную кислоту, стеариновую кислоту, молочную кислоту,аскорбиновую кислоту, п-толуолсульфоновую кислоту, олеиновую кислоту и лауриновую кислоту. Хотя возможно, что для применения в терапии заявленное соединение, а также его соли можно вводить в виде чистого препарата, т.е. без дополнительного носителя, более обычной практикой является предоставление активного ингредиента, полученного с носителем или разбавителем. Таким образом,изобретение дополнительно относится к фармацевтическим композициям, включающим заявленное соединение и его фармацевтически приемлемые соли, и один или несколько фармацевтически приемлемых носителей, разбавителей или эксципиентов. Заявленное соединение и его фармацевтически приемлемые соли являются такими, как описано выше. Носитель(и), разбавитель(и) или эксципиент(ы) должны быть приемлемыми в смысле необходимости совместимости с другими ингредиентами состава и отсутствия их вредного воздействия на потребителя. По другому аспекту изобретения также предоставлен способ получения фармацевтической композиции, включающий смешивание заявленного соединения или его фармацевтически приемлемых солей, с одним или несколькими фармацевтически приемлемыми носителями, разбавителями или эксципиентами. Фармацевтические композиции можно предоставлять в стандартных лекарственных формах, содержащих предопределенное количество активного ингредиента на стандартную дозу. Такая стандартная лекарственная форма может содержать, например, от 0,5 до 3500 мг, предпочтительно от 1 до 700 мг,более предпочтительно от 5 до 100 мг заявленного соединения в зависимости от подлежащего лечению состояния, способа введения и возраста, массы и состояния пациента, или фармацевтические композиции можно предоставлять в стандартных лекарственных формах, содержащих предопределенное количество активного ингредиента на стандартную дозу. Предпочтительные стандартные лекарственные формы представляют собой формы, содержащие суточную дозу или поддозу, как перечислено в настоящем документе выше, или их соответствующие части активного ингредиента. Кроме того, такие фармацевтические композиции можно получать любыми хорошо известными в области фармации способами. Фармацевтические композиции можно адаптировать для введения любым подходящим способом введения, например, посредством перорального (включая буккальное или сублингвальное), ректального,назального, топического (включая буккальное, сублингвальное или трансдермальное), вагинального или парентерального (включая подкожное, внутримышечное, внутривенное или интрадермальное) способа введения. Такие композиции можно получать любым известным в области фармации способом, напри-2 021927 мер ассоциируя заявленное соединение с носителем(ями) или эксципиентом(ами). Фармацевтические композиции, адаптированные для перорального введения, можно предоставлять в виде дискретных единиц, таких как капсулы или таблетки; порошки или гранулы; растворы или суспензии в водных или неводных жидкостях; съедобные пены или кремы; или жидкие эмульсии масло-вводе или жидкие эмульсии вода-в-масле. Капсулы изготавливают, получая порошковую смесь, как описано выше, и заполняя сформованные желатиновые оболочки. Перед заполнением в порошковую смесь можно добавлять способствующие скольжению средства и смазочные средства, такие как коллоидный диоксид кремния, тальк, стеарат магния, стеарат кальция или твердый полиэтиленгликоль. Также для улучшения доступности лекарственного средства при приеме капсулы можно добавлять дезинтегратор или солюбилизатор, такие как агарагар, карбонат кальция или карбонат натрия. Кроме того, при желании или необходимости в смесь также можно вводить подходящие связывающие средства, смазочные средства, дезинтегрирующие средства и красители. Подходящие связывающие средства включают крахмал, желатин, природные сахара, такие как глюкоза или -лактоза, кукурузные подсластители, природные и синтетические камеди, такие как гуммиарабик, трагакант или альгинат натрия, карбоксиметилцеллюлоза, полиэтилен гликоль, воски и т.п. Смазочные средства, используемые в этих лекарственных формах, включают олеат натрия, стеарат натрия, стеарат магния, бензоат натрия,ацетат натрия, хлорид натрия и т.п. Дезинтегрирующие средства включают в качестве неограничивающих примеров крахмал, метилцеллюлозу, агар, бентонит, ксантановую камедь и т.п. Таблетки формулируют, например, получая порошковую смесь, гранулируя или агрегируя, добавляя смазочное средство и дезинтегрант и прессуя в таблетки. Порошковую смесь получают, смешивая соответствующим образом измельченное соединение с разбавителем или основанием, как описано выше, и, необязательно, со связывающим средством, таким как карбоксиметилцеллюлоза, альгинат, желатин или поливинилпирролидон, замедлителем растворения, таким как парафин, ускорителем рассасывания, таким как четвертичная соль и/или средством для всасывания, таким как бентонит, каолин или дифосфат кальция. Порошковую смесь можно гранулировать посредством формирующих таблетки прессов посредством добавления стеариновой кислоты, соли стеариновой кислоты, талька или минерального масла. Затем смесь с добавленной смазкой прессуют в таблетки. Соединения по настоящему изобретению также можно комбинировать с инертным носителем с высокой текучестью и прессовать в таблетки непосредственно без прохождения стадий гранулирования или агрегации. Можно наносить прозрачное или непрозрачное защитное покрытие, состоящее из герметизирующего покрытия из шеллака, покрытия из сахара или полимерного вещества и полирующего покрытия из воска. К этим покрытиям можно добавлять красящие вещества для различения разных единиц дозирования. Пероральные жидкости, такие как растворы, сиропы и эликсиры, можно получать в стандартной лекарственной форме так, чтобы заданное количество содержало предопределенное количество заявленного соединения. Сиропы можно получать, растворяя соединение в подходящим образом ароматизированном водном растворе, тогда как эликсиры получают, используя нетоксический спиртовой носитель. Суспензии можно формулировать, диспергируя соединение в нетоксическом носителе. Также можно добавлять солюбилизаторы и эмульгаторы, такие как этоксилированные изостеариловые спирты и простые полиоксиэтиленсорбитные эфиры, консерванты, ароматизаторы, такие как масло перечной мяты или природные подсластители или сахарин или другие искусственные подсластители и т.п. При необходимости, единицы дозирования фармацевтических композиций для перорального введения можно микроинкапсулировать. Также можно получать состав для пролонгированного или продолжительного высвобождения, например, как посредством нанесения покрытия или помещения частиц в полимеры, воск или т.п. Фармацевтические составы, пригодные для парентерального введения, включают водные и неводные стерильные растворы для инъекций, которые могут содержать антиоксиданты, буферы, бактериостатики и растворы, делающие композицию изотонической с кровью предполагаемого реципиента; и водные и неводные стерильные суспензии, которые могут включать суспендирующие средства и загустители. Фармацевтические композиции можно предоставлять в контейнерах с единичной дозой и контейнерах с несколькими дозами, например, в герметизированных ампулах и флаконах, и их можно хранить в высушенном сублимацией (лиофилизированном) состоянии, требующем только добавления стерильного жидкого носителя, например, воды для инъекций, непосредственно перед использованием. Приготовляемые для немедленного приема растворы и суспензии для инъекций можно получать из стерильных порошков, гранул и таблеток. Терапевтически эффективное количество соединения по настоящему изобретению зависит от ряда факторов, включающих, например, возраст и массу предполагаемого реципиента, конкретного состояния, требующего лечения, и его тяжести, характера и маршрута введения состава, и, в конечном счете,находится на усмотрении лица, назначающего лекарственное средство. Однако эффективное количество заявленное соединение для лечения злокачественной опухоли, как правило, находится в диапазоне от 0,001 до 100 мг/кг массы тела реципиента в сутки, соответственно в диапазоне от 0,01 до 10 мг/кг массы тела в сутки. Для взрослого массой 70 кг фактическое количество в сутки соответственно составляет от 7 до 700 мг, и это количество можно вводить однократной дозой в сутки или несколькими (например, двумя, тремя, четырьмя, пятью или шестью) поддозами в сутки так, чтобы общая суточная доза оставалась такой же. Эффективное количество соли или сольвата и т.д., по существу, можно определять как пропорциональную часть от эффективного количества заявленного соединения. Полагают, что для лечения различных указанных выше состояний могут подходить сходные дозы. Терапия. Соединения и композиции по изобретению используют для лечения клеточно-пролиферативных заболеваний. Болезненные состояния, которые можно лечить способами и композициями, предоставляемыми по настоящему документу, включают в качестве неограничивающих примеров, злокачественную опухоль, аутоиммунное заболевание, грибковые нарушения, артрит, отторжение трансплантата, воспалительное заболевание кишечника, пролиферацию, индуцированную после медицинских манипуляций,включая в качестве неограничивающих примеров хирургию, ангиопластику и т.п. Следует понимать, что в некоторых случаях клетки могут не находиться в состоянии гипер- или гипопролиферации (аномальное состояние) и тем не менее может требоваться лечение. Например, при заживлении ран клетки могут пролиферировать "нормально", но желательным может являться усиление пролиферации. Таким образом, в одном из вариантов осуществления изобретение по настоящему документу включает применение для клеток или индивидуумов пораженных или с угрозой поражения любым из этих нарушений или состояний. Эти соединения также можно использовать для лечения дегенерации желтого пятна, ассоциированной с неоваскуляризацией, такой как AMD. Композиции и способы, предоставляемые по настоящему документу, полагают особенно подходящими для лечения злокачественной опухоли, включая такие опухоли, как опухоли кожи, молочной железы, головного мозга, карциномы шейки матки, карциномы семенников и т.д. Они особенно пригодны для лечения метастазирующих или злокачественных опухолей. Более конкретно, злокачественные опухоли,которые можно лечить композициями и способами по изобретению включают в качестве неограничивающих примеров такие типы опухолей, как карциномы и саркомы: астроцитарные, молочной железы,шейки матки, колоректальные, эндометрия, пищевода, желудка, головы и шеи, гепатоцеллюлярные, ларингеальные, легких, полости рта, яичников, предстательной железы и щитовидной железы. Более конкретно, эти соединения можно использовать для лечения сердца: саркомы (ангиосаркомы, фибросаркомы, рабдомиосаркомы, липосаркомы), миксомы, рабдомиомы, фибромы, липомы и тератомы; легкого: бронхогенной карциномы (плоскоклеточной, недифференцированной мелкоклеточной, недифференцированной крупноклеточной, аденокарциномы), альвеолярной (бронхиолярной) карциномы, бронхиальной аденомы, саркомы, лимфомы, хондроматозной гамартомы, мезотелиомы; желудочно-кишечного тракта: пищевода (плоскоклеточной карциномы, аденокарциномы, лейомиосаркомы, лимфомы), желудка(карциномы, лимфомы, лейомиосаркомы), поджелудочной железы (протоковой аденокарциномы, инсулиномы, глюкагономы, гастриномы, карциноидных опухолей, ВИПомы), тонкого кишечника (аденокарциномы, лимфомы, карциноидных опухолей, саркомы Капоши, лейомиомы, гемангиомы, липомы, нейрофибромы, фибромы), толстого кишечника (аденокарциномы, тубулярной аденомы, ворсинчатой аденомы, гамартомы, лейомиомы); мочеполовых путей: почек (аденокарциномы, опухоли Вильма (нефробластомы), лимфомы, лейкоза), мочевого пузыря и мочеиспускательного канала (плоскоклеточной карциномы, переходноклеточной карциномы, аденокарциномы), предстательной железы (аденокарциномы,саркомы), семенников (семиномы, тератомы, эмбриональной карциномы, тератокарциномы, хориокарциномы, саркомы, карциномы интерстициальных клеток, фибромы, фиброаденомы, аденоматоидных опухолей, липомы); печени: гепатомы (печеночноклеточной карциномы), холангиокарциномы, гепатобластомы, ангиосаркомы, печеночноклеточной аденомы, гемангиомы; костей: остеогенной саркомы (остеосаркомы), фибросаркомы, злокачественной фиброзной гистиоцитомы, хондросаркомы, саркомы Юинга, злокачественной лимфомы (саркомы ретикулярных клеток), множественной миеломы, злокачественной гигантоклеточной хордомы, остеохондромы (костно-хрящевого экзостоза), доброкачественной хондромы, хондробластомы, хондромиксофибромы, остеоидной остеомы и гигантоклеточных опухолей; нервной системы: черепа (остеомы, гемангиомы, гранулемы, ксантомы, деформирующего остита), оболочек головного мозга (менингиомы, менингиосаркомы, глиоматоза), головного мозга (астроцитомы,медуллобластомы, глиомы, эпендимомы, герминомы (пинеаломы), мультиформной глиобластомы, олигодендроглиомы, шванномы, ретинобластомы, наследственных опухолей), нейрофибромы спинного мозга, менингиомы, глиомы, саркомы); гинекологических нарушений: матки (карциномы эндометрия), шейки матки (карциномы шейки матки, предопухолевой дисплазии шейки матки), яичников (карциномы яичников (серозной цистаденокарциномы, слизистой цистаденокарциномы, неклассифицированной карциномы), гранулезоклеточных опухолей, опухолей из клеток Сертоли-Лейдига, дисгерминомы, злокачественной тератомы), наружных женских половых органов (плоскоклеточной карциномы, интраэпителиальной карциномы, аденокарциномы, фибросаркомы, меланомы), влагалища (светлоклеточного рака,плоскоклеточной карциномы, ботриоидной саркомы (эмбриональной рабдомиосаркомы), фаллопиевых труб (карциномы); гематологических нарушений: крови (миелолейкоза (острого и хронического), острого лимфобластного лейкоза, хронического лимфоцитарного лейкоза, миелопролиферативных заболеваний, множественной миеломы, миелодиспластического синдрома), болезни Ходжкина, неходжкинской лимфомы (злокачественной лимфомы); кожи: злокачественной меланомы, базально-клеточной карциномы, плоскоклеточной карциномы, саркомы Капоши, родинок диспластических невусов, липомы, ангиомы, дерматофибромы, келоидов, псориаза; и надпочечников: нейробластомы. Таким образом, как предоставлено в настоящем документе термин "злокачественная клетка" включает клетку, пораженную любым из указанных выше состояний или родственных им. В сравнении с родственными 2,4-диаминопиридиновыми производными, описанными в других источниках, соединения по настоящему изобретению содержат функциональную группу сложного эфира гидроксамовой кислоты во 2 положении 4-аминофенильного цикла и аминопиразол во 2 положении пиридинового цикла. Функциональная группа сложного эфира гидроксамовой кислоты на фенильном цикле по сравнению с соответствующим амидом увеличивает эффективность против FAK порядка в 2,5 раза,особенно in vitro, и улучает селективность для FAK относительно других ферментов. Пиразол снижает реакционную способность относительно цитохромов Р 450. Таким образом, комбинация конструкции сложного эфира гидроксамовой кислоты на фенильном цикле с аминопиразолом во 2 положении в пиридиновом цикле дает соединения с улучшенной безопасностью и эффективностью относительно других ингибиторов FAK, таких как 2,4-диаминопиридиновые производные. Соединения по настоящему изобретению можно комбинировать или совместно вводить с другими терапевтическими средствами, в частности со средствами, которые могут увеличивать активность или время распределения соединений. Способы комбинированного лечения по изобретению включают введение по меньшей мере одного соединения по изобретению и использование по меньшей мере одного другого способа лечения. В одном из вариантов осуществления способы комбинированного лечения по изобретению включают введение по меньшей мере одного соединения по изобретению и хирургическое лечение. В одном из вариантов осуществления способы комбинированного лечения по изобретению включают введение по меньшей мере одного соединения по изобретению и лучевую терапию. В одном из вариантов осуществления способы комбинированного лечения по изобретению включают введение по меньшей мере одного соединения по изобретению и по меньшей мере одного средства симптоматической терапии (например, по меньшей мере одного противорвотного средства). В одном из вариантов осуществления способы комбинированного лечения по настоящему изобретению включают введение по меньшей мере одного соединения по изобретению и по меньшей мере одного другого химиотерапевтического средства. В одном конкретном варианте осуществления изобретение включает введение по меньшей мере одного соединения по изобретению и по меньшей мере одного противоопухолевого средства. В еще одном варианте осуществления изобретение включает схему лечения, где ингибиторы FAK по настоящему изобретению сами не активны или не активны на значимом уровне, но при комбинировании с другим способом лечения, который может быть активен или может не быть активен в качестве самостоятельного лечения, комбинация обеспечивает успешный терапевтический исход. Как применяют в настоящем документе под термином "совместное введение" и производными от него, подразумевают или одновременное введение, или любой способ раздельного последовательного введения ингибирующего FAK соединения, как описано в настоящем документе, и дополнительного активного ингредиента или ингредиентов, которые известны как подходящие для лечения злокачественной опухоли, включая химиотерапевтическое и радиационное лечение. Как применяют в настоящем документе, термин "дополнительный активный ингредиент или ингредиенты" включает любое соединение или терапевтическое средство, у которого известны или которое демонстрирует полезные свойства при введении пациенту, нуждающемуся в лечении злокачественной опухоли. Предпочтительно, если введение не является одновременным, соединения вводят в непосредственной временной близости друг с другом. Кроме того, не имеет значение, вводят ли соединения в одинаковой лекарственной форме, например, одно из соединений можно вводить топически, а другое соединение можно вводить перорально. Как правило, по настоящему изобретению для лечения конкретных злокачественных опухолей можно совместно вводить любое противоопухолевое средство, обладающее активностью против чувствительной опухоли, подвергаемой лечению. Примеры таких средств можно найти в Cancer Principles andPractice of Oncology by V.T. Devita and S. Hellman (editors), 6th edition (February 15, 2001), Lippincott WilliamsWilkins Publishers. Специалист в данной области сможет определить, какие комбинации средств подойдут на основе конкретных характеристик лекарственных средств и рассматриваемой злокачественной опухоли. Типичные противоопухолевые средства, пригодные по настоящему изобретению, включают в качестве неограничивающих примеров средства против микротрубочек, такие как дитерпеноиды и алкалоиды барвинка; координационные комплексы платины; алкилирующие средства, такие как азотистые иприты, оксазофосфорины, алкилсульфонаты, нитрозомочевины и триазены; антибиотики, такие как антрациклины, актиномицины и блеомицины; ингибиторы топоизомеразы II, такие как эпиподофиллотоксины; антиметаболиты, такие как аналоги пуринов и пиримидинов и антифолатные соединения; ингибиторы топоизомеразы I, такие как камптотецины; гормоны и аналоги гормонов; ингибиторы путей передачи сигнала; ингибиторы ангиогенеза под действием нерецепторных тирозинкиназ; иммунотерапевтические средства; проапоптотические средства и ингибиторы передачи сигналов клеточного цикла. Как правило, в комбинации с соединениями по изобретению можно использовать любое химиотерапевтическое средство с активностью против восприимчивой неоплазии, подвергаемой лечению, при условии, что это конкретное средство клинически совместимо с терапией, в которой применяют соединение по изобретению. Типичные противоопухолевые средства, пригодные по настоящему изобретению,включают в качестве неограничивающих примеров: алкилирующие средства, антиметаболиты, противоопухолевые антибиотики, антимитотические средства, ингибиторы топоизомераз I и II, гормоны и аналоги гормонов; ретиноиды, ингибиторы путей передачи сигнала, включающие ингибиторы клеточного роста или функционирования факторов роста, ингибиторы ангиогенеза и ингибиторы серин/треониновых или других киназ; ингибиторы циклинзависимых киназ; лекарственные средства на основе антисмысловых последовательностей и иммунотерапевтические средства, включая моноклональные антитела, вакцины или другие биологические средства. Ингибиторы путей передачи сигнала представляют собой ингибиторы, блокирующие или ингибирующие химический процесс, вызывающий внутриклеточные изменения. Как применяют в настоящем документе, это изменение представляет собой пролиферацию, или дифференцировку, или продолжительность жизни клеток. Ингибиторы путей передачи сигнала, пригодные по настоящему изобретению,включают в качестве неограничивающих примеров ингибиторы рецепторных тирозинкиназ, нерецепторных тирозинкиназ, блокаторов доменов SH2/SH3, серин/треониновых киназ, фосфатидилинозитол-3-ОНкиназ, передачи сигнала миоинозитолом и Ras-онкогенов. Ингибиторы путей передачи сигнала можно применять в комбинации с соединениями по изобретению в композициях и способах, описанных выше. Также по настоящему изобретению могут найти применение ингибиторы ангиогенеза под действием рецепторных киназ. Выше приведено обсуждение ингибиторов ангиогенеза, связанного с VEGFR иTIE-2, в отношении ингибиторов передачи сигнала (оба представляют собой рецепторные тирозинкиназы). В комбинации с соединениями по изобретению можно использовать другие ингибиторы. Например,антитела к VEGF, не распознающие VEGFR (рецепторная тирозинкиназа), но связывающиеся с лигандом; низкомолекулярные ингибиторы интегрина (V3), ингибирующие ангиогенез; также полезными в комбинации с соединениями по изобретению могут оказаться эндостатин и ангиостатин (не RTK). Одним из примеров антитела к VEGFR является бевацизумаб (авастин). В разработке находятся несколько ингибиторов рецепторов факторов роста, и они включают антагонисты лигандов, антитела, ингибиторы тирозинкиназ, антисмысловые олигонуклеотиды и аптамеры. Любой из этих ингибиторов рецепторов факторов роста можно применять в комбинации с соединениями по изобретению в любых из композиций и способах/применениях, описываемых в настоящем документе. Примером ингибитора функционирования фактора роста на основе антитела к erbB2 является трастузумаб (герцептин). Одним из примеров ингибитора функционирования фактора роста на основе антитела к erbB1 является цетуксимаб (эрбитукс, С 225). Примером моноклонального антитела к VEGFR является бевацизумаб (авастин). Примеры низкомолекулярных ингибиторов рецепторов эпидермального фактора роста включают в качестве неограничивающих примеров лапатиниб (тайкерб) и эрлотиниб (тарцева). Одним из примеров ингибиторов PDGFR является иматиниба мезилат (гливек). Примеры ингибиторов VEGFR включают пазопаниб, ZD6474, AZD2171, PTK787, сунитиниб и сорафениб. Особый интерес представляют пазопаниб и соединения формулы I и их соли. Средства против микротрубочек или антимитотические средства представляют собой фазоспецифические средства, активные против микротрубочек опухолевых клеток в течение М-фазы или митоза клеточного цикла. Примеры средств против микротрубочек включают в качестве неограничивающих примеров дитерпеноиды и алкалоиды барвинка. Дитерпеноиды, которые получают из природных источников, представляют собой фазоспецифические средства против злокачественных опухолей, которые действуют в фазах G2/M клеточного цикла. Полагают, что дитерпеноиды стабилизируют -субъединицу тубулина микротрубочек посредством связывания с этим белком. Затем, по-видимому, происходит ингибирование разборки белка с арестом митоза и последующей гибелью клеток. Примеры дитерпеноидов включают в качестве неограничивающих примеров паклитаксел и его аналог доцетаксел. Паклитаксел, 4,10-диацетат-2-бензоат 5,20-эпокси-1,2,4,7,10,13-гексагидрокситакс-11-ен-9 она со сложноэфирной связью в положении 13 с (2R,3S)-N-бензоил-3-фенилизосерином; представляет собой природный дитерпеновый продукт, выделенный из тихоокеанского тиса Taxus brevifolia и является коммерчески доступным в качестве инъецируемого раствора таксол. Он является представителем таксанового семейства терпенов. Его впервые выделили в 1971 г. по Wani et al. J. Am. Chem, Soc., 93:2325. 1971, охарактеризовавшим его структуру посредством химических и рентгенокристаллографических способов. Один из механизмов его активности связан со способностью паклитаксела связывать тубулин,ингибируя, таким образом, рост злокачественных клеток. Schiff et al., Proc. Natl, Acad, Sci. USA, 77:15611565 (1980); Schiff et al., Nature, 277:665-667 (1979); Kumar, J. Biol., Chem., 256: 10435-10441 (1981). Для обзора синтеза и противоопухолевой активности некоторых производных паклитаксела см.: D.G.I. Kingston et al., Studies in Organic Chemistry vol. 26, озаглавленной "New trends in Natural Products Chemistry 1986", Attaur-Rahman, P.W. Le Quesne, Eds. (Elsevier, Amsterdam, 1986) pp. 219-235. Паклитаксел одобрен для клинического применения для лечения неподдающегося лечению рака яичников в Соединенных Штатах Америки (Markman et al., Yale Journal of Biology and Medicine, 64:583,-6 021927 1991; McGuire et al., Ann. Intern, Med., 111:273, 1989) и для лечения рака молочной железы (Holmes et al.,J. Nat. Cancer Inst., 83:1797, 1991). Он является потенциальным кандидатом на лечение неоплазии кожи(Einzig et al., Proc. Am. Soc. Clin. Oncol., 20:46) и карциномы головы и шеи (Forastire et al., Sem. Oncol.,20:56, 1990). Соединение также демонстрирует потенциал для лечения поликистозного заболевания почек (Woo et al., Nature, 368:750. 1994), рака легких и малярии. Лечение пациентов паклитакселом приводит к супрессии костного мозга (несколько линий клеток, Ignoff, R.J. et al., Cancer Chemotherapy PocketGuide, 1998), связанной с длительностью дозирования выше пороговой концентрации (50 нМ) (Kearns,C.M. et al., Seminars in Oncology, 3(6) p. 16-23, 1995). Доцетаксел, сложный (2R,3S)-N-карбокси-3-фенилизосериновый, N-трет-бутиловый эфир в положении 13 с 4-ацетат-2-бензоатом 5-20-эпокси-1,2, 4,7,10,13-гексагидрокситакс-11-ен-9-она, тригидрат; является коммерчески доступным в виде инъецируемого раствора, как таксотер. Доцетаксел предназначен для лечения рака молочной железы. Доцетаксел представляет собой полусинтетическое производное паклитаксела, см. выше, полученное из природного предшественника, 10 деацетилбаккатина III, экстрагированного из игл европейского тиса. Лимитирующей дозу токсичностью доцетаксела является нейтропения. Алкалоиды барвинка представляют собой фазоспецифические противоопухолевые средства, получаемые из растения барвинка. Алкалоиды барвинка действуют в М-фазе (митозе) клеточного цикла, специфически связываясь с тубулином. Таким образом, связанная молекула тубулина не способна к полимеризации в микротрубочки. Полагают, что происходит задержка митоза в метафазе с последующей гибелью клеток. Примеры алкалоидов барвинка включают в качестве неограничивающих примеров винбластин, винкристин и винорелбин. Винбластин, сульфат винкалейкобластина, коммерчески доступен как велбан в виде инъецируемого раствора. Хотя он имеет возможное показание в качестве терапии второй линии различных солидных опухолей, он, прежде всего, предназначен для лечения рака яичка и различных лимфом, включая болезнь Ходжкина и лимфоцитарные и гистиоцитарные лимфомы. Лимитирующим дозу побочным эффектом винбластина является миелосупрессия. Винкристин, сульфат 22-оксовинкалейкобластина, коммерчески доступен как онковин в виде инъецируемого раствора. Винкристин предназначен для лечения острых лейкозов, а также находит применение в схемах лечения злокачественной лимфомы Ходжкина и неходжкинских злокачественных лимфом. Наиболее частыми побочными эффектами винкристина являются алопеция и неврологические эффекты и в меньшей степени возникают миелосупрессия и желудочно-кишечный мукозит. Винорелбин, 3',4'-дидегидро-4'-дезокси-С'-норвинкалейкобластин [R-(R,R)-2,3-дигидроксибутандиоат (1:2) (соль)], коммерчески доступный в виде инъецируемого раствора тартрата винорелбина (навельбин), представляет собой полусинтетический алкалоид барвинка. Винорелбин показан в качестве единственного средства или в комбинации с другими химиотерапевтическими средствами, такими как цисплатин, для лечения различных солидных опухолей, в частности немелкоклеточного рака легких, рака молочной железы на поздних стадиях и устойчивого к гормонам рака предстательной железы. Наиболее частым ограничивающим дозу побочным эффектом винорелбина является миелосупрессия. Координационные комплексы платины являются нефазоспецифическими противоопухолевыми средствами, которые взаимодействуют с ДНК. Комплексы платины проникают в опухолевые клетки,гидратируются и образуют внутри межцепочечные связи с ДНК, вызывая неблагоприятные биологические эффекты для опухоли. Примеры координационных комплексов платины включают в качестве неограничивающих примеров цисплатин и карбоплатин. Цисплатин, цисдиаминдихлорплатина, коммерчески доступен как платинол в виде инъецируемого раствора. Цисплатин, прежде всего, предназначен для лечения метастазирующих рака яичка, рака яичников и рака мочевого пузыря на поздних стадиях. Первичные ограничивающие дозу побочные эффекты цисплатина представляют собой нефротоксичность, которую можно контролировать гидратацией, диурез и ототоксичность. Карбоплатин, диамин-[1,1-циклобутандикарбоксилат(2-)-О,О']-платина, коммерчески доступен как параплатин в виде инъецируемого раствора. Карбоплатин прежде всего предназначен для лечения первой и второй линии карцином яичников на поздних стадиях. Лимитирующей дозу токсичностью карбоплатина является супрессия костного мозга. Алкилирующие средства являются нефазоспецифическими противоопухолевыми средствами и строгими электрофилами. Как правило, алкилирующие средства образуют ковалентные связи посредством алкилирования ДНК по нуклеофильным группам молекулы ДНК, таким как фосфатные, амино-,сульфгидрильные, гидроксильные, карбоксильные и имидазольные группы. Такое алкилирование нарушает функцию нуклеиновой кислоты, приводя к гибели клеток. Примеры алкилирующих средств включают в качестве неограничивающих примеров азотистые иприты, такие как циклофосфамид, мелфалан и хлорамбуцил; алкилсульфонаты, такие как бусульфан; производные нитрозомочевины, такие как кармустин; и триазены, такие как дакарбазин. Циклофосфамид, моногидрат 2-[бис-(2-хлорэтил)амино]тетрагидро-2 Н-1,3,2-оксазафосфорин-2 оксида, коммерчески доступен в виде инъецируемого раствора или таблетки как цитоксан. Циклофосфамид показан в качестве единственного средства или в комбинации с другими химиотерапевтическими средствами для лечения злокачественных лимфом, множественной миеломы и лейкозов. Наиболее частыми ограничивающими дозу побочными эффектами циклофосфамида являются алопеция, тошнота,рвота и лейкопения. Мелфалан, 4-[бис-(2-хлорэтил)амино]-L-фенилаланин, коммерчески доступен в виде инъецируемого раствора или таблетки как алкеран. Мелфалан предназначен для паллиативного лечения множественной миеломы и неоперабельных эпителиальных карцином яичника. Наиболее частым ограничивающим дозу побочным эффектом мелфалана является супрессия костного мозга. Хлорамбуцил, 4-[бис-(2-хлорэтил)амино]бензолбутановая кислота, коммерчески доступен в виде таблеток леикерана. Хлорамбуцил предназначен для паллиативного лечения хронического лимфатического лейкоза и злокачественных лимфом, таких как лимфосаркома, макрофолликулярная лимфома и болезнь Ходжкина. Наиболее частым ограничивающим дозу побочным эффектом хлорамбуцила является супрессия костного мозга. Бусульфан, 1,4-бутандиолдиметансульфонат, коммерчески доступен в виде таблеток милерана. Бусульфан предназначен для паллиативного лечения хронического миелогенного лейкоза. Наиболее частым ограничивающим дозу побочным эффектом бусульфана является супрессия костного мозга. Кармустин, 1,3-[бис-(2-хлорэтил)-1-нитрозомочевина, коммерчески доступен в виде отдельных ампул лиофилизированного вещества как БиКНУ. Кармустин предназначен для паллиативного лечения опухолей головного мозга, множественной миеломы, болезни Ходжкина и неходжкинских лимфом в виде единственного средства или в комбинации с другими средствами. Наиболее частым ограничивающим дозу побочным эффектом кармустина является пролонгированная миелосупрессия. Дакарбазин, 5-(3,3-диметил-1-триазено)имидазол-4-карбоксамид, коммерчески доступен в виде отдельных ампул вещества как DTIC-Dome. Дакарбазин предназначен для лечения метастазирующей злокачественной меланомы и в комбинации с другими средствами для лечения второй линии болезни Ходжкина. Наиболее частыми ограничивающими дозу побочными эффектами дакарбазина являются тошнота,рвота и анорексия. Антибиотические антинеопластические средства представляют собой нефазоспецифические средства, которые связываются с ДНК или включаются в ДНК. Как правило, такое действие приводит к стабильным комплексам или разрыву цепей ДНК, что нарушает нормальное функционирование нуклеиновых кислот, приводя к гибели клеток. Примеры антибиотических противоопухолевых средств включают в качестве неограничивающих примеров актиномицины, такие как дактиномицин, антрациклины, такие как даунорубицин и доксорубицин; и блеомицины. Дактиномицин, также известный как актиномицин D, коммерчески доступен в инъецируемой форме как космеген. Дактиномицин предназначен для лечения опухоли Вильма и рабдомиосаркомы. Наиболее частыми ограничивающими дозу побочными эффектами дактиномицина являются тошнота, рвота и анорексия. Даунорубицин, гидрохлорид (8S-цис-)-8-ацетил-10-[(3-амино-2,3,6-тридезоксиL-ликсогексопиранозил)окси]-7,8,9,10-тетрагидро-6,8,11-тригидрокси-1-метокси-5,12-нафтациндиона, коммерчески доступен в виде липосомальной инъецируемой формы как дауноксом или в виде инъецируемого препарата как церубидин. Даунорубицин предназначен для индукции ремиссии для лечения острого нелимфоцитарного лейкоза и ассоциированной с ВИЧ саркомы Капоши на поздних стадиях. Наиболее частым ограничивающим дозу побочным эффектом даунорубицина является миелосупрессия. Доксорубицин, гидрохлорид (8S,10S)-10-[(3-амино-2,3,6-тридезоксиL-ликсогексопиранозил)окси]-8-гликоля, 7,8,9,10-тетрагидро-6,8,11-тригидрокси-1-метокси-5,12-нафтациндиона, коммерчески доступен в качестве инъецируемой формы как рубекс или адриамицин RDF. Доксорубицин прежде всего предназначен для лечения острого лимфобластного лейкоза и острого миелобластного лейкоза, но также является подходящим компонентом для лечения некоторых солидных опухолей и лимфом. Наиболее частым ограничивающим дозу побочным эффектом доксорубицина является миелосупрессия. Блеомицин, смесь цитотоксических гликопептидных антибиотиков, выделенных из штамма Streptomyces verticillus, коммерчески доступен как бленоксан. Блеомицин показан в качестве паллиативного лечения, в виде единственного средства или в комбинации с другими средствами, плоскоклеточной карциномы, лимфомы и карциномы яичка. Наиболее частыми ограничивающими дозу побочными эффектами блеомицина являются легочная и кожная токсичность. Ингибиторы топоизомеразы II включают в качестве неограничивающих примеров эпиподофиллотоксины. Эпиподофиллотоксины представляют собой фазоспецифические противоопухолевые средства, получаемые из растения мандрагоры. Эпиподофиллотоксины, как правило, действуют на клетки в фазах S и G2 клеточного цикла, формируя тройной комплекс с топоизомеразой II и ДНК, вызывая разрывы цепей ДНК. Разрывы цепей накапливаются и следом наступает гибель клеток. Примеры эпиподофиллотоксинов включают в качестве неограничивающих примеров этопозид и тенипозид. Этопозид, 4'-деметилэпиподофиллотоксин-9-[4,6-0-(R)-этилиденD-глюкопиранозид], коммерчески доступен в виде инъецируемого раствора или капсулы как вепезид и общеизвестен как VP-16. Этопозид показан в качестве единственного средства или в комбинации с другими химиотерапевтическими средствами для лечения рака яичек и немелкоклеточного рака легких. Наиболее частым побочным эффектом этопозида является миелосупрессия. Влияние лейкопении обычно бывает более тяжелым, чем тромбоцитопении. Тенипозид, 4'-деметилэпиподофиллотоксин-9-[4,6-0-(R)-тенилиденD-глюкопиранозид], коммерчески доступен в виде инъецируемого раствора как ВУМОН и общеизвестен как VM-26. Тенипозид показан в качестве единственного средства или в комбинации с другими химиотерапевтическими средствами для лечения острого лейкоза у детей. Наиболее частым ограничивающим дозу побочным эффектом тенипозида является миелосупрессия. Тенипозид может индуцировать и лейкопению, и тромбоцитопению. Антиметаболические антинеопластические средства представляют собой фазоспецифические противоопухолевые средства, действующие в S-фазе (синтеза ДНК) клеточного цикла, ингибируя синтез ДНК или ингибируя синтез пуриновых или пиримидиновых оснований и, таким образом, ограничивая синтез ДНК. Таким образом, S-фаза не проходит и происходит гибель клеток. Примеры антиметаболических противоопухолевых средств включают в качестве неограничивающих примеров фторурацил, метотрексат, цитарабин, меркаптопурин, тиогуанин и гемцитабин. 5-Фторурацил, 5-фтор-2,4-(1 Н,3 Н)-пиримидиндион, коммерчески доступен как фторурацил. Введение 5-фторурацила приводит к ингибированию синтеза тимидилата, а также он встраивается в РНК и ДНК. Как правило, результатом является гибель клеток. 5-Фторурацил показан в качестве единственного средства или в комбинации с другими химиотерапевтическими средствами для лечения карциномы молочной железы, толстой кишки, прямой кишки, желудка и поджелудочной железы. Ограничивающими дозу побочными эффектами 5-фторурацила являются миелосупрессия и мукозит. Другие аналоги фторпиримидинов включают 5-фтордезоксиуридин (флоксуридин) и монофосфат 5-фтордезоксиуридина. Цитарабин, 4-амино-1D-арабинофуранозил-2-(1 Н)-пиримидинон, коммерчески доступен как цитозар-U и общеизвестен как Ara-С. Полагают, что цитарабин фазоспецифически действует на клетки вS-фазе, ингибируя удлинение цепи ДНК посредством концевого включения цитарабина в растущую цепь ДНК. Цитарабин показан в качестве единственного средства или в комбинации с другими химиотерапевтическими средствами для лечения острого лейкоза. Другие аналоги цитидина включают 5-азацитидин и 2',2'-дифтордезоксицитидин (гемцитабин). Цитарабин индуцирует лейкопению, тромбоцитопению и мукозит. Меркаптопурин, моногидрат 1,7-дигидро-6 Н-пурин-6-тиона, коммерчески доступен как пуринетол. Меркаптопурин фазоспецифически действует на клетки в S-фазе, ингибируя синтез ДНК посредством еще не установленного механизма. Меркаптопурин показан в качестве единственного средства или в комбинации с другими химиотерапевтическими средствами для лечения острого лейкоза. Полагают, что побочными эффектами меркаптопурина в высоких дозах являются миелосупрессия и мукозит желудочно-кишечного тракта. Подходящим аналогом меркаптопурина является азатиоприн. Тиогуанин, 2-амино-1,7-дигидро-6 Н-пурин-6-тион, коммерчески доступен как таблоид. Тиогуанин фазоспецифически действует на клетки в S-фазе, ингибируя синтез ДНК посредством еще не установленного механизма. Тиогуанин показан в качестве единственного средства или в комбинации с другими химиотерапевтическими средствами для лечения острого лейкоза. Наиболее частым ограничивающим дозу побочным эффектом введения тиогуанина является миелосупрессия, включающая лейкопению, тромбоцитопению и анемию. Однако возникают и могут ограничивать дозу желудочно-кишечные побочные эффекты. Другие аналоги пуринов включают пентостатин, эритрогидроксинониладенин, фосфат флударабина и кладрибин. Гемцитабин, моногидрохлорид 2'-дезокси-2',2'-дифторцитидина (-изомер), коммерчески доступен как гемзар. Гемцитабин фазоспецифически действует на клетки в S-фазе и блокирует продвижение клеток через границу G1/S. Гемцитабин показан в комбинации с цисплатином для лечения локального распространенного немелкоклеточного рака легких и в виде самостоятельного средства для лечения локально распространенного рака поджелудочной железы. Наиболее частым ограничивающим дозу побочным эффектом введения гемцитабина является миелосупрессия, включающая лейкопению, тромбоцитопению и анемию. Метотрексат, N-[4-(2,4-диамино-6-птеридинил)метил]метиламино]бензоил]-L-глутаминовая кислота, коммерчески доступен как метотрексат натрия. Метотрексат фазоспецифически действует на клетки в S-фазе, ингибируя синтез, репарацию и/или репликацию ДНК посредством ингибирования дигидрофолатредуктазы, необходимой для синтеза пуриновых нуклеотидов и тимидилата. Метотрексат показан в качестве единственного средства или в комбинации с другими химиотерапевтическими средствами для лечения хориокарциномы, менингеального лейкоза, неходжкинской лимфомы и карцином молочной же-9 021927 лезы, головы, шеи, яичника и мочевого пузыря. Полагают, что побочными эффектами введения метотрексата являются миелосупрессия (лейкопения, тромбоцитопения и анемия) и мукозит. В качестве ингибиторов топоизомеразы I доступны или находятся в разработке камптотецины,включая, камптотецин и производные камптотецина. Полагают, что цитотоксическая активность камптотецинов связана с их ингибирующим действием на топоизомеразу I. Примеры камптотецинов включают в качестве неограничивающих примеров иринотекан, топотекан и различные оптические формы 7-(4 метилпиперазинометилен)-10,11-этилендиокси-20-камптотецина, описанные ниже. Иринотекан HCl, гидрохлорид (4S)-4,11-диэтил-4-гидрокси-9-[(4-пиперидинопиперидино)карбонилокси]-1H-пирано[3',4',6,7]индолизино[1,2-b]хинолин-3,14(4 Н,12 Н)-диона, коммерчески доступен в качестве инъецируемого раствора камптосара. Иринотекан представляет собой производное камптотецина, связывающееся вместе с его активным метаболитом SN-38 с комплексом топоизомераза I-ДНК. Полагают, что цитотоксичность возникает в результате необратимых двойных разрывов цепей, вызываемых взаимодействием тройного комплекса топоизомераза I:ДНК:иринотекан или SN-38 с ферментами репликации. Иринотекан предназначен для лечения метастазирующей злокачественной опухоли толстой или прямой кишки. Ограничивающими дозу побочными эффектами иринотекана HCl являются миелосупрессия, включающая нейтропению, и действие на ЖКТ, включающее диарею. Топотекан HCl, моногидрохлорид (S)-10-[(диметиламино)метил]-4-этил-4,9-дигидрокси-1Hпирано[3',4',6,7]индолизино[1,2-b]хинолин-3,14-(4 Н,12 Н)-диона, коммерчески доступен в качестве инъецируемого раствора гикамтина. Топотекан представляет собой производное камптотецина, связывающееся с комплексом топоизомераза I-ДНК и предотвращающая обратное лигирование одиночных разрывов цепей, вызываемых топоизомеразой I в ответ на деформацию скручивания молекулы ДНК. Топотекан предназначен для лечения второй линии метастазирующих карциномы яичника и мелкоклеточного рака легких. Ограничивающим дозу побочным эффектом топотекана HCl является миелосупрессия, преимущественно нейтропения. Приведенные ниже схемы иллюстрируют то, как можно получать соединения по настоящему изобретению. Указанные конкретные растворители и условия реакций также приведены в качестве иллюстрации и не предназначены для ограничения. Схемы. Заявленное соединение можно получать способами, приведенными в схеме 1 ниже. Соединения формулы (II) и (III) являются коммерчески доступными или их можно синтезировать с применением общепринятых в данной области способов. Группа L в соединении (III) представляет собой уходящую группу, такую как F или Cl. Соединения формулы (II) и (III) можно подвергать реакции при кипячении с обратным холодильником или в условиях микроволновой печи с получением промежуточного соединения (IV). Реакцию присоединения, как правило, проводят с применением полярных протонных растворителей, таких как н-бутанол или изопропанол. Альтернативно можно использовать условия реакций связывания, катализируемых металлами. Когда соединение (II) включает функциональную группу, нуждающуюся в защите, например гидроксильную группу или аминогруппу, предпочтительно используют соответствующую защитную группу. Затем соединения формулы (IV) можно подвергать реакции с аминопиразолом (V), который является коммерчески доступным или который можно синтезировать с применением общепринятых в данной области способов, с получением заявленного соединения. Как правило, реакцию проводят в присутствии металлического катализатора, такого как соль палладия, а также с соответствующим фосфиновым лигандом. Альтернативно реакцию можно проводить с каталитическим количеством кислоты, такой как соляная или трифторуксусная кислота, и в подходящем растворителе, таком как вода, 1,4-диоксан, или изопропанол, или их сочетании; реакцию преимущественно проводят при повышенной температуре, например, в условиях кипячения с обратным холодильником или с применением микроволнового устройства. Как правило, кислотный катализатор относительно заявленного соединения присутствует в количестве 10-30 мол.%. Схема 1 Соединения формулы (VIII) можно удобно получать способами, приведенными на схеме 1, но начиная с соответствующего антраниламида (VI), как приведено на схеме 2. Соединение (VI) может содержать дополнительные заместители. Например, как показано на схеме 3, у бензоксазина (IX), который является или коммерчески доступным, или синтезируемым с использованием общепринятых в данной области способов, можно произвести размыкание цикла посредством амина с образованием бензамида (X), к которому затем можно добавлять соединение (III) с выходом соединения формулы (XI). Схема 3 Соединение формулы (XII) можно получать посредством реакции соединения формулы (II) с соединением формулы (XIII). Эту реакцию можно проводить, как описано на схеме 1. Затем соединения формулы (XII) можно подвергать реакции с соединением формулы (XIV) с получением заявленного соединения. Реакцию можно проводить в инертном растворителе в присутствии металлического катализатора и соответствующего лиганда. Схема 4 Определенное заявленное соединение также можно получать, как приведено на схеме 5. Сначала аминогруппу соединения формулы (XV) можно подвергать реакции с дикетеном с последующим ацилированием и обработкой гидразином. Затем посредством обработки кислотой можно получать соединение формулы (XVI), затем проводить реакцию с соединением формулы (II) с получением заявленного соединения. Эту последнюю реакцию можно проводить, как описано на схеме 1. Схема 5 Соединения формулы (V) можно получать посредством конденсации замещенного гидразина(XVIII) с соответствующим цианокетоном (XVII), например, в соответствии со способами Honma, Т. etal. J. Med. Chem. 2002, vol. 44 (26), 4628-4640 или Adachi, I. et al. ChemicalPharmaceutical Bulletin 1987,35(8), 3235-52, как приведено на схеме 6. Соединение формулы (XXI) также можно получать, как приведено на схеме 7. Нитрил формулы(XIV) можно гидролизовать до карбоновой кислоты формулы (XX), а затем связывать с амином с получением соединений формулы (XXI). Схема 7 Экспериментальная часть Биохимический анализ активности FAK. Анализ 1. Меченную GST (меченную глутатион-S-трансферазой) FAK приобретали в Invitrogen(PV3832) (www.invitrogen.com). Активность FAK измеряли посредством мониторинга фосфорилирования пептидного субстрата (Ac-RRRRRRSETDDYAEIID-NH2; (SEQ ID NO: 1), т.е. Ac-Arg-Arg-Arg-ArgArg-Ser-Glu-Thr-Asp-Asp-Tyr-Ala-Glu-Ile-Ile-Asp-NH2) в присутствии радиоактивно меченной АТФ. Для измерения активности ингибиторов FAK сначала получали соединения в виде 10 исходного раствора в 10% DMSO. Небольшую часть каждого раствора (4 мкл) добавляли в 96-луночный планшет (Corning,3884). Получали 6 нМ раствор GST-FAK в 1,1 буфере для реакции, содержащем 44 мМ HEPES, рН 7,2,11 мМ MgCl2, 2,2 мМ MnCl2, 1,1 мМ DTT и 0,011% Tween-20. Затем 20 мкл 6 нМ раствора GST-FAK предварительно инкубировали с соединением в течение 30 мин при комнатной температуре. Реакцию инициировали добавлением 16 мкл субстратов (62,5 мкМ пептид, 5 мкМ АТФ и 0,02 мКи/мл 33 Р-АТФ), полученных в указанном выше буфере для реакции. Реакции перед гашением 40 мкл 1% H3PO4 позволяли протекать в течение 90 мин. Часть реакционной смеси (60 мкл) переносили в фосфоцеллюлозный планшет для фильтрования (Millipore; www.millipore.com, MAPHNOB50) и инкубировали в течение 20 мин. Планшет отфильтровывали, три раза промывали с использованием 150 мкл 0,5% H3PO4 и сушили при 50 С в течение 30 мин. После добавления в планшет 60 мкл Microscint-20 измеряли радиоактивность с использованием TopCount (PerkinElmer; www.PerkinElmer.com). Анализ 2. В лаборатории получали Flag-His-TEV-FAK1. Полноразмерную FAK человека с использованием бакуловируса экспрессировали с N-концевыми метками FLAG-6 His с последующим участком расщепления TEV (FLAG-6 His-TEV-huFAK) в клетках Sf9. Активность FAK измеряли посредством мониторинга фосфорилирования субстрата LANCE Ultra NH2-(ULight)-CSETDDYAEIID-COOH (SEQ IDNO: 2) (С = цистеин, S = серин, Е = глутаминовая кислота, Т = треонин, D = аспарагиновая кислота, Y = тирозин, А = аланин, I = изолейцин) (приобретенного в Perkin Elmer Life Sciences). Для измерения активности ингибиторов FAK сначала получали 100 исходные растворы соединений в 100% DMSO. Небольшую часть раствора каждого соединения (50 нл) добавляли в чистый 384-луночный планшет для микротитрования малого объема (Greiner 784076). Получали 1,2 нМ раствор Flag-His-TEV-FAK1 в 1 буфере для реакции, содержащем 40 мМ Tris/Tris-HCL, 10 мМ MgCl2, 1 мМ CHAPS при рН 7,5 с добавлением 1 мМ DTT. 2,5 мкл 1,2 нМ раствора Flag-FAK добавляли в планшеты и предварительно инкубировали с соединениями в течение 30 мин при комнатной температуре. Затем в планшет для инициации реакции добавляли 2,5 мкл раствора субстрата (0,1 мкМ специфичного для пептида FAK P2 субстрата (Lance Ultra NH2-(ULight)-CSETDDYAEIID-COOH (SEQ ID NO: 2) из Perkin Elmer), 10 мкМ АТФ и 1 буфер для реакции, описанный выше). После инкубации в течение 120 мин при комнатной температуре реакцию гасили добавлением 5 мкл 20 мМ ЭДТА и 5 нМ антитела Eu-Anti-pTyr в 1 буфере для детекции LANCE. После инкубации в течение 30 мин при комнатной температуре планшет сканировали в устройстве PerkinElmer Viewlux с фильтром возбуждения 320-340 нм и измеряли испускание при 615 и 665 нм. Для нормализации данных использовали соотношение 665 нм/615 нм. В приведенной ниже табл. А предоставлены конкретные данные для заявленного соединения из примера ниже, которое анализировали в одном или обоих из приведенных выше анализах. Эти данные в указанном анализе получали по меньшей мере за один проход; в повторных анализах могли получать или могут получать данные, которые до некоторой степени варьируют относительно этих данных. Таблица А Химические примеры. Приведенные ниже химические примеры приведены только с иллюстративными целями и не предназначены для ограничения объема настоящего изобретения. Соединения названы с использованием программного обеспечения ACD Name (Advanced Chemistry Development, www.acdlabs.com). Все соединения для описанного выше биохимического анализа обладают pIC50 большей 6,5. Масс-спектрометр с одним квадруполем РЕ Sciex API 150 (РЕ Sciex, Thornhill, Ontario, Canada) действовал с использованием ионизации распылением в электрическом поле в режиме детекции положительных ионов. Распыляемый газ получали из генератора чистого воздуха (Balston Inc., Haverhill, MA;www.parker.com) и выпускали при 45699,5227 кг/м 2, а заградительным газом являлся высокочистый азот,подаваемый из сосуда Дьюара с жидким азотом при 35153,479 кг/м 2. Прилагаемое напряжение к игле для электрораспыления составляло 4,8 кВ. Выходное отверстие устанавливали на 25 В и сканирование массспектрометра проводили при скорости 0,5 скан/с с использованием шага массы 0,2 а.е.м., собирая данные профиля. Способ A, LCMS. Образцы вводили в масс-спектрометр с использованием автодозатора СТС PAL(LEAP Technologies, Carrboro, NC), оборудованного 10 мкл впрыскивателем Hamilton, проводящего инъекцию в 10-портовый инжекторный клапан Valco. Насос ВЭЖХ представлял собой Shimadzu LC-10ADvp (Shimadzu Scientific Instruments, Columbia,MD), функционирующий при 0,3 мл/мин и линейном градиенте от 4,5% А до 90% В в течение 3,2 мин с удержанием 0,4 мин. Подвижная фаза состояла из 100% (H2O 0,02% TFA) в сосуде А и 100% (CH3CN 0,018% TFA) в сосуде В. Неподвижная фаза представляет собой Aquasil (C18), а размеры колонки представляют собой 140 мм. Детекцию проводили посредством УФ-излучения при 214 нм, испарительного светорассеяния (ELSD) и MS. Способ В, LCMS. Альтернативно использовали аналитическую систему ВЭЖХ Agilent 1100 сLC/MS и ее эксплуатировали при 1 мл/мин и линейном градиенте от 5% А до 100% В в течение 2,2 мин с удержанием 0,4 мин. Подвижная фаза состояла из 100% (H2O 0,02% TFA) в сосуде А и 100% (CH3CN 0,018% TFA) в сосуде В. Неподвижная фаза представляла собой Zobax (C8) с размером частиц 3,5 мкм, а размеры колонки составляли 2,150 мм. Детекцию проводили посредством УФ-излучения при 214 нм,испарительного светорассеяния (ELSD) и MS. Способ В, LCMS. Альтернативно использовали MDSSCIEX API 2000, оборудованное капиллярной колонкой (504,6 мм, 5 мкм). ВЭЖХ проводили на системе СЭЖХ серии Agilent-1200, оборудованной колонкой Zorbax SB-C18 (504,6 мм, 1,8 мкм), проводя элюцию буфером CH3CN:аммоний ацетат. Реакции проводили в микроволновой печи (СЕМ, Discover). Спектры 1 Н-ЯМР (далее в настоящем документе ЯМР) получали при 400 МГц с применением устройства Bruker AVANCE 400 MHz с применением ACD Spect manager версии 10 для обработки. Указанные мультиплетности представляют собой s = синглет, d = дублет, t = триплет, q = квартет, m = мультиплет, dd = двойной дублет, dt = двойной триплет и т.д., а br означает широкий сигнал. Аналитическая ВЭЖХ: продукты анализировали посредством системы для аналитической хроматографии Agilent 1100 с колонкой Zorbax XDB-C18 4,575 мм (3,5 мкм) при 2 мл/мин с 4 мин градиентом от 5% CH3CN (0,1% муравьиная кислота) до 95% CH3CN (0,1% муравьиная кислота) в H2O (0,1% муравьиная кислота) и с удержанием 1 мин. Препаративная ВЭЖХ: продукты очищали с применением системы для препаративной хроматографии Gilson с колонкой I. D. YMC CombiPrep ODS-A column 7530 мм (5 мкм) (www.waters.com) при 50 мл/мин с 10 мин градиентом от 5% CH3CN (0,1% муравьиная кислота) до 95% CH3CN (0,1% муравьиная кислота) в H2O (0,1% муравьиная кислота) и удержанием 2 мин; альтернативно продукты очищали с применением системы для препаративной хроматографии Agilent 1100 с колонкой Gemini C18 10030 мм(5 мкм) при 60 мл/мин с 10 мин градиентом от 5% CH3CN (0,1% муравьиная кислота) до 95% CH3CN(0,1% муравьиная кислота) в H2O (0,1% муравьиная кислота) и удержанием 2 мин. Препаративную хроматографию с нормальными фазами проводили с применением системыAnalogix IntelliFlash 280 с колонками SuperFlash Sepra Si 50. Альтернативно ВЭЖХ с обращенной фазой проводили на Agilent с использованием колонки Zorbax SB - С 18 (21,2250 мм, 7 мкм), проводя элюцию В микроволновую пробирку помещали 2-[(2,5-дихлор-4-пиридинил)амино]-N-(метилокси)бензамид(230 мг, 0,706 ммоль). Реакционную смесь дегазировали азотом в течение 10 мин. В это же время добавляли BINAP (50 мг, 0,080 ммоль) и ацетат палладия(II) (10 мг, 0,045 ммоль). Реакционную смесь нагревали в микроволновой печи при 160 С в течение 40 мин. Неочищенное вещество очищали посредством ВЭЖХ с обращенной фазой (Gilson) с элюцией CH3CN/H2O с 0,1% муравьиной кислотой, что давало указанное в заголовке соединение (15 мг, 15%); MS: M (C20H23ClN6O2)=414,89, (М+Н)+=415, 416; 1 Н ЯМР Раствор 2,5-дихлор-4-йодопиридина (100 г, 365 ммоль), 2-аминобензонитрила (43,1 г, 365 ммоль) и трифосфата калия (233 г, 1095 ммоль) в 1,4-диоксане (2,5 л) дегазировали потоком N2. К этому раствору добавляли DPEPhos (15,73 г, 29,2 ммоль) и ацетат палладия (3,28 г, 14,60 ммоль). Реакционную смесь перемешивали при кипячении с обратным холодильником в течение 18 ч. Раствор фильтровали через 1,27 см целита и 5,08 мм силикагеля. Раствор выпаривали. Твердое вещество суспендировали в простом диэтиловом эфире и фильтровали. Простой диэтиловый эфир концентрировали и полученное твердое вещество фильтровали. Выделяли 2-[(2,5-дихлор-4-пиридинил)амино]бензонитрил (80 г, 288 ммоль, 79% выход) в виде оранжевого твердого вещества. 1 Н ЯМР (400 МГц, ДМСО-d6)м.д. 6,49 (с, 1 Н), 7,50 (тд,J=7,58, 1,01 Гц, 1 Н), 7,56 (д, J=7,58 Гц, 1 Н), 7,80 (тд, J=7,83, 1,77 Гц, 1 Н), 7,95 (дд, J=7,83, 1,52 Гц, 1 Н),8,26 (с, 1 Н), 9,05 (уш.с, 1 Н); ВЭЖХ Rt=2,88 мин, MS (ESI): 263,9, 265,9 [М+Н]+. Промежуточное соединение 4. 2-[(5-Хлор-2-[3-метил-1-(1-метилэтил)-1 Н-пиразол-5-ил]амино-4 пиридинил)амино]бензонитрил(2,5 л) дегазировали потоком N2 и добавляли 2,2'-бис-(дифенилфосфино)-1,1'-бинафтил (BINAP) (19,71 г,31,7 ммоль) с последующим ацетатом палладия (3,55 г, 15,83 ммоль). Реакционную смесь нагревали до температуры кипения с обратным холодильником в течение ночи в атмосфере N2. Реакционную смесь фильтровали и жидкость концентрировали. Добавляли этилацетат (1500 мл) с последующим 1 М HCl(1000 мл). Разделяли слои. Этилацетат промывали 1 М HCl до тех пор, пока не переставали наблюдать продукт посредством ВЭЖХ (1000 мл всего, 1). Фазы с HCl объединяли и промывали этилацетатом(31000 мл) до тех пор, пока продукт в слое с HCl не становился относительно чистым. Затем у слоя HCl повышали основность NaOH (50 мас./мас. с последующим 1 М) до рН 4 с получением непрозрачного раствора. Добавляли этилацетат (2000 мл) и разделяли слои. Этилацетат промывали насыщенным солевым раствором и выпаривали. После нейтрализации и добавления этилацетата реакционную смесь фильтровали с получением некоторого количества продукта. Также в течение выпаривания можно проводить выделение продукта посредством фильтрации белого твердого вещества, которое поступает из исходного раствора. Все твердые и выпаренные продукты объединяли. Выделяли 2-[(5-хлор-2-[3-метил-1-(1 метилэтил)-1 Н-пиразол-5-ил]амино-4-пиридинил)амино]бензонитрил (80 г, 207 ммоль, 52,4% выход) в- 14021927 виде желтого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6)м.д. 1,24 (д, J=6,57 Гц, 6 Н), 2,08 (с, 3 Н),4,34 (квинтет, J=6,57 Гц, 1 Н), 5,87 (с, 1 Н), 5,97 (с, 1 Н), 7,41 (тд, J=7,58, 1,01 Гц, 1 Н), 7,47 (д, J=8,08 Гц,1 Н), 7,75 (тд, J=7,83, 1,52 Гц, 1 Н), 7,90 (дд, J=7,83, 1,52 Гц, 1 Н), 7,94 (с, 1 Н), 8,42 (д, J=17,43 Гц, 2 Н); ВЭЖХ Rt=2,36 мин, MS (ESI): [M+H]+=367,l, 368,1. Промежуточное соединение 5. 2-[(5-Хлор-2-[3-метил-1-(1-метилэтил)-1 Н-пиразол-5-ил]амино-4 пиридинил)амино]бензойная кислота(80 г, 218 ммоль) растворяли в 1,4-диоксане (1,5 л) и добавляли 1 М NaOH (1500 мл, 1500 ммоль). Суспензию кипятили с обратным холодильником в течение ночи. После охлаждения до комнатной температуры добавляли этилацетат (1 л) и разделяли слои. Водный слой промывали 1 л этилацетата. Оба органических слоя объединяли и промывали 0,1 М NaOH (1 л) до тех пор, пока в органическом слое не переставали наблюдать продукт. Затем органические слои отбрасывали. Затем объединенные водные слои промывали 1 л этилацетата. Затем водный слой подкисляли уксусной кислотой (очень медленно до рН 7). Твердое вещество фильтровали и выделяли 2-[(5-хлор-2-[3-метил-1-(1-метилэтил)-1 Н-пиразол-5-ил] амино-4-пиридинил)амино]бензойную кислоту (67 г, 165 ммоль, 76% выход) в виде желтого твердого вещества. 1 Н ЯМР (400 МГц, ДМСО-d6)м.д. 1,28 (д, J=6,57 Гц, 6 Н), 2,11 (с, 3 Н), 4,41 (квинтет, J=6,57 Гц, 1 Н), 5,96 (с, 1 Н) , 6,83 (с, 1 Н), 7,09 (ддд, J=8,02, 5,12, 3,03 Гц, 1 Н), 7,40 (1 Н), 7,52-7,61 (м, 2 Н), 7,918,16 (м, 2 Н), 8,55 (с, 1 Н), 10,17 (уш.с, 1 Н), 13,64 (уш.с, 1 Н); ВЭЖХ Rt=2,35 мин, MS (ESI): [M+H]+=386,1. Пример 1b. 2-[(5-Хлор-2-[3-метил-1-(1-метилэтил)-1 Н-пиразол-5-ил]амино-4-пиридинил)амино]N-(метилокси)бензамид(15,95 г, 191 ммоль) и раствор перемешивали в течение дополнительных 15 мин, охлаждали до 0 С и капельно добавляли диизопропилэтиламин (91 мл, 521 ммоль). Реакционную смесь перемешивали в течение ночи при комнатной температуре. Добавляли воду (4000 мл) и раствор подкисляли уксусной кислотой (20 мл). Раствор экстрагировали 22 л этилацетата. Органический слой промывали водой (1 л), насыщенным солевым раствором и сушили над MgSO4, фильтровали и выпаривали. Выделяли 2-[(5-хлор-2[3-метил-1-(1-метилэтил)-1 Н-пиразол-5-ил]амино-4-пиридинил)амино]-N-(метилокси)бензамид (74 г,164 ммоль, 94% выход, 92% чистоты) в виде желтой пены. 1 Н ЯМР (400 МГц, ДМСО-d6)м.д. 1,27 (д,J=6,57 Гц, 6 Н), 2,10 (с, 3 Н), 3,71 (с, 3 Н), 4,39 (квинтет, J=6,51 Гц, 1 Н), 5,93 (с, 1 Н), 6,66 (с, 1 Н), 7,08-7,19(ESI): [M+H]+=415,1. Очистка продуктов примеров 1 а и 1b 2-[(5-Хлор-2-[3-метил-1-(1-метилэтил)-1 Н-пиразол-5-ил]амино-4-пиридинил)амино]-N(метилокси)бензамид (173,3 г, 63,5% мас./мас., 265,2 ммоль) растворяли в этилацетате (3,50 л, 20 об.) и нагревали приблизительно до 50 С. К этому раствору добавляли Si-тиол (функционализированный силикагель) (87 г, 50% загрузка). Смесь выдерживали приблизительно при 50 С в течение 16-20 ч. Затем отфильтровывали силикагель с Si-тиолом. Отфильтрованный осадок промывали этилацетатом (2200 мл) и фильтраты объединяли. Затем объединенные фильтраты промывали 1 М водным формиатом аммония при рН 9,4 (51 л каждый), промывали водой, насыщенным солевым раствором и сушили над сульфатом магния. Высушенный EtOAC фильтровали и выпаривали досуха с получением желтой пены. Ее сушили при 50-55 С приблизительно в течение 2 ч до постоянной массы 160 г. Это вещество суспендировали в метиленхлориде (800 мл, 5 об.), нагревали до температуры кипения с обратным холодильником с получением раствора и фильтровали. Раствор охлаждали до 20-25 С. Продукт кристаллизовали при охлаждении. Приблизительно через 2 ч. продукт собирали посредством фильтрования и промывали метиленхлоридом. Белое твердое вещество сушили при 50-55 С в течение 14-16 ч до постоянной массы. Выделяли 2[(5-хлор-2-[3-метил-1-(1-метилэтил)-1 Н-пиразол-5-ил]амино-4-пиридинил)амино]-N-(метилокси)бензамид (85,0 г, 204,9 ммоль, 77% общий выход) в виде белого твердого вещества. 1 Н ЯМР (400 МГц,ДМСО-d6)м.д. 1,27 (д, J=6,57 Гц, 6 Н), 2,10 (с, 3 Н), 3,70 (с, 3 Н), 4,39 (квинтет, J=6,57 Гц, 1 Н), 5,92 (с,1 Н), 6,66 (с, 1 Н), 7,02-7,24 (м, 1 Н), 7,45-7,68 (м, 3 Н), 7,98 (с, 1 Н), 8,48 (с, 1 Н), 9,49 (уш.с, 1 Н), 11,91 (с,1 Н). С 18 ВЭЖХ Rt=6,2 мин (99,0% чистоты). MS (ESI): 415,0 [М+Н]+. 2-[(5-Хлор-2-[3-метил-1-(1-метилэтил)-1 Н-пиразол-5-ил]амино-4-пиридинил)амино]-N(метилокси)бензамид (235,2 г общей массы, 228,0 г оцениваемого содержания, 549,5 ммоль) суспендировали в этилацетате (7,1 л, 30 об.). Смесь нагревали приблизительно до 50-55 С с получением непрозрачного раствора. Непрозрачный раствор фильтровали. К отфильтрованному раствору добавляли 2,0 М HCl в простом диэтиловом эфире (210 г, 281 мл, 1,02 экв.) в течение 15-20 мин. После добавления HCl наблюдали белую взвесь. Ее перемешивали при комнатной температуре приблизительно в течение 16-20 ч. Продукт собирали посредством фильтрования и промывали этилацетатом (2500 мл каждый). Отфильтрованный осадок сушили при 50-55 С/5 мм рт.ст. в течение 16-20 ч до постоянной массы. Выделяли моногидрохлорид 2-[(5-хлор-2-[3-метил-1-(1-метилэтил)-1 Н-пиразол-5-ил]амино-4-пиридинил)амино]N-(метилокси)бензамида (245,9 г, 544,7 ммоль, 96% выход) в виде белого твердого вещества. 1 Н ЯМР(400 МГц, ДМСО-d6)м.д. 1,32 (д, J=6,57 Гц, 6 Н), 2,18 (с, 3 Н), 3,70 (с, 3 Н), 4,35-4,62 (м, 1 Н), 6,12 (уш.с,1 Н), 6,60 (уш.с, 1 Н), 7,19-7,41 (м, 1 Н), 7,48-7,75 (м, 3 Н), 8,09 (с, 1 Н), 9,59-9,99 (м, 2 Н), 11,98 (уш.с, 1 Н). С 18 ВЭЖХ Rt=6,1 мин (99,6% чистоты). MS (ESI): 414,8 [М+Н]+. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение 2-[(5-хлор-2-[3-метил-1-(1-метилэтил)-1H-пиразол-5-ил]амино-4 пиридинил)амино]-N-(метилокси)бензамид или его фармацевтически приемлемая соль. 2. Соединение по п.1, представляющее собой 2-[(5-хлор-2-[3-метил-1-(1-метилэтил)-1H-пиразол-5 ил]амино-4-пиридинил)амино]-N-(метилокси)бензамид. 3. Фармацевтическая композиция для лечения злокачественной опухоли, содержащая терапевтически эффективное количество соединения по п.1 или 2 и фармацевтически приемлемый эксципиент. 4. Способ получения фармацевтической композиции по п.3, включающий приведение соединения по п.1 в контакт с фармацевтически приемлемым эксципиентом. 5. Применение соединения по п.1 для ингибирования активности FAK у нуждающегося в этом пациента. 6. Применение по п.5, где пациентом является человек. 7. Фармацевтическая композиция по п.3, где композиция находится в форме таблетки. 8. Способ лечения злокачественной опухоли, включающий введение нуждающемуся в этом пациенту фармацевтически эффективного количества соединения по п.1 или 2. 9. Способ по п.8, где указанная злокачественная опухоль выбрана из опухоли кожи, молочной железы, головного мозга, карциномы шейки матки, карциномы семенников, астроцитарной, колоректальной,эндометрия, пищевода, желудка, головы и шеи, гепатоцеллюлярной, ларингеальной, легких, полости рта,яичников, предстательной железы, щитовидной железы, саркомы, лимфомы, мезотелиомы, желудочнокишечного тракта: желудка, поджелудочной железы, тонкого кишечника, толстого кишечника; почек,мочевого пузыря и мочеиспускательного канала, печени, костей, саркомы Юинга, злокачественной лимфомы, множественной миеломы, злокачественной гигантоклеточной хордомы, мультиформной глиобластомы, спинного мозга, матки, шейки матки, плоскоклеточной карциномы и гематологических нарушений. 10. Моногидрохлоридная соль соединения
МПК / Метки
МПК: A61K 31/535
Метки: качестве, фармацевтическая, композиция, 2-[(5-хлор-2-{[3-метил-1-(1-метилэтил)-1н-пиразол-5-ил]амино}-4-пиридинил)амино]-n-(метилокси)бензамид, содержащая, ингибиторов
Код ссылки
<a href="https://eas.patents.su/18-21927-2-5-hlor-2-3-metil-1-1-metiletil-1n-pirazol-5-ilamino-4-piridinilamino-n-metiloksibenzamid-v-kachestve-ingibitorov-fak-i-soderzhashhaya-ego-farmacevticheskaya-kompoziciya.html" rel="bookmark" title="База патентов Евразийского Союза">2-[(5-хлор-2-{[3-метил-1-(1-метилэтил)-1н-пиразол-5-ил]амино}-4-пиридинил)амино]-n-(метилокси)бензамид в качестве ингибиторов fak и содержащая его фармацевтическая композиция</a>
Предыдущий патент: Приводной механизм листогибочного пресса и листогибочный пресс, содержащий его
Следующий патент: Самосвал
Случайный патент: Способ получения производных дезоксирибофуранозы






















