Применение йота-каррагенана в качестве противовирусного ингредиента
Формула / Реферат
1. Применение йота-каррагенана в противовирусно эффективном количестве в качестве противовирусного активного ингредиента при производстве фармацевтической композиции или лекарственного средства для профилактического или терапевтического лечения симптома, состояния или заболевания, вызванного или связанного с инфекцией респираторным вирусом, выбранным из группы, состоящей из парамиксовирусов, вируса гриппа А человека и аденовируса субтипа В.
2. Применение по п.1, где парамиксовирус выбран из группы, состоящей из вируса парагриппа человека (HPV) 1 типа, HPV 2 типа, HPV 3 типа, HPV 4 типа и RSV.
3. Применение по п.1 или 2, где патологическое состояние или заболевание выбрано из группы, состоящей из острого бронхита, хронического бронхита, ринита, синусита, крупа, острого капиллярного бронхита, фарингита, тонзиллита, ларингита, трахеита, астмы и пневмонии, и где симптом выбран из группы, состоящей из лихорадки, боли, головокружения, дрожи, потоотделения и обезвоживания.
4. Применение по любому из пп.1-3, где противовирусная фармацевтическая композиция или лекарственное средство приспособлены для местного кожного применения или местного применения на слизистых.
5. Применение по п.4, где противовирусная фармацевтическая композиция или лекарственное средство изготовлены в виде лосьона для кожи, крема, мази, геля, порошка, включая порошок для ингаляций, спрея, пены, жидких капель или раствора для полоскания рта и горла.
6. Применение по любому из пп.1-3, где противовирусная фармацевтическая композиция или лекарственный препарат приспособлены для перорального введения.
7. Применение по п.6, где противовирусная фармацевтическая композиция или лекарственный препарат изготовлены в виде жидкого раствора или в виде полутвердого или твердого препарата, такого как сухой порошок, таблетки, капсулы или драже.
8. Применение по любому из пп.4-7, где композиция является жидкой или полутвердой и содержит в виде готового препарата йота-каррагенан в количестве 0,01-10 мас.% по отношению к общему количеству препарата.
9. Применение по п.8, где композиция содержит йота-каррагенан в количестве 0,01-5 мас.% по отношению к общему количеству препарата.
10. Применение по п.8, где композиция содержит йота-каррагенан в количестве 0,1-2 мас.% по отношению к общему количеству препарата.
11. Применение по п.6 или 7, где композиция является твердой и содержит в виде готового препарата йота-каррагенан в количестве 0,01-10 мас.%.
12. Применение по п.11, где композиция содержит йота-каррагенан в количестве 0,01-5 мас.%.
13. Применение по п.11, где композиция содержит йота-каррагенан в количестве 0,1-2 мас.%.
14. Применение по п.1, где композиция дополнительно содержит каппа-каррагенан.
15. Применение по п.14, где композиция содержит 50 мас.% или более сухого вещества йота-каррагенана по отношению к общей сухой массе каррагенанов, присутствующих в композиции.
16. Применение по п.15, где композиция содержит 70 мас.% или более сухого вещества йота-каррагенана по отношению к общей сухой массе каррагенанов, присутствующих в композиции.
17. Применение по п.15, где композиция содержит 95 мас.% или более сухого вещества йота-каррагенана по отношению к общей сухой массе каррагенанов, присутствующих в композиции.
18. Применение по любому из пп.1-17, где композиция дополнительно содержит по меньшей мере один фармацевтически приемлемый носитель и/или вспомогательное вещество.
19. Применение по п.18, где фармацевтически приемлемое вспомогательное вещество представляет собой фармацевтически приемлемую соль щелочного металла.
20. Применение по п.19, где фармацевтически приемлемое вспомогательное вещество представляет собой хлорид натрия или калия.
21. Применение по п.19 или 20, где фармацевтически приемлемая соль присутствует в композиции в количестве 1% или менее.
22. Применение по п.21, где фармацевтически приемлемая соль присутствует в композиции в количестве 0,6% или менее.
23. Применение по любому из пп.1-22, где композиция содержит йота-каррагенан частично или полностью в виде его соли.
24. Применение по п.23, где композиция содержит йота-каррагенан частично или полностью в виде его натриевой соли.
25. Применение по любому из пп.1-24, где композиция зафиксирована посредством нанесения покрытия или импрегнирования на твердой поверхности предмета гигиены или санитарии.
26. Применение по п.25, где предмет гигиены или санитарии выбран из группы, состоящей из гигиенической или санитарной перчатки, ткани или бумаги, носового платка или салфетки, ватного аппликатора, пылезащитной маски и санитарной или медицинской маски для лица.
27. Применение по любому из пп.1-24, где композиция входит в состав губной помады.
28. Применение по любому из пп.1-27, где композиция дополнительно содержит некаррагенановое физиологически активное соединение.
29. Применение по п.28, где некаррагенановое физиологически активное соединение выступает в качестве основного активного ингредиента.
30. Применение по любому из пп.1-29, где патологическое состояние или заболевание имеет место у индивидуума, который является пациентом с высоким риском, выбранным из группы, состоящей из COPD-пациента, пациента с астмой, с аллергией, с ослабленной иммунной, сердечной или дыхательной системой и пациента после трансплантации.
Текст
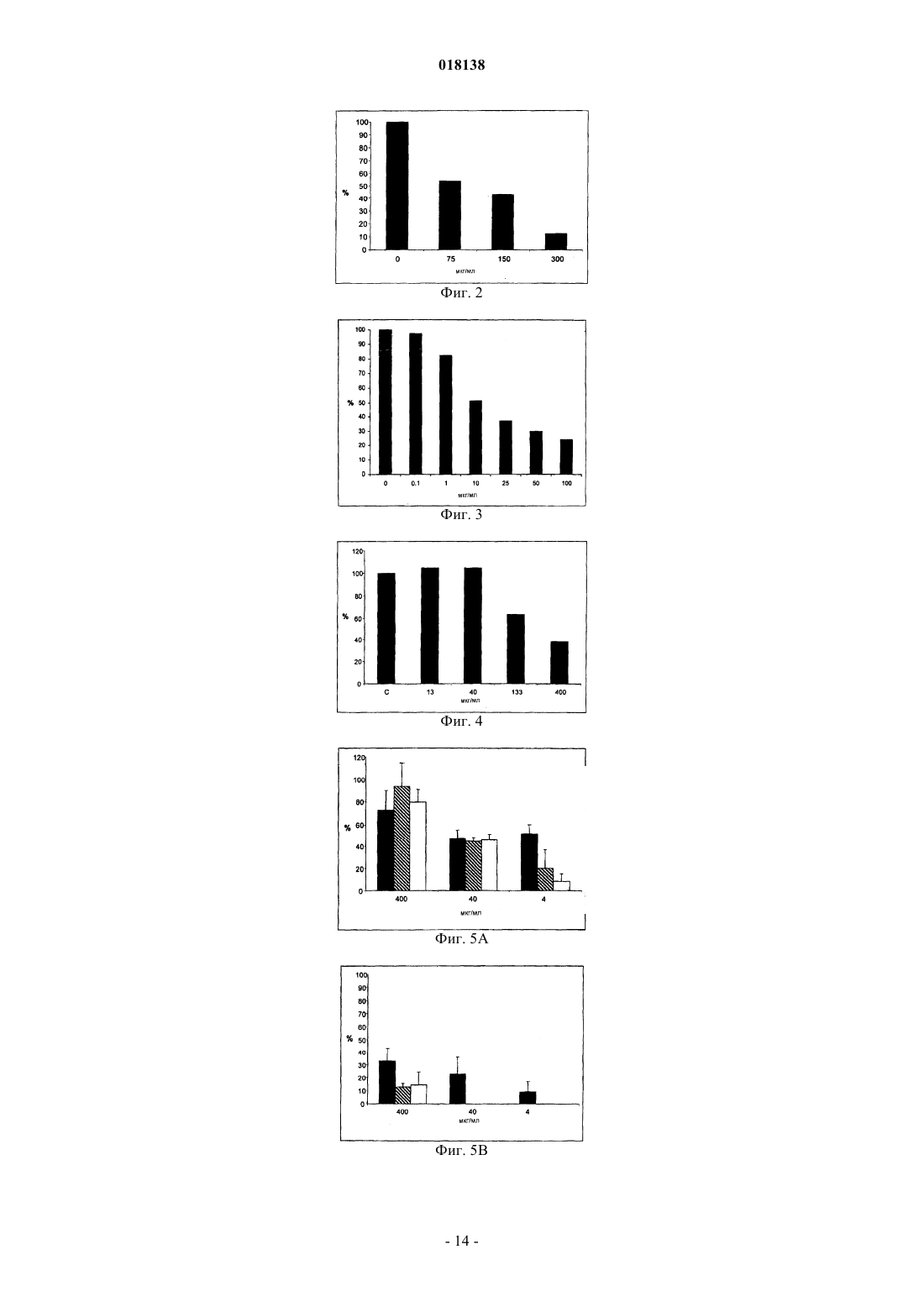
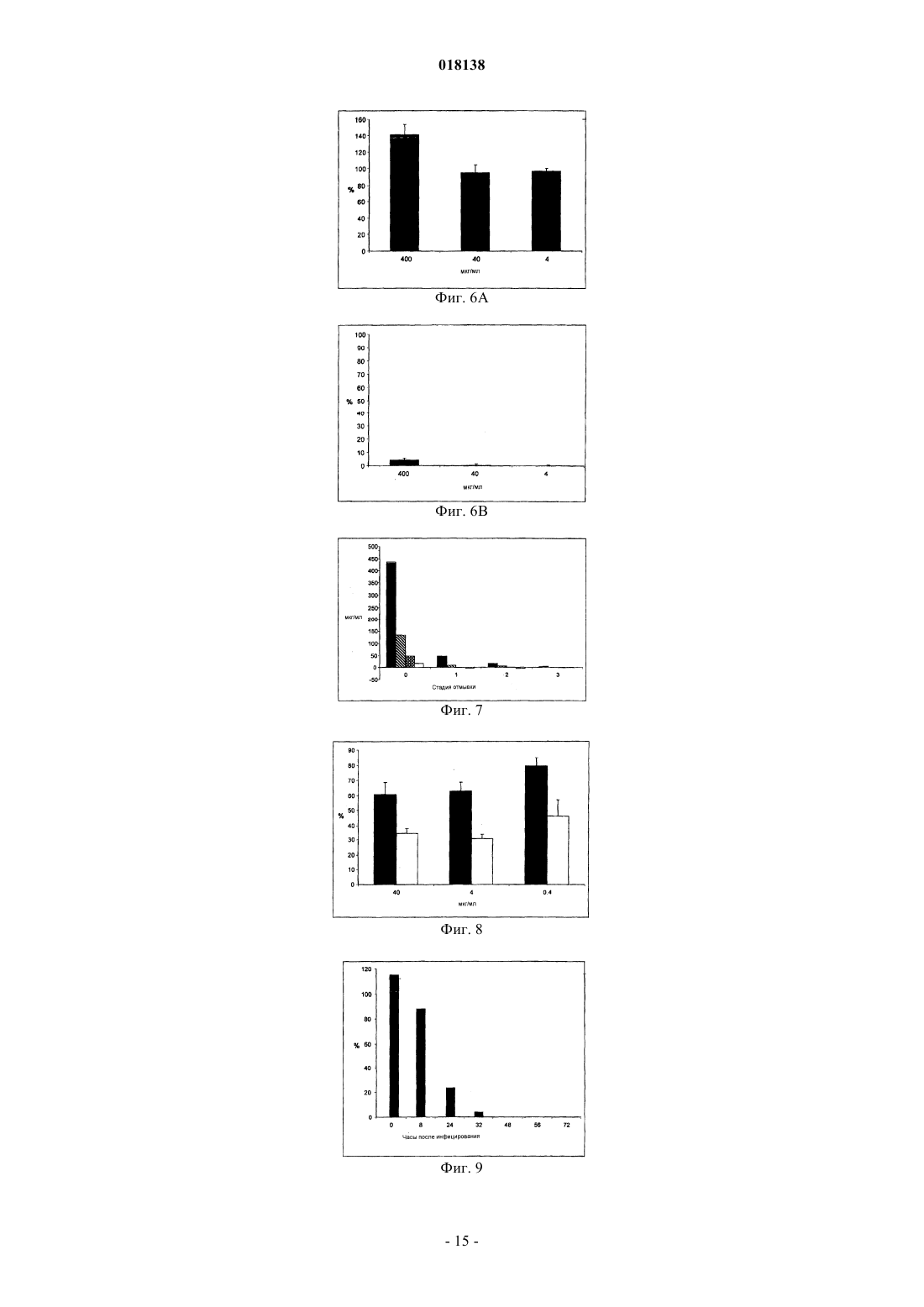
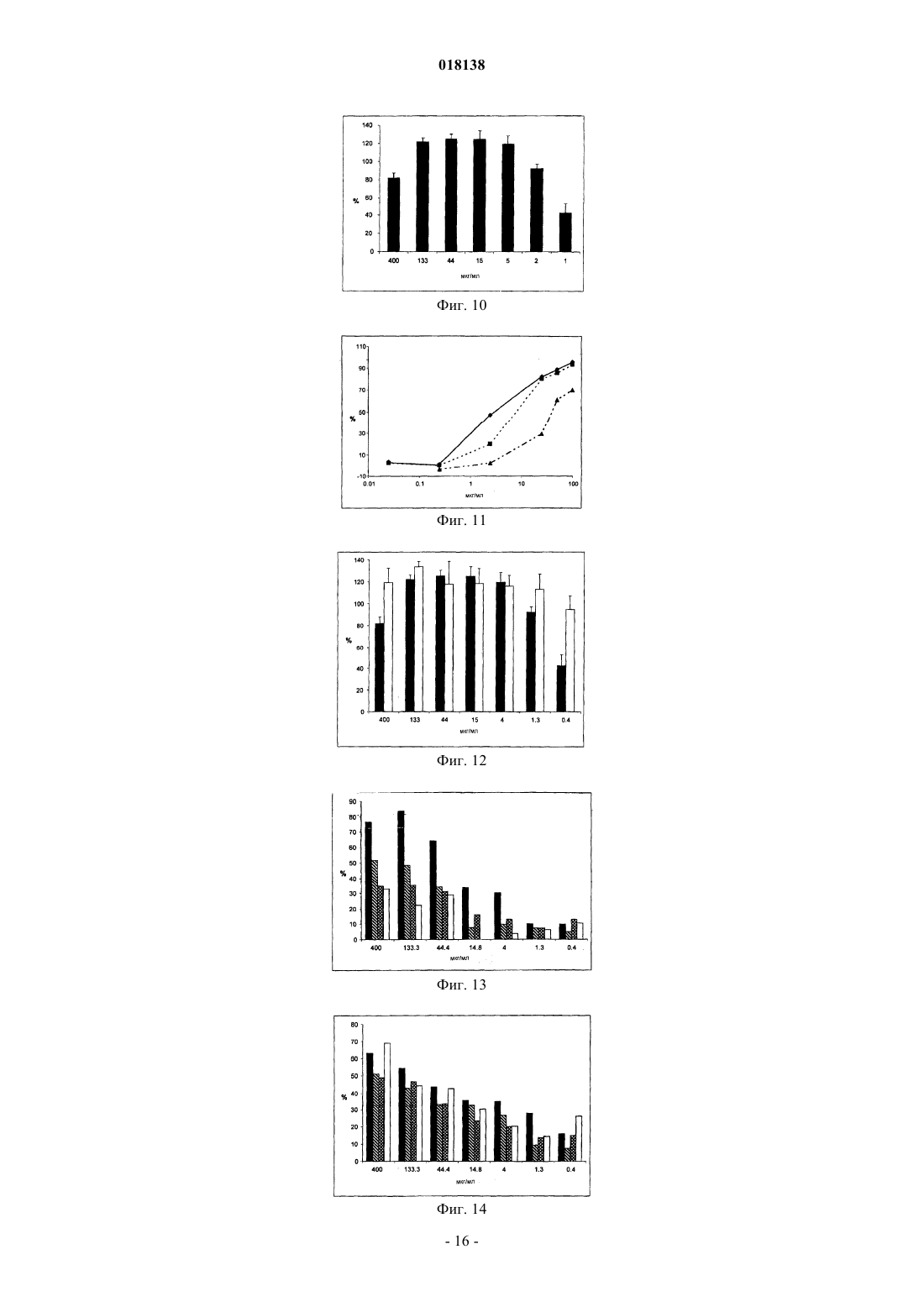
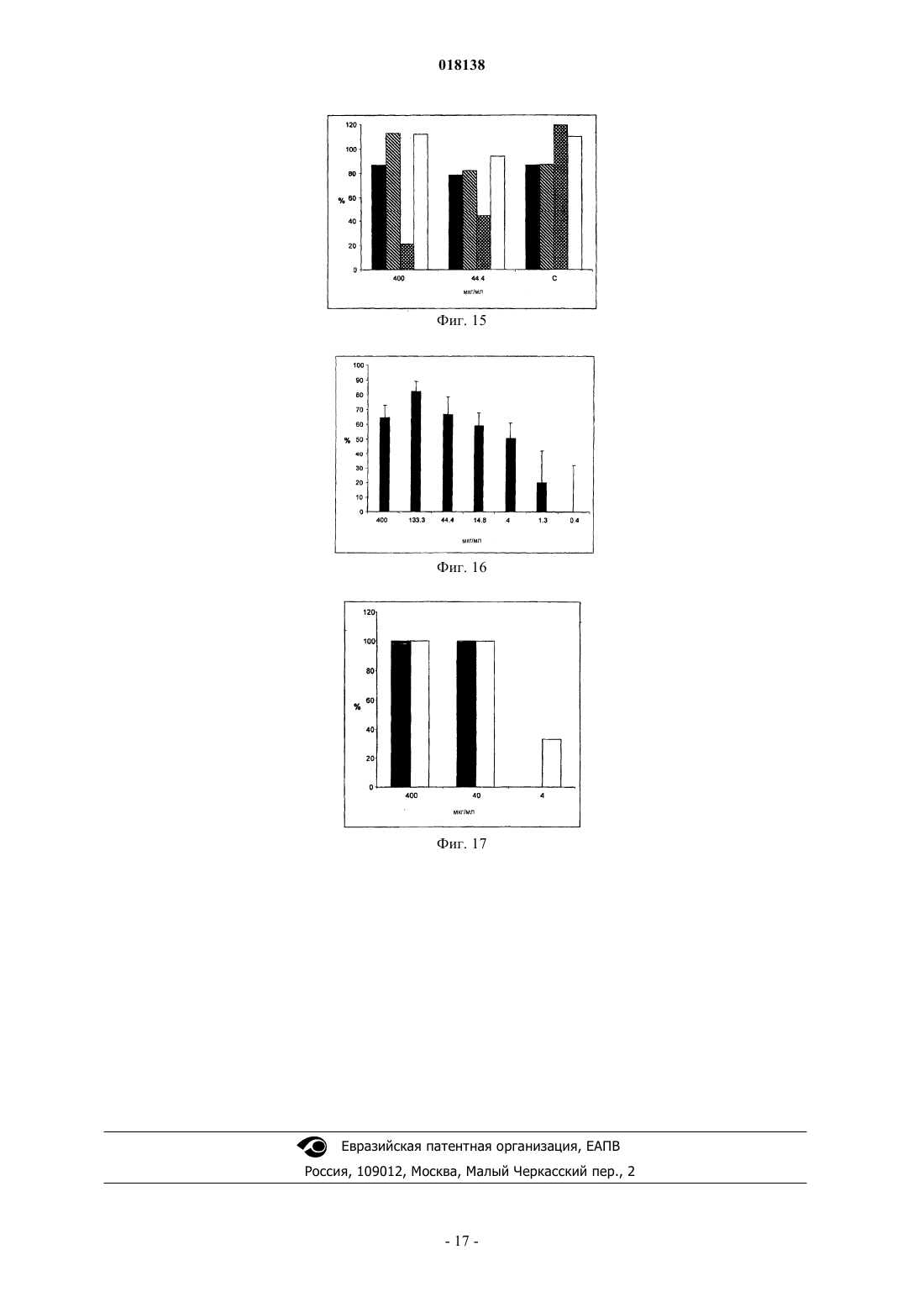
Изобретение относится к применению йота-каррагенана в качестве активного противовирусного ингредиента при производстве противовирусной фармацевтической композиции или лекарственного средства для профилактики или лечения симптома, состояния или заболевания,вызванного или ассоциированного с инфицированием респираторным вирусом, выбранным из группы, состоящей из парамиксовирусов, вируса гриппа А человека и аденовируса субтипа В.(71)(73) Заявитель и патентовладелец: МАРИНОМЕД БИОТЕХНОЛОГИ ГМБХ (AT) Область техники Изобретение относится к сульфатированным полисахаридам, выбранным из группы каррагенанов и фукоиданов и фармацевтическим композициям на их основе, где указанные сульфатированные полисахариды присутствуют в качестве противовирусных активных ингредиентов для медицинского или ветеринарного применения или применения при лечении или профилактике заболеваний, вызванных или связанных с попаданием вируса в организм индивидуума через дыхательные пути, где вирус выбран из группы Orthomyxoviridae, Paramyxoviridae, Adenoviridae и Coronaviridae. Предпосылки изобретенияOrthomyxoviridae представляют собой РНК-вирусы, наиболее выделяющимися членами являются виды вируса гриппа. Вирусы гриппа А и В представляют собой два типа вирусов гриппа, которые вызывают эпидемические заболевания у людей. Типично, они распространяются от человека к человеку, преимущественно респираторно-капельным путем. Семейство Paramyxoviridae включает респираторно-синцитиальный вирус (RSV), вирус парагриппа и вирус метапневмонии. Инфекции RSV и вирусом парагриппа могут приводить к серьезным респираторным инфекциям у грудных детей, детей младшего возраста, но также могут вызывать тяжелые заболевания у пожилых людей и взрослых с ослабленной иммунной системой. Среди вирусов вирус парагриппа человека известны четыре члена, которые вызывают серьезные респираторные заболевания у детей и для которых в настоящее время не доступны эффективная терапия или способы профилактики, эти четыре члена представляют собой с 1 по 4 типы вирусы парагриппа. Считается, что вспышки вируса парагриппа и RSV, по существу, содействуют увеличению уровня смертности и госпитализации. Пациенты с ослабленной иммунной, сердечно-сосудистой или дыхательной системами имеют повышенный риск столкнуться с серьезными осложнениями после инфекции парамиксовирусом и, следовательно, извлекут особенную пользу от противовирусной терапии. Респираторно-синцитиальный вирус (RSV), который является самым широко распространенным респираторным патогеном, типично поражающим детей в грудном возрасте и дошкольном возрасте по всему миру, ежегодно вызывает вспышки пневмонии и бронхита в течение зимнего периода и ранней весны. RSV капиллярный бронхит и пневмония требуют госпитализации сотен тысяч грудных детей каждый год. Пассивная защита от RSV доступна по меньшей мере частично при сообщавшемся уровне успешности 55% при ежемесячном внутримышечном введении гуманизированных моноклональных анти-RSV антител паливизумаб (Синагис). Семейство Coronaviridae включает коронавирусы и торовирусы. Известно, что коронавирусы инфицируют верхние дыхательные пути и желудочно-кишечный тракт млекопитающих и птиц. Полагают, что коронавирусы являются причиной большой процентной доли всех простудных заболеваний у взрослых людей.Adenoviridae представляют собой ДНК-вирусы, которые типично инфицируют верхние дыхательные пути. В настоящее время известно более 50 различных серотипов аденовируса человека, которые разбиты на шесть субтипов от А до F, которые ответственны за 5-10% инфекций верхних дыхательных путей у детей. Принимая во внимание указанное выше, полагают, что существует острая необходимость в мощной противовирусной фармацевтической композиции, которую легко применять и которая эффективна при профилактике и лечении респираторных вирусных инфекций, вызванных членами семейств Paramyxoviridae, Orthomyxoviridae, Coronaviridae и/или Adenoviridae. В течение десятилетий известно, что сульфатированные полисахариды, включающие каррагенаны и фукоидан, обладают противовирусным эффектом. Таким образом, известный уровень техники наполнен научными статьями по противовирусным эффектам каррагенанов. В самом интересном обзоре GonzalezM. E. et al. (1987, Antimicrob. Agents Chemother. 31, 1388-1393) сообщают о противовирусной эффективности различных сульфатированных полисахаридов, включая йота-каррагенан, против некоторых вирусов животных. Йота-каррагенан показал противовирусную активность против оболочечных вирусовHSV-1, HSV-2, вируса леса семлики (SFV), вируса осповакцины и вируса африканской свиной чумы(ASF) и против голого вируса энцефаломиокардита (ЕМС). Йота-каррагенан не обладал действием на оболочечные вирусы - вирус везикулярного стоматита (VSV) и вирус кори - и на голые вирусы - вирус полиомиелита 1 типа и аденовирус 5 типа. Патент США 4783446 раскрывает противовирусную активность йота-, каппа- и лямбда-каррагенана против ретровирусной инфекции, в частности против инфекции вирусом Т-клеточной лейкемии человекаWO 88/06396 раскрывает способ лечения ретровирусных инфекций, включая HIV-инфекции, посредством введения каррагенана или смеси каррагенанов.Girond et al. (1991, Research Virol. 142, 261-270) раскрывают, что сульфатированные полисахариды,подобные йота-, каппа- и лямбда-каррагенану, обладают эффективной ингибиторной активностью против репликации вируса гепатита A (HAV).Baba M. et al. (1988, Antimicrob. Agents Chemother. 32, 1742-1745) раскрывают некоторые сульфати-1 018138 рованные полисахариды, включая сульфат декстрана, полисульфат пентозана, фукоидан и каррагенан, в качестве мощных ингибиторов HSV-1, HSV-2, цитомегаловируса человека (ЦМВ), вируса везикулярного стоматита (VSV), вируса Синдбис и HIV-1. С другой стороны, при тестировании эти сульфатированные полисахариды оказались неактивными против вируса коксаки, вируса полиомиелита и вируса парагриппа. ЕР 0293826 раскрывает терапевтическое и профилактическое применение сульфатированных полисахаридов, таких как фукоидан и каррагенаны, для ингибирования HIV-1 in vitro. Патент США 5658893 раскрывает способ подавления инфекции клеток человека ротавирусом посредством соприкосновения ротавируса с лямбда-каррагенаном. Также раскрывается, что йота-и каппакаррагенан не проявляют активность против ротавируса.US 2003/181415 А раскрывает, что для сульфатированных полисахаридов, включая сульфат целлюлозы, известна их эффективность против различных оболочечных вирусов и, в частности, против вируса простого герпеса (HSV), папилломавирусов и HIV. Фукоидан представляет собой сульфатированный полисахарид, в основном выделяемый из различных видов коричневых морских водорослей. Существует два фармакологических сорта фукоиданов, доступных на рынке, высокомолекулярная фракция фукоидана (HMWF) обладает средней молекулярной массой в диапазоне приблизительно от 1000000 до 2000000 Да (например, Kraeber, Germany) и низкомолекулярная фракция фукоидана (НМФ) обладает средней молекулярной массой 8200 Да. F-фукоидан в основном состоит из сульфатированных эфиров фукозы, тогда как U-фукоидан состоит приблизительно из 20% глюкуроновой кислоты. Каррагенан является родовым термином для линейных сульфатированных полисахаридов на основе галактозы, экстрагированных из морских водорослей (Rhodophyceae). В основном он используется в качестве загустителя, гелеобразователя, стабилизатора или эмульсификатора в фармацевтических и пищевых продуктах. Существует более 10 структурно различных каррагенанов, их свойства зависят рода морских водорослей, из которого их экстрагируют. Три основных типа представляют собой йота-, каппа- и лямбда-каррагенан, которые немного различаются по структуре и степени сульфатирования. Йотакаррагенан является мягким гелеобразующим сульфатированным галактаном, преимущественно выделяемым из красных морских водорослей Gigartina stellata и Chondrus crispus. Каппа-каррагенан дает плотные, твердые гели и его преимущественно производят из Kappaphycus cottonii. Лямбда-каррагенан,который является самой распространенной формой, часто используется для сгущения молочных продуктов. Несмотря на то что уже давно известна противовирусная активность каррагенанов против таких вирусов, как, например, HTV, HSV, HAV, HTLV или HPV, механизм, посредством которого каррагенаны проявляют противовирусную активность, все еще требует дальнейшего прояснения. Например, Baba M. et al. (1988, Antimicrob. Agents Chemother. 32, 1742-1745) размышляют о том,что сульфатированные полисахариды, включая каппа- и лямбда-каррагенан, подавляют или, по меньшей мере, способствуют ингибированию вирусной адсорбции некоторых оболочечных вирусов на поверхности клетки-хозяина. Сходным образом, US 2005/0261240 предполагает, что каррагенан может неспецифически связываться с вирусом, таким образом, блокируя клеточные рецепторы вирусов. Damonte Е. В.et al. (2004, Curr. Med. Chem. 11, 2399-2419) раскрывают, что сульфатированные полисахариды могут имитировать клеточный сульфат и поэтому блокировать клеточные рецепторы вирусов, отвечающие за начальное взаимодействие между вирусом и клеткой-хозяином, тогда как Gonzalez M. E. et al. (1987, Antimicrob. Agents Chemother. 31, 1388-1393), используя меченые вирусные частицы, обнаружили, что вирионы HSV-1 проникают внутрь клеток даже в присутствие высокой концентрации йота-каррагенана. Они пришли к выводу, что по меньшей мере для HSV-1 каррагенан подавляет стадию вирусной репликации, следующей за присоединением вируса и проникновением вируса в клетку, но перед синтезом поздних вирусных белков.Turner E. V. и Sonnenfeld G. (1979, Infection and Immunity 25, 467-469) раскрывают противовирусную активность лямбда-, но не каппа-каррагенана против коровьего вируса везикулярного стоматита, эта противовирусная активность возникает благодаря иммуномодуляции, т.е. благодаря индуцированию интерферона. В заключение, подводя итог, можно привести цитату из US 5658893 "принимая во внимание различные ответные реакции различных вирусов на сульфатированные полисахариды, ясно, что ответная реакция конкретного вируса на каррагенан без эксперимента не может быть предсказана с уверенностью. Механизм, с помощью которого сульфатированные полисахариды, в особенности каррагенаны, подавляют репликацию вирусов и инфекционность может не быть одинаковым, поскольку различные исследователи сообщали о противоречащих находках при работе с различными вирусами и типами клеток. Профессионалу в данной области будет очевидно, что такое вещество как сульфатированный полисахарид,являясь эффективным ингибитором для одного вируса, будет проявлять схожее действие на другой вирус". В свете вышесказанного настоящее изобретение относится к противовирусной композиции на основе каррагенана и/или фукоидана, пригодной для профилактического или терапевтического лечения-2 018138 респираторный вирусных инфекций, вызванных членами семейств Paramyxoviridae, Orthomyxoviridae,Adenoviridae и/или Coronaviridae. Вопреки раскрытию авторов Fujisawa H. et al. (1987, J. gen. Virol. 68,425-423), которые сообщили о том, что интраназальное введение каррагенана не снижает титр вируса гриппа А у мышей, но напротив даже увеличивает восприимчивость животных к вирусу, в зависимости от количества вируса, использованного для инфицирования, теперь с удивлением было обнаружено, что каррагенан, в частности йота- и каппа-каррагенан, несомненно обладал противовирусным действием против различных членов Orthomyxoviridae, Paramyxoviridae, Adenoviridae и Coronaviridae. Более того, с удивлением было обнаружено, что фукоидан, в особенности высокомолекулярная фракция фукоидана (HWMF), обладала противовирусным действием против различных членов Orthomyxoviridae и Paramyxoviridae. Таким образом, настоящее изобретение имеет целью предоставить противовирусную фармацевтическую композицию, пригодную для профилактики или лечения инфекций дыхательных путей, вызванных вирусом, выбранным из группы, состоящей из ортомиксовирусов, парамиксовирусов, аденовирусов и коронавирусов, а также для заболеваний или патологических состояний, связанных с такими первичными вирусными инфекциями, такие заболевания или состояния включают вторичные вирусные или бактериальные инфекции, а также системные симптомы, типично связанные с любой такой первичной или вторичной инфекцией, включая такие симптомы как лихорадка, боль, головокружение, дрожь, потоотделение и/или обезвоживание. Описание изобретения В первом варианте осуществления настоящее изобретение относится к применению йотакаррагенана в качестве активного противовирусного ингредиента в производстве фармацевтической композиции для профилактики или лечения симптома, состояния или заболевания, вызванного инфекцией респираторным вирусом или связанного с инфекцией респираторным вирусом, выбранным из группы,состоящей из парамиксовирусов, вируса гриппа А человека и аденовируса субтипа В."Клетка-хозяин", упоминаемая в настоящем документе, представляет собой любую эукариотическую клетку, которая по природе, т.е. при естественных, или похожих на естественные, условиях является мишенью для любого вируса, упомянутого в дальнейшем в настоящем документе, и в которую такой вирус проникает. На современном уровне развития техники для экспериментальных и лабораторных целей используют хозяйские клеточные линии, которые типично признают пригодными в качестве моделейin vitro для тестирования действия физиологически активных средств и которые предусматривают по меньшей мере некоторую предсказуемость результатов в отношении сопоставимости с применением к человеку. Кроме того, настоящее изобретение относится к фармацевтической композиции, содержащей йотаи/или каппа-каррагенан в качестве противовирусного активного ингредиента, и к их применениям для профилактики или лечения заболеваний, вызванных попаданием вируса в организм человека через дыхательные пути или связанных с ним, где указанный вирус содержит по меньшей мере один белок, присоединенный к его вирусной мембране или интегрированный в нее, белок способен связываться с клеткойхозяином через рецептор, имеющий по меньшей мере один сахарный остаток, и вирус выбран из группы,состоящей из парамиксовирусов, вируса гриппа А человека и аденовируса субтипа В. Термин "активный противовирусный ингредиент", как применяют в настоящем документе, относится к соединению, которое является непосредственно или опосредовано эффективным при специфическом вмешательстве по меньшей мере в один из видов деятельности вируса, выбранных из группы, состоящей из проникновения вируса в эукариотические клетки, репликации вируса в эукариотических клетках, сборки вируса, высвобождения вируса из инфицированных эукариотических клеток, или которое эффективно при неспецифическом сдерживании увеличения титра вируса или при неспецифическом снижении уровня титра вируса в хозяйской системе из эукариотов или млекопитающих. Это также относится к соединению, которое предупреждает вирусную инфекцию или снижает вероятность ее получения. Настоящую фармацевтическую композицию можно вводить, в зависимости от обстоятельств, до или после начала вирусной инфекции, т.е. для целей профилактического или терапевтического лечения,или как для профилактического, так и для терапевтического введения. Термин "профилактика" или "профилактическое лечение", как применяют в настоящем документе,относится к введению настоящей фармацевтической композиции здоровому человеку для того, чтобы снизить восприимчивость указанного человека к вирусной инфекции. Термин "терапия" или "терапевтическое лечение", как применяют в настоящем документе, относится к введению настоящей фармацевтической композиции для того, чтобы достичь снижения тяжести и/или частоты симптомов, устранить симптомы и/или первопричину, предупредить возникновение симптомов и/или их первопричины, и/или исправить или устранить вред, непосредственно вызванный вирусной инфекцией или опосредованно связанный с ней, например, через вторичную инфекцию. Известно, что ортомиксо- и парамиксовирусы и некоторые другие вирусы прикрепляются к клеткехозяину посредством связывания с рецепторами, расположенными на поверхности клетки-хозяина, рецепторы типично представляют собой гликопротеины или гликолипиды, содержащие сахарные остатки,-3 018138 включающие сиаловую кислоту (N-ацил нейрамовая кислота) и остатки гепарансульфата. В случае ортомиксовирусов, например вирусов гриппа, вирионы связываются с остатками сиаловых кислот. Вирусы гриппа человека предпочтительно связываются с остатками сиаловых кислот, содержащими альфа 2-6 связи, тогда как вирус птичьего гриппа предпочтительно связывается с остатками сиаловых кислот, содержащими альфа 2-3 связи. В поглощение парамиксовируса клеткой вовлечено по меньшей мере два ее интегральных мембранных гликопротеина. Один из них, типично выбранный из группы гликопротеинов HN, Н и G, вовлечен в присоединение к клетке, и другой гликопротеин, т.е. гликопротеин F, опосредует не зависящее от рН слияние вирусной оболочки с мембраной клетки-хозяина. Например, респировирусы и рубулавирусы связываются с остатками сиаловых кислот гликопротеиновых или гликолипидных рецепторов клеткихозяина. Присоединение RSV изучено не полностью, но присоединение к клетке-хозяину скорее всего включает взаимодействие с гепарансульфатом, глюкозаминогликана, который является частью внеклеточного матрикса. Наряду с раскрытием настоящего изобретения, было замечено, что, подвергая клетки-хозяева воздействию йота-каррагенана in vitro, в частности и/или каппа-каррагенана, можно повредить структуру клеточной поверхности указанной клетки-хозяина, что, по-видимому, вызывает конформационные изменения в трехмерной структуре определенных рецепторов клеточной поверхности или маскирует и/или модифицирует указанные рецепторы. К удивлению, это изменение на поверхности клетки-хозяина предотвращало присоединение ортомиксо- и парамиксовирусов к клеткам-хозяевам даже после удаления каррагенана из клеток-хозяев, т.е. в отсутствие каррагенана в момент искусственного запуска инфекции посредством инокулирования invitro. Этот конкретный противовирусный эффект каррагенана наблюдали до тех пор, пока искусственно запущенную инфекцию инициировали не позже, чем приблизительно через 2 ч после удаления полимера из клеток-хозяев, что указывает на относительно устойчивый эффект от структурных изменений на клеточной поверхности, вызванных взаимодействием с каррагенаном. В отличие от парамиксо- и ортомиксовирусов, для других вирусов защитный эффект при отсутствии каррагенана в момент запуска инфекции не наблюдался, включая риновирус и коронавирус, тогда как защитное действие достигалось только в присутствии каррагенана. Поэтому, принимая во внимание экспериментально доказанное противовирусное действие каррагенана против риновирусной инфекции, был сделан вывод о том, что для риновируса и также возможно для других вирусов противовирусный эффект может возникать скорее из-за присоединения каррагенанового полимера к вирионам, чем из-за химического или физического взаимодействия полимера с рецепторами клетки-хозяина. Как отмечено ранее в настоящем документе, композиции с каррагенаном по настоящему изобретению можно успешно применять против ортомиксовирусной инфекции, включая инфекции, вызванные вирусом гриппа А или В, и в особенности где указанный вирус гриппа А или В представляет собой вирус человека, который связывается с клеткой-хозяином с использованием 2-6 связи в сиаловой кислоте. Инфекции вирусом гриппа человека лучше всего лечить с использованием преимущественно или только йота-каррагенана в качестве противовирусного активного ингредиента. Обнаружено, что виды парамиксовирусов, выбранные из группы, состоящей из вируса парагриппа человека (HPV) типа 1, HPV типа 2, HPV типа 3, HPV типа 4 и RSV, являются восприимчивыми к лечению йота-каррагенаном. Если выбранным парамиксовирусом является RSV, то предпочтительно, чтобы йота-каррагенан или фукоидан использовались в качестве преобладающего или единственного сульфатированного полисахаридного ингредиента для профилактического или терапевтического введения, поскольку йота-каррагенан и фукоидан давали наилучшие результаты при постановке эксперимента. Симптомы, состояния или заболевания, упоминаемые в настоящем документе в связи с профилактическим или терапевтическим введением каррагенана, включают острый бронхит, хронический бронхит, ринит, синусит, круп, острый капиллярный бронхит, фарингит, тонзиллит, ларингит, трахеит, астму и пневмонию, лихорадку, боль, головокружение, дрожь, потоотделение и обезвоживание. Каррагенан особенно подходит для местного применения для лечения воспалений кожи или слизистых. Каррагенан, который может использоваться при местном применении на коже или слизистой в соответствии с настоящим изобретением, обладает молекулярной массой в диапазоне приблизительно от 15000 до 5000000 Да, и особенно предпочтительны фракции, обладающие средними молекулярными массами более 50000 Да, и особенно фракции, обладающие средними молекулярными массами в диапазоне от 50000 до 3000000 Да. Также возможно системное, например, парентеральное или пероральное введение, особенно при использовании низкомолекулярных полимеров, обладающих средней молекулярной массой в диапазоне от 15000 до 100000 Да. Фармацевтическая композиция по настоящему изобретению, приспособленная для парентерального применения, может быть предоставлена в виде средства, выбранного из группы, содержащей кожные-4 018138 лосьоны, крема, мази, гели, порошки, включая порошки для ингаляции, спреи, пены, жидкие капли или растворы для полоскания. Однако лекарственные средства с каррагенаном также могут быть приспособлены для перорального введения, например, в виде жидких растворов, или полужидких или твердых лекарственных средств, таких как порошки, таблетки, капсулы, драже или любые другие перорально принимаемые галеновские формы. Фармацевтические композиции для применения на слизистых включают назальные спреи или капли и любые другие системы доставки лекарственного средства, известные в данной области, например, раскрытые в US 6391452. Когда композиция предназначена для местного применения и представляет собой жидкую или полутвердую форму, она типично содержит готовую к употреблению форму каррагенана в количестве 0,0110%, предпочтительно 0,01-5%, наиболее предпочтительно 0,1-2 мас.% по отношению к общему количеству композиции. Когда композиция представляет собой твердую форму, она типично содержит готовую для использования форму каррагенана в количестве 0,01-10%, предпочтительно 0,01-5%, наиболее предпочтительно 0,1-2 мас.% по отношению к общей массе композиции. Каррагенаны, которые можно использовать в настоящем изобретении, коммерчески доступны, но их также можно получить экстрагированием из морских водорослей в соответствии с процедурами экстрагирования, известными в данной области. Если не указано обратное, термин "каррагенан" в настоящем документе относится к йота-, или к каппа-каррагенану или к их смеси. Кроме того, каррагенан по настоящему изобретению может быть гомополимером или гетерополимером. Каррагенановый гомополимер состоит из субъединиц только одного типа, или йота-или каппакаррагенана, тогда как каррагенановый гетерополимер содержит субъединицы обоих указанных типов каррагенана. Таким образом, "смесь" каррагенанов также может относиться к композиции материалов, содержащей смесь различных субъединиц каррагенана в виде части по меньшей мере одного гетерополимерного каррагенана, присутствующего в указанной композиции. Типично, противовирусные фармацевтические композиции по настоящему изобретению по существу не содержат каррагенаны, отличные от йота- и каппа-каррагенана, т.е. содержат или йота-или каппакаррагенан, или их смесь, в количестве 80% или более, предпочтительно 90% или более, и в частности до 99% (мас./мас.) или более, по отношению к сухой массе всех каррагенанов, присутствующих в композиции. Для некоторых применений композиция, по существу, содержит только йота-карраген, тогда как композиция для других применений может содержать более чем 50%, предпочтительно более чем 70% и в частности более чем 95% (мас./мас. ) по сухой массе йота-каррагенана, относительно общей сухой массы всех каррагенанов, присутствующих в композиции. Однако для других применений может использоваться композиция, которая содержит более чем 50%, предпочтительно более чем 70%, и в частности более чем 95% (мас./мас.) по сухой массе каппакаррагенана, по отношению к общей сухой массе всех каррагенанов, присутствующих в композиции. Когда композиция содержит по меньшей мере один гетерополимерный каррагенан, приведенные выше численные значения относятся к процентным долям соответствующих субъединиц каррагенана. Противовирусные композиции с каррагенаном в соответствии с настоящим изобретением могут дополнительно содержать по меньшей мере один фармацевтически приемлемый носитель и/или вспомогательное вещество, которое пригодно и разрешено для медицинского применения. Носитель может представлять собой разбавитель, например воду, физиологический раствор, необязательно фосфатно-солевой буфер (PBS), эксципиент или другой носитель, который облегчает введение композиции. Когда композиция является твердой, полутвердой или жидкой, группы носителей и вспомогательных веществ, соответственно, могут содержать, но без ограничений, SiO2, TiO2, связывающие вещества, такие как микрокристаллическая целлюлоза, поливинилпирролидон, трагакантовая камедь, желатин, крахмал, лактоза, моногидрат лактозы, альгиновая кислота или маисовый крахмал; смазывающие вещества или поверхностно-активные вещества, такие как стеарат магния или лаурилсульфат натрия; скользящие вещества, например, такие как коллоидная двуокись кремния; подсластители, такие как сахароза или сахарин. Еще могут быть выбраны дополнительные вспомогательные вещества, выбранные из группы, состоящей из физиологически приемлемых консервантов, фармацевтически приемлемых солей щелочных металлов, таких как натрий, калий, литий или хлориды аммония, буферов или регуляторов рН, таких как лимонная кислота, уксусная кислота, фумаровая кислота, соляная кислота, яблочная кислота, азотная кислота, фосфорная кислота, пропионовая кислота, серная кислота и винная кислота и сочетания указанных кислот. Для многих применений может использоваться композиция, которая содержит хлорид натрия в качестве вспомогательного вещества. Типично, фармацевтически приемлемая соль присутствует в композиции в количестве не более чем 1%, предпочтительно не более чем 0,6% (мас./об.). В композициях по настоящему изобретению каррагенан тоже может присутствовать в виде соли,-5 018138 предпочтительно в виде соли натрия. Предпочтительно, чтобы настоящие композиции для профилактического или терапевтического медицинского применения предоставлялись в виде стерильных препаратов, не содержащих микробов, патогенов, пирогенов и/или аллергенов. Было обнаружено, что каррагенан не токсичен при пероральном или кожном применении или при ингаляции, даже при применении в чрезвычайно высоких дозах. Поэтому он классифицирован как "общепризнан безопасным" (GRAS) Управлением по продовольствию и лекарствам (FDA). Каррагенан, в частности йота-каррагенан, также можно использовать в качестве противовирусного средства, эффективного против ортомиксовирусных и парамиксовирусых инфекций в различных лекарственных средствах вместе с другими физиологически активными соединениями или лекарственными средствами в качестве основных активных ингредиентов, где каррагенан выполняет роль носителя или вспомогательного средства, такого как эмульсификатор или модификатор вязкости. Он совместим с большинством фармацевтических препаратов и не вызывает нежелательных побочных эффектов. Было замечено, что каррагенан также может обладать иммуномодулирующей активностью, в особенности, способностью укреплять иммунную систему. Однако до сих пор не вполне ясно, связана ли эта активность напрямую с физиологической интерференцией вещества или опосредована через его противовирусное действие. Обычно композиция по настоящему изобретению будет входить в средства для местного применения или на слизистых, предпочтительно, выбранных из спреев, в особенности назальных спреев, порошков, капель, растворов для полоскания, пен, гелей, кремов, мазей, лосьонов, пастилок и т.п. Однако фармацевтическую композицию по настоящему изобретению также можно наносить на твердые поверхности предметов гигиены или санитарии, например, таких как гигиенические продукты для лица или санитарные продукты, типично используемые в области ротовой полости и/или носа, включая в качестве неограничивающих примеров бумагу или салфетки для носа и носовые платки. Более конкретно, фармацевтическую композицию можно использовать, например распылять - подобно дезинфицирующим средствами - на перчатки, гигиенические салфетки или бумагу, включая бумагу или салфетки для носа, для того, чтобы оказать вирицидный эффект, по меньшей мере до некоторой степени, и таким образом содействовать уменьшению повторяющегося самоинфицирования человека инфицированными кончиками пальцев, а также снижать распространение вируса среди других, находящихся поблизости и контактирующих друг с другом людей, например, лицом к лицу. К другим предметам, покрытым, импрегнированным или пропитанным фармацевтической композицией на основе каррагенана, относятся ватные аппликаторы, пылезащитные маски или санитарные или медицинские маски для лица. Даже в состав губной помады может входить количество каррагенана, достаточное для проявления противовирусного эффекта. Эти гигиенические или санитарные продукты могут быть использованы для профилактики или для терапевтического лечения от вирусной инфекции и могут способствовать предупреждению или снижению риска инфекции. Цель настоящего изобретения состоит в том, чтобы предоставить противовирусные композиции на основе йота-каррагенана для профилактического или терапевтического лечения людей, в частности, с восприимчивостью или повышенным риском ортомиксо- или парамиксовирусной инфекции, включая пациентов с высокой степенью риска, выбранных из группы, состоящей из COPD-пациентов, пациентов с астмой, людей, страдающих от аллергий или с ослабленной иммунной, сердечно-сосудистой или дыхательной системами, и пациентов после трансплантации органов, а также симптомов, выбранных из группы, состоящей из лихорадки, боли, головокружения, дрожи, потоотделения и обезвоживания. В соответствии с настоящим изобретением каррагенан также можно использовать в качестве противовирусного активного ингредиента при производстве фармацевтической композиции для профилактики или терапевтического лечения патологического состояния или заболевания, вызванного инфекцией респираторного вируса или связанного с инфекцией респираторного вируса, выбранного из группы, состоящей из аденовируса и коронавируса, аденовирус предпочтительно представляет собой аденовирус типа В (Ad50). Аденовирусные и коронавирусные инфекции лучше всего лечить с использованием композиций, в которых йота-каррагенан является единственным или преобладающим активным противовирусным ингредиентом. Экспериментальные исследования также подтвердили, что фукоидан тоже эффективен в качестве противовирусного активного ингредиента в производстве фармацевтической композиции, которая эффективна при профилактике или лечении патологических состояний или заболеваний, вызванных инфекцией респираторного вируса или связанных с ней, респираторный вирус выбран из группы, состоящей из ортомиксо- и парамиксовирусов. В этом контексте ортомиксовирус типично представляет собой вирус гриппа А или В и парамиксовирус типично представляет собой RSV. Композиция на основе фукоидана в готовой для использования форме для местного или перорального применения может содержать фукоидан в количестве 0,01-10%, предпочтительно 0,01-5%, наиболее предпочтительно 0,1-2% массы на объем (мас./об.) или массы на массу (мас./мас.) в зависимости от того,является ли композиция жидкой или полутвердой (процентные доли мас./об.) или твердой (процентные-6 018138 доли мас./мас.). Дополнительно она может содержать по меньшей мере один фармацевтически приемлемый носитель и/или вспомогательное вещество, а также другие физиологически активные вещества или лекарственные средства. Например, хлорид натрия часто используют в качестве вспомогательного вещества. В основном, фармацевтически приемлемые соли могут присутствовать в композициях с фукоиданом в количестве не более чем 1%, предпочтительно не более чем 0,6%. Краткое описание рисунков На фиг. 1 показана эффективность йота-каррагенана по снижению бляшкообразования вирусом гриппа A/Chile/1/93 H1N1 в клетках MDCK при различных дозах в диапазоне от конечной концентрации 0,1 до 100 мкг/мл. Ордината = процентная доля бляшкообразования после инфицирования клеток MDCK суспензией вируса гриппа A/Chile/1/93 H1N1, содержащей различные концентрации йота-каррагенана по отношению к бляшкообразованию в клетках MDCK, инфицированных суспензией вируса гриппаA/Chile/1/93 H1N1 без йота-каррагенана (принято за 100%); абсцисса = различные конечные концентрации йота-каррагенана в суспензии вируса в мкг/мл. На фиг. 2 показана эффективность йота-каррагенана по снижению бляшкообразования вирусом гриппа A/Aichi2/68 H3N2 в клетках MDCK при различных дозах в диапазоне от конечной концентрации 75 до 300 мкг/мл. Ордината = процентная доля бляшкообразования после инфицирования клеток MDCK суспензией вируса гриппа A/Aichi2/68 H3N2, содержащей различные концентрации йота-каррагенана по отношению к бляшкообразованию в клетках MDCK, инфицированных суспензией вируса гриппаA/Aichi2/68 H3N2 без йота-каррагенан (принято за 100%); абсцисса = различные конечные концентрации йота-каррагенана в суспензии вируса в мкг/мл. На фиг. 3 показана эффективность йота-каррагенана по снижению бляшкообразования вирусом парагриппа 3 в клетках Нер-2 при различных дозах в диапазоне от конечной концентрации 0,1 до 100 мкг/мл. Ордината = процентная доля бляшкообразования после инфицирования клеток Нер-2 суспензией вируса парагриппа 3, содержащей различные концентрации йота-каррагенана по отношению к бляшкообразованию в клетках Нер-2, инфицированных суспензией вируса парагриппа 3 без йота-каррагенана(принято за 100%); абсцисса = различные конечные концентрации йота-каррагенана в суспензии вируса в мкг/мл. На фиг. 4 показана эффективность предварительной обработки йота-каррагенаном для снижения бляшкообразования вирусом парагриппа 3 в клетках HeLa при различных дозах в диапазоне от конечной концентрации 13 до 400 мкг/мл. Ордината = процентная доля бляшкообразования после инфицирования предварительно обработанных клеток HeLa (предварительная инкубация в течение 3 ч с йотакаррагенаном с последующим удалением полимера) суспензией вируса парагриппа 3 по отношению к бляшкообразованию необработанных клеток HeLa (без предварительной инкубации с йотакаррагенаном) (принято за 100%); абсцисса = различные конечные концентрации йота-каррагенана в среде для предварительной инкубации в мкг/мл. С = клетки, предварительно инкубированные с полимером карбоксиметилцеллюлозой (отрицательный контроль). На фиг. 5 показаны результаты эксперимента по ингибированию клеточной смерти, вызванной коронавирусом, на клетках почки кошки (СК). Ордината = процентная доля неинфицированных клеток после инфицирования по отношению к неинфицированным контрольным клеткам; абсцисса = различные конечные концентрации каррагенана в суспензии вируса (фиг. 5 А) или в среде для предварительной инкубации (фиг. 5 В) в мкг/мл; фиг. 5 А = клетки, инфицированные кошачьим коронавирусом FIP в присутствие йота-, каппа- или лямбда-каррагенана; фиг. 5 В = клетки, предварительно инкубированные в течение 3 ч с йота-, каппа- или лямбда-каррагенаном, впоследствии отмытые три раза в PBS и инфицированные кошачьим коронавирусом FIP в отсутствие полимера. На фиг. 6 показаны результаты эксперимента по ингибированию клеточной смерти, вызваннойHRV8, на клетках HeLa. Ордината = процентная доля неинфицированных клеток после инфицирования по отношению к неинфицированным контрольным клеткам; абсцисса = различные конечные концентрации йота-каррагенана в суспензии вируса (фиг. 6 А) или в среде для предварительной инкубации (фиг. 6 В) в мкг/мл; фиг. 6 А = клетки, инфицированные риновирусом человека 8 типа (HRV8) в присутствие йота-каррагенана; фиг. 6 В = клетки, предварительно инкубированные в течение 3 ч с йота-каррагенаном,впоследствии три раза отмытые в PBS и инфицированные HRV8 в отсутствие йота-каррагенана. На фиг. 7 показано связывание FITC-меченого йота-каррагенана с клетками HeLa после последующей отмывки в PBS. Ордината = вычисленная концентрация йота-каррагенана в мкг/мл (пересчитанная из единиц флуоресцентного свечения в мкг/мл с использованием калибровочной кривой); абсцисса = стадии отмывки клеток в PBS; 0 = супернатант, содержащий FITC-меченый йота-каррагенан, удаляли из клеток; 1 = первая стадия отмывки клеток в PBS; 2 = вторая стадия отмывки клеток в PBS; 3 = третья стадия отмывки клеток в PBS. На фиг. 8 показаны результаты эксперимента по ингибированию клеточной смерти, вызваннойRSV, на клетках Vero. Ордината = процентная доля неинфицированных клеток после инфицирования по отношению к неинфицированным контрольным клеткам; абсцисса = различные конечные концентрации йота-каррагенана в суспензии вируса (темные столбики) или в среде для предварительной инкубации(светлые столбики) в мкг/мл; темные столбики = клетки, инфицированные RSV в присутствие йота-7 018138 каррагенана; светлые столбики = клетки, предварительно инкубированные в течение 3 ч с йотакаррагенаном, впоследствии три раза отмытые в PBS и инфицированные RSV в отсутствие йотакаррагенана . На фиг. 9 показаны результаты эксперимента по ингибированию клеточной смерти, вызваннойRSV, на клетках HNep. Ордината = процентная доля неинфицированных клеток после инфицирования и 5 дней инкубирования по отношению к неинфицированным контрольным клеткам; абсцисса = моменты времени, в которые добавляли йота-каррагенан в конечной концентрации 100 мкг/мл в инкубационную среду (часы после инфицирования). На фиг. 10 показаны результаты эксперимента по ингибированию клеточной смерти, вызваннойRSV, на клетках HNep. Ордината = процентная доля неинфицированных клеток после инфицирования и 5 дней инкубирования по отношению к неинфицированным контрольным клеткам; абсцисса = различные конечные концентрации йота-каррагенана в суспензии вируса в мкг/мл. На фиг. 11 показаны результаты эксперимента по ингибированию клеточной смерти, вызваннойRSV, на клетках НЕр-2. Ордината = процентная доля неинфицированных клеток после инфицирования и 6 дней инкубирования при 37 С по отношению к неинфицированным контрольным клеткам; абсцисса = различные конечные концентрации йота-, каппа- или лямбда-каррагенана в суспензии вируса в мкг/мл. На фиг. 12 показаны результаты эксперимента по ингибированию клеточной смерти, вызваннойRSV, на клетках HNep. Ордината = процентная доля неинфицированных клеток после инфицирования по отношению к неинфицированным контрольным клеткам; абсцисса = различные конечные концентрации йота-каррагенана (темные столбики) и фукоидана (светлые столбики) в суспензии вируса в мкг/мл. На фиг. 13 показаны результаты эксперимента по ингибированию клеточной смерти, вызванной вирусом парагриппа 3, на клетках HNep. Ордината = процентная доля неинфицированных клеток после инфицирования по отношению к неинфицированным контрольным клеткам; абсцисса = различные конечные концентрации йота-, каппа- или лямбда-каррагенана или фукоидана в суспензии вируса в мкг/мл. На фиг. 14 показаны результаты эксперимента по ингибированию клеточной смерти, вызванной вирусом гриппа H3N2 (FLU), на клетках HNep. Ордината = процентная доля неинфицированных клеток после инфицирования по отношению к неинфицированным контрольным клеткам; абсцисса = различные конечные концентрации йота-, каппа- или лямбда-каррагенана или фукоидана в суспензии вируса в мкг/мл. На фиг. 15 показана эффективность йота-, каппа-, лямбда-каррагенана и фукоидана по снижению бляшкообразования вирусом гриппа A H5N1 в клетках MDCK в дозах 400 мкг/мл и 44 мкг/мл. Ордината= процентная доля бляшкообразования после инфицирования клеток MDCK суспензией вируса птичьего гриппа H5N1, содержащей различные концентрации йота-, каппа-, лямбда-каррагенана или фукоидана по отношению к бляшкообразованию в клетках MDCK, инфицированных суспензией вируса гриппа H5N1 без полимера (принято за 100%); абсцисса = различные конечные концентрации йота-, каппа-, лямбдакаррагенана или фукоидана в суспензии вируса в мкг/мл. На фиг. 16 показаны результаты эксперимента по ингибированию клеточной смерти, вызванной аденовирусом 50 типа (Ad50), на клетках HNep. Ордината = процентная доля неинфицированных клеток после инфицирования по отношению к неинфицированным контрольным клеткам; абсцисса = различные конечные концентрации йота-каррагенана в суспензии вируса в мкг/мл. На фиг. 17 показаны результаты эксперимента по ингибированию клеточной смерти, вызваннойAd50, на клетках HNep. Ордината = процентная доля неинфицированных клеток после инфицирования по отношению к неинфицированным контрольным клеткам; абсцисса = различные конечные концентрации йота-каррагенана в суспензии вируса (темные столбики) или в среде для предварительной инкубации (светлые столбики) в мкг/мл; темные столбики = клетки, инфицированные Ad50 в присутствие йотакаррагенана; светлые столбики = клетки, предварительно инкубированные в течение 3 ч с йотакаррагенаном, впоследствии три раза отмытые в PBS и инфицированные Ad50 в отсутствие йотакаррагенана. Для того чтобы описываемое в настоящем документе изобретение можно было понять более полно,приведены следующие примеры. Эти примеры служат только иллюстративным целям и не должны рассматриваться в качестве ограничения этого изобретения в каком-либо отношении. Также следует понимать, что настоящее изобретение также будет включать некоторую степень изменений, явно раскрытых вариантов осуществления, которые сможет предположить специалист в данной области. Примеры Пример 1. Действие различных концентраций йота-каррагенана на бляшкообразование вирусом гриппа А на клетках MDCK. Суспензии вируса, содержащие 60-80 БОЕ (pfu) вируса гриппа A/Chile/1/93 H1N1, смешивали с основным раствором йота-каррагенана до конечных концентраций 0,1, 1, 10, 25, 50 или 100 мкг/мл. Слившиеся монослои линии клеток из почки собаки MDCK в шести луночных планшетах инфицировали суспензиями вируса в течение 60 мин при 34 С. Удаляли инфекционный инокулят и промывали клетки вPBS и добавляли верхний слой, содержащий 0,6% агарозы. Планшеты инкубировали при 36 С в увлажненной атмосфере с 5% СО 2 в воздухе. Через 48-60 ч после инфицирования верхний слой агарозы удаля-8 018138 ли, клетки окрашивали красителем кристаллическим фиолетовым и подсчитывали видимые бляшки. Процентную долю бляшкообразования по отношению к неинфицированному контролю (без обработки йота-каррагенаном) определяли для каждой концентрации йота-каррагенана. Как показано на фиг. 1, было обнаружено, что йота-каррагенан ингибирует, пропорционально дозе,бляшкообразование вирусом гриппа A/Chile/1/93 H1N1 в клетках MDCK. 50% снижение количества бляшек (IC50) достигали при концентрации йота-каррагенана 50 мкг/мл. Пример 2. Действие различных концентраций йота-каррагенана на бляшкообразование вирусом гриппа А на клетках MDCK. Суспензии вируса, содержащие 60-80 БОЕ вируса гриппа A/Aichi2/68 H3N2 смешивали с основным раствором йота-каррагенана до конечных концентраций 75, 150 или 300 мкг/мл. Слившиеся монослои линии клеток из почки собаки MDCK в шести луночных планшетах инфицировали суспензиями вируса в течение 60 мин при 34 С. Удаляли инфекционный инокулят и промывали клетки в PBS и добавляли верхний слой, содержащий 0,6% агарозы. Планшеты инкубировали при 37 С в увлажненной атмосфере с 5% СО 2 в воздухе. Через 48-60 ч после инфицирования верхний слой агарозы удаляли, клетки окрашивали красителем кристаллическим фиолетовым и подсчитывали видимые бляшки. Процентную долю бляшкообразования по отношению к неинфицированному контролю (без йота-каррагенана) определяли для каждой концентрации йота-каррагенана. Как показано на фиг. 2, было обнаружено, что йота-каррагенан ингибирует, пропорционально дозе,бляшкообразование вирусом гриппа A/Aichi/2/68 H3N2 на клетках MDCK. Пример 3. Действие различных концентраций йота-каррагенана на бляшкообразование вирусом парагриппа 3 на клетках Нер-2. Суспензии вируса, содержащие 60-80 БОЕ вируса парагриппа 3, смешивали с основным раствором йота-каррагенана до конечных концентраций 0,1, 1, 10, 25, 50 и 100 мкг/мл. Смесь инкубировали в течение 1 ч при 34 С. Слившиеся монослои клеток Нер-2 в шести луночных планшетах инфицировали суспензиями вируса в течение 60 мин при 34 С. Удаляли инфекционный инокулят и промывали клетки вPBS и добавляли верхний слой, содержащий 0,6% агарозы. Лотки инкубировали в увлаженной атмосфере с 5% CO2. Через 48-60 ч после инфицирования удаляли верхний слой агарозы, клетки окрашивали красителем кристаллическим фиолетовым и подсчитывали видимые бляшки. Процентную долю бляшкообразования по отношению к планшетам с неинфицированным контролем (без йота-каррагенана) определяли для каждой концентрации йота-каррагенана. Как показано на фиг. 3, было обнаружено, что йота-каррагенан ингибирует, пропорционально дозе,бляшкообразование вируса парагриппа 3 на клетках Нер-2. 50% снижение количества бляшек (IC50) достигали при концентрации йота-каррагенана 10 мкг/мл. Пример 4. Влияние предварительной инкубации с йота-каррагенаном на бляшкообразование вирусом парагриппа 3 на клетках HeLa. Слившиеся монослои клеток HeLa инкубировали три часа с йота-каррагенаном при концентрациях 13, 40, 133 и 400 мкг/мл. Супернатант, содержащий йота-каррагенан, удаляли и клетки промывали три раза в PBS и затем инфицировали вирусом парагриппа 3, как описано в примере 3, не без добавления йота-каррагенана в суспензию вируса. Процентную долю бляшкообразования по отношению к неинфицированному контролю (без предварительной обработки йота-каррагенаном) определяли для каждой концентрации йота-каррагенана. Как показано на фиг. 4, было обнаружено, что йота-каррагенан подавляет бляшкообразование вирусом парагриппа 3 при концентрациях 400 и 133 мкг/мл, если клетки предварительно инкубировали в течение трех часов с йота-каррагенаном, несмотря на то, что йота-каррагенан отсутствовал в момент инфицирования и в процессе всего последующего периода инкубирования при 37 С. Этот результат показывает, что йота-каррагенан химически или структурно модифицирует рецепторы на поверхности клеткихозяина таким образом, что рецептор-опосредованное связывание вируса парагриппа 3 с клеткойхозяином в пространственно затрудняется или предотвращается даже в отсутствие модифицирующего средства каррагенана. Также это доказывает мощное профилактическое действие йота-каррагенана. Пример 5. Влияние предварительной обработки эукариотических клеток различными каррагенанами на ингибирование клеточной смерти, опосредованной коронавирусом. Субконфлюэнтные клетки СК в присутствии йота-, каппа- или лямбда-каррагенана в концентрациях 4, 40 и 400 мкг/мл инфицировали кошачьим коронавирусом FIPV при moi (множественность заражения) равной 0,1) (см. фиг. 5 А). При сравнении субконфлюэнтные клетки СК инкубировали три часа с йота-,лямбда- или каппа-каррагенаном при концентрациях 4, 40, и 400 мкг/мл. Супернатант, содержащий каррагенан, удаляли и клетки промывали три раза в PBS и инфицировали кошачьим коронавирусом FIP(moi=0,1) в отсутствии полимера (см. фиг. 5 В). Процентную долю жизнеспособных клеток по отношению к неинфицированному контролю определяли для каждого каррагенана и каждой концентрации. Как показано на фиг. 5 А, все три типа каррагенана ингибируют клеточную смерть, опосредованную коронавирусом, в клетках СК при самой высокой концентрации 400 мкг/мл. Йота-каррагенан проявляет значительное ингибирование еще в концентрации 4 мкг/мл, тогда как каппа- и лямбда-каррагенан не эффективны в этих концентрациях. Из фиг. 5 В можно понять, что, в отличие от вирусов, которые проника-9 018138 ют в клетку через углеводные рецепторы (см. предыдущие примеры), похоже, коронавирусная инфекция не ингибируется за счет структурных или химических изменений коронавирус-специфичного рецептора(ов) каррагенаном на поверхности клетки-хозяина, поскольку невозможно было повысить защищенность клетки-хозяина выше уровня 35% ингибирования даже при самой высокой экспериментальной концентрации каррагенана 400 мкг/мл и при предварительной инкубации длительностью три часа. Также предварительная обработка клеток-хозяев каррагенаном значительно не повысила защищенность клеток от коронавирусной инфекции. Результаты показывают, что для достижения значительной защищенности от коронавирусной инфекции противовирусное активное средство, т.е. каррагенан, должно присутствовать в момент инфицирования, т.е. когда собирается произойти взаимодействие между вирусом и клеткой-хозяином. Пример 6. Влияние предварительной обработки эукариотической клетки йота-каррагенаном на ингибирование клеточной смерти, опосредованной HRV8. Субконфлюэнтные клетки HeLa инфицировали риновирусом человека 8 типа (HRV8; moi=0,1) в присутствии йота-каррагенана в концентрациях 4, 40 и 400 мкг/мл (см. фиг. 6 А). При сравнении, субконфлюэнтные клетки HeLa инкубировали в течение 3 ч перед инфицированием с йота-каррагенаном в концентрациях 4, 40 и 400 мкг/мл. Супернатант, содержащий йота-каррагенан, удаляли и клетки промывали три раза в PBS и затем инфицировали с использованием HRV8 в отсутствии полимера (см. фиг. 6 В). Процентную долю жизнеспособных клеток по отношению к неинфицированному контролю определяли для каждой концентрации йота-каррагенана. Как показано на фиг. 6 А, йота-каррагенан ингибирует клеточную смерть, опосредованную HRV8,при всех концентрациях. Из фиг. 6 В можно понять, что, в отличие от вирусов, которые проникают в клетку через углеводные рецепторы, клеточная смерть, опосредованная HRV8, не подавлялась более чем на 5% даже при концентрации 400 мкг/мл и предварительной инкубации клеток в течение трех часов йота-каррагенаном. Этот результат согласуется с предыдущими находками (данные не приведены) и показывает, что для HRV8 предварительная инкубация клеток-мишеней с каррагенаном не значительно защищает клетки-мишени от инфицирования, если каррагенан отсутствует в момент инфицирования. Этот результат показывает, что рецептор для HRV8, LDL-рецептор, не модифицируется или маскируется при обработке йота-каррагенаном. Пример 7. Йота-каррагенан количественно удаляли из клеток HeLa посредством отмывки клеток вPBS. Клетки HeLa инкубировали с FITC-меченым йота-каррагенаном в концентрациях 400, 133, 4 и 0,4 мкг/мл в течение 10 мин, затем супернатант удаляли и клетки промывали три раза в PBS. Количество остаточного FITC-меченого каррагенана определяли с помощью флуоресцентного считывателя (BMGOmega) после удаления супернатанта, содержащего FITC-меченый йота-каррагенан и после каждой стадии отмывки. Единицы флуоресцентного свечения пересчитывали в значение концентрации в мкг/мл каррагенана с использованием калибровочной кривой. Как показано на фиг. 7, FITC-меченый йота-каррагенан количественно удаляли (95%) из клетокHeLa посредством отмывки клеток по меньшей мере три раза в PBS. Этот результат доказывает, что каррагенан не связывался ковалентно с поверхностью клеток. Результат подтвердили во второй серии экспериментов, в которой инкубационный период увеличивали с 10 мин до 3 ч с использованием того же способа обнаружения. Таким образом, результаты подтверждают заключения, сделанные в настоящем документе и в примерах, касающиеся того, что каррагенан вызывает модификацию углеводных рецепторов на поверхности клеток-мишеней, участвующих в связывании с вирионами, и эта модификация все еще присутствует после удаления полимера с поверхности клетки-мишени. Пример 8. Влияние предварительной обработки эукариотической клетки йота-каррагенаном на ингибирование клеточной смерти, опосредованной RSV. Субконфлюэнтные клетки Vero инфицировали в присутствие йота-каррагенана в концентрациях 0,4, 4 и 40 мкг/мл с использованием RSV (moi=0,1). При сравнении, субконфлюэнтные клетки Vero инкубировали в течение трех часов с йота-каррагенаном в концентрациях 0,4, 4 и 40 мкг/мл. Супернатант,содержащий йота-каррагенан, удаляли и клетки промывали три раза в PBS и инфицировали RSV(moi=0,1) в отсутствие каррагенана. Процентную долю жизнеспособных клеток по отношению к неинфицированному контролю определяли для каждой концентрации каррагенана. Как показано на фиг. 8, йота-каррагенан ингибирует клеточную смерть, опосредованную RSV, при всех концентрациях, даже если полимер отсутствует в момент и в процессе инфицирования. Известно,что RSV присоединяется к клеткам через гепарансульфат, углеводородную молекулу, которая присутствует на поверхности эпителиальных клеток. Результаты показывают, что этот рецептор модифицируется йота-каррагенаном и присоединение RSV к клеточной поверхности и последующая вирусная репликация таким образом блокируются. Пример 9. Влияние обработки эукариотических клеток йота-каррагенаном в различные моменты времени после инфицирования на ингибирование клеточной смерти, опосредованной RSV, в клетках- 10018138 добавляли при конечной концентрации 40 мкг/мл в различные моменты времени после инфицирования,как показано на фиг. 9 (0, 8, 24, 32, 48, 56 и 72 ч после инфицирования) и процентные доли жизнеспособных клеток HNep по отношению к неинфицированному контролю определяли для каждого момента времени. Как показано на фиг. 9, йота-каррагенан значительно ингибирует клеточную смерть, опосредованную RSV, при концентрациях 100 мкг/мл даже когда полимер добавляли только через 24 ч после инфицирования. Этот результат показывает, что йота-каррагенан можно использовать не только профилактически, но он также оказывает противовирусное действие в процессе терапевтического лечения, когда применяется в ранней фазе вирусной инфекции. Пример 10. Влияние профилактического лечения йота-каррагенаном на ингибирование клеточной смерти, опосредованной RSV, в клетках HNep. Субконфлюэнтные клетки HNep инфицировали в присутствие йота-каррагенана при концентрациях 400, 133, 44, 15, 5, 2 и 1 мкг/мл с использованием RSV (moi=0,1). Процентные доли жизнеспособных клеток HNep по отношению к неинфицированному контролю определяли для каждой концентрации йотакаррагенана. Как показано на фиг. 10, йота-каррагенан значительно ингибирует клеточную смерть, опосредованную RSV, даже при концентрация всего лишь 1 мкг/мл, если полимер присутствовал в процессе инфицирования. Этот результат показывает, что йота-каррагенан можно эффективно использовать для стратегий профилактического вмешательства. Пример 11. Влияние обработки эукариотических клеток различными каррагенанами на ингибирование клеточной смерти, опосредованной RSV, в клетках НЕр-2. Клетки НЕр-2 в 6-луночных планшетах инфицировали в присутствие йота-, каппа- или лямбдакаррагенана при концентрации 0,01, 0,1, 1, 10 и 100 мкг/мл вирусом RSV A2 (moi=0,001). Процентные доли жизнеспособных клеток по отношению к неинфицированному контролю определяли для каждого каррагенана и каждой концентрации. Как показано на фиг. 11, все три типа каррагенана ингибировали клеточную смерть, опосредованную RSV, в клетках НЕр-2, при этом йота-каррагенан проявил самый сильный эффект. Пример 12. Сравнения влияния обработки эукариотических клеток йота-каррагенаном и фукоиданом на ингибирование клеточной смерти, опосредованной RSV. Субконфлюэнтные клетки HNep инфицировали в присутствие йота-каррагенана и фукоидана в концентрациях 400, 133, 44, 15, 4, 1,3 и 0,4 мкг/мл вирусом RSV (moi=0,1). Процентные доли жизнеспособных клеток HNep по отношению к неинфицированному контролю определяли для каждой концентрации йота-каррагенана и каждой концентрации фукоидана. Как показано на фиг. 12, фукоидан существенно ингибирует клеточную смерть, опосредованнуюRSV, в клетках HNep при концентрации 0,4 мкг/мл, если полимер присутствует в процессе инфицирования. Поэтому фукоидан является интересным претендентом на разработку средств для профилактики и лечения инфекций. Пример 13. Влияние обработки эукариотических клеток различными каррагенанами и фукоиданом на ингибирование клеточной смерти, опосредованной вирусом парагриппа 3. Субконфлюэнтные клетки HNep в присутствии йота- или каппа-или лямбда-каррагенана или фукоидана при концентрациях 400, 133,3, 44,4, 14,8, 4, 1,3 и 0,4 мкг/мл инфицировали вирусом парагриппа 3 типа. Процентные доли жизнеспособных (то есть, неинфицированных) клеток HNep по отношению к неинфицированному контролю определяли для каждого полимера и каждой концентрации полимера. Как показано на фиг. 13, все три типа каррагенана ингибировали клеточную смерть, опосредованную вирусом парагриппа 3, в клетках HNep, при этом йота-каррагенан проявлял самый сильный эффект. Фукоидан также ингибировал клеточную смерть, опосредованную вирусом парагриппа 3, в клеткахHNep в объеме, сравнимом с ингибиторным действием каппа- и лямбда-каррагенана. Пример 14. Влияние обработки эукариотических клеток различными каррагенанами и фукоиданом на ингибирование клеточной смерти, опосредованной вирусом гриппа H3N2. Субконфлюэнтные клетки HNep в присутствии йота-, каппа-, лямбда-каррагенана и фукоидана в концентрациях 400, 133,3, 44,4, 14,8, 4, 1,3 и 0,4 мкг/мл инфицировали вирусом гриппа H3N2. Процентные доли жизнеспособных клеток HNep по отношению к неинфицированному контролю определяли для каждого полимера и каждой концентрации полимера. Как показано на фиг. 14, все три типа каррагенана ингибировании клеточную смерть, опосредованную вирусом гриппа H3N2, в клетках HNep. Кроме того, было обнаружено, что фукоидан ингибирует клеточную смерть, опосредованную вирусом гриппа H3N2, в клетках HNep в объеме, сравнимо с ингибированием йота-каррагенаном. Пример 15. Влияние различных каррагенанов и фукоидана на бляшкообразование вирусом птичьего гриппа H5N1 на клетках MDCK. Суспензии вируса, содержащие 60-80 БОЕ вируса птичьего гриппа H5N1 смешивали с основным раствором полимера или йота- или каппа- или лямбда-каррагенана или фукоидана до конечных концентраций полимера 400 или 44,4 мкг/мл. Слившиеся монослои линии клеток из почки собаки MDCK в шес- 11018138 ти луночных планшетах инфицировали суспензиями вируса в течение 60 мин при 34 С. Инфекционный инокулят удаляли и промывали клетки в PBS и добавляли верхний слой агарозы, содержащий 0,6% агарозы. Планшеты инкубировали при 36 С в увлажненной атмосфере с 5% CO2 в воздухе. Через 48-60 ч после инфицирования верхний слой агарозы удаляли, клетки окрашивали красителем кристаллическим фиолетовым и подсчитывали видимые бляшки. Процентные доли бляшкообразования по отношению к неинфицированному контролю (без обработки полимером) определяли для каждого полимера и каждой концентрации полимера. Как показано на фиг. 15, было обнаружено, что на бляшкообразование вирусом птичьего гриппаH5N1 не влияли йота-и лямбда-каррагенан и фукоидан. Однако каппа-каррагенан ингибировал, пропорционально дозе, бляшкообразование вирусом птичьего гриппа H5N1 на клетках MDCK. Поскольку вирус птичьего гриппа предпочтительно связывается с остатками сиаловых кислот с 2-3 связью, результаты показывают, что каппа-каррагенан предпочтительно может модифицировать такие остатки сиаловых кислот, обладающие 2-3 связью. Пример 16. Влияние профилактической обработки эукариотических клеток йота-каррагенаном на ингибирование клеточной смерти, опосредованной аденовирусом типа В (Ad50). Субконфлюэнтные клетки HNep в присутствии йота-каррагенана в концентрациях 400, 133,3, 44,4,14,8, 4, 1,3 и 0,4 мкг/мл инфицировали вирусом Ad50. Процентные доли жизнеспособных клеток HNep по отношению к неинфицированному контролю определяли для каждой концентрации йота-каррагенана. Как показано на фиг. 16, йота-каррагенан существенно ингибирует клеточную смерть, опосредованную Ad50, даже в концентрации всего лишь 4 мкг/мл, если полимер присутствует в момент и в процессе инфицирования. Этот результат указывает на то, что йота-каррагенан можно использовать для эффективных стратегий профилактического вмешательства против аденовируса субтипа В (например,Ad50). Однако при тестировании аденовирусов субтипов А, С и D в серии экспериментов, как описано выше, достоверный эффект йота-каррагенана не был обнаружен (данные не приведены). Пример 17. Сравнение влияния профилактической обработки эукариотических клеток йотакаррагенаном на ингибирование клеточной смерти, опосредованной Ad50. Субконфлюэнтные клетки HNep в присутствии йота-каррагенана в концентрациях 400, 40 и 4 мкг/мл инфицировали вирусом Ad50. При сравнении, субконфлюэнтные клетки HNep инкубировали в течение трех часов с йота-каррагенаном в концентрациях 400, 40 и 4 мкг/мл перед инфицированием. Супернатант, содержащий йота-каррагенан, удаляли и клетки промывали три раза в PBS и инфицировали вирусом Ad50 в отсутствие каррагенана. Процентные доли жизнеспособных клеток HNep по отношению к неинфицированному контролю определяли для каждой концентрации йота-каррагенана. Как показано на фиг. 17, йота-каррагенан существенно ингибирует клеточную смерть, опосредованную Ad50, при концентрациях 400 и 40 мкг/мл в присутствие и в отсутствие йота-каррагенана в момент инфицирования и в процессе наблюдавшегося инфекционного периода. Эти данные указывают на то, что йота-каррагенан модифицирует рецептор для аденовирусов субтипа В на клеточной поверхности,о котором известно, что он является углеводным рецептором, тогда как аденовирусы других субтипов вероятно проникают в клетку посредством других рецепторов. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Применение йота-каррагенана в противовирусно эффективном количестве в качестве противовирусного активного ингредиента при производстве фармацевтической композиции или лекарственного средства для профилактического или терапевтического лечения симптома, состояния или заболевания,вызванного или связанного с инфекцией респираторным вирусом, выбранным из группы, состоящей из парамиксовирусов, вируса гриппа А человека и аденовируса субтипа В. 2. Применение по п.1, где парамиксовирус выбран из группы, состоящей из вируса парагриппа человека (HPV) 1 типа, HPV 2 типа, HPV 3 типа, HPV 4 типа и RSV. 3. Применение по п.1 или 2, где патологическое состояние или заболевание выбрано из группы, состоящей из острого бронхита, хронического бронхита, ринита, синусита, крупа, острого капиллярного бронхита, фарингита, тонзиллита, ларингита, трахеита, астмы и пневмонии, и где симптом выбран из группы, состоящей из лихорадки, боли, головокружения, дрожи, потоотделения и обезвоживания. 4. Применение по любому из пп.1-3, где противовирусная фармацевтическая композиция или лекарственное средство приспособлены для местного кожного применения или местного применения на слизистых. 5. Применение по п.4, где противовирусная фармацевтическая композиция или лекарственное средство изготовлены в виде лосьона для кожи, крема, мази, геля, порошка, включая порошок для ингаляций,спрея, пены, жидких капель или раствора для полоскания рта и горла. 6. Применение по любому из пп.1-3, где противовирусная фармацевтическая композиция или лекарственный препарат приспособлены для перорального введения. 7. Применение по п.6, где противовирусная фармацевтическая композиция или лекарственный препарат изготовлены в виде жидкого раствора или в виде полутвердого или твердого препарата, такого как- 12018138 сухой порошок, таблетки, капсулы или драже. 8. Применение по любому из пп.4-7, где композиция является жидкой или полутвердой и содержит в виде готового препарата йота-каррагенан в количестве 0,01-10 мас.% по отношению к общему количеству препарата. 9. Применение по п.8, где композиция содержит йота-каррагенан в количестве 0,01-5 мас.% по отношению к общему количеству препарата. 10. Применение по п.8, где композиция содержит йота-каррагенан в количестве 0,1-2 мас.% по отношению к общему количеству препарата. 11. Применение по п.6 или 7, где композиция является твердой и содержит в виде готового препарата йота-каррагенан в количестве 0,01-10 мас.%. 12. Применение по п.11, где композиция содержит йота-каррагенан в количестве 0,01-5 мас.%. 13. Применение по п.11, где композиция содержит йота-каррагенан в количестве 0,1-2 мас.%. 14. Применение по п.1, где композиция дополнительно содержит каппа-каррагенан. 15. Применение по п.14, где композиция содержит 50 мас.% или более сухого вещества йотакаррагенана по отношению к общей сухой массе каррагенанов, присутствующих в композиции. 16. Применение по п.15, где композиция содержит 70 мас.% или более сухого вещества йотакаррагенана по отношению к общей сухой массе каррагенанов, присутствующих в композиции. 17. Применение по п.15, где композиция содержит 95 мас.% или более сухого вещества йотакаррагенана по отношению к общей сухой массе каррагенанов, присутствующих в композиции. 18. Применение по любому из пп.1-17, где композиция дополнительно содержит по меньшей мере один фармацевтически приемлемый носитель и/или вспомогательное вещество. 19. Применение по п.18, где фармацевтически приемлемое вспомогательное вещество представляет собой фармацевтически приемлемую соль щелочного металла. 20. Применение по п.19, где фармацевтически приемлемое вспомогательное вещество представляет собой хлорид натрия или калия. 21. Применение по п.19 или 20, где фармацевтически приемлемая соль присутствует в композиции в количестве 1% или менее. 22. Применение по п.21, где фармацевтически приемлемая соль присутствует в композиции в количестве 0,6% или менее. 23. Применение по любому из пп.1-22, где композиция содержит йота-каррагенан частично или полностью в виде его соли. 24. Применение по п.23, где композиция содержит йота-каррагенан частично или полностью в виде его натриевой соли. 25. Применение по любому из пп.1-24, где композиция зафиксирована посредством нанесения покрытия или импрегнирования на твердой поверхности предмета гигиены или санитарии. 26. Применение по п.25, где предмет гигиены или санитарии выбран из группы, состоящей из гигиенической или санитарной перчатки, ткани или бумаги, носового платка или салфетки, ватного аппликатора, пылезащитной маски и санитарной или медицинской маски для лица. 27. Применение по любому из пп.1-24, где композиция входит в состав губной помады. 28. Применение по любому из пп.1-27, где композиция дополнительно содержит некаррагенановое физиологически активное соединение. 29. Применение по п.28, где некаррагенановое физиологически активное соединение выступает в качестве основного активного ингредиента. 30. Применение по любому из пп.1-29, где патологическое состояние или заболевание имеет место у индивидуума, который является пациентом с высоким риском, выбранным из группы, состоящей изCOPD-пациента, пациента с астмой, с аллергией, с ослабленной иммунной, сердечной или дыхательной системой и пациента после трансплантации.
МПК / Метки
МПК: A61K 31/431, A61P 31/20, A61P 31/14, A61P 31/16, A61K 31/737
Метки: качестве, противовирусного, ингредиента, йота-каррагенана, применение
Код ссылки
<a href="https://eas.patents.su/18-18138-primenenie-jjota-karragenana-v-kachestve-protivovirusnogo-ingredienta.html" rel="bookmark" title="База патентов Евразийского Союза">Применение йота-каррагенана в качестве противовирусного ингредиента</a>
Предыдущий патент: Композиции, содержащие пневмококковые антигены
Следующий патент: Гидрокарбилиден нитрогидразинкарбоксимидамиды и способ их получения, а также их применения в качестве инсектицида
Случайный патент: Способ извлечения редкоземельных элементов из твердой смеси, содержащей галофосфат и соединение одного или нескольких редкоземельных элементов