Применение тория- 227 в лучевой терапии заболеваний мягких тканей
Формула / Реферат
1. Способ лечения заболевания мягких тканей у млекопитающего субъекта, включающий введение указанному субъекту терапевтически эффективного количества обеспечивающего направленную доставку к мягким тканям комплекса тория-227 и комплексообразующего агента, причем указанное количество является таким, что в результате распада введенного тория-227 in vivo образуется допустимое немиелотоксическое количество радия-223, при этом торий-227 конъюгирован с обеспечивающей направленную доставку группировкой с биосродством, за исключением остеотропов, липосом и фолат-конъюгированных антител или фрагментов антител, и где терапевтически эффективное количество тория-227 составляет по меньшей мере 25 кБк/кг.
2. Способ по п.1, где указанный субъект представляет собой человека или собаку.
3. Способ по п.1 или 2, где указанное терапевтически эффективное количество тория-227 составляет по меньшей мере 75 кБк на килограмм массы тела.
4. Способ по любому из пп.1-3, где указанное допустимое немиелотоксическое количество радия-223 составляет менее 300 кБк на килограмм массы тела.
5. Способ по п.4, где указанное допустимое немиелотоксическое количество радия-223 составляет менее 150 кБк на килограмм массы тела.
6. Способ по любому из пп.1-5, где указанный комплекс содержит хелатированный торий-227, связанный с лигандом, выбранным из группы антител, конструкций антител, фрагментов антител, конструкций фрагментов антител и их смесей.
7. Способ по любому из пп.1-6, где указанное заболевание мягких тканей представляет собой злокачественное заболевание.
8. Способ по п.7, где злокачественное заболевание представляет собой заболевание, выбранное из группы карцином, сарком, миелом, лейкозов, лимфом и раковых заболеваний смешанного типа.
9. Способ по любому из пп.1-8, где указанного субъекта лечат также с целью противодействия миелотоксичности образующегося в нем радия-223.
10. Способ по п.9, где указанного субъекта лечат стволовыми клетками.
11. Способ лечения заболевания мягких тканей у млекопитающего субъекта, включающий введение указанному субъекту терапевтически эффективного количества обеспечивающего направленную доставку к мягким тканям комплекса тория-227 и комплексообразующего агента, причем указанное количество, Dadd, которое рассчитывают по формуле I, приведенной ниже, такое, что в результате распада введенного тория-227 in vivo образуется допустимое немиелотоксическое количество радия-223, DRa
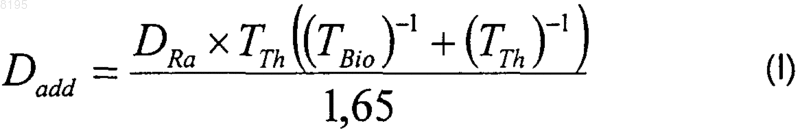
где ТBio означает биологический период полураспада указанного обеспечивающего направленную доставку к мягким тканям комплекса тория-227 и комплексообразующего агента;
ТTh означает физический период полураспада 227Th (18,7 дней);
Dadd означает активность введенного комплекса 227Тh (кБк/кг) и равно по меньшей мере 25 кБк/кг и
DRa означает допустимое немиелотоксическое количество 223Ra;
и при этом торий-227 конъюгирован с обеспечивающей направленную доставку группировкой с биосродством, за исключением остеотропов, липосом и фолат-конъюгированных антител или фрагментов антител.
12. Способ по п.11, где DRa равно 200 кБк/кг.
13. Способ по любому из пп.1-12 в комбинации по меньшей мере с одним дополнительным лечебным воздействием, выбранным из хирургии, наружной лучевой радиотерапии, химиотерапии, эндорадионуклидной терапии радионуклидами, отличными от 227Тh, и/или регулирования температуры тканей.
14. Фармацевтическая композиция, содержащая обеспечивающий направленную доставку к мягким тканям комплекс тория-227 и комплексообразующего агента вместе по меньшей мере с одним фармацевтическим носителем или эксципиентом, где торий-227 конъюгирован с обеспечивающей направленную доставку группировкой с биосродством, за исключением остеотропов, липосом и фолат-конъюгированных антител или фрагментов антител, и где торий-227 присутствует в терапевтически эффективном количестве по меньшей мере 25 кБк/кг.
15. Обеспечивающий направленную доставку к мягким тканям комплекс тория-227 и комплексообразующего агента, где торий-227 конъюгирован с обеспечивающей направленную доставку группировкой с биосродством, за исключением остеотропов, липосом и фолат-конъюгированных антител или фрагментов антител, и где торий-227 присутствует в количестве эффективной дозы, равной по меньшей мере 25 кБк/кг.
16. Комплекс по п.15, где торий-227 хелатирован производным 1,4,7,10-тетраазациклододекан-1,4,7,10-тетрауксусной кислоты.
17. Способ образования комплекса по п.16, включающий нагревание указанного тория-227 с указанным производным 1,4,7,10-тетраазациклододекан-1,4,7,10-тетрауксусной кислоты с образованием хелатированного тория-227 и последующее присоединение указанного хелатированного тория-227 к обеспечивающей направленную доставку группировке.
18. Набор для использования в способе по любому из пп.1-13, включающий раствор обеспечивающего направленную доставку к мягким тканям комплекса тория-227 и комплексообразующего агента вместе с инструкциями для использования указанного раствора в указанном способе, где торий-227 конъюгирован с обеспечивающей направленную доставку группировкой с биосродством, за исключением остеотропов, липосом и фолат-конъюгированных антител или фрагментов антител.
19. Набор для использования в способе по любому из пп.1-13, включающий комплексообразующий агент, способный образовывать комплекс с ионами тория, где указанный комплексообразующий агент не является обеспечивающим направленную доставку к мягким тканям комплексообразующим агентом, соединение, обеспечивающее направленную доставку к мягким тканям, возможно вместе с линкерным соединением, которое может быть конъюгировано с указанным комплексообразующим агентом с получением обеспечивающего направленную доставку к мягким тканям комплексообразующего агента, и инструкции для приготовления обеспечивающего направленную доставку к мягким тканям комплекса тория-227 и комплексообразующего агента, и также возможно для использования указанного комплекса в указанном способе, где обеспечивающий направленную доставку к мягким тканям комплекс представляет собой группировку с биосродством, за исключением остеотропов, липосом и фолат-конъюгированных антител или фрагментов антител.
Текст
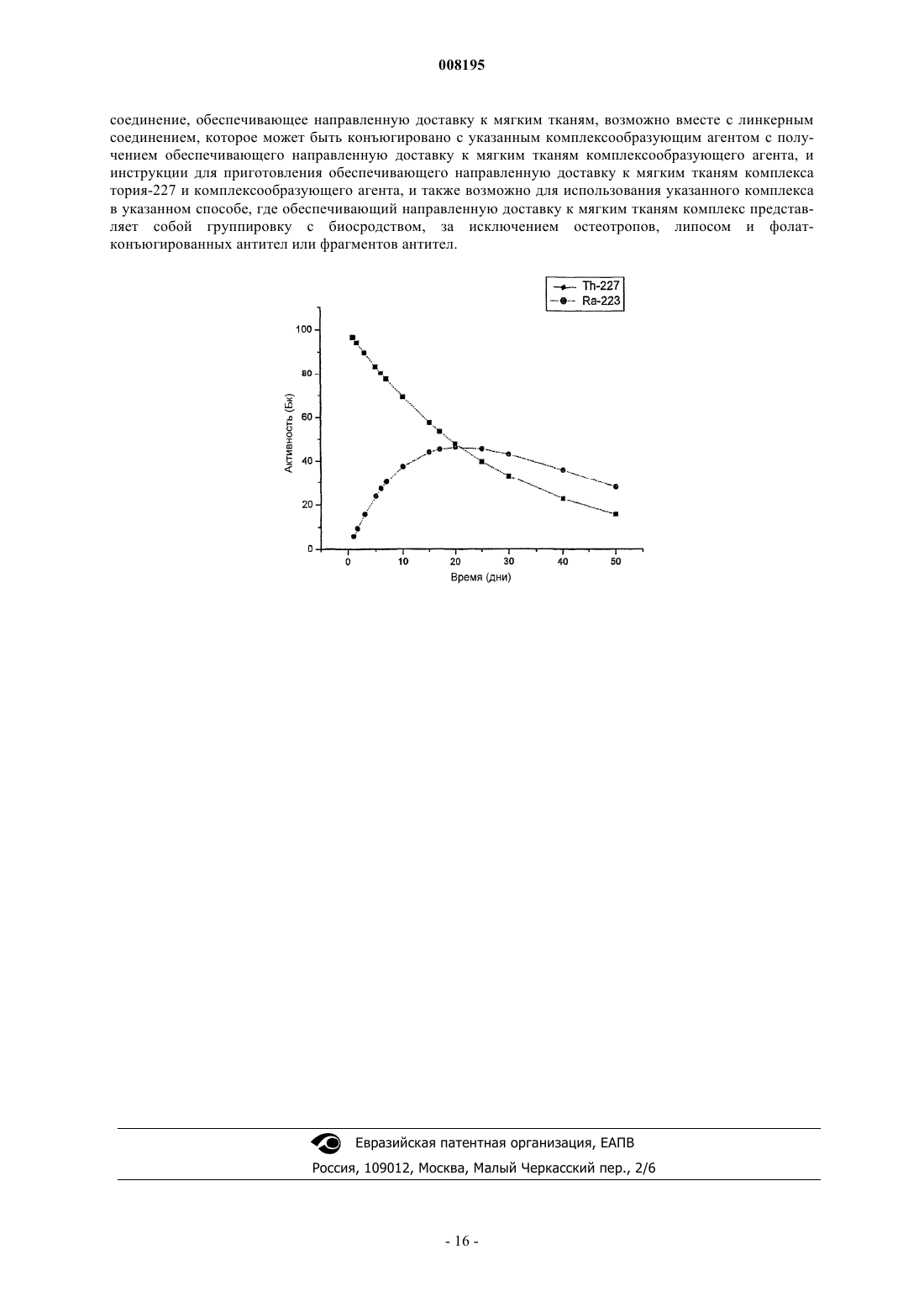
008195 Область изобретения Настоящее изобретение относится к способу радиотерапии, более конкретно, к способу, вовлекающему применение тория-227 в лечение заболевания мягких тканей. Предпосылки изобретения Киллинг определенных клеток может быть необходим для успешного лечения множества заболеваний у млекопитающих. Типичные примеры этого имеют место при лечении злокачественных заболеваний, таких как саркомы и карциномы. Однако избирательное уничтожение некоторых типов клеток может играть ключевую роль также в лечении других заболеваний, в частности, гиперпластических и неопластических заболеваний. Наиболее распространенными способами избирательного лечения в настоящее время являются хирургия, химиотерапия и наружное лазерное облучение. Однако терапия радионуклидами с обеспечением направленной доставки является многообещающей и развивающейся областью с возможностью доставки высокоцитотоксического излучения к нежелательным типам клеток. В наиболее распространенных формах радиофармацевтических средств, разрешенных в настоящее время для применения у людей, используются бета-излучающие и/или гамма-излучающие радионуклиды. Однако существовал интерес к применению в терапии альфа-излучающих радионуклидов из-за их способности к более специфическому клеточному киллингу. В физиологическом окружении диапазон излучения типичных источников альфа-излучения обычно составляет менее 100 мкм; что эквивалентно всего нескольким клеточным диаметрам. Это делает эти источники весьма подходящими для лечения опухолей, включая микрометастазы, поскольку лишь небольшая часть энергии излучения будет выходить за пределы клеток-мишеней, и, таким образом, повреждение окружающей здоровой ткани может быть сведено к минимуму (см. Feinendengen et al., Radiat Res 148: 195-201 (1977. В отличие от этого, в воде бета-частица имеет диапазон излучения 1 мм или более(см. Wilbur, Antibody Immunocon Radiopharm 4: 85-96 (1991. Энергия излучения альфа-частиц является высокой по сравнению с бета-частицами, гамма-лучами и рентгеновскими лучами и обычно составляет 5-8 МэВ, что в 5-10 раз выше, чем энергия бета-частиц, и в 20 или более раз выше, чем энергия гамма-лучей. Таким образом, такая локализация большого количества энергии на очень коротком расстоянии сообщает альфа-излучению исключительно высокий линейный перенос энергии (LET, linear energy transfer), высокую относительную биологическую эффективность(RBE, relative biological efficacy) и низкий коэффициент кислородного усиления (OER, oxygen enhancement ratio) по сравнению с гамма- и бета-излучением (см. Hall, "Radiobiology for the radiologist", Fifth edition, Lippincott WilliamsWilkins, Philadelphia PA, USA, 2000). Это объясняет исключительную цитотоксичность альфа-излучающих радионуклидов, а также налагает строгие требования на уровень контроля и распределения альфа-излучающих радионуклидов, необходимых для того, чтобы избежать недопустимые побочные эффекты. В настоящее время считают, что лишь немногие альфа-излучающие радионуклиды полезны для молекулярно-нацеленной терапии (см. выше, например, Feinendegen and Wilbur). Для того чтобы установить, является ли конкретный нуклид подходящим, исследуемые нуклиды должны тщательно оцениваться на основании их физических характеристик, химических свойств, а также свойств продукта(ов) распада (т.е. их дочерних нуклидов). Часто бывает так, что дочерние нуклиды, образующиеся в результате распада потенциального терапевтического альфа-излучающего радионуклида, также представляют собой альфа-излучающие источники и/или в результате распада, в свою очередь, образуют дополнительные альфа-излучающие изотопы. Поэтому при оценке терапевтической эффективности альфа-излучающего источника необходимо учитывать свойства потенциальных дочерних нуклидов. В табл. 1 ниже показаны физические свойства альфа-излучателей в результате распада, до сих пор широко предлагаемых в литературе в качестве источников, имеющих возможную терапевтическую эффективность. Таблица 1-1 008195 До сих пор основное внимание было сфокусировано на 211At и 213Bi, и эти два нуклида были исследованы в клинических иммунотерапевтических испытаниях. Некоторые из предложенных радионуклидов являются короткоживущими, т.е. имеют период полураспада менее 12 ч. Такой короткий период полураспада затрудняет производство и распространение радиофармацевтических средств на основе этих радионуклидов коммерческим способом. Введение короткоживущего нуклида также увеличивает долю дозы радиации, которая будет излучаться в организме до того, как достигнет мишени. В этом отношении два долгоживущих нуклида 223Ra и 225 Ас имеют более предпочтительные периоды полураспадов. Оба этих радионуклида имеют короткоживущие дочерние продукты распада (материнский нуклид и дочерние нуклиды испускают в совокупности четыре альфачастицы), которые могли бы создавать сильный каскад альфа-частиц при условии, что распад материнского и дочерних нуклидов происходит в одном и том же месте. Однако если дочерние нуклиды не удерживаются в участке-мишени, то эти нуклиды способны высвобождать большое количество разрушающего излучения в здоровые ткани. Важная и фундаментальная проблема состоит также в том, что отдача дочернего ядра после альфа-распада является высокоэнергетической (выброс ядра гелия со скоростью примерно 2% от скорости света сообщает остающемуся дочернему ядру значительный импульс). Энергия отдачи от альфа-излучения во многих случаях вызывает утечку дочерних нуклидов из места распада родительского нуклида. Этой энергии отдачи достаточно для того, чтобы выбить многие дочерние ядра из химического окружения, которое, возможно, удерживало родительский нуклид, например, когда родительский нуклид образовывал комплекс слигандом, таким как хелатирующий агент. Это будет происходить даже тогда, когда дочерний нуклид химически сочетается, т.е. способен образовывать комплекс, с тем же самым лигандом. В равной степени этот эффект утечки будет даже больше в тех случаях, когда дочерний нуклид представляет собой газ, особенно инертный газ, такой как радон, или химически не сочетается с данным лигандом. Когда дочерние нуклиды имеют период полураспада больше нескольких секунд, тогда они могут диффундировать в кровеносную систему, не удерживаясь комплексообразующим соединением, которое удерживало родительский нуклид. Затем эти свободные радиоактивные дочерние нуклиды могут вызывать нежелательную системную токсичность. Недавно внимание привлек актиний-225, однако, исследование этого нуклида было затруднено недостаточной доступностью исходного материала. Было показано, что 225 Ас может быть соединен с моноклональными антителами и использован для направленной доставки к тканям, содержащим антиген. Однако исследования, проведенные до сих пор, показывают, что антитела, меченные 225 Ас, являются очень токсичными в экспериментах на животных. Другие нуклиды, которые были упомянуты в качестве кандидатов для терапии с использованием альфа-излучателя, включают 224Ra и 226Ra (T1/2 = 1600 лет), которые интенсивно использовали в начале прошлого столетия, но от которых затем отказались из-за отрицательных отдаленных последствий,включающих костный рак. Эти два радиевых нуклида имеют радоновые дочерние нуклиды, которые являются газообразными и быстро диффундируют из места, занимаемого родительским нуклидом. В общем случае также отсутствуют подходящие линкеры для присоединения радия к молекулярному агенту,обеспечивающему направленную доставку. Кроме того, чрезвычайно длинный период полураспада 226Ra является очень проблематичным с точки зрения радиационной безопасности и риска загрязнения. Таким образом, большинство альфа-излучающих радионуклидов считаются в целом непригодными из-за неподходящих периодов полураспада или из-за того, что их продукты распада считаются несовместимыми с медицинским применением, например, из-за того, что дочерние нуклиды являются остеотропными (см. Mausner, Med Phys 20, 503-509 (1993. Так, например, радий, будучи аналогом кальция, представляет собой особенно сильный остеотроп, и известно, что при высвобождении из 227Th in vivo происходит нежелательное накопление дочернего нуклида 223Ra в скелете (см. Muller, Int J Radiat Biol 20, 233243 (1971, где можно ожидать значительную миелотоксичность. Согласно Feinendegen и др. ("Alpha-emitters for medical therapy" Second Bi-Annual Workshop, Toronto, June 1998, US Dept. of Energy Report No. DOE/NE-0116) существуют два потенциальных терапевтических радионуклида, которые распадаются, проходя по меньшей мере через три вторичных распада с альфа-излучением. Это 225 Ас и 223Ra. Терапевтические исследования на животных моделях с помощью радиоиммуноконъюгатов актиния-225 (T1/2 = 10,0 дней) показали, что инъецируемые дозы 6,3 кБк (приблизительно 250 кБк/кг, исходя из предположения, что средняя масса животного составляет 25 г) могли бы сильно улучшить выживаемость мышей-носителей ксенотрансплантатов при диссеминированной лимфоме. Семейство актиния-225 высвобождает четыре альфа-частицы, первые три альфа-излучателя в этом семействе имеют периоды полураспада менее 5 мин, тогда как последний альфа-излучатель в этом семействе висмут-213 имеет период полураспада 46 мин. Данные, демонстрирующие противоопухолевые эффекты 223Ra in vivo, до сих пор отсутствуют в литературе. Преимущество этого нуклида состоит в наличии короткоживущих дочерних нуклидов, т.е. дочерних нуклидов от высвобождения из 219Rn (T1/2 = 3,96 с) более чем двух альфа-частиц в течение нескольких секунд, хотя последний альфа-излучатель в этом семействе 211 Вi, которому предшествует 211 Рb(T1/2 = 36,1 мин), имеет период полураспада 2,17 мин и может диффундировать далеко от 223Ra. В случае 223Ra, а также 225 Ас три альфа-излучателя из четырех будут распадаться вблизи материнского нуклида.-2 008195 Это сильно отличается от 227Th, который имеет вторичные частицы, испускающие четыре альфачастицы, все из которых предшествуют периоду полураспада дочернего нуклида 223Ra, равному 11,4 дня. Вероятно, этот длительный период полураспада дочернего 223Ra будет вызывать почти полное смещение вторичных частиц по сравнению с материнским нуклидом 227Th и, соответственно, значительные трудности при контролировании местонахождения этих четырех альфа-излучателей и, как результат, высокую вероятность нежелательных побочных эффектов. Однако недавно торий-227 (T1/2 = 18,7 дней) был предложен (см. WO 01/60417 и WO 02/05859) в качестве терапевтического радионуклида, при условии использования системы носителя, которая позволяет удерживать дочерние нуклиды в замкнутой среде. В одном случае этот радионуклид помещают внутрь липосомы, и значительный размер этой липосомы (по сравнению с расстоянием отдачи) помогает удерживать дочерние нуклиды внутри липосомы. В другом случае используют остеотропные комплексы этого радионуклида, которые включаются в костный матрикс и тем самым ограничивают высвобождение дочерних нуклидов. Потенциально эти способы являются весьма выгодными, но введение липосом в некоторых случаях является нежелательным, и существует множество заболеваний мягкой ткани, при которых эти радионуклиды не могут быть окружены минерализованным матриксом с тем, чтобы удерживать дочерние изотопы. Из общедоступной информации, касающейся токсичности радия, становится понятным, что при отсутствии таких специфических средств удержания радиевых дочерних нуклидов тория-227 невозможно использовать торий-227 в качестве терапевтического агента, так как дозы, необходимые для достижения терапевтического эффекта от распада тория-227, давали бы в результате высокотоксичную и, возможно,летальную дозу облучения от распада дочерних нуклидов радия, т.е. отсутствие терапевтического окна. Поэтому сохраняется существенная потребность в разработке новых способов лечения мягких тканей радионуклидами, которые делают возможным терапевтическое лечение злокачественного и доброкачественного заболевания альфа-излучателями, не вызывая нежелательных побочных эффектов, особенно миелотоксичность. Авторы настоящего изобретения неожиданно обнаружили, что в терапевтическом лечении не существует окна, в котором субъекту (обычно млекопитающему) может быть введено терапевтически эффективное количество направленно доставляемого радионуклида тория-227 без образования радия-223 в количестве, достаточном для того, чтобы вызвать нежелательную миелотоксичность. Краткое изложение сущности изобретения Таким образом, как видно из первого аспекта, в настоящем изобретении предложен способ лечения заболевания мягких тканей у млекопитающего субъекта (преимущественно у человека или собаки),включающий введение указанному субъекту терапевтически эффективного количества обеспечивающего направленную доставку к мягким тканям комплекса тория-227 и комплексообразующего агента, причем указанное количество является таким, что в результате распада введенного тория-227 in vivo образуется допустимое немиелотоксическое количество радия-223. Как видно из другого аспекта, в настоящем изобретении предложено применение тория-227 для изготовления лекарства, содержащего обеспечивающий направленную доставку к мягким тканям комплекс тория-227 и комплексообразующего агента, для использования в способе лечения заболевания мягких тканей. Как видно из другого аспекта, в настоящем изобретении предложена фармацевтическая композиция, содержащая обеспечивающий направленную доставку к мягким тканям комплекс тория-227 и комплексообразующего агента вместе по меньшей мере с одним фармацевтическим носителем или эксципиентом. Как видно из еще одного аспекта, в настоящем изобретении также предложен обеспечивающий направленную доставку к мягким тканям комплекс тория-227 и комплексообразующего агента. Для того чтобы отличать их от нерадиоактивных комплексов тория, следует понимать, что комплексы тория и их композиции, заявленные в настоящем изобретении, содержат больше тория-227, чем относительная концентрация в природе, например, больше по меньшей мере на 20%. Это не влияет на определение способа по изобретению, где ясно видно, что требуется терапевтически эффективное количество тория-227. Как видно из еще одного аспекта, в настоящем изобретении также предложен набор для использования в способе по изобретению, включающий раствор обеспечивающего направленную доставку к мягким тканям комплекса тория-227 и комплексообразующего агента, вместе с инструкциями для использования указанного раствора в способе по изобретению. Как видно из еще одного аспекта, в настоящем изобретении также предложен набор для использования в способе по изобретению, включающий комплексообразующий агент, способный образовывать комплекс с ионами тория, где указанный комплексообразующий агент не является обеспечивающим направленную доставку к мягким тканям комплексообразующим агентом, соединение, обеспечивающее направленную доставку к мягким тканям, возможно вместе с линкерным соединением, которое может быть конъюгировано с указанным комплексообразующим агентом с получением обеспечивающего направленную доставку к мягким тканям комплексообразующего агента, и инструкции для приготовления-3 008195 из них обеспечивающего направленную доставку к мягким тканям комплекса тория-227 и комплексообразующего агента, и также возможно для использования указанного комплекса в способе по изобретению. Краткое описание графических материалов На чертеже представлен график, показывающий падение со временем радиоактивности в результате распада тория-227 и результирующее увеличение со временем радиоактивности в результате распада радия-223 после введения комплекса тория-227 по изобретению. Подробное описание изобретения Под "обеспечением направленной доставки к мягким тканям" в данном описании подразумевают,что рассматриваемое вещество, представленное в форме ториевого комплекса, служит для доставки тория к участку мягкой ткани, в котором желателен его радиоактивный распад. Это может осуществляться благодаря компоненту комплексообразующего агента, который связывается с поверхностными клеточными маркерами (например, с рецепторами), присутствующими на пораженных болезнью клетках или на клетках, находящихся вблизи от пораженных болезнью клеток (например, с белками, более интенсивно экспрессирующимися на поверхностях пораженных клеток, чем на поверхностях здоровых клеток, или более интенсивно экспрессирующимися на поверхностях клеток во время периодов роста или репликации, чем во время фаз покоя), или благодаря компоненту, который связывается с дополнительным агентом, связывающимся с мягкими тканями (в этом случае указанный дополнительный агент следует вводить первым в качестве "зонда" для ториевого комплекса). Альтернативно, это обеспечение направленной доставки может осуществляться к антигену, который ассоциирован с клетками-мишенями, но непосредственно к ним не присоединен. Обычно такие антигены находятся в матриксе между клеткамимишенями и, таким образом, окружены больной тканью. Примерами этого являются матриксные антигены, такие как танасцин, который ассоциирован с опухолями головного мозга, но экспрессируется в матриксе между клетками. Такие матриксные антигены могут становиться мишенями непосредственно или с помощью предварительно связывающегося агента, как обсуждено выше. Термин "мягкая ткань" используется в данном описании для обозначения тканей, которые не имеют твердого минерализованного матрикса. В частности, мягкие ткани, как использовано здесь, могут представлять собой любые ткани, которые не являются скелетными тканями. Соответственно, "заболевание мягких тканей", как использовано в данном описании, обозначает заболевание, встречающееся в "мягкой ткани", как использовано здесь. Настоящее изобретение является особенно подходящим для лечения раковых заболеваний, и "заболевание мягких тканей", таким образом, охватывает карциномы, саркомы,миеломы, лейкозы, лимфомы и смешанные типы раковых заболеваний, встречающихся в любой "мягкой" (т.е. неминерализованной) ткани, а также другие незлокачественные заболевания такой ткани. Злокачественное "заболевание мягкой ткани" включает в себя солидные опухоли, встречающиеся в мягких тканях, а также метастазирующие и микрометастазирующие опухоли. Действительно, указанное заболевание мягких тканей может включать в себя первичную солидную опухоль мягкой ткани и по меньшей мере одну метастазирующую опухоль в мягкой ткани того же пациента. Альтернативно, указанное "заболевание мягких тканей" может состоять только из солидной опухоли или только из метастазов, при этом первичная опухоль представляет собой заболевание скелета. Используемый в данном описании термин "допустимое немиелотоксическое" используют для обозначения того, что наиболее важным является то, что количество образующегося радия обычно недостаточно для того, чтобы быть непосредственно летальным для субъекта. Однако специалисту обычно понятно, что степень повреждения спинного мозга (и возможность летальной реакции), которая будет представлять собой переносимый побочный эффект такого лечения, будет существенно меняться в зависимости от типа заболевания, которое лечат, целей схемы лечения и прогноза для этого субъекта. Хотя предпочтительными субъектами для настоящего изобретения являются люди, другие млекопитающие,особенно собаки, будут получать пользу от применения этого изобретения, и уровень допустимого повреждения спинного мозга также может зависеть от вида этого субъекта. Уровень допустимого повреждения спинного мозга обычно будет больше при лечении злокачественного заболевания, чем доброкачественного заболевания. Хорошо известным критерием уровня миелотоксичности является количество нейтрофильных клеток, и в настоящем изобретении допустимое немиелотоксическое количество 223Ra будет обычно означать количество, контролируемое таким образом, что нейтрофильная фракция в ее самой низкой точке (низший уровень) будет составлять не менее 10% от ее количества до лечения. Предпочтительно, когда допустимое немиелотоксическое количество 223Ra будет таким, что фракция нейтрофильных клеток будет составлять по меньшей мере 20% на низшем уровне и более предпочтительно по меньшей мере 30%. Наиболее предпочтительно, когда низший уровень фракции нейтрофильных клеток составляет по меньшей мере 40%. Кроме того, если будет включена поддержка стволовыми клетками или сравнимый способ восстановления, то 227 Тh-содержащие соединения могут быть использованы в схемах с высокими дозами, когда миелотоксичность образующего 223Ra в норме является недопустимой. В таких случаях количество нейтрофильных клеток может быть уменьшено до уровня менее 10% на низшем уровне и в исключительных случаях будет уменьшено до 5% или, при необходимости, до уровня менее 5%, при условии, что приня-4 008195 ты соответствующие меры предосторожности и дается последующая поддержка стволовыми клетками. Такие способы хорошо известны в данной области. Торий-227 относительно легко производить и можно приготовить непрямым способом из облученного нейтронами 226Ra, который будет содержать материнский нуклид тория-227, т.е. актиний-227 (T1/2 = 22 года). Актиний-227 можно достаточно легко отделить от 226Rа-мишени и использовать в качестве генератора 227 Тh. При необходимости, этот процесс можно масштабировать до промышленного уровня, и,следовательно, можно избежать проблемы снабжения, испытываемой с большинством других альфаизлучателей, рассматриваемых в качестве кандидатов для молекулярно-нацеленной радиотерапии. Торий-227 распадается через радий-223. В этом случае первичный дочерний нуклид имеет период полураспада 11,4 дня. В течение первых нескольких дней источник чистого 227 Тh продуцирует лишь небольшое количество радия. Однако потенциальная токсичность 223Ra выше, чем потенциальная токсичность 227Th, поскольку испускание альфа-частицы из 223Ra в пределах нескольких минут сопровождается испусканием трех дополнительных альфа-частиц из короткоживущих дочерних нуклидов (см. табл. 2 ниже, которая представляет последовательность распада для тория-227). Таблица 2 Отчасти из-за того, что он генерирует потенциально вредные продукты распада, торий-227 (Т 1/2 = 18,7 дней) не рассматривался широко для терапии альфа-частицами. Авторы настоящего изобретения впервые установили, что торий-227 можно вводить в количествах,достаточных для того, чтобы обеспечить желательные терапевтические эффекты без образования настолько большого количества радия-223, которое может вызвать недопустимое подавление костного мозга. Исходя из предположения, что эффект киллинга опухолевых клеток будет определяться главным образом торием-227, а не его дочерними нуклидами, вероятно, что терапевтическая доза этого изотопа может быть установлена путем сравнения с другими альфа-излучателями. Например, для астата-211 терапевтическая доза для животных типично составляла 2-10 МБк на килограмм. После уточнения периода полураспада и энергии соответствующая доза для тория-227 должна составлять по меньшей мере 36-200 кБк на килограмм массы тела. Это значение должно устанавливать нижний предел для количества 227Th,которое может быть полезным при введении в расчете на терапевтический эффект. Этот расчет предполагает сравнимое удержание тория и астата. Однако ясно, что период полураспада тория, составляющий 18,7 дней, вероятнее всего, будет приводить к большей элиминации этого изотопа перед его распадом. Поэтому в норме эту вычисленную дозу следует рассматривать в качестве минимального эффективного количества. Терапевтическая доза, выраженная на основе полностью удерживаемого 227 Тh (т.е. тория 227, который не элиминирован из организма), обычно составляет по меньшей мере 18 или 25 кБк/кг,предпочтительно - по меньшей мере 36 кБк/кг, и более предпочтительно по меньшей мере 75 кБк/кг, например, 100 кБк/кг или больше. Можно было бы ожидать, что большее количество тория будет оказывать больший терапевтический эффект, но не может быть введено, если это приведет к неприемлемым побочным эффектам. Аналогично, если торий вводят в форме, имеющей короткий биологический период полураспада (т.е. полупериод перед элиминацией из организма, все еще несущего торий), то для терапевтического эффекта потребуются большие количества этого радиоизотопа из-за того, что много тория будет элиминировано до того, как он распадется. Однако будет происходить соответствующее уменьшение количества образующегося радия-223. Вышеупомянутые количества вводимого тория-227, когда этот изотоп полностью удерживается, можно легко соотнести с эквивалентными дозами с более короткими биологическими периодами полураспада. Такие расчеты приведены ниже в примерах 1 и 2. В качестве примера можно привести расчет количества 227 Тh, которое эквивалентно отдельной полностью удерживаемой дозе, с учетом пренебрежимо малого удержания в участке-мишени. В этом случаеDret означает эквивалент, полностью удерживаемую дозу; ТTh означает физический период полураспада 227 Тh (18,7 дней) и ТBio означает биологический период полураспада введенного ториевого комплекса. Таким образом, может быть легко установлена минимальная эффективная доза ториевого комплекса. Более того, биологический период полураспада можно определить, не прибегая к применению радиоактивной формы ториевого комплекса. Если радиоактивно меченое соединение высвобождает дочерние нуклиды, то важно знать судьбу этих радиоактивных дочерних нуклидов(а), если возможно. В случае тория-227 основным дочерним продуктом является 223Ra, который подвергают клинической оценке из-за его остеотропных свойств. Радий 223 очень быстро выводится из крови и концентрируется либо в скелете, либо выделяется через кишечный и почечный пути (см. Larsen, J Nucl Med 43 (5, Supplement): 160P (2002. Поэтому радий-223, высвобождающийся in vivo из 227Th, возможно, не будет сильно повреждать здоровую мягкую ткань. В исследовании распределения 227 Тh в виде растворенной соли лимонной кислоты (Mller, Int. J. Radiat. Biol. 20: 223-243 (1971 было обнаружено, что 223Ra, образующийся из 227 Тh в мягких тканях, легко перераспределялся в кость или выделялся. Таким образом, эта известная токсичность 223Ra, особенно в отношении костного мозга, по-видимому, является ограничивающим фактором при использовании 227Th in vivo. Авторы настоящего изобретения установили, что комплексы 227 Тh (например, хелатированные комплексы) после распада 227 Тh высвобождают 223Ra (см. ниже пример 6). Это может являться результатом отдачи ядра, или несовместимого хелатирования, или комбинации факторов. Это противоречит тому, что принято считать в данной области желательным свойством для альфа-излучателя (см., например,Freinendegen и др., 1998, выше), в том смысле, что альфа-излучающее соединение должно удерживать любые радиоактивные дочерние нуклиды в родительском хелатированном соединении, что является важной характеристикой безопасности. Согласно имеющимся в настоящее время данным в данной области техники можно ожидать, что максимально переносимая доза радия-223 находится в диапазоне 39-113 кБк/кг (см. ниже пример 7). В данной области техники общепринято, что должна быть утверждена реальная и осторожная оценка токсических побочных эффектов дочерних изотопов (см., например, Finendagen (1998) выше) и, таким образом, для радия-223 допустимым следует считать максимальное значение 39 кБк/кг. Можно ожидать, что при любой дозе, большей, чем эта, радий будет летальным для субъекта, что, конечно, недопустимо. Образование 223Ra in vivo будет изменяться в зависимости от времени удержания 227 Тh. В случае 100%-ного удержания, 1 кБк 227 Тh будет образовывать количество атомов 223Ra, эквивалентное инъецируемой дозе 1,6 кБк полностью удерживаемого 223Ra. Таким образом, максимально переносимая доза радия-223 39 кБк/кг эквивалентна введению 24,4 кБк/кг полностью удерживаемого 227Th. Это значительно ниже минимальной ожидаемой терапевтической дозы 36 кБк/кг, которая также установлена на основе полного удержания (см. обсуждение выше). Если удержание тория будет уменьшаться, то на единицу введенного тория будет образовываться меньше радия, но эффективность тория будет, соответственно,уменьшаться, и, следовательно, его доза должна быть увеличена. Таким образом, исходя из доступных в данной области фактов ожидали, что минимальное количество 227Th, достаточное для обеспечения терапевтического эффекта, будет больше, чем то количество, которое должно вызывать летальную миелотоксичность. Таким образом, никакого терапевтического окна для введения 227 Тh, вероятно, не может существовать. Важно, что в настоящее время авторы изобретения установили, что 223Ra может вводиться людям и переноситься ими фактически в дозе по меньшей мере 200 кБк/кг. Эти данные представлены в примере 8 ниже. Поэтому сейчас можно считать, что весьма неожиданно, что терапевтическое окно, в пределах которого млекопитающему субъекту можно вводить терапевтически эффективное количество 227 Тh (например, более 36 кБк/кг), не ожидая, что такой субъект будет испытывать нежелательный риск серьезной или даже летальной миелотоксичности, все же существует. Количество 223Ra, образующегося из 227 Тh-содержащего фармацевтического средства, будет зависеть от биологического периода полураспада этого радиоактивно меченого соединения. Идеальная ситуация состояла бы в применении комплекса с быстрым накоплением в опухоли, включая интернализацию в опухолевую клетку, прочное удержание в опухоли и короткий биологический период полураспада в нормальных тканях. Однако комплексы с меньшим чем идеальный биологическим периодом полураспада могут быть полезны до тех пор, пока доза 223Ra поддерживается в пределах допустимого уровня. Количество радия-223, образующегося in vivo, будет представлять собой показатель количества введенного тория и времени биологического удержания ториевого комплекса. Количество радия-223, образующегося в любом конкретном случае, может быть легко рассчитано специалистом, и типичные расчеты приведены в примерах 1 и 2 ниже. Максимальное вводимое количество 227 Тh будет определяться указанным количеством радия, образующегося in vivo, и должно быть меньше, чем количество, которое будет создавать недопустимый уровень побочных эффектов, в особенности миелотоксичности. Это количество обычно будет меньше 300 кБк/кг, в частности меньше 200 кБк/кг и более предпочтительно меньше 170 кБк/кг (например, меньше 130 кБк/кг).-6 008195 Таким образом, в способе по изобретению ториевый комплекс желательно вводить в дозе тория 227, равной 18-400 кБк/кг массы тела, предпочтительно 36-200 кБк/кг (например, 50-200 кБк/кг), более предпочтительно 75-170 кБк/кг, особенно предпочтительно 100-130 кБк/кг. Более того, желательно, чтобы доза тория, комплексообразующий агент и путь введения были такими, чтобы доза радия-223, образующегося in vivo, была меньше 300 кБк/кг, более предпочтительно меньше 200 кБк/кг, еще более предпочтительно меньше 150 кБк/кг, особенно предпочтительно меньше 100 кБк/кг. Вышеуказанные дозовые уровни представляют собой предпочтительно полностью удерживаемую дозу 227Th, но могут представлять собой введенную дозу, если принять во внимание, что некоторое количество 227Th будет выводиться из организма перед тем, как он распадется. Когда биологический период полураспада 227 Тh-содержащего комплекса короткий (например, менее 7 дней, в особенности, менее 3 дней), то могут понадобиться значительно большие вводимые дозы, чтобы обеспечить эквивалентную удерживаемую дозу. Так, например, согласно уравнению, представленному в этом описании выше, полностью удерживаемая доза 150 кБк/кг эквивалентна комплексу с периодом полураспада 5 дней, вводимому в дозе 711 кБк/кг. Используя это уравнение, эквивалентная вводимая доза для любой из вышеупомянутых удерживаемых доз может быть рассчитана на основе скорости биологического выведения этого комплекса. Так как распад одного ядра 227 Тh дает один атом 223Ra, удержание и терапевтическая активность 227 Тh будут напрямую связаны с дозой 223Ra, которую сможет перенести пациент. При упрощенном расчете образование 223Ra in vivo может быть связано с количеством введенного 227 Тh, при условии отсутствия какого-либо значительного удержания в ткани-мишени. В таком случае максимально переносимую дозу 227 Тh можно выразить как где ТBio означает биологический период полураспада 227 Тh-содержащего комплекса;TTh означает физический период полураспада 227 Тh, 18,7 дней;Dadd означает активность введенного 227 Тh-содержащего комплекса, кБк/кг иMaxRa означает допустимое немиелотоксическое количество 223Ra, кБк/кг, как обсуждается в этом описании. Поэтому в предпочтительном воплощении настоящего изобретения предложен способ лечения заболевания мягких тканей у млекопитающего субъекта, включающий введение указанному субъекту терапевтически эффективного количества обеспечивающего направленную доставку к мягким тканям комплекса тория-227 и комплексообразующего агента, причем указанное количество Dadd, которое рассчитывают по формуле I, приведенной ниже, такое, что в результате распада введенного тория-227 in vivo образуется допустимое немиелотоксическое количество радия-223, DRa где ТBio означает биологический период полураспада обеспечивающего направленную доставку к мягким тканям комплекса тория-227 и комплексообразующего агента;TTh означает физический период полураспада 227 Тh, 18,7 дней;Dadd означает активность введенного 227 Тh-содержащего комплекса, кБк/кг иDRa означает допустимое немиелотоксическое количество 223Ra, например, 75-200 кБк/кг. Биологический период полураспада любого конкретного, обеспечивающего направленную доставку к мягким тканям комплекса тория-227 и комплексообразующего агента, можно определить известными способами, используя нерадиоактивный торий, или путем измерения, например, характеристических гамма-излучений с использованием очень низких уровней тория-227 в комбинации с нерадиоактивным торием. Из этой формулы, например, можно видеть, что немиелотоксическая доза 223Ra 100 кБк/кг образуется из обеспечивающего направленную доставку к мягким тканям комплекса тория-227 и комплексообразующего агента, имеющего биологический период полураспада 10 дней, путем введения дозы [10018,7(10-1+18,7-1)]/1,65 = 173 кБк/кг. Конечно, желательно свести к минимуму облучение субъекта дочерним изотопом 223Ra, если свойства этого изотопа не используются с пользой. Однако для того, чтобы количество введенного 227 Тh было достаточным, необходимо, чтобы образовывалось определенное количество радия. Это количество обычно означает такое количество радия, которое является достаточным для обеспечения терапевтически эффективного введения 227 Тh, и обычно является большим, чем количество, которое раньше брали как максимально переносимое в свете ожидаемой миелотоксичности 223Ra (см. примеры 7 и 8 ниже и обсуждение выше). В частности, количество радия-223, образующегося in vivo, составляет обычно более 40 кБк/кг, например более 60 кБк/кг. В некоторых случаях необходимо, чтобы количество образующегося in vivo 223Ra составляло более 80 кБк/кг, например более 100 или 115 кБк/кг. Комплексы, меченые торием-227, в подходящих растворах-носителях можно вводить внутривенно,внутриполостно (например, внутрибрюшинно), подкожно, перорально или местно в виде однократного введения или в режиме дробного введения. Предпочтительно эти комплексы вводят в виде растворов-7 008195 парентеральным путем, в частности внутривенно, или внутриполостным путем. Предпочтительно композиции для парентерального введения по настоящему изобретению приготавливают в виде препаратов в стерильном растворе. В способах и продуктах по настоящему изобретению торий-227 может быть использован один или в комбинации с другими лечебными воздействиями, включающими хирургию, наружную лучевую радиотерапию, химиотерапию, другие радионуклиды или регулирование температуры тканей и т.д. Это создает еще одно предпочтительное воплощение способа по изобретению. В одном особенно предпочтительном воплощении субъект подвергают также лечению стволовыми клетками для уменьшения эффектов миелотоксичности, индуцированных радием-223. Согласно этому изобретению 227Th может образовывать комплексы с обеспечивающими направленную доставку комплексообразующими агентами. Обычно эти агенты имеют молекулярную массу от 100 г/моль до нескольких миллионов г/моль и предпочтительно имеют сродство к связанному с заболеванием рецептору и/или к подходящему предварительно введенному рецептору (например, биотину или авидину), связанному с молекулой, которая была направленно доставлена к участку заболевания заранее, до введения 227 Тh. Подходящие, обеспечивающие направленную доставку группировки включают в себя поли- и олигопептиды, белки, фрагменты ДНК и РНК, аптамеры и т.д., предпочтительно белок, например авидин, стрептавидин, поликлональное или моноклональное антитело (включая антитела IgG- и IgMтипа), или смесь белков, или фрагменты, или конструкции белка. Особенно предпочтительными являются антитела, конструкции антител, фрагменты антител (например, FAB-фрагменты), конструкции фрагментов (например, одноцепочечные антитела) или их смесь. Для применения по настоящему изобретению также пригодны терапевтические конъюгаты 227 Тh с пептидом, аминокислотой, стероидным или нестероидным гормоном, фолатом, эстрогеном, тестостероном, биотином или другими специфически связывающими соединениями с молекулярной массой обычно ниже 10000 г/моль. Таким образом, обычно принимают во внимание, что обеспечивающий направленную доставку к мягким тканям комплексообразующий агент представляет собой бифункциональный агент: одна группировка должна служить для комплексообразования с ионом тория, желательно в хелатированном комплексе, т.е. в комплексе, в котором торий многократно подвергается комплексообразованию, а другая группировка должна служить вектором, обеспечивающим направленную доставку этого комплекса к мягкой ткани, которая подлежит лечению. Комплексообразующая группировка может состоять из одной или более функциональных групп, присутствующих на обеспечивающей направленную доставку группировке, или может быть введена в обеспечивающую направленную доставку группировку путем химической обработки. Однако чаще комплексообразующая группировка прямо или опосредованно (например, через линкерную группировку) конъюгирована с обеспечивающей направленную доставку группировкой. Такие конструкции из активного (например, терапевтически или диагностически активного) металла комплексообразующей группировки, возможной линкерной группировки, обеспечивающей направленную доставку группировки, хорошо известны в области радиофармацевтических средств для направленной доставки и визуализирующих агентов для направленной доставки и в случае тория могут быть выбраны и сконструированы аналогичным образом. В этом отношении можно привести ссылку,например, на "Handbook of Targeted Delivery of Imaging Agents", Ed. Torchilin, CRC Press, 1995. Согласно настоящему изобретению торий-227 будет предпочтительно конъюгирован с обеспечивающей направленную доставку молекулой с использованием бифункциональных хелатообразующих агентов. Они могут представлять собой циклические, линейные или разветвленные хелатообразующие агенты. В частности, можно сослаться на полиаминополикислотные хелатообразующие агенты, которые содержат линейный, циклический или разветвленный полиазаалкановый скелет с кислотными (например, карбоксиалкильными) группами, присоединенными к азотным атомам скелета. Примеры подходящих хелатообразующих агентов включают в себя производные DOTA, такие как п-изотиоцианатобензил 1,4,7,10-тетраазациклододекан-1,4,7,10-тетрауксусная кислота (p-SCN-Bz-DOTA), и производные DTPA,такие как п-изотиоцианатобензилдиэтилентриаминпентауксусная кислота (p-SCN-Bz-DTPA), при этом первые представляют собой циклические хелатообразующие агенты, а вторые - линейные хелатообразующие агенты. Согласнонастоящему изобретению производные 1,4,7,10-тетраазациклододекан-1,4,7,10 тетрауксусной кислоты являются особенно предпочтительными хелатообразующими агентами для тория, но не известно, способны ли они образовывать координационные связи с четырехвалентными металлами, такими как торий. Неожиданно авторы настоящего изобретения обнаружили, что хотя стандартные способы не могут быть использованы для хелатирования тория с использованием производныхDOTA, нагревание производного DOTA с этим металлом обеспечивает эффективное образование хелатированного комплекса, как показано в примерах ниже. Таким образом, в еще одном аспекте настоящего изобретения предложен способ образования комплекса по изобретению или комплекса, пригодного для использования в способах по настоящему изобретению, включающий нагревание тория-227 с производным 1,4,7,10-тетраазациклододекан-1,4,7,10-тетрауксусной кислоты с образованием хелатированного тория-227 и последующее присоединение этого хелатированного тория-227 к обеспечивающей направ-8 008195 ленную доставку группировке Можно использовать любую подходящую, обеспечивающую направленную доставку группировку, такую как группировки, указанные в данном описании (например, ниже). Металлирование комплексообразующей группировки может быть выполнено до или после присоединения комплексообразующей группировки к обеспечивающей направленную доставку группировке. Однако при использовании способа нагревания, указанного выше, предпочтительно, чтобы металл был координирован до присоединения к обеспечивающей направленную доставку группировке. Предпочтительно хелатообразующие агенты представляют собой нефосфонатные молекулы, и в настоящем изобретении предпочтительно, чтобы 227 Тh не был присоединен к какому-либо фосфонату или другой группе для направленной доставки к костям. Типы соединений, обеспечивающих направленную доставку, которые могут связываться с торием 227 через хелатообразующий агент, включают в себя моноклональные или поликлональные антитела,ростовые факторы, пептиды, гормоны и аналоги гормонов, фолат и производные фолата, биотин, авидин и стрептавидин или их аналоги. Другими возможными носителями могут быть РНК, ДНК или их фрагменты, олигонуклеотиды, углеводы, липиды или соединения, образованные путем объединения таких групп с белками или без белков и т.д. Для облучения мягкой ткани с терапевтическими целями торий-227 подвергают конъюгированию с обеспечивающей направленную доставку группировкой с биосродством, предпочтительно за исключением остеотропов, липосом и фолат-конъюгированных антител или фрагментов антител. Меченные торием-227 молекулы по настоящему изобретению могут быть использованы для лечения злокачественных и доброкачественных заболеваний путем направленной доставки к рецепторам,ассоциированным с заболеванием. Обычно такое медицинское применение 227 Тh для лечения злокачественных или доброкачественных заболеваний осуществляется посредством радиоиммунотерапии, основанной на связывании 227Th с помощью хелатообразующего агента с антителом, фрагментом антитела или конструкцией антитела или фрагментами антитела. Применение 227 Тh в способах и фармацевтических средствах по настоящему изобретению является особенно подходящим для лечения любой формы злокачественного и ревматологического заболевания, особенно рака кожи, предстательной железы, шеи или молочной железы, или воспалительных заболеваний, таких как артрит или фиброз. Представленные в данном описании эксперименты in vitro с моноклональными антителами, меченными торием, показали, что торий-227 может быть связан с молекулой-носителем через бифункциональный хелатообразующий агент. Также показано, что такие 227 Тh-иммуноконъюгаты продемонстрировали специфическую связывающую активность в отношении клеток линии DAUDI лимфомы человека, экспрессирующих антиген CD20, и что с каждой клеткой может связываться подходящее количество атомов 227Th. Тем самым впервые показано, что возможна направленная доставка к рецептору посредством молекулы, меченной торием-227. Интересная особенность применения тория-227 заключается в том, что интенсивность излучения со временем будет увеличиваться из-за прироста излучения дочерних радионуклидов, т.е. доза, доставляемая к нормальным органам, может оставаться низкой во время фаз поглощения и элиминации. Это проиллюстрировано с помощью чертежа из прилагаемых графических материалов. Если бы удержание в опухоли было высоким, то мощность поглощенной дозы со временем увеличивалась бы из-за прироста дочерних нуклидов, зависящего от удержания опухолью дочернего нуклида. Однако из-за проблем, связанных с энергиями отдачи, эффективное удержание дочерних нуклидов в участке-мишени обычно требует очень специфических способов доставки, таких как доставка в липосомах, или таких, при которых радионуклид включается в минерализованную кость. Количество высвобождаемого 223Ra могло бы быть уменьшено, если бы молекула, несущая 227 Тh,имела короткий биологический период полуудержания in vivo, поскольку этот радионуклид в основном элиминируется до того, как большая часть 227 Тh распадается до 223Ra. Однако согласно настоящему изобретению для того, чтобы оставаться терапевтически эффективным, количество 227Th необходимо увеличивать. Предпочтительный биологический период полураспада in vivo составляет менее 7 дней, предпочтительно менее 4 дней и особенно предпочтительно менее 2 дней. Если комплексообразующий агент выбран таким образом, чтобы доставлять 227 Тh внутрь клеток-мишеней, то это дополнительно увеличивает специфическую цитотоксичность и уменьшает системный токсический эффект радиоактивных дочерних нуклидов из-за, по меньшей мере, частичного удержания дочерних изотопов в участке опухоли. Обе этих особенности расширяют терапевтическое окно для 227 Тh и, таким образом, образуют предпочтительные воплощения изобретения. В дополнительном воплощении изобретения пациенты с заболеванием как мягкой, так и скелетной ткани могут подвергаться лечению как с помощью 227 Тh, так и с помощью 223Ra, образующегося in vivo при введении тория. В этом особенно полезном аспекте дополнительный терапевтический компонент для лечения происходит из допустимого немиелотоксического количества 223Ra при направленной доставке к скелетному заболеванию. В этом терапевтическом способе 227Th обычно используют для лечения первичного и/или метастазирующего рака мягкой ткани путем направленной доставки к этой ткани, a 223Ra,образующийся в результате распада, используют для лечения сопутствующего скелетного заболевания у того же субъекта. Это скелетное заболевание может представлять собой метастазы в скелет, являющиеся-9 008195 результатом первичного рака мягких тканей, или может представлять собой первичное заболевание, при котором лечение мягких тканей должно противоречить лечению метастазирующего рака. Иногда заболевания мягких тканей и скелета могут быть не связаны друг с другом (например, дополнительное лечение скелетного заболевания у пациента с ревматологическим заболеванием мягких тканей). При этом документы, на которые ссылаются в данном описании, включены посредством ссылки. Изобретение теперь будет проиллюстрировано следующими не ограничивающими примерами. Примеры Основное предположение. Как правило, масса опухолевой ткани у субъекта является незначительной по сравнению с массой тела, и даже если обеспечивается значительная концентрация и удержание ториевого комплекса в опухоли, как правило, 1% тория или меньше будет попадать в опухолевую ткань у людей. Поэтому облучение мягкой ткани может быть оценено на основе выведения ториевого комплекса из всего тела. Таким образом, в примерах 1 и 2 будут пренебрегать эффектом направленной доставки к опухоли, что демонстрирует влияние биологического периода полураспада на количество 223Ra, образующегося in vivo, относительно количества введенного 227 Тh. Материалы. Ацетат аммония (АmАс), L-аскорбиновая кислота (AscA), диэтилентриаминпентауксусная кислота(NаНСО 3), тетраметиламмония ацетат (ТМАА, 90% чистоты) были получены от Aldrich (Milwaukee, WI,USA) и, если не указано иначе, чистота превышала 99%. 2-(р-Изотиоцианатобензил)-1,4,7,10 тетраазациклододекан (NCS-DOTA) был получен от Macrocyclics (Dallas, TX, USA). Бычий сывороточный альбумин (БСА) и V фракция бычьего альбумина были получены от Sigma (St. Louis, МО, USA). Фосфатно-солевой буфер (ФСБ), фетальная бычья сыворотка (FBS) и среда RPMI 1640 с глутамаксом были получены от Gibco (Paisley, Scotland, UK). В среду RPMI 1640 добавляли 15% FBS, пенициллин и стрептомицин. Анионообменник был получен от Bio-Rad Laboratories (Hercules, CA, USA). Mabthera (ритуксимаб) был получен от F.Hoffmann-La Roche AG (Basel, Switzerland). Используемая клеточная линия представляла собой CD20-положительную лимфому DAUDI, приобретенную в Европейской коллекции клеточных линий животных (ЕСАСС, Salisbury, UK). Пример 1. Оценка образования in vivo 223Ra после введения соединения, меченого торием, с 12 часовым периодом полуудержания тория во всем организме. Эффективный период полураспада 227 Тh (исходя из предположения, что фракция 227 Тh, удерживаемая в опухоли, пренебрежимо мала) будет составлять 1/T1/2 эффективный = 1/Т 1/2 физ+1/Т 1/2 биол 1/T1/2 эффективный = 0,487 дней. Фракция 227 Тh, распавшегося в организме, будет эквивалентна T1/2 эффективный/Т 1/2 физ = 0,0262, что соответствует образованию 6,1109 атомов 223Ra на 100 кБк инъецируемого 227 Тh. Токсический компонент от дочерних нуклидов должен быть примерно эквивалентен дозе радия-223 4,3 кБк 223Ra на 100 кБк (первоначальных) 227 Тh. Величина распада 0,0262 введенного тория эквивалентна 2,6 кБк полностью удерживаемого 227 Тh на каждые введенные 100 кБк. Пример 2. Оценка образования 223Ra in vivo после введения соединения, меченного торием, с 4 дневным периодом полуудержания тория во всем организме. Согласно вычислениям, произведенным как в примере 1, Т 1/2 эффективный = 3,3 дня для выведения из организма. Эта величина эквивалентна фракции 0,176 атомов Тh, распадающихся в организме. Это соответствует 4,11010 атомам 223Ra, образующихся на 100 кБк 227 Тh. Токсический компонент от дочерних нуклидов должен быть примерно эквивалентен инъецируемой дозе 29 кБк 223Ra на 100 кБк инъецируемого 227 Тh. При таком биологическом периоде полураспада 100 кБк введенного 227 Тh эквивалентно 17,6 кБк полностью удерживаемого. Пример 3: Получение 227Th. Торий-227 избирательно выделяли из смеси с 227 Ас, которая накапливала дочерние нуклиды в течение двух недель, путем добавления в смесь Ас (упаренную досуха) 0,25 мл 7 М НNО 3 и элюции этого раствора через анионообменную колонку. Колонка, содержащая приблизительно 70 мг анионообменной смолы AG-1 Х 8 (Biorad Laboratories, Hercules, CA, USA) (нитратной формы), имела внутренней диаметр 2 мм и длину 30 мм. Колонку промывали с помощью 2-4 мл 7 М НNО 3 для удаления 227 Ас, 223Ra и дочерних нуклидов Ra, при удержании 227 Тh. Затем 227 Тh удаляли с колонки несколькими миллилитрами 12 МHCl. В заключение, HCl выпаривали досуха, и 227 Тh перерастворяли в 0,2 М HCl. Пример 4. Мечение бифункционального хелатообразующего агента NCS-DOTA торием-227. Если не указано иначе, то используемые химические реагенты были получены oт Aldrich (Milwaukee, WI, USA) и имели чистоту 99% или выше. К 100 мкл 227 Тh, растворенного в 0,2 М HCl в полуграммовой пробирке, добавляли раствор, содержащий 25 мкл п-SCN-бензил-DОТА (10 мг/мл) (Macrocyclics(300 мг/мл) (90% чистоты), до рН примерно 5,5. Эту реакционную смесь выдерживали в шейкеретермостате (Thermomixer Comfort, Eppendorf AG, Hamburg, Germany) при 55 С в течение 1 ч. (Обычно это служит основанием для количественной элюции 227 Тh через 0,5 мл колонку с Sephadex C-25 с исполь- 10008195 зованием 2,5 мл 0,9%-ного раствора NaCl, тогда как 223Ra (не образующий комплексы) почти количественно удерживается на этой колонке. В контрольном эксперименте с 227 Тh в "реакционном" растворе без хелатообразующего агента также подтвердили, что более 90% и 227 Тh, и 223Ra удерживалось на колонке. Неочищенный реакционный продукт 227Th-п-SCN-бензил-DOTA использовали для мечения ритуксимаба. Пример 5. Получение радиоиммуноконъюгата (РИК) на основе 227Th. Мечение выполняли с помощью двухстадийной методики, где на первой стадии 227Th и хелатообразующий агент подвергают реакции сочетания (описано в примере 4). На второй стадии радиоактивный хелатообразующий агент присоединяют к антителу. Реакционный раствор (пример 4) добавляли к 200 мкл ритуксимаба (10 мг/мл,Mabthera, F.Hoffmann-LA Roche AG, Basel, Switzerland), и этот реакционный раствор доводили до рН приблизительно 9 путем добавления примерно 100 мкл 1 М Nа 2 СО 3/NаНСО 3. Этот реакционный раствор осторожно перемешивали на шейкере (Thermomixer Comfort, Eppendorf AG, Hamburg, Germany) при 35 С в течение 1 ч. После этого добавляли 50 мкл 10 мМ диэтилентриаминпентауксусной кислоты (DTPA,Fluka Chemie AG Buchs, Neu-Ulm, Germany) и 200 мкл 0,2 М глицина в насыщенном борате (тетраборат натрия декагидрат, от Fluka), и инкубацию продолжали в течение 5 мин. После этого реакционную смесь переносили на колонку Sephadex G-50 PD 10 и элюировали 1%-ным БСА (бычий альбумин, V фракция,Sigma Chemical Co., St. Louis, МО, USA) в ФСБ (Gibco, Paisley, Scotland, UK). Элюат собирали фракциями примерно по 0,6 мл и считали на дозкалибраторе (CRC-127R, Capintec, Ramsey, NJ, USA), и фракции,соответствующие белковому элюату, анализировали с помощью гамма-спектроскопии (детектор GEM15P и компьютерная программа Gammavision 5.20, и то и другое от EGG Ortec, Oak Ridge, TN, USA) для определения гамма-квантов 227 Тh относительно гамма-квантов 223Ra в каждой фракции перед дальнейшим использованием. Использовали следующие гамма-пики: 236,0 кэВ (относительное содержание 11,6%), 256,3 кэВ (7,4%), 329,9 кэВ (2,8%) для 227Th; 154,2 кэВ (6,0%), 269,4 кэВ (13,6%), 323,9 кэВ(3,7%) для 223Ra соответственно. Использовали фракции 6 и 7, соответствующие приблизительно 50% белкового элюата (как подтверждено элюцией 125I-меченного ритуксимаба через колонки PD-10), так как они, по существу, не содержали 223Ra. Фракции 8 и 9 содержали большие количества 223Ra, что указывает на значительное перекрывание между белком и маленькими молекулами в этих фракциях (при повторной очистке на колонке PD-10 эти две фракции давали примерно 50% 227Th во фракциях 6 и 7 из нового элюата, что подтверждало присутствие 227 Тh-ритуксимаба). На основе измерения элюированных с колонки PD-10 фракций на Ge-детекторе установлено, что суммарный выход меченого продукта составлял приблизительно 12%. С помощью препарата, хранившегося 5 дней при 8 С, показано, что конъюгат 227 Тh и антитела может быть легко очищен на колонке PD-10 с удалением 223Ra, образующегося в результате распада 227 Тh. Таким образом, было показано, что 227 Тh может быть связан с обеспечивающей направленную доставку молекулой через бифункциональный хелатообразующий агент и очищен от дочерних продуктов. При хранении образующийся дочерний продукт 223Ra обычно высвобождается из хелатообразующего агента, и при использовании очистки гель-фильтрацией/фракционированием по размеру можно выделить чистый конъюгат 227Th и антитела. Пример 6. Связывание 227 Тh-меченого антитела с клетками лимфомы человека DAUDI. Клетки DAUDI, приобретенные в Европейской коллекции клеточных линий животных (ЕСАСС,Salisbury, UK), выращивали в соответствии с инструкциями поставщика, используя клеточную среду и добавки от Gibco (Paisley, Scotland, UK) и используя флаконы объемом 500 мл для культивирования (CellStar, Greiner Bio-One GmbH, Frickenhausen, Germany). Клетки DAUDI (2107 клеток в 0,7 мл ФСБ) использовали для изучения связывания in vitro 227 Тh-меченого ритуксимаба. В качестве контроля неспецифического связывания использовали клетки DAUDI, предварительно насыщенные (блокированные) 40 мкг немеченого ритуксимаба в течение 15 мин. В тест-пробирки (полистироловые культуральные тестпробирки, 1275 мм, Elkay, Shrewsbury, MA, USA) добавляли 227 Тh-меченый ритуксимаб, соответствующий 1,3, 5,3 или 26 мкг/мл в указанном порядке. Этот эксперимент проводили в двух повторностях для каждого концентрационного уровня, используя неблокированные и блокированные клетки. Инкубацию осуществляли в течение 2 ч при 8 С. После инкубации клеточные суспензии измеряли на радиоактивность (Crystal II Multidetector, Packard Instrument Company Inc. Downers Grove, IL, USA) и промывали клетки 2 мл 1%-ного БСА (бычий альбумин, V фракция, Sigma Chemical Co., St. Louis, МО, USA) в ФСБ(Gibco, Paisley, Scotland, UK), и центрифугировали (Centrifuge 5810 R, Eppendorf AG, Hamburg, Germany) при 200 об./мин в течение 5 мин. Это промывание/центрифугирование повторяли дважды. После этого клеточные осадки измеряли на радиоактивность. Результаты (среднее двух повторностей для каждого) представлены в табл. 3 ниже. Эти результаты показывают, что 227 Тh-меченый ритуксимаб специфически связывается с клеткамиDAUDI. В среднем примерно в 12 раз больше РИК связывалось с неблокированными клетками по сравнению с блокированными. Более того, на клетку приходилось терапевтически значимое количество связанных атомов 227 Тh. Таким образом, используя бифункциональный хелатообразующий агент, полезный для связывания с антителами, пептидами и витаминами и т.д., можно получить 227 Тh-меченый РИК, способный специфически связывать терапевтически значимое количество атомов 227 Тh с опухолевыми клетками. Пример 7. Оценка токсичности 223Ra в предшествующем уровне техники. Из-за отсутствия данных по токсичности радия-223 и радия-224 для человека, предполагаемую радиотоксичность для 223Ra можно получить следующим образом, используя опубликованные данные для радия-224 на собаках. Цепь распадов (включая распады дочерних нуклидов) как 223Ra, так и 224Ra приводит к испусканию четырех альфа-частиц в расчете на атом радия. Суммарные дозы альфа-частиц из 223Ra и 224Ra, уравновешенные дочерними нуклидами, составляют примерно 26,3 и 27,1 МэВ на превращение соответственно и, следовательно, являются почти эквивалентными. Период полураспада 224Ra составляет 3,62 дня, а для 223Ra - 11,43 дня. Это означает, что на инъецируемую единицу активности доза в скелете,происходящая из 223Ra, обычно является примерно в 3,1 раза большей, чем доза из 224Ra, с учетом энергии альфа-частиц и различий в периодах полураспада и при условии долговременного биологического удержания этого радионуклида (т.е. выведение определяется физическим периодом полураспада радионуклида). Это является обоснованным предположением, поскольку Ra является аналогом Са и быстро включается в скелет. Из клеток крови сильнее всего после лечения с помощью 224Ra или 223Ra поражаются нейтрофилы. Данные из опубликованного исследования о биологических эффектах 224Ra у взрослых собак (см. Vuggenburg, Radiat Res 146: 171-186, (1996, который вводили в виде однократной внутривенной инъекции,показывают, что количество нейтрофильных клеток сильно уменьшалось при 120 и тем более при 350 кБк на кг массы тела (кБк/кг), как показано в табл. 4 ниже. Таблица 4 При 350 кБк/кг у некоторых субъектов (3 собаки из 8) наблюдали смерть, вызванную гематологической дискразией, возникающей из-за деструкции костного мозга. Поэтому можно предположить, что максимально переносимая доза 224Ra для собак находится в диапазоне от 120 до 350 кБк/кг. В пересчете на 223Ra, как описано выше, это соответствует 39-113 кБк/кг 223Ra. С учетом схожей гематологической токсичности у собак и людей, следует ожидать достижения максимально переносимой дозы для людей в пределах диапазона 39-113 кБк/кг 223Ra. Обычно следует быть осторожным при сравнении данных для двух разных видов. Однако собаки и люди очень похожи в отношении токсического влияния излучения на спинной мозг (см. Hall, "Radiobiology for the radiologist", Lippincott WilliamsWilkins, Philadelphia,PA, USA, 2000) и, таким образом, следовало бы ожидать, что эти расчеты дадут эффективную оценку максимально переносимой дозы 223Ra для людей. Пример 8. Лабораторное исследование 223Ra у людей. В 1 фазе исследования пациентам с раком молочной железы или простаты давали дозовые уровни 37, 74, 130, 170 и 200 кБк/кг 223Ra в виде однократных доз. Фракции нейтрофильных клеток служили в- 12008195 качестве чувствительного критерия контроля гематологической токсичности. Результаты представлены в табл. 5 ниже. Таблица 5 Таким образом, неожиданно обнаружили, что высокие дозовые уровни допустимы для людей, и это указывает на то, что с помощью 223Ra можно доставлять существенно более высокие дозы радиации к костным поверхностям, чем предполагалось раньше, не вызывая вредной гематологической токсичности. Пример 9. Дополнительное лабораторное исследование 223Ra у людей. Эксперимент из примера 8 выполняли с помощью дозиметрии с высокой точностью градуировки. Дозовые уровни 46, 93, 163, 213 и 250 кБк/кг 223Ra давали в виде однократных доз, а также вводили режим многократных доз. Пациенты и критерии исследования. Тридцать один пациент с метастазами в скелет (10 - от рака молочной железы, и 21 - от рака простаты) участвовали в фазе IА и фазе IВ испытаний. Пациенты с раком простаты имели возраст от 60 до 85 лет и массу тела, варьирующую от 50 до 120 кг. Все пациенты имели прогрессирующее заболевание,которое рассматривали как не поддающееся гормонотерапии. Пациенты с раком молочной железы имели возраст от 40 до 75 лет и массу тела от 50 до 95 кг. Все они пришли к повторной гормонотерапии и/или химиотерапии. Главная цель заключалась в оценке безопасности и переносимости 223Ra. Наблюдение. Период наблюдения составлял 8 дней. Дозовые уровни и режимы лечения. При испытании с применением однократной инъекции использовали следующие средние дозовые уровни: 46, 93, 163, 213 и 250 кБк/кг массы тела. На каждый дозовый уровень было распределено по пять пациентов. Были включены 15 пациентов с раком простаты и 10 пациентов с раком молочной железы. В режим повторной инъекции были включены 6 пациентов, все с раком простаты. Трем пациентам было назначено 5 доз с трехнедельными интервалами, каждая по 50 кБк/кг массы тела, и трем пациентам 2 дозы с шестинедельными перерывами, каждая по 125 кБк/кг массы тела. Клиренс крови. В разные моменты времени после инъекции забирали примерно 1 мл крови и использовали для измерения радиоактивности для того, чтобы определить профили клиренса крови у 25 пациентов, включенных в режим однократной инъекции. Определяли массу каждого образца крови и рассчитывали уровень радиоактивности на миллилитр крови (при условии, что 1 мл крови равен 1 г). Радиоактивность измеряли на счетчике с ячейкой NaI типа. Уровень этой активности сразу после инъекции рассчитывали с учетом, что первоначально в крови находилось 100% этой активности и что общая масса крови составляет 7 мас.% тела. Эти данные представлены в виде биологических данных, т.е. данных, откорректированных относительно радиоактивного распада от времени инъекции до времени измерения. Получение радионуклидов. Радий-223 получали из 227 Ас/227 Тh и очищали с использованием Ас-смолы для иммобилизации 227 Ас 227 и Th, как описано в WO 0040275. Перед дальнейшим использованием концентрированный продукт,т.е. растворенный 223RaCl2, тестировали на радионуклидную чистоту с помощью гамма-спектроскопии. Концентрат 223Ra в NaCl и цитрате натрия переводили в стерильный продукт. Корректировали изотоничность, рН, объемную активность, отбирали пробу для тестирования на патогены и пирогены, и конечный продукт вносили в стерильные ампулы, которые затем герметически закрывали с помощью резиновой мембраны, проницаемой для шприцов. Эти ампулы вставляли в свинцовые контейнеры и отправляли в госпитали. Побочные эффекты. В исследовании с возрастающими дозами не наблюдали дозоограничивающей токсичности. Имела место обратимая миелосупрессия с наиболее низким уровнем в течение 2-3 недель после инъекции и восстановлением в течение периода наблюдения. Нейтропения максимальной третьей стадии имела место у двух из 25 пациентов. На тромбоцитах была обнаружена только первая степень токсичности, даже- 13008195 при двух самых высоких дозовых уровнях. В общем, с увеличением дозового уровня наблюдалась незначительная тенденция к более высокой миелотоксичности, но этот эффект не очевидный. Наблюдали несколько неблагоприятных случаев, самым частым случаем была тошнота, имевшая место у четырех из пяти пациентов с самым высоким дозовым уровнем. Обратимую диарею 1 и 2 степени, хорошо поддающуюся лечению, наблюдали во всех группах, получающих дозы, и в целом приблизительно у 50% пациентов. В группе, получающей самую высокую дозу, рвота имела место у четырех из пяти пациентов. В группах, получающих другие дозы, этого не наблюдали. Режимы повторных инъекций. Три пациента, получающих дозы в режиме 505, не чувствовали какой-либо дополнительной токсичности, связанной с повторным лечением. По-видимому, такое сглаживание гематологических профилей объясняется режимом дробного приема доз по сравнению с однократной дозой, составляющей в сумме дозу, аналогичную пяти фракциям вместе. Неблагоприятные случаи, не связанные с 223Ra. В режиме повторного дозирования фактически только один из пациентов получил вторую дозу в режиме 1252. Из двух пациентов, которым не дали конечную дозу, один умер из-за прогрессирования метастазов в печень, а другой был признан непригодным для дальнейшего лечения из-за рецидива прежнего сердечного состояния. Миелотоксичность. Чтобы получить широкий диапазон измерения гематологической токсичности, контролировали влияние радия-223 на фракции нейтрофильных клеток, тромбоциты, количество лейкоцитов и гемоглобин. Влияние на нейтрофилы и лейкоциты было наиболее ярко выраженным, что указывало на то, что они являются чувствительными маркерами миелотоксичности. Эти результаты выражены как количество пациентов, демонстрирующих в исследовании определенный уровень токсичности по степени токсичности, оцениваемой по шкале ОКТ (общий критерий токсичности от англ. СТС, Common Toxicity Criteria),и представлены в табл. 6 ниже. Таблица 6 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ лечения заболевания мягких тканей у млекопитающего субъекта, включающий введение указанному субъекту терапевтически эффективного количества обеспечивающего направленную доставку к мягким тканям комплекса тория-227 и комплексообразующего агента, причем указанное количество является таким, что в результате распада введенного тория-227 in vivo образуется допустимое немиелотоксическое количество радия-223, при этом торий-227 конъюгирован с обеспечивающей направленную доставку группировкой с биосродством, за исключением остеотропов, липосом и фолатконъюгированных антител или фрагментов антител, и где терапевтически эффективное количество тория-227 составляет по меньшей мере 25 кБк/кг.- 14008195 2. Способ по п.1, где указанный субъект представляет собой человека или собаку. 3. Способ по п.1 или 2, где указанное терапевтически эффективное количество тория-227 составляет по меньшей мере 75 кБк на килограмм массы тела. 4. Способ по любому из пп.1-3, где указанное допустимое немиелотоксическое количество радия 223 составляет менее 300 кБк на килограмм массы тела. 5. Способ по п.4, где указанное допустимое немиелотоксическое количество радия-223 составляет менее 150 кБк на килограмм массы тела. 6. Способ по любому из пп.1-5, где указанный комплекс содержит хелатированный торий-227, связанный с лигандом, выбранным из группы антител, конструкций антител, фрагментов антител, конструкций фрагментов антител и их смесей. 7. Способ по любому из пп.1-6, где указанное заболевание мягких тканей представляет собой злокачественное заболевание. 8. Способ по п.7, где злокачественное заболевание представляет собой заболевание, выбранное из группы карцином, сарком, миелом, лейкозов, лимфом и раковых заболеваний смешанного типа. 9. Способ по любому из пп.1-8, где указанного субъекта лечат также с целью противодействия миелотоксичности образующегося в нем радия-223. 10. Способ по п.9, где указанного субъекта лечат стволовыми клетками. 11. Способ лечения заболевания мягких тканей у млекопитающего субъекта, включающий введение указанному субъекту терапевтически эффективного количества обеспечивающего направленную доставку к мягким тканям комплекса тория-227 и комплексообразующего агента, причем указанное количество, Dadd, которое рассчитывают по формуле I, приведенной ниже, такое, что в результате распада введенного тория-227 in vivo образуется допустимое немиелотоксическое количество радия-223, DRa где ТBio означает биологический период полураспада указанного обеспечивающего направленную доставку к мягким тканям комплекса тория-227 и комплексообразующего агента; ТTh означает физический период полураспада 227Th (18,7 дней);Dadd означает активность введенного комплекса 227 Тh (кБк/кг) и равно по меньшей мере 25 кБк/кг иDRa означает допустимое немиелотоксическое количество 223Ra; и при этом торий-227 конъюгирован с обеспечивающей направленную доставку группировкой с биосродством, за исключением остеотропов, липосом и фолат-конъюгированных антител или фрагментов антител. 12. Способ по п.11, где DRa равно 200 кБк/кг. 13. Способ по любому из пп.1-12 в комбинации по меньшей мере с одним дополнительным лечебным воздействием, выбранным из хирургии, наружной лучевой радиотерапии, химиотерапии, эндорадионуклидной терапии радионуклидами, отличными от 227 Тh, и/или регулирования температуры тканей. 14. Фармацевтическая композиция, содержащая обеспечивающий направленную доставку к мягким тканям комплекс тория-227 и комплексообразующего агента вместе по меньшей мере с одним фармацевтическим носителем или эксципиентом, где торий-227 конъюгирован с обеспечивающей направленную доставку группировкой с биосродством, за исключением остеотропов, липосом и фолатконъюгированных антител или фрагментов антител, и где торий-227 присутствует в терапевтически эффективном количестве по меньшей мере 25 кБк/кг. 15. Обеспечивающий направленную доставку к мягким тканям комплекс тория-227 и комплексообразующего агента, где торий-227 конъюгирован с обеспечивающей направленную доставку группировкой с биосродством, за исключением остеотропов, липосом и фолат-конъюгированных антител или фрагментов антител, и где торий-227 присутствует в количестве эффективной дозы, равной по меньшей мере 25 кБк/кг. 16. Комплекс по п.15, где торий-227 хелатирован производным 1,4,7,10-тетраазациклододекан 1,4,7,10-тетрауксусной кислоты. 17. Способ образования комплекса по п.16, включающий нагревание указанного тория-227 с указанным производным 1,4,7,10-тетраазациклододекан-1,4,7,10-тетрауксусной кислоты с образованием хелатированного тория-227 и последующее присоединение указанного хелатированного тория-227 к обеспечивающей направленную доставку группировке. 18. Набор для использования в способе по любому из пп.1-13, включающий раствор обеспечивающего направленную доставку к мягким тканям комплекса тория-227 и комплексообразующего агента вместе с инструкциями для использования указанного раствора в указанном способе, где торий-227 конъюгирован с обеспечивающей направленную доставку группировкой с биосродством, за исключением остеотропов, липосом и фолат-конъюгированных антител или фрагментов антител. 19. Набор для использования в способе по любому из пп.1-13, включающий комплексообразующий агент, способный образовывать комплекс с ионами тория, где указанный комплексообразующий агент не является обеспечивающим направленную доставку к мягким тканям комплексообразующим агентом,- 15008195 соединение, обеспечивающее направленную доставку к мягким тканям, возможно вместе с линкерным соединением, которое может быть конъюгировано с указанным комплексообразующим агентом с получением обеспечивающего направленную доставку к мягким тканям комплексообразующего агента, и инструкции для приготовления обеспечивающего направленную доставку к мягким тканям комплекса тория-227 и комплексообразующего агента, и также возможно для использования указанного комплекса в указанном способе, где обеспечивающий направленную доставку к мягким тканям комплекс представляет собой группировку с биосродством, за исключением остеотропов, липосом и фолатконъюгированных антител или фрагментов антител.
МПК / Метки
МПК: A61K 51/04, A61P 35/00
Метки: заболеваний, применение, терапии, тория, лучевой, тканей, мягких
Код ссылки
<a href="https://eas.patents.su/17-8195-primenenie-toriya-227-v-luchevojj-terapii-zabolevanijj-myagkih-tkanejj.html" rel="bookmark" title="База патентов Евразийского Союза">Применение тория- 227 в лучевой терапии заболеваний мягких тканей</a>
Предыдущий патент: Способы обнаружения амниотической жидкости во влагалищном секрете и устройства для реализации указанных способов
Следующий патент: Твердая лекарственная форма для перорального применения
Случайный патент: Вспомогательная опорная рамка для по меньшей мере одной единицы электрооборудования