Способ сайт-специфичного получения конъюгатов рилизинг-фактора гормона роста человека и полиэтиленгликоля, конъюгаты, полученные данным способом, и их применение в производстве лекарственного средства
Номер патента: 4269
Опубликовано: 26.02.2004
Авторы: Веронезе Франческо Мария, Скьявон Оддоне, Каличети Паоло
Формула / Реферат
1. Способ сайт-специфичного получения конъюгатов рилизинг-фактора гормона роста человека и полиэтиленгликоля (hGRF-PEG), содержащих одно или несколько звеньев PEG (в расчете на hGRF), ковалентно связанных с Lys12 и/или Lys21 и/или Na, отличающийся тем, что реакцию конъюгирования между пептидом hGRF и активированным PEG осуществляют в растворе и целевой конъюгат hGRF-PEG выделяют из реакционной смеси и очищают.
2. Способ по п.1, в котором раствор представляет собой концентрированный водный раствор никотинамида или водный буферный раствор денатурирующего агента.
3. Способ по п.1, в котором растворитель представляет собой полярный органический растворитель, выбранный из диметилсульфоксида, смеси диметилформамида и буфера или смеси ацетонитрила и буфера.
4. Способ по п.1, в котором конъюгат hGRF-PEG выделяют из реакционной смеси и очищают хроматографическими методами.
5. Способ по любому из предшествующих пунктов, в котором пептид hGRF представляет собой hGRF(1-29)-NH2.
6. Способ по п.1, в котором перед реакцией конъюгации с PEG пептид hGRF защищают по одному или нескольким из положений Na, Lys12 и Lys21.
7. Способ по п.1 или 6, который включает снятие защиты после реакции конъюгации с PEG.
8. Способ по любому из предшествующих пунктов, в котором активированный PEG является алкилирующим или ацилирующим PEG в монометоксилированной форме.
9. Конъюгат hGRF-PEG, полученный способом по любому из пп.1-8, содержащий один или несколько звеньев PEG (в расчете на hGRF), ковалентно связанных с Lys12, и/или Lys21, и/или Na.
10. Конъюгат hGRF-PEG по п.9, в котором одно звено PEG ковалентно связано с Lys12.
11. Конъюгат hGRF-PEG по п.9, в котором одно звено PEG ковалентно связано с Lys21.
12. Конъюгат hGRF-PEG по п.9, в котором одно звено ковалентно связано и с Lys12, и с Lys21.
13. Конъюгат hGRF-PEG по п.9, в котором одно звено ковалентно связано с каждым из Lys12, Lys21 и Na.
14. [Lys(Alloc)12,21]-hGRF в качестве промежуточного соединения в реакции конъюгации с PEG по п.1.
15. [Na-изопропил-Tyr1, Lys(Alloc)12]-hGRF в качестве промежуточного соединения в реакции конъюгации с PEG по п.1.
16. Применение конъюгатов по любому из пп.9-13 в производстве лекарственных средств для лечения, профилактики или диагностики нарушений, связанных с гормоном роста.
17. Применение по п.16 в производстве лекарственного средства для лечения или диагностики недостаточности гормона роста.
Текст
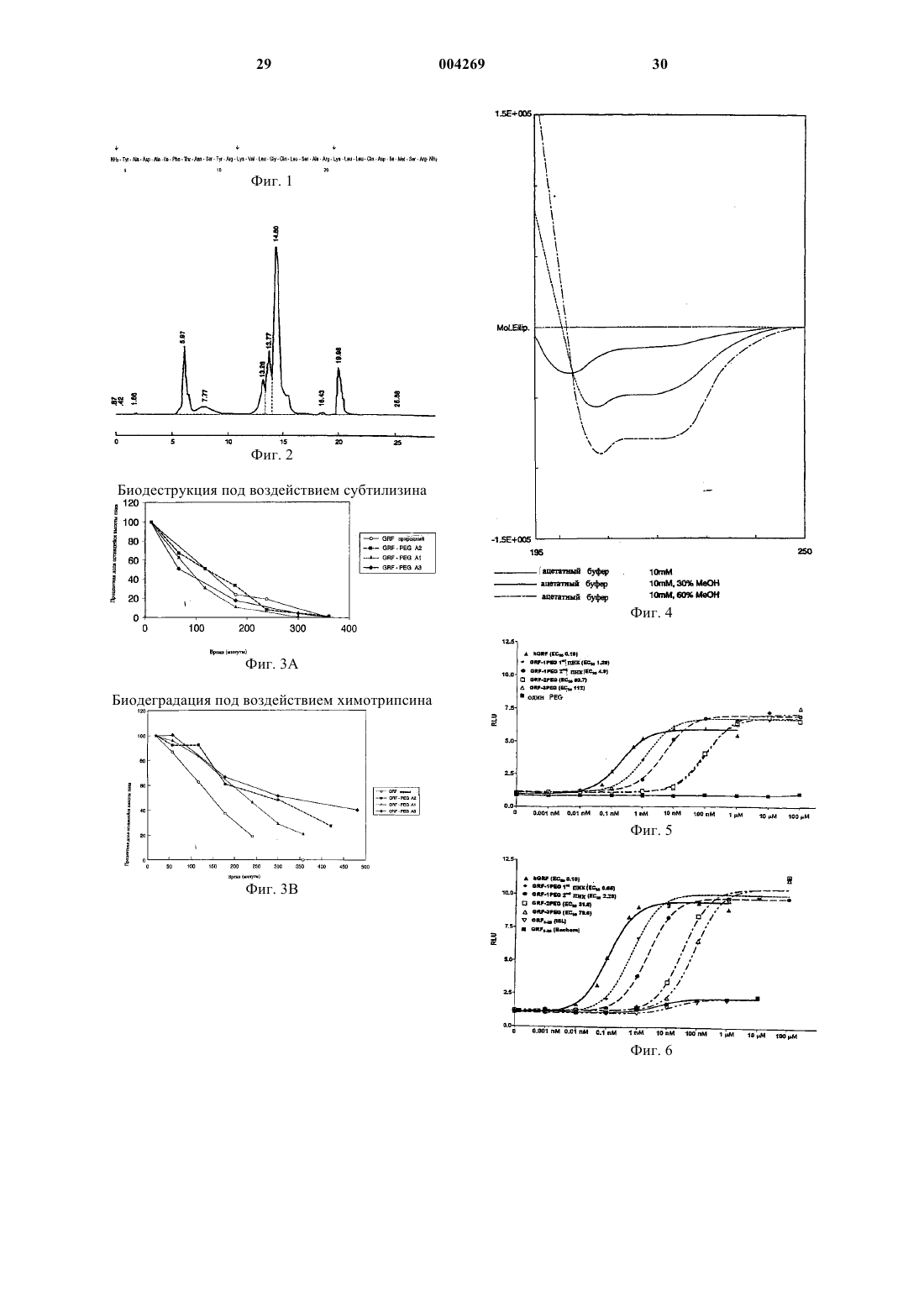
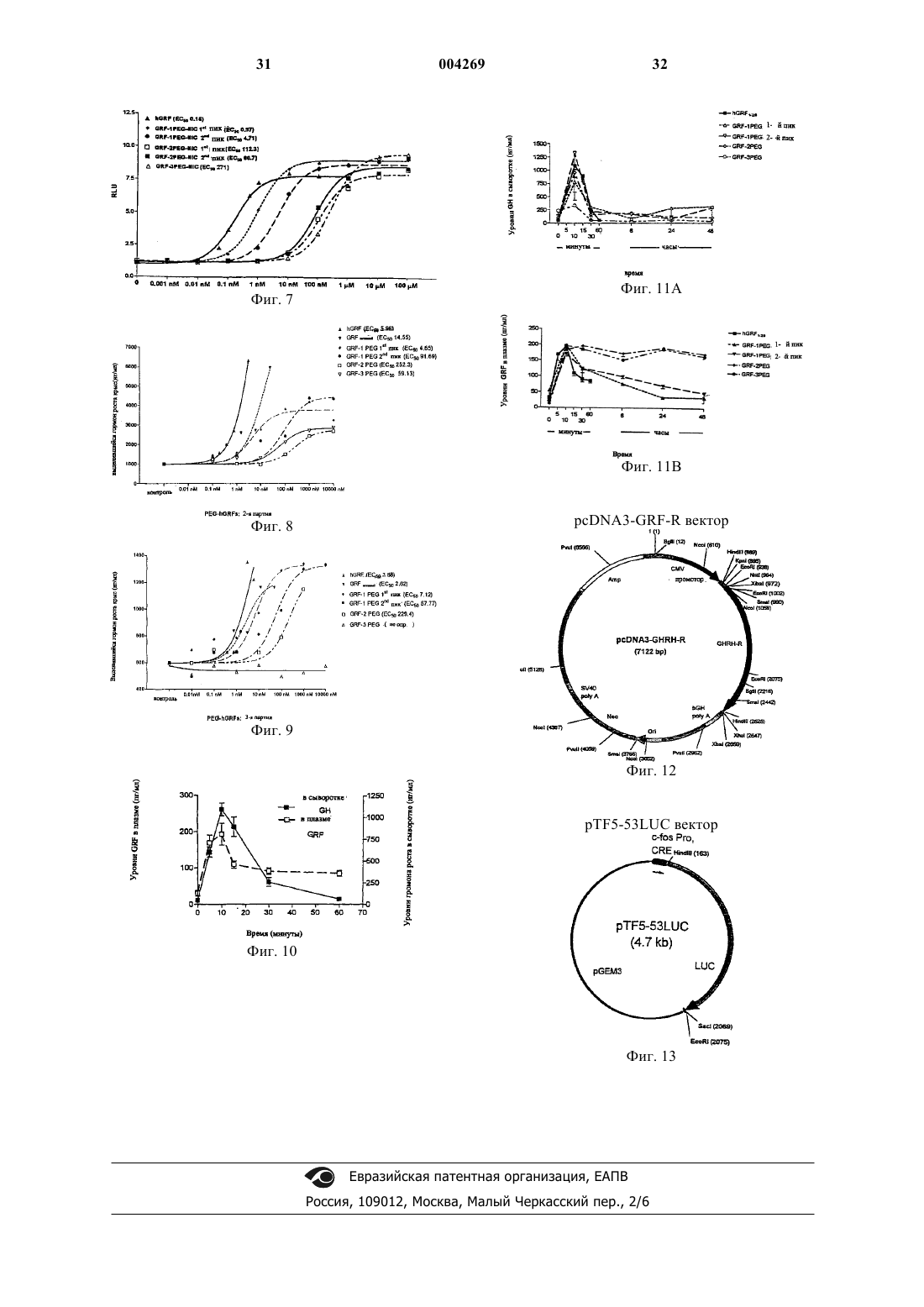
1 Область изобретения Настоящее изобретение относится к способу сайт-специфичного получения конъюгатовbGRF-PEG, содержащих одну или несколькоPEG единиц (в расчете на hGRF), ковалентно связанных с Lys12 и/или Lys21 и/или N, отличающемуся тем, что реакцию конъюгирования между пептидом hGRF и активированным PEG проводят в растворе и целевой продукт - конъюгат hGRF-PEG очищают хроматографическими методами. Конъюгаты, полученные данным способом, а также их применение для лечения, профилактики и диагностики заболеваний, связанных с гормоном роста, также составляют объект настоящего изобретения. Предпосылки изобретения В начале 1980-х несколько групп исследователей выделили и охарактеризовали рилизингфактор гормона роста (GRF).GRF (называемый также соматорелин) представляет собой пептид, секретируемый гипоталамусом, который действует на свой рецептор и может способствовать высвобождению гормона роста (GH) из передней доли гипофиза. Он представляет собой пептид из 44, 40 или 37 аминокислотных остатков; его форма, состоящая из 44 аминокислотных остатков, может быть физиологически превращена в формы с более короткими последовательностями. Сообщается, что все три формы являются активными, причем активность сосредоточена, в основном, в первых 29 аминокислотных остатках. Синтетический пептид, соответствующий 1-29 аминокислотам последовательности человеческого GRF[hGRF(1-29)], называемый также серморелином, был получен с помощью технологии рекомбинантных ДНК, как описано вeвропейском патенте ЕР 105759. Серморелин в форме ацетата был использован для диагностики и лечения недостаточности гормона роста.GRF обладает реальной терапевтической ценностью при лечении определенных связанных с гормоном роста заболеваний. Использование GRF для стимулирования высвобожденияGH представляет собой физиологический метод ускорения роста длинных костей или анаболизма белков. Одна проблема, связанная с использованием GRF, касается его короткого биологического времени полужизни (от около 12 до 30 мин).hGRF(1-29)-NH2 подвергается ферментативному разрушению и быстро разрушается в плазме под воздействием дипептидилпептидазы IV-(DPPIV) в точке между остатками Аlа 2 и Asp3. Таким образом целесообразно разработать биологически стабильные, длительно действующие аналоги GRF путем специфической химической модификации GRF для того, чтобы воспрепятствовать или уменьшить деградацию под воздействием фермента. 2 Полиэтиленгликоль (PEG) - этот гидрофильный биосовместимый и нетоксичный полимер общей формулы H(OCH2CH2)nOH, гдеn4. Его молекулярная масса может варьировать от 200 до 20 000 дальтон. Было показано, что химическая конъюгация PEG в его монометоксилированной форме с белками и/или пептидами значительно увеличивает продолжительность их биологического действия. Подобно углеводным остаткам в гликопротеине, PEG обеспечивает защитное окружение и увеличивает размер молекулы, уменьшая тем самым его метаболическое разрушение и скорость его выведения почками. Конъюгация с PEG является уже разработанной совокупностью способов доставки пептидов и белков, приоритет в которых принадлежит фундаментальным исследованиям Davis,Abuchowski (Abuchowski et al., 1977a и 1977b). Конъюгация PEG с пептидами или белками обычно приводит к неспецифическому химическому присоединению PEG к нескольким аминокислотным остаткам. Одним из ключевых вопросов в данной технологии является, таким образом, изыскание подходящих химических способов ковалентного связывания молекулы(молекул) PEG с определенными аминокислотными остатками. Например, активированный трихлортриазином PEG, относительно которого было установлено, что он токсичен и взаимодействует неспецифическим путем, был позднее заменен различными PEG реагентами с химическими линкерами, которые могли специфично взаимодействовать с аминогруппами (Benchamp et al.,1983; Veronese et al., 1985; Zalipsky et al., 1983;Zalipski et al., 1990; and Delgado et al., 1990), с сульфгидрильными группами (Sartore et al.,1991; and Morpurgo et al., 1996) или с остатками гуанидина (Pande et al., 1980). Было установлено, что различные PEG белковые конъюгаты защищены от протеолиза и/или обладают уменьшенной иммуногенностью (Monfardini et al., 1995; and Yamsuki et al.,1988). Другая техническая трудность, сопровождающая Конъюгацию с PEG белков, возникает в связи с тем, что конъюгаты белков с PEG обычно имеют различное количество присоединенных молекул PEG, и это приводит к получению смеси конъюгатов с различной стехиометрией PEG:белок. Сайт-специфичная конъюгация с PEG остается химической проблемой. Конъюгирование PEG и GH представляет собой типичный пример, отражающий эту проблему(Clark et al., 1996). Было показано, что конъюгация с PEG Lys-остатков GH происходит по случайным положениям. Для того, чтобы избежать или уменьшить воздействие фермента, активный сайт сначала должен быть защищен с тем, чтобы конъюгацияPEG с ферментом происходила в неактивном сайте(-ах) (Caliceti et al., 1993). Недавно был предложен другой подход для сайт-специфичного конъюгирования PEG с низкомолекулярными пептидами, такими какGRF, который получали твердофазным пептидным синтезом. В этих конъюгатах предварительно полученную и конъюгированную с PEG аминокислоту вводили в пептидную цепочку с помощью твердофазного синтеза. Эта процедура, однако, требует весьма сложной очистки продукта, что, как известно, является пилигтирующей стадией при твердофазном синтезе. Наличие PEG, в силу его высокой молекулярной массы и полидиспергируемости, с большой вероятностью приводит к получению целевого продукта с нежелательными примесями и/или продуктов с пропусканием (недостачей) аминокислотных остатков, причем последнее обычно происходит при использовании метода Merrifield'a. Недавно в литературе сообщалось (Felix etal., 1995) о присоединении только одной молекулы PEG к специфичному аминокислотному остатку [Ala15]-hGRF(1-29)-NH2 с использованием твердофазного синтеза. В этом исследовании показано, что [Аlа 15]-hGRF(1-29)-NH2, конъюгированный с PEG в положениях 21-го или 25-го остатков, полностью сохраняет активность invitro no сравнению с исходным [Ala15]-hGRF(129)-NH2. Однако отсутствуют данные, показывающие, проявляют ли эти конъюгированные сPEG конъюгаты более продолжительное время свою активность in vivo по сравнению с неконъюгированным с PEG аналогом. Совсем недавно было показано (Campbellet al., 1997), что присоединение PEG с различными молекулярными массами к С-концу различных аналогов hGRF, опять же при использовании твердофазного синтеза, увеличивает продолжительность сохранения активности при испытаниях как на свиньях, так и на мышах, по сравнению с неконъюгированным с PEG аналогом. Описание изобретения В противоположность методу твердофазного получения моноконъюгированного с PEGhGRF, упомянутому выше, настоящее изобретение относится к сайт-специфичному конъюгированию с PEG hGRF в растворе. Установлено,что hGRF имеет низкую растворимость в нейтрально-щелочном буферном растворе, в результате чего имеет место химическое условие для наиболее эффективного осуществления реакции конъюгации с PEG. В разбавленном растворе гидролиз активированного PEG (например, PEG-эфира) имеет тенденцию к уменьшению выхода реакции конъюгации с PEG. В данном изобретении установлено, что в подходящем растворителе, обеспечивающем высокую растворимость hGRF, можно осуществлять реакцию сайт-специфичного конъюгиро 004269 4 вания с PEG в жидкой фазе. В этом случае, даже если исходный пептид hGRF незащищен, PEGцепочки будут связываться с высокими выходами и почти исключительно с первичными аминогруппами (-aминогруппами) Lys12, Lys21 и/или N в зависимости от условий реакции. Были получены следующие четыре конъюгата,которые входят в объем настоящего изобретения, со стехиометрическим соотношениемhGRF:PEG в конъюгатах, зависящим главным образом от молярного соотношения hGRF и"N" означает в описании данного изобретения аминогруппу на N-конце пептида (Туr). После этой стадии можно осуществлять простое хроматографическое фракционирование конъюгатов, полученных согласно указанной реакции, либо гель-фильтрацией, либо путем непосредственного нанесения на колонку С 18 ВЭЖХ с элюцией градиентом смеси воды и ацетонитрила. Второй способ предпочтительнее,т.к. можно получить и очистить большие количества продуктов. Поэтому главным объектом настоящего изобретения является способ сайтспецифичного получения различных конъюгатов hGRF-PEG, содержащих один или несколько PEG-фрагментов (в расчете на hGRF), ковалентно связанных с Lys12, и/или Lys21, и/или N,характеризующийся тем, что реакцию конъюгации с PEG проводят в растворе и целевой конъюгат hGRF-PEG очищают, например, хроматографическими способами. Конъюгаты hGRF и PEG, содержащие один или несколько PEG-фрагментов (на мольLys21, и/или N, также являются объектом настоящего изобретения. Предпочтительными продуктами настоящего изобретения являются конъюгаты hGRF-PEG, в которых 1 молекулаPEG ковалентно связана с Lys12 и/или Lys21. Согласно другому воплощению данного изобретения, если одна или более из этих трех аминогрупп, к которым присоединены цепочкиPEG, обратимо защищены определенными химическими группами от конъюгации с PEG, реакция конъюгации с PEG будет давать непосредственно целевой конъюгат со специфичными сайгами конъюгации с PEG, который можно затем выделить из реакционной смеси, например, ультрафильтрацией или другими хромато 5 графическими методами. В этом случае способ получения может далее необязательно включать реакцию снятия защиты. Реакцию снятия защиты предпочтительно осуществляют известными способами и в зависимости от химической природы защитных групп, которые следует удалить. В соответствии с изобретением имеется в виду, что под термин hGRF, если только это специально не оговорено, подпадают любые пептиды GRF человека, в особенности, это касается пептидов 1-44, 1-40, 1-29 и соответствующих им амидов (содержащих амидную группу на N- и С-концах). Предпочтительным пептидомhGRF является gGRF(1-29)-NH2, аминокислотная последовательность которого приводится в"Активированный PEG" (или PEGконъюгирующий агент) представляет собой любое производное PEG, которое может быть использовано для модификации белков благодаря тому, что оно содержит функциональную группу, способную взаимодействовать с некоторыми функциональными группами в молекуле белка/пептида с получением конъюгата PEG с белком или пептидом. Обзор производных PEG,которые могут использоваться в качестве модификаторов белков, может быть найден у Harris(1985). Активированный PEG может быть алкилирующим реагентом, таким как альдегидное или эпоксидное производные PEG, PEGтрезилат, или он может быть ацилирующим реагентом, таким как сложный эфир PEG. Активированный PEG предпочтительно используют в монометоксилированной форме. Он предпочтительно имеет молекулярную массу между 2000 и 20000. Монометоксилированный РЕG5000 особенно предпочтителен для получения активированного PEG согласно изобретению. Если активированный PEG является ацилирующим агентом, он предпочтительно содержит остаток либо норлейцина, либо орнитина,связанный с остальной частью молекулы PEG с помощью амидной связи. Эти остатки позволяют сделать точное определение присоединившихся фрагментов PEG на моль пептида (см. для примера Sartore et al., 1991). Поэтому особенно предпочтительным активированным PEG является Монометоксилированный РЕG500, связанный с помощью амидной связи с альфааминогруппой норлейцина, так что карбоксигруппа превращается в сукцинимидную эфирную группу.PEG с разветвленной цепью также могут использоваться. Разветвленные PEG могут быть представлены как R(-PEG-OH)m, в которых R представляет собой центральный сердцевинный остаток молекулы, такой как пентаэритрит или глицерин, a m показывает количество разветвлений. Количество разветвлений (m) может варьировать от трех до ста и более. Гидроксиль 004269 6 ные группы могут быть химически модифицированы. Другая разветвленная форма, такая как, например, описанная в заявке на выдачу патента РСТ WO 96/21469, имеет единственную группу на конце молекулы, которая может быть подвергнута химической модификации. Этот тип PEG может быть представлен как (СН 3 О-РЕG-)рR-Х, где р равно 2 или 3, R представляет собой центральную сердцевинную часть молекулы, такую как лизин или глицерин, а Х представляет собой функциональную группу, такую как карбокси,которую можно химически активировать. Еще одна разветвленная форма имеет реакционноспособные группы, такие как карбоксигруппы,распределенные вдоль основной цепочки молекулы PEG, а не на концах PEG-цепей. Все эти разветвленные PEG и могут быть активированы, как показано выше. Под хроматографическими методами подразумевают любой метод, использующийся для выделения компонентов из смеси путем нанесения на носитель (в стационарной фазе), через который пропускают растворитель (подвижная фаза). Принципы хроматографического выделения базируются на различиях физической природы стационарной и подвижной фаз. Некоторые разновидности хроматографических методов, которые хорошо известны из литературы, включают жидкостную, жидкостную высокого давления, ионообменную, адсорбционную, аффинную, разделительную, гидрофобную,обращенно-фазовую,гельфильтрационную, ультрафильтрационную или тонкослойную хроматографию. Конъюгация с PEG - это реакция, с помощью которой на основе активированного PEG и белка или пептида получают PEG - белок/пептидный соответствующий конъюгат. Молярное соотношение PEG: hGRF может быть 1:1, 2:1 или 3:1 в зависимости от того, какой конъюгат получен с высокими выходами. Растворитель для реакции конъюгации сPEG выбирают из группы, состоящей из высококонцентрированного водного раствора никотинамида, водного буферного раствора денатурирующего агента (такого как мочевина), или им может быть полярный органический растворитель, выбранный из диметилсульфоксида,смеси диметилформамида с буфером или смеси ацетонитрила с буфером. рН раствора обычно поддерживают между 7 и 9. Перечень химических защитных групп для(1-(1'-Адамантил)-1-метил-этоксикарбонил) или 2-Cl-Z (2-Хлор-бензилоксикарбонил). Alloc является предпочтительной защитной группой для лизиновой группы. После конъюгации c PEGAlloc может быть удален одним из способов, 7 описанных в Greene et al. (1991). Dde может быть удален 2% гидразином в ДМФ (см. W.C.Chan et al., 1995). Adpoc может быть удален аналогично Alloc (см. также Dick F.et al., 1997). Для снятия 2-Cl-Z может потребоваться более сильная кислота (HF, ТFМSА, НВr) или гидрирование (см. также Fam et al., 1987). Защитные группы для N могут представлять собой алкильные группы, такие как метил,этил, пропил, изопропил, бутил, трет-бутил,бензил или циклогексил. Предпочтительной группой является изопропил. Эти алкильные группы могут быть введены восстановительным алкилированием (см. Murphy et al., 1988 или[Lys-(Alloc)12,21]-hGRF также входят в объем настоящего изобретения как новые и используемые в качестве промежуточных соединений в реакции конъюгации с PEG. Было также установлено, что конъюгация сPEG согласно изобретению 1) не изменяет конформации пептида,2) увеличивает устойчивость к протеолитическому разложению,3) не влияет или лишь очень слабо понижает биологическую активность в зависимости от степени конъюгации с PEG и 4). позволяет получать продукты (конъюгаты), которые обладают большей растворимостью в водных буферных растворах. Другим объектом настоящего изобретения являются конъюгаты hGRF-PEG с высокой степенью чистоты, применимые в фармацевтических композициях в качестве активных ингредиентов. Другим аспектом настоящего изобретения является применение конъюгатов изобретения в качестве лекарственного средства для лечения,профилактики или диагностики нарушений,связанных с гормоном роста, например, недостаточности гормона роста, в особенности, недостаточности гормона роста у детей. Лекарственное средство предпочтительно находится в форме фармацевтической композиции, содержащей кoнъюгаты по изобретению вместе с одним или несколькими фармацевтически приемлемыми носителями и/или наполнителями. Такие фармацевтические композиции составляют еще один объект настоящего изобретения. Реализация изобретения заключается в введении фармакологически активного количества конъюгатов данного изобретения лицам,подверженным риску развития связанного с гормоном роста заболевания или уже имеющим такую патологию. Другой объект данного изобретения представляет собой способ лечения, профилактики или диагностики расстройств, связанных с гормоном роста, предусматривающий введение 8 эффективного количества конъюгатов по изобретению в присутствии одного или нескольких фармацевтически приемлемых наполнителей. Термин Эффективное количество означает количество активных ингредиентов, достаточное для оказания эффекта на течение и тяжесть вышеописанных нарушений, приводя к облегчению или ремиссии этой патологии. Эффективное количество будет зависеть от способа введения и состояния пациента. Фармацевтически приемлемый означает любой носитель, который не препятствует проявлению биологической активности активного ингредиента и нетоксичен для пациента, которому он вводится. Например, для парентерального введения вышеупомянутые активные ингредиенты могут быть представлены в виде составов в дозировочных формах для инъекций,таких как солевые, декстрозные растворы, раствор сывороточного альбумина и раствора Рингера. Помимо фармацевтически приемлемого носителя композиции по изобретению могут включать минорные количества таких добавок,как стабилизаторы, наполнители, буферы и консерванты. Может использоваться любой тип введения, совместимый с активным началом. Предпочтительным является парентеральное введение, такое как подкожная, внутримышечная или внутривенная инъекция. Доза активного ингредиента, которую нужно ввести, зависит в основном, от медицинских показаний, в соответствии с возрастом, массой тела и индивидуальной реакцией больного. Доза активного ингредиента для лечения человека может составлять от 5 до 6000 мкг/кг массы тела и предпочтительно составляет от 10 до 3000 мкг/кг массы тела. Настоящее изобретение описано со ссылкой на конкретные формы его воплощения, но содержание описания включает все модификации, которые могут быть выполнены специалистом в данной области, без выхода за пределы объема притязаний. Далее изобретение будет описано с помощью примеров, которые не следует воспринимать как ограничивающие настоящее изобретение. Примеры будут соотнесены с графическими материалами, пояснения к которым приводятся ниже. Описание графических материалов На фиг. 1 показаны аминокислотная последовательность hGRF(1-29)-NH2. Стрелками показаны возможные сайты конъюгации с PEG. На фиг. 2 показаны данные ВЭЖХ с обращенной фазой смеси, полученной после реакции конъюгации с PEG в DMSO, проведенной как описано в примере 1. Первые два больших пика соответствуют конъюгатам, содержащим 1 PEG цепочку на моль hGRF. Следующий минорный 9 пик соответствует конъюгату с соотношениемhGRF:PEG и последний минорный пик соответствует конъюгату с соотношением hGRF:3PEG. На фиг. 3A показано разложение hGRF(129) и конъюгатов PEG настоящего изобретения под воздействием субтилизина. На фиг. 3B показано разложение hGRF(129) и конъюгатов PEG настоящего изобретения под воздействием химотрипсина. На фиг. 4 показана спектроскопическая характеристика [Lys(MPEG5000-CH2-CO-Nle-CO)12,21hGRF(1-29)-NH2], полученную путем кругового дихроизма. Спектры являются весьма впечатляющими по сравнению с таковыми нативногоhGRF. На фиг. 5 показан биологический эффект различных конъюгатов hGRF-PEG (от 1-гоDMSO получения) в CHO-hGRFR-LUC в исследованиях in vitro. Данные отображают средние результаты трех независимых экспериментов. На фиг. 6 показан биологический эффект различных конъюгатов hGRF-PEG (от 2-гоDМSО получения) в CHO-hGRFR-LUC в исследовании in vitro. Данные отображают средние результаты двух независимых экспериментов. На фиг. 7 показан биологический эффект различных конъюгатов hGRF-PEG (получены с никотинамидом) в CHO-hGRFR-LUC исследовании in vitro. Данные отражают средние результаты двух независимых экспериментов. Фиг. 8 иллюстрирует биологическое действие различных конъюгатов hGRF-PEG (1-еDMSO получение) на выделение GH из клеток гипофиза крысы in vitro. Фиг. 9 показывает биологическое действие различных конъюгатов hGRF-PEG (2-е DMSO получение) на выделение GH из клеток гипофиза крысы in vitro. Фиг. 10 показывает кривую динамики зависимости уровней hGRF в плазме и GH в сыворотке в зависимости от hGRF (400 мкг/крыса),при внутривенной инъекции крысам-самцам. Каждая точка представляет значениевеличинаSEM, полученное на 9 крысах. Фиг. 11 А (см. первый график на странице) показывает кривую динамики во времени зависимости уровней сывороточного GH после i.v. инъекции 400 мкг/крыса конъюгатов hGRF-PEG(DMSO получение) крысам-самцам. Каждая точка показывает значение, полученное для трех крыс. Фиг. 11 В (см. второй график на странице) показывает кривую динамики зависимости уровней hGRF плазмы после i.v. инъекции 400 мкг/крыса конъюгатов hGRF-PEG (DMSO получение) крысам-самцам. Каждая точка показывает значение, полученное для трех крыс. На фиг. 12 представлена карта рестрикции плазмиды рс DNA3-hGRF-R, используемая в исследовании маркерного гена для определения 10 На фиг. 13 показана карта рестрикции плазмиды pTF5-53-LUC, используемая в исследовании маркерного гена для определения GRFактивности. Примеры Сокращения Ацетонитрил (ACN), аллилоксикарбонил(Воc), дихлорметан (DCM), диизопропилэтиламин (DIFA), диметилформамид (DMF), диметилсульфоксид (DMSO), 9-фторфенилметилоксикарбонил (FMOC), гексафторфосфат 2-[1 Нбензотриазол-1-ил]-1,1,3,3-тетраметилурония, 1 гидроксибензотриазол (HOBt), метил-т-бутиловый эфир, норлейцин (Nle) , N-метилпирролидон (NMP), 2,2,5,7,8-пентаметилхроман-6 сульфонил (Pmc), трет-бутил (tBu), трифторуксусная кислота (TFA), трифенилметил (Trt). Пример 1. Жидкофазная конъюгация hGRF с PEG. В этих экспериментах в качестве конъюгирующего с PEG агента использовали монометоксилированный PEG5000[MPEG5000], связанный амидной связью с альфа-аминогруппой норлейцина, то есть активированный по карбоксигруппе до сукцинимидной эфирной группы. Это может быть выполнено, например, по Lu et al.,1994. Человеческий GRF1-29 hGRF (1-29)-NH2,который был получен от Bachem, использовался в качестве пептида hGRF. При условии, что низкая растворимостьhGRF(1-29) в водном растворе при нейтральных и слабощелочных значениях рН была необходима для конъюгации с PEG, предварительно были подобраны альтернативные реакционные условия от А до Е: А. Диметилсульфоксид: 20 мг пептида растворяли в 1 мл DMSO и сразу же добавляли соответствующие количества конъюгирующего сPEG реагента. В. Диметилформамид/0,2 М боратный буфер рН 8,0 при объемном соотношении 1:1:пептид и соответствующие количества конъюгирующего с PEG реагента добавляли сразу же. С. Высококонцентрированный водный раствор никотинамида (200 мг/мл): 200 мг никотинамида добавляли к раствору 40 мг hGRF(129) в 1 мл 10 мМ уксусной кислоты. 1 мл 0,2 М боратного буфера при рН 8,0 добавляли к указанному раствору кислоты для достижения желаемого рН перед добавлением соответствующих количеств конъюгирующего с PEG реагента.D. Ацетонитрил/0,2 М боратный буфер рН 8,0 при объемном соотношении 1:1 и соответствующие количества конъюгирующего с PEG реагента добавляли сразу же. Е. 0,2 М боратный буфер, 5 М мочевина,рН 8,0 и соответствующие количества конъюгирующего с PEG реагента добавляли сразу же. 11 Сухой PEG реагент добавляли при перемешивании, чтобы достичь окончательного молярного соотношения PEG:hGRF 1:1, 2:1 или 3:1. Предпочтительным является 2:1. Использование различных значений молярного соотношения PEG:hGRF позволило получать реакционную смесь, в которой преобладающим конъюгатом был целевой конъюгат. Реакционный раствор перед очисткой оставляли на 3 ч при комнатной температуре. Следующие 4 конъюгата hGRF-PEG (A1A4) были получены: А 1:(МРЕG5000-СН 2-СО-Nlе-СО)12,21-hGRF(1-29)NH2]. Избыток DMSO, диметилформамида, ацетонитрила или мочевины и побочный продукт реакции (гидроксисукцинимид) удаляли гельфильтрацией, используя мембрану с 1000 Д отсечением. Объем доводили до 10 мл 10 мМ уксусной кислотой и затем снижали до 1 мл. Эту процедуру повторяли трижды. Конъюгаты hGRF-PEG выделяли гельфильтрацией или же хроматографией с обращенной фазой. Пример 2. Гель-фильтрационная хроматография. С помощью гель-фильтрационной хроматографии продукты были фракционированы по молекулярному весу компонентов (в этом случае MB конъюгатов hGRF-PEG 1:1=8,358, MBhGRF-PEG 1:2=13,358 и MB hGRF-PEG 1:3= 18,358. MB не конъюгированного hGRF=3358). Выделение осуществляли на серии колонок системы Superdex 75-Superose 12 смол (Biotech,Pharmacia) с элюцией 10 мл уксусной кислоты при скорости потока 1,5 мл/мин. Собранные фракции объемом 1 мл анализировались по оптической плотности (OD) при 280 нм на содержание белка и с помощью иодного теста на содержание PEG (Sims et al.,1980). После конъюгации с PEG в DMSO при мольном соотношении hGRF:PEG 1:1 были получены 3 пика: конъюгат hGRF-PEG при элюированном объеме в 132 мл (основной пик); конъюгат hGRF-PEG при элюированном объеме в 108 мл (слабый, минорный пик); и неконъюгированный hGRF при элюированном объеме в 108 мл (слабый пик). После конъюгации с PEG в DMSO при мольном соотношении hGRF:PEG 1:2 были получены три пика: конъюгат hGRF-PEG при элюированном объеме в 108 мл (основной пик); 12 конъюгат hGRF-PEG при элюированном объеме в 132 мл (слабый пик; и конъюгат hGRF-PEG при элюированном объеме в 73 мл (слабый пик). После конъюгации с PEG в DMSO при мольном соотношении hGRF:PEG 1:3 были получены два пика: конъюгат hGRF-PEG при элюированном объеме в 73 мл (основной пик); и конъюгат hGRF-PEG при элюированном объеме в 108 мл (слабый пик). Элюированные пики собирали, концентрировали ультрафильтрацией на мембране с 1000 Д отсечением, лиофилизировали, растворяли в 10 мМ уксусной кислоте и продукты охарактеризовывали, как здесь указано, после их идентификации и определения их количеств. Было установлено, что пик в элюированном объеме 73 мл соответствует соединению А 4. Установлено, что пик в элюированном объеме 132 мл соответствует соединению A3. Установлено, что пик в элюированном объеме 108 мл соответствует смеси соединений А 2 и А 1. Установлено, что пик в элюированном объеме 232 мл соответствует не конъюгированному hGRF. Однако данный метод очистки не позволяет разделить конъюгаты hGRF-PEG, имеющие одинаковые молекулярные веса, но различные сайты конъюгации с PEG (позиционные изомеры). Пример 3. Хроматография с обращенной фазой. Более специфичное фракционирование выполняется путем гидрофобной хроматографии с использованием RP-HPLC С 18 колонки. Этим способом можно разделить возможные получившиеся изомеры с одними и теми же молекулярными весами. Фактически было установлено, что при таком способе единичный полученный гель-фильтрацией пик, соответствующий конъюгатам с 1 ковалентно присоединенным PEG, разделяется на два пика. Обращеннофазовую хроматографию выполняли на RP-HPLC C18 препаративной колонке (Vydac) с элюцией градиентом H2O/0,05%UV-Vis Детектор при 280 нм. После конъюгации с PEG в DMSO при мольном соотношении hGRF:PEG 1:1 были получены 4 пика: 1. 13,2 мин основной пик; 2. 13,7 мин основной пик; После конъюгации с PEG в DMSO при мольном соотношении hGRF:PEG 1:2 были получены 4 пика: 1. 13,2 мин слабый пик; 2. 13,7 мин слабый пик; 3. 14,4 мин основной пик, и 4. 15,5 мин слабый пик. После конъюгации с PEG в DMSO при мольном соотношении PEG 1:3 были получены 2 пика: 1. 14,4 мин слабый пик; и 2. 15,5 мин основной пик. Элюированные фракции, соответствующие пикам, собирали, выпаривали, чтобы удалить ацетонитрил и трифторуксусную кислоту, и затем лиофилизировали. Сухой продукт затем растворяли в 10 мМ растворе уксусной кислоты и анализировали, как здесь указано, после идентификации и определения количеств выделенных образцов. Было установлено, что конъюгат hGRFPEG, элюированный за 13,2 мин, является соединением A1 (GRF-1PEG, первый пик). Было установлено, что конъюгат hGRFPEG, элюированный за 13,7 мин, является соединением А 2 (GRF-PEG, второй пик). Было установлено, что конъюгат hGRFPEG, элюированный за 14,4 мин, является соединением A3 (GRF-2PEG). Было установлено, что конъюгат hGRFPEG, элюированный за 15,5 мин, является соединением А 4 (GRF-3PEG). Было установлено, что пик, элюированный за 8,9 мин, содержит неконъюгированныйhGRF. В качестве типичного примера обращеннофазовая хроматография продуктов конъюгации с PEG, полученных при молярном соотношенииPEG:hGRF 2:1, показана на фиг. 2. Сухие продукты получали выпариванием растворителя или лиофилизацией. Пример 3 а. Конъюгация hGRF с помощьюPEG10000 в растворе. В этом примере использовался монометоксилированный PEG с разветвленной цепью и молекулярной массой 10000 дальтон с лизином в качестве спейсера (получен от ShearwaterPolymers Inc.). Этот разветвленный PEG был получен связыванием каждой аминогруппы лизина и PEG5000. Карбоксигруппа лизинового спейсера, активированная до сукцинимидного эфира, взаимодействовала в DMSO с аминогруппамиhGRF(1-29)-NH2 при мольном соотношении 0,9 моль PEG на 1 моль GRF. Растворитель удаляли и остаток фракционировали гель-эксклюзивной хроматографией 14 на препаративной колонке Superose 12 ТМ. Элюировались 2 пика, соответствующие двум конъюгатам hGRF-PEG. Первый (слабый) пик соответствовал конъюгату, имеющему 2 фрагмента PEG10000, связанных с hGRF, второй (основной) пик соответствовал конъюгату, содержащему один фрагмент PEG10000 на hGRF. Пример 3b. Конъюгация hGRF с PEG20000 в растворе. В этом примере использовался монометоксилированный разветвленный PEG с молекулярной массой 20000 дальтон с лизином в качестве спейсера (получен от Shearwater Polymers,Inc.). Этот разветвленный PEG был получен связыванием каждой аминогруппы лизина иPEG10000. Карбоксигруппа лизинового спейсера, активированная до сукцинимидного эфира, взаимодействовала в DMSO с аминогруппамиhGRF(1-29)-NН 2 при молярном соотношении 0,9 моль ПЭГ на 1 моль GRF. Растворитель удаляли лиофилизацией, а остаток фракционировали гель-эксклюзивной хроматографией на препаративной колонке Superose 12 ТМ. Был получен единственный пик,соответствующий конъюгату, содержащему один фрагмент PEG20000 в расчете на hGRF. Пример 4. Аналитическая характеристика конгьюгатов hGRF-PEG. Продукты, полученные так, как описано выше, были проверены на наличие связанных цепей PEG с помощью следующих методик: 1. Колориметрический способ, основанный на (использовании) тринитробензолсульфоната,использовали для определения свободных аминогрупп (как описано у Habeed et al., 1966); 2. Колориметрический метод, основанный на иодном анализе, был использован для определения содержания PEG (как описано у Sims etal., 1980); 3. Использовали количество цепей PEG,основанное на (использовании) норлейцина в качестве показателя в аминокислотном анализе(как описано у Sartore et al., 1991); 4. Масс-спектроскопия использовалась для определения молекулярной массы конъюгатов.MALDI - масс-спектрометрия использовалась, чтобы определить молекулярную массу конъюгатов и их полидиспергируемость, порожденную полидиспергируемостью исходногоPEG. Анализ конъюгатов hGRF-PEG в отношении сайта присоединения PEG проводили с помощью аминокислотной последовательности. Каждый образец разбавляли в 100 раз. Затем 10 мкл этого раствора (около 50 пикомоль) загружали в секвенатор. Чистота конечного продукта подтверждалась данными RP HPLC аналитической хроматографии. 15 Анализ выполняли с помощью С 18 аналитической колонки (Vydac) с элюцией градиентом Н 2 О/0,05% трифторуксусной кислоты (элюент А) и смесью ацетонитрила и 0,05% трифторуксусной кислоты (элюент В) следующим образом: 0-5 мин 80% А 5-50 мин 80% А 5% А 50-52 мин 5% А 52-54 мин 5% А 80% А Скорость потока 1 мл/мин, loop 20 мкл,UV-Vis. Детектор при 226 нм. Неконъюгированный hGRF элюировали за 20,7 мин. Соединение A1 элюировали за 22,9 мин,соединение А 2 элюировали за 23,4 мин, соединение A3 - за 24,4 мин и соединение А 4 - за 25,5 мин. Конформационная характеристика нативного и полимер-связанных пептидов осуществлялась на основе анализа кругового дихроизма. Спектроскопическую характеристику неконъюгированного hGRF и конъюгатов hGRFPEG осуществляли на основе анализа кругового дихроизма в пределах 190-300 нм. Образцы (50 мкг/мл) растворяли в 10 мМ уксусной кислоте или смеси метанол/10 мМ уксусная кислота с молярным соотношением 30:70 и 60:40. Во всех вышеперечисленных растворах неконъюгированный hGRF и конъюгаты hGRF-PEG проявили свои особенности, как это показано на фиг. 4 для соединения A3. В растворе уксусной кислоты пептиды были в хаотичной конформации,тогда как при повышении концентрации метанола пептиды принимали -спиралевидную структуру. Результаты показывают, что конъюгацияPEG не изменяет значительно структурных особенностей этого пептида. Пример 5. Определение стабильности конъюгатов hGRF-PEG. Стабильность hGRF и конъюгатов hGRFPEG в отношении протеолиза исследовали с помощью протеолитических ферментов, таких как субтилизин и химотрипсин. Опыт с субтилизином осуществляли путем инкубирования при 4 С 0,297 мМ пептидного раствора в 0,1 М Трис НСl 0,05 М CaCl2 рН 8,0 при мольном соотношении пептид/протеаза 1:50000. В случае с химотрипсином пептид был растворен в 0,08 М Трис НСl, 0,1 М CaCl2 рН 7,8 и использовалось мольное соотношение пептид/протеаза 1:15000. После режима деградации проводили аналитическую RP-HPLC с помощью колонки С 18 с элюцией в тех же условиях, что приведены в примере 4. Высота, соответствующая пику исходного соединения, была вычислена перед инкубацией с протеолитическим ферментом и по 004269 16 сле намеченной по плану продолжительности инкубации. Процентная доля остаточной высоты при намеченной продолжительности была вычислена, и она показана на фиг. 3 а и 3b. Пример 6. Конъюгация с алкилированнымhGRF конъюгировали с монометоксилированным PEG, активированным различными ацилирующими группами, а также алкилирующими группами. Алкилирующий PEG обладает тем преимуществом, что позволяет получать конъюгаты, у которых сохраняется положительный заряд на остатке лизина. Выделение и оценка свойств осуществлялись так же, как описано в примерах 1-4. Пример 7. Оценка активности контюгатовhGRF-PEG. Материалы Используемые соединения Человеческий GRF1-29 hGRF(1-29)-NH2,партия 1299201, поставлен Bachem; Человеческий GRF3-29 hGRF(3-29), поставлен Bachem; Человеческий GRF3-29, поставлен ISL; и конъюгаты hGRF-PEG приготовлены, как описано выше. РеагентыCHO-hGRFR-LUC для исследований in vitro. Среда MEM альфа с рибонуклеозидами и дезоксирибонуклеозидами (Gibco), содержащая 10% околоплодной сыворотки теленка (Gibco) плюс 600 мкг/мл сульфата дженетицина G418(Gibco); Реагент для лизиса клеточной культуры(Promega); Реагент для анализа на основе люциферазыIn vitro биоисследование гипофизарных клеток крысы Набор сбалансированных солей Earle(EBSS)(Gibco), содержащий 50 мкг/мл сульфата гентамицина (Sigma), Среда 199 (М 199) с солями Earle (Gibco) с 12,5% околоплодной сыворотки теленка (FBS) (Gibco) и 50 мкг/мл сульфата гентамицина. Набор для исследования GH крысы, поставлен Amersham. Ферментный раствор для биодеструкции тканей (приготовленный на 30 мл EBSS): 120 мг коллагеназы (Sigma) 30 мг гиалуронидазы (Sigma) 30 мг ДНКазы I (Sigma) 900 мг БСА (Sigma) После составления раствора его стерильно фильтруют и помещают в термостат при 37 С. Биологический анализ in vitro. Набор для радиоиммуноанализа GH крысы, поставлен Amersham. Набор для радиоиммуноанализа GRF (1-44) человека, поставленCHO-hGRFR-LUC (клон 1-11-20) представляет собою линию клона клеток, которая была получена путем совместной трансфекции векторами pcDNA3-hGRF-R и pTF5-53 LUCCHO-DUKX клеточной линии. Плазмида pcDNA3-hGRF-R была сконструирована включением cDNA рецептора рилизинг-фактора гормона роста человека (hGRF-R) в вектор экспрессии pcDNA3. Bluescript плазмида, содержащая cDNA-hGRF-R, была любезно представлена д-ром B.Gaylinn (University of Virginia), экспрессирующий вектор pcDNA млекопитающих был получен от Invitrogen. Кодирующая hGRF-R последовательность была получена с помощью промотора цитомегаловируса(CMV) человека. Ее карта рестрикции приведена на фиг. 12. Плазмида pTF5-53LUC была сконструирована встраиванием с-fos элемента ответа цАМФ в область расположения эндогенного промотора выше кодирующей люциферазу последовательности в плазмиде poLus. Элемент ответа из цАМФ и c-fos промотор были получены из плазмида pTF5-53 (описана Fish et al., 1989). Вектор, содержащий беспромоторный маркерный ген (poLus) с множественными сайтами клонирования в области, расположенной над последовательностью, кодирующей люциферазу, был получен от д-ра Brasier (University ofTexas, Galveston). Его карта рестрикции приводится на фиг. 13. Эти клетки CHO-DUKX, полученные, как указано выше, котрансфекцией, обычным способом культивировали на среде MEM альфа,содержащей рибонуклеозиды и дезоксирибонуклеозиды, а также 10% околоплодной сыворотки теленка плюс 600 мкг/мл сульфата дженетицина G418. Перед исследованием клетки высевали(40000 клеток на лунку) на белые 96-луночные планшеты (Dynatech) и инкубировали в течение 16-18 ч в 200 мкг/мл культуральной среды. На следующий день среду удалили и заменили ее средой, содержащей различные концентрации hGRF(1-29), введенные в эталонный стандарт (Bachem), или различные конъюгатыhGRF-PEG, перед инкубированием планшета при 37 С и 5% СО 2 в течение 2 ч. В конце инкубирования CHO-GRFR-LUC-клетки дважды промывали 200 мкл PBS (Sigma) и затем лизировали добавлением в каждую ячейку 50 мкл специального реагента для лизиса клеток (Promega). После дальнейшего 15-минутного инкубирования при комнатной температуре и введении 150 мкл люциферазного реагента для анали 004269 18 за (Promega) пластины просмотрели в люминометре (Dynatech). В качестве альтернативного способа CHOhGRFR-LUC-клетки, засеянные по 50000 клеток в ячейку, в конце инкубирования с различными конъюгатами hGRF-PEG промывали PBS, как описано выше. В каждую ячейку добавляли 100 мкг/мл PBS, содержащего ионы кальция и магния, затем добавляли 100 мкл Luclite (Packard). После 10-минутной выдержки при комнатной температуре пластины считывались в люминометре (Lumicount-Packard). Результаты выражали в относительных световых единицах (RLU). Оценка биологической активности (1-29) на клетках гипофиза крыс Животные (SPF крысы-самцы SpragueDawley с массой тела 200 г) были умерщвлены ингаляцией СО 2 и у них были удалены гипофизы. Ткань тщательно измельчали и помещали в емкость с раствором фермента для биодеструкции ткани. Емкость помещали в термостат при 37 С на 1 ч. Деструктированную ткань извлекали и клетки дважды промывали, подсчитывали и доводили концентрацию до 5 х 105/мл. Клетки помещали на пластину с 48 ячейками (200 мкл/ячейка), пластину помещали в термостат на 72 ч. Спустя 72 ч клетки инкубировали с hGRF при различных его концентрациях в течение 4 ч. По завершении инкубирования собирали надосадочные жидкости и хранили их при -80 С. Содержание GH в каждом образце определяли с помощью имеющегося в продаже набора для радиоиммуноанализа крысиного GH. Исследование in vivo Животным i.v. вводили hGRF(1-29) (400 мкг/крыса). За несколько минут до забора крови животных анестезировали (кетамин-ксилазин). У каждой крысы из нижней полой вены отбиралось по 2 мл крови. Образец делили на 2 аликвоты: 1 мл отбирали сам по себе и сыворотку получали после инкубирования в течение около 3 ч при 37 С с последующим центрифугированием; оставшийся 1 мл собирали в ампулу, содержащую 50 мкл раствора гепарина с концентрацией 4 мг/мл, немедленно помещали на лед и получали плазму после центрифугирования при 4 С. Образцы крови отбирали в различные моменты времени после инъекции испытуемого соединения от различных животных. В каждом эксперименте для каждого момента времени использовалось по три крысы. Образцы плазмы и сыворотки немедленно замораживались и хранились при -20 С. Уровни содержания GH в сыворотке измеряли с помощью набора, который есть в продаже, уровни содержания в плазме измеряли с помощью продаваемого RIA набора для hGRF(144).[Lys(MPEG5000-CH2-CO-Nle-CO)12,21-hGRF(129)-NH2] и "GRF-3PEG" соответствует N(MPEG5000-CH2-CO-Nle-CO) [Lys(MPEG5000-CH2CO-Nle-CO)12,21-hGRF(1-29)-NH2]. Исследование in vitro CHO-hGRFR-LUC Активности двух различных групп конъюгатов hGRF-PEG, приготовленных с использованием DMSO, при исследовании in vitro CHOhGRFR-LUC, показаны на фиг. 5 и 6. Было установлено, что все препараты активны, несмотря на меньший уровень содержания по сравнению с нативным hGRF (hGRF,подвергнутый тем же стадиям очистки, использовался для конъюгации с PEG соединений),причем GRF-1PEG (и 1-й, и 2-й пики) был более активным, чем GRF-2PEG и GRF-3PEG. Никакой разницы между hGRF и нативным hGRF не наблюдалось (данные не приводятся). Наблюдалась подобная in vitro биологическая активность конъюгатов hGRF-PEG из обеих полученных с использованием DMSO партий(фиг. 5 и фиг. 6), а также конъюгатов, из партии,полученной с использованием раствора никотинамида (фиг. 7). На фиг. 6 показаны также 2 различных hGRF (3-29) препарата, не обладающих значительной in vitro активностью по сравнению с hGRF (1-29). Исследование in vitro гипофизарных клеток крысы на активность hGRF1-29 В обоих исследованиях, проведенных на основе конъюгатов hGRF-PEG, полученных с использованием DMSO, было установлено, чтоGRF-1PEG 1-й пик соответствует самому активному соединению, затем идет GRF-1PEG 2-й пик, затем - GRF-2PEG и, наконец, GRF-3PEG(фиг. 8 и 9). Эти выводы хорошо согласуются с теми, что получены при исследовании маркерного гена. Исследование in vivo В предыдущих опытах уровни сывороточного GH и плазменного hGRF определялись на крысах, исход из i.v. инъекции 400 мкг hGRF. Соответствующие результаты проиллюстрированы на фиг. 10. Как показано, и GH и hGRF дают пики спустя 10 мин после инъекции hGRF. Затем концентрации GH в сыворотке быстро понижаются и возвращаются к базальному уровню через 60 мин, тогда как концентрацииhGRF в плазме сохраняются на прежнем уровне в течение того же временного интервала. На фиг. 11 А и 11 В показаны уровни GH иGRF в крови в различные моменты времени в течение 48 ч у крыс, которым были i.v. введены по 400 мкг 1-го и 2-го пиков GRF-1PEG; GRF2PEG и GRF-3PEG (приготовленные с DMSO). 20 Все конъюгированные с PEG препараты дают пик сывороточного GH спустя 10 мин после i.v. инъекции подобно hGRF1-29. Однако,хотя 1-й и 2-й пики GRF-1PEG и GRF-2PEG показывают уровни сывороточного GH, сравнимые с теми, что получены от hGRF1-29, подтверждается, что GRF-3PEG является менее активным, чем это установлено в испытаниях invitro. Что же касается уровней GRF в плазме, то здесь наблюдается совершенно иная картина в отношении 1-го и 2-го пиков GRF-1PEG по сравнению с GRF-2PEG и GRF-3PEG безотносительно типа приготовления используемого препарата (с использованием DMSO или никотинамида). В течение 48 ч после инъекцииGRF-1PEG 1-го и 2-го пиков концентрации GRF в плазме возвращаются к базальному уровню,тогда как наиболее долго сохраняющиеся уровни содержания соответствуют GRF-2PEG иGRF-3PEG. Пример 8. Твердофазный синтез сайтзащищенных производных hGRF(1-29)-NH2 в качестве исходных соединений в процессе конъюгации с PEG. Был осуществлен твердофазный синтез производных hGRF(1-29)-NH2, содержащих специфическую защитную группу(Nаллилоксикарбонил-группу) в положении первичных аминогрупп как Lys12, так и Lys21. Это позволяет проводить сайт-специфичную конъюгацию с PEG N-концов. Другое аминозащищенное производное получают блокированиемN-конца посредством ацилирования и Lys12 Nаллилоксикарбонильной группой. Это производное используют для сайт-специфичной конъюгации с PEG. Материалы и методы Операции пептидного синтеза Все продукты присоединения hGRF пептидных производных к смолам были первоначально собраны Fmoc-химическим методом с помощью пептидного синтезатора фирмы Applied Biosystems Inc. модель 431 А, с использованием PAL-PEG-PS смолы с низкой степенью замещения (0,16 ммоль/г) и двойного сочетания с введением протокола для каждого остатка,чтобы оптимизировать количество и чистоту получаемого неочищенного продукта. Дополнительно продукт присоединения пептида Nизопропил-Туr1, Lys(Alloc)12-hGRF(1-29)-NH2 к смоле подвергали выполняемой вручную процедуре восстановительного алкилирования, чтобы присоединить N-терминальную изопропильную группу. Все продукты присоединения пептидов к смоле расщепляли смесью трифторуксусной кислоты (TFA), 1,2-этандитиола, тиоанизола и воды [10:0,5:0,5:0,5 (объем/объем)] в течение 2 ч и неочищенные пептиды выделяли осаждением в МТВЕ и центрифугированием. Лиофилизиро 21 ванные неочищенные пептиды очищали градиентной ВЭЖХ с обращением фаз на препаративной колонке Vydac С 18 с помощью 0,1%TFA - вода/ацетонитрильной буферной системы. Все очищенные пептиды были охарактеризованы с помощью аналитической хроматографии с обращением фаз к MALDI-TOF массспектрометрии. МатериалыApplied Biosystems Inc. Уксусный ангидрид Applied Biosystems Inc. Аминокислоты: большая часть FMOC аминокислот, используемых на синтезаторе ABI 431A, были закуплены у Applied Biosystems в виде 1,0 ммолярных картриджей с предопределенным весом. Fmoc-Lys(Alloc)-ОН была закуплена у Perseptive Biosystems (Framingham, MA) по массе и картриджи заполнялись на месте. Все используемые аминокислоты былиLконфигурации. Смолы: исходные смолы, используемые для hGRF-аналогов были PAL-PEG-PS (пептидамидный линкер полиэтиленгликольполистирол)смолы. PAL-PEG-PS носители, закупленные у Perseptive Biosystems, постоянно показывают превосходные результаты по чистоте и выходу неочищенного продукта. Смолу с низкой степенью замещения 0,16 ммоль/г использовали для всех производных. Смолы с низкой степенью замещения обычно используют для длинных тяжелых цепей, чтобы обеспечить лучшее сочетание и уменьшить стерические затруднения и возникновение эффекта распластывания в наращиваемых пептидных цепочках. Методы Сборка цепочки - пептидный синтезатор фирмыApplied Biosystems Inc., модель 431 А Цепочки защищенных пептидов сначала собирают с помощью Fmoc-метода на пептид 004269 22 ном синтезаторе фирмы Applied Biosystems Inc.,модель 431 А, в котором используются программные циклы быстрого Fmoc (Fast Моc)HBTU используется для активации и сочетания,20% пиперидин - для снятия защиты, a NMP основной растворитель, используемый для снятия защиты, растворения аминокислот и промывки смолы. Аминокислотами заполняют 1,0 ммоль картриджи, рассчитанные на заранее предопределенный вес. В 0,25 ммольных Fast Моc циклах используют 1,0 ммольные картриджи и реакционную емкость объемом 40 мл. Сборка цепочки - способ Стадии для программных циклов, калиброванных по 0,25 ммоль, могут быть в целом охарактеризованы следующим образом: 1. Снятие защиты пиперидином. - Смолу сначала промывают NMP, затем обрабатывают 18% раствором пиперидина в NMP, и снятие защиты происходит за 3 мин. Жидкости в реакционной емкости дают стечь, заливают 20% раствор пиперидина и процесс снятия защиты продолжается около 8 мин. 2. Растворение аминокислоты - NMP (2,1 г) и 0,9 ммоль 0,45 М HBTU/HOBt в DMF (2,0 г)добавляют в картридж и перемешивают в течение 6 мин. 3. Промывание NMP - из реакционной емкости дают стечь жидкости и промывают смолуNMP добавляют в картридж, чтобы начать активацию аминокислоты, затем переносят из картриджа в RV. 5. Сочетание и конечное промывание - Реакция сочетания между активированной аминокислотой и пептидом со снятой N-концевой защитой, присоединенным к смоле, продолжается около 20 мин, затем жидкую фазу из RV сливают и смолу промывают NMP. 6. Завершение (при желании) - Приблизительно 12 мл 0,5 М уксусного ангидрида, 0,125 М DIEA и 0,015 HOBt в растворе NMP добавляют в реакционную емкость и взбалтывают в течение 5 мин. Это должно приводить к ацетилированию любых свободных не подвергнувшихся сочетанию точек на смоле, что дает в результате усеченные, а не делетированные цепочки, что затем значительно упрощает стадии очистки. Полный протокол для этих циклов можно найти в Applied Biosystems User Bulletin N 35(FastMoc 0,25 и 0,10 для Модели 431 А). Стандартный план для типичного синтеза Стадия 1. Промывка смолы 3 Х DMF. Стадия 2. Снятие защиты 2 Х по 5 мин 20% пиперидином в DMF. Стадия 3. Промывка смолы 6 Х DMF. Стадия 4. Сочетание в течение 45 мин аминокислоты,активированной смесью 23 Стадия 5. Промывка смолы 3 Х DMF. Для тяжелых цепей дополнительная стадия завершения, в которой используется 70% уксусный ангидрид в DMF в течение 20 мин для ацетилирования любых незанятых точек на смоле с присоединенным пептидом, что дает в результате в конечном неочищенном продукте усеченные, а не делегированные цепи, может осуществляться после стадии сочетания. Отщепление/Экстракция Отщепляющая смесь, используемая для удаления защищающих групп и отсоединения пептида от смолы, является стандартной смесью, применяемой для пептидов, содержащих аргинин и/или метионин. Для 0,1-1,5 г продукта присоединения пептида к смоле: 10 мл трифторуксусной кислоты, 0,5 мл деионизированной воды, 0,5 мл тиоанизола, 0,5 мл этандитиола(87% трифторуксусной кислоты, 4,3% деионизированной воды, 4,3% тиоанизола, 4,3% этандитиола). Процедура отщепления 100 мг-1 г присоединенного к смоле пептида помещают в 20 мл стеклянный сосуд и охлаждают в бане со льдом. Готовят отщепляющую смесь и также охлаждают ее на льду, затем добавляют к пептиду, связанному со смолой, до конечного объема примерно 10 мл. Сосуд извлекают из ледяной бани и дают ему нагреться до комнатной температуры. Сосуд закрывают крышкой и перемешивают реакционную смесь при комнатной температуре в течение 2 ч. Спустя 2 ч раствор отфильтровывают под вакуумом через пористый фильтр, обеспечивающий протекаемость среды, в приблизительно 30 мл холодного МТВЕ. Реакционный сосуд промывают 1 мл трифторуксусной кислоты и фильтруют через ту же самую фильтрующую воронку в холодный МТВЕ. Вся суспензия затем переносится в 50 мл центрифужную пробирку и центрифугируются в течение 10 мин при 2000 об./мин при комнатной температуре. Супернатант отсасывают, остаток ресуспендируют в 40 мл холодного МТВЕ и центрифугируют снова. Эту стадию повторяют еще раз. Конечный супернатант отсасывают, а осадок продувают азотом для испарения основного количества оставшегося в нем эфира. Затем пептид растворяют в 20-30 мл 1-10% водного раствора уксусной кислоты, разбавленного примерно 100-150 мл деионизированной воды, замораживают и лиофилизируют. Очистка Методы ВЭЖХ с обращенной фазой Система - Waters Delta Prep 4000 Колонка - Vydac обращение - фазовая С 18,10 мкм; 2,2 х 25 см (Кат.218 ТР 1022) Буферы - А: Вода/0,1% ТФК В; Ацетонитрил/0,1% ТФК Скорость потока - 15 мл/мин 24 Детекция - Waters 484 УФ детектор, 220 нм,Градиент - изменяющийся, обычно 0,2% В/мин вплоть до 1,0% В/мин. Лиофилизированные неочищенные пептиды получают растворением 50-100 мг пептида в 200 мл 0,1% водного раствора трифторуксусной кислоты. Пептидный раствор затем наносят непосредственно на препаративную колонку через резервуарную линию буфера А и включают программу градиента. Собранные фракции в течение ночи прогоняют на анализирующей ВЭЖХ системе с автопробником. Выходящие фракции, достигающие в пике более 92% чистоты, собираются, разбавляются деионизированной водой в соотношении 4:1, замораживаются и затем лиофилизируются в Virtis 25SL замораживающей сушилке. Характеристика Обращенно-фазовая ВЭЖХ Условия: Система - насосная Waters 510, 717 Автопробник,УФ детектор 490 мультидлинноволновый,Колонка - Vydac C18, 5 мкм, 0,46 х 25 смTFA Скорость потока - 1 мл/мин Детекция - УФ: 214 нм, 280 нм. Градиент - 2% В/мин. Очищенные лиофилизированные пептидные образцы готовят растворением 0,2-10 мг пептида в 0,1% водной трифторуксусной кислоте до концентрации 0,5-1,0 мг/мл. 15-18 5 мкл наносят на колонку и элюируют с помощью градиентной программы 0-50% ацетонитрила через 25 мин. Результаты хроматографии собирают и хранят, используя Waters(Матрикссопутствующая лазерная десорбция) ионизация периода полета Система: Perseptive Biosystems VoyagerTFA. Образцы пептидов готовят концентрацией 1-20 мкмоль в 50% ACN/0,1% TFA. 0,5 мкл раствора матрикса, а затем 0,5 мкл образца пептида наносят на ячейки пластинки для анализа и дают высохнуть. Аналитическую пластину загружают в машину, и образцы сканируют и анализируют, используя Reflector Delayed-Extraction метод, оптимизированный для пептидов. Для каждого образца данные в виде кумулятивного сигнала от 32-128 лазерных доз собирались и анализировались. В каждый прогон для калиб 25 ровки включалась ячейка с пробой контрольного пептида. Специфический синтез Получение [Lys(Alloc)12,21]-hGRF(1-29)-NH2 Продукт связывания[Lys(Alloc)12,21]hGRF(1-29)-PAL-PEG-PS-смола первоначально синтезировали Fmoc-методом на пептидном синтезаторе Applied Biosystems 431 А (см. Методы синтеза выше), включающим снятие защиты N-концевой Fmoс-группы. Продукт пептид - смола расщепляли смесью[10:0,5:0,5:0,5 (объем/объем)] в течение 2 ч и выделяли пептид осаждением в МТВЕ с получением 240 мг неочищенного пептида. Очистка препаративной обращеннофазовой ВЭЖХ на колонке Vydac C18 (22 х 250 мм) приводила к получению 60 мг очищенного продукта (95% аналитическая ВЭЖХ). MALDI-TOF массспектр. Вычислено: 3523,8. Найдено: 3524,2. Получение [N-изопропил-Туr1, Lys(Alloc)12]hGRF(1-29)-NH2 Сборка начального продукта [Lys(Alloc)12]hGRF(1-29)-PAL-PEG-PS-смола.[Lys(Alloc)12]-hGRF(1-29)-PAL-PEG-PSсмолу собирают Fmoc-методом на пептидном синтезаторе 431 А фирмы Applied Biosystems(см. выше Методы синтеза), включая снятие защиты Fmoс группы N-концевого остатка.N-изопропильную группу присоединяли восстановительным алкилированием присоединенного к смоле пептида с помощью натрийцианборгидрида и соответствующего кетона (ацетона), как описано Hocart et al., 1987. 880 мг пептида, присоединенного к смоле (70 мкмоль) замачивали для набухания в 5 мл DCM в течение 30 мин, затем добавляли 10 ммоль (174 мкл) ацетона в 7 мл МеОН/1% НОАс и смесь периодически взбалтывали в течение 2 ч при температуре окружающей среды. Затем добавляли 2 ммоля (129 мг) натрий-цианборгидрида в 12 мл МеОН/1% НОАс, смесь периодически взбалтывали в течение 2 ч и затем оставили на ночь (15 ч). Качественный мониторинг с нингидрином показал завершение реакции (отсутствие голубого окрашивания). Пептид отсоединили от смолы смесью TFA:1,2-этандитиол:тиоанизол: вода [10:0,5:0,5:0,5 (объем/объем)] за 2 ч и выделили пептид осаждением в МТВЕ с получением 200 мг неочищенного продукта. Очистка препаративной обращенно-фазовой градиентной ВЭЖХ в системе растворителей Вода/Ацетонитрил/0,1% трифторуксусная кислота на колонке Vydac C18 (22 х 250 мм) привела к получению 50 мг чистого продукта (95%аналитическая ВЭЖХ). MALDI-TOF массспектр: Вычислено: 3481,9, Найдено: 3481,8.hGRF(1-29). Производные hGRF, полученные как описано в примере 8, конъюгировали с активированным PEG, как описано в примерах 1 и 6. Очистка в этом случае включала только выделение из избытка реагентов и побочных продуктов, тогда как не было необходимости осуществлять процедуру, описанную в примерах 2 и 3. Список литературы(2) ДАННЫЕ ДЛЯ ПОСЛЕДОВАТЕЛЬНОСТИ SEQ ID NO:1: ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ сайт-специфичного получения конъюгатов рилизинг-фактора гормона роста человека и полиэтиленгликоля (hGRF-PEG),содержащих одно или несколько звеньев PEG (в расчете на hGRF), ковалентно связанных с Lys12,и/или Lys21, и/или N, отличающийся тем, что 28 реакцию конъюгирования между пептидомhGRF и активированным PEG осуществляют в растворе и целевой конъюгат hGRF-PEG выделяют из реакционной смеси и очищают. 2. Способ по п.1, в котором раствор представляет собой концентрированный водный раствор никотинамида или водный буферный раствор денатурирующего агента. 3. Способ по п.1, в котором растворитель представляет собой полярный органический растворитель, выбранный из диметилсульфоксида, смеси диметилформамида и буфера или смеси ацетонитрила и буфера. 4. Способ по п.1, в котором конъюгатhGRF-PEG выделяют из реакционной смеси и очищают хроматографическими методами. 5. Способ по любому из предшествующих пунктов, в котором пептид hGRF представляет собой hGRF(1-29)-NH2. 6. Способ по п.1, в котором перед реакцией конъюгации с PEG пептид hGRF защищают по одному или нескольким из положений N, Lys12 и Lys21. 7. Способ по п.1 или 6, который включает снятие защиты после реакции конъюгации сPEG. 8. Способ по любому из предшествующих пунктов, в котором активированный PEG является алкилирующим или ацилирующим PEG в монометоксилированной форме. 9. Конъюгат hGRF-PEG, полученный способом по любому из пп.1-8, содержащий один или несколько звеньев PEG (в расчете на hGRF),ковалентно связанных с Lys12, и/или Lys21, и/илиN. 10. Конъюгат hGRF-PEG по п.9, в котором одно звено PEG ковалентно связано с Lys12. 11. Конъюгат hGRF-PEG no п.9, в котором одно звено PEG ковалентно связано с Lys21. 12. Конъюгат hGRF-PEG по п.9, в котором одно звено ковалентно связано и с Lys12, и сLys21. 13. Конъюгат hGRF-PEG по п.9, в котором одно звено ковалентно связано с каждым изLys12, Lys21 и N. 14. [Lys(Alloc)12,21]-hGRF в качестве промежуточного соединения в реакции конъюгации с PEG по п.1. 15. [N-изопропил-Туr1, Lys(Alloc)12]-hGRF в качестве промежуточного соединения в реакции конъюгации с PEG по п.1. 16. Применение конъюгатов по любому из пп.9-13 в производстве лекарственных средств для лечения, профилактики или диагностики нарушений, связанных с гормоном роста. 17. Применение по п.16 в производстве лекарственного средства для лечения или диагностики недостаточности гормона роста. Фиг. 2 Биодеструкция под воздействием субтилизина Фиг. 4 Фиг. 3A Биодеградация под воздействием химотрипсина
МПК / Метки
МПК: A61K 38/25, A61P 5/02, C07K 14/60
Метки: человека, данным, применение, получения, средства, полученные, рилизинг-фактора, сайт-специфичного, способом, производстве, лекарственного, конъюгаты, гормона, способ, конюгатов, полиэтиленгликоля, роста
Код ссылки
<a href="https://eas.patents.su/17-4269-sposob-sajjt-specifichnogo-polucheniya-konyugatov-rilizing-faktora-gormona-rosta-cheloveka-i-polietilenglikolya-konyugaty-poluchennye-dannym-sposobom-i-ih-primenenie-v-proizvodstve.html" rel="bookmark" title="База патентов Евразийского Союза">Способ сайт-специфичного получения конъюгатов рилизинг-фактора гормона роста человека и полиэтиленгликоля, конъюгаты, полученные данным способом, и их применение в производстве лекарственного средства</a>
Предыдущий патент: Производные циклобутендиона, способ их получения и содержащие их фармацевтические композиции
Следующий патент: Способы лечения множественной миеломы и индуцированной миеломой резорбции костей с помощью антагонистов интегрина
Случайный патент: Устройство каротажа перфорационных отверстий и способ