Ингибитор катепсина с
Формула / Реферат
1. Соединение формулы (I) или его фармацевтически приемлемая соль
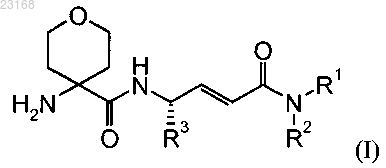
где R1 и R2, взятые вместе с азотом, к которому они присоединены, представляют 5-6-членное насыщенное или ненасыщенное кольцо, необязательно конденсированное с фенильной группой; и
R3 представляет собой (С1-С6)алкил или (С3-С6)циклоалкил(C1-С4)алкил.
2. Соединение по п.1, которое представляет собой 4-амино-N-[(1S,2E)-4-(2,3-дигидро-1H-индол-1-ил)-1-этил-4-оксо-2-бутен-1-ил]тетрагидро-2H-пиран-4-карбоксамид или его фармацевтически приемлемую соль.
3. Соединение по п.1, которое представляет собой гидрохлорид 4-амино-N-[(1S,2E)-4-(2,3-дигидро-1H-индол-1-ил)-1-этил-4-оксо-2-бутен-1-ил]тетрагидро-2H-пиран-4-карбоксамида.
4. Соединение по п.1, которое представляет собой 4-амино-N-[(1S,2E)-4-(2,3-дигидро-1H-индол-1-ил)-1-(2-метилпропил)-4-оксо-2-бутен-1-ил]тетрагидро-2H-пиран-4-карбоксамид или его фармацевтически приемлемую соль.
5. Соединение по п.1, которое представляет собой гидрохлорид 4-амино-N-[(1S,2Е)-4-(2,3-дигидро-1H-индол-1-ил)-1-(2-метилпропил)-4-оксо-2-бутен-1-ил]тетрагидро-2H-пиран-4-карбоксамида.
6. Фармацевтическая композиция для лечения хронического обструктивного заболевания легких, включающая соединение или его фармацевтически приемлемую соль по любому из пп.1-5 и фармацевтически приемлемый наполнитель.
7. Способ получения композиции по п.6, включающий смешивание соединения или его фармацевтически приемлемой соли по любому из пп.1-5 с фармацевтически приемлемым наполнителем.
8. Способ лечения хронического обструктивного заболевания легких, включающий введение пациенту эффективного количества соединения или его фармацевтически приемлемой соли по любому из пп.1-5.
9. Способ лечения хронического обструктивного заболевания легких, включающий введение пациенту фармацевтической композиции по п.6.
10. Применение соединения или его фармацевтически приемлемой соли по любому из пп.1-5 для лечения хронического обструктивного заболевания легких.
11. Применение соединения или его фармацевтически приемлемой соли по любому из пп.1-5 для производства лекарственного средства для лечения хронического обструктивного заболевания легких.
Текст
Раскрываются 4-амино-2-бутенамиды формулы (I), обладающие фармакологической активностью, фармацевтические композиции, содержащие их, и способы лечения заболеваний,опосредуемых ферментом катепсином С, таких как хроническое обструктивное заболевание легких.(71)(73) Заявитель и патентовладелец: ГЛЭКСОСМИТКЛАЙН ИНТЕЛЛЕКЧУАЛ ПРОПЕРТИ ДИВЕЛОПМЕНТ ЛИМИТЕД (GB) По заявке на данное изобретение заявляется приоритет предварительной заявки США 61/441840,поданной 11 февраля 2011 г., которая целиком включена в данное описание. Область изобретения Настоящее изобретение относится к некоторым 4-амино-2-бутенамидам, которые являются ингибиторами катепсина С, фармацевтическим композициям, содержащим данные соединения, и к их применению в лечении заболеваний, опосредуемых ферментом катепсином С, таких как хроническое обструктивное заболевание легких. Предпосылки изобретения Катепсины представляют собой семейство ферментов, входящее в папаиновое подсемейство цистеинпротеаз. В научной литературе описаны катепсины В, С, F, Н, K, L, S, V и X. Катепсин С также известен в литературе как дипептидилпептидаза, или "DPPL". Ряд опубликованных недавно исследований начали описывать роль катепсина, которую он играет в некоторых воспалительных процессах. См., например, Adkison et al., The Journal of Clinical Investigation 109:363-371 (2002): Tran et al., Archives of Biochemistry and Biophysiscs, 403:160-170 (2002); Thiele et al.,The Journal of Immunology, 158:5200-5210 (1997); Bidere et al., The Journal of Biological Chemistry,277:32339-32347 (2002); Mabee et al., The Journal of Immunology, 160:5880-5885; McGuire et al., TheJournal of Biological Chemistry, 268:2458-2467 и Paris et al., FEBS Letters, 369:326-330 (1995). Из данных публикаций следует, что катепсин С соэкспрессируется в гранулах с некоторыми серинпротеазами и функционирует, перерабатывая проформы данных протеаз в активные формы, которые затем высвобождаются из гранул воспалительных клеток и пополняют участки воспаления. Будучи активированными,данные протеазы выполняют ряд функций, включая разрушение различных компонентов внеклеточного матрикса, что вместе может способствовать распространению повреждения ткани и хронического воспаления. Например, хроническое обструктивное заболевание легких ("COPD") является хроническим воспалительным заболеванием, с участием катепсина С. Хронический бронхит и эмфизема обычно случаются вместе у COPD пациентов. Хронический бронхит обычно характеризуется хроническим влечением за собой кашля, тогда как эмфизема обычно характеризуется постоянным расширением воздушных пространств, периферическим к концевым бронхиолам, и разрушением стенок воздушных путей. Курение является важным фактором риска развития COPD. Подвергание действию сигаретного дыма и других вредных частиц и газов может приводить в результате к хроническому воспалению легких. В ответ на такое действие воспалительные клетки, такие как CD8+ T-клетки, макрофаги и нейтрофилы, пополняют данную область. Данные, пополнившие воспалительные клетки, высвобождают протеазы,которые, как считают, играют важную роль к этиологии заболеваний с помощью ряда механизмов. Считается, что протеазы, вовлеченные в данный процесс, включают нейтрофильную эластазу ("NE") серинпротеаз, катепсин G и протеиназу 3, все высвободившиеся из нейтрофилов, гранзимы А и В, высвобождаемые из цитотоксических T-клеток или природных клеток убийц; и химазы, высвобождаемые из клеток молочной железы. Катепсин С, по-видимому, вовлечен в активирование всех данных ферментов. В дополнение, мыши, нокаутированные катепсином С, устойчивы к расширению воздушного пространства легких и инфильтрации воспалительных клеток и в сигаретном дыме, и подверженных действию озона моделях COPD. См., Guay et al., Current Topics in Medicinal Chemistry, 2010, 10, 708-716; см. такжеPodolin et al. (2008), Inflammation Research, 57 (Suppl 2), S. 104. Ревматоидный артрит ("RA") является еще одним хроническим заболеванием, при котором может играть роль катепсин С. Нейтрофилы пополняются в участке воспаления сустава и высвобождения катепсина G, NE и протеиназы 3, которые, считается, являются ответственными частично за разрушение хряща, связанное с RA (Hu, Y. и Pham, C.T. (2005), Arthritis Rheum, 52:2553-2558). Другие состояния, при которых может играть роль катепсин С, включают остеоартрит, астму и рассеянный склероз. См., например, Matsui, K.; Yuyama, N.; Akaiwa, M.; Yoshida, N.L.; Maeda, M.; Sugita, Y.;Respiratory CellMolecular Biology, 22 (2):183-90, 2000. Одним из путей лечения данных состояний является ингибирование активности серинпротеаз, вовлекаемых в воспалительный процесс, особенно активности NE. См. например, Ohbayashi, "NeutrophilNE, желательно получить соединения, которые ингибируют их активность, которые тем самым ингибируют активность серинпротеазы. Таким образом, существует потребность в идентификации соединений,которые ингибируют катепсин С, которые могут использоваться в лечении множества состояний, опосредуемых катепсином С. Имеются дополнительные активности катепсина С, которые также могут быть связаны с этиологией заболеваний. Было продемонстрировано, что катепсин С участвует в миграции нейтрофилов при разви-1 023168 тии аневризм аорты за счет механизма, который до конца не выяснен (Pagano, М.В. et al. (2007), PNAS,104:2855-2860). Таким образом, болезненными процессами, которые вовлекают миграцию нейтрофилов,так же как и высвобождением протеолитических ферментов, можно управлять с помощью ингибирования катепсина С. Катепсин С также в высокой степени экспрессируется в легочном эпителии, где он может участвовать в переработке других ферментов, еще не идентифицированных. Сообщается также, что катепсин С расщепляет калликреин-4, который, как считают, участвует в созревании зубной эмали(Туе, С.Е. et al. (2009), J. Dental Res. 88: 323-327). Наконец, катепсин С сам по себе высвобождается из клеток и может участвовать в разложении матриксных белков. Краткое содержание изобретения Настоящее изобретение включает новые соединения формулы (I) или их фармацевтически приемлемые соли: где R1 и R2, взятые вместе с азотом, к которому они присоединены, представляют 5-6-членное насыщенное или ненасыщенное кольцо, необязательно конденсированное с фенильной группой; иR3 представляет собой (С 1-С 6)алкил или (С 3-С 6)циклоалкил(C1-С 4)алкил. Настоящее изобретение также направлено на применение соединения формулы (I) или его фармацевтически приемлемой соли при предотвращении, регулировании или лечении респираторного или воспалительного заболевания, такого как хроническая обструктивная болезнь легких или ринит. В дополнительном аспекте изобретение относится к фармацевтически приемлемой готовой форме композиции, включающей соединение формулы (I) или его фармацевтически приемлемую соль и фармацевтически приемлемый наполнитель. Краткое описание фигур Фиг. 1 показывает накопление общих лейкоцитов в бронхоальвеолярной жидкости для санацииC57BL/6 мышей после перорального введения дважды в день соединений примера 1 и 2 в указанных дозах в течение последних 6 недель во время 18-недельного воздействия сигаретного дыма. Фиг. 2 показывает накопление нейтрофилов в бронхоальвеолярной жидкости для санации C57BL/6 мышей после перорального введения дважды в день соединений примера 1 и 2 в указанных дозах в течение последних 6 недель во время 18-недельного воздействия сигаретного дыма. Фиг. 3 показывает накопление мононуклеарных клеток в бронхоальвеолярной жидкости для санации C57BL/6 мышей после перорального введения дважды в день соединений примера 1 и 2 в указанных дозах в течение последних 6 недель во время 18-недельного воздействия сигаретного дыма. Подробное описание изобретения Термины и их определение. Используемый здесь термин "алкил" обозначает углеводородный радикал с прямой или разветвленной цепью, имеющий указанное число атомов углерода. Используемые здесь термины "(C1-C4)алкил" и"(C1-C6)алкил" обозначают алкильную группу, имеющую по меньшей мере от 1 и до 4 или 6 атомов углерода соответственно. Примеры таких алкильных групп с прямой или разветвленной цепью, используемых в настоящем изобретении, включают, но не ограничиваются ими, метил, этил, н-пропил, изопропил,н-бутил, изобутил, втор-бутил, трет-бутил, н-пентил, изопентил, н-гексил, и разветвленные аналоги н-гексила. Используемый здесь термин "циклоалкил" относится к неароматическому, насыщенному, циклическому углеводородному кольцу, содержащему указанное число атомов углерода. Термин"(С 3-С 6)циклоалкил" относится к неароматическому циклическому углеводородному кольцу, имеющему от 3 до 6 кольцевых атомов углерода. Примеры "(С 3-С 6)циклоалкильных" групп, используемых в настоящем изобретении, включают циклопропил, циклобутил, циклопентил и циклогексил. Подходящим образом R1 и R2, взятые вместе с азотом, к которому они присоединены, представляют 5-6-членное насыщенное или ненасыщенное кольцо, необязательно конденсированное с фенильным фрагментом. В выбранном воплощении R1 и R2, взятые вместе с азотом, к которому они присоединены,представляют 1H-индол-1-ил или 2,3-дигидро-1H-индол-1-ил. В еще одном воплощении R1 и R2, взятые вместе с азотом, к которому они присоединены, представляют 2,3-дигидро-1H-индол-1-ил. Подходящим образом R3 представляет собой (С 1-С 6)алкил или (C3-C6)циклоалкил(C1-C4)алкил. В выбранных воплощениях R3 представляет собой этил, изобутил или втор-бутил. В дополнительных выбранных воплощениях R3 представляет собой циклопропилметил, циклобутилметил, циклопентилметил или циклогексилметил. В еще одном выбранном воплощении R3 представляет собой циклопропилметил. Одним конкретным воплощением изобретения является соединение формулы (I) или его фармацевтически приемлемая соль, гдеR1 и R2, взятые вместе с азотом, к которому они присоединены, представляют собой 5-6-членное насыщенное или ненасыщенное кольцо, необязательно сконденсированное с фенильным фрагментом;R3 представляет собой (C1-C6)алкил или (С 3-С 6)циклоалкил(C1-С 2)алкил. Еще одним конкретным воплощением изобретения является соединение формулы (I) или его фармацевтически приемлемая соль, гдеR3 представляет собой (C1-C6)алкил или (С 3-С 6)циклоалкил(C1-С 2)алкил. Конкретными соединениями формулы (I) являются 4-амино-N-[(1S,2E)-4-(2,3-дигидро-1H-индол-1-ил)-1-этил-4-оксо-2-бутен-1-ил]тетрагидро-2Hпиран-4-карбоксамид и 4-амино-N-[(1S,2E)-4-(2,3-дигидро-1H-индол-1-ил)-1-(2-метилпропил)-4-оксо-2-бутен-1 ил]тетрагидро-2H-пиран-4-карбоксамид или их фармацевтически приемлемые соли. Когда описываемое соединение или его соль называют по его наименованию или изображают структурно, следует понимать, что соединение или его соль могут существовать в кристаллических формах, некристаллических формах или их смеси. Соединение или соль могут также проявлять полиморфизм (т.е. способность находиться в различных кристаллических формах). Данные различные кристаллические формы обычно называют "полиморфами". Следует понимать, что, когда дается название или изображается структура, соединение также включает все его полиморфы. Полиморфы имеют тот же химический состав, но отличаются по уплотнению, геометрическому расположению и другим описательным свойствам кристаллического твердого состояния. Полиморфы, следовательно, могут иметь различные физические качества, такие как вид, плотность, твердость, деформируемость, стабильность и свойства растворения. Полиморфы обычно обнаруживают различные точки плавления, ИК-спектры и характер рентгеновской порошковой дифракции, которые могут использоваться для идентификации. Специалисты в данной области понимают, что различные полиморфы могут получаться, например, путем изменения или регулирования условий, используемых при кристаллизации/перекристаллизации соединения. Вследствие их потенциального использования в медицине соли соединений формулы (I) предпочтительно являются фармацевтически приемлемыми. Подходящие фармацевтически приемлемые соли могут включать аддитивные соли кислот или оснований. Данное изобретение предусматривает также превращение одной фармацевтически приемлемой соли соединения данного изобретения, например гидрохлоридной соли, в другую фармацевтически приемлемую соль соединения данного изобретения, например сульфатную соль. Используемый здесь термин "фармацевтически приемлемое(ая)" обозначает соединение, которое является подходящим для фармацевтического применения. Соли соединений изобретения, которые являются подходящими для применения в медицине, являются теми, в которых противоион или ассоциируемый растворитель является фармацевтически приемлемым. Однако соли и сольваты, имеющие не фармацевтически приемлемые противоионы или ассоциируемые растворители, охватываются объемом настоящего изобретения, например, для применения в качестве промежуточных соединений при получении других соединений изобретения и их солей и сольватов. Соединения формулы (I) имеют один или более атомов азота, достаточно основных для образования фармацевтически приемлемых кислотно-аддитивных солей с помощью обработки подходящей кислотой. Подходящие кислоты включают фармацевтически приемлемые неорганические кислоты и фармацевтически приемлемые органические кислоты. Характерные представители фармацевтически приемлемых кислотно-аддитивных солей включают ацетатную, аспартатную, бензолсульфонатную, бензоатную, бикарбонатную, битартратную, бромидную, кальций эдетатную, камзилатную, карбонатную, хлоридную, цитратную, дигидрохлоридную, эдетатную, эдизилатную, эстолатную, эзилатную, формиатную,фумаратную, галактуронатную, глюцептатную, глюконатную, глутаматную, гликоллиларсанилатную,гексаноатную, гидробромидную, гидрохлоридную, гидроксинафтоатную, йодидную, изетионатную, молочную, лактобионатную, малатную, малеатную, манделатную, мезилатную, метилсульфатную, мукатную, напсилатную, нитратную, памоатную, пантотенатную, фосфат/дифосфатную, полигалактуронатную, пропионатную, салицилатную, стеаратную, субацетатную, сукцинатную, сульфатную, таннатную,тартратную, теоклатную и тозилатную соли. Другие виды соединений изобретения имеют кислотную функциональную группу, достаточно кислотную для образования солей. Представители солей включают фармацевтически приемлемые соли металлов, такие как соли натрия, калия, лития, кальция, магния, алюминия и цинка; карбонаты и бикарбонаты фармацевтически приемлемых катионов металлов, таких как натрий, калий, литий, кальций, магний, алюминий и цинк; фармацевтически приемлемых органических первичных, вторичных и третичных аминов, включающих алифатические амины, ароматические амины, алифатические диамины и гидроксиалкиламины, такие как метиламин, этиламин, 2-гидроксиэтиламин, диэтиламин, триэтиламин, этилендиамин, этаноламин, диэтаноламин, циклогексиламин, триэтаноламин, холин, аргинин, лизин и гистидин. В объем изобретения входят все возможные стехиометрические и не стехиометрические формы солей соединений формулы (I). Соединения изобретения ингибируют фермент катепсин С и могут быть полезны при лечении состояний, при которых патология приписывается (по меньшей мере, частично) вовлечению в процесс катепсина С, или при состояниях, при которых ингибирование катепсина С дает некоторое клиническое преимущество, даже хотя патология (даже частично) и не является следствием действия катепсина С. Примеры таких состояний включают COPD, ревматоидный артрит, остеоартрит, астму и рассеянный склероз. Соответственно, в еще одном аспекте изобретение направлено на способы лечения таких состояний. Способы лечения согласно изобретению предусматривают введение эффективного количества соединения изобретения пациенту, нуждающемуся в этом. Используемый здесь термин "лечение" в отношении состояния обозначает (1) улучшение состояния, подвергаемого лечению, или одного или более биологических проявлений подвергаемого лечению состояния; (2) препятствие (а) одному или более моментов в биологическом каскаде, которые ведут или являются ответственными за подвергаемое лечению состояние, или (b) одному или более биологических проявлений подвергаемого лечению состояния; или (3) снятие одного или более симптомов или эффектов, ассоциируемых с подвергаемым лечению состоянием."Эффективное количество" обозначает количество лекарства или фармацевтического агента, которое вызывает биологическую или медицинскую ответную реакцию ткани, системы, животного или человека, которой добивается, например, исследователь или клиницист. Кроме того, термин "терапевтически эффективное количество" обозначает любое количество, которое по сравнению с субъектом, который не принимал такое количество, дает в результате улучшение лечения, излечение, предотвращение или улучшение состояния заболевания, расстройства или побочного эффекта или снижение степени прогрессирования заболевания или расстройства. Данный термин также охватывает количества, эффективные для усиления нормальных физиологических функций. Используемый здесь термин "пациент" относится к человеку или животному. Соединения изобретения могут вводиться любым подходящим способом введения, включая как системное введение, так и местное введение. Системное введение предусматривает пероральное введение,парентеральное, трансдермальное, ректальное введение и введение с помощью ингаляции. Парентеральное введение относится к способам введения, иным, чем энтеральное, трансдермальное или с помощью ингаляции, и представляет собой местное введение с помощью инъекции или инфузии. Парентеральное введение включает внутривенную, внутримышечную и подкожную инъекцию или инфузию. Ингаляция относится к введению в легкие пациента, будь то ингаляция через рот или через носовые проходы. Местное введение включает применение к коже, а также внутриглазное, ушное, внутривлагалищное и внутриназальное введение. Соединения изобретения могут вводиться за один раз или в соответствии с режимом дозировки, при котором ряд доз вводятся с варьированием интервалов времени в течение заданного периода времени. Например, дозы могут вводиться один, два, три или четыре раза в день. Дозы могут вводиться до тех пор,пока не будет достигнут желаемый терапевтический эффект, или независимо от достижения терапевтического эффекта. Подходящие режимы дозировки для соединения изобретения зависят от фармакокинетических свойств данного соединения, таких как абсорбция, распределение и период полуразложения,которые могут быть определены специалистом. В дополнение, подходящие режимы дозировки, включая вводимое количество и длительность введения при таких режимах для соединений изобретения, зависят от подвергаемого лечению состояния, тяжести данного состояния, возраста и физического состояния пациента, которого лечат, медицинской истории болезни пациента, характера сопутствующей терапии,конкретного способа выбранного введения, желаемого терапевтического эффекта и аналогичных факторов, известных и проверенных специалистом. Далее, таким специалистам очевидно понятно, что подходящие режимы дозировки могут требовать регулировки режима дозировки в зависимости от ответной реакции отдельного пациента на данный режим, или на протяжении времени, при котором пациент нуждается в изменении режима. Типичные суточные дозы составляют в интервале от 1 до 1000 мг. Изобретение включает применение соединений изобретения для приготовления композиции для лечения или улучшения состояния болезней, опосредуемых ферментом катепсином С, у субъекта, нуждающегося в этом, при котором композиция представляет смесь одного или более соединений изобретения и необязательного фармацевтически приемлемого наполнителя. Изобретение дополнительно предоставляет применение соединений изобретения в качестве активных терапевтических веществ, в частности для лечения заболеваний, опосредуемых катепсином С. Конкретно, изобретение предусматривает применение соединений изобретения для лечения COPD, ревматоидного артрита, остеоартрита, астмы и рассеянного склероза. В еще одном аспекте изобретение включает применение соединений изобретения в производстве медикаментов для использования в лечении указанных выше расстройств. Композиции. Перед введением пациенту соединения изобретения обычно, но необязательно, формируются в фармацевтическую композицию. Соответственно, в соответствии с еще одним аспектом изобретение направлено на фармацевтическую композицию, включающую соединение изобретения и фармацевтически приемлемый наполнитель. Фармацевтическая композиция изобретения может быть получена и упакована в массовую форму,при этом эффективное количество соединения изобретения может экстрагироваться, а затем даваться пациенту в таком виде, как порошок, сиропы и растворы для инъекций. Альтернативно, фармацевтическая композиция изобретения может получаться и упаковываться в единичной дозированной форме, в которой каждая физически дискретная единица содержит эффективное количество соединения изобретения. При получении формы дозированных единиц фармацевтические композиции изобретения в типичном случае содержат от 1 до 1000 мг. Фармацевтические композиции изобретения обычно содержат одно соединение изобретения. Однако согласно некоторым воплощениям фармацевтические композиции изобретения содержат более одного соединения изобретения. Например, в некоторых воплощениях фармацевтические композиции изобретения содержат два соединения изобретения. В дополнение, фармацевтические композиции изобретения могут необязательно дополнительно включать одно или более дополнительных фармацевтически активных соединений. Фармацевтические композиции изобретения обычно содержат более одного фармацевтически приемлемого наполнителя. Однако в некоторых воплощениях фармацевтические композиции изобретения содержат один фармацевтически приемлемый наполнитель. Используемый здесь термин "фармацевтически приемлемый наполнитель" обозначает материал,композицию или наполнитель, включаемые в назначаемую форму или композицию, которая является безопасной при введении пациенту. Каждый наполнитель должен быть совместим с другими ингредиентами фармацевтической композиции во избежание ситуаций, когда при смешивании компонентов возникали бы взаимодействия, которые существенно снижали бы эффективность соединений изобретения при введении пациенту, и взаимодействия, которые давали бы в результате фармацевтические композиции,которые не являются фармацевтически приемлемыми. Кроме того, каждый наполнитель, конечно, должен быть достаточно высокой чистоты, чтобы сделать композицию фармацевтически приемлемой. Соединения изобретения и фармацевтически приемлемый наполнитель или наполнители обычно формируют в дозировочную форму, адаптируемую для введения пациенту желаемым способом введения. Например, дозировочные формы включают формы, приспосабливаемые для (1) перорального введения, такие как таблетки, капсулы, каплеты, пилюли, пастилки, порошки, сиропы, эликсиры, суспензии,растворы, эмульсии, саше и облатки; (2) парентерального введения, такие как стерильные растворы, суспензии и порошки для переустройства; (3) трансдермального введения, такие как трансдермальные пластыри; (4) ректального введения, например в виде свечей; (5) ингаляции, такой как в виде аэрозолей и растворов; и (6) местного введения, например в виде кремов, мазей, лосьонов, растворов, паст, спреев,пен и гелей. Подходящие фармацевтически приемлемые наполнители варьируют в зависимости от выбранной конкретно дозировочной формы. В дополнение, подходящие фармацевтически приемлемые наполнители могут выбираться для конкретного действия и могут служить в виде композиции. Например, определенные фармацевтически приемлемые наполнители могут выбираться по их способности облегчать получение однородных дозировочных форм. Некоторые фармацевтически приемлемые наполнители могут выбираться по их способности облегчать получение стабильных дозировочных форм. Некоторые фармацевтически приемлемые наполнители могут выбираться по их способности облегчать перенос или транспортировку соединения или соединений изобретения, введенных пациенту из одного органа или части тела в другой орган или часть тела. Некоторые фармацевтически приемлемые наполнители могут выбираться по их способности усиливать восприимчивость пациента. Подходящие фармацевтически приемлемые наполнители включают следующие типы наполнителей: разбавители, наполнители, связующие, дезинтегрирующие агенты, смазки, агенты, способствующие скольжению, гранулирующие агенты, агенты покрытий, смачивающие агенты, растворители, сорастворители, суспендирующие агенты, эмульгаторы, подсластители, вкусовые или придающие запах агенты,маскирующие вкус или запах агенты, окрашивающие агенты, антиотвердители, увлажнители, хелатирующие агенты, пластификаторы, увеличивающие вязкость агенты, антиоксиданты, консерванты, стабилизаторы, поверхностно-активные вещества и буферные агенты. Специалисты понимают, что некоторые фармацевтически приемлемые наполнители могут выполнять более одной функции и могут служить для альтернативных действий в зависимости от того, много ли наполнителя присутствует в готовой рецептурной форме и какие другие ингредиенты присутствуют в готовой форме. Специалисты обладают знаниями и квалификацией в данной области, чтобы иметь возможность выбрать подходящие фармацевтически приемлемые наполнители в соответствующих количествах для использования в изобретении. Кроме того, существует ряд источников, которые доступны специалистам и которые описывают фармацевтически приемлемые наполнители и могут быть полезными при выборе подходящих фармацевтически приемлемых наполнителей. Примерами источников являются Remington'sand the Pharmaceutical Press). Фармацевтические композиции изобретения получают с использованием приемов и методов, известных специалистам в данной области. Некоторые из используемых в данной области методов описываются в Remington's Pharmaceutical Sciences (Mack Publishing Company). Согласно одному аспекту изобретение направлено на твердую оральную дозировочную форму, такую как таблетка или капсула, включающую эффективное количество соединения изобретения и разбавитель или наполнитель. Подходящие разбавители и наполнители включают лактозу, сахарозу, декстрозу, маннит, сорбит, крахмал (например, кукурузный, картофельный и прежелатинизированный крахмал),целлюлозу и их производные (например, микрокристаллическую целлюлозу), сульфат кальция и двухосновный фосфат кальция. Оральная твердая дозировочная форма может дополнительно включать связующее. Подходящие связующие включают крахмал (например, кукурузный, картофельный и прежелатинизированный крахмал), желатин, аравийскую камедь, альгинат натрия, альгиновую кислоту, трагакант, гуаровую смолу, повидон и целлюлозу и ее производные (например, микрокристаллическую целлюлозу). Оральная твердая дозировочная форма может дополнительно включать дезинтегрирующий агент. Подходящие дезинтегрирующие агенты включают кросповидон, натрий-крахмалгликолят, кроскармеллозу, альгиновую кислоту и натрий-карбоксиметилцеллюлозу. Оральная твердая дозировочная форма может дополнительно включать лубрикант. Подходящие лубриканты включают стеариновую кислоту, стеарат магния, стеарат кальция и тальк. Согласно еще одному аспекту изобретение направлено на дозировочную форму, приспособленную для введения пациенту ингаляцией. Например, соединение изобретения может вводиться ингаляцией в легкие в виде сухого порошка, аэрозоля, суспензии или раствора. Сухие порошковые композиции для доставки в легкие с помощью ингаляции включают соединение изобретения в виде тонко измельченного порошка вместе с одним или более фармацевтически приемлемыми наполнителями в виде тонкоизмельченных порошков. Фармацевтически приемлемые наполнители, особенно подходящие для использования в сухих порошках, известны специалистам в данной области и включают лактозу, крахмал, маннит и моно-, ди- и полисахариды. Сухой порошок может вводиться пациенту из ингалятора в виде резервуара с сухим порошком(RDPI), имеющего резервуар, подходящий для хранения множества (не отмеренных доз) медикамента в форме сухого порошка. RDPI обычно включают средства для отмеривания каждой дозы медикамента из резервуара в доставочное положение. Например, отмеривающие средства могут включать мерную чашку, которая является подвижной из первого положения, в котором чашка может заполняться медикаментом из резервуара, во второе положение, в котором отмеренная доза медикамента становится доступной для ингаляции пациенту. Альтернативно, сухой порошок может быть представлен в капсулах (например, желатиновых или пластиковых), картриджах или блистерных упаковках для использования в многодозовом ингаляторе сухого порошка (MDPI). MDPI представляют собой ингаляторы, в которых медикамент включен в многодозовую упаковку, содержащую (или иначе несущую) множество определенных доз (или их часть) медикамента. Когда сухой порошок представлен в виде блистерной упаковки, она обычно включает множество блистеров для содержания медикамента в форме сухого порошка. Блистеры обычно располагаются упорядоченным образом для легкого высвобождения из него медикамента. Например, блистеры могут располагаться на блистерной упаковке в форме диска или блистеры могут быть продолговатыми по форме, например, включать полоску или ленту. Каждая капсула, картридж или блистер может, например, содержать от 20 мкг до 10 мг соединения изобретения. Аэрозоли могут образовываться с помощью суспендирования или растворения соединения по изобретению в жидком газе-вытеснителе. Подходящие жидкие газы-вытеснители включают галогенуглероды, углеводороды и другие ожижженные газы. Характерные представители жидких газов-вытеснителей включают трихлорфторметан (пропеллент 11), дихлорфторметан (пропеллент 12), дихлортетрафторэтан(пропеллент 114), тетрафторэтан (HFA-134 а), 1,1-дифтороэтан (HFA-152a), дифторметан (HFA-32), пентафторэтан (HFA-12), гептафторпропан (HFA-227a), перфторпропан, перфторбутан, перфторпентан, бутан, изобутан и пентан. Аэрозоли, включающие соединение по изобретению, обычно вводят пациенту с помощью ингалятора с отмеренными дозами (MDI). Такие устройства известны специалистам в данной области. Аэрозоль может содержать дополнительные фармацевтически приемлемые наполнители, обычно используемые с многодозовыми ингаляторами, такие как поверхностно-активные вещества, лубриканты,сорастворители и другие наполнители, для улучшения физической стабильности рецептурной формы,для улучшения технических характеристик клапана, для улучшения стабильности или вкуса. Суспензии и растворы, содержащие соединение изобретения, могут также вводиться пациенту с помощью распылителя. Растворителем или суспензионным агентом, используемым для распыления, может быть любая фармацевтически приемлемая жидкость, такая как вода, водный солевой или физиологический раствор, спирты или гликоли, например этанол, изопропиловый спирт, глицерин, пропиленгли-6 023168 коль, полиэтиленгликоль и пр. или их смеси. Солевые растворы используют соли, которые почти или совсем не обладают фармакологической активностью после введения. Для данной цели могут использоваться как неорганические соли, такие как соли щелочного металла или аммонийные соли, например хлорид натрия, хлор калия, так и органические соли, такие как калиевые, натриевые и аммониевые соли органических кислот, например аскорбиновой, лимонной, уксусной, винной и пр. К суспензии или раствору могут добавляться другие фармацевтически приемлемые наполнители. Соединение изобретения может быть добавлением неорганической кислоты, например соляной, азотной,серной и/или фосфорной кислоты; органической кислоты, например аскорбиновой, лимонной, уксусной и винной кислоты и др.; комплексообразующего агента, такого как EDTA или лимонной кислоты и их солей; или антиоксиданта, такого как витамин Е или аскорбиновая кислота. Для стабилизации соединения изобретения могут использоваться по одному или вместе. Могут добавляться консерванты, такие как хлорид бензалкония или бензойная кислота и ее соли. Могут добавляться поверхностно-активные вещества, особенно для улучшения физической стабильности суспензий. Они включают лецитин, динатрийдиоксилсульфосукцинат, олеиновую кислоту и сорбитановые сложные эфиры. Способы получения. Соединения формулы (I) могут быть получены с использованием синтетических процедур, проиллюстрированных на схемах, приведенных ниже, или с помощью приемов, известных квалифицированному химику-органику. Приемы синтеза, предоставленные на данных схемах, применимы для получения соединений изобретения, имеющих множество различных R1-R3 групп с применением соответствующих предшественников, которые, если понадобится, подходящим образом защищены, для достижения совместимости с показанными здесь реакциями. Последующее снятие защиты, если необходимо, дает соединения описанного здесь в общем типа. Хотя схемы показаны с соединениями только формулы (I), они являются иллюстративными для процессов, которые могут использоваться для получения соединений изобретения. Наименования соединений произведены с использованием компьютерной программы наименования ACD/Name Pro V6.02, доступной от Advanced Chemistry Development, Inc., 110 Yonge Street, 14thFloor, Toronto, Ontario, Canada, M5C 1T4 (http//www.acdlabs.com/). Как показано на схеме 1, соединения формулы (I) могут быть получены с помощью многостадийной последовательности реакций, из Boc-защищенной -аминокислоты, такой как промышленно доступнаяN-(трет-бутоксикарбонил)-L-лейцин. Образование соответствующего амидного производного, такого как амид Weinreb, с использованием соответствующего амина или соли амина, такой как гидрохлоридN,O-диметилгидроксиламина,с соответствующим реагентом сочетания,таким как 1,1'-карбонилдиимидазол, и соответствующим основанием, таким как DIPEA, в соответствующем растворителе, таком как CH2Cl2, с последующим восстановлением соответствующим восстанавливающим агентом, таким как LiAlH4, в соответствующем растворителе, таком как Et2O, дает требуемый альдегид. Образование еноата с соответствующим олефинирующим реагентом, таким как метил (трифенилфосфоранилиден)ацетат, в соответствующем растворителе, таком как Et2O, сопровождается сложноэфирным гидролизом соответствующим реагентом, таким как LiOH, в соответствующем растворителе, таком какTHF, MeOH и вода. Данная реакция сопровождается образованием амидной связи соответствующим ациклическим или циклическим амином и соответствующим реагентом или реагентами сочетания, такими как T3P или BOP реагент, и соответствующим основанием, таким как Et3N или DIPEA, в соответствующем растворителе, таком как CH2Cl2 или DMF. Boc снятие защиты соответствующим реагентом, таким какTFA,сопровождается сочетанием освобожденного амина с 4-третбутоксикарбонил)амино)тетрагидро-2H-пиран-4-карбоновой кислотой, соответствующим реагентом или реагентами сочетания, такими как T3P, и соответствующим основанием, таким как Et3N, в соответствующем растворителе, таком как CH2Cl2. Boc снятие защиты соответствующим реагентом, таким какHCl, приводит в результате к образованию желаемых соединений формулы (I), которые могут быть выделены в форме соответствующей соли или превращены в свободное основание с использованием общепринятых приемов.h) HCl, изопропанол. Примеры синтеза Изобретение будет описано с помощью следующих примеров, которые являются всего лишь иллюстративными и не должны рассматриваться как ограничивающие объем настоящего изобретения. Все температуры даны в градусах Цельсия, все растворители имеют наивысшую, доступную чистоту, а все реакции проходят в безводных условиях в атмосфере аргона (Ar) или азота (N2), когда необходимо. Для тонкослойной хроматографии использовали тонкослойные пластины с силикагелем AnaltechGF и силикагелем E. Merck 60 F-254. Обе, флэш и гравитационную, хроматографии осуществляли на E.Merck Kieselgel 60 (230-400 меш) силикагеле. CombiFlash систему, используемую для очистки в данном изобретении, закупали у фирмы Isco, Inc. CombiFlash очистку осуществляли с использованием предварительно наполненных силикагелем колонок, детектора с УФ-длиной волны 254 нм и множества растворителей или сочетаний растворителей. Препаративную HPLC выполняли с использованием препаративной системы Gilson с варьируемой длиной волны УФ-детекции или Agilent Mass Directed AutoPrep(MDAP) системы и с масс-, и УФ-детекцией с варьируемой длиной волны. При очистке использовали множество колонок с обращенной фазой, например Luna 5u C18(2) 100A, SunFire C18, XBridge C18 с выбором подложки колонки в зависимости от условий, используемых при очистке. Соединения элюируют с использованием градиента CH3CN и воды. В нейтральных условиях использовали CH3CN и водный градиент без всякого дополнительного модификатора, в кислотных условиях использовали кислотный модификатор, обычно 0,1% TFA (добавляемую и к CH3CN, и к воде), и в основных условиях использовали основный модификатор, обычно 0,1% NH4OH (добавляемый к воде). Аналитическую HPLC проводили с использованием системы Agilent с варьируемой длиной волны УФ-детекции с использовании хроматографии с обращенной фазой с CH3CN и водным градиентом с 0,05 или 0,1% TFA модификатором (добавляемым к каждому растворителю). LC-MS определяли с использованием или РЕ Sciex Single QuadrupoleBruker AVANCE 400 или Brucker DPX400 спектрометра. CDCl3 представляет дейтериохлороформ,DMSO-d6 представляет гексадейтериодиметилсульфоксид и MeOD представляет тетрадейтериометанол. Химические сдвиги приводятся в частях на миллионвниз от внутреннего стандарта тетраметилсилана(TMS) или калиброванные до остаточного протонного сигнала в ЯМР растворителе (например, CHCl3 вCDCl3). Сокращения для ЯМР данных являются следующими: s = синглет, d = дублет, t = триплет,-8 023168q = квартет, m = мультиплет, dd = дублет дублетов, dt = дублет триплетов, app = видимый, br = уширенный. J обозначает константу ЯМР сочетания, измеряемую в герцах. Точки плавления определяли с использованием устройства Electrothermal 9100 (Electrothermal Engineering Ltd.). Нагревание реакционных смесей с микроволновыми облучениями осуществляли на Smith Creator(закупаемом у Personal Chemistry, Foxboro, MA, владельцем которой теперь является Biotage), EmrysOptimizer (закупаемом у Personal Chemistry) или Explorer (закупаемом у СЕМ, Matthews, NC) микроволнах. Картриджи или колонки, содержащие основанные на полимерах функциональный группы (кислота,основание, хелаторы металлов и др.), могут использоваться как часть обработки соединений. "Аминовые" колонки или картриджи используются для нейтрализации или подщелачивания кислотных реакционных смесей или продуктов. Они включают NH2 аминопропил SPE-ed SPE картриджи, доступные отApplied Separations, и диэтиламино SPE картриджи, доступные от United Chemical Technologies, Inc. Сокращения перечислены в таблице ниже. Все другие сокращения такие, как описаны в ACS Style Промежуточные соединения Промежуточное соединение 1. 1,1-Диметилэтил-1S)-1-[метил(метилокси)амино]карбонилпропил)карбаматTHF (15,0 мл) добавляли 1,1'-карбонилдиимидазол (2,39 г, 14,8 ммоль) порциями на протяжении около 10 мин. После перемешивания 30 мин при КТ добавляли раствор гидрохлоридаN,O-диметилгидроксиламина (1,32 г, 13,5 ммоль) и DIPEA (2,36 мл, 13,5 ммоль) в ДМФ (4,0 мл). Реакционную смесь перемешивали в течение 2 ч при КТ с последующим концентрированием в вакууме. Остаток разбавляли EtOAc (50 мл) и промывали 1 М водн. HCl (220 мл), насыщенным водным NaHCO3(220 мл) и солевым раствором (20 мл). Органический слой сушили над Na2SO4, фильтровали и концентрировали в вакууме, получая указанное в заголовке соединение (2,60 г, 88%) в виде прозрачного бесцветного масла. К раствору LiAlH4 (0,453 г, 11,9 ммоль) в Et2O (20 мл) при 0C добавляли по каплям раствор 1,1-диметилэтил-1S)-1-[метил(метокси)амино]карбонилпропил)карбамат (2,67 г, 10,8 ммоль) в Et2O(15 мл). Реакционную смесь перемешивали в течение 30 мин при 0C и гасили EtOAc (6,5 мл) с последующим 5% водным бисульфатом калия (6,5 мл). Реакционную смесь промывали 1 М водн. HCl (310 мл), насыщенным водным NaHCO3 (310 мл) и солевым раствором (10 мл). Органический слой сушили над Na2SO4, фильтровали и концентрировали в вакууме, получая указанное в заголовке соединение в виде прозрачного бесцветного масла. Промежуточное соединение 3. Метил-(2E,4S)-4-([(1,1-диметилэтил)окси]карбониламино)-2-гексеноат К перемешиваемому раствору метил (трифенилфосфоранилиден)ацетата (4,35 г, 13,0 ммоль) в Et2O(25 мл) при комнатной температуре добавляли раствор промежуточного соединения 2 в Et2O (15 мл). Реакционную смесь перемешивали на протяжении ночи при комнатной температуре. Твердое вещество удаляли фильтрованием и раствор концентрировали в вакууме. Очистка с помощью флэшхроматографии на колонке (0-50% EtOAc/гексаны) давала указанное в заголовке соединение (1,44 г, 55% на протяжении двух стадий) в виде прозрачного бесцветного масла.(2E,4S)-4-([(1,1 диметилэтил)окси]карбониламино)-2-гексеноата (6 г, 24,66 ммоль) в ТГФ (50 мл), MeOH (10,00 мл) и воде (50,0 мл). Реакционную смесь перемешивали на протяжении ночи при комнатной температуре. Спустя 18,5 ч реакционную смесь концентрировали при пониженном давлении для удаления ТГФ и MeOH. Добавляли воду (40 мл) и водную смесь доводили до pH 3 с помощью 6 М водного HCl, измеряемого с помощью pH бумаги. Добавляли EtOAc (80 мл), слои разделяли и водный слой экстрагировали EtOAc (240 мл). Объединенные органические слои сушили над Na2SO4, концентрировали при пониженном давлении и сушили в глубоком вакууме, получая 6,09 г указанного в заголовке соединения. Раствор 50 мас.% T3P в EtOAc (22,00 мл, 37,0 ммоль) добавляли по каплям с помощью воронки к раствору(5,65 г,24,64 ммоль), 2,3-дигидро-1H-индола (2,76 мл, 24,64 ммоль) и Et3N (11 мл, 7 9 ммоль) в CH2Cl2 (90 мл) при 0C (температура бани). Гасили добавлением по каплям насыщенного водного NaHCO3 (50 мл). Слои разделяли и реакционную смесь промывали 10% лимонной кислотой (150 мл). Органический слой концентрировали в токе азота и остаток очищали с помощью флэш-хроматографии на колонке, получая 7,21 г (89%) указанного в заголовке соединения.TFA (25 мл, 324 ммоль) добавляли к раствору 1,1-диметилэтил [(1S,2E)-4-(2,3-дигидро-1H-индол-1 ил)-1-этил-4-оксо-2-бутен-1-ил]карбамата (7,21 г, 21,82 ммоль) в CH2Cl2 (25 мл). Реакционную смесь перемешивали при комнатной температуре. Спустя 3,5 ч добавляли CH2Cl2 (200 мл) и реакционную смесь концентрировали при пониженном давлении и сушили в глубоком вакууме. Раствор 50 мас.% T3P в EtOAc (1,3 мл, 2,184 ммоль) добавляли по каплям к раствору трифторацетата [(1S,2E)-4-(2,3-дигидро-1H-индол-1-ил)-1-этил-4-оксо-2-бутен-1-ил]амина (500 мг, 1,452 ммоль),4-трет-бутоксикарбонил)амино)тетрагидро-2H-пиран-4-карбоновой кислоты (356 мг, 1,452 ммоль) иEt3N (1 мл, 7,21 ммоль) в CH2Cl2 (5 мл) при 0C (температура бани). Ледяную баню удаляли и реакционную смесь перемешивали при комнатной температуре. Спустя 1 ч 20 мин реакционную смесь промывали насыщенным водным NaHCO3 (15 мл) и 10% уксусной кислотой (15 мл). Органический слой концентрировали в токе азота, а остаток очищали с помощью флэш-хроматографии на колонке, получая 251 мг К раствору N-(трет-бутоксикарбонил)-L-лейцина (3,00 г, 13,0 ммоль) в ТГ'Ф (25,0 мл) добавляли 1,1'-карбонилдиимидазол (2,52 г, 15,6 ммоль) порциями на протяжении примерно 10 мин. После перемешивания 1 ч при комнатной температуре добавляли раствор гидрохлорида N,O-диметилгидроксиламина(1,39 г, 14,3 ммоль) и DIPEA (2,49 мл, 14,3 ммоль) в ДМФ (6,0 мл). Реакционную смесь перемешивали в течение 2,5 ч при комнатной температуре с последующим концентрированием в вакууме. Остаток разбавляли EtOAc (50 мл) и промывали 1 М водн. HCl (220 мл), насыщенным водным NaHCO3 (220 мл) и солевым раствором (20 мл). Органический слой сушили над Na2SO4, фильтровали и концентрировали в вакууме, получая указанное в заголовке соединение (2,34 г, 66%) в виде прозрачного бесцветного масла. К раствору LiAlH4 (0,356 г, 9,38 ммоль) в Et2O (20 мл) при 0C добавляли по каплям растворEt2O (15 мл). Реакционную смесь перемешивали в течение 30 мин при 0C и гасили EtOAc (6 мл) с последующим 5% водным бисульфатом калия (6 мл). Реакционную смесь промывали 1 М водн. HCl(210 мл), насыщенным водным NaHCO3 (210 мл) и солевым раствором (10 мл). Органические слой сушили над Na2SO4, фильтровали и промывали 1 М водн. HCl (210 мл) и концентрировали в вакууме,получая указанное в заголовке соединение в виде прозрачного бесцветного масла. Промежуточное соединение 10. Метил(2E,4S)-4-([(1,1-диметилэтил)окси]карбониламино)-6-метил-2-гептеноат(25 мл) при комнатной температуре добавляли раствор промежуточного соединения 9 в Et2O (15 мл). Реакционную смесь перемешивали в течение 15 ч при комнатной температуре. Твердое вещество удаляли фильтрованием и раствор концентрировали в вакууме. Очистка с помощью флэш-хроматографии на колонке (0-50% EtOAc/гексаны) давала указанное в заголовке соединение (1,74 г, 75% на протяжении двух стадий) в виде прозрачного бесцветного масла.(5,00 г, 18,43 ммоль) в ТГФ (15 мл), MeOH (15,0 мл) и воды (15 мл) добавляли LiOH (2,206 г,92,00 ммоль). После перемешивания в течение 2 ч при комнатной температуре реакционную смесь концентрировали в вакууме. Реакционную смесь подкисляли 6 М водн. HCl до pH 5, а затем экстрагировалиEtOAc. Органический слой промывали водой, сушили над Na2SO4, фильтровали и концентрировали в вакууме, получая указанное в заголовке соединение (4,7 г, 99%) в виде белого полутвердого вещества.(4,70 г, 18,26 ммоль) в ДМФ (30,0 мл) добавляли BOP реагент (8,08 г, 18,26 ммоль) и DIPEA (6,38 мл,36,5 ммоль). После перемешивания при комнатной температуре в течение 5 мин добавляли 2,3-дигидро 1H-индол (2,053 мл, 18,26 ммоль) перемешивание продолжали на протяжении ночи. Реакционную смесь разбавляли водой и экстрагировали EtOAc. Органический слой промывали солевым раствором, сушили над Na2SO4, фильтровали, концентрировали в вакууме и очищали с помощью флэш-хроматографии на колонке (0-20% EtOAc/гексаны), получая указанное в заголовке соединение (4,83 г, 74%) в виде белого твердого вещества. К раствору 1,1-диметилэтил[(1S,2E)-4-(2,3-дигидро-1H-индол-1-ил)-1-(2-метилпропил)-4-оксо-2 бутен-1-ил]карбамата (3,21 г, 8,95 ммоль) в CH2Cl2 (10,0 мл) добавляли TFA (10 мл, 130 ммоль). Реакционную смесь перемешивали в течение 17,5 ч при комнатной температуре, а затем концентрировали при пониженном давлении и сушили в глубоком вакууме, получая указанное в заголовке соединение. Раствор 50 мас.% T3P в EtOAc (1,2 мл, 2,016 ммоль) добавляли по каплям к раствору трифторацетата [(1S,2E)-4-(2,3-дигидро-1H-индол-1-ил)-1-(2-метилпропил)-4-оксо-2-бутен-1-ил]амина (500 мг,1,343 ммоль), 4-трет-бутоксикарбонил)амино)тетрагидро-2H-пиран-4-карбоновой кислоты (329 мг,1,343 ммоль) и Et3N (0,93 мл, 6,71 ммоль) в CH2Cl2 (5 мл) при 0C (температура бани). Ледяную баню удаляли и реакционную смесь перемешивали при комнатной температуре. Спустя 1 ч 20 мин реакционную смесь промывали насыщенным водным NaHCO3 (15 мл) и 10% лимонной кислотой (15 мл). Органический слой концентрировали в токе азота, а остаток очищали с помощью флэш-хроматографии на колонке, получая 204 мг (31%) указанного в заголовке соединения.[4-([(1S,2E)-4-(2,3-дигидро-1H-индол-1-ил)-1-этил-4-оксо-2-бутен-1-ил]аминокарбонил)тетрагидро-2Hпиран-4-ил]карбамата (251 мг, 0,549 ммоль) в изопропаноле (2,5 мл). Реакционную колбу снабжали воздушным конденсатором и нагревали до 65C (температура бани) в течение 1 ч 45 мин. Растворитель выпаривали при пониженном давлении. К остатку добавляли воду и смесь концентрировали при пониженном давлении при 65C. К остатку добавляли воду (2 мл) и смесь лиофилизовали, получая 193,3 мг (89%) указанного в заголовке соединения.[4-([(1S,2E)-4-(2,3-дигидро-1H-индол-1-ил)-1-(2-метилпропил)-4-оксо-2-бутен-1 ил]аминокарбонил)тетрагидро-2H-пиран-4-ил]карбамата (251 мг, 0,517 ммоль) в изопропаноле (2,5 мл). Реакционную колбу снабжали воздушным конденсатором и реакционную смесь нагревали до 65C (температура бани). Спустя 1 ч 45 мин растворитель выпаривали при пониженном давлении при 60C. К остатку добавляли воду (5 мл) и смесь концентрировали при пониженном давлении при 65C. К остатку добавляли воду (2 мл), и смесь лиофилизовали, получая 130,6 мг (60%) указанного в заголовке соединения.H ЯМР (400 МГц, метанол-d4)част/млн. 8,15 (д, J=7,03 Гц, 1H); 7,25 (д, J=7,03 Гц, 1H); 7,18 (т,J=7,65 Гц, 1H); 7,06 (т, J=7,91 Гц, 1H); 6,81 (дд, J=15,18, 6,40 Гц, 1H); 6,49 (ушир.с, 1H); 4,73-4,85 (м, 2H); 4,21 (т, J=8,28 Гц, 2H); 3,91-3,97 (м, 2H); 3,70-3,77 (м, 2H); 3,25-3,21 (м, 2H); 2,35-2,48 (м, 2H); 1,82 (д,J=14,31 Гц, 2H); 1,63-1,71 (м, 2H); 1,50-1,57 (м, 1H); 0,98 (дд, J=11,92, 6,40 Гц, 6 Н). Биологическая предпосылка. Биологический анализ(ы. Соединения формулы (I) являются ингибиторами катепсина С, которые непосредственно ингибируют активность серинпротеаз, которые активируются катепсином С, таким как NE. Соединения формулы (I), следовательно, могут применяться при лечении COPD и других состояний, вовлекающих катепсин С и/или такие серинпротеазы. Биологическая активность соединения формулы (I) может быть определена с использованием любого подходящего анализа на определение соединения-кандидата как ингибитора катепсина С или на определение способности соединения-кандидата предотвращать опосредуемое катепсином С активирование определенных серинпротеаз, а также подходящие ткани и модели invivo. А. Люминесцентный анализ жизнеспособности, основанный на транспептидировании лейцинлейцин-O-метил (LLOM) клеток Принцип. Было показано, что катепсин С катализирует транспептидирование дипептидил-метил-О-сложных эфиров в липосомах из линейных моноцитных клеток HL60, U937 или ТНР 1, вызывая мембранолитический эффект, что приводит в результате к гибели клеток (DL. Thiele, P. Lipsky PNAS 1990. Vol. 87, p. 8387). Данный механизм использовали для оценки активности катепсина С в клетках в присутствии соединений изобретения.- 13023168 Замороженные HL-60 клетки повторно суспендировали при 1,25105 клеток/мл в свежей предварительно подогретой Iscove's модифицированной Dulbeccos' среде (EMDM, содержит 25 мМ глутамат) с 20% FBS. Данную суспензию распределяли (8 мкл) в белые низкообъемные 384-луночные планшеты. На планшеты предварительно помещали 100 нл соединения при наибольшей концентрации 2,5 мМ и серийно разбавляли 1:3. Контрольные и холостые лунки содержали 100 нл ДМСО. В каждую лунку затем добавляли 2 мкл свежего 1,25 мМ раствора лейцин-лейцин-О-метил (LLOM, Bachem) в IMDM плюс 25 мМHEPES (конечная концентрация LLOM 250 мкМ). Планшеты накрывали и инкубировали в течение 4 ч при 37C в 5% CO2 инкубаторе, затем удаляли и уравновешивали до комнатной температуры в течение 10 мин. Жизнеспособность клеток определяли с помощью CellTiter-Glo люминесцентного анализа(Promega) в соответствии с инструкциями производителя. Жизнеспособность клеток сравнивали с контролями, не содержащими LLOM (100%).B. Анализ in vitro рекомбинантного катепсина С. Активность рекомбинантного человеческого катепсина С измеряли с помощью расщепления фторогенного субстрата, H-Ser-Tyr-АМС. Вкратце, 24 пМ катепсина С инкубировали с испытуемым соединением (например, ингибитором) в буфере, состоящем из 50 мМ ацетата натрия, 30 мМ хлорида натрия,1 мл CHAPS, 1 мМ дитиотреитола, 1 мМ EDTA, pH 5,5 при комнатной температуре в течение 1 ч. После одночасового инкубирования испытуемого соединения с катепсином С начинали анализ на активность добавлением равного объема 0,010 мМ H-Ser-Tyr-AMC в том же буфере. Спустя 1 ч анализ на активность прекращали добавлением 1/5 объема 100 мкМ Е-64. Продукт реакции измеряли на счетчике флуоресценции при длине волны возбуждения 360 нм и длине волны эмиссии 460 нм и оборудованном 400 нм дихроичным зеркалом. В среднем по двум экспериментам соединения примеров 1 и 2, каждое, показывали 50% ингибирование катепсина С при концентрации менее чем 1 нМ.C. Подвергание мышей действию сигаретного дыма в in vivo анализе. Подвергание мышей действию сигаретного дыма и лечение лекарственным средством. Начиная с возраста 3-4 недели самок мышей C57BL/6 (Jackson Laboratory, Bar Harbor, ME) подвергали действию только через нос 4% сигаретного дыма от 3R4F сигарет (College of Agriculture, ReferenceCigarette Program, University of Kentucky) в течение 2 ч/день, 5 дней/неделю в течение 18 недель. Дым генерировали Baumgartner-Jaeger CSM 2070i курительным устройством (CH Technologies Inc., Westwood,NJ). Во время подвергания воздействию дыма или воздуха (бутафорский контроль) мышей содержали в трубках из нержавеющей стали, содержащих носовые конические вставки из нержавеющей стали. Через 2 ч после окончательного подвергания действию дыма собирали бронхоальвеолярный лаваж (BAL) жидкость (n=3 на группу с лечением). Во время конечных 6 недель 18-недельного подвергания действию мышам вводили перорально лекарственное средство или только наполнитель (1% метилцеллюлоза/25 мМ цитрат, pH 4,0) дважды в день) с интервалами 11 и 13 ч), 7 дней/неделя. Мыши, подвергаемые бутафорскому воздействию, получали только наполнитель, тогда как мыши, подвергаемые действию дыма, получали одно из следующих лечебных средств: один наполнитель, соединение примера 1 в количестве 1, 10 или 30 мг/кг или соединение примера 2 - 1, 10 или 30 мг/кг. Мыши получали первую ежедневную дозу лекарства или одного наполнителя за 1 ч до начала подвергания действию дыма/имитации. Бронхоальвеолярный лаваж. Мышей подвергали эвтаназии с использованием в.п. инъекции 0,1 мл Fatal Plus (VortechPharmaceuticals, Dearborn, MI) и в трахеи вставляли трубчатые канюли РЕ 90 с 3-дюймовой длиной (BD,Franklin Lakes, NJ), к которым присоединяли притупленную иглу 21-калибра, соединенную с 3-сторонним запорным краном (Baxter Healthcare, Deerfield, IL). Вводили четырежды 1 мл аликвоты холодного ледяного PBS и последовательно удаляли отдельно через канюлю, BAL жидкость центрифугировали при 140g в течение 2 мин. Клеточные пеллеты собирали от четырех аликвот и с использованием гемоцитометра подсчитывали все клетки. Дифференциальный клеточный анализ проводили на цитоцентрифугах с использованием штамма Wright-Geimsa. Статистический анализ. Данные представлены на фиг. 1-3 в виде среднего + S.E.M. Статическую значимость определяли с использованием одностороннего ANOVA с Bonferroni пост-тестом. Величины p0,05 считали значимыми.p0,05;p0,01;p0,001. Показанные процентные величины указывают процентное ингибирование в окне между животными, обработанными наполнителем/подвергнутыми действию дыма, и животными, обработанными наполнителем/подвергнутыми бутафорскому действию. Полагают, что соединения изобретения полезны в терапии, определенной выше, и не проявляют неприемлемых или неблагоприятных эффектов при использовании в соответствии с допустимым терапевтическим режимом. Представленные выше примеры и анализ даны для иллюстрации изобретения и не ограничивают его. Объем заявленного изобретения ограничивается нижеприведенной формулой изобретения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы (I) или его фармацевтически приемлемая соль где R1 и R2, взятые вместе с азотом, к которому они присоединены, представляют 5-6-членное насыщенное или ненасыщенное кольцо, необязательно конденсированное с фенильной группой; иR3 представляет собой (С 1-С 6)алкил или (С 3-С 6)циклоалкил(C1-С 4)алкил. 2. Соединение по п.1, которое представляет собой 4-амино-N-[(1S,2E)-4-(2,3-дигидро-1H-индол-1 ил)-1-этил-4-оксо-2-бутен-1-ил]тетрагидро-2H-пиран-4-карбоксамид или его фармацевтически приемлемую соль. 3. Соединение по п.1, которое представляет собой гидрохлорид 4-амино-N-[(1S,2E)-4-(2,3-дигидро 1H-индол-1-ил)-1-этил-4-оксо-2-бутен-1-ил]тетрагидро-2H-пиран-4-карбоксамида. 4. Соединение по п.1, которое представляет собой 4-амино-N-[(1S,2E)-4-(2,3-дигидро-1H-индол-1 ил)-1-(2-метилпропил)-4-оксо-2-бутен-1-ил]тетрагидро-2H-пиран-4-карбоксамид или его фармацевтически приемлемую соль. 5. Соединение по п.1, которое представляет собой гидрохлорид 4-амино-N-[(1S,2 Е)-4-(2,3-дигидро 1H-индол-1-ил)-1-(2-метилпропил)-4-оксо-2-бутен-1-ил]тетрагидро-2H-пиран-4-карбоксамида. 6. Фармацевтическая композиция для лечения хронического обструктивного заболевания легких,включающая соединение или его фармацевтически приемлемую соль по любому из пп.1-5 и фармацевтически приемлемый наполнитель. 7. Способ получения композиции по п.6, включающий смешивание соединения или его фармацевтически приемлемой соли по любому из пп.1-5 с фармацевтически приемлемым наполнителем. 8. Способ лечения хронического обструктивного заболевания легких, включающий введение пациенту эффективного количества соединения или его фармацевтически приемлемой соли по любому из пп.1-5. 9. Способ лечения хронического обструктивного заболевания легких, включающий введение пациенту фармацевтической композиции по п.6. 10. Применение соединения или его фармацевтически приемлемой соли по любому из пп.1-5 для лечения хронического обструктивного заболевания легких. 11. Применение соединения или его фармацевтически приемлемой соли по любому из пп.1-5 для производства лекарственного средства для лечения хронического обструктивного заболевания легких.
МПК / Метки
МПК: A61K 31/35, A01N 43/16
Код ссылки
<a href="https://eas.patents.su/17-23168-ingibitor-katepsina-s.html" rel="bookmark" title="База патентов Евразийского Союза">Ингибитор катепсина с</a>
Предыдущий патент: Подошва для обуви, растягивающаяся и приспосабливающаяся к различной ширине монтажной колодки и изменениям конфигурации ступни
Следующий патент: Амиды n-(1,2,5-оксадиазол-3-ил)-, n-(тетразол-5-ил)- и n-(триазол-5-ил)бициклоарилкарбоновых кислот и гербицидные средства
Случайный патент: Противоточное шахтное осушительное устройство полочного типа с перемещаемыми полками для высушивания агломератов с небольшой механической прочностью












