Бифенил- и нафтилфенилпроизводные гидроксамовой кислоты
Номер патента: 12729
Опубликовано: 30.12.2009
Авторы: Мерлини Лучио, Дзунино Франко, Джаннини Джузеппе, Даллавалле Сабрина, Пизано Клаудио, Пенко Серджо, Весчи Лоредана
Формула / Реферат
1. Соединение формулы (I)
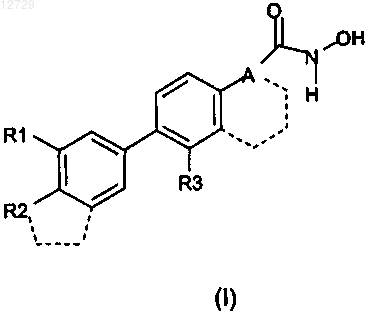
в которой R1 выбран из группы, состоящей из Н, адамантила, Cl;
R2 выбран из группы, состоящей из ОМе, Cl, CN и (CH2)nOH, где n равно 0, 1 и 2; или
R2, взятый вместе с кольцом, с которым он связан, образует метилен- или этилендиоксипроизводное;
R3 выбран из Н и Cl;
А представляет собой одну из следующих двухвалентных групп: [СН=СН] (транс), [СуС] или группа А, взятая вместе с кольцом, с которым она связана, образует нафтильную группу.
2. Соединение формулы (I) по п.1, которое выбрано из группы, состоящей из
Е-3-(4'-гидроксибифенил-4-ил)-N-гидроксиакриламида;
Е-3-[3'-(1-адамантил)-4'-гидроксибифенил-4-ил]-N-гидроксиакриламида;
N-гидроксиамида 6-[3-1-(адамантил)-4- гидроксифенил]нафталин-2-карбоновой кислоты;
N-гидроксиамида 6-[3-1-(адамантил)-4-метоксифенил]нафталин-2-карбоновой кислоты;
3-[4-(8-адамантан-1-ил-2,3-дигидробензо[1,4]диоксин-6-ил)фенил]-N-гидроксиакриламида;
Е-3-(3'-адамантан-1-ил-2-хлор-4'-гидроксибифенил-4-ил)-N-гидроксиакриламида;
Е-3-(3'-адамантан-1-ил-4'-метоксибифенил-4-ил)-N-гидроксиакриламида;
Е-3-(4'-гидроксибифенил-4-ил)-N-гидроксипропиоламида;
Е-3-(4'-гидроксиметилбифенил-4-ил)-N-гидроксиакриламида;
Е-3-(3'-хлор-4'-гидроксибифенил-4-ил)-N-гидроксиакриламида;
Е-3-[4'-метоксибифенил-4-ил]-N-гидроксиакриламида;
Е-3-[4'-цианобифенил-4-ил]-N-гидроксиакриламида и
Е-3-[4'-хлорбифенил-4-ил]-N-гидроксиакриламида.
3. Способ получения соединений по п.1 или 2, включающий взаимодействие соответствующих карбоновых кислот с гидрохлоридом гидроксиламина.
4. Фармацевтическая композиция, предназначенная для лечения опухолевых патологий, содержащая в качестве активного ингредиента соединение по любому из пп.1, 2 и по меньшей мере один фармацевтически приемлемый эксципиент и/или разбавитель.
5. Композиция по п.4, предназначенная для лечения опухолевой патологии, при которой опухоль проявляет лекарственную резистентность к другим противоопухолевым лекарственным средствам, применяемым для такого же лечения.
6. Композиция по п.4 или 5 для лечения опухолевой патологии, где опухолевая патология выбрана из группы, состоящей из саркомы, карциномы, карциноида, костной опухоли, нейроэндокринной опухоли, лимфоидного лейкоза, острого промиелоцитарного лейкоза, миелоидного лейкоза, моноцитарного лейкоза, мегакариобластного лейкоза и болезни Ходжкина.
7. Композиция по любому из пп.4-6, в которой активный ингредиент объединен с одним или несколькими известными противоопухолевыми агентами.
8. Композиция по п.7, в которой известный противоопухолевый агент выбран из группы, состоящей из алкилирующих агентов, ингибиторов топоизомеразы, антитубулиновых агентов, интеркаляционных соединений, антиметаболитов, природных продуктов, таких как алкалоиды барвинка, эпиподофиллотоксинов, антибиотиков, ферментов, таксанов и цитодифференцирующих соединений.
9. Композиция по п.8, в которой цитодифференцирующее противоопухолевое соединение представляет собой полностью трансретиноевую кислоту.
10. Способ получения композиции по любому из пп.4-9, включающий смешивание активного ингредиента по меньшей мере с одним фармацевтически приемлемым эксципиентом и/или разбавителем.
11. Применение соединения по любому из пп.1, 2 для получения лекарственного средства с противоопухолевой активностью.
12. Применение соединения по любому из пп.1, 2 для получения лекарственного средства для лечения опухолевой патологии, где опухоль проявляет лекарственную резистентность к другим противоопухолевым лекарственным средствам, применяемым для такого же лечения.
13. Применение по п.11 или 12, где опухоль выбрана из группы, состоящей из саркомы, карциномы, карциноида, костной опухоли, нейроэндокринной опухоли, лимфоидного лейкоза, острого промиелоцитарного лейкоза, миелоидного лейкоза, моноцитарного лейкоза, мегакариоцитарного лейкоза и болезни Ходжкина.
14. Применение по п.13, где опухоль представляет собой острый промиелоцитарный лейкоз.
15. Способ лечения млекопитающего, страдающего опухолевой патологией, где опухоль проявляет лекарственную резистентность к другим противоопухолевым лекарственным средствам, применяемым для такого же лечения, и выбрана из группы, состоящей из саркомы, карциномы, карциноида, костной опухоли, нейроэндокринной опухоли, лимфоидного лейкоза, острого промиелоцитарного лейкоза, миелоидного лейкоза, моноцитарного лейкоза, мегакариоцитарного лейкоза и болезни Ходжкина, предпочтительно острого промиелоцитарного лейкоза, включающий введение терапевтически эффективного количества соединения по любому из пп.1 или 2.
16. Способ по п.15, в котором соединение объединено с одним или несколькими известными противоопухолевыми агентами.
17. Способ по п.16, в котором известный противоопухолевый агент представляет собой полностью трансретиноевую кислоту.
Текст
012729 Область техники, к которой относится изобретение Настоящее изобретение относится к бифенил- и фенилнафтилсоединениям, имеющим гидроксамовую группу, которые обладают противоопухолевой и антиангиогенной активностью. Уровень техники изобретения Описана антипролиферативная и антиангиогенная активность нескольких соединений, аналогичных по структуре классу соединений, описанных в настоящем изобретении. Описано, что (6[3'-(1-адамантил)-4'-гидроксифенил]-2-нафталинкарбоновая кислота (AHPN), также названная CD437) (Cancer Research, 2002; 62(8), 2430-6; Blood, 2000; 95, 2672-82; Leukemia, 1999, 13, 73949; Cancer Letters, 1999, 137, 217-2), является селективной в отношении к гамма-рецептору ретиноевой кислоты RAR-, ингибирует клеточный рост и индуцирует апоптоз в клеточной линии карциномы молочной железы, меланомы и цервикальной клеточной карциномы, включая линии, которые устойчивы к полностью транс-ретиноевой кислоте (ATRA), по механизму, независимому от рецепторного связывания(Clin. Cancer Res. 1999, 5, 2304-10) или производные, такие как RE-80, АМ-580 или Am-80 (Eur. J. Pharmacol. 1993, 249, 113-6), проявляют антиангиогенные свойства. Недавно описаны новые соединения, которые представляют собой бифенилпроизводные акриловой кислоты (Cincinelli R. et al., J. Med. Chem. 2003, 46: 909-912 и WO03/11808). Было обнаружено на большом перечне опухолевых клеток человека, что в особенности соединение, названное ST1926 (Е-3-(4'гидрокси-3'-адамантилбифенил-4-ил)акриловая кислота), обладает сильной антипролиферативной активностью. Описано, что один из последних разработанных аналогов CD437, соединение (Е)-4-[3'-(1 адамантил)-4'-гидроксифенил]-3-хлоркоричная кислота (3-Cl-АНРС) (Dawson, M.I. et al. J. Med. Chem. 2004, 47(14), 3518-3536; WO0348101) ингибирует пролиферацию и индуцирует апоптоз раковых клеток как in vitro, так и in vivo. В патенте JP10182583 описаны некоторые производные фенилциннамогидроксамовой кислоты,оказывающие индуцирующее дифференциацию воздействие на раковые клетки и применимые как лекарственные средства при лечении злокачественных опухолей, аутоиммунных заболеваний и кожных заболеваний. Описание изобретения Соединения настоящего изобретения отличаются присутствием гидроксамовой группы, которая неожиданно придает соединениям высокую противоопухолевую активность. В частности, соединения изобретения являются неожиданно активными в отношении клеточных линий опухолей, которые становятся резистентными к другим известным противоопухолевым соединениям, которые принадлежат к аналогичным химическим классам, но не содержат гидроксамовую группу. Следовательно, главной задачей настоящего изобретения является получение бифенил- и фенилнафтилсоединений формулы (I)R3 выбран из Н и Cl; А представляет собой одну из следующих двухвалентных групп: [СН=СН](транс), [СС] или А,взятая вместе с кольцом, с которым она связана, образует нафтильную группу. Как уже указано, соединения настоящего изобретения проявляют неожиданную противоопухолевую активность в отношении линий опухолевых клеток, которые становятся резистентными к другим известным противоопухолевым соединениям. Предпочтительно, они имеют индекс резистентности ниже 5, более предпочтительно, близко к 1. Индекс резистентности представляет собой отношение между величиной IC50, измеренной для линий резистентных опухолевых клеток, и IC50, измеренной для линий восприимчивых опухолевых клеток[(IC50 для линий резистентных опухолевых клеток/IC50 для линий восприимчивых опухолевых клеток)]; для определения этой величины сделана ссылка на соответствующий раздел, озаглавленный Биологиче-1 012729 ские исследования. Ниже представлены некоторые из наиболее предпочтительных соединений согласно изобретению: Е-3-(4'-гидроксибифенил-4-ил)-N-гидроксиакриламид (ST2782); Е-3-[3'-(1-адамантил)-4'-гидроксибифенил-4-ил]-N-гидроксиакриламид (ST2992);N-гидроксиамид 6-[3-1(адамантил)-4-метоксифенил]-нафталин-2-карбоновой кислоты (ST3259); 3-[4-(8-адамантан-1-ил-2,3-дигидробензо[1,4]диоксин-6-ил)фенил]-N-гидроксиакриламид (ST3081); Е-3-(3'-адамантан-1-ил-2-хлор-4'-гидроксибифенил-4-ил)-N-гидроксиакриламид (ST3088); Е-3-(3'-адамантан-1-ил-4'-метоксибифенил-4-ил)-N-гидроксиакриламид (ST3056); Е-3-(4'-гидроксиметилбифенил-4-ил)-N-гидроксиакриламид (ST3258); Е-3-(3'-хлор-4'-гидроксибифенил-4-ил)-N-гидроксиакриламид (ST3192); Е-3-[4'-метоксибифенил-4-ил]-N-гидроксиакриламид (ST3595); Е-3-[4'-цианобифенил-4-ил]-N-гидроксиакриламид (ST3604) и Е-3-[4'-хлорбифенил-4-ил]-N-гидроксиакриламид (ST3483). Полученные экспериментальные результаты (описанные в разделе, озаглавленном Примеры) показывают, что соединения формулы (I), как в отдельности, так и в сочетании с другими известными противоопухолевыми лекарственными средствами, являются полезными агентами для лечения опухолей. Следующей задачей описываемого здесь изобретения является обеспечение соединений общей формулы (I) и их применение в области медицины. Следующей задачей описываемого здесь изобретения является обеспечение фармацевтической композиции, содержащей в качестве активного ингредиента соединение формулы (I), по меньшей мере один фармацевтически приемлемый эксципиент и/или разбавитель. Следующей задачей описываемого здесь изобретения является обеспечение соединений общей формулы (I) и способ их получения. Следующей задачей описываемого здесь изобретения является обеспечение фармацевтической композиции, содержащей в качестве активного ингредиента соединение формулы (I), для лечения опухолевой патологии, где опухоль выбрана из группы, состоящей из саркомы, карциномы, карциноида, костной опухоли, нейроэндокринной опухоли, лимфоидного лейкоза, острого промиелоцитарного лейкоза,миелоидного лейкоза, моноцитарного лейкоза, мегакариобластного лейкоза и болезни Ходжкина. Следующей задачей описываемого здесь изобретения является обеспечение фармацевтической композиции, содержащей в качестве активного ингредиента соединение формулы (I), для лечения опухолевой патологии, где опухоль проявляет лекарственную резистентность к другим противоопухолевым агентам, применяемым для такого же лечения. Следующей задачей описываемого здесь изобретения является обеспечение фармацевтической композиции, содержащей в качестве активного ингредиента соединение формулы (I) в сочетании с одним или несколькими известными противоопухолевыми агентами, где противоопухолевое соединение выбрано из группы, состоящей из алкилирующих агентов, ингибиторов топоизомеразы, антитубулиновых агентов, интеркаляционных соединений, антиметаболитов, природных продуктов, таких как алкалоиды барвинка, эпиподофиллотоксины, антибиотики, ферменты, таксаны и цитодифференцирующие соединения. Среди цитодифференцирующих противоопухолевых агентов предпочтительным агентом является полностью транс-ретиноевая кислота (ATRA). Следующей задачей описываемого здесь изобретения является применение соединения формулы (I) для получения лекарственного средства для лечения опухолевой патологии. Следующей задачей описываемого здесь изобретения является применение соединения формулы (I) для получения лекарственного средства для лечения опухолевой патологии, где опухоль проявляет лекарственную резистентность к другим противоопухолевым лекарственным средствам, применяемым для такого же лечения. Следующей задачей описываемого здесь изобретения является применение соединения формулы (I) в сочетании с одним или несколькими известными противоопухолевыми агентами для получения лекарственного средства для лечения опухолевых патологий. Следующей задачей описываемого здесь изобретения является применение соединения формулы (I) в сочетании с полностью транс-ретиноевой кислотой для получения лекарственного средства для лечения острого промиелоцитарного лейкоза. Еще одной задачей настоящего изобретения является обеспечение способа получения фармацевтических композиций изобретения, включающего смешивание активного ингредиента по меньшей мере с одним фармацевтически приемлемым эксципиентом и/или разбавителем. Следующей задачей настоящего изобретения является обеспечение способа лечения млекопитающего, страдающего опухолевой патологией, как указано выше, включающего введение терапевтически эффективного количества соединения(ий) формулы (I). Терапевтически эффективным количеством является количество, эффективное для достижения требуемого лечебного результата при лечении субъекта. Фармацевтические композиции могут содержать-2 012729 фармацевтически приемлемые носители, биологически совместимые среды, подходящие для введения животному (например, физиологический раствор соли) и необязательно включающие вспомогательные средства (подобные эксципиентам, стабилизаторам или разбавителям), которые облегчают технологию изготовления из активных соединений препаратов, которые можно применять в фармации. Фармацевтические композиции можно изготавливать любым приемлемым путем для удовлетворения требований способа введения. Применение биоматериалов и других полимеров для доставки лекарственного средства, а также различные методики и модели для обоснования конкретного способа введения описаны в литературе. Можно также применять модификации соединений изобретения для улучшения проникновения через гематоэнцефалический барьер головного мозга. Специалист в данной области может применять и определять любой приемлемый способ введения. Например, введение можно осуществлять различными парентеральными путями, такими как подкожный,внутривенный, внутрикожный, внутримышечный, внутрибрюшинный, интраназальный, чрескожный,пероральный или буккальный пути. Парентеральное введение можно проводить путем инъекции болюса или ступенчатой перфузией в течение определенного периода времени. Препараты для парентерального введения включают стерильные водные или неводные растворы, суспензии и эмульсии, которые могут содержать вспомогательные агенты или эксципиенты, известные в данной области, и которые можно изготавливать согласно общепринятым способам. Кроме того, можно вводить суспензию активных соединений, если требуются маслянистые суспензии, для инъекций. Подходящие липофильные растворители или носители включают жирные масла, например кунжутное масло, или сложные эфиры жирных кислот, например сложные эфиры кунжутного масла, или сложные эфиры синтетических жирных кислот, например этилолеат или триглицериды. Водные суспензии для инъекций, которые могут содержать вещества, повышающие вязкость суспензии, включают, например, натриевую соль карбоксиметилцеллюлозы, сорбит и/или декстран. Суспензия необязательно может также содержать стабилизаторы. Фармацевтические композиции включают подходящие растворы для введения путем инъекции и содержат от приблизительно 0,01 до 99%, предпочтительно от приблизительно 20 до 75% активного соединения вместе с эксципиентом. Композиции, которые можно вводить ректально, включают суппозитории. Понятно, что вводимая доза будет зависеть от возраста, пола, состояния здоровья и массы реципиента, вида сопутствующего лечения, если оно имеется, частоты лечения и природы требуемого воздействия. Доза может быть адаптирована для индивидуального субъекта, как в состоянии понять и определить специалист в данной области. Суммарную дозу, требуемую для каждого лечения, можно вводить многократными дозами или в виде однократной дозы. Фармацевтическую композицию настоящего изобретения можно вводить одну или в сочетании с другими терапевтическими средствами, предназначенными для лечения данного состояния или других симптомов состояния пациента. Обычно суточная доза активного ингредиента составляет от 0,01 до 100 мг на килограмм массы тела. Соединения настоящего изобретения можно вводить пациенту внутривенно в фармацевтически приемлемом носителе, таком как физиологический солевой раствор. Можно применять стандартные способы для внутриклеточной доставки пептидов, например, доставку посредством липосом. Такие способы хорошо известны специалисту в данной области. Препараты данного изобретения применимы для парентерального введения, такого как внутривенное, подкожное,внутримышечное и внутрибрюшинное. Как хорошо известно в области медицины, дозы для любого пациента зависят от многих факторов,включающих комплекцию пациента, участок поверхности тела, возраст, конкретное соединение для введения, пол, время и путь введения, общее состояние здоровья, а также другие совместно вводимые лекарственные средства. Все цитированные здесь ссылки полностью включены в описание, включая все данные, таблицы,фигуры и текст, присутствующий в этих ссылках. Кроме того, полные содержания ссылок, цитируемых в ссылках, которые включены в данное описание, также полностью включены в описание в качестве ссылки. Ссылка на стадии известного способа,стадии общепринятого способа, известные способы или общепринятые способы никоим образом не является допущением того, что любой аспект, описание или вариант осуществления настоящего изобретения описан, указан или предлагается в рассматриваемой области. Если понятны отличительные признаки способов и продуктов, описанных в настоящей заявке, необходимость и тип дополнительных стадий можно легко установить изучением или анализом предшествующего уровня техники, а также неограничивающих нижеследующих фигур и примеров, описывающих основные детали и некоторые применения изобретения. Соединения настоящего изобретения можно легко получить согласно способу, в котором применяют в качестве исходного вещества соответствующую карбоновую кислоту. Такие соответствующие карбоновые кислоты можно получить согласно методикам, описанным в WO9703682, JP10182583,-3 012729WO03/11808 и аналогичных публикациях или согласно стандартной методике органического синтеза. В качестве удобного эталона можно применять схемы реакции, описанные в разделе Примеры, и можно легко разработать синтез конкретного соединения формулы (I). Нижеследующие примеры, в которых сделаны ссылки на упоминаемые фигуры, иллюстрируют изобретение. Описание чертежей На фиг. 1 изображены химические структуры соединений, синтезы и биологические испытания которых описаны в настоящей заявке. Соединения, имеющие гидроксамовую группу, описаны с их идентификационным номером, указанным в примерах или ссылочных примерах и в скобках указан идентификационный номер соединения соответствующей карбоновой кислоты. Соединения, идентифицированные по номерам (в скобках), и данные их соответствующей биологической активности описаны только для целей сравнения. На фиг. 2 изображены химические структуры соединений, биологические испытания которых описаны в данной заявке, но которые находятся вне объема настоящего изобретения. Соединения, имеющие гидроксамовую группу, описаны с их идентификационным номером, как указано в примерах и ссылочных примерах, и в скобках указан идентификационный номер соответствующего соединения карбоновой кислоты. Соединения, идентифицированные по номерам (в скобках), и соответствующие данные их биологической активности описаны только для сравнительных целей. Примеры Пример 1. Получение Е-3-(4'-гидроксибифенил-4-ил)-N-гидроксиакриламида (ST2782) Указанное в заголовке соединение получали согласно схеме синтеза 1, приведенной ниже. Схема синтеза 1 250 мг (1,04 ммоль) Е-4-(4-гидроксифенил)коричной кислоты растворяли в атмосфере азота в 10 мл ДМФА, затем добавляли 169 мг (1,25 ммоль) гидрата гидроксибензотриазола и 259 мг (1,35 ммоль) гидрохлорида 1-(3-диметиламинопропил)-3-этилкарбодиимида и полученный таким образом раствор выдерживали при комнатной температуре при перемешивании в течение 3 ч. После добавления гидрохлорида гидроксиламина (361 мг, 5,2 ммоль) и последующего добавления 0,72 мл (5,2 ммоль) TEA смесь перемешивали при комнатной температуре в течение ночи. ДМФА удаляли при пониженном давлении и остаток промывали водой с получением 263 мг неочищенного продукта. Очисткой флэш-хроматографией на силикагеле с обращенной фазой (LiChroprep RP-18, Merck) с применением в качестве элюента смеси метанол:вода 50/50 получали 34 мг (13%) указанного в заголовке соединения в виде твердого вещества белого цвета. Т.пл.300 С. Rf=0,2 (силикагель Merck 60F254, CH2Cl2:MeOH 90:10); Rf=0,34 (Merck LiChroprep RP18, MeOH/H2O 60:40). 1(ST2992) Указанное в заголовке соединение получали согласно схеме синтеза 2, приведенной ниже. Схема синтеза 2 К раствору Е-4-(3-(1-адамантил)-4-гидроксифенил)коричной кислоты (2 г, 5,34 ммоль) в 80 мл ДМФА добавляли гидрат гидроксибензотриазола (866 мг, 5,34 ммоль) и гидрохлорид 1-(3 диметиламинопропил)-3-этилкарбодиимида (1130 мг, 6,94 ммоль). Смесь перемешивали при комнатной температуре в течение 4 ч. После добавления гидрохлорида гидроксиламина (1856 мг, 26,7 ммоль) и последующего добавления 3,7 мл (26,7 ммоль) TEA смесь перемешивали при комнатной температуре в течение ночи. ДМФА удаляли при пониженном давлении и остаток промывали водой с получением 5 г неочищенного продукта. Очищением флэш-хроматографией на силикагеле (буферированном фосфатом) с использованием в качестве элюента смеси дихлорметан/метанол 95:5 получали 950 мг указанного в заголовке соединения в виде твердого вещества белого цвета. Т.пл. 210-212 С (разл.). Rf=0,19 (силикагель Merck 60F254, гексан/EtOAc 4:6).(4 Н, м, 4 Ar); 9,03 (1 Н, ушир.с, -CONHOH); 9,54 (1 Н, с, -ОН); 10,75 (1 Н, ушир.с, -CONHOH). Пример 3. Получение N-гидроксиамида 6-[3-1-(адамантил)-4-гидроксифенил]нафталин-2 карбоновой кислоты (ST2142) Указанное в заголовке соединение получали согласно схеме синтеза 3, приведенной ниже. Схема синтеза 3 212 мг (0,53 ммоль) 6-[3-1-(адамантил)-4-гидроксифенил]нафталин-2-карбоновой кислоты растворяли в атмосфере азота в 8 мл ДМФА, затем добавляли 79 мг (0,58 ммоль) гидрата гидроксибензотриазола и 132 мг (0,67 ммоль) гидрохлорида 1-(3-диметиламинопропил)-3-этилкарбодиимида и полученный таким образом раствор выдерживали при перемешивании при комнатной температуре в течение 2 ч. После добавления гидрохлорида гидроксиламина (184 мг, 2,65 ммоль) и последующего добавления 0,36 мл(2,65 ммоль) TEA смесь перемешивали при комнатной температуре в течение ночи. ДМФА удаляли при пониженном давлении и остаток промывали водой с получением 150 мг неочищенного продукта. Очищением флэш-хроматографией на силикагеле с обращенной фазой (LiChroprep RP-18, Merck) с применением в качестве элюента смеси метанол:вода 85:15 получали 80 мг (41%) указанного в заголовке соединения в виде твердого вещества белого цвета. Т.пл. 217-219 С (разл.). 1 Н ЯМР (ДМСО-d6) : 1,76 (6 Н, с, 6 ад.); 2,05 (3 Н, с, 3 ад.); 2,17 (6 Н, с, 6 ад.); 6,90 (1 Н, д, 1 Ar,J=8,19 Гц); 7,41-7,54 (2 Н, м, 2 Ar); 7,77-7,88 (2 Н, м, 2 Ar); 8,02 (2 Н, дд, 2 Ar, J=2,23, 8,93 Гц); 8,33 (1 Н, с,1 Ar); 9,57 (1 Н, ушир.с, -CONHOH); 11,35 (1 Н, ушир.с, -CONHOH). Пример 4. Получение 3-[4-(8-адамантан-1-ил-2,3-дигидробензо[1,4]диоксин-6-ил)-фенил]-Nгидроксиакриламида (ST3081) Указанное в заголовке соединение получали согласно схеме синтеза 4, приведенной ниже. Схема синтеза 4 60 мг (0,144 ммоль) 3-[4-(8-(1-адамантил)-2,3-дигидробензо[1,4]диоксин-6-ил)фенил]акриловой кислоты, 55 мг (0,144 ммоль) N-оксида N-[(диметиламино)-1 Н-1,2,3-триазоло[4,5-b]пиридин-1-илметилен]N-метилметанаминийгексафторфосфата (HATU) и 50 мкл (0,288 ммоль) DIPEA растворяли в атмосфере азота в 1 мл ДМФА. Полученную смесь перемешивали в течение 2 мин (время предактивации), затем добавляли гидрохлорид гидроксиламина (40 мг, 0,576 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. После выпаривания растворителя остаток охлаждали льдом, добавляли воду и перемешивали в течение 1 ч при комнатной температуре. Полученную суспензию фильтровали и фильтрат промывали водой и диэтиловым эфиром с получением 40,5 мг (65%) твердого вещества белого цвета. Т.пл. 211-213 С (разл.). Rf=0,6 (силикагель Merck 60F254, CH2Cl2/MeOH 9:1). 1 Н ЯМР (ДМСО-d6) : 1,74 (6 Н, с, 6 ад.); 2,04 (3 Н, с, 3 ад.); 2,12 (6 Н, с, 6 ад.), 4,27 (4 Н, с, СН 2-О-); 6,47 (1 Н, д, -СН=, J=16,00 Гц); 7,00 (1 Н, с, 1 Ar); 7,03 (1 Н, с, 1 Ar); 7,47 (1 Н, д, -СН=, J=16,00 Гц); 7,527,68 (4 Н, м, 4 Ar); 9,04 (1 Н, ушир.с, -CONHOH); 10,75 (1 Н, ушир.с, -CONHOH). Пример 5. Получение Е-3-(3'-адамантан-1-ил-2-хлор-4'-гидроксибифенил-4-ил)-N-гидроксиакриламида (ST3088) Указанное в заголовке соединение получали согласно схеме синтеза 5, приведенной ниже. Схема синтеза 5N-[(диметиламино)-1 Н-1,2,3-триазоло[4,5-b]пиридин-1-илметилен]-Nметилметанаминийгексафторфосфата (HATU) и 47 мкл (0,288 ммоль) DIPEA растворяли в атмосфере азота в 1 мл ДМФА. Полученную смесь перемешивали в течение 2 мин (время предактивации). Добавля-5 012729 ли гидрохлорид гидроксиламина (37 мг, 0,536 ммоль) и реакционную смесь перемешивали дополнительно в течение 90 мин. После выпаривания растворителя остаток охлаждали льдом, добавляли воду и перемешивали в течение 1 час при комнатной температуре. Полученную суспензию фильтровали и фильтрат промывали водой и диэтиловым эфиром. Неочищенный продукт очищали флэш-хроматографией на силикагеле (буферированном фосфатом) с применением в качестве элюента смеси дихлорметан/метанол 9:1 с получением 15 мг твердого вещества белого цвета. Т.пл. 160 С (разл.). Rf=0,27 (силикагель Merck 60F254, CH2Cl2/MeOH 95:5). 1 Н ЯМР (ДМСО-d6) : 1,72 (6 Н, с, 6 ад.); 2,02 (3 Н, с, 3 ад.); 2,09 (6 Н, с, 6 ад.); 6,51 (1 Н, д, -СН=,J=16,00 Гц); 6,84 (1 Н, д, 1Ar, J=8,19 Гц); 7,13 (1H, д, 1Ar, J=8,93 Гц); 7,16 (1H, с, 1Ar); 7,36-7,51 (2H, м,2Ar); 7,56 (1H, д, 1Ar, J=8,19 Гц); 7,71 (1H, c, 1Ar); 9,10 (1H, ушир.с, -CONHOH); 9,58 (1H, c, -OH); 10,77(ST3056) Указанное в заголовке соединение получали согласно схеме синтеза 6, приведенной ниже. Схема синтеза 6 450 мг (1,159 ммоль) Е-3-[3'-(1-адамантил)-2-хлор-4'-метоксибифенил-4-ил]акриловой кислоты,529,2 мг (1,392 ммоль) N-оксида N-[(диметиламино)-1 Н-1,2,3-триазоло[4,5-b]пиридин-1-илметилен]-Nметилметанаминийгексафторфосфата (HATU) и 404 мкл (2,32 ммоль DIPEA растворяли в атмосфере азота в 13,5 мл ДМФА. Полученную смесь перемешивали в течение 30 мин (время предактивации). Добавляли раствор гидрохлорида гидроксиламина (161,19 мг, 2,320 ммоль) и DIEA (404 мкл, 2,320 ммоль) в 4,5 мл ДМФА и реакционную смесь перемешивали дополнительно в течение 2,2 ч. Обработка реакционной смеси: реакционную смесь подкисляли водной HCl (рН 3-4); полученную суспензию фильтровали и осадок промывали водной HCl (рН 3-4) и водой. Затем осадок суспендировали в горячем МеОН, давали возможность охлаждаться до комнатной температуры и выдерживали при перемешивании в течение ночи. Полученную суспензию фильтровали и промывали ацетоном, в результате получали 350 мг твердого вещества белого цвета (0,867; выход 75%).ES-MS: 402,48 [М-Н]- и 426,38 [M-Na]+. Пример 7. Получение Е-3-(4'-гидроксибифенил-4-ил)-N-гидроксипропиоламида Указанное в заголовке соединение получали согласно схеме синтеза 7, приведенной ниже. Схема синтеза 7 40 мг (0,17 ммоль) (4'-гидроксибифенил-4-ил)пропиновой кислоты растворяли в атмосфере азота в 13 мкл ДМФА, затем добавляли 1,2 мл CH2Cl2 и раствор охлаждали до 0 С. После медленного добавления 33 мкл (0,38 ммоль) оксалилхлорида раствор выдерживали при перемешивании при 0 С в течение 40 мин. Раствор 47 мг (0,68 ммоль) гидрохлорида гидроксиламина и 148 мкл (1,06 ммоль) TEA в 0,7 мл смеси ТГФ/Н 2 О 6:1 прибавляли по каплям при 0 С, затем смесь перемешивали при 0 С в течение 1,5 ч. После добавления CH2Cl2 органический слой промывали 2 н HCl, сушили над Na2SO4, фильтровали и выпаривали с получением 30 мг твердого вещества желтого цвета. Очисткой флэш-хроматографией с обращенной фазой (LiChroprep RP-18, Merck) с применением в качестве элюента смеси вода/метанол 1:1 получали 15 мг (35%) указанного в заголовке соединения в виде твердого вещества белого цвета.-6 012729 Указанное в заголовке соединение получали согласно схеме синтеза 8, приведенной ниже. Схема синтеза 8 70 мг (0,28 ммоль) Е-4-гидроксиметилфенилкоричной кислоты растворяли в атмосфере азота в 3 мл ДМФА, затем добавляли 107 мг (0,28 ммоль) HATU и 97 мкл (0,56 ммоль) DIPEA и полученный таким образом раствор выдерживали при перемешивании при комнатной температуре в течение 5 мин. После добавления гидрохлорида гидроксиламина (22 мг, 0,31 ммоль) смесь перемешивали при комнатной температуре в течение 3 ч. ДМФА удаляли при пониженном давлении и остаток промывали водой с получением после фильтрования 48 мг твердого вещества белого цвета. Т.пл. 220-223 С (разл.). Rf=0,6 (силикагель Merck 60F254, CH2Cl2/MeOH 90:10). 1 Н ЯМР (ДМСО-d6) : 4,51 (2 Н, д, -СН 2-, J=5,58 Гц); 5,20 (1 Н, т, -ОН, J=5,58 Гц); 6,47 (1 Н, д, -СН=,J=16,00 Гц); 7,38 (2 Н, д, 2 Ar, J=7,82 Гц); 7,47 (1 Н, д, -СН=, J=16,00 Гц); 7,54-7,77 (6 Н, м, 6 Ar); 9,03 (1 Н,ушир.с, -CONHOH); 10,75 (1 Н, ушир.с, -CONHOH). Пример 9. Получение Е-3-[3'-хлор-4'-гидроксибифенил-4-ил]-N-гидроксиакриламида (ST3192) Указанное в заголовке соединение получали согласно схеме синтеза 9, приведенной ниже. Схема синтеза 9 205 мг (0,75 ммоль) Е-3-хлор-4-гидроксифенилкоричной кислоты растворяли в атмосфере азота в 7,5 мл ДМФА, затем добавляли 285 мг (0,75 ммоль) HATU и 97 мкл (0,56 ммоль) DIPEA и полученный таким образом раствор выдерживали при перемешивании при комнатной температуре в течение 2 мин. После добавления гидрохлорида гидроксиламина (261 мг, 3,75 ммоль) смесь перемешивали при комнатной температуре в течение 2 дней. ДМФА удаляли при пониженном давлении и остаток промывали водой с получением после фильтрования 140 мг неочищенного продукта. Очисткой флэш-хроматографией с обращенной фазой (LiChroprep RP-18, Merck) с применением в качестве злюента смеси вода/метанол 1:1 и кристаллизацией из диэтилового эфира получали 21 мг указанного в заголовке соединения в виде твердого вещества белого цвета. Т.пл. 172-175 С. Rf=0,16 (RP18 Merck, H2O/MeOH 1:1). 1 Н ЯМР (ДМСО-д 6) : 6,48 (1 Н, д, -СН=, J=15,63 Гц); 7,05 (1 Н, д, 1 Ar, J=8,93 Гц); 7,40-7,74 (7 Н, м, 7Ar); 9,03 (1 Н, ушир.с, -CONHOH); 10,50 (1 Н, ушир.с, -CONHOH). Пример 10. Получение N-гидроксиамида 6-[3-1-(адамантил)-4-метоксифенил]нафталин-2 карбоновой кислоты (ST3259) Указанное в заголовке соединение получали согласно схеме синтеза 10, приведенной ниже. Схема синтеза 10 Метил 6-(3-адамантил-4-гидроксифенил)нафтоат (506 мг, 1,23 ммоль добавляли к охлажденной льдом суспензии NaH (80 мг, 60%) в сухом ДМФА, смесь перемешивали 1 ч при 0 С, затем добавляли 245 мг (1,7 ммоль) CH3I и оставляли на 90 мин при комнатной температуре. После добавления 80 мл холодной воды, повторной экстракции CH2Cl2, затем EtOAc, сушки и упаривания объединенных органических фаз и хроматографии (силикагель, гексан/EtOAc 9/1) получали 300 мг метил 6-(3-адамантил-4 метоксифенил)нафтоата. Это соединение (235 мг) суспендировали в 1 М растворе NaOH в МеОН и смесь кипятили с обратным холодильником 8 ч. Выпариванием, обработкой водой, добавлением НС 1 и фильтрованием получали 227 мг 6-(3-адамантил-4-метоксифенил)нафтойной кислоты. Т.пл.300 С. Это соединение (100 мг, 0,24 ммоль) растворяли в атмосфере азота в 2,4 мл ДМФА, затем добавляли 92 мг (0,24 ммоль) HATU и 0,2 мл (1,21 ммоль) DIPEA и полученный таким образом раствор выдерживали при перемешивании при комнатной температуре в течение 2 мин. После добавления гидрохлорида гидроксиламина (84 мг, 1,21 ммоль) смесь перемешивали 2 ч при комнатной температуре. ДМФА удаляли при пониженном давлении и остаток промывали водой с получением после фильтрования 111 мг неочищенного продукта, который очищали флэш-хроматографией (силикагель, МеОН/Н 2 О 85:15). Т.пл. 222 С. Н ЯМР: (ДМСО-d6) : 1,76 (с, 6 Н, адам.), 2,03 (с, 3 Н, адам.), 2,14 (с, 6 Н, адам.), 3,86 (с, 3 Н, ОСН 3),7,12 (д, 1 Н, 1 Ar, J = 8,56 Гц), 7,57 (д, 1 Н, 1 Ar, J = l,86 Гц), 7,65 (дд, 1 Н, 1 Ar, J = l,86, 8,93 Гц), 7,83 (дд,1 Н, 1 Ar, J=8,56, 1,86 Гц), 7,88 (дд, 1 Н, 1 Ar, J = 8,56, 1,86 Гц), 8,00-8,10 (м, 2 Н, 2 Ar), 8,19 (с, 1 Н, 1 Ar),8,35 (с, 1 Н, 1 Ar), 9,40 (с, 1 Н), 11,35 (с, 1 Н). Пример 11. Получение Е-3-[4'-хлорбифенил-4-ил]-N-гидроксиакриламида (ST3483) Указанное в заголовке соединение получали согласно схеме синтеза 11, приведенной ниже. Схема синтеза 11 К смеси 61 мг (0,22 ммоль) 3-(4-хлорбифенилил)акриловой кислоты и 2 6 мг (0,22 ммоль) Отетрагидропиранилгидроксиламина в 3 мл ТГФ добавляли 0,45 мл (0,46 ммоль) гексаметилсилазана лития, смесь перемешивали 10 мин в атмосфере азота, затем реакцию гасили раствором NH4Cl. После этого при комнатной температуре смесь экстрагировали EtOAc и экстракт упаривали с получением 79 мг 2 тетрагидропиранилоксиамида 3-(4-хлорбифенилил)акриловой кислоты. Это соединение (79 мг, 0,22 ммоль) растворяли в 3 мл МеОН, добавляли 12 мг (0,066 ммоль) моногидрата п-толуолсульфокислоты и смесь перемешивали 2 дня при комнатной температуре. После фильтрования и промывания МеОН получали гидроксиамид 3-(4-хлорбифенилил)акриловой кислоты. Т.пл. 200-202 С, Rf=0,6 (TCX, силикагель Merck, CH2Cl2/MeOH 95/5). 1 Н ЯМР (ДМСО-d6) : 6,50 (с, 1 Н, -СН=, J=16,00 Гц), 7,49 (с, 1 Н, -СН=, J=16,00 Гц), 7,50-7,75 (м,8 Н, 8 Ar), 9,10 (с, 1 Н), 10,50 (с, 1 Н). Пример 12. Получение Е-3-[4'-метоксибифенил-4-ил]-N-гидроксиакриламида (ST3595) Указанное в заголовке соединение получали согласно схеме синтеза 12, приведенной ниже. Схема синтеза 12 200 мг (0,83 ммоль) метил 4-бромциннамата растворяли в сухом толуоле, добавляли 29 мг (0,025 ммоль) Pd(PPh3)4, раствор 152 мг (0,91 ммоль) 4-метоксибензолбороновой кислоты в 0,5 мл EtOH, 1,66 мл 2 М Na2CO3 в воде и кипятили с обратным холодильником 2 ч. После добавления EtOAc, промывания водой, затем насыщенным раствором соли, фильтрования и флэш-хроматографии (силикагель Merck) с применением смеси гексан/EtOH от 95/5 до 8/2, получали 112 мг метил 3-(4-метоксибифенилил)акрилата,т.пл. 175-177 С. Раствор вышеуказанного соединения (110 мг, 0,41 ммоль) и 2-тетрагидропиранил-Огидроксиламина (48 мг, 0,41 ммоль) в 6 мл ТГФ охлаждали до -78 С, добавляли 0,81 мл гексаметилдисилазана натрия, перемешивали 2 ч, затем нагревали до -20 С, снова охлаждали до -78 С, реакцию гасили с помощью NH4Cl, экстрагировали EtOAc, экстракт упаривали с получением 145 мг 2 тетрагидропиранилоксиамида 3-(4-метоксибифенилил)акриловой кислоты в виде твердого вещества желтого цвета. Раствор вышеуказанного соединения (145 мг, 0,41 ммоль) в 5 мл МеОН обрабатывали 23 мг (0,12 ммоль) п-толуолсульфоновой кислоты, перемешивали 24 ч при комнатной температуре, фильтровали и промывали МеОН с получением 50 мг гидроксиамида 3-(4-метоксибифенилил)акриловой кислоты. Т.пл. 199 С (разл.). Rf=0,2 (CH2Cl2/MeOH 95/5). 1 Н ЯМР: (ДМСО-d6):3,80 (с, 3 Н, ОМе), 6,47 (д, 1 Н, -СН=, J = 15,6 Гц), 7,03 (д, 2 Н, 2Ar, J = 8,9 Гц),7,48 (д, 1 Н, -СН=, J=15,6 Гц), 7,56-7,73 (м, 6 Н, 6 Ar), 9,05 (с, 1 Н), 10,76 (с, 1 Н). Пример 13. Получение Е-3-[4'-цианобифенил-4-ил]-N-гидроксиакриламида CST3604) Указанное в заголовке соединение получали согласно схеме синтеза 13, приведенной ниже. Схема синтеза 13-8 012729 Т.пл. 150-152 С. Раствор вышеуказанного соединения (270 мг, 1,02 ммоль) и 2-тетрагидропиранил-Oгидроксиламина (117 мг, 1,02 ммоль) в 14 мл ТГФ охлаждали до -78 С, добавляли 1,07 мл гексаметилдисилазана натрия, перемешивали 2 ч, затем нагревали до -20 С, снова охлаждали до -78 С, гасили реакцию с помощью NH4Cl, экстрагировали EtOAc, экстракт упаривали и хроматографировали (силикагельMerck) с применением смеси гексан/EtOAc 6/4 с получением 189 мг 2-тетрагидропиранилоксиамида 3-(4 цианобифенилил)акриловой кислоты в виде твердого вещества белого цвета. Т.пл. 211-213 С. Раствор вышеуказанного соединения (187 мг, 0,54 ммоль) в 5 мл МеОН обрабатывали 30 мг (0,16 ммоль) п-толуолсульфоновой кислоты, перемешивали 24 ч при комнатной температуре, фильтровали и промывали МеОН с получением 96 мг гидроксиамида 3-(4-цианобифенилил)акриловой кислоты. Т.пл. 212-214 С, Rf=0,3 (CH2Cl2/MeOH 95/5). 1 Н ЯМР: (ДMCO-d6): 6,54 (д, 1 Н, -СН=, J = 15,3 Гц), 7,51 (д, 1 Н, -СН=, J = 15,3 Гц), 7,69 (д, 2 Н, 2Ar,J=8,2 Гц), 7,82 (д, 2 Н, 2 Ar, J=8,2 Гц), 7,8-8,0 (м, 4 Н, 6 Ar), 9,05 (с, 1 Н, NH), 10,80 (С, 1 Н, ОН). Ссылочные примеры В этом разделе описан синтез некоторых соединений, которые синтезировали и испытывали для сравнительных целей, для того, чтобы выявить превосходство и преимущество заявленных соединений относительно их ближайших гомологов. Ссылочный пример 1. Получение N-гидрокси-3-(4'-гидроксибифенил-4-ил)пропионамида (ST3208) Указанное в заголовке соединение получали согласно схеме синтеза 1R, приведенной ниже. Схема синтеза 1R 368 мг (1,5 ммоль) 3-(4'-гидроксибифенил-4-ил)пропионовой кислоты растворяли в атмосфере азота в 15 мл ДМФА, затем добавляли 568 мг (1,5 ммоль) HBTU и 1,23 мл (7,5 ммоль) DIPEA и полученный таким образом раствор выдерживали при перемешивании при комнатной температуре в течение 10 мин. После добавления гидрохлорида гидроксиламина (521 мг, 7,5 ммоль) смесь перемешивали при комнатной температуре в течение 3,5 ч. ДМФА удаляли при пониженном давлении, к осадку добавляли воду и перемешивали при 0 С в течение 15 мин с получением после фильтрования 354 мг твердого вещества белого цвета (92%). Т.пл. 180-182 С. Rf=0,l (силикагель Merck 60F254, CH2Cl2/MeOH 95:5). 1 Н ЯМР (ДМСО-d6) : 2,27 (2 Н, д, -СН 2-, J=7,82 Гц); 2,81 (2 Н, д, -СН 2-, J=7,82 Гц); 6,82 (2 Н, д, 2 Ar,J=8,93 Гц); 7,22 (2 Н, д, 2 Ar, J=8,19 Гц); 7,40-7,55 (4 Н, м, 4 Ar); 8,75 (1 Н, ушир.с, -CONHOH); 9,55 (1 Н,ушир.с, -CONHOH); 10,45 (1 Н, ушир.с, -ОН). Ссылочный пример 2. Получение Е-3-(бифенил-4-ил)-N-гидроксиакриламида (ST3256) Указанное в заголовке соединение получали согласно схеме синтеза 2R, приведенной ниже. Схема синтеза 2R 200 мг (0,89 ммоль) Е-4-фенилкоричной кислоты растворяли в атмосфере азота в 9 мл ДМФА, затем добавляли 338 мг (0,89 ммоль) HATU и 308 мкл (1,78 ммоль) DIPEA и полученный таким образом раствор выдерживали при перемешивании при комнатной температуре в течение 2 мин. После добавления гидрохлорида гидроксиламина (68 мг, 0,98 ммоль) смесь перемешивали при комнатной температуре в течение 4 ч. ДМФА удаляли при пониженном давлении и остаток промывали водой с получением после фильтрования 220 мг твердого вещества белого цвета. Т.пл. 168-170 С. Rf=0,6 (силикагель Merck 60F254, CH2Cl2/MeOH 90:10). 1-9 012729 Ссылочный пример 3. Получение Е-3-[4'-гидроксибифенил-3-ил]-N-гидроксиакриламида (ST3284) Указанное в заголовке соединение получали согласно схеме синтеза 3R, приведенной ниже. Схема синтеза 3R 70 мг (0,29 ммоль) Е-3-(4'гидроксибифенил-3-ил)акриловой кислоты растворяли в атмосфере азота в 3 мл ДМФА, затем добавляли 109 мг (0,29 ммоль) HBTU и 100 мкл (0,57 ммоль) DIPEA при 0 С. Через 5 мин добавляли гидрохлорид гидроксиламина (20 мг, 0,29 ммоль) и смесь перемешивали при 0 С в течение 10 мин, затем при комнатной температуре в течение 4 ч. ДМФА удаляли при пониженном давлении и остаток промывали водой с получением после фильтрования 73 мг неочищенного продукта. После очистки флэш-хроматографией на силикагеле, забуференном КН 2 РО 4, с применением в качестве элюента смеси CH2Cl2/MeOH 95:5 получали 24 мг указанного в заголовке соединения в виде твердого вещества белого цвета. Т.пл. 127-128 С. Rf=0,26 (силикагель Merck 60F254, CH2Cl2/MeOH 90:10). 1 Н ЯМР (ДМСО-d6) : 6,51 (1 Н, д, -СН=, J=16 Гц); 6,85 (2 Н, д, 2Ar, J=8,93 Гц); 7,35-7,80 (7 Н, м, 6 Ar(ST3400) Указанное в заголовке соединение получали согласно схеме синтеза 4R, приведенной ниже. Схема синтеза 4Ral. J. Med. Chem. 10, 366 (1967 растворяли в атмосфере азота в 7 мл ДМФА, затем добавляли 267 мг (0,7 ммоль) HBTU и 245 мкл (0,56 ммоль) DIPEA и полученный таким образом раствор выдерживали при перемешивании при комнатной температуре в течение 10 мин. После добавления гидрохлорида гидроксиламина (54 мг, 0,77 ммоль) смесь перемешивали при комнатной температуре в течение ночи. ДМФА удаляли при пониженном давлении и остаток промывали водой с получением после фильтрования 53 мг продукта. 1 Н ЯМР (ДМСО-d6) : 6,02 (с, 1 Н, -СН=, J = 14,89 Гц), 6,90-7,40 (м, 3 Н), 7,40 (м, 1 Н, 1 Ar), 7,45-7,50(ST3444) Указанное в заголовке соединение получали согласно схеме синтеза 5R, приведенной ниже. Схема синтеза 5R 35 мг (0,13 ммоль) Е-4-(4-диметиламинофенил)коричной кислоты (полученной Suzuki взаимодействием 4-диметиламинобромбензола с метил 4-бромциннаматом с последующим гидролизом сложного эфира) растворяли в атмосфере азота в 1,3 мл ДМФА, затем добавляли 55 мг (0,14 ммоль) HBTU и 43 мкл (0,26 ммоль) DIPEA и полученный таким образом раствор выдерживали при перемешивании при комнатной температуре в течение 10 мин. После добавления гидрохлорида гидроксиламина (10 мг, 0,14 ммоль) смесь перемешивали при комнатной температуре в течение ночи. ДМФА удаляли при пониженном давлении и остаток промывали водой с получением после фильтрования, сушки и обработки простым эфиром 25 мг продукта. Т.пл. 260-263 С (разл.). 1 Н ЯМР: (ДМСО-d6) : 2,95 (с, 6 Н, N(CH3)2), 6,44 (с, 1 Н, -СН=, J = 16,38 Гц), 6,80 (д, 2 Н, 2 Ar, J=8,93- 10012729 Гц), 7,46 (д, 1 Н, СН=, J = 16 Гц), 7,52-7,70 (м, 6 Н, 6 Ar), 9,00 (с, 1 Н), 10,75 (с, 1 Н). Биологические исследования Результаты испытаний на цитотоксичность Здесь описано цитотоксическое действие некоторых бифенил- и фенилнафтилсоединений, имеющих группу гидроксамовой кислоты. Эти соединения обладают фармакологическими особенностями,отличающимися от соответствующих соединений, имеющих группу карбоновой кислоты. Химические структуры испытуемых соединений изобретения и соответствующих соединений, имеющих группу карбоновой кислоты, представлены на фиг. 1. Для испытаний воздействия соединений на рост клеток применяли клетки промиелоцитарного лейкоза человека NB4, клетки немалоклеточной карциномы NCIH460, Н 460/(R9A) (резистентные к соединениям, имеющим группу карбоновой кислоты: ST1898,ST1926, ST1964), клетки карциномы толстой кишки человека НСТ-116, IGROV-1 и IGROV-1/Pt (восприимчивые клетки карциномы яичников и платина-резистентные клетки карциномы яичников, соответственно). Опухолевые клетки NB4 и NCI-H460 выращивали в RPMI 1640, содержащей 10% фетальную бычью сыворотку (GIBCO), опухолевые клетки НСТ-116 выращивали в McCoy's 5A, содержащей 10% фетальную бычью сыворотку (GIBCO), IGROV-1 и IGROV-1/Pt выращивали в DMEM, содержащей 10% фетальную бычью сыворотку (GIBCO). Опухолевые клетки засевали в 96-луночные планшеты для культуры тканей приблизительно при 10% уровне конфлюентности, предоставляли возможность для прилипания и выдерживали по меньшей мере 24 ч. Затем добавляли различные концентрации лекарственных средств в каждую лунку для вычисления величины IC50 (концентрация, при которой достигают 50% выживания клеток). Планшеты инкубировали в течение 24 ч при 37 С. В конце обработки для опухолевых клеток NB4 в суспензии методику осуществляли следующим образом: культуральную среду удаляли центрифугированием планшетов при 1600g в течение 10 мин и супернатант удаляли. Добавляли 250 мкл PBS, затем планшеты центрифугировали при 1600g в течение 10 мин, супернатант удаляли. Добавляли 200 мкл/на лунку культуральной среды RPMI 1640, содержащей 10% FCS, и планшеты инкубировали при 37 С дополнительно в течение 48 ч. Планшеты снова центрифугировали при 1600g в течение 10 мин, культуральную среду удаляли и добавляли 200 мкл PBS и 50 мкл не содержащей радиоактивных веществ 80% ТСА. Планшеты инкубировали на льду по меньшей мере в течение 1 ч. ТСА удаляли, планшеты промывали 3 раза погружением в дистиллированную воду и сушили на бумаге и при 40 С в течение 5 мин. Затем добавляли 200 мкл 0,4% сульфородамина В в 1% уксусной кислоте. Планшеты инкубировали при комнатной температуре в течение 30 мин. Сульфородамин В удаляли, планшеты промывали погружением в 1% уксусную кислоту 3 раза, затем планшеты сушили на бумаге и при 40 С в течение 5 мин. Затем добавляли 200 мкл Tris 10 мМ, планшеты выдерживали при перемешивании в течение 20 мин. Выжившие клетки определяли (детектировали) по величине оптической плотности с помощью спектрофлуориметра Multiskan при 540 нм. Для испытания опухолевых клеток в фазе адгезии (NCI-H460 и НСТ-116) методика была такой, как описано выше, за исключением того, что в конце обработки планшеты промывали удалением супернатанта и добавлением PBS 3 раза без центрифугирования. В последний день испытания также супернатант удаляли без центрифугирования. Количество погибших клеток вычисляли как процент уменьшения связывания сульфородамина В по сравнению с контрольными культурами. Величины IC50 (концентрация, при которой достигали 50% выживания клеток) вычисляли с помощью программы ALLFIT. Резистентная клеточная линия опухоли NCI-H460 R9A представляла собой клон, выбранный вследствие резистентности к ST1926 (табл. 3). Для получения резистентной клеточной линии опухоли восприимчивые клетки опухоли NCI-H460 обрабатывали 2 мкМ ST1926 в течение 24 ч и выдерживали в среде без лекарственного средства в течение 7 дней до времени извлечения. Затем выжившие клетки культивировали с применением длительного селективного воздействия 2 мкМ (10IC50) ST1926. Резистентные клетки NCI-H460 субкультивировали 3-4 раза перед увеличением концентрации ST1926 до 4 мкМ(20IC50). Выжившие клетки засевали в 96-луночные планшеты для выделения резистентных клеточных клонов и выдерживали в полной среде с 4 мкМ ST1926. Клеточную линию опухоли выдерживали, по меньшей мере, в течение одной недели, перед засеванием для испытания на цитотоксичность SRB, в среде без лекарственного средства. Неожиданно, гидроксамовые производные ST2782 и ST3056 обнаружили, по отношению к соответствующим соединениям, имеющим группу карбоновой кислоты (ST2188 и ST1898), повышенную антипролиферативную активность в отношении различных клеточных линий опухоли (табл. 1). Различие в активности для ST2782 становится ярко выраженным при сравнении с ST2188.- 11012729 Таблица 1. Цитотоксичность различных соединений в отношении опухолевых клеток NB4, IGROV1 и IGROV-1/Pt Кроме того, гидроксамовые производные ST2782, ST2992, ST3081, ST3088, ST3056, ST2142 обнаружили значительную антипролиферативную активность в отношении различных опухолевых клеток(табл. 2). Таблица 2. Цитотоксичность различных соединений в отношении опухолевых клеток NCI-H460, НСТ 116, IGROV-1 и IGROV-1/Pt Неожиданно, эти соединения также были эффективны как цитотоксические агенты в отношении клеточной линии карциномы легких H460/(R9A), выбранной вследствие ее резистентности к соединениям, имеющим группу карбоновой кислоты (ST1898, ST1926, ST1964). Чтобы оценить воздействие соединения на уничтожение клеток, применяли сульфородаминовый В тест. Количество погибших клеток вычисляли как процент уменьшения связывания сульфородамина В с контрольными культурами. Величины IC50 (концентрация, при которой достигали 50% выживания клеток) вычисляли с помощью программы ALLFIT. Как показано в табл. 3, в то время как соответствующие соединения, имеющие группы карбоновой кислоты, например, ST1926, ST1964 (CD437), ST1898, были в 34-78 раз менее эффективны в отношенииH4 60/R9A, гидроксамовые производные, например, ST2142, ST2992, ST3056, полностью преодолевали резистентность, подтверждая таким образом, что выбранные соединения имели специфические фармакологические отличия от соответствующих карбоксильных соединений. Интересно, что такие же характеристики сохраняются для соединений ST2782, ST3081 и ST3088.- 12012729 Таблица 3. Цитотоксичность различных соединений в отношении опухолевых клетокR.I. [RI=индекс резистентности (IC50 для резистентной клеточной линии опухоли/IC50 для восприимчивой клеточной линии опухоли)]. Результаты испытаний цитодифференцирующей активности Острый промиелоцитарный лейкоз (APL) представляет собой форму острого миелогенного лейкоза с типичными хромосомными транслокациями, приводящими к экспрессии аномальных гибридных белков, включающих ядерные рецепторы ретиноевой кислоты (RAR). Эти гибридные белки действуют как онкогены и являются ответственными за блокирование дифференциации и расширение лейкозного клона. У большинства пациентов с APL транслокация включает хромосомы 15 и 17 и приводит к возникновению промиелоцитарного лейкоза (PML)-RAR. APL представляет собой объект для интенсивного исследования, поскольку она является единственным примером неопластического заболевания, которое можно лечить цитодифференцирующим подходом. Пациентов с APL переводят в состояние клинической ремиссии с помощью полностью транс-ретиноевой кислоты (ATRA), которая усиливает лейкозный бласт, который обнаруживает множество характеристик дифференцированных в концевой части нейтрофилов. Они включают короткую продолжительность жизни и способность подвергаться природному процессу программируемой клеточной гибели или апоптозу. Хотя успех, достигнутый в случае пациентов с APL, стимулировал клиническое применение ATRA при лечении лейкоза и других неопластических заболеваний, терапевтическая эффективность этого соединения до сих пор вызывает проблемы, такие как резистенция и токсичность. Одной возможной стратегией увеличения терапевтического индекса ATRA является разработка на основе ATRA фармакологических комбинаций, которые являются более сильнодействующими и легко переносимыми, чем индивидуальные компоненты. Соответствующие аспекты программы дифференциации, основанные на движении ATRA в клеткиAPL, можно репродуцировать в первичных культурах лейкозных бластов и в производной клеточной линии NB4, которая является уникальной моделью для изучения фармакологической активности ATRA и ее производных. Фармакологические концентрации ATRA задерживают рост NB4 бластов и дифференцируют их в клетках, которые имеют сходство со зрелыми нейтрофилами. За этим следует медленный процесс апоптоза. Как представлено в табл. 3, авторы применяли клетки NB4 для демонстрации того, что такие различные соединения потенциируют фармакологическую активность ATRA. В частности, дифференциацию опухолевых клеток NB4, индуцированную соединениями, определяли по уменьшению нитросинего тетразолия. Клетки промиелоцитарного лейкоза NB4 засевали с плотностью 150000 клеток/мл в среде RPMI 1640, содержащей 10% FCS. Для измерения цитодифференциирующего действия молекул опухолевые клетки обрабатывали соединениями при различных концентрациях, начиная по меньшей мере от 0,4 до 0,01 мкМ, тогда как для измерения усиливающего действия активности молекул ATRA клетки NB4 обрабатывали повышающимися концентрациями соединений в присутствии или в отсутствие ATRA при субоптимальной концентрации (5 нМ). Опухолевые клетки инкубировали в течение 3 дней при 37 С без замены культуральной среды. Для измерения продифференцирующего действия собирали 500000 клеток, центрифугировали и ресуспенди- 13012729 ровали их в 1 мл среды RPMI 1640, содержащей 10% FCS, 1 мг/мл нитросинего тетразолия (NBT) и 100 нг РМА (4-форбол-12-миристат-13-ацетат). Ресуспендированные опухолевые клетки инкубировали при 37 С в течение 60 мин. По окончании инкубирования опухолевые клетки центрифугировали и осадок ресуспендировали в 1 мл PBS, содержащей 10% Тритон 100. Образцы обрабатывали ультразвуком и определяли поглощение при 540 нм с помощью спектрофотометра. Дифференциацию опухолевых клеток в виде АС 50 (концентрация активирования) оценивали как концентрацию соединения, обеспечивающую 50% максимального индуцирования уменьшения активности NBT в присутствии или в отсутствие ATRA. Как показано в табл. 4, соединения сами по себе были не в состоянии индуцировать дифференциацию опухолевых клеток NB4, в то же время, когда они были в сочетании с субоптимальной концентрациейATRA (5 нМ), некоторые соединения увеличивали индуцированную ATRA дифференциацию. Наиболее сильнодействующими соединениями были ST2992 с величиной АС 50 0,19 мкМ, сравнимой с ST2142(AC50=0,31 мкМ), за которым следует ST2782 с величиной АС 50 в пределах 2,47 мкМ. Неожиданно ни один из ближайших аналогов (ST1926, ST1964, ST3256, ST34 00) не показал подобных результатов. Таблица 4. Усиливающее действие гидроксамовых производных на цитодифференцирующую активностьATRA в отношении опухолевых клеток NB4R3 выбран из Н и Cl; А представляет собой одну из следующих двухвалентных групп: [СН=СН] (транс), [СС] или группа А, взятая вместе с кольцом, с которым она связана, образует нафтильную группу. 2. Соединение формулы (I) по п.1, которое выбрано из группы, состоящей изN-гидроксиамида 6-[3-1-(адамантил)-4-метоксифенил]нафталин-2-карбоновой кислоты; 3-[4-(8-адамантан-1-ил-2,3-дигидробензо[1,4]диоксин-6-ил)фенил]-N-гидроксиакриламида; Е-3-(3'-адамантан-1-ил-2-хлор-4'-гидроксибифенил-4-ил)-N-гидроксиакриламида; Е-3-(3'-адамантан-1-ил-4'-метоксибифенил-4-ил)-N-гидроксиакриламида; Е-3-(4'-гидроксибифенил-4-ил)-N-гидроксипропиоламида; Е-3-(4'-гидроксиметилбифенил-4-ил)-N-гидроксиакриламида; Е-3-(3'-хлор-4'-гидроксибифенил-4-ил)-N-гидроксиакриламида; Е-3-[4'-метоксибифенил-4-ил]-N-гидроксиакриламида; Е-3-[4'-цианобифенил-4-ил]-N-гидроксиакриламида и Е-3-[4'-хлорбифенил-4-ил]-N-гидроксиакриламида. 3. Способ получения соединений по п.1 или 2, включающий взаимодействие соответствующих карбоновых кислот с гидрохлоридом гидроксиламина. 4. Фармацевтическая композиция, предназначенная для лечения опухолевых патологий, содержащая в качестве активного ингредиента соединение по любому из пп.1, 2 и по меньшей мере один фармацевтически приемлемый эксципиент и/или разбавитель. 5. Композиция по п.4, предназначенная для лечения опухолевой патологии, при которой опухоль проявляет лекарственную резистентность к другим противоопухолевым лекарственным средствам, применяемым для такого же лечения. 6. Композиция по п.4 или 5 для лечения опухолевой патологии, где опухолевая патология выбрана из группы, состоящей из саркомы, карциномы, карциноида, костной опухоли, нейроэндокринной опухоли, лимфоидного лейкоза, острого промиелоцитарного лейкоза, миелоидного лейкоза, моноцитарного лейкоза, мегакариобластного лейкоза и болезни Ходжкина. 7. Композиция по любому из пп.4-6, в которой активный ингредиент объединен с одним или несколькими известными противоопухолевыми агентами. 8. Композиция по п.7, в которой известный противоопухолевый агент выбран из группы, состоящей из алкилирующих агентов, ингибиторов топоизомеразы, антитубулиновых агентов, интеркаляционных соединений, антиметаболитов, природных продуктов, таких как алкалоиды барвинка, эпиподофиллотоксинов, антибиотиков, ферментов, таксанов и цитодифференцирующих соединений. 9. Композиция по п.8, в которой цитодифференцирующее противоопухолевое соединение представляет собой полностью трансретиноевую кислоту. 10. Способ получения композиции по любому из пп.4-9, включающий смешивание активного ингредиента по меньшей мере с одним фармацевтически приемлемым эксципиентом и/или разбавителем. 11. Применение соединения по любому из пп.1, 2 для получения лекарственного средства с противоопухолевой активностью. 12. Применение соединения по любому из пп.1, 2 для получения лекарственного средства для лечения опухолевой патологии, где опухоль проявляет лекарственную резистентность к другим противоопухолевым лекарственным средствам, применяемым для такого же лечения. 13. Применение по п.11 или 12, где опухоль выбрана из группы, состоящей из саркомы, карциномы,карциноида, костной опухоли, нейроэндокринной опухоли, лимфоидного лейкоза, острого промиелоцитарного лейкоза, миелоидного лейкоза, моноцитарного лейкоза, мегакариоцитарного лейкоза и болезни Ходжкина. 14. Применение по п.13, где опухоль представляет собой острый промиелоцитарный лейкоз. 15. Способ лечения млекопитающего, страдающего опухолевой патологией, где опухоль проявляет лекарственную резистентность к другим противоопухолевым лекарственным средствам, применяемым для такого же лечения, и выбрана из группы, состоящей из саркомы, карциномы, карциноида, костной опухоли, нейроэндокринной опухоли, лимфоидного лейкоза, острого промиелоцитарного лейкоза, миелоидного лейкоза, моноцитарного лейкоза, мегакариоцитарного лейкоза и болезни Ходжкина, предпочтительно острого промиелоцитарного лейкоза, включающий введение терапевтически эффективного количества соединения по любому из пп.1 или 2. 16. Способ по п.15, в котором соединение объединено с одним или несколькими известными противоопухолевыми агентами. 17. Способ по п.16, в котором известный противоопухолевый агент представляет собой полностью трансретиноевую кислоту.
МПК / Метки
МПК: A61K 31/185, C07C 259/06, C07C 259/10, C07D 319/18, A61P 35/00
Метки: бифенил, нафтилфенилпроизводные, кислоты, гидроксамовой
Код ссылки
<a href="https://eas.patents.su/17-12729-bifenil-i-naftilfenilproizvodnye-gidroksamovojj-kisloty.html" rel="bookmark" title="База патентов Евразийского Союза">Бифенил- и нафтилфенилпроизводные гидроксамовой кислоты</a>
Предыдущий патент: Способ получения искусственной пищевой зернистой икры
Следующий патент: Способ усовершенствования реакции полимеризации путём отбора и анализа пробы
Случайный патент: Способ получения наноразмерных керамических материалов












