Антиамилоидные иммуногенные композиции, способы и применения
Номер патента: 14531
Опубликовано: 30.12.2010
Авторы: Оттонелло Симоне, Моретто Надя, Виллетти Джино, Имбимбо Бруно Пьетро
Формула / Реферат
1. Иммуногенная конструкция, содержащая в качестве носителя тиоредоксин, связанный по меньшей мере с одним фрагментом Аb42.
2. Иммуногенная конструкция по п.1, где по меньшей мере один фрагмент Аb42 связан с тиоредоксином посредством аминокислотного линкера.
3. Иммуногенная конструкция по п.1 или 2, где по меньшей мере один фрагмент Аb42 выбран из группы, состоящей из Аb1-3, 1-4, 1-5, 1-6, 1-7, 1-8, 1-9, 1-10, 1-11, 1-12, 1-13, 1-14, 1-15.
4. Иммуногенная конструкция по п.3, где по меньшей мере один фрагмент Аb42 представляет собой Ab1-15.
5. Иммуногенная конструкция по п.4, где фрагмент Аb1-15 связан с тиоредоксином посредством аминокислотного линкера.
6. Иммуногенная конструкция по п.5, где аминокислотный линкер представляет собой Gly-Gly-Pro.
7. Иммуногенная конструкция по п.4, где тиоредоксин несет более чем один фрагмент Аb1-15.
8. Иммуногенная конструкция по п.7, где тиоредоксин несет четыре фрагмента Аb1-15 (Trx(Аb1-15)4).
9. Фармацевтическая композиция для вакцинации против амилоидогенных заболеваний, содержащая иммуногенную конструкцию по любому из пп.1-8.
10. Композиция по п.9, дополнительно содержащая адъювант.
11. Композиция по п.10, где адъювант выбран из группы, состоящей из 3-де-О-ацилированного монофосфориллипида A (MPL), сапонина QS21, мурамилдипептида или соли алюминия.
12. Композиция по п.11, где адъювант представляет собой соль алюминия, выбранную из группы, состоящей из гидроксида алюминия, фосфата алюминия и сульфата алюминия.
13. Моноклональное антитело, которое распознает иммуногенную конструкцию по любому из пп.1-8.
14. Антитело по п.13, где иммуногенная конструкция представляет собой (Trx(Аb1-15)4).
15. Терапевтический агент для предупреждения или лечения амилоидогенного заболевания, содержащий моноклональное антитело по п.13 или 14 в качестве активного ингредиента.
Текст
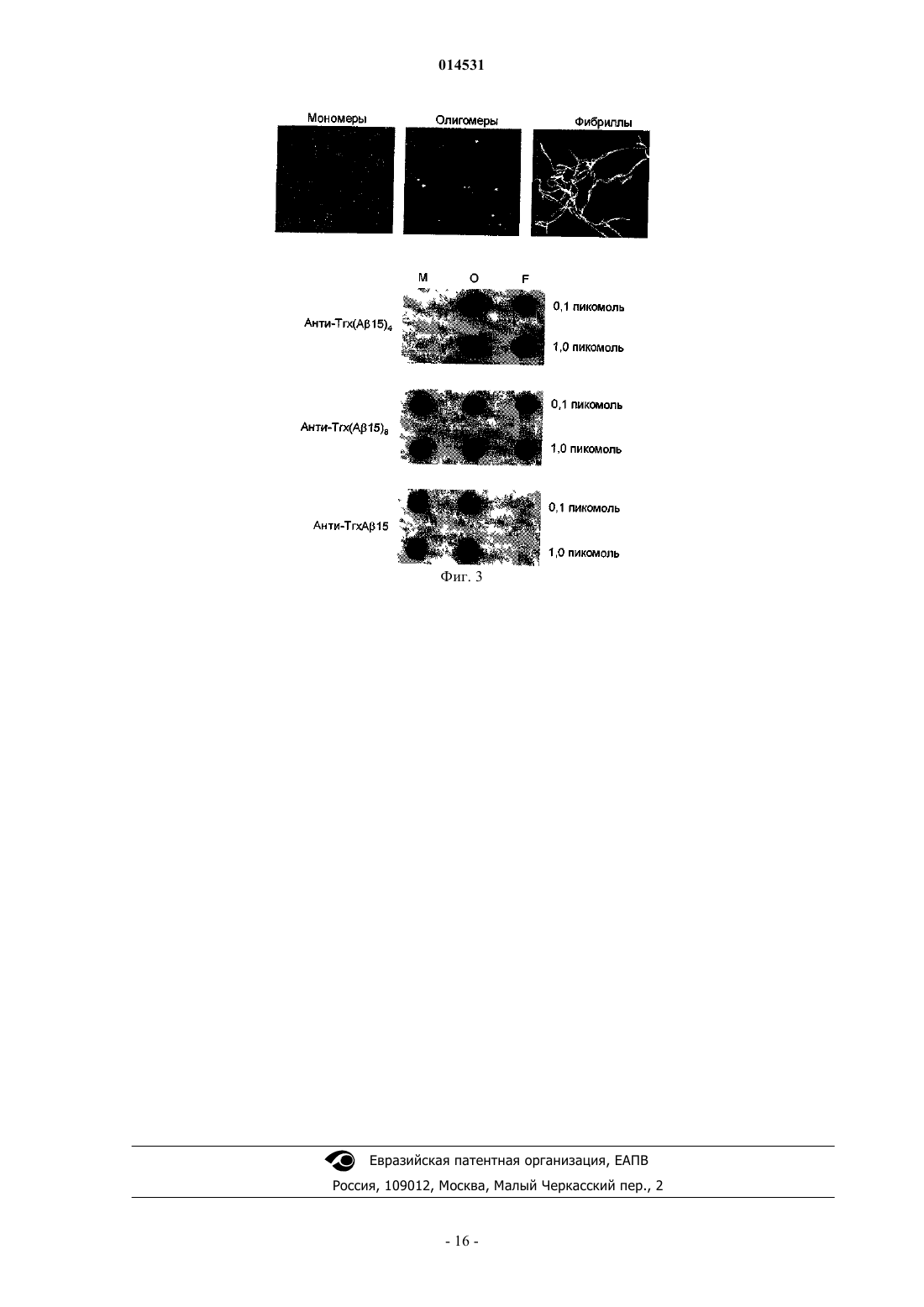
В изобретении предложена рекомбинантная иммуногенная конструкция, полученная путем тандемной мультимеризации фрагмента А 42, несущего В-клеточный эпитоп, внутри активного петлевого участка носителя (участка дисплея), предпочтительно бактериального тиоредоксина(Trx). Полипептиды, несущие множественные копии фрагментов А 42, предпочтительно с расположенным между ними аминокислотным линкером, были сконструированы и инъецированы мышам в сочетании с адъювантом. Было обнаружено, что индуцированные антитела избирательно связываются с фибриллярными и/или олигомерными А внутри нейритных AD-бляшек. 014531 Область изобретения Настоящее изобретение относится к иммуногенным конструкциям, содержащим фрагмент А 42 и носитель, отличающимся тем, что указанный фрагмент расположен в пределах активного петлевого участка (экспонированного участка) носителя, к способу их получения и к их применениям. Предшествующий уровень техники Амилоидогенные заболевания, такие как болезнь Альцгеймера (AD), признаны основной причиной деменции у пожилых людей. Снижение когнитивных способностей при AD связано с гистопатологическими изменениями в головном мозге, причем наиболее значимым является образование амилоидных бляшек и нейрофибриллярных клубков. Хотя амилоидные бляшки содержат многие белки, их основным составляющим является пептид амилоид- (А). Образование А-пептида и, следовательно, А-амилоидных бляшек происходит в результате аберрантного процессинга амилоидного белка-предшественника (АРР). В настоящее время разработано несколько фармакологических подходов к замедлению или реверсированию развития AD. Хотя некоторые подходы направлены на ингибирование метаболического генерирования А-пептида, другие направлены на предотвращение агрегации А-амилоида в головном мозге пациентов, пораженных AD. Однако наиболее перспективные подходы направлены на повышение клиренса А-бляшек в головном мозге посредством введения либо антигенов, способных генерировать иммунный ответ против А(активная иммунизация), либо антител, направленных против А (пассивная иммунизация). Антигены или иммуногены обычно представляют собой макромолекулы, содержащие отдельные антигенные участки или "эпитопы", которые распознаются различными компонентами иммунной системы и взаимодействуют с ними. Они обычно содержат малую молекулу или "гаптен", такую как короткий пептид, связанную с подходящим носителем. Носители обычно представляют собой белки с более высокой молекулярной массой, которые способны вызвать иммунный ответ при введении in vivo. При иммунном ответе антитела продуцируются и секретируются В-лимфоцитами в сочетании с Тхелперными (ТН) клетками. В большинстве систем гаптен-носитель В-клетки продуцируют антитела,специфичные как к гаптену, так и к носителю. В этих случаях Т-лимфоциты будут иметь специфичные связывающие домены на носителе, но не будут распознавать гаптен сам по себе. В случае синергизма Ви Т-клетки содействуют друг с другом в индукции гаптен-специфичного антительного ответа. Следовательно, при конструировании эффективного антигена выбор подходящего носителя и подходящего гаптена является критическим для гарантии надежного и селективного иммунного ответа. Безопасность антигена является также критически важной. Например, введение пациентам с AD перспективной вакцины AN-1792, состоящей из предварительно агрегированного А 42 и иммунного адъюванта QS-21, привело к тяжелому менингоэнцефалиту у примерно 6% субъектов, прошедших лечение. В качестве потенциальных механизмов токсичности были предложена как центральная активация цитотоксических Т-клеток, так и аутоиммунные реакции. Иммунологический ответ против эндогенного мономерного А может быть вредным, поскольку неагрегированные молекулы A играют физиологическую роль в активности нейронов. Таким образом, огромную важность имеет правильный выбор как гаптена, так и носителя для гарантии селективности антитела в отношении вредных молекул A и для предотвращения аутоиммунной токсичности. В WO 2005058940 предложена конъюгация пептидного иммуногена, содержащего A пептид или его фрагмент, с белковым/полипептидным носителем. Иммуногенные конструкции получают химическим способом, включающим дериватизацию функциональных групп аминокислотных остатков носителя, где любые неконъюгированные дериватизированные функциональные группы аминокислотных остатков инактивированы посредством кэппирования с целью блокирования их взаимодействия с другими молекулами. Такой способ приводит в результате к иммуногенам, где фрагмент А связан с аминокислотными боковыми цепями носителя. Хотя в WO 2005058940 предложено несколько различных носителей и гаптенов, их гистопатологическая эффективность in vivo не показана. В Kim, H.D. et al. Biochem. Biophys, Res. Commun. Volume 336, p. 84-92 предлагается анти-А ДНКвакцина, состоящая из бескаркасных 11-кратных повторов А 1-6. Такая конструкция инициировала антитела, которые одинаково распознавали мономерные, олигомерные и фибриллярные А 42. Вообще говоря, селективная направленность иммуногенов против разных состояний сборки А 42(мономеров, олигомеров или фибрилл) до настоящего времени не была достигнута. В свете вышеизложенных соображений все еще остается необходимость в разработке безопасной и эффективной иммуногенной конструкции, которую можно использовать в композициях для терапевтической вакцинации для предотвращения агрегации А-амилоида в головном мозге пациентов, пораженных AD или другими амилоидогенными заболеваниями, такими как синдром Дауна. В настоящем изобретении предложена рекомбинантная иммуногенная конструкция, отличающаяся-1 014531 тем, что фрагменты A расположены в активном петлевом участке (экспонированном участке) носителя вероятнее, а не связаны с концами носителя. Указанный пептид получают посредством тандемной мультимеризации В-клеточного эпитопа, несущего фрагмент А 42, в активном петлевом участке (экспонированном участке) носителя, предпочтительно тиоредоксина (Trx). Было обнаружено, что иммуногены по настоящему изобретению инициируют антитела, распознающие нейротоксические олигомерные молекулы А-амилоида, которые, как недавно было показано,являются наиболее непосредственными причинными факторами амилоидогенных заболеваний. Эта способность связана с конструкцией иммуногена, характерным признаком которого является расположение А амилоида в рамках носителя. Такая конфигурация в некоторой степени обеспечивает правильную укладку иммуногенного белка и более эффективно презентирует его иммунной системе. Когда иммуноген несет более чем один А-амилоидный фрагмент, и, в частности, конкретное число указанных фрагментов, сходство иммуногена с А-амилоидными олигомерами, как представляется, дополнительно улучшает его эффективность, а также повышает селективность. Линкер между носителем и фрагментами дополнительно способствует сохранению определенного состояния сборки пептидных эпитопов. Краткое изложение сущности изобретения В настоящем изобретении предложена иммуногенная конструкция (также указанная здесь ниже как иммуноген), содержащая фрагмент, несущий иммунодоминантный В-клеточный эпитоп А 42 и носитель, отличающаяся тем, что указанный фрагмент расположен в активном петлевом участке (экспонированном участке) носителя. Носитель предпочтительно представляет собой тиоредоксин, тогда как Афрагмент предпочтительно представляет собой N-концевой фрагмент из менее чем 30 аминокислотных остатков, предпочтительно менее чем 20 аминокислот, более предпочтительно представляет собой A115. Еще более предпочтительно иммуногенная конструкция несет более чем один фрагмент, предпочтительно от 2 до 16, наиболее предпочтительно 4 фрагмента. В настоящем изобретении также предложен способ конструирования указанного иммуногена,включающий тандемную мультимеризацию В-клеточного эпитопа, несущего фрагмент А 42, в экспонированном участке носителя, предпочтительно N-концевого фрагмента из менее чем 30 аминокислотных остатков, при помощи линкера. В другом аспекте в настоящем изобретении предложена композиция, содержащая указанный иммуноген, для активной вакцинации против амилоидогенных заболеваний. В еще одном аспекте в настоящем изобретении предложено применение указанного иммуногена для разработки антител, предпочтительно моноклональных антител, для применения в качестве пассивной вакцины против амилоидогенных заболеваний. Описание графических материалов На фиг. 1 а показана конструкция Trx(A1-15-Gly-Gly-Pro)n по настоящему изобретению. На фиг. 1 б показана очистка до однородности посредством металл-аффинной хроматографии конструкций, несущих одну, четыре или восемь копий A1-15 на Trx-экспонированном участке. На фиг. 1 в показаны уровни анти-А антител, индуцируемых иммуногенами в соответствии с воплощениями настоящего изобретения. На фиг. 1 г показаны иммуногены Th2-поляризованного ответа в соответствии с воплощениями настоящего изобретения. На фиг. 2 а-б-в показаны срезы головного мозга человека, обработанные сыворотками мышей, иммунизированных иммуногенами, в соответствии с воплощениями настоящего изобретения. На фиг. 3 представлены изображения, полученные посредством AFM, демонстрирующие предпочтительные связывания иммуногенов в соответствии с воплощениями настоящего изобретения. Подробное описание предпочтительных воплощений В настоящем изобретении предложена иммуногенная конструкция (или иммуноген), содержащая носитель, несущий по меньшей мере один фрагмент А 42. Указанный фрагмент расположен в экспонируемом на поверхности участке (активном петлевом участке или экспонированном участке) носителя,который конформационно его стабилизирует. Точный размер и химическую однородность конструкции обычно определяют посредством как гель-электрофореза, так и масс-спектрометрии. Структуру конструкции можно определить с помощью аналитических методик; однако, предпочтительно использовать ядерный магнитный резонанс (ЯМР). Носитель предпочтительно представляет собой тиоредоксин (Trx). Trx является особенно подходящим благодаря его небольшому размеру (109 аминокислот), емкости пептидного экспонированного участка и способности действовать в качестве нетоксичного иммуноусилителя, способного стимулировать пролиферацию Т-клеток мышей. Однако можно использовать и другие носители. А-амилоидный фрагмент представляет собой N-концевой конец, преимущественно N-концевой фрагмент, имеющий менее 30 аминокислотных остатков, предпочтительно менее 20 аминокислот и более-2 014531 предпочтительно выбран из группы, состоящей из А 1-3, 1-4, 1-5, 1-6, 1-7, 1-8, 1-9, 1-10, 1-11, 1-12, 1-13,1-14, 1-15, приведенных ниже в таблице 1, в соответствии с однобуквенным кодом для аминокислот. Предпочтительно А-амилоидный фрагмент представляет собой А 1-15. Преимущественно иммуногенная конструкция по изобретению несет более чем один фрагмент,предпочтительно от 2 до 16, более предпочтительно 4 фрагмента. В предпочтительном воплощении фрагменты связаны с носителем через линкер для предотвращения образования соединительных эпитопов. Указанный линкер представляет собой короткую аминокислотную последовательность, предпочтительно линкер, состоящий из 1-5 аминокислотных остатков, более предпочтительно Глицин-Глицин-Пролин (Gly-Gly-Pro). Однако можно использовать и другие линкеры, такие как Глицин-Пролин-Глицин-Пролин-Глицин (Gly-Pro-Gly-Pro-Gly) или Серин-ГлицинСерин-Глицин (Ser-Gly-Ser-Gly). Предпочтительная иммуногенная конструкция состоит из тиоредоксина, связанного, возможно через подходящий линкер, с четырьмя фрагментами А 1-15, и упоминается здесь ниже как Trx(А 1-15)4. Способом конструирования указанного иммуногена является способ клонирования, который включает амплификацию носителя в подходящей бактерии, встраивание носителя в подходящий вектор, где указанный вектор содержит промотор Т 7 для экспрессии белка через систему рЕТ; получение ДНКвставки А-фрагмента; рестрикцию и лигирование носителя-вектора и ДНК-вставки А-фрагмента. Предпочтительно ДНК-вставка А-фрагмента содержит аминокислотный линкер. Когда получают мультимеры, используют избыток ДНК-вставки А-фрагмента. Таблица 1 Оказалось, что предпочтительная иммуногенная конструкция по настоящему изобретению при инъекции один раз в месяц в течение 4 месяцев у трансгенных мышей, у которых была индуцирована амилоидная патология головного мозга, уменьшает число и размер А-бляшек в гиппокампе и в коре головного мозга. Кроме того, было обнаружено, что предпочтительная иммуногенная конструкция по изобретению индуцирует образование антител, которые распознают определенные типы А 42. Указанные антитела при инъекции в гиппокамп способны устранять А 42-положительные бляшки в гиппокампе и коре головного мозга трансгенных мышей, причем указанный эффект устранения особенно очевиден для олигомерных А. Было также обнаружено, что указанные антитела значительно улучшают А-ассоциированный астроглиоз (пример 2). Соответственно, иммуногенные конструкции по настоящему изобретению могут составлять композиции для применения в качестве как активной, так и пассивной вакцины против амилоидогенных заболеваний. Для активной вакцинации фармацевтическую композицию, содержащую иммуногенную конструкцию по изобретению, предпочтительно вводят в комбинации с адъювантом. Выбор адъюванта и/или носителя зависит от стабильности вакцины, содержащей адъювант, пути введения, режима дозирования, эффективности адъюванта в отношении вакцинируемых видов, а у людей фармацевтически приемлемым адъювантом является такой, который был одобрен или может быть одобрен для введения людям соответствующими регулирующими органами. Например, полный адъювант Фрейнда непригоден для введения людям. Подходящие адъюванты включают 3-де-О-ацилированный монофосфориллипид A (MPL), мурамилдипептид и сапонины, такие как QS21 и Qui1A. Предпочтительным классом адъювантов являются соли алюминия (квасцы), такие как гидроксид алюминия, фосфат алюминия, сульфат алюминия. Дополнительные адъюванты включают цитокины,такие как интерлейкины (IL-1, IL-2 и IL-12), макрофагальный колониестимулирующий фактор (M-CSF),-3 014531 фактор некроза опухоли (TNF). Адъювант можно вводить с иммуногеном в виде единой композиции, либо его можно вводить до,одновременно с введением или после введения иммуногена. Возможно, два или более чем два различных адъюванта можно применять одновременно. Иммуноген и адъювант могут быть упакованы и поставляться либо в одном и том же флаконе, либо они могут быть упакованы в отдельные флаконы и смешаны перед применением. Фармацевтические композиции, содержащие иммуногенную конструкцию по изобретению, также могут включать ряд других фармацевтически приемлемых компонентов. См. Remington's PharmaceuticalScience (15th Ed., Mack Publishing Company, Easton, Pennsylvania, 1980). Предпочтительная фармацевтическая форма зависит от предполагаемого способа введения и от терапевтического применения. Композиции могут также включать, в зависимости от желательного препарата, фармацевтически приемлемые, нетоксичные носители или разбавители, которые определены как носители, обычно используемые для изготовления препаратов фармацевтических композиций для введения животным и людям. Разбавитель выбирают таким образом, чтобы он не влиял на биологическую активность комбинации. Примерами таких разбавителей являются дистиллированная вода, физиологический фосфатнобуферный солевой раствор, растворы Рингера, раствор декстрозы и раствор Хэнка. Для парентерального введения иммуногенную конструкцию по изобретению можно вводить в виде инъекционных доз раствора или суспензии вещества в физиологически приемлемом разбавителе с фармацевтическим носителем, который может представлять собой стерильную жидкость, такую как вода,масло, физиологический раствор, глицерин или этанол. Кроме того, в композициях могут присутствовать вспомогательные вещества, такие как увлажняющие или эмульгирующие агенты, поверхностно-активные вещества, рН-буферные вещества и тому подобное. Композиции по изобретению можно готовить в виде инъекционных препаратов, либо в виде жидких растворов или суспензий; также можно изготовить твердые формы, пригодные для растворения или суспендирования в жидких носителях перед инъекцией. Иммуногенную конструкцию по изобретению можно вводить в форме депо-инъекции или имплантируемого препарата, который можно изготовить таким образом, чтобы он обеспечивал возможность пролонгированного высвобождения активного ингредиента. Дополнительные препараты, пригодные для других способов введения, включают пероральные, интраназальные и легочные препараты, суппозитории и чрескожные препараты. Для пассивной вакцинации композицию инъецируют млекопитающему, такому как морская свинка или другие виды животных, и полученные в результате антитела очищают, а затем инъецируют людям. Предпочтительно антитела являются моноклональными, и их продуцируют путем иммунизации млекопитающего иммуногенной конструкцией Trx(А 1-15)4. Указанные антитела применяют для предупреждения и лечения амилоидогенных заболеваний, в частности болезни Альцгеймера. Пример 1. Получение различных иммуногенных конструкций TrxA и оценка ех vivo эффектов различных анти-TrxA антител. Для конструирования Trx(А 1-15)n применяли стратегию клонирования, основанную на использовании избытка ДНК-вставки А 1-15 по отношению к модифицированному реципиентному вектору, несущему кодирующую последовательность Trx под контролем промотора фага Т 7 (фиг. 1 а). Конструкции,несущие одну, четыре или восемь копий Trx-экспонированных А 1-15, выделяли и использовали для экспрессии соответствующих полипептидов, которые затем очищали до гомогенности посредством металл-аффинной хроматографии (фиг. 1 б). Эффективными для получения правильно собранных мультимеров А 1-15 были направленность и способность к слиянию в рамке уникального сайта Cpol, присутствующего в последовательности Trx(положения нуклеотидов 99-105, соответствующие аминокислотным остаткам 34-35, идентифицированные как: 5'CG/GT(A)CCG3'), а также включение в ДНК А 1-15 концевой последовательности, кодирующей промежуточный линкер Gly-Gly-Pro, таким образом, также предотвращая образование соединительных эпитопов. Четвертая конструкция (TrxA42), несущая одну копию полноразмерного пептида А 42, была получена аналогично. Хотя все полипептиды Trx(А 1-15)n были растворимы, независимо от кратности А 31-15, большая часть белка TrxA42 заканчивалась в тельцах включения в нерастворимой форме (не показано). Таким образом, оказалось, что А 42 является слаборастворимым даже при слиянии с Trx в гетерологичном окружении бактериальных клеток. Пять групп по 10 самцов мышей BALB/c обрабатывали 10 наномоль вышеописанных полипептидовTrx(А 15)n или эквивалентными количествами предварительно агрегированных синтетических А 42 илиTrxA42, все с добавлением квасцов, адъюванта, одобренного к применению у людей (фиг. 1 в). Две дополнительные группы, которым инъецировали только буфер (PBS) или A42 без квасцов,-4 014531 служили в качестве отрицательных контролен. Сыворотки собирали через две недели после четвертой инъекции, случайно объединяли в пары и анализировали посредством твердофазного иммуноферментного анализа (ELISA), используя агрегированный А 42 в качестве антигена-мишени. Как показано на фиг. 1 в, средние уровни анти-А антитела, индуцированные Trx(А 1-15)4 и Trx(А 1-15)8, но не TrxA1-15,были значительно выше (Р 0,05), чем в ложно обработанных контролях и подобны уровням групп, обработанных А 42, где TrxA42 функционировала так же, как свободный А 42. Р представляет собой р-значение, связанное с t-критерием на log трансформированном контроле, и экспериментальными данными с использованием байесовского анализа или стандартных отклонений; Р указывает на вероятность, с которой результат, полученный в статистическом тесте, является случайным скорее, чем действительным взаимоотношением между измерениями. Сильный противовоспалительный Th2-поляризованный ответ, типичный для квасцового адъюванта,был выявлен путем изотипного профилирования (фиг. 1 г). Хотя преобладание иммуноглобулина классаG и подклассов 1 (lgG1) наблюдалось со всеми антигенами, отношение lgG1/lgG2 (иммуноглобулина класса G и подклассов 2) было воспроизводимо выше (Р 0,05) для мультимерных Trx(А 1-15)n иTrxA42 иммуноконъюгатов, чем для неконъюгированного А 42. Затем была исследована способность антисывороток, генерируемых в ответ на Trx(А 1-15)n связываться с амилоидными бляшками. Это свойство, в настоящее время рассматриваемое как наилучший прогностический показатель эффективности анти-А антитела in vivo, не является общим для всех ранее описанных анти-А антисывороток (например m266 и других антител, нацеленных на С-концевой участок А 42). Как показано на фиг. 2 а-б, сыворотки от мышей, иммунизированных тетрамерной или октамерной формой Trx(А 1-15)n, связывались с амилоидными бляшками вплоть до разведения 1/1000. Большие нейритные бляшки, также как зрелые и незрелые бляшки, метили антимультимерными антителами Trx(A1-15)n, Более широкое иммунологическое окрашивание, в частности в сердцевинах сенильных бляшек, наблюдалось с положительным контролем анти-Pan -амилоидной антисыворотки, генерируемой у кроликов с использованием А 40 в качестве антигена (не показано). Для сравнения, бляшки не были обнаружены ни с сыворотками от ложно обработанных животных (не показано), ни с сыворотками от мышей, иммунизированных мономерным TrxA1-15 (фиг. 2 в). Наконец, иммуноблоты использовали для оценки функциональной активности различных антиTrx(А 1-15)n антител в отношении разных состояний сборки А 42 (мономеров, олигомеров и фибрилл),генерируемых in vitro в определенных ранее условиях и подтвержденных атомно-силовой микроскопией(AFM). Результаты данного анализа приведены на фиг. 3, где показано, что антитела анти-Trx(А 1-15)8 связывают все три типа А 42, тогда как антитела анти-Trx(А 1-15)4 преимущественно связывают как растворимые олигомеры, так и фибриллы, но не мономеры А 42. В резком противоречии с этим, антитела, индуцированные против мономерного антигена TrxA1-15, не демонстрировали никакого связывания, а также не распознавали фибриллы А 42. Последнее наблюдение находится в соответствии с неспособностью этих антител распознавать агрегаты А 42 более высокого порядка в анализах ELISA, а также А-фибрилл в бляшках AD (см. фиг. 1 в и 2 в). Интересно, однако, что антимономерные антитела TrxA115 связывают мономеры и олигомеры А 42 (фиг. 3). Trx(А 1-15)4 представляет собой, таким образом,растворимое производное амилоида- с отсутствующим Т-клеточным эпитопом с хорошей иммуногенной активностью, даже при включении в состав препарата с адъювантом умеренной силы, таким как квасцы, Al(OH)3. Также значимой является способность Trx(А 1-15)4 генерировать антитела, которые связываются с синаптотоксическими олигомерами и фибриллами А 42, но не связываются с предположительно физиологическими мономерными А. Основными преимуществами Trx-dPI по сравнению с другими стратегиями пептидной иммунизации являются их эффективности по времени и стоимости, отсутствие клеточной токсичности и выход химически гомогенных иммуноконъюгатов, однородность которых от партии к партии можно легко подтвердить. Кроме того, как только "ведущий антиген" идентифицирован, он легко поддается дальнейшей модификации, включающей введение дополнительных пептидных эпитопов и замещение вектора в целях ДНК-вакцинации. Конструкции TrxA. Последовательность, кодирующая тиоредоксин Е. coli, была амплифицирована с помощью полимеразной цепной реакции (PCR) с использованием праймеров 1 и 2 (табл. 2), сконструированных для создания сайтов рестрикции Ndel и BamHI. Амплифицированный фрагмент был подвергнут двойному гидролизу ферментами рестрикции Ndel и BamHI и лигирован с pET28b (Novagen), гидролизованными теми же двумя ферментами; полученный в результате вектор, обозначенный как рТ 7KanTrx, содержит последовательность His6-меченого по N- и С-концам варианта бактериального тиоредоксина вместе с маркером устойчивости к канамицину. Уникальный сайт Cpol, присутствующий в Trx-кодирующей последовательности (положения нуклеотидов 99-105, соответствующие аминокислотным остаткам 34-35, идентифицированным как: 5'CG/GT(A)CCG3'), использовали в качестве сайта клонирования.-5 014531 Эффективными для получения мультимеров А 1-15 являются направленность и способности к слиянию в рамке уникального сайта Cpol. Инструментом для получения мультимеров А 1-15 являются способности к направленности и слиянию в рамке уникального сайта Cpol.pT7Kan-TrxA1-15. Последовательность, кодирующая пептид А 1-15, N-концевой фрагмент амилоидного бета-пептида А 42, была получена путем отжига фосфорилированных олигонуклеотидов: несущих концевую последовательность распознавания Cpol. ДНК-вставка из 57 п.о. (пар оснований) (5'-выступающий Cpol) была лигирована с Cpol-гидролизованным рТ 7Kan-Trx, при молярном отношении вектор/вставка 1/10. Полноразмерная последовательность представляет собой: Основные признаки конструкции TrxA1-15 касаются присутствия остатка Met(М) на N-конце пептида A1-15, линкера Gly-Gly-Pro на С-конце пептида А 1-15 и последовательностей, кодирующих His6 меченый по N- и С-концам вариант бактериального тиоредоксина. Конструкции, несущие большее количество копий пептида А 1-15, были получены аналогично, но при молярном отношении вектор/вставка 1/100. Рекомбинантные клоны подвергали скринингу посредством рестрикционного гидролиза/гель-электрофореза, и два из них, несущие четыре или восемь копий последовательности А 1-15, использовали для экспрессии и очистки соответствующих рекомбинантных белков Присутствие двух меток His6 способствует стадии очистки и может повысить иммуногенность, как в случае тандемных повторов лизиновых остатков. Таблица 2 Экспрессия и очистка полипептидов Trx А. Экспрессию индуцировали добавлением 1 мМ изопропилD-тиогалактопиранозида (IPTG) к клеткам Е. coli BL21Star (DE3) (Invitrogen), трансформированным каждой из вышеописанных конструкций, и давали возможность продолжаться в течение 2 ч при 37 С. Другой штамм Е. coli (Origami-DE3; Novagen) и модифицированные условия экспрессии (векторpT7-Amp-Trx; 5 ч при 30 С) использовали для Trx А 42, который иначе был полностью нерастворимым. После лизиса клеток His6-меченые полипептиды Trx А связывали с металл-аффинной смолой (Talon;Clontech), очищали в соответствии с инструкциями изготовителя и подвергали интенсивному диализу против фосфатно-буферного солевого раствора (PBS). Концентрацию белка определяли методом окрашивания Кумасси (Bio-Rad) и по УФ-поглощению. Состав и чистоту индивидуальных полипептидов оценивали как с помощью гель-электрофореза в гелях 11% полиакриламид/SDS (додецилсульфат натрия), так и с помощью анализа MALDI-TOF (matrix-assisted laser desorption ionization-time of flight, времяпролетная система с ионизацией посредством лазерной десорбции при содействии матрицы) (MassLynx4.0, Waters). Протокол иммунизации. Рекомбинантные полипептиды Trx А (2 мг/мл в PBS) стерилизовали фильтрацией, и аликвоту каждого из них (10 наномоль) смешивали с 1 мг квасцов (Sigma-Aldrich) в конечном объеме 400 мкл непосредственно перед использованием. А 42 (Sigma-Aldrich) растворяли в PBS(2 мг/мл) и подвергали агрегации в течение ночи при 37 С перед иммунизацией. Пяти случайно подобранным группам самцов мышей BALB/c в возрасте одного месяца (Charles River Laboratories; 10 животных в каждой) инъецировали подкожно вышеуказанные антигены на 1, 15, 30 и 60 сутки, как показано на фиг. 1 в. Такую же обработку применяли к двум отрицательным контрольным группам, которым инъецировали PBS и агрегированный А 42, оба без квасцов. Сыворотки собирали через две недели после по-6 014531 следнего бустера и случайным образом объединяли попарно. Обнаружение анти-Ар 42 антител. Суммарные антитела анти-А 42 обнаруживали с помощьюELISA при фиксированном разведении 1/200, используя агрегированный A42 (0,5 мкг/лунка) в качестве антигена-мишени 23. После инкубации, промывки и добавления конъюгированных с пероксидазой хрена(HRP) иммуноглобулинов против мыши (1/5000; Sigma-Aldrich) и хромогенного субстрата ортофенилендиамина (Sigma-Aldrich) планшеты считывали на спектрофотометре при 450 нм. Определение изотипа иммуноглобулина проводили при фиксированном разведении 1/200, используя специфичные к подклассу Ig HRP-конъюгированные вторичные антитела крысы против мыши (TechniPharm). ELISA проводили в трех параллелях на пяти спаренных сыворотках из каждой группы; только подгруппу сывороток от трех животных с максимальным ответом в группах 1, 3, 4, 6 и 7 (фиг. 1 в) использовали для определения изотипа. Сравнения между группами проводили посредством одностороннего анализаANOVA, используя программное обеспечение Analyze-it. Иммуногистохимия. Сыворотки от мышей, иммунизированных каждым из трех полипептидовTrxA1-15, подвергали скринингу на их способность к связыванию А бляшек в срезах головного мозга человека - 68-летнего пациента с невропатологическими и клиническими симптомами, типичными для тяжелой болезни Альцгеймера. Анализировали различные разведения (1/100-1/1000) объединенных сывороток от трех высокоотвечающих особей в группах 5, 6 и 7; лучшие результаты были получены с разведением 1/500. Сыворотки добавляли к серийным 8 мкм срезам головного мозга фиксированной в формалине ткани височной коры, предварительно обработанным муравьиной кислотой (80%, 15 мин). Сыворотки от ложно обработанных животных (PBS), и имеющийся в продаже препарат поликлонального анти-А 40 антитела (Anti-Pan -Amyloid, Biosource) использовали в качестве отрицательного и положительного контролей, соответственно. Иммунологическое мечение выявляли с помощью системы EnVision Plus/пероксидаза хрена (Dako), используя 3,3'-диаминобензидин в качестве хромогенного субстрата согласно инструкциям изготовителя. Изображения получали с помощью цифровой камеры при увеличениях в интервале от 50 до 400 Х. Дот-блот анализы и визуализация посредством AFM. А 42 для дот-блот анализа готовили в соответствии с протоколами, ранее известными в данной области техники (см., например, Stine, W.B. et al. вJ. Biol. Chem. Volume 278, page 11612-11622). Кратко, А 42, растворенный в 2 M DMSO (конечная концентрация 1 мМ), использовали как источник мономерной формы; разбавление концентрированного раствора DMSO в холодной среде Ham's F12 К (без фенолового красного; Biosource) при конечной концентрации 100 мкМ с последующей инкубацией в течение 24 ч при 4 С использовали для получения растворимых олигомеров; тот же исходный раствор, разведенный в 10 мМ НСl при конечной концентрации 100 мкМ и инкубированный в течение 24 ч при 37 С, использовали для образования А фибрилл. Идентичность различных типов А, а также отсутствие фибрилл из растворов растворимых олигомеров проверяли с помощью AFM. К данному моменту вышеописанные растворы А 42 были разведены 10-кратно в 20 мкл буфера для осаждения (4 мМ HEPES рН 7,4, 10 мМ NaCl, 7 мМ MgCl2) до конечной концентрации 10 мкМ и немедленно осаждены на свежих сколах рубиновой слюды при комнатной температуре. Через пять минут слюдяные диски ополаскивали водой марки milli-Q и осторожно сушили в потоке азота. Изображения получали с помощью микроскопа Nanoscope III (Digital Instruments), работающего в режимеTapping Mode (режим обстукивания), используя имеющиеся в продаже трамплинные силиконовые кронштейны (MikroMasch). Фиксированный объем каждого типа А, соответствующий либо 0,1 пмоль,либо 1 пмоль пептида А 42, наносили в виде пятна на нитроцеллюлозную мембрану (GE Healthcare LifeSciences), предварительно увлажненную 20 мМ Трис-HCl, рН 7,5, 0,8% NaCl (TBS), используя вакуумный аппарат для дот-блоттинга (96 лунок; Bio-Rad). Дот-блоттинги готовили партиями из восьми мембран каждая, которые сушили и хранили при 4 С в течение не более двух недель до использования. Антисыворотку для дот-блот-анализа подвергали аффинной очистке на миниколонках с белком A (Diatheva) согласно инструкциям изготовителя. После определения суммарной концентрации иммуноглобулина методом окрашивания Кумасси очищенные иммуноглобулины использовали для дот-блот анализов при конечной концентрации 0,75 мкг/мл. После блокирования при комнатной температуре с помощью 5%ного обезжиренного сухого молока в TBS с добавлением 0,05% Твин 20 (TBST) блоттинги инкубировали в течение 1,5 часов с каждым из трех первичных антител Trx А 1-15 в сухом молоке-TBST, отмывали 310 мин TBST, а затем обнаруживали иммуноглобулины мыши с помощью набора SuperSignal WestFemto (Pierce), как указано изготовителем. Три независимых технических повтора проводили с антисыворотками из пула самого высокого ответа в каждой группе. Пример 2. Оценка эффектов анти-Trx(А 1-15)4 антител in vivo на -амилоидную патологию головного мозга у взрослых трансгенных мышей Tq2576. Методы Самок трансгенных мышей AD (Tg2576), экспрессирующих шведскую мутацию человеческого АРР(1), получали из популяции мышей Центра по изучению болезни Альцгеймера Бостонского университета. Основатели этой популяции были предоставлены Dr. Karen Hsiao-Ashe (кафедра неврологии медицинского факультета университета Миннесоты). У мышей АРР Tg2576 развиваются поведенческие ано-7 014531 малии и проявляются гистологические свидетельства отложений А в головном мозге в виде бляшек,параллельно с сопутствующим астроглиозом в возрасте уже 8 месяцев. Мышей генотипировали с использованием стандартизованного анализа PCR хвостовой ДНК и помещали по четыре в каждую клетку в стандартных условиях при свободном доступе к пище и воде. Шесть 14-месячных мышей АРР (32-34 г каждая), помещенных в 12-часовой световой режим, использовали для хирургических операций. Мышей анестезировали внутрибрюшинной инъекцией кетамина HCl/ксилазина (100 мг/кг кетамина и 10 мг/кг ксилазина; 100 мкл/10 г массы тела) и помещали в стереотаксический аппарат (Koph) с адаптером для головы мыши. Терморегуляцию поддерживали при 37 С, используя грелку-подушку, с мониторингом дыхания на протяжении всей процедуры. Скальп надрезали по срединной линии, чтобы обнажить сагиттальный шов, и определяли стереотаксические координаты в обоих полушариях (2). Брегму использовали в качестве эталонной точки (2,0 мм), и сверлили отверстия в своде черепа на стыке левой и правой латеральной координаты (1,75 мм). Аффинно-очищенные анти-Trx(А 1-15)4 антитела параллельно с иммуноглобулинами от ложно обработанных PBS (2 мкл каждого) контрольных мышей стереотаксически инъецировали в левый и правый гиппокамп (2,0 мм вентрально) соответственно, используя шприц на 10 мкл с тупым наконечником (Hamilton). После помещения шприца и до извлечением шприца проходило 2 мин времени выдержки, затем 4 мин времени инъекции и еще 2 мин времени выдержки. Местный анестетик применяли при закрытии надреза с использованием 9 мм автоматического зажима. Мышей держали на грелке-подушке до полного восстановления. Все эксперименты с животными проводили в соответствии с Руководством по использованию лабораторных животных и уходу за ними Национальных институтов здоровья, а также администрации Комитета Ветеранов и комитета по уходу за животными Бостонского университета. Через семь суток после инъекции мышей подвергали глубокой анестезии и перфузировали транскардиально 2% забуференным параформальдегидом (100 мл). Головной мозг подвергали постфиксации в течение 2 ч, криопротекции в маркированной серии глицерина, и затем получали замороженные срезы (50 мкм). Серийные тканевые срезы мышей окрашивали на субстанцию Ниссля,окрашивали с использованием анти-А 42 ( по каталогу 344; Biosource International), анти-А олигомера (А 11; Biosource International) и против глиального фибриллярного антигенного белка (GFAP; Dako) антител, и окрашивали серебром, используя метод Campbell-Switzer для идентификации зрелых Абляшек. Серийные фронтальные тканевые срезы, иммуноокрашенные А 42 в пределах гиппокампа, начиная от между ушами: 1,68 мм/брегма: -2,12 мм до между ушами: 2,16 мм/брегма: -1,64 мм были проанализированы количественно. А 42-положительные бляшки количественно определяли на основании изображений высокого разрешения одних и тех же областей головного мозга в полушарии, обработанном анти-Trx(А 1-15)4, и противоположном полушарии, обработанном PBS, используя программы BioVision (3) и Neurolucida (MicroBrightField, Williston, VT). Программа BioVision дифференцирует бляшки от фонового нейропиля и считает их, тогда как программа Neurolucida вычленяет данные из изображенийBioVision, передавая их в Excel (Microsoft, Redmond, WA) для статистического анализа. Результаты Далее оценивали иммунотерапевтический потенциал анти-Trx(А 1-15)4 путем стереотаксической инъекции этого антитела в гиппокамп 14-месячных АРР-трансгенных мышей AD (Tg2576). Иммуноглобулины от ложной обработки мышей только PBS, инъецировали в противоположное полушарие, что служило внутренним контролем для данного эксперимента. Через семь суток после инъекции гистопатологическое исследование выявило значительное уменьшение иммунологического окрашивания A в гиппокампе и перекрывающей его новой коре головного мозга мышей, получающих антитело антиTrx(А 1-15)4, в противоположность полушарию, контрольному к инъецированному. А-положительные бляшки не только отсутствовали в месте инъекции, но были значительно уменьшены в пределах инъекционной пенумбры (2 мм спереди/сзади от места инъекции). Это позволяет предположить, что не только фибриллы и малые олигомеры, но также олигомеры более высокого порядка являются мишенью in vivo для антитела анти-Trx(А 1-15)4. Для подтверждения того, что полученные данные не являлись результатом конкуренции между анти-Trx(А 1-15)4 и первичным анти-А антителом, авторы изобретения провели альтернативные гистопатологические анализы,используя иммунологическое окрашивание глиального фибриллярного антигенного белка (GFAP) и окрашивание серебром Campbell-Switzer (Кэмпбелл-Швайзер) для обнаружения астроглиоза и А бляшек. Астроглиоз и бляшки, связанные с глией, были значительно уменьшены в пределах инъекционной пенумбры антитела анти-Trx(А 1-15)4 по сравнению с противоположным ложно инъецированным полушарием. Кроме того, как выявлено путем окрашивания серебром Campbell-Switzer, было намного меньше бляшек в полушарии с инъекцией анти-Trx(А 1-15)4 по сравнению с ложно инъецированным полушарием. Оба наблюдения совпадают с данными иммунологического окрашивания, полученным с обнаружением антитела анти-А. С количественной точки зрения, по сравнению с полушарием, обработаннымPBS, происходило значительное уменьшение количества А 42-положительных бляшек в полушарии,обработанном анти-Trx(Ар 1-15)4 (полушарие, обработанное PBS: 3,341030,58; полушарие, обработанное анти-Trx(А 1-15)4: 0,971030,27, P 0,01). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Иммуногенная конструкция, содержащая в качестве носителя тиоредоксин, связанный по меньшей мере с одним фрагментом А 42. 2. Иммуногенная конструкция по п.1, где по меньшей мере один фрагмент А 42 связан с тиоредоксином посредством аминокислотного линкера. 3. Иммуногенная конструкция по п.1 или 2, где по меньшей мере один фрагмент А 42 выбран из группы, состоящей из А 1-3, 1-4, 1-5, 1-6, 1-7, 1-8, 1-9, 1-10, 1-11, 1-12, 1-13, 1-14, 1-15. 4. Иммуногенная конструкция по п.3, где по меньшей мере один фрагмент А 42 представляет собой A1-15. 5. Иммуногенная конструкция по п.4, где фрагмент А 1-15 связан с тиоредоксином посредством аминокислотного линкера. 6. Иммуногенная конструкция по п.5, где аминокислотный линкер представляет собой Gly-Gly-Pro. 7. Иммуногенная конструкция по п.4, где тиоредоксин несет более чем один фрагмент А 1-15. 8. Иммуногенная конструкция по п.7, где тиоредоксин несет четыре фрагмента А 1-15 (Trx(А 115)4). 9. Фармацевтическая композиция для вакцинации против амилоидогенных заболеваний, содержащая иммуногенную конструкцию по любому из пп.1-8. 10. Композиция по п.9, дополнительно содержащая адъювант. 11. Композиция по п.10, где адъювант выбран из группы, состоящей из 3-де-О-ацилированного монофосфориллипида A (MPL), сапонина QS21, мурамилдипептида или соли алюминия. 12. Композиция по п.11, где адъювант представляет собой соль алюминия, выбранную из группы,состоящей из гидроксида алюминия, фосфата алюминия и сульфата алюминия. 13. Моноклональное антитело, которое распознает иммуногенную конструкцию по любому из пп.18. 14. Антитело по п.13, где иммуногенная конструкция представляет собой (Trx(А 1-15)4). 15. Терапевтический агент для предупреждения или лечения амилоидогенного заболевания, содержащий моноклональное антитело по п.13 или 14 в качестве активного ингредиента.
МПК / Метки
МПК: A61K 39/00, A61P 25/28
Метки: композиции, иммуногенные, применения, антиамилоидные, способы
Код ссылки
<a href="https://eas.patents.su/17-14531-antiamiloidnye-immunogennye-kompozicii-sposoby-i-primeneniya.html" rel="bookmark" title="База патентов Евразийского Союза">Антиамилоидные иммуногенные композиции, способы и применения</a>
Предыдущий патент: Способ получения фармацевтического промежуточного соединения
Следующий патент: Интраназальное или ингаляционное введение виросом