Применение модифицированных поксвирусов для быстрой индукции иммунитета против поксвирусных или других инфекционных агентов
Формула / Реферат
1. Применение поксвируса для изготовления вакцины для быстрой индукции защитного иммунного ответа у животного, в том числе у человека, при котором поксвирус является репликационно-некомпетентным у указанного животного, в том числе у человека, причем защитный иммунный ответ возникает в течение 7 дней или менее после введения поксвируса.
2. Применение по п.1, в котором поксвирус является модифицированным вирусом осповакцины Анкара (MVA).
3. Применение по п.2, в котором MVA выбран из MVA штаммов MVA 575, MVA 572 и MVA-BN.
4. Применение по любому из пп.1-3, в котором вирус представляет собой клонированный очищенный вирус.
5. Применение по любому из пп.1-4, в котором вирус получен путем бессывороточного культивирования.
6. Применение по любому из пп.2-5, в котором поксвирус вводят в дозе от 105 до 5´108 TCID50/мл.
7. Применение по любому из пп.1-6, в котором поксвирус вводят внутривенно, внутримышечно или подкожно.
8. Применение по любому из пп.1-7, в котором защитный иммунный ответ представляет собой защитный иммунный ответ против поксвирусной инфекции.
9. Применение по п.8, в котором иммунный ответ является иммунным ответом против инфекции оспы.
10. Применение по любому из пп.1-9, в котором поксвирус является рекомбинантным поксвирусом.
11. Применение по п.10, в котором рекомбинантный поксвирус содержит по меньшей мере одну гетерологичную последовательность нуклеиновой кислоты.
12. Применение по п.11, в котором гетерологичная последовательность нуклеиновой кислоты является последовательностью, кодирующей по меньшей мере один антиген, антигенный эпитоп и/или терапевтическое соединение.
13. Применение по п.12, в котором антигенные эпитопы и/или антигены являются антигенными эпитопами и/или антигенами инфекционного агента.
14. Применение по п.13, в котором инфекционный агент выбран из вирусов, грибов, патогенных одноклеточных эукариотических и/или прокариотических организмов, паразитических организмов.
15. Применение по п.14, в котором вирусы выбраны из семейства вируса гриппа, флавивируса, парамиксовируса, вируса гепатита, вируса иммунодефицита человека или из вирусов, вызывающих геморрагическую лихорадку.
16. Применение по любому из пп.13-15, в котором иммунная защита является защитой против инфекционного агента, из которого получен антигенный эпитоп и/или антиген.
17. Способ быстрой индукции защитного иммунного ответа у животного, в том числе у человека, включающий этап введения животному, в том числе человеку, поксвируса, который является репликационно-некомпетентным у указанного животного, в том числе у человека, где защитный иммунный ответ возникает в течение 7 дней или менее после введения поксвируса.
18. Способ по п.17, в котором поксвирус представляет собой модифицированный вирус осповакцины Анкара (MVA).
19. Способ по п.18, в котором MVA выбран из MVA-штаммов MVA 575, MVA 572 и MVA-BN.
20. Способ по любому из пп.17-19, в котором вирус является клинированным очищенным вирусом.
21. Способ по любому из пп.17-20, в котором вирус получен путем бессывороточного культивирования.
22. Способ по любому из пп.18-21, в котором поксвирус вводят в дозе от 105 до 5´108 TCID50/мл.
23. Способ по любому из пп.17-22, в котором поксвирус вводят внутривенно, внутримышечно или подкожно.
24. Способ по любому из пп.17-23, в котором защитный иммунный ответ представляет собой защитный иммунный ответ против поксвирусной инфекции.
25. Способ по п.24, в котором иммунный ответ является иммунным ответом против инфекции оспы.
26. Способ по любому из пп.17-25, в котором поксвирус является рекомбинантным поксвирусом.
27. Способ по п.26, в котором рекомбинантный поксвирус содержит по меньшей мере одну гетерологичную последовательность нуклеиновой кислоты.
28. Способ по п.27, в котором гетерологичная последовательность нуклеиновой кислоты является последовательностью, кодирующей по меньшей мере один антиген, антигенный эпитоп и/или терапевтическое соединение.
29. Способ по п.28, в котором антигенные эпитопы и/или антигены являются антигенными эпитопами и/или антигенами инфекционного агента.
30. Способ по п.29, в котором инфекционный агент выбран из вирусов, грибов, патогенных одноклеточных эукариотических и/или прокариотических организмов, паразитических организмов.
31. Способ по п.30, в котором вирусы выбраны из семейства вируса гриппа, флавивирусов, парамиксовирусов, вируса гепатита, вируса иммунодефицита человека или из вирусов, вызывающих геморрагическую лихорадку.
32. Способ по любому из пп.29-31, в котором иммунная защита является защитой против инфекционного агента, из которого получен антигенный эпитоп и/или антиген.
Текст
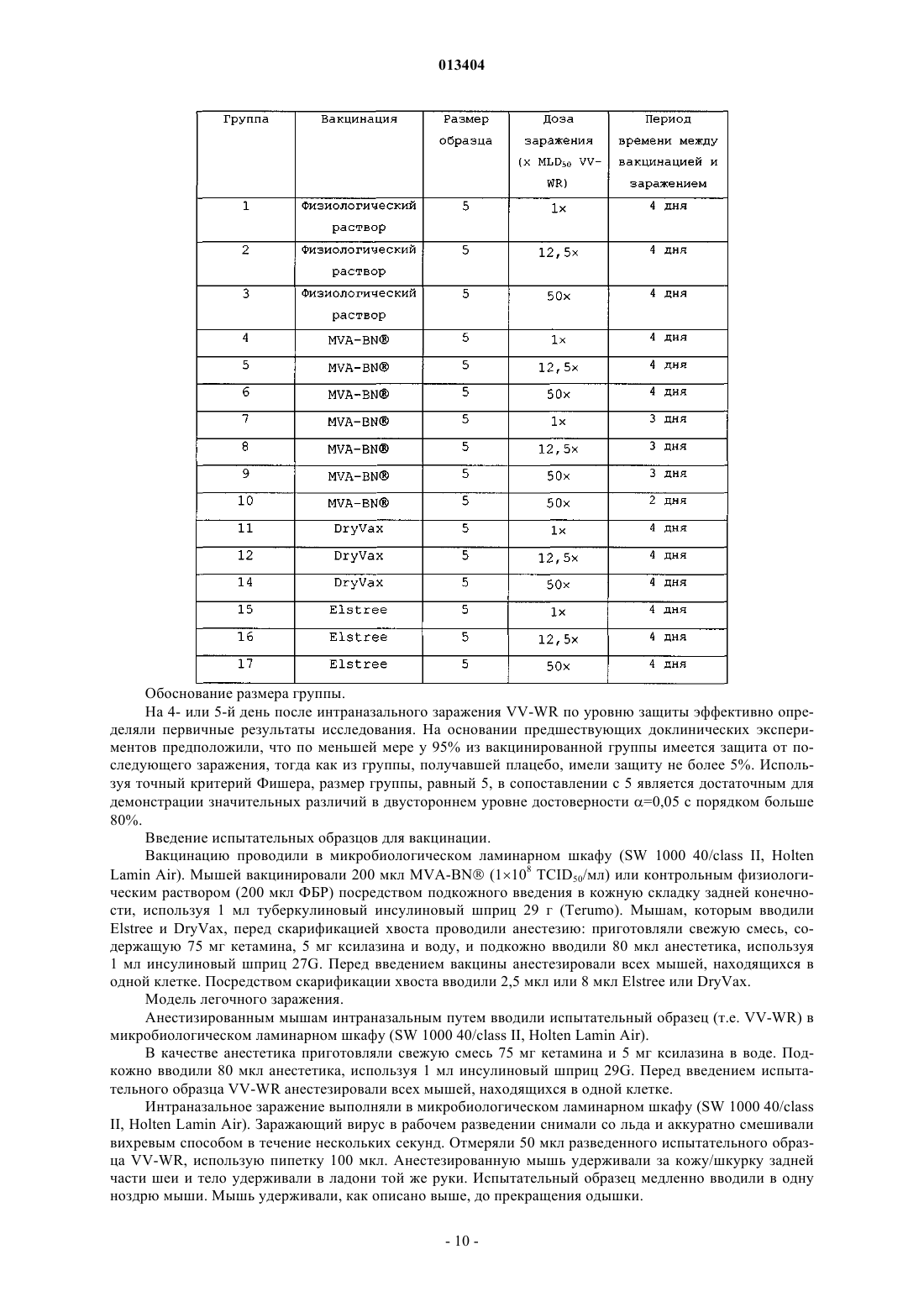
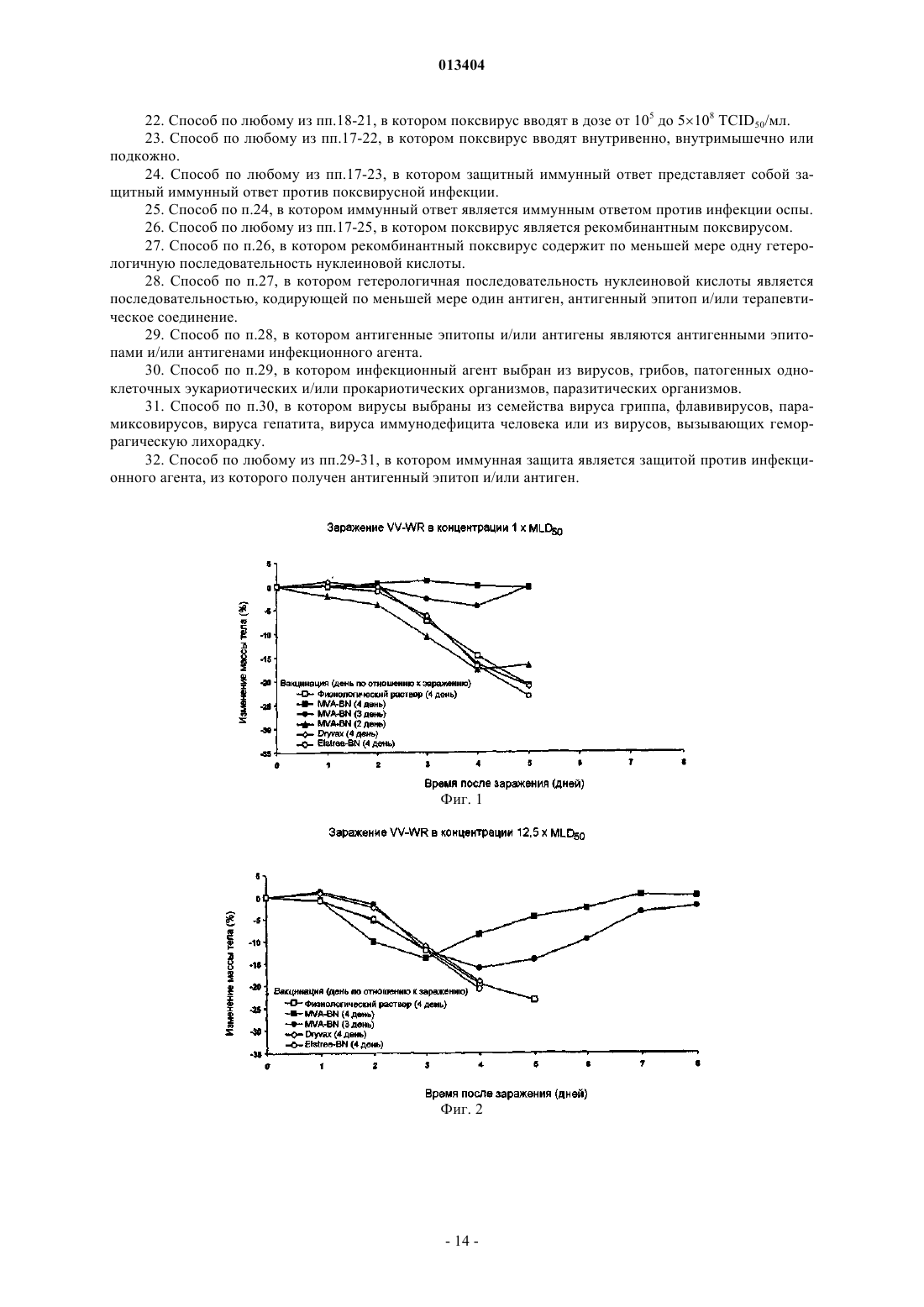
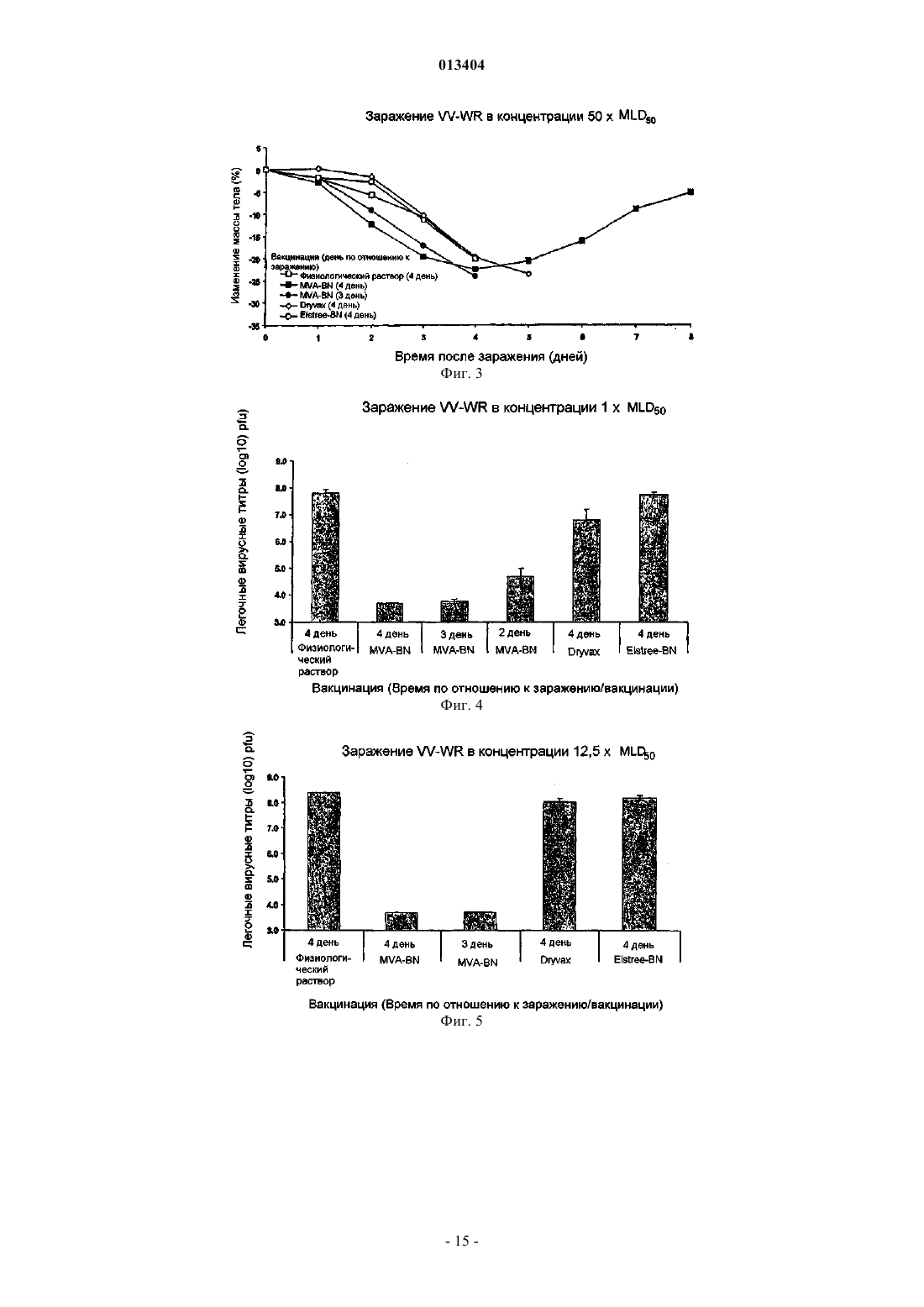
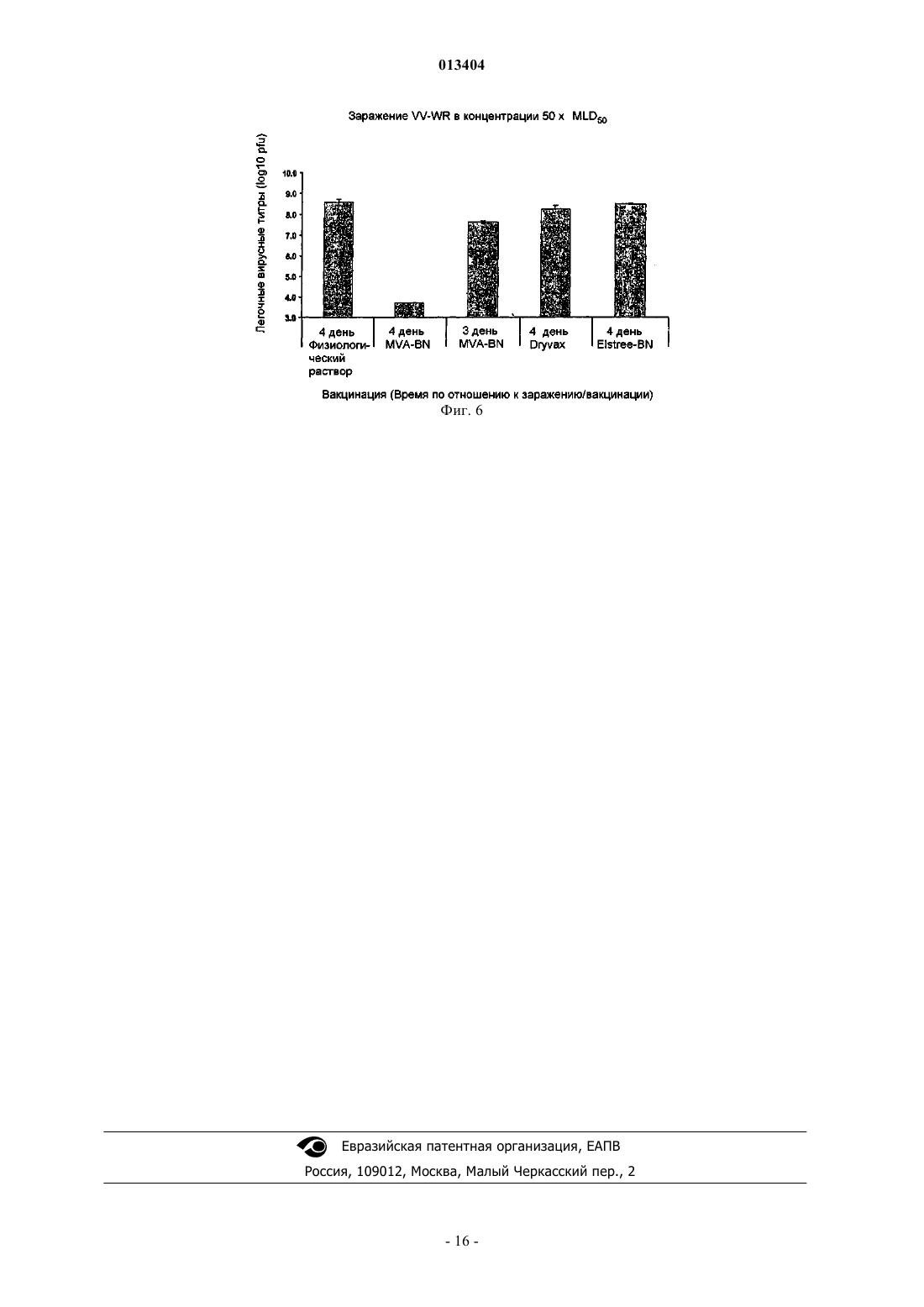
013404 Настоящее изобретение относится к быстрой индукции защитного иммунного ответа на поксвирусы и поксвирусные инфекции, такие как оспа, путем вакцинации животного, в том числе человека, поксвирусом, являющимся репликационно-некомпетентным у указанного животного, в том числе у человека. Примером такого поксвируса является модифицированный вирус осповакцины Анкара (MVA). Настоящее изобретение дополнительно относится к применению рекомбинантного поксвируса, являющегося репликационно-некомпетентным у животного, в том числе у человека, вакцинированного вирусом,таким как рекомбинантный MVA, экспрессирующий гетерологичные антигены и/или антигенные эпитопы для быстрой индукции защитных иммунных ответов против указанного гетерологичного антигена и/или антигенного эпитопа, например против антигена и/или антигенного эпитопа, представляющего собой часть инфекционного агента. Уровень техники изобретения Для многих заболеваний, таких как инфекционные болезни, уже разработаны вакцины или в настоящее время идет процесс разработки вакцин. Эти вакцины индуцируют защитный иммунный ответ в течение определенного периода времени. Так как большинство вакцин используют для вакцинации против заболеваний, редко встречающихся в популяции, необходимость в быстром создании иммунного ответа обычно отсутствует. Вместе с тем, существуют ситуации, при которых иммунный ответ, такой как защитный иммунный ответ, необходимо индуцировать как можно быстрее. Это может иметь место при вспышке оспы или любого другого человеческого поксвирусного заболевания. Возбудитель оспы представляет собой вирус натуральной оспы, член рода Orthopoxvirus. Вирус осповакцины, также являющийся членом рода Orthopoxvirus семейства Poxviridae, использовали в качестве живой вакцины для иммунизации против оспы. Всемирное использование вакцинации вирусом осповакцины достигло наивысшего успеха, который заключался в исчезновении вируса натуральной оспы (Theeradication); History of Public Health, No. 4, Geneva: World Health Organization, 1980). Тем временем было уничтожено большинство очагов инфекции вирусов натуральной оспы. Вместе с тем, нельзя исключить,что оспа или подобные оспе заболевания, вызываемые поксвирусами, вновь могут возникнуть и стать задачей для здравоохранения. Существует дополнительный риск распространения среди людей поксвирусных заболеваний животных. Кроме того, также могут встречаться другие ситуации, при которых является желательной быстрая индукция иммунного ответа, например желательной может быть быстрая индукция иммунного ответа против заболеваний, являющихся эндемическими в некоторых частях света, при необходимости незамедлительного выезда в такие страны. Подробное описание изобретения Настоящее изобретение относится к способу быстрой индукции защитного иммунного ответа у животного, в том числе у человека, включающему этап применения у животного, в том числе у человека,поксвируса, который является репликационно-некомпетентным у указанного животного, в том числе у человека. Настоящее изобретение дополнительно относится к применению указанного репликационнонекомпетентного поксвируса для изготовления вакцины, предназначенной для быстрой индукции защитного иммунного ответа, и к поксвирусу для быстрой индукции защитного иммунного ответа в качестве вакцины, в которой поксвирус представляет собой репликационно-некомпетентный для указанного животного, в том числе для человека, вирус. Термин "репликационно-некомпетентный поксвирус" и его синоним, означающий вирус, "не способный к репликации в вирус контагиозного рода", относится к поксвирусам, которые вообще не реплицируются в клетках вакцинированного животного, и к вирусам, проявляющим незначительную остаточную репликационную активность, регулируемую иммунной системой животного, в том числе человека,которому вводят поксвирус. Согласно варианту осуществления настоящего изобретения репликационно-некомпетентные поксвирусы представляют собой вирусы, способные инфицировать клетки животного, в том числе человека, у которого вирус используется в качестве вакцины. Вирусы, которые "способны инфицировать клетки", являются вирусами, способными к взаимодействию с клетками-хозяевами в такой степени, что вирус, или, по меньшей мере, вирусный геном, внедряется в клетку-хозяина. Хотя вирусы, используемые по настоящему изобретению, способны инфицировать клетки вакцинированного животного, в том числе человека, они или не способны к репликации в вирус контагиозного рода в клетках вакцинированного животного, или проявляют только незначительную остаточную репликационную активность, регулируемую иммунной системой животного, в том числе человека, которому вводят поксвирус. Необходимо понимать, что вирус, способный к инфицированию клеток одного вида животных, но не способный к репликации в вирус контагиозного рода в указанных клетках, у другого вида животных может вести себя по-другому. Например, для людей вирусы MVA-BN (вирус Ankara-Bavarian Nordic) и их производные (см. ниже) являются вирусами, способными инфицировать клетки человека, но не способны к репликации в вирус контагиозного рода в клетках человека. Те же вирусы очень эффективно реплицируются у цыплят; т.е. у цыплят вирус MVA-BN является вирусом, способным инфицировать клетки и способным к репликации в вирус контагиозного рода. Выбор вируса, необходимого для кон-1 013404 кретных видов животных, известен специалисту в данной области техники. В патенте WO 02/42480 раскрывается тест, позволяющий определять способность вируса к репликации у мышей, в котором использовали мышиную линию AGR129 (см. ниже) и любую другую линию мышей, не способных к продукции зрелых В- и Т-лимфоцитов и также являющихся строго иммунокомпромиссными и высоко восприимчивыми к реплицирующимся вирусам. Результаты, полученные на этой модели мышей, являются показательными для людей. Согласно варианту осуществления настоящего изобретения вирусы по настоящему изобретению способны к репликации, по меньшей мере, в клетках одного типа по меньшей мере у одного вида животных. Таким образом, возможна амплификация вируса перед введением животному, которое необходимо вакцинировать и/или лечить. В качестве примера имеется ссылка на MVA-BN, который может амплифицироваться в клетках CEF (фибробласты куриных эмбрионов), но является вирусом, не способным к репликации в вирус контагиозного рода у людей. Согласно варианту осуществления настоящего изобретения модифицированный вирус осповакцины Анкара (MVA) используется у людей и нескольких видов животных, таких как мыши и приматы нечеловеческого происхождения. Известно, что MVA обладает исключительной безопасностью. MVA был создан продолжительными серийными пассажами вируса осповакцины штамма Анкара (CVA) на фибробластах куриных эмбрионов (для информации см. Mayr, А., Hochstein-Mintzel, V. и Stickl, H. [1975], Infection 3, 6-14; Патент Швейцарии 568392). Примерами вирусных штаммов MVA, депонированных согласно требованиям Будапештского договора и являющихся эффективными для осуществления настоящего изобретения, являются штамм MVA 572, депонированный в Европейской коллекции клеточных культур животных (ЕСАСС), Солсбери (Великобритания) под номером депонирования ЕСАСС 94012707 от 27 января 1994 г., MVA 575, депонированный под номером ЕСАСС 00120707 от 7 декабря 2000 г., иMVA-BN, депонированный под номером ЕСАСС 00083008 от 30 августа 2000 г. Согласно варианту осуществления настоящего изобретения штамм MVA представляет собойMVA-BN и его производные. Определение MVA-BN и его производных приведено в патенте РСТ/ЕР 01/13628. Коротко, MVA-BN и его производные, согласно раскрытию в патенте РСТ/ЕР 01/13628, отличаются наличием по меньшей мере одного, по меньшей мере двух, по меньшей мере трех или всех нижеперечисленных свойств:(i) способностью к репродуктивной репликации в фибробластах куриных эмбрионов (CEF) и в клеточных линиях ВНК, но отсутствием способности к репродуктивной репликации в клеточных линиях человека. Согласно варианту осуществления настоящего изобретения клеточные линии человека представляют собой клеточную линию остеосаркомы костей человека 143 В, клеточную линию кератиноцитов человека HaCat и клеточную линию цервикальной аденокарциномы человека HeLa;(iii) индукцией более высокой иммуногенности по сравнению с известным штаммом MVA 575(ЕСАСС V00120707) на модели летального заражения и/или(iv) индукцией, по меньшей мере по существу, того же уровня иммунитета в схемах примирования вирусом осповакцины/бустер-иммунизации вирусом осповакцины при сравнении с ДНКпримированием/бустер-иммунизацией вирусом осповакцины. Ссылка на патент WO 02/42480 (РСТ/ЕР 01/13628) дает подробную информацию относительно анализов, применяемых для выявления у штамма MV7A одного или более из вышеупомянутых свойств от(i) до (iv). В этой публикации также раскрыты способы получения вирусов, имеющих желательные свойства. Ниже приведен короткий обзор возможных для проведения специалистом в данной области техники анализов наличия у штамма MV7A одного или более указанных свойств и, таким образом, определения соответствия этого вируса указанному варианту осуществления настоящего изобретения. Необходимо понимать, что нижеприведенное краткое описание не ограничивает существенность для настоящей заявки следующей информации из патента WO 02/42480. Патент WO 02/42480 вместо этого приведен в настоящем изобретении в качестве ссылки в полном объеме. Термин "не способный к репродуктивной репликации" в клеточных линиях человека, таких как клеточные линии НаСАТ (Boukamp et al. 1988, J. Cell. Biol. 106 (3): 761-71), или HeLa, используется в настоящем описании согласно определению патента WO 02/42480. Таким образом, вирус, "не способный к репродуктивной репликации" в клеточной линии, является вирусом, который в указанной клеточной линии показывает коэффициент амплификации менее 1. "Коэффициент амплификации" вируса является отношением вируса, производимого инфицированной клеткой (Выход), к количеству, исходно применяемому для первичного инфицирования клетки (Вход). Коэффициент "1" между Выходом и Входом определяет состояние амплификации, при котором количество вирусов, производимое инфицированными клетками, является тем же, что и количество, исходно применяемое для инфицирования клеток. Согласно варианту осуществления настоящего изобретения у вирусов, "не способных к репродуктивной репликации" в клеточных линиях человека, коэффициент амплификации в любой из вышеупомянутых человеческих клеточных линий HeLa, HaCat и 143 В может составлять 1,0 (среднее значение) или менее или даже 0,8 (среднее значение) или менее.-2 013404 Используемый в описании термин "среднее" относится к средним значениям, полученным по меньшей мере в 2, 3, 4, 5, 6, 7, 8, 9, 10 или более экспериментах. Специалисту в данной области техники будет понятно, что в силу свойственной биологическим системам вариабельности результаты единичных экспериментов могут отклоняться от средних значений. Термин "неспособность реплицироваться in vivo" используют в настоящем изобретении согласно определению патента WO 02/42480. Таким образом, указанный термин относится к вирусам, которые не реплицируются у модели мышей, что поясняется в патенте WO 02/42480. Используемые в патентеWO 02/42480 мыши не способны продуцировать зрелые В- и Т-лимфоциты (мыши AGR 129). MVA-BN и его производные не вызывают смерть мышей AGR129 в течение периода времени по меньшей мере 45 дней (среднее значение), такого как в течение по меньшей мере 60 дней (среднее значение) или в течение 90 дней (среднее значение) после инфицирования мышей вирусами в количестве 107 pfu (бляшкообразующих единиц), вводимых внутрибрюшинно. Согласно варианту осуществления настоящего изобретения вирусы, которые проявляют "неспособность реплицироваться in vivo", дополнительно отличаются тем, что из органов или тканей мышей AGR129 невозможно вывести какой-либо вирус через 45 дней (среднее значение), альтернативно через 60 дней (среднее значение) и альтернативно через 90 дней (среднее значение) после инфицирования мышей вирусами в количестве 107 pfu, вводимыми внутрибрюшинно. Вместо мышиной линии AGR129 можно использовать любую другую линию мышей,не способных к продукции зрелых В- и Т-лимфоцитов и также являющихся строго иммунокомпромиссными и высоко восприимчивыми к реплицирующемуся вирусу. Данные, полученные на указанной модели мышей, являются показательными для людей. Таким образом, согласно варианту осуществления настоящего изобретения вирусы, такие как MVA-BN и их производные, вообще не реплицируются у людей. Определение из раздела, относящегося к терминам "репликационно-некомпетентный поксвирус" иMVA-BN и его производных у людей, также относится к вирусам в объеме настоящего изобретения,проявляющим незначительную остаточную репликационную активность, регулируемую иммунной системой человека, которому вводят поксвирус. Подробности эксперимента летального заражения, используемого для определения наличия у штамма MVA "более высокой иммуногенности по сравнению с известным штаммом MVA 575", объяснены в патенте WO 02/42480. В такой модели летального заражения невакцинированные мыши умирают после инфицирования репликационно-компетентными штаммами вируса осповакцины, такими как штаммы Western Reserve L929 TK+ или IHD-J. В контексте описания модели летального заражения инфицирование репликационно-компетентными вирусами осповакцины относится к "заражению". Обычно через 4 дня после заражения мышей умерщвляли и стандартными анализами бляшкообразования с использованием клеток VERO определяли вирусный титр в яичниках. Вирусный титр определяли для невакцинированных мышей и для мышей, вакцинированных MVA-BN и его производными. Более конкретно, в этом тесте MVA-BN и его производные отличаются снижением вирусных титров в яичниках после вакцинации вирусами в концентрации 102 TCID50/мл по меньшей мере на 70% (среднее значение),альтернативно по меньшей мере на 80% (среднее значение), альтернативно по меньшей мере на 90%(среднее значение) по сравнению с титрами у невакцинированных мышей. Считается, что вирус осповакцины, такой как штамм MVA, при схемах примирования вирусом осповакцины/бустер-иммунизацией вирусом осповакцины, индуцирует, по меньшей мере по существу, тот же уровень иммунитета по сравнению со схемами ДНК-примирования/бустер-иммунизации вирусом осповакцины, если реакция CTL (реакция цитотоксических лимфоцитов), измеренная в одном из анализов "проба 1" и "проба 2" согласно раскрытию в патенте WO 02/42480, является, по меньшей мере по существу, аналогичной в схемах примирования вирусом осповакцины/бустер-иммунизации вирусом осповакцины при сравнении со схемами ДНК-примирования/бустер-иммунизации вирусом осповакцины. Согласно варианту осуществления настоящего изобретения реакция CTL в схемах примирования вирусом осповакцины/бустер-иммунизации вирусом осповакцины, по меньшей мере по существу, является аналогичной при сравнении со схемами ДНК-примирования/бустер-иммунизацией вирусом осповакцины при измерении в двух анализах "проба 1" и "проба 2" согласно раскрытию в патенте WO 02/42480. Согласно варианту осуществления настоящего изобретения после введения примирующего вируса осповакцины/бустер-иммунизации вирусом осповакцины реакция CTL является более высокой по меньшей мере в одной из проб по сравнению со схемами ДНК-примирования вирусом осповакцины/бустериммунизацией вирусом осповакцины. Согласно варианту осуществления настоящего изобретения реакция CTL является более высокой в обеих пробах. Согласно варианту осуществления настоящего изобретения производные MVA-BN отличаются тем,что (i) они способны к репродуктивной репликации в фибробластах куриных эмбрионов (CEF) и в клеточной линии почки детеныша хомяка ВНК, но не способны к репродуктивной репликации в клеточных линиях человека, при этом согласно варианту осуществления настоящего изобретения клеточные линии человека представляют собой клеточную линию остеосаркомы костей человека 143 В, клеточную линию кератиноцитов человека HaCat и клеточную линию цервикальной аденокарциномы человека HeLa и (ii) не способны реплицироваться in vivo у строго иммунокомпромиссных мышей.-3 013404 Согласно варианту осуществления настоящего изобретения вирус является клонированным очищенным вирусом, таким как моноклональный вирус. Согласно варианту осуществления настоящего изобретения вирус представляет собой вирус, полученный/перевиваемый в бессывороточных условиях для уменьшения риска инфекций агентами, содержащимися в сыворотке. По настоящему изобретению MVA вводят в концентрации в диапазоне от 104 до 109 TCID50/мл, например в концентрации в диапазоне от 105 до 5108 TCID50/мл или в концентрации в диапазоне, например от 106 до 108 TCID50/мл. Фактическая концентрация зависит от типа вируса и вида вакцинируемых животных. Обычная доза MVA-BN для вакцинации у людей содержит от 5107 до 5108 TCID50, например около 110s TCID50, при подкожном введении. Согласно варианту осуществления настоящего изобретения вышеуказанный поксвирус, например штамм MVA, такой как MVA-BN и его производные, для быстрой индукции защитного иммунного ответа вводят однократно. Клинические данные показали, что единственная вакцинация MVA-BN приводит к выявляемому иммунному ответу почти у 100% вакцинированных людей. Согласно другому варианту осуществления настоящего изобретения вышеуказанный поксвирус,например штамм MVA, такой как MVA-BN и его производные, также можно применять в гомологичных примирующих бустерных схемах, т.е. возможно применение поксвируса, такого как MVA, для первой вакцинации и для усиления иммунного ответа, выработанного первой вакцинацией, путем введения этого же штамма или штамма, родственного штамму поксвируса, применявшегося при первой вакцинации. Вышеуказанный поксвирус, например штамм MVA, такой как MVA-BN и его производные, также можно применять в гетерологичных примирующих бустерных схемах, при которых одну или более вакцинаций проводят вышеуказанным поксвирусом, и одну или более вакцинаций проводят другим типом вакцины, например другой вирусной вакциной, белковой или ДНК-вакциной. Способом введения может быть внутривенный, внутрикожный, интраназальный или подкожный путь введения. Можно использовать любой другой способ введения, такой как скарификация. Поксвирус, применяемый по настоящему изобретению, может представлять собой нерекомбинантный поксвирус, такой как штамм MVA, например MVA-BN и его производные. В этом случае можно проводить вакцинацию для быстрой индукции защитного иммунного ответа против поксвирусной инфекции, такой как оспа. Таким образом, по настоящему изобретению вышеуказанный поксвирус, такой как штамм MVA, например MVA-BN и его производные, подходит для быстрой индукции защитного иммунного ответа против оспы. Это показано в примере 1, где приводится сравнение продолжительности выработки защитного иммунного ответа против патогенного вирусного штамма осповакцины у мышей после вакцинации MVA-BN (штаммом по настоящему изобретению) и не-MVA штаммами, такими какDryVax и Elstree. Эти штаммы в отличие от штамма MVA-BN являются полностью репликационнокомпетентными. То, что единственная вакцинация MVA-BN у мышей приводит к значительному защитному иммунному ответу за период 4, 3 и даже 2 дня, показывает, что по сравнению с Elstee и DyvaxMVA-BN имеет явно улучшенные свойства. Например, это показано в анализе легочного титра патогенного вируса осповакцины, штамма Western Reserve (VV-WR), вводимого через 2, 3 или 4 дня после вакцинации MVA-BN. При заражении вакцинированных стандартной дозой MVA-BN мышей VV-WR в количестве 12,5MLD50 (средняя 50% летальная доза) через 3 дня после вакцинации у мышей не было выявлено какого-либо вирусного титра VV-WR, тогда как мыши, вакцинированные DryVax или Elstree, не имели защиты и их легочный титр был очень сходен с титром невакцинированных мышей из группы контроля. Когда через 4 дня после вакцинации мышей заражали 50MLD50, какой-либо вирусный титрVV-WR не мог быть выявлен у мышей, вакцинированных стандартной дозой MVA-BN, тогда как мыши,вакцинированные DryVax или Elstree, не имели защиты и имели легочный титр, очень сходный с титром невакцинированных контрольных мышей. Термин MLD50 относится к концентрации патогенного штамма вируса осповакцины, при которой 50% вакцинированных мышей умирают. Нужно отметить, что данные мышей являются показательными для людей. Кроме того, необходимо принимать во внимание, что концентрации патогенного вируса, которые в 50 раз превышают летальную дозу, обычно не встречаются в природе, в особенности они не встречаются для человеческих поксвирусов, вызывающих оспу. Согласно варианту осуществления настоящего изобретения термин "быстрая индукция защитного иммунного ответа у животного, в том числе у человека" предпочтительно относится к созданию защитного иммунного ответа в течение 7 дней или менее, 6 дней или менее, 5 дней или менее, 4 дней или менее, 3 дней или менее или даже 2 дней или менее после вакцинации вирусом по настоящему изобретению. Это является неожиданностью, так как в данной области техники существует догма, что требуется по меньшей мере от 10 до 14 дней для создания защитного иммунного ответа против общепринятых противооспенных вакцин, основанных на реплицирующихся штаммах вирусов осповакцины. Скорость индукции защитного иммунного ответа можно оценить на модели животных, описанной в разделе "Примеры". Указанная модель также показательна для людей. Таким образом, согласно варианту осуществления настоящего изобретения поксвирусная вакцина является эффективной для индукции быстрого иммунно-4 013404 го ответа у мышей, если после вакцинации мышей эффективной дозой поксвирусной вакцины, такой какMVA, например MVA-BN и ее производными, и заражения VV-WR в концентрации соответственно 1,12,5 и 50 MLD50 через 4 дня после вакцинации легочные вирусные титры в среднем составляют ниже 5103 pfu (что соответствует log 3,69), согласно определению тестовой системы, описанной в разделе"Примеры". Альтернативно, через 3 дня после вакцинации эффективной дозой поксвирусной вакцины значения в среднем являются ниже 5103 pfu (что соответствует log 3,69) после заражения VV-WR в концентрации соответственно 1 и 12,5 MLD50. В более широком смысле вирус приводит к быстрой индукции защитного иммунного ответа у мышей, если указанный вирус в анализе легочного титра и в пробе массы тела, описанной в примере, ведет себя подобно MVA-BN. Таким образом, пределы, пороговые значения, условия и параметры, описанные в разделе "Примеры", также в широком смысле применимы для других поксвирусных вакцин, которые считаются вакцинами, быстро индуцирующими защитный иммунный ответ. Очевидно, что данные и информацию, приведенную в разделе "Примеры", в общем можно использовать для подтверждения любых недостающих данных и информации в этом разделе, например для информации, относящейся к описанию тестовой системы. Альтернативно, скорость индукции защитного иммунного ответа можно оценивать тестом сероконверсии, объяснение которого приведено ниже; в этом контексте точка времени, в которой наблюдается сероконверсия, считается точкой времени, в которой индуцирован защитный иммунный ответ. Согласно варианту осуществления настоящего изобретения животное, в том числе человек, является животным, в том числе человеком, которое является нативным в отношении поксвирусных инфекций,т.е. животным, в том числе человеком, которое никогда не имело контакта с поксвирусами и не было вакцинировано поксвирусными вакцинами. Согласно родственному варианту осуществления животное, в том числе человек, является животным, в том числе человеком, которое было в контакте с поксвирусами и/или было вакцинировано поксвирусной вакциной. У этих животных, в том числе у человека, возможно, имеется повышенный иммунный ответ против поксвирусов и/или поксвирусных вакцин, таких как MVA. Термин "защитный иммунный ответ" означает, что вакцинированное животное способно контролировать инфицирование патогенным агентом, против которого провели вакцинацию. Обычно у животного с развившимся "защитным иммунным ответом" наблюдаются только от слабых до умеренно выраженных клинических симптомов или вообще отсутствуют симптомы. Обычно у животного, имеющего "защитный иммунный ответ" против конкретного агента, не наблюдается смертельных исходов в результате инфицирования указанным агентом. Как указано выше, концентрации MVA-BN или его производного для создания защитного иммунного ответа у людей против оспы находится в диапазоне от 5107 до 5108 TCID50, такая концентрация,как 1108 TCID50, при которой вирус можно водить подкожно или внутримышечно. Кажется, что вышеуказанный механизм развития быстрой иммунной защиты после вакцинации поксвирусом, таким как штамм MVA, например MVA-BN и его производные, зависит от того, является ли вакцинированное животное, в том числе человек, нативным животным (ранее никогда не имевшим контакт с поксвирусом) или животным, которое ранее было в контакте с поксвирусом (например, посредством вакцинации). У нативного животного, в том числе у человека, введение поксвируса по настоящему изобретению, такого как MVA-BN, или его производных эффективно примирует иммунную систему,даже если в первые несколько дней после вакцинации нейтрализирующие антитела могут быть не выявлены. Инфицирование патогенным вирусом усиливает иммунную систему таким образом, что эффективно примированная иммунная система может неожиданно эффективно и быстро контролировать указанную инфекцию. Таким образом, у нативных животных, вакцинированных вирусом по настоящему изобретению, легко создается защита против инфицирования патогенным вирусом, против которого провели вакцинирование всего лишь после единственной вакцинации. Указанные вирусы по настоящему изобретению, такие как MVA-BN, и их производные также неожиданно эффективно и быстро действуют при бустер-иммунизации у ранее вакцинированных животных, имевших до этого контакт с поксвирусом, таким образом, что также быстро возникает защитный иммунный ответ. Скорость индукции защитного иммунного ответа также отражается в неожиданно быстрой сероконверсии после вакцинации животных, в том числе людей, вирусом по настоящему изобретению, таким как MVA, например MVA-BN и его производными. Показано, что у приматов нечеловеческого происхождения сероконверсия происходит в течение менее 10 дней, например в течение 7 дней, что составляет на одну неделю быстрее, чем сроки сероконверсии после вакцинации другими противооспенными вакцинами, такими как Elstree. Ниже описана методика оценки сероконверсии после вакцинации MVA-BN и его производными. Тот же тестовый принцип применяют mutatis mutantdis при анализе сероконверсии после вакцинации другими вирусами. Единственной модификацией, необходимой для оценки индуцированной указанным другим вирусом сероконверсии, вместо количественного определения общихMVA-BN специфических антител IgG, является количественное определение общих антител IgG, специ-5 013404 фических для указанного другого вируса. Величины cut off и критерии оценки образца на положительный результат в основном определяют аналогичным способом с необязательными незначительными модификациями, входящими в диапазон навыков специалиста в данной области техники. Для оценки сероконверсии после вакцинации MVA-BN (или его производными) проводят количественное определение общих MVA-BN специфических антител IgG в тестовой сыворотке с использованием прямого твердофазного иммуноферментного анализа ELISA. ELISA является чувствительным способом, применяемым для выявления антител в сыворотке. MVA-BN - специфический ELISA представляет собой стандартный анализ связывания ELISA, применяемый для выявления общих антител IgG в человеческой тестовой сыворотке. Результаты ELISA выражены в виде конечного титра антител, полученного прямым определением логарифмических линий тренда. Определяли величину cut off или конечный результат оптической плотности, составляющий 0,35. Конечный результат титра образца определяли построением графика в логарифмическом масштабе, например используя коммерчески доступную компьютерную программу Excel (с оптической плотностью (OD) на оси Y и логарифмом разведения сыворотки на оси X). И в этом случае данные приматов нечеловеческого происхождения показательны для людей. Тестовый образец считают положительным, когда OD образца составляет больше чем 0,35 в разведении тестового образца 1:50. Среднее геометрическое значение титра (GMT) вычисляют путем взятия антилогарифма от среднего значения трансформаций титра log10. Обычно GMT является титром, опубликованным для титров ELISA. Уровень сероконверсии определяют как процент от изначально серонегативных объектов,провляющих в MVA-специфическом анализе IgG ELISA титры антител 1:50. Таким образом, согласно варианту осуществления настоящего изобретения термин "быстрая индукция защитного иммунного ответа у животного, в том числе человека" относится к вышеуказанной сероконверсии после вакцинации вирусом по настоящему изобретению в течение 10 дней или менее, 7 дней или менее, 6 дней или менее,5 дней или менее, 4 дней или менее, 3 дней или менее или даже в течение 2 дней или менее с вышеуказанным тестом. Вышеуказанный поксвирус, такой как штамм MVA, например MVA-BN и его производные, может также являться штаммом рекомбинантного поксвируса, таким как рекомбинантный MVA-BN или его производные. Рекомбинантные вирусы по настоящему изобретению, такие как рекомбинантныйMVA-BN и его производные, могут содержать по меньшей мере одну гетерологичную последовательность нуклеиновой кислоты. Термин "гетерологичный" далее в настоящем изобретении использован для любой комбинации последовательностей нуклеиновой кислоты, для которой обычно в природе не найдено тесной связи с вирусом. Гетерологичные последовательности могут быть антигенными эпитопами или антигенами, которые выбирают из любого, не являющегося вирусом осповакцины источника. Согласно варианту осуществления настоящего изобретения указанный рекомбинантный вирус экспрессирует один или более антигенных эпитопов или антигенов, являющихся антигенными эпитопами или антигенами инфекционного агента. Инфекционный агент может представлять собой любой инфекционный агент, такой как вирус,гриб, патогенный одноклеточный эукариотический и/или прокариотический организм или паразитический организм. Примерами инфекционных агентов являются Plasmodium falciparum, микобактерии, вирус гриппа, флавивирусы, парамиксовирусы, вирусы гепатита, вирусы иммунодефицита человека, вирусы, вызывающие геморрагическую лихорадку, такие как хантавирусы или филовирусы, а именно вирус Эбола или вирус Марбург. Согласно этому варианту осуществления вышеуказанный рекомбинантный поксвирус можно применять не только для индукции быстрого иммунного ответа против поксвирусной инфекции, но также(или альтернативно) для индукции быстрого иммунного ответа против гетерологичного антигенного эпитопа/антигена, экспрессируемого гетерологичной нуклеиновой кислотой, содержащейся в рекомбинантном вирусе. Таким образом, для примера, если рекомбинантный MVA экспрессирует эпитоп ВИЧ или эпитоп вируса желтой лихорадки, рекомбинантный MVA можно применять для индукции быстрого иммунного ответа соответственно против ВИЧ и вируса желтой лихорадки. Способность рекомбинантного вируса альтернативно экспрессировать антигенный эпитоп/антиген,дополнительно повышающий иммуногенность MVA, также находится в объеме настоящего изобретения. Рекомбинантный вирус, используемый по настоящему изобретению, может также содержать гетерологичный ген/нуклеиновую кислоту, экспрессирующую терапевтическое соединение. "Терапевтическое соединение", кодируемое гетерологичной нуклеиновой кислотой в вирусе, например, может являться терапевтической нуклеиновой кислотой, такой как антисмысловая нуклеиновая кислота, или пептидом, или белком с желательной биологической активностью. Согласно варианту осуществления настоящего изобретения экспрессия гетерологичной последовательности нуклеиновой кислоты может находиться под транскрипционным контролем промотора поксвируса. Примером подходящего промотора поксвируса является промотор коровьей оспы ATI (см. патент WO 03/097844).-6 013404 Согласно варианту осуществления настоящего изобретения гетерологичная последовательность нуклеиновой кислоты вставляется в несущественную область вирусного генома. Согласно другому варианту осуществления настоящего изобретения гетерологичная последовательность нуклеиновой кислоты вставляется во встречающийся в природе сайт делеции генома MVA (что раскрыто в патенте РСТ/ЕР 96/02926). Согласно дополнительному альтернативному варианту гетерологичная последовательность может быть вставлена в межгенную область поксвирусного генома (см. патент WO 03/097845). Специалисту в данной области техники известны способы вставок гетерологичных последовательностей в поксвирусный геном. Все вышеприведенные определения для варианта осуществления, относящегося к применению нерекомбинантных вирусов, также применимы для варианта осуществления, относящегося к рекомбинантным вирусам. Сущность изобретения Использование поксвируса для изготовления вакцины для быстрой индукции защитного иммунного ответа у животного, в том числе у человека, при котором поксвирус у указанного животного, в том числе у человека, является репликационно-некомпетентным. Способ быстрой индукции защитного иммунного ответа у животного, в том числе у человека,включающий этап введения животному, в том числе человеку, поксвируса, который является репликационно-некомпетентным у указанного животного, в том числе у человека. Вышеуказанное применение или способ, при котором защитный иммунный ответ создается в течение 7 дней или менее. Вышеуказанное применение или способ, при котором поксвирус представляет собой модифицированный вирус осповакцины Анкара (MVA). Вышеуказанное применение или способ, при котором MVA выбирают из MVA-штаммов MVA 575,MVA 572 и MVA-BN. Вышеуказанное применение или способ, при котором вирус является клонированным очищенным вирусом. Вышеуказанное применение или способ, при котором вирус получали путем бессывороточного культивирования. Вышеуказанное применение или способ, при котором поксвирус вводили в дозе от 105 до 8 510 TCID50/мл. Вышеуказанное применение или способ, при котором поксвирус вводили внутривенно, внутримышечно или подкожно. Вышеуказанное применение или способ, при котором защитный иммунный ответ представляет собой защитный иммунный ответ против поксвирусной инфекции. Вышеуказанное применение или способ, при котором создают иммунный ответ против инфекции оспы. Вышеуказанное применение или способ, при котором поксвирус является рекомбинантным поксвирусом. Вышеуказанное применение или способ, при котором рекомбинантный поксвирус содержит по меньшей мере одну гетерологичную последовательность нуклеиновой кислоты. Вышеуказанное применение или способ, при котором гетерологичная последовательность нуклеиновой кислоты является последовательностью, кодирующей по меньшей мере один антиген, антигенный эпитоп и/или терапевтическое соединение. Вышеуказанное применение или способ, при котором антигенные эпитопы и/или антигены являются антигенными эпитопами и/или антигенами инфекционного агента. Вышеуказанное применение или способ, при котором антигенный агент выбирают из вирусов, грибов, патогенных одноклеточных эукариотических и/или прокариотических организмов, паразитических организмов. Вышеуказанное применение или способ, при котором вирусы выбирают из семейства вируса гриппа, флавивирусов, парамиксовирусов, вируса гепатита, вируса иммунодефицита человека или из вирусов,вызывающих геморрагическую лихорадку. Вышеуказанное применение или способ, при котором создают иммунную защиту против инфекционного агента, из которого получен антигенный эпитоп и/или антиген.-7 013404 Краткое описание чертежей Фиг. 1. Изменения массы тела вакцинированных различными способами мышей после интраназального заражения 1 MLD50 VV-WR. Мышей Balb/c подкожно вакцинировали MVA-BN, Elstree, DryVax, или фосфатно-буферным раствором (ФБР) за 4 дня, или MVA-BN за 3 дня или за 2 дня до заражения 4104 TCID50 VV-WR на мышь. Массу тела измеряли до заражения (0 день) и затем ежедневно после заражения в одно и то же время. График представляет средние изменения массы тела на группу с течением времени, с использованием нормированных отдельных значений (0 день в качестве исходного значения). Фиг. 2. Изменения массы тела вакцинированных различными способами мышей после интраназального заражения 12,5 MLD50 VV-WR. Мышей Balb/c подкожно вакцинировали MVA-BN, Elstree, DryVax, или физиологическим раствором (ФБР) за 4 дня, или MVA-BN за 3 дня до заражения 5105 TCID50 VV-WR на мышь. Массу тела измеряли до заражения (0 день) и затем ежедневно после заражения в одно и то же время. График представляет средние изменения массы тела на группу с течением времени, с использованием нормированных отдельных значений (0 день в качестве исходного значения). Фиг. 3. Изменения массы тела вакцинированных различными способами мышей после интраназального заражения 50 MLD50 VV-WR. Мышей Balb/c подкожно вакцинировали MVA-BN, Elstree, DryVax, или физиологическим раствором (ФБР) за 4 дня, или MVA-BN за 3 дня до заражения 2106 TCID50 VV-WR на мышь. Массу тела измеряли до заражения (0 день) и затем ежедневно после заражения в одно и то же время. График представляет средние изменения массы тела на группу с течением времени, с использованием нормированных отдельных значений (0 день в качестве исходного значения). Фиг. 4-6. Вирусная нагрузка в легких на момент смерти или умерщвления после интраназального заражения 1 MLD50 VV-WR (фиг. 4), с 12, 5 MLD50 VV-WR (фиг. 5) или 50 MLD50 VV-WR (фиг. 6). У каждого животного забирали легкие и определяли вирусную нагрузку, используя стандартный анализ бляшкообразования на клетках Vero. Столбики отражают средний легочный титр на группустандартная ошибка. Примеры Следующие примеры дополнительно иллюстрируют настоящее изобретение. Специалист в данной области техники будет хорошо понимать, что представленные примеры нельзя интерпретировать таким образом, чтобы ограничить этими примерами применимость технологии, обеспечиваемой настоящим изобретением. Пример 1. Возникновение защиты у мышей, вакцинированных MVA-BN, Elstree или DryVax, зараженных вирусом осповакцины VV-Western Reserve (VV-WR) в концентрации 1, 12,5 или 50 MLD50. 1. Введение. Мышиная модель интраназального заражения вирусом осповакцины была разработана для проверки эффективности возможных противооспенных вакцин. В этой модели осуществляли вакцинирование мышей вакцинами, эффективность которых было необходимо определить. У контрольных мышей вместо вакцины использовали контрольный физиологический раствор. Через несколько дней после вакцинации мышей заражали патогенным штаммом вируса осповакцины, таким как штамм вируса осповакциныWestern Reserve (VV-WR). На невакцинированных мышах определяли мышиную 50% летальную дозу(MLD50) вируса осповакцины штамма Western Reserve (VV-WR), составляющую 3,6104 TCID50. В предварительном исследовании было показано, что мыши Balb/c, вакцинированные MVA-BN,при заражении VV-WR в концентрациях как 25, так и 50 MLD50, быстро выздоравливали от вирусного заражения, не проявляли явных признаков клинических симптомов и в легких этих животных не имелось каких-либо патологических поражений. В другом предварительном исследовании изучали время после вакцинации, необходимое для установления защиты от летального заражения VV-WR: При заражении вакцинированных MVA-BN мышей сублетальной дозой VV-WR (5103 TCID50/на мышь) через 3 дня после вакцинации была выявлена защита (по отношению к потере массы тела и легочным вирусным титрам). Задача этого примера состояла в сужении периода времени после вакцинации MVA-BN (илиElstree или DryVax), необходимого для создания защиты, после летального заражения VV-WR. 2. Вирусы и контрольные группы. Тестовая вакцина 1. Модифицированный вирус осповакцины Ankara-Bavarian Nordic (MVA-BN) в концентрации 5,0 Е+08 TCID50/мл. Рецептура: 140 ммоль NaCl с уровнем рН 7,4 в 10 ммоль Трис. В группах, вакцинированных MVA-BN, не проводили каких-либо дополнительных разведений исходной культуры MVA-BN и вводили 200 мкл подкожно, в результате получая конечную дозу 1,0 Е+08 TCID50/мл.-8 013404 Тестовая вакцина 2. Вирус осповакцины штамм Elstree с номинальной концентрацией 1,0 Е+08 TCID50/мл. Рецептура: 140 ммоль NaCl с уровнем рН 7,4 в 10 ммоль Трис. Не проводили каких-либо дополнительных разведений исходной культуры Elstree и 2,5 мкл вводили путем скарификации хвоста каждой мыши, в результате получая конечную дозу 2,5 Е+05 TCID50/мл. Тестовая вакцина 3.NaCl с уровнем рН 7,4 в 10 ммоль Трис. Не проводили каких-либо дополнительных разведений исходной культуры DryVax и 8 мкл вводили путем скарификации хвоста каждой мыши, в результате получая конечную дозу 2,5 Е+05 TCID50/мл. Каждую из тестовых вакцин 1-3 вводили в ее оптимальной дозе и оптимальным путем введения. Вирус заражения. Вирус осповакцины Western Reserve (VV-WR) с номинальной концентрацией 4,0 Е+08 TCID50/мл. Были сделаны следующие разведения VV-WR (4,0 Е+08 TCID50/мл) для создания конечной рабочей исходной культуры 8,0 Е+04 TCID50/мл и 4,0 Е+07 TCID50/мл. Для заражения 1 MLD50 VV-WR/на мышь (суспензия 8,0 Е+05 TCID50/мл рабочей исходной культуры): 100 мкл исходной культуры VV-WR 4,0 Е+08 TCID50/мл добавляли к 900 мкл ФБР, смешивали вихревым способом (для получения концентрации 4,0 Е+07 TCID50/мл), 100 мкл этой суспензии переносили в 900 мкл ФБР, снова смешивали вихревым способом (для получения концентрации 4,0 Е+06 TCID50/мл), 600 мкл этой суспензии добавляли к 2400 мкл ФБР, смешивали вихревым способом для получения конечной концентрации 8,0 Е+05 TCID50/мл. Для заражения 50 MLD50 VV-WR/на мышь (суспензия 4,0 Е+07 TCID50/мл рабочей исходной культуры): 300 мкл исходной культуры VV-WR 4,0 Е+08 TCID50/мл добавляли к 2700 мкл ФБР и смешивали вихревым способом для получения конечной концентрации 4,0 Е+07 TCID50/мл. Контрольный физиологический раствор. В группах контрольного физиологического раствора использовали 200 мкл ФБР (согласно поставке изготовителя) для подкожной инъекции у отдельных мышей. 3. Способы и схема эксперимента. Тестовая система. Беспатогенные (SPF) самки мышей Balb/c H-2d были получены от фирмы Taconic MB, P.O. Box 1079, DK-8680 Ry, Дания. Количество животных в исследовании составляло 60. Возраст на начало заражения: 9 недель. Масса тела на начало заражения: от 18 до 23 г. Линию мышей Balb/c широко использовали для тестирования иммуногенности и эффективности противооспенных вакцин. Линия является высоко восприимчивой к заражению VV-WR. Эксперименты выполняли в соответствии с Dyreforsgstilsynet (Дания). Распределение по группам испытаний. При получении животных они были рандомизированно распределены на испытательные группы,состоящие из 5 животных на испытательную группу (и клетку). Обоснование уровня дозы.MVA-BN использовали в оптимальной дозе, показавшей в предыдущих экспериментах, что она вызывает сильные гуморальные и клеточно-опосредованные иммунные ответы у мышей. Elstree и DryVax использовали в дозе, предлагаемой для людей. Схема вакцинации и заражения. В общей сложности в этом исследовании использовали 80 мышей (см. таблицу ниже). Через 4 дня после вакцинации мышей заражали MVA-BN или VV-WR в концентрации 1, 12,5, или 50 MLD50,или Elstree, или DryVax. В дополнительных группах мышей заражали через 3 дня после вакцинацииMVA-BN VV-WR в концентрации 1, 12,5, или 50 MLD50 или через 2 дня после вакцинации мышей заражали MVA-BN VV-WR в концентрации 1 MLD50. В контрольных группах мышей заражалиVV-WR в концентрации 1, 12,5 или 50 MLD50 без предварительной вакцинации. Контрольных животных, получавших VV-WR в концентрации 1 и 12,5 или 50 MLD50, умерщвляли соответственно через 5 дней или через 4 дня после заражения в случае, если потеря массы тела превышала 20% от исходной массы тела, или в случае, если у животных наблюдали диспноэ. Это проводили для уменьшения страданий. Обоснование размера группы. На 4- или 5-й день после интраназального заражения VV-WR по уровню защиты эффективно определяли первичные результаты исследования. На основании предшествующих доклинических экспериментов предположили, что по меньшей мере у 95% из вакцинированной группы имеется защита от последующего заражения, тогда как из группы, получавшей плацебо, имели защиту не более 5%. Используя точный критерий Фишера, размер группы, равный 5, в сопоставлении с 5 является достаточным для демонстрации значительных различий в двустороннем уровне достоверности =0,05 с порядком больше 80%. Введение испытательных образцов для вакцинации. Вакцинацию проводили в микробиологическом ламинарном шкафу (SW 1000 40/class II, HoltenLamin Air). Мышей вакцинировали 200 мкл MVA-BN (1108 TCID50/мл) или контрольным физиологическим раствором (200 мкл ФБР) посредством подкожного введения в кожную складку задней конечности, используя 1 мл туберкулиновый инсулиновый шприц 29 г (Terumo). Мышам, которым вводилиElstree и DryVax, перед скарификацией хвоста проводили анестезию: приготовляли свежую смесь, содержащую 75 мг кетамина, 5 мг ксилазина и воду, и подкожно вводили 80 мкл анестетика, используя 1 мл инсулиновый шприц 27G. Перед введением вакцины анестезировали всех мышей, находящихся в одной клетке. Посредством скарификации хвоста вводили 2,5 мкл или 8 мкл Elstree или DryVax. Модель легочного заражения. Анестизированным мышам интраназальным путем вводили испытательный образец (т.е. VV-WR) в микробиологическом ламинарном шкафу (SW 1000 40/class II, Holten Lamin Air). В качестве анестетика приготовляли свежую смесь 75 мг кетамина и 5 мг ксилазина в воде. Подкожно вводили 80 мкл анестетика, используя 1 мл инсулиновый шприц 29G. Перед введением испытательного образца VV-WR анестезировали всех мышей, находящихся в одной клетке. Интраназальное заражение выполняли в микробиологическом ламинарном шкафу (SW 1000 40/classII, Holten Lamin Air). Заражающий вирус в рабочем разведении снимали со льда и аккуратно смешивали вихревым способом в течение нескольких секунд. Отмеряли 50 мкл разведенного испытательного образца VV-WR, использую пипетку 100 мкл. Анестезированную мышь удерживали за кожу/шкурку задней части шеи и тело удерживали в ладони той же руки. Испытательный образец медленно вводили в одну ноздрю мыши. Мышь удерживали, как описано выше, до прекращения одышки.- 10013404 Перед заражением (0 день) и ежедневно после заражения животные находились под наблюдением для контроля любых симптомов плохого состояния здоровья. Для контроля развития заболевания измеряли массу тела до заражения (0 день) и после заражения, ежедневно, до дня вскрытия. В группе физиологического раствора, получавшей VV-WR в концентрации 50 MLD50, выявлено превышение массы тела, по установке cut off Dyreforsgstilsyn, и эту группу умерщвляли через 4 дня после заражения. В группе физиологического раствора, получавшей VV-WR в концентрации 1 или 12,5 MLD50, выявлено превышение массы тела, по установке cut off Dyreforsgstilsyn, и эту группу умерщвляли через 5 дней после заражения. Вакцинированных животных заражали VV-WR в концентрации 1 MLD50, и их умерщвляли через 5 дней после заражения, при этом вакцинированных MVA-BN животных, зараженных VV-WR в концентрации 12,5 или 50 MLD50, умерщвляли через 8 дней после заражения в последнюю очередь. Удаляли легкие и определяли общее количество вирусов в легких, используя стандартный анализ бляшкообразования на клетках Vero. Животных считали полностью защищенными, когда легочные титры были ниже 5103 pfu, что является самым низким титром, возможным для выявления с использованием данного способа вирусного титрования на клетках Vero. 4. Результаты и обсуждение. Изменения массы тела. В ряде групп настоящего исследования изучали влияние вакцинации различными противооспенными вакцинами на массу тела через 4 дня после заражения вирусом осповакцины штамма Western Reserve(VV-WR) 1 MLD50. Как показано в фиг. 1, потеря массы тела в невакцинированной группе (контрольная группа физиологического раствора) у мышей, зараженных VV-WR в концентрации 1 MLD50, впервые становилась выявляемой через 3 дня после заражения. Масса тела продолжала снижаться до умерщвления на 5-й день в среднем на 20,9% ниже средней исходной массы тела. Подобная потеря массы тела была выявлена в группах, вакцинированных Elstree или DryVax за 4 дня до заражения VV-WR: средняя масса тела в день умерщвления составляла соответственно или на 23,2%, или на 21,1% ниже начальной средней массы тела в этих группах. В группе, вакцинированной MVA-BN за 2 дня до зараженияVV-WR, первая потеря массы тела (около 4% от средней исходной массы тела) была выявлена через 2 дня после заражения. В этой группе средняя масса тела продолжала снижаться до 4 дня после заражения и была ниже на 17,6% от исходной средней массы тела. На 5-й день после заражения не наблюдали снижения средней массы тела и она была на 16,7% ниже исходной средней массы тела. В группе, вакцинированной MVA-BN за 3 дня до заражения, было выявлено только незначительное снижение массы тела, которое появлялось на 3-й день после заражения и на 4-й день после заражения было максимально ниже на 4,2% от исходной массы тела. В этой группе масса тела восстанавливалась на 5-й день до исходных значений. В группе мышей, вакцинированных MVA-BN, за 4 дня до заражения, не проявлялось потери массы тела после заражения VV-WR в концентрации 1 MLD50. Во втором наборе групп мышей заражали VV-WR в концентрации 12,5 MLD50 и снова наблюдали за массой тела мышей до заражения, и затем ежедневно после заражения. Как показано в фиг. 2, потеря массы тела в невакцинированной группе мышей (контроль с физиологическим раствором) впервые становился выявляемым через 2 дня после заражения. Масса тела продолжала снижаться до умерщвления на 5-й день в среднем на 23,3% ниже средней исходной массы тела. Таким образом, потеря массы тела была выявляемой на 1 день раньше, чем в невакцинированой группе, зараженной VV-WR в концентрации 1 MLD50, и была более заметной в день умерщвления (см. фиг. 1). Сходную с невакцинированными мышами потерю массы тела выявляли в группах, вакцинированных Elstree или DryVax за 4 дня до заражения VV-WR. В группе, вакцинированой с MVA-BN за 3 дня до заражения VV-WR, первая незначительная потеря массы тела (около 1,7% от средней исходной массы тела) была выявлена через 2 дня после заражения. В этой группе средняя масса тела продолжала снижаться до 4 дня после заражения при средней массе тела на 16,1% ниже исходной. Затем в этой группе средняя масса тела начинала восстанавливаться и на 8-й день после заражения выявляли снижение средней массы тела 2,3% ниже средней исходной массы тела. В группе мышей, вакцинированных MVA-BN за 4 дня до заражения, выявляли среднюю потерю массы тела, составлявшую 10,8% по сравнению со средней исходной массой тела. Максимальная средняя потеря массы тела в 13,8% была выявлена на 3-й день после заражения. Восстановление массы тела выявлено в последующие дни со сходной средней массой тела, обнаруженной через 8 дней после заражения, по сравнению с массой до заражения. В третьем наборе групп мышей заражали VV-WR в концентрации 50 MLD50 и массу тела мышей вновь отслеживали до заражения и затем ежедневно после заражения. Как показано на фиг. 3, уже первая потеря массы тела в невакцинированной группе мышей (контроль с физиологическим раствором) становилась выявляемой через 1 день после заражения. Средняя масса тела продолжала снижаться до умерщвления на 4-й день на 20,1% ниже средней исходной массы тела. Таким образом, потеря массы тела становилась выявляемой на 2 дня или на 1 день раньше, чем в невакцинированной группе, зараженной соот- 11013404 ветственно VV-WR 1 или 12,5 MLD50. Потеря массы тела в группах, вакцинированных Elstree илиDryVax, становилась выявляемой через 2 дня после заражения, и через 4 дня после заражения мышей в этих группах выявляли потери средней массы тела соответственно на 20,1% или на 19,7% от исходной массы тела. В группе, вакцинированой MVA-BN за 3 дня до заражения VV-WR, первая потеря массы тела (около 1,6% от средней исходной массы тела) была обнаружена на 1-й день после заражения. В этой группе средняя масса тела продолжала снижаться до умерщвления на 4-й день после заражения при средней массе тела на 24,0% ниже исходной. В группе мышей, вакцинированных MVA-BN за 4 дня до заражения, первую потерю массы тела было возможно выявить в 1-й день после заражения, средняя масса тела продолжала снижаться на 22,5% ниже средней исходной массы тела на 4-й день после заражения. Восстановление массы тела выявляли в последующие дни и на 8-й день после заражения выявляли среднюю массу тела, составлявшую на 5,1% ниже средней исходной массы. Легочные титры. После смерти или умерщвления у мышей удаляли легкие и определяли общее количество вирусов в этой ткани, используя стандартный анализ бляшкообразования на клетках Vero. Животных считали полностью защищенными, когда легочные титры были ниже log10 3,69 (5103 pfu), что является самым низким титром, выявляемым с использованием данного способа вирусного титрования на клетках Vero. Сравнивали группы мышей из первого набора, зараженных VV-WR в концентрации 1 MLD50. Как показано на фиг. 4, невакцинированные мыши показывали среднюю вирусную нагрузку log10 7,81. Мыши,вакцинированные Elstree или DryVax за 4 дня до заражения, показывали среднюю вирусную нагрузку в легких log10 7,75 и log10 6,68. Таким образом, мыши, вакцинированные Elstree, были неспособны предотвратить легочную вирусную инфекцию, и мыши, вакцинированные DryVax, были только до некоторой степени в состоянии предотвратить легочную вирусную инфекцию. В группе мышей, вакцинированных MVA-BN за 4 дня до заражения легкого, не выявлено вирусных титров и, таким образом, эти мыши полностью защищены от вирусной инфекции после интраназального заражения VV-WR в концентрации 1 MLD50. Сокращение интервала между вакцинацией MVA-BN и заражением VV-WR от 4 дней до 3 или 2 дней увеличивало количество вирусположительных легких на группу от 1 из 5 или от 4 из 5 со средними легочными вирусными титрами соответственно log10 3,77 или log10 4,68. Сравнивали группы мышей из второго набора, зараженных VV-WR в концентрации 12,5 MLD50. Как показано на фиг. 5, невакцинированные мыши показывали среднюю вирусную нагрузку log10 8,38. Мыши, вакцинированные Elstree или DryVax за 4 дня до заражения, показывали среднюю вирусную нагрузку в легких log10 8,17 и log10 8,00. Таким образом, мыши, вакцинированные Elstree и DryVax, были неспособны предотвратить легочную вирусную инфекцию. В группе мышей, вакцинированныхMVA-BN за 4 или 3 дня до заражения, не было выявлено вирусных легочных титров и, таким образом,эти мыши были полностью защищены от вирусной инфекции после интраназального заражения VV-WR в концентрации 12,5 MLD50. Сравнивали группы мышей из третьего набора, зараженных VV-WR в концентрации 50 MLD50. Как показано на фиг. 6, невакцинированные мыши показывали среднюю вирусную нагрузку log10 8,59. Мыши, вакцинированные Elstree или DryVax за 4 дня до заражения, показывали среднюю вирусную нагрузку в легких log10 8,49 и log10 8,25. Таким образом, мыши, вакцинированные Elstree и DryVax, не обладали способностью предотвращать легочную вирусную инфекцию. В группе мышей, вакцинированных MVA-BN при введении вакцины за 4 дня до заражения, не было выявлено каких-либо легочных вирусных титров. Следовательно, эти мыши защищены от вирусной инфекции после интраназального заражения VV-WR 50 MLD50. В этой группе мышей, у которых применяли 3-дневный интервал между вакцинацией MVA-BN и заражением VV-WR, выявляли среднюю легочную вирусную нагрузку log10 7,63. Таким образом, эта группа защищена от вирусной инфекции только до некоторой степени. 5. Заключение. В настоящем исследовании восстановление потери массы тела, а также вирусные легочные титры предназначены для определения "защищенности" от летального интраназального заражения VV-WR. Контрольные животные, зараженные VV-WR в концентрации 1, 12,5 или 50 MLD50, показывали непрерывную потерю массы тела и после смерти имели высокую вирусную нагрузку в легких (чем выше доза заражения, тем выше выявляемая в легких вирусная нагрузка). Таким образом, эти мыши не обладали способностью контролировать инфекцию. Возможная противооспенная вакцина IMVAMUNE (MVA-BN) была способна защищать против интраназального заражения VV-WR в концентрации до 50 MLD50. Эта защита была связана с восстановлением массы тела после исходной потери массы тела и также была связана с отсутствием вируса в легких. Чем выше доза заражения VV-WR, тем дольше период после заражения, необходимый для восстановления массы тела у мышей, вакцинированных MVA-BN за 4 дня до заражения: при зараженииVV-WR в концентрации 12,5 MLD50 восстановление массы тела выявлено на 4-й день после заражения,тогда как при заражении мышей VV-WR 50 MLD50 восстановление массы тела было выявлено на 5-й- 12013404 день после заражения. Дополнительно, настоящее исследование явно показало, что можно сократить интервал времени между вакцинацией мышей MVA-BN и заражением VV-WR в концентрации 1 MLD50 до 2 дней, что является интервалом времени, достаточным, чтобы дать возможность стабилизировать массу тела и получить уменьшенные легочные вирусные титры после заражения мышей VV-WR 1 MLD50. Кроме того, повышение дозы заражения приводило к увеличению интервала времени между вакцинацией MVA-BN и заражением, которое необходимо для создания защиты от летального заражения: в случае заражения VV-WR в концентрации 50 MLD50 было недостаточно 3-дневного интервала,тогда как после заражения VV-WR в концентрации 12,5 MLD50 для создания защиты было достаточно 3-дневного интервала между вакцинацией и заражением. В отличие от MVA-BN противооспенные вакцины первого и второго поколения соответственноDryVax и Elstree были неспособны защищать против интраназального заражения VV-WR в концентрации до 50 MLD50 при введении за 4 дня до заражения. Причина этих различий может заключаться в различных путях введения: MVA-BN вводили мышам (и вводят в клинических испытаниях людям) подкожно,тогда как Eistree и DryVax вводили мышам (и вводят людям) посредством скарификации. В заключение, настоящее исследование явно показывает превосходство MVA-BN по сравнению сElstree и DryVax в отношении создания защиты. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Применение поксвируса для изготовления вакцины для быстрой индукции защитного иммунного ответа у животного, в том числе у человека, при котором поксвирус является репликационнонекомпетентным у указанного животного, в том числе у человека, причем защитный иммунный ответ возникает в течение 7 дней или менее после введения поксвируса. 2. Применение по п.1, в котором поксвирус является модифицированным вирусом осповакцины Анкара (MVA). 3. Применение по п.2, в котором MVA выбран из MVA штаммов MVA 575, MVA 572 и MVA-BN. 4. Применение по любому из пп.1-3, в котором вирус представляет собой клонированный очищенный вирус. 5. Применение по любому из пп.1-4, в котором вирус получен путем бессывороточного культивирования. 6. Применение по любому из пп.2-5, в котором поксвирус вводят в дозе от 105 до 5108 TCID50/мл. 7. Применение по любому из пп.1-6, в котором поксвирус вводят внутривенно, внутримышечно или подкожно. 8. Применение по любому из пп.1-7, в котором защитный иммунный ответ представляет собой защитный иммунный ответ против поксвирусной инфекции. 9. Применение по п.8, в котором иммунный ответ является иммунным ответом против инфекции оспы. 10. Применение по любому из пп.1-9, в котором поксвирус является рекомбинантным поксвирусом. 11. Применение по п.10, в котором рекомбинантный поксвирус содержит по меньшей мере одну гетерологичную последовательность нуклеиновой кислоты. 12. Применение по п.11, в котором гетерологичная последовательность нуклеиновой кислоты является последовательностью, кодирующей по меньшей мере один антиген, антигенный эпитоп и/или терапевтическое соединение. 13. Применение по п.12, в котором антигенные эпитопы и/или антигены являются антигенными эпитопами и/или антигенами инфекционного агента. 14. Применение по п.13, в котором инфекционный агент выбран из вирусов, грибов, патогенных одноклеточных эукариотических и/или прокариотических организмов, паразитических организмов. 15. Применение по п.14, в котором вирусы выбраны из семейства вируса гриппа, флавивируса, парамиксовируса, вируса гепатита, вируса иммунодефицита человека или из вирусов, вызывающих геморрагическую лихорадку. 16. Применение по любому из пп.13-15, в котором иммунная защита является защитой против инфекционного агента, из которого получен антигенный эпитоп и/или антиген. 17. Способ быстрой индукции защитного иммунного ответа у животного, в том числе у человека,включающий этап введения животному, в том числе человеку, поксвируса, который является репликационно-некомпетентным у указанного животного, в том числе у человека, где защитный иммунный ответ возникает в течение 7 дней или менее после введения поксвируса. 18. Способ по п.17, в котором поксвирус представляет собой модифицированный вирус осповакцины Анкара (MVA). 19. Способ по п.18, в котором MVA выбран из MVA-штаммов MVA 575, MVA 572 и MVA-BN. 20. Способ по любому из пп.17-19, в котором вирус является клинированным очищенным вирусом. 21. Способ по любому из пп.17-20, в котором вирус получен путем бессывороточного культивирования.- 13013404 22. Способ по любому из пп.18-21, в котором поксвирус вводят в дозе от 105 до 5108 TCID50/мл. 23. Способ по любому из пп.17-22, в котором поксвирус вводят внутривенно, внутримышечно или подкожно. 24. Способ по любому из пп.17-23, в котором защитный иммунный ответ представляет собой защитный иммунный ответ против поксвирусной инфекции. 25. Способ по п.24, в котором иммунный ответ является иммунным ответом против инфекции оспы. 26. Способ по любому из пп.17-25, в котором поксвирус является рекомбинантным поксвирусом. 27. Способ по п.26, в котором рекомбинантный поксвирус содержит по меньшей мере одну гетерологичную последовательность нуклеиновой кислоты. 28. Способ по п.27, в котором гетерологичная последовательность нуклеиновой кислоты является последовательностью, кодирующей по меньшей мере один антиген, антигенный эпитоп и/или терапевтическое соединение. 29. Способ по п.28, в котором антигенные эпитопы и/или антигены являются антигенными эпитопами и/или антигенами инфекционного агента. 30. Способ по п.29, в котором инфекционный агент выбран из вирусов, грибов, патогенных одноклеточных эукариотических и/или прокариотических организмов, паразитических организмов. 31. Способ по п.30, в котором вирусы выбраны из семейства вируса гриппа, флавивирусов, парамиксовирусов, вируса гепатита, вируса иммунодефицита человека или из вирусов, вызывающих геморрагическую лихорадку. 32. Способ по любому из пп.29-31, в котором иммунная защита является защитой против инфекционного агента, из которого получен антигенный эпитоп и/или антиген.
МПК / Метки
МПК: A61K 39/12, A61K 39/285, A61P 37/04, A61K 39/145, A61K 39/29
Метки: агентов, поксвирусов, поксвирусных, других, модифицированных, применение, индукции, быстрой, инфекционных, против, иммунитета
Код ссылки
<a href="https://eas.patents.su/17-13404-primenenie-modificirovannyh-poksvirusov-dlya-bystrojj-indukcii-immuniteta-protiv-poksvirusnyh-ili-drugih-infekcionnyh-agentov.html" rel="bookmark" title="База патентов Евразийского Союза">Применение модифицированных поксвирусов для быстрой индукции иммунитета против поксвирусных или других инфекционных агентов</a>
Предыдущий патент: 4-((феноксиалкил)тио)феноксиуксусные кислоты и аналоги
Следующий патент: Состав аэрозоля для дозирующих ингаляторов под давлением
Случайный патент: Весовое дозирующее устройство для сыпучих продуктов