Производные циклопентенона
Номер патента: 1808
Опубликовано: 27.08.2001
Авторы: Като Икуносин, Кобайаси Ейдзи, Икаи Кацусиге, Койама Нобуто
Формула / Реферат
1. Производное циклопентенона, представленное следующей общей формулой I, рацемат или чистый антипод его
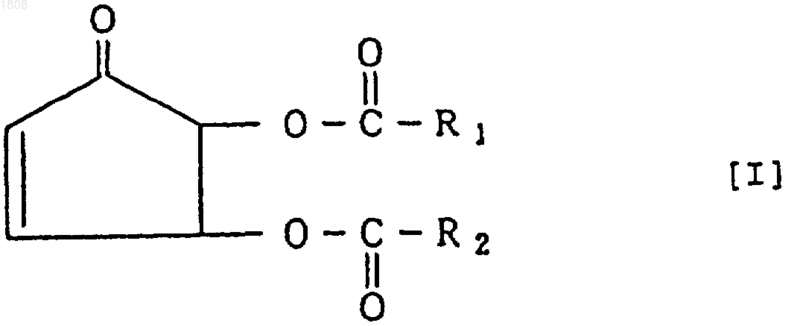
где R1 и R2 являются одинаковыми или разными и каждый из них является алкильной группой с прямой или разветвленной цепью, содержащей не более 13 атомов углерода, алкенильной группой с прямой или разветвленной цепью, содержащей не более 13 атомов углерода, фенильной группой или фенилалифатической группой, при условии, что такой случай, когда R1 = R2 = -СН3 исключен.
2. Лекарственный препарат, который характеризуется тем, что он содержит в качестве эффективного компонента, по меньшей мере, одно соединение производного циклопентенона по п.1.
3. Лекарственный препарат по п.2, который представляет собой противораковое средство.
4. Лекарственный препарат по п.2, который представляет собой апоптоз-индуцирующее средство.
5. Лекарственный препарат по п.2, который представляет собой противомикробное средство.
6. Способ получения производного циклопентенона, представленного формулой
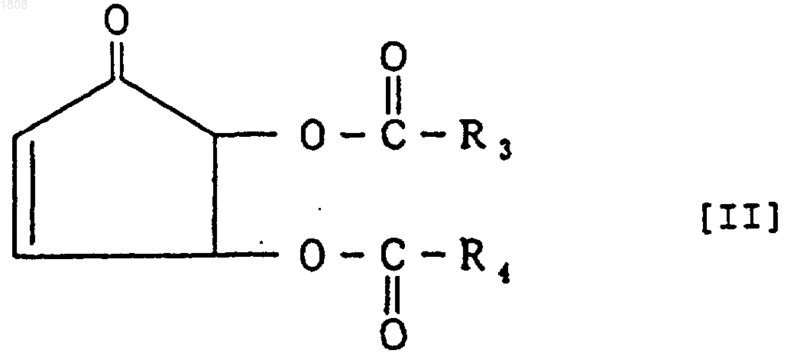
где R3 и R4 являются одинаковыми или разными и каждый из них является алкильной группой с прямой или разветвленной цепью, содержащей не более 13 атомов углерода, алкенильной группой с прямой или разветвленной цепью, содержащей не более 13 атомов углерода, фенильной группой или фенилалифатической группой, отличающийся тем, что 4,5-дигидрокси-2-циклопентен-1-он, представленный следующей формулой
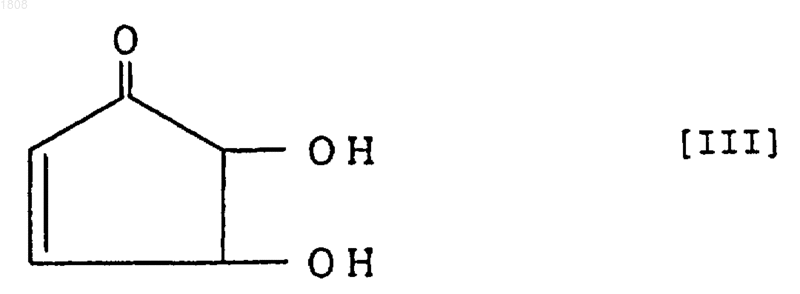
и/или его оптически активное производное подвергают взаимодействию или одновременно, или последовательно с карбоновой кислотой и/или ее реакционно-способным производным с R3 и R4, соответствующими производному циклопентенона, представленному следующей формулой [II].
7. Лекарственный препарат, отличающийся тем, что он содержит в качестве эффективного компонента, по меньшей мере, одно соединение, выбранное из производного циклопентенона, полученного способом по п.6, или его оптически активного вещества, соли.
8. Лекарственный препарат по п.7, который представляет собой противораковое средство.
9. Лекарственный препарат по п.7, который представляет апоптоз-индуцирующее средство.
10. Лекарственный препарат по п.7, который представляет собой противомикробное средство.
Текст
1 Область техники Настоящее изобретение относится к производному циклопентенона, пригодному для применения в области лекарственных препаратов, обладающих физиологической активностью, например, противораковым действием, а также к способу производства таких соединений. Предшествующий уровень техники Лекарственные препараты, применяемые в клинической терапии, включают множество лекарственных средств, например, противораковые лекарственные средства, антибиотики,иммунопотенцирующие средства, иммуномодуляторы и т.д. (например, алкилирующие средства, антиметаболиты и растительные алкалоиды),но едва ли можно сказать, что такая лекарственная терапия уже полностью создана. Сообщалось, что из простагландинов, полученных из природных веществ, в качестве высокобезопасного противоракового средства,вследствие ингибирования синтеза ДНК, можно применять простагландины А и J, имеющие ,ненасыщенный карбонил в пятичленном кольце,и затем были синтезированы их различные производные (смотри описание патента Японии,выложенное для открытого ознакомления Sho62/96438). Проблемы, решаемые изобретением Целью настоящего изобретения является получение производного циклопентенона, обладающего физиологическим действием, например противораковым действием, действием,вызывающим апоптоз, противомикробным действием и т.д., и обеспечение способа производства упомянутых соединений и лекарственных препаратов, содержащих такие соединения. Средства для решения проблем Настоящие изобретатели провели интенсивные исследования для достижения вышеназванных целей и обнаружили, что производное циклопентенона, представленное формулой [II],можно получить путем взаимодействия 4,5 дигидро-2-циклопентен-1-она (далее циклопентенон), представленного формулой [III], с карбоновой кислотой и/или с ее реакционноспособным производным, и что производное циклопентенона настоящего изобретения обладает различной сильной физиологической активностью, ингибирующей рост раковых клеток и т.д., на основе проведенных исследований и было создано настоящее изобретение. Настоящее изобретение можно кратко изложить следующим образом. Первый объект настоящего изобретения относится к производному циклопентенона, представленному следующей формулой (I), или его оптически активному веществу или его соли(В формуле R1 и R2 являются одинаковыми или разными, и каждый из них является алкильной группой с прямой или разветвленной цепью, алкенильной группой с прямой или разветвленной цепью, ароматической группой или ароматической-алифатической группой, при условии, что такой случай, когда R1 = R2 = -СН 3 исключен). Второй объект настоящего изобретения относится к способу получения производного циклопентенона, представленного формулой [II] характеризующемуся тем, что 4,5-дигидрокси-2 циклопентен-1-он, представленный следующей формулой [III] и/или его оптически активное производное взаимодействуют(ет) или одновременно или последовательно с карбоновой кислотой и/или ее реакционноспособным производным с R3 и(В формуле R3 и R4 являются одинаковыми или разными, и каждый из них является алкильной группой с прямой или разветвленной цепью, алкенильной группой с прямой или разветвленной цепью, ароматической группой или ароматической-алифатической группой). Третьим объектом настоящего изобретения является лекарственный препарат, который характеризуется тем, что он включает в себя в качестве активного компонента соединение, выбранное из производного циклопентенона, его оптически активного вещества или его соли,являющееся первым объектом. Четвертым объектом настоящего изобретения является лекарственный препарат, который характеризуется тем, что он включает в себя в качестве активного компонента соединение, выбранное из производного циклопентенона, его оптически активного вещества или его соли, полученное способом, являющимся вторым объектом настоящего изобретения. В предпочтительном варианте третьего и четвертого объектов настоящего изобретения,упомянутый лекарственный препарат представляет собой противораковое средство, вызывающее апоптоз или противомикробное средство. 3 Краткое объяснение рисунков Фиг. 1 показывает масс-спектр диацетилциклопентенона. Фиг. 2 показывает спектр 1H-ЯМР диацетилциклопентенона. Фиг. 3 показывает масс-спектр дибензоилциклопентенона. Фиг. 4 показывает спектр 1 Н-ЯМР дибензоилциклопентенона. Фиг. 5 показывает спектр 1 Н-ЯМР дигексаноилциклопентенона. Фиг. 6 показывает спектр 1H-ЯМР димиристоилциклопентенона. Фиг. 7 показывает спектр 1H-ЯМР диоктаноилциклопентенона. Фиг. 8 показывает спектр 1H-ЯМР ди-3 октеноилциклопентенона. Фиг. 9 показывает спектр 1H-ЯМР дибутирилциклопентенона. Фиг. 10 показывает спектр 1H-ЯМР дидеканоилциклопентенона. Фиг. 11 показывает спектр 1H-ЯМР дивалерилциклопентенона. Фиг. 12 показывает спектр 1H-ЯМР дипропионилциклопентенона. Фиг. 13 показывает спектр 1 Н-ЯМР ди-2 гексеноилциклопентенона. Фиг. 14 показывает CD (круговой дихромизм) п-диметиламино-бензоильного производного (-) циклопентенона и стереоструктуру (-)циклопентенона. Фиг. 15 показывает круговой дихроизм пдиметиламино-бензоильного производного (+) циклопентенона и стереоструктуру(+)циклопентенона. Сущность изобретения Далее настоящее изобретение будет описано более подробно. Применяемый в настоящем изобретении циклопентенон, представленный формулой (III),охватывает оба изомера, у которых конфигурации гидроксильных групп в 4- и 5-положениях представляют собой цис- и транс-конфигурации. В настоящем изобретении может быть использован любой изомер циклопентенона, такой как цис-циклопентенон, транс-циклопентенон и смесь цис- и транс-циклопентенона. Можно также применять их оптически активные вещества. Цис-циклопентенон может быть получен химическим синтезом [Helvetica Chimica Acta,Volume 55, pages 2838-2844 (1972)]. Трансциклопентенон может быть получен или путем химического синтеза [Carbohydrate Res., volume 247, pages 217-222 (1993)], или нагреванием уроновой кислоты, например глюкуроновой кислоты, производного уроновой кислоты, например, глюкуронолактона и т.д. (см. PCE/JP 97/03052). В настоящем изобретении можно также применять такой нагретый продукт или неполностью очищенный продукт или очищенный продукт. 4 Так, например, когда в качестве уроновой кислоты применяют D-глюкуроновую кислоту и ее 1% раствор нагревают в течение четырех часов до 121 С, в термообработанном веществе получается циклопентенон. Находящийся в термообработанном веществе циклопентенон экстрагируют растворителем и экстракт концентрируют. Затем концентрированный экстракт отделяют посредством колоночной хроматографии на силикагеле, концентрируют фракцию элюированного циклопентенона, экстрагируют циклопентенон из концентрата хлороформом и экстракт концентрата подвергают колоночной хроматографии с нормальной фазой, после чего выделяют находящийся в термообработанном веществе циклопентенон. Физические свойства циклопентенона представлены ниже. В данном случае массспектрометрический анализ циклопентенона проводили с применением масс-спектрометра(изготовленного фирмой Nippon Denshi) проводили измерение ЯМР с применением в качестве растворителя тяжелого хлороформа. Постоянную оптического вращения измерили посредством поляриметра DIP-370 (изготовленного фирмой Nippon Bunko); ультрафиолетовый спектр поглощения измерили посредством спектрофотометра UV-2500 (изготовленного Shimadzu); и инфракрасный спектр поглощения (ИК) измерили посредством инфракрасного спектрофотометра (изготовленного Shimadzu). MS m/z 115H-NMR (CDCl3):4.20 (1H, d, J=2.4 Hz, 5H), 4.83 (1H, m, 4-H), 6.30 (1H, dd, J=1.2, 6.1 Hz,2-H), 7.48 (1H, dd, J = 2.1, 6.1 Hz, 3-H). В данном случае, значение химического сдвига 1H-ЯМР представлено на основе того,что значение химического сдвига СНСl3 составило 7,26 ppm. (млн. дол.) Оптическое вращение: []D20 0(с 1,3 вода) УФ: mах 215 нм (вода). ИК (метод КВr): поглощения были отмечены при 3400, 1715, 1630, 1115, 1060, 1025 см-1. Когда выделенный циклопентенон подвергают оптическому расщеплению, получают (-)4,5-дигидрокси-2-циклопентен-1-он и (+)-4,5 дигидрокси-2-циклопентен-1-он. Совершенно ясно, что циклопентенон, полученный методом синтеза, может быть также подвергнут оптическому расщеплению. Циклопентенон растворяют, например, в этаноле. Затем к этанольному раствору для получения раствора циклопентенона добавляют гексан/этанол (94/6). Циклопентенон может быть оптически расщеплен когда пробу раствора подвергают HPLC (высокоэффективной жидкостной хроматографии) с применением, например, Chirial Park AS (изготовитель Daicel Chemical Industries) при условии, что 5 температура колонки составляет 40 С и подвижной фазой является гексан/этанол (94/6). Оптическое вращение оптически расщепленного (-)-транс-4,5-дигидрокси-2-циклопентен-1-она (далее обозначен как (-)-циклопентенон) является следующим: []D20 -105(с 30 этанол), тогда как оптическое вращение оптически расщепленного (+)-транс-4,5-дигидрокси-2 циклопентен-1-она (далее (+)-циклопентенон) является следующим: []D20 +104(с 0,53 этанол). В данном случае оптическое вращение измерили вышеупомянутым поляриметром типаBunko). После этого каждый из (-)-циклопентенона и (+)-циклопентенона подвергли структурному анализу посредством масс-анализатора и ядерного магнитного резонанса (ЯМР), измерению ультрафиолетового спектра поглощения и измерению инфракрасного спектра поглощения посредством вышеупомянутых методов. В результате оба оптически активных вещества показали такой же результат, какой показал циклопентенон перед оптическим расщеплением. Каждый из оптически расщепленных (-)циклопентенона и (+)-циклопентенона превратили в производное п-диметиламинобензоила с применением дисперсиметра типа J-720 для измерения кругового дихромизма (изготовленного фирмой Nippon Bunko). Измерили спектр кругового дихромизма (CD) и к полученному результату для определения конфигурации применили правило хиральности дибензоата [J. Am.CD (круговой дихромизм) п-диметиламинобензоильного производного (-)-циклопентанона и стереоструктура (-)-циклопентенона показаны на фиг. 14. На рисунке на оси ординат показан молярный круговой дихромизм, тогда как на оси абсцисс показана длина волны (нм). В данном случае вышеприведенная стереоструктура представлена ниже в виде формулыCD (круговой дихромизм) п-диметиламинобензоильного производного (+)-циклопентанона и стереоструктура (+)-циклопентенона показаны на фиг. 15. На рисунке на оси ординат показан молярный круговой дихромизм, тогда как на оси абсцисс показана длина волны (нм). В данном случае вышеприведенная стереоструктура представлена ниже в виде формулы Как показано на фиг. 14, 15 и как следует из формулы [IV] и формулы [V](-)-циклопентенон представляет собой (-)(4R,5R)-транс-4,5-дигидрокси-2-циклопентен-1 он, тогда как (+)-циклопентенон представляет собой (+)-(4R,5R)-транс-4,5-дигидрокси-2 циклопентен-1-он. Вышеупомянутые циклопентеноны или их оптически активные вещества могут быть получены посредством любого способа, т.е. они могут быть получены посредством способа, раскрытого в этом изобретении, или посредством химического синтеза; в настоящем изобретении также могут быть использованы транс- и цисциклопентенон, их смесь или их оптически активные вещества. Когда циклопентенон и/или его оптически активное вещество взаимодействуют(ет) или одновременно или последовательно с карбоновой кислотой и/или ее реакционноспособным производным, имеющим алкильную группу с прямой или разветвленной цепью, алкенильную группу с прямой или разветвленной цепью,ароматическую группу или ароматическуюалифатическую группу, в реакционном растворе получается прозводное циклопентенона настоящего изобретения, представленное формулой [II], или его оптически активное производное. В качестве карбоновой кислоты, имеющей алкильную группу, может быть использована карбоновая кислота, имеющая алкильную группу с прямой или разветвленной цепью, и длина алкильной цепи может быть подходяще выбрана в соответствии с биологической активностью,растворимостью и т.д. производного циклопентенона. Примерами подходящих карбоновых кислот, имеющих алкильную группу с прямой цепью, являются уксусная кислота, пропионовая кислота, масляная кислота, валериановая кислота, гексановая кислота, гептановая кислота, ноктановая кислота, пеларгоновая кислота, ндекановая кислота, ундекановая кислота, лауриновая кислота, тридекановая кислота, миристиновая кислота, пентадекановая кислота, пальмитиновая кислота, гептадекановая кислота, стеариновая кислота, нонадекановая кислота, икозановая кислота, лигноцериновая кислота, церотовая кислота, мелиссиновая кислота и богеновая кислота. Примерами подходящих карбоновых кислот, имеющих алкильную группу с разветвленной цепью, являются изомасляная кислота, изовалериановая кислота, 2-метилмасляная кислота, пивалиновая кислота, 4-метилвалериановая кислота и 1, 2-диметилвалериановая кислота. Что касается карбоновой кислоты, имеющей алкенильную группу, то может быть использована карбоновая кислота, имеющая алкенильную группу с прямой или разветвленной цепью, и длина цепи, степень ненасыщенности и положение ненасыщенной связи алкенильной группы могут быть подходяще выбраны в соот 7 ветствии с биологической активностью, растворимостью и т.д. производного циклопентенона. Примерами подходящих карбоновых кислот, имеющих алкенильную группу с прямой цепью, являются акриловая кислота, винилуксусная кислота, кротоновая кислота, изокротоновая кислота, аллилуксусная кислота, 2 гекcеновая кислота, 3-гексеновая кислота, 3 октеновая кислота, обтузиловая кислота, 10 ундеценовая кислота, пальмитолеиновая кислота, петрозелиновая кислота, элаидиновая кислота, олеиновая кислота, линолевая кислота, линоленовая кислота, -линоленовая кислота,элеостеариновая кислота, икозатриеновая кислота, арахидоновая кислота, эйкозапентаеновая кислота, брассидиновая кислота, эруковая кислота, докозагексаеновая кислота, ксименовая кислота и 21-триаконтеновая кислота. Примерами подходящих карбоновых кислот, имеющих алкенильную группу с разветвленной цепью, являются метакриловая кислота,тиглиновая кислота, ангеликовая кислота и этилкротоновая кислота. Примерами подходящих карбоновых кислот, имеющих ароматическую группу, являются бензойная кислота, толуиловая кислота,хлорбензойная кислота, бромбензойная кислота,нитробензойная кислота, фталевая кислота,изофталевая кислота, терефталевая кислота,салициловая кислота, ацетилсалициловая кислота, ацетилсалицилсалициловая кислота, аминосалициловая кислота, п-гидроксибензойная кислота, аминобензойная кислота, метоксибензойная кислота, ацетамидобензойная кислота,ванилиновая кислота, орселлиновая кислота,нафтойная кислота, цинхомероновая кислота,ксантуреновая кислота, хининовая кислота и кинуреновая кислота, и карбоновая кислота,имеющая соответствующую арильную группу,может быть выбрана в соответствии с биологической активностью, растворимостью и т.д. получаемых производных циклопентенона. Примерами подходящих карбоновых кислот, имеющих ароматическую алифатическую группу, являются фенилуксусная кислота, фенилпропионовая кислота, фенилмолочная кислота, фенилпировиноградная кислота, коричная кислота, атроповая кислота и нафтилуксусная кислота, и карбоновая кислота, имеющая соответствующую аралкильную группу, может быть выбрана в соответствии с биологической активностью, растворимостью и т.д. получаемых производных циклопентенона. Примерами реакционноспособного производного карбоновой кислоты, применяемого в настоящем изобретении, являются галоидангидриды, ангидриды кислот, кислые эфиры и соли,и в зависимости от цели может быть получено подлежащее применению реакционноспособное производное карбоновой кислоты. 8 Реакцию карбоновой кислоты или ее реакционноспособного производного с циклопентеноном можно осуществить таким способом, чтоR3 и R4 производного циклопентенона будут или одинаковыми или разными. Таким образом, с циклопентеноном могут взаимодействовать или одновременно или последовательно карбоновые кислоты, имеющие различные R3 и R4. Эффективное получение производных циклопентенона, имеющих различные R3 и R4, можно осуществить в том случае, когда одна из гидроксильных групп циклопентенона в это время защищена. Производное циклопентенона или его оптически активное вещество, которое получают посредством реакции циклопентенона или его оптически активного вещества с карбоновой кислотой, имеют сильнодействующую ингибирующую активность в отношении роста онкогенов и могут быть очищены и выделены из реакционного раствора с применением такой активности в качестве показателя. Способы очистки и выделения могут быть известными способами очистки, например, химическими и физическими способами. Таким образом, вследствие объединения общеизвестных способов,например, гель-фильтрации, фракционирования с применением молекулярного мембранного фильтра, экстракции растворителем, фракционной перегонки, различных хроматографических методов, в которых применяют ионообменные смолы, и т.д., можно очистить и выделить производное циклопентенона или его оптически активное вещество. Так, например, циклопентенон или его оптически активное вещество, 4-метиламинопиридин и карбоновую кислоту растворяют в дихлорметане, затем при охлаждении льдом добавляют N,N-дициклогексилкарбодиимид и смесь подвергают реакции, при которой получается производное циклопентенона настоящего изобретения. Полученный продукт для выделения необходимого производного циклопентенона очищают посредством тонкослойной силикагель-хроматографии. Возможно также взаимодействие циклопентенона или его оптически активного вещества с уксусным ангидридом в безводном пиридине, после чего образованный диацетилциклопентенон очищают и выделяют из реакционной смеси. Разделение оптически активных веществ производного циклопентенона, полученного способом настоящего изобретения, можно осуществить путем подвергания рацемической смеси механическому разделению, селективной кристаллизации, разделению посредством кристаллизации в виде диастереомерных солей или в виде соединений включения, динамическому растворению с применением ферментов или микроорганизмов, разделению посредством хроматографии и т.д. 9 В случае разделения посредством хроматографии могут быть применены газовая хроматография, жидкостная хроматография, тонкослойная хроматография и т.д., при этом может быть применена хиральная стационарная фаза, которая является подходящей для каждого из указанных методов хроматографии. При оптическом разрешении посредством жидкостной хроматографии может быть применен метод, в котором применяют хиральную стационарную фазу, метод, в котором применяют хиральный элюат, а также разделение в виде стереомеров и т.д. В качестве хиральной стационарной фазы могут быть применены стационарная фаза типа амида, стационарная фаза типа мочевины, стационарная фаза лигандообменного типа, стационарная фаза из производного полисахаридполисахарида, протеиновая стационарная фаза,стационарная фаза из полиметакрилата, стационарная фаза из полиметакриламида и т.д. Что касается элюента, то при сочетании его с вышеупомянутой стационарной фазой могут быть предпочтительно использованы элюенты типа гексана, спирта, водного (буферного) раствора и т.д. Что касается соли соединения настоящего изобретения или его оптически активного вещества, то примером таких солей могут служить соли, которые являются приемлемыми в качестве лекарственных средств и они могут быть получены путем превращения посредством известных способов. Полученные настоящим изобретением производное циклопентенона, его оптически активное вещество или его соль обладают действием, подавляющим рост раковых клеток,например, промиелоцитных лейкозных клеток человека HL-60, лимфобластических лейкозных клеток MOLT-3, легочных раковых клеток А-549, легочных раковых клеток WI38VA13, трансформированных в SV-40, гепатомных клеток Нер G2, колониеобразующих раковых клеток НСТ 116, колониеобразующих раковых клеток человека SW 480, колониеобразующих раковых клеток человека Wi Dr, раковых клеток желудка AGS и клеток множественной миеломы. Лекарственный препарат, содержащий соединение, выбранное из производного циклопентенона настоящего изобретения, его оптически активного вещества или его соли в качестве эффективного компонента, может быть получен, например, когда соединение, выбранное из производного циклопентенона настоящего изобретения, его оптически активного вещества или его соли, применяют в качестве эффективного компонента и превращают в лекарственный препарат путем смешивания с известными фармацевтическими носителями, таким образом, стало возможным получение противоракового средства. Механизм ингибирующей активности полученных настоящим изобретени 001808 10 ем производного циклопентенона, его оптически активного вещества или его соли, в отношении раковых клеток совсем не ограничивает область настоящего изобретения и действие,индуцирующее апоптоз раковых клеток, также охвачено настоящим изобретением. Обычно соединение, выбранное из производного циклопентенона, его оптически активного вещества или его соли, смешивают с фармацевтически приемлемым жидким или твердым носителем и, если необходимо, с растворителем, диспергaтором, эмульгатором, буфером,стабилизатором, наполнителем, связующим,измельчающим средством, смазкой и т.д.,вследствие этого получают противораковое средство, которое может быть в твердом виде,например, в виде таблеток, гранул, разжиженных порошков, порошков, капсул и т.д. или в виде жидкости, например, растворов, суспензий,эмульсий и т.д. Кроме того, противораковое средство может быть в виде сухого препарата,который может быть превращен перед применением в жидкость добавлением соответствующего носителя. Фармацевтический носитель может быть выбран в зависимости от вышеупомянутого способа введения и от формы препарата. В случае препаратов для перорального приема могут быть использованы крахмал, лактоза, сахар,маннит, карбоксиметилцеллюлоза, кукурузный крахмал, неорганические соли и т.д. При производстве лекарственных препаратов для перорального приема с ними могут быть дополнительно смешаны связующие, измельчaющие средства, поверхностно-активные вещества,смазки, активаторы течения, корректоры вкуса,красители, ароматизирующие добавки и т.д. С другой стороны, в случае парентерального приема лекарственные препараты могут быть получены посредством общепринятых способов, в которых соединение, выбранное из производного циклопентенона, его оптически активного вещества или его соли, которое является эффективным ингредиентом настоящего изобретения, растворяют или суспендируют в разбавителе для инъекций, например в дистиллированной воде, физиологическом растворе,водном растворе глюкозы, растительном масле для инъекций, кунжутном масле, арахисовом масле, соевом масле, кукурузном масле, пропиленгликоле, полиэтиленгликоле и затем, в случае необходимости, добавляют бактерициды,стабилизаторы, изотонические растворы, анальгетики и т.д. Противораковое средство настоящего изобретения вводят соответствующим способом,зависящим от формы препарата. На способ введения лекарственного препарата не накладывается конкретных ограничений, и препарат можно ввести перорально, наружно и парентерально в виде инъекционного раствора. Препараты для инъекций вводят, например, внутривенно, внут 11 римышечно, подкожно, внутрикожно и т.д., тогда как препараты для наружного применения включают суппозитории т.д. Доза противоракового средства определяется формой препарата, способом введения, целью применения и возрастом, массой тела, симптомами больного, подвергаемого лечению, и не всегда, но обычно, количество производного циклопентенона, его оптически активного вещества или его соли, содержащееся в препарате,составляет от 0,1 мг до 200 мг/кг массы тела в день (для взрослых людей). Конечно, доза может изменяться в зависимости от различных обстоятельств, и поэтому в некоторых случаях может быть достаточной доза менее вышеприведенной, тогда как в других случаях может быть необходимой доза более вышеприведенной. Лекарственный препарат настоящего изобретения можно ввести непосредственно перорально и, кроме того, его можно добавить в пищу и напитки, т.е. препарат может быть введен общепринятым путем. Полученные настоящим изобретением производное циклопентенона, его оптически активное вещество или его соль обладают действием, индуцирующим апоптоз, в связи с чем может быть получено средство, индуцирующее апоптоз, которое содержит в качестве эффективного компонента, по меньшей мере, еще одно соединение, выбранное из вышеперечисленных соединений. Средство, индуцирующее апоптоз может быть превращено в лекарственные препараты таким же образом, как и противораковое средство и его вводят таким же способом, как и в случае применения противоракового средства. Доза средств, индуцирующих апоптоз,точно не устанавливается, и она может быть соответственно определена в зависимости от лекарственной формы, способа введения, цели применения и возраста, массы тела, состояния и т.д. больного, которому назначено такое средство. Однако обычно количество производного циклолентенона, его оптически активного вещества или его соли, содержащееся в препарате,для взрослых составляет 0,1 мкг-100 мг/кг в день. В сущности, доза может изменяться в зависимости от различных факторов, и поэтому в некоторых случаях может быть достаточной доза менее вышеупомянутой, тогда как в других случаях может быть необходимой доза более вышеупомянутой. Средство настоящего изобретения может быть введено перорально как таковое и, кроме того, средство можно вводить ежедневно после добавления в обычную пищу, а также в напитки. Считается, что в отличие от некроза, который является патогенным отмиранием клеток,апоптоз представляет собой отмирание, которое заранее запрограммировано в самом гене клетки. Таким образом, ген, который программирует апоптоз, активируется определенными внешни 001808 12 ми и эндогенными факторами, вследствие этого упомянутым геном вызывается запрограммированное им отмирание клеток, и затем сама клетка разлагается и погибает за счет запрограммированной гибели белка. Вызывающее апоптоз средство настоящего изобретения является полностью пригодным,так как оно способно вызвать в желательных тканях и клетках апоптоз и исключить ненужные клетки из находящегося в естественном состоянии живого организма. Апоптоз-индуцирующее средство настоящего изобретения может быть использовано в способе индуцирования апоптоза. Поэтому когда в качестве эффективного компонента применяют производное циклопентенона, его оптически активное вещество или его соль, можно индуцировать апоптоз и такой способ является пригодным, например, для объяснения механизма индуцирования апоптоза и для отбора апоптоз-индуцирующих средств и ингибиторов индуцирования апоптоза. Может быть получено также противомикробное средство, содержащее, по меньшей мере,одно соединение, выбранное из вышеперечисленных в качестве эффективного компонента веществ. Противомикробное средство может быть превращено в лекарственные препараты таким же образом, как и вышеприведенное противораковое средство и его вводят соответствующим путем, зависящим от формы препарата. На способ введения также не накладывается конкретных ограничений, и препарат можно ввести перорально, наружно и парентерально в виде инъекционного раствора. Препараты для инъекций вводят, например, внутривенно, внутримышечно, подкожно и внутрикожно. Препараты для наружного применения включают суппозитории. Доза противомикробного средства определяется соответственно формой препарата, способом введения, целью применения и возрастом, массой тела и симптомами больного, подвергаемого лечению, и не всегда, но обычно,количество производного циклопентенона, его оптически активного вещества или его соли,содержащееся в препарате, составляет от 10 мкг до 20 мг/кг массы тела в день (для взрослых людей). Конечно, доза может изменяться в зависимости от различных обстоятельств, и поэтому в некоторых случаях может быть достаточной доза менее вышеприведенной, тогда как в других случаях может быть необходимой доза более вышеприведенной. Лекарственный препарат настоящего изобретения можно ввести непосредственно перорально и, кроме того, его можно добавить в пищу и напитки, т.е. препарат может быть введен общепринятым путем. Кроме того, противомикробное средство настоящего изобретения может быть использовано в качестве антисептического средства для улучшения сохраняемости продуктов или на 13 питков. Более того, производное циклопентенона, его оптически активное вещество или его соль можно добавить в пищу или напитки и использовать в антисептическом способе консервирования пищевых продуктов и напитков. Противомикробное средство настоящего изобретения является эффективным как для грамположительных, так и для грамотрицательных бактерий. К тому же противомикробное средство настоящего изобретения обладает антимикробной активностью в отношении бактерий, вызывающих кариес зубов и периодонтальные заболевания, в связи с чем могут быть предложены интрапероральные препараты, содержащие противомикробное средство настоящего изобретения. Интрапероральный препарат может быть в виде известной формы, например в виде жидкости или пасты. Примером интраперорального препарата является средство для чистки зубов. Могут быть предложены противомикробные косметические средства, содержащие противомикробное средство настоящего изобретения. Могут быть также предложены банные средства, содержащие противомикробное средство настоящего изобретения. Полученные настоящим изобретением производное циклопентенона, его оптически активное вещество или его соль могут быть эффективно получены из циклопентенона и карбоновой кислоты или ее рекционноспособного производного. На способ производства пищевых продуктов и напитков, содержащих производное циклопентенона, его оптически активное вещество или его соль, полученные способом настоящего изобретения, не накладывается конкретных ограничений, и могут быть применены обычные способы варки, жарки, обработки продуктов,используемые для производства пищевых продуктов и напитков, при условии, что в образованном пищевом продукте или напитке будет содержаться эффективное количество производного циклопентенона, его оптически активного вещества или его соли. Полученные способом настоящего изобретения производное циклопентенона, его оптически активное вещество или его соль при введении дозы, которая являем эффективной для достижения физиологической активности, не проявляет токсичность. Так, например, в случае однократного перорального приема 300 мг/кг массы тела дипропионилциклопентенона, дигексаноилциклопентенона, ди-2-гексеноилциклопентенона и их оптически активных веществ и солей смертельного случая у мышей не наблюдалось. Суммируя вышеизложенное, производное циклопентенона, его оптически активное вещество или его соль, полученные настоящим изобретением, могут быть легко получены и, благодаря их различным физиологическим функциям, эти соединения являются полностью при 001808 14 годными в области лекарственных препаратов,пищевых продуктов и т.д. Примеры Настоящее изобретение будет далее проиллюстрировано следующими примерами, хотя настоящее изобретение никоим образом не ограничивается этими примерами. Применяемое в примерах обозначение % в данном случае означает % по весу, NMR-ЯМР, s-синглет, mмультиплет, d-дуплет, t-триплет, dd-двойной дуплет; Пример 1.D-глюкуроновую кислоту (G5269; производимую фирмой Sigma) (10 г) растворили в 1 л воды, нагрели в течение 4 ч при 121 С и концентрировали в вакууме до получения около 10 мл. Ее смешали с 40 мл верхнего слоя смеси,состоящей из бутилацетата, уксусной кислоты и воды, при соотношении компонентов в этой смеси 3:2:2, и центрифугировали и затем образованную надосадочную жидкость концентрировали в вакууме до получения около 10 мл. Вышеполученный экстракт поместили на силикагель (BW-300SP; 2 х 28 см; производимый фирмой Fuji Silycia) для проведения колоночной хроматографии и отделили с применением в качестве элюата верхнего слоя смеси бутилацетата, уксусной кислоты и воды при соотношении компонентов в этой смеси 3:2:2,при скорости потока около 5 мл/мин, под давлением 0,2 кг/см с применением компрессора. Для получения объема одной фракции 10 мл осуществили фракционирование и часть каждой фракции подвергли анализу тонкослойной хроматографией, после которого циклопентенон высокой чистоты содержался во фракциях от шестьдесят первой до восьмидесятой. Эти фракции собрали, концентрировали в вакууме,экстрагировали 40 мл хлороформа и экстракт концентрировали в вакууме, при этом получили 100 мл циклопентенона. Посредством HPLC (высокоэффективной жидкостной хроматографии) с нормальной фазой, в которой использовали колонку Palpack типа S, (изготовленную Tokara Shuzo), отделили фракцию и с помощью поглощения ультрафиолетовых лучей с длиной волны 215 нм осуществили обнаружение, степень чистоты составила 98%. Вышеуказанный циклопентенон (113,9 мг) растворили в 2,85 мл этанола. К раствору этанола добавили 3,85 мл гексана/этанола (94/6), при этом получили раствор циклопентенона (17 мг/мл). Для получения пробы раствора, необходимой для оптического разрешения HPLC, раствор циклопентенона фильтровали через фильтр 0,5 мкм. Эту пробу раствора использовали для оптического разрешения HPLC, каждую из фракций (-)-циклопентенона более раннего пика и(+)-циклопентенона более позднего пика собрали и выпарили досуха в вакууме, при этом по 15 лучили 43,2 мг (-)-циклопентенона и 43,0 мг (+)циклопентенона. Условия для оптического разрешения HPLC Колонки: Chiral Pack AS (производимые(2,55 мг); Каждый из полученных (-)-циклопентенона и (+)-циклопентенона содержал около 1% энантиомера и поэтому их опять подвергли оптическому разрешению при вышеприведенных условиях. В результате из 30,0 мг (-)-циклопентенона более раннего пика получили 19,7 мг (-)-циклопентенона, не содержащего энантиомера, тогда как из 37,4 мг (+)-циклопентенона более позднего пика получили 27,7 мг (+)-циклопентенона, не содержащего энантиомера. В данном случае время элюирования при оптическом разрешении(2) К 29,6 мг циклопентенона, полученного способом, упомянутым в примере 1-(1), добавили 1 мл безводного пиридина (295-26, производимого Nacalai Tesque) и 0,1 мл уксусного ангидрида (002-26, производимого Nacalai Tesque) и затем осуществили перемешивание при комнатной температуре в течение 3 ч. Реакционный раствор экстрагировали хлороформом, при этом получили 36 мг диацетилциклопентенона. С применением масс-спектрометра DX-302(изготовленного Nippon Denshi) осуществили масс-анализ полученного диацетилциклопентенона. Кроме этого, его растворили в CDCl3 и его структуру анализировали посредством ЯМР. В качестве аппаратуры для изучения ядерного магнитного резонанса использовали JMN-A500(изготовленный Nippon Denshi). Результаты представлены ниже. В данном случае значения химического сдвига 1H-ЯМР выразили таким образом, что значение химического сдвига хлороформа составляло 7,24 ppm.(1H, m, H-4), 6.40 (1H, d-d, J=1.5, 6.5 Hz, H-2),7.43 (1H, d-d, J=2.5, 6.5 Hz, H-3). Фиг. 1 показывает масс-спектр диацетилциклопентенона и фиг. 2 показывает спектр 1HЯМР диацетилциклопентенона. На фиг. 1 на оси абсцисс показано значение m/z, тогда как на оси ординат показана относительная интенсивность(%). На фиг. 2 на оси абсцисс показано значение химического сдвига (млн. дол.) тогда как на оси ординат показана интенсивность сигнала.(3) Для получения 15,1 мг диацетил (-)циклопентенона с применением 15,9 мг (-)циклопентенона, полученного способом примера 1-(1), осуществили ту же самую реакцию, 001808 16 которая описана в вышеприведенном примере 1-(2). Диацетил (-)-циклопентенон подвергли структурному анализу посредством массанализа и ЯМР тем же самым способом, который описан в вышеприведенном примере 1-(2),при этом получили такие же результаты, как в примере 1-(2).(4) Для получения 18,8 мг диацетил (+)циклопентенона с применением 16,7 мг (+)циклопентенона, полученного способом примера 1-(1), осуществили ту же самую реакцию,которая описана в вышеприведенном примере 1-(2). Диацетил (+)-циклопентенон подвергли структурному анализу посредством массанализа и ЯМР тем же самым способом, который описан в вышеприведенном примере 1-(2),при этом получили такие же результаты, как в примере 1-(2).(5) К 13,8 мг циклопентенона добавили 44,3 мг бензойной кислоты (041-20, производимой Nacalai Tesque), 7,5 мг диметиламинопиридина (DMAP; D1450, производимогоTokyo Kasei Kogyo) и 51,0 мг N,N'дициклогексилкарбодиимида (DCC; 1001, производимого Peptide Kenkyusho), затем 5 мл хлороформа и смесь перемешали при охлаждении льдом в течение четырех часов. Реакционный раствор фильтровали, полученный фильтрат поместили в колонку с 75 мл силикагеля и колонку элюировали, при этом получили фракцию, содержащую дибензоилциклопентенон. Растворитель этой фракции выпарили в вакууме, остаток растворили в этаноле и отделили посредством тонкослойной силикагель-хроматографии с применением в качестве проявительного растворителя смеси хлороформа и метанола 99:1. С тонкого слоя соскребли силикагель,соответствующий Rf = 0,450,55, затем осуществили экстракцию хлороформом, при этом получили 3,2 мг дибензоилциклолентенона. Структурный анализ образованного дибензоилциклопентенона посредством масс-анализа и ЯМР осуществили тем же самым способом,который описан в вышеприведенном примере 1(2). Результаты приведены ниже.(1H, m, H-4), 6.54 (1H, d-d, J=1.5, 6.5 Hz, H-2),7.44 (H of 4H, m, аром. кольцо), 7.58 (H of 2 Н,m, аром. кольцо), 7.64 (1H, d-d, J=2.0, 6.5 Hz, H3), 8.06 (H of 4H, m, аром. кольцо). Фиг. 3 показывает масс-спектр дибензоилциклопентенона и фиг. 4 показывает спектр 1HЯМР дибензоилциклопентенона. На фиг. 3 на оси абсцисс показано значение m/z, тогда как на оси ординат показана относительная интенсивность (%). На фиг. 4 на оси абсцисс показано значение химического сдвига (млн. дол.) тогда как на оси ординат показана интенсивность сигнала.DMAP и 80,3 мг DCC осуществили такую же реакцию, которая описана в вышеприведенном примере 1-(5), при этом получили 19,2 мг дибензоил (-)-циклопентенона. Структурный анализ образованного осуществили посредством масс-анализа и ЯМР тем же самым способом,который описан в вышеприведенном примере 1(5), и получили такие же результаты, как и в примере 1-(5).DMAP и 74,3 мг DCC осуществили такую же реакцию, которая описана в вышеприведенном примере 1-(5), при этом получили 21,4 мг дибензоил (+)-циклопентенона. Структурный анализ образованного осуществили посредством масс-анализа и ЯМР тем же самым способом,который описан в вышеприведенном примере 1(5) и получили такие же результаты, как в примере 1-(5).(8) Циклопентенон (30 мг), 10 мг DMAP и 153 мг гексановой кислоты (070-26, производимой Nacalai Tesque), растворили в 5,9 мл дихлорметана и затем при охлаждении льдом добавили 108 мг DCC. После того, как реагенты провзаимодействовали в течение одного часа,реакционный раствор отделили и очистили посредством тонкослойной силикагель-хроматографии с применением в качестве проявительного растворителя хлороформа. С тонкого слоя соскребли силикагель, соответствующий Rf = 0,30,4, затем осуществили экстракцию хлороформом, при этом получили 11 мг дигексаноилциклопентенона. Образованный дигексаноилциклопентенон растворили в CDCl3 и его образование подтвердили ЯМР. В качестве аппаратуры для измерения ЯМР применяли систему JNM-EX270 FT ЯМР (изготовленную фирмой Nippon Denshi). Что касается значений химического сдвига 1HЯМР, то значение химического сдвига тетраметилениина выразили в виде 0 ррm. Результаты представлены ниже. 1(4H, m), 1.26 (8H, m), 0.88 (6 Н, t) Фиг. 5 показывает спектр 1H-ЯМР дигексаноилциклопентенона. На фиг. 5 на оси абсцисс показано значение химического сдвига(млн. дол.) тогда как на оси ординат показана интенсивность сигнала.(9) Циклопентенон (30 мг), 10 мг DMAP и 301 мг миристиновой кислоты (МО 476, производимой Tokyo Kasei Kogyo), растворили в 5,9 мл дихлорметана и затем при охлаждении льдом добавили 108 мг DCC. После того, как реагенты провзаимодействовали в течение одного часа,реакционный раствор отделили и очистили посредством тонкослойной силикагель-хроматографии с применением в качестве проявитель 001808 18 ного растворителя хлороформа. С тонкого слоя соскребли силикагель, соответствующий Rf = 0,450,55, затем осуществили экстракцию хлороформом, при этом получили 53 мг димиристоилциклопентенона. Структурный анализ образованного димиристоилциклопентенона посредством ЯМР осуществили тем же самым способом, который описан в примере 1-(8). Результаты приведены ниже. 1Hz, H-5), 2.42 (2H, t, J=7.26 Hz), 2.38 (2H, t,J=7.91 Hz), 1.63 (4H, m), 1.26 (32H, m), 0.88 (6H,t) Фиг. 6 показывает спектр ЯМР димиристоилциклопентенона. На фиг. 6 на оси абсцисс показано значение химического сдвига (млн. дол.), тогда как на оси ординат показана интенсивность сигнала.(10) Циклопентенон (30 мг), 10 мг DMAP и 190 мг октановой кислоты (071-11, производимой Nacalai Tesque), растворили в 5,9 мл дихлорметана и затем при охлаждении льдом добавили 108 мг DCC. После того, как реагенты провзаимодействовали в течение одного часа,реакционный раствор отделили и очистили посредством тонкослойной силикагель-хроматографии с применением в качестве проявительного растворителя хлороформа. С тонкого слоя соскребли силикагель, соответствующий Rf = 0,250,35, затем осуществили экстракцию хлороформом, при этом получили 27 мг диоктаноилциклопентенона. Структурный анализ образованного диоктаноилциклопентенона посредством ЯМР осуществили тем же самым способом, который описан в примере 1-(8). Результаты приведены ниже. 1H-NMR7.44 (1H, dd, J2-3=6.1 Hz, J3-4= 2.16 Нz, H-3), 6.41 (1H, dd, J2-3=6.1 Hz, J3-4=1.48Hz, H-5), 2.42 (2H, t, J=7.59 Hz), 2.38 (2H, t,J=7.91 Hz), 1.65 (4H, m), 1.29 (16H, m), 0.88 (6H,t) Фиг. 7 показывает спектр 1H-ЯМР диоктаноилциклопентенона. На фиг. 7 на оси абсцисс показано значение химического сдвига (млн. дол.), тогда как на оси ординат показана интенсивность сигнала.(11) Циклопентенон (30 мг), 10 мг DMAP и 190 мг 3-октеновой кислоты (00070, производимой Tokyo Kasei Kogyo), растворили в 5,9 мл дихлорметана и затем при охлаждении льдом добавили 108 мг DCC. После того, как реагенты провзаимодействовали в течение одного часа,реакционный раствор отделили и очистили посредством тонкослойной силикагель-хроматографии с применением в качестве проявительного растворителя хлороформа. С тонкого слоя 19 соскребли силикагель, соответствующий Rf = 0,250,35, затем осуществили экстракцию хлороформом, при этом получили 25 мг ди-3 октеноилциклопентенона. Структурный анализ образованного ди-3 октеноилциклопентенона посредством ЯМР осуществили тем же самым способом, который описан в примере 1-(8). Результаты приведены ниже. 1(6H, t) Фиг. 8 показывает спектр 1 Н-ЯМР ди-3 октеноилциклопентенона. На фиг. 8 на оси абсцисс показано значение химического сдвига(млн. дол.), тогда как на оси ординат показана интенсивность сигнала.(12) Циклопентенон (30 мг), 10 мг DMAP и 115 мг н-масляной кислоты (ВО 754, производимой Tokyo Kasei Kogyo), растворили в 5,9 мл дихлорметана и затем при охлаждении льдом добавили 108 мг DCC. После того, как реагенты провзаимодействовали в течение одного часа,реакционный раствор отделили и очистили посредством тонкослойной силикагель-хроматографии с применением в качестве проявительного растворителя хлороформа. С тонкого слоя соскребли силикагель, соответствующий Rf = 0,200,30, затем осуществили экстракцию хлороформом, при этом получили 16 мг дибутирилциклопентенона. Структурный анализ образованного дибутирилциклопентенона посредством ЯМР осуществили тем же самым способом, который описан в примере 1-(8). Результаты приведены ниже. 1Hz, H-5). Фиг. 9 показывает спектр 1H-ЯМР дибутирилциклопентенона. На фиг. 9 на оси абсцисс показано значение химического сдвига (млн. дол.), тогда как на оси ординат показана интенсивность сигнала.(13) Циклопентенон (30 мг), 10 мг DMAP и 226 мг н-декановой кислоты (D0017, производимой Tokyo Kasei Kogyo), растворили в 5,9 мл дихлорметана и затем при охлаждении льдом добавили 108 мг DCC. После того, как реагенты провзаимодействовали в течение одного часа,реакционный раствор отделили и очистили посредством тонкослойной силикагель-хроматографии с применением в качестве проявительного растворителя хлороформа. С тонкого слоя соскребли силикагель, соответствующий Rf= 0,350,45, затем осуществили экстракцию хлороформом, при этом получили 35 мг дидеканоилциклопентенона. 20 Структурный анализ образованного дидеканоилциклопентенона посредством ЯМР осуществили тем же самым способом, который описан в примере 1-(8). Результаты приведены ниже. 1(2H, t, J=7.24 Hz), 2.38 (2H, t, J=7.91 Hz), 1.65 (4H,m), 1.26 (24H, m), 0.88(6H, t) Фиг. 10 показывает спектр 1H-ЯМР дидеканоилциклопентенона. На фиг. 10 на оси абсцисс показано значение химического сдвига(млн. дол.) , тогда как на оси ординат показана интенсивность сигнала.Kogyo) , растворили в 5,9 мл дихлорметана и смесь провзаимодействовала в течение одного часа при охлаждении льдом. Реакционный раствор проявили посредством тонкослойной силикагель-хроматографии с применением в качестве проявительного растворителя смеси хлороформа и метанола при соотношении компонентов в смеси 200:1, с тонкого слоя соскребли силикагель, соответствующий Rf = 0,70,8 и осуществили экстракцию хлороформом, при этом получили 39 мг дивалерилциклопентенона. Структурный анализ образованного дивалерилциклопентенона посредством ЯМР осуществили тем же самым способом, который описан в примере 1-(8). Результаты приведены ниже. 1Hz, H-5), 2.43 (2H, dd, J=7.59, 7.59 Hz), 2.39 (2H,dd, J=7.59, 7.59 Hz), 1.65 (4H,m), 1.38 (4H, m),0.93 (6H, dd, J=7.26, 7.26 Hz) Фиг. 11 показывает спектр 1 Н-ЯМР дивалерилциклопентенона. На фиг. 11 на оси абсцисс показано значение химического сдвига(млн. дол.), тогда как на оси ординат показана интенсивность сигнала.(15) Циклопентенон (30 мг), 16 мг DMAP,66 мг триэтиламина и 86 мг пропиового ангидрида (Р 0513, производимого Tokyo Kasei Коgуо), растворили в 5,9 мл дихлорметана и смесь провзаимодействовала в течение одного часа при охлаждении льдом. Реакционный раствор проявили посредством тонкослойной силикагель-хроматографии с применением в качестве проявительного растворителя смеси хлороформа и метанола при соотношении компонентов в смеси 200:1, с тонкого слоя соскребли силикагель, соответствующий Rf = 0,50,6 и осуществили экстракцию хлороформом, при этом получили 31 мг дипропионилциклопентенона. 21 Структурный анализ образованного дипропионилциклопентенона посредством ЯМР осуществили тем же самым способом, который описан в примере 1-(8). Результаты приведены ниже. 1(2H, dd, J=15.01, 7.59 Hz), 1.18 (6H, dd, J=7.59,7.59 Hz) Фиг. 12 показывает спектр 1H-ЯМР дипропионилциклопентенона. На фиг. 12 на оси абсцисс показано значение химического сдвига(млн. дол.), тогда как на оси ординат показана интенсивность сигнала.(16) Циклопентенон (2 г), 733 мг DMAP,4,1 мл транс-2-гексановой кислоты (НО 383,производимой Tokyo Kasei Коgуо) и 5,57 г DCC,растворили в 200 мл дихлорметана и смесь провзаимодействовала при комнатной температуре в течение двух часов. Реакционный раствор подвергли колоночной силикагель-хроматографии с применением в качестве растворителя смеси гексана и этилацетата при соотношении компонентов в смеси 8:1, получив при этом фракцию, показывающую одиночное пятно. Эту фракцию концентрировали в вакууме, при этом получили 900 мг маслянистого ди-2-гексеноилциклопентенона. Структурный анализ образованного ди-2 гексеноилциклопентенона посредством ЯМР осуществили тем же самым способом, который описан в примере 1-(8). Результаты приведены ниже. 1(1 Н, d, J=3.0 Hz, 5-H), 5.85 (2H, m, 7-H+7'-H),5.98 (1H, m, 4-H), 6.41 (1H, dd, J=1.0, 6.0 Hz, 2H), 7.04 (2H, m, 8-H+8'-H), 7.47 (1H, dd, J=2.0,6.0 Hz, 3-H) Углеродные атомы 2-гексеноильной группы, связанной с положением 5 циклопентенона,последовательно от карбонильной группы пронумеровали положениями от 6 до 11, тогда как атомы 2-гексеноильной группы, связанной с положением 4 циклопентенона, последовательно от карбонильной группы пронумеровали положениями от 6' до 11'. Фиг. 13 показывает спектр 1H-ЯМР ди-2 гексеноилциклопентенона. На фиг. 13 на оси абсцисс показано значение химического сдвига(млн. дол.), тогда как на оси ординат показана интенсивность сигнала. Пример 2.(1) Каждый из 1 мМ этанольных растворов диацетилциклопентенона, диацетил (-)-циклопентенона, диацетил (+)-циклопентенона, дибензоил (-)-циклопентенона, дибензоил (+)циклопентенона, дигексаноилциклопентенона,димиристоилциклопентенона, диоктаноилцик 001808 22 лопентенона,ди-3-октеноилциклопентенона,дибутирилциклопентенона, дидеканоилциклопентенона, дивалерилциклопентенона, дипропионилциклопентенона и ди-2-гексеноилциклопентенона дибензоилциклопентена, разбавили 70% водным раствором этанола. Каждые 5 мл разбавленных растворов поместили в ячейку, содержащую пластину микротитратора с 96-ю лунками, и сушили воздухом, затем в каждую лунку добавили 100 мкл 10% плодной бычьей сыворотки, содержащей среду RPMI 1640, содержащую 5000 клеток HL60 (АТСС CCL-240) и после этого осуществили инкубацию при 37 С в присутствии 5% диоксидиуглеродного газа в течение 48 ч. Под оптическим микроскопом наблюдали формы клеток,затем добавили 10 мкл фосфорнокислого буферного водного раствора хлорида натрия, содержащего 5 г/мл 3-(4,5-диметилтиазол-2-ил)2,5-дифенилтетразолийбромида (ММТ), смесь инкубировали в течение более четырех часов и под микроскопом наблюдали состояние роста клеток. Добавили 100 мкл 2-пропанола, содержащего 0,04 н. НСl, смесь хорошо перемешали,измерили поглощающую способность при 590 нм и определили ее как степень роста клеток. Минимальную концентрацию производного циклопентенона, содержащегося в лунке, при которой не были обнаружены живые клетки,определили как концентрацию, ингибирующую рост клеток. Результаты представлены в таблице 1. Название вещества Диацетилциклопентенон Диацетил (-)-циклопентенон Диацетил (+)-циклопентенон Дибензоилциклопентенон Дибензоил (-)-циклопентенон Дибензоил (+)-циклопентенон Дигексаноилциклопентенон Димиристоилциклопентенон Диоктаноилциклопентенон Ди-3-октеноилциклопентенон Дибутирилциклопентенон Дидеканоилциклопентенон Дивалерилциклопентенон Дипропионилциклопентенон Ди-2-гексеноилциклопентенон Таблица 1 Концентрация, ингибирующая рост клеток (м) 3,9 3,9 3,9 7,7 7,7 7,7 3,0 187 9,8 5,0 3,4 17,2 6,2 3,8 6,2 При каждой из концентраций, ингибирующих рост клеток, в клетках продуцировались апоптические тела. Оптически активные вещества этих соединений фактически показали подобное действие, ингибирующее рост клеток,а также действие, вызывающее апоптоз. Пример 3. В чувствительной бульонной среде (производимой Nissui) (семенная культура) в течение всей ночи инкубировали Staphylococcus aureus ЗА (NCTC 8319; испытуемый микроорганизмIFO 3081 (испытуемый микроорганизм (3. Измерили поглощательную способность при 600 нм и с помощью калибровочной кривой, показывающей отношение между количеством живых клеток и поглощательной способностью при 600 нм, сосчитали количество живых клеток. Инкубированную жидкость разбавили свежим чувствительным бульоном до степени 1 х 106 клеток/мл и затем каждые 180 мкл поместили в каждую лунку пластины микротитратора,содержащей 96 лунок. В каждую из лунок поместили по 20 мкл из каждого водного раствора дигексаноилциклопентенона, полученного в примере 1-(8), с концентрацией 2000 мкг/мл,1000 мкг/мл, 500 мкг/мл, 250 мкг/мл, 125 мкг/мл и 62,5 мкг/мл или воду и в течение всей ночи при 37 С выращивали стационарную культуру(основная культура). Тем временем, часть семенной культуральной жидкости разбавили стерилизованной водой, нанесли на чашку с агаровой средой, содержащей чувствительный бульон, инкубировали в течение всей ночи при 37 С и для определения точного количества живых клеток сосчитали количество колоний. Инкубированную жидкость каждой лунки после разбавления основной культуры стерилизованной водой нанесли на чашку с агаровой средой, содержащей чувствительный бульон,инкубировали в течение всей ночи при 37 С и для определения точного количества живых клеток сосчитали количество колоний. Минимальную концентрацию, при которой количество живых клеток меньше по сравнению с количеством таких клеток в лунке, в которую добавили воду, определили как концентрацию,ингибирующую рост, тогда как минимальную концентрацию, при которой количество живых клеток меньше по сравнению с количеством таких клеток при исходном состоянии основной культуры, определили как стерилизующую концентрацию. Результаты представлены в табл. 2. Данные, приведенные в табл. 2, представляют собой концентрации дигексаноилциклопентенона, показывающие действие, ингибирующее рост испытуемых микроорганизмов, и стерилизующее действие в отношении испытуемых микроорганизмов (1)(3), выраженные в мкг/мл. Концентрация, ингибирующая рост Испытуемый микроорганизм Из вышеприведенных результатов следует,что дигексаноилциклопентенон обладает сильнодействующей антибактериальной активностью. Полученные в примере 1 другие соедине 24 ния и из оптически активные вещества тоже показали такую же антибактериальную активность, какую имеет дигексаноилциклопентенон. Пример 4. Препараты для инъекций.(1) Для получения препарата для инъекций к физиологическому раствору с концентрацией 1% (такому же, который приведен выше) добавили диацетилциклопентенон или дигексаноилциклопентенон.(2) Для получения препарата для инъекций к физиологическому раствору с концентрацией 0,5% и 0,1% (такому же, который приведен выше) добавили соответственно дибензоилциклопентенон или дибутирилциклопентенон. Пример 5. Таблетки.(1) Для производства препарата в виде таблеток получили таблетку, содержащую 100 мг дибензоилциклопентенона и соответствующее количество микрокристаллической целлюлозы и покрыли ее сахаром.(2) Для производства препарата в виде таблеток получили таблетку, содержащую 0,1 мг диацетил (-)-циклопентенона, 10 мг дикалийглициргизината и соответствующее количество микрокристаллической целлюлозы. Достоинства изобретения Настоящее изобретение предлагает способ производства производного циклопентенона,его оптически активного вещества или его соли,которые проявляют физиологические активности, например противораковую активность, активность, ингибирующую рост раковых клеток,активность, вызывающую апоптоз, антибактериальную активность и т.д. Лекарственный препарат, в котором применяют в качестве эффективного компонента соединение, полученное настоящим изобретением, является лекарственным препаратом, в особенности пригодным для сохранения гомеостаза живого организма. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Производное циклопентенона, представленное следующей общей формулой I, рацемат или чистый антипод его где R1 и R2 являются одинаковыми или разными и каждый из них является алкильной группой с прямой или разветвленной цепью, содержащей не более 13 атомов углерода, алкенильной группой с прямой или разветвленной цепью, содержащей не более 13 атомов углерода, фенильной группой или фенилалифатической группой, при условии, что такой случай, когда R1 = R2 = -СН 3 исключен. 2. Лекарственный препарат, который характеризуется тем, что он содержит в качестве эффективного компонента, по меньшей мере, 25 одно соединение производного циклопентенона по п.1. 3. Лекарственный препарат по п.2, который представляет собой противораковое средство. 4. Лекарственный препарат по п.2, который представляет собой апоптоз-индуцирующее средство. 5. Лекарственный препарат по п.2, который представляет собой противомикробное средство. 6. Способ получения производного циклопентенона, представленного формулой где R3 и R4 являются одинаковыми или разными и каждый из них является алкильной группой с прямой или разветвленной цепью, содержащей не более 13 атомов углерода, алкенильной группой с прямой или разветвленной цепью, содержащей не более 13 атомов углерода, фенильной группой или фенилалифатической группой, отличающийся тем,что 4,5-дигидрокси-2 циклопентен-1-он, представленный следующей формулой Фиг. 2 и/или его оптически активное производное подвергают взаимодействию или одновременно,или последовательно с карбоновой кислотой и/или ее реакционно-способным производным сR3 и R4, соответствующими производному циклопентенона, представленному следующей формулой [II]. 7. Лекарственный препарат, отличающийся тем, что он содержит в качестве эффективного компонента, по меньшей мере, одно соединение,выбранное из производного циклопентенона,полученного способом по п.6, или его оптически активного вещества, соли. 8. Лекарственный препарат по п.7, который представляет собой противораковое средство. 9. Лекарственный препарат по п.7, который представляет апоптоз-индуцирующее средство. 10. Лекарственный препарат по п.7, который представляет собой противомикробное средство.
МПК / Метки
МПК: C07C 69/28, A61K 31/215, A61P 35/00
Метки: производные, циклопентенона
Код ссылки
<a href="https://eas.patents.su/16-1808-proizvodnye-ciklopentenona.html" rel="bookmark" title="База патентов Евразийского Союза">Производные циклопентенона</a>
Предыдущий патент: Система и устройство для обмена данными (варианты) и способ связи
Следующий патент: Гемисульфат карбоциклического нуклеозида и его применение при лечении вирусных инфекций
Случайный патент: Способ детекции нуклеотидного полиморфизма












