Тиенотриазолодиазепиновые соединения и лекарственное средство
Номер патента: 1732
Опубликовано: 27.08.2001
Авторы: Суеока Хироюки, Кобаяси Харухито, Комацу Хироцугу, Ехара Сюдзи
Формула / Реферат
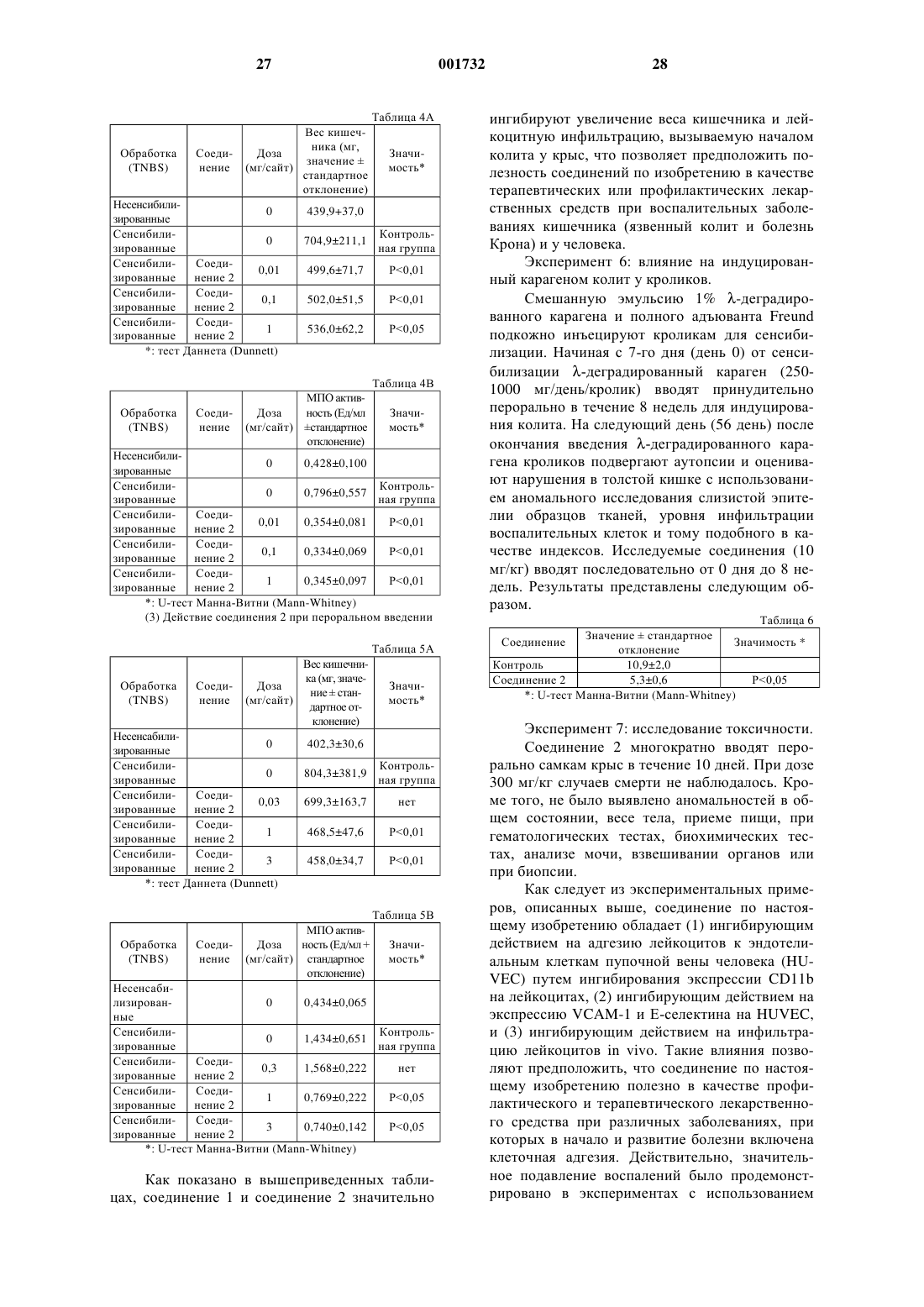
1. Тиенотриазолодиазепиновое соединение формулы (1)
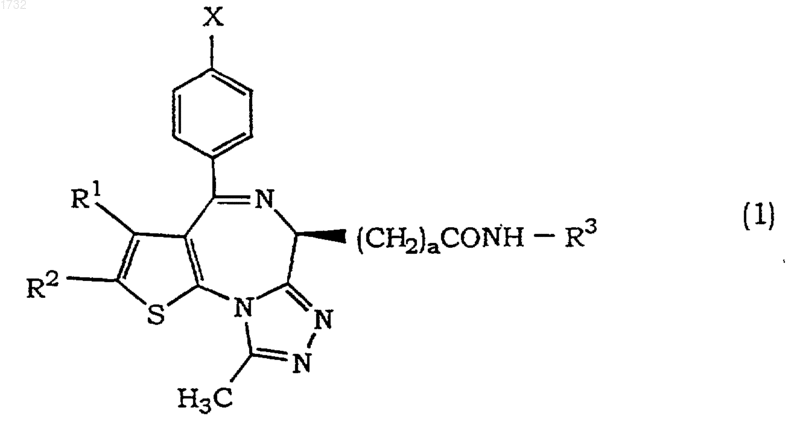
где Х представляет собой галоген;
R1 представляет собой алкил, имеющий 1-4 атома углерода;
R2 представляет собой алкил, имеющий 1-4 атома углерода;
а равен 1;
R3 представляет собой алкил, имеющий 1-4 атома углерода, гидроксиалкил, имеющий 1-4 атома углерода, алкокси, имеющий 1-4 атома углерода, фенил, необязательно имеющий заместитель, или пиридил, необязательно имеющий заместитель,
его фармацевтически приемлемая соль или его гидрат.
2. Тиенотриазолодиазепиновое соединение по п.1, где в формуле (1) Х представляет собой хлор и R1 и R2 оба представляют собой метил, его фармацевтически приемлемая соль или его гидрат.
3. Тиенотриазолодиазепиновое соединение по п.1, где соединение формулы (1) представляет собой (S)-2-[4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил]-N-(4-гидроксифенил)ацетамид, его фармацевтически приемлемую соль или его гидрат.
4. (S)-2-[4-(4-хпорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил]-N-(4-гидроксифенил)ацетамид дигидрат.
5. Лекарственное средство, содержащее тиенотриазолодиазепиновое соединение формулы (1)
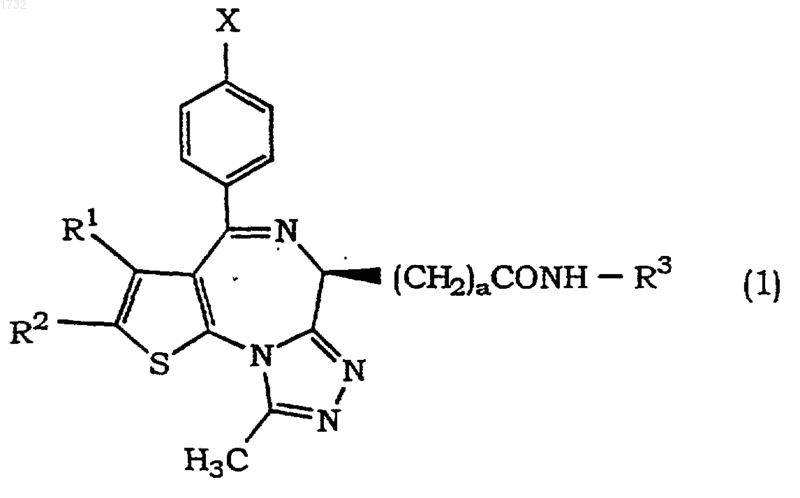
где Х представляет собой галоген;
R1 представляет собой алкил, имеющий 1-4 атома углерода;
R2 представляет собой алкил, имеющий 1-4 атома углерода;
а равен 1;
R3 представляет собой алкил, имеющий 1-4 атома углерода, гидроксилалкил, имеющий 1-4 атома углерода, алкокси, имеющий 1-4 атома углерода, фенил, необязательно имеющий заместитель, или пиридил, необязательно имеющий заместитель,
его фармацевтически приемлемую соль или его гидрат.
6. Лекарственное средство по п.5, содержащее тиенотриазолодиазепиновое соединение формулы (1), где Х представляет собой хлор и R1 и R2 оба представляют собой метил, его фармацевтически приемлемую соль или его гидрат.
7. Лекарственное средство по п.5, где соединение формулы (1) представляет собой (S)-2-[4-(4-xлopфeнил)-2,3,9-тpимeтил-6H-тиeнo[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил]-N-(4-гидроксифенил)ацетамид.
8. Лекарственное средство по п.5, которое представляет собой терапевтический агент при воспалительном заболевании кишечника.
9. Лекарственное средство по п.5, которое представляет терапевтический агент при язвенном колите.
10. Лекарственное средство по п.5, которое представляет терапевтический агент при болезни Крона.
11. Лекарственное средство, содержащее (S)-2-[4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил]-N-(4-гидроксифенил)ацетамид дигидрат.
12. Лекарственное средство по п.11, которое представляет терапевтический агент при воспалительном заболевании кишечника.
13. Лекарственное средство по п.11, которое представляет терапевтический агент при язвенном колите.
14. Лекарственное средство по п.11, которое представляет терапевтический агент при болезни Крона.
Текст
1 Область техники Настоящее изобретение относится к новым тиенотриазолодиазепиновым соединениям, обладающим сильным ингибирующим действием на клеточную адгезию и которые полезны в качестве терапевтического лекарственного средства при воспалительных заболеваниях кишечника, таких как язвенный колит, болезнь Крона и тому подобных, и к их фармацевтическому применению. Предшествующий уровень техники В международной публикацииWO 89/05812 и не прошедшей экспертизы публикации патента Японии 223290/1991 описаны тиенодиазепиновые соединения, обладающие антагонистическим действием к ССК или антагонистическим действием к гастрину; в международной публикацииWO 93/07129 описано тиенотриазолодиазепиновое соединение, используемое в качестве терапевтического агента при остеопорозе; и в международных публикацияхWO 93/12177, WO 94/06082 и WO 94/22872 раскрываются тиенотриазолодиазепиновые соединения, обладающие ингибирующим действием на клеточную адгезию. В не прошедшей экспертизы публикации патента Японии 243691/1990 описано тиенотриазолодиазепиновое соединение, обладающее ингибирующей активностью для тромбоцитактивирующего фактора (ТАФ). Раскрытые в примерах соединения имеют либо заместитель в 2-положении тиофена, либо циклоалкан, образованный сочетанием 2-положения и 3 положения, и фенил, имеющий хлор в ортоположении (2-положение), т.е. 2-хлорфенил в 4 положении, 6-положение в этих соединениях замещено метилом, гидроксилом, карбоксиалкилом, гидроксиалкилом, алкоксикарбонилом,алкоксикарбонилалкилом, морфолинокарбонилэтилом и тому подобными. Среди них соединение по примеру 8, имеющее структуру следующей формулы (А), известно как соединение,имеющее амид в 6-положении. При различных воспалениях и аллергических заболеваниях инфильтрация так называемых воспалительных клеток (лейкоциты в широком смысле), таких как полиморфоядерные лейкоциты, макрофаги и лимфоциты, глубоко связана с симптомами заболевания. Прогресс последнего времени в молекулярной биологии дал возможность идентификации молекул, связанных с адгезией, и показал им функциональную значимость, то есть были прояснены явление адгезии лейкоцитов за счет определенных адгезионных молекул, экспрессируемых на со 001732 2 судистых эндотелиальных клетках, и адгезии молекул на лейкоцитах, которые специфически связываются с указанными молекулами с последующей инфильтрацией лейкоцитов в воспалительные клетки. В связи с заболеваниями, сообщалось о промотированных экспрессиях ICAM-1 (межклеточная адгезионная молекула-1) и Е-селектина в места воспалений при автоиммунных заболеваниях, таких как воспалительные кожные заболевания (например, контактный дерматит, световая сыпь, вызываемая высокой фоточувствительностью и так далее) и хронический ревматоидный артрит, и было предложено участие VCAM-1 (сосудистая клеточная адгезионная молекула-1), ICAM-1 и Мас-1 при астме. Также сообщалось, что клеточная адгезия черезICAM-1 играет важную роль в отторжении трансплантата после трансплантации органа, и что адгезионные молекулы связаны с метастазами опухолей. Недавние исследования установили, что клеточные адгезионные молекулы, такие как Мас-1, Е-селектин, VCAM-1 и тому подобные, глубоко связаны с началом и развитием язвенного колита, болезни Крона, нефрита и тому подобных. Более того, известно, что клеточные адгезионные молекулы глубоко вовлечены в процессы образования и развития атеросклероза, при ишемическом реперфузионном повреждении, септическом шоке и так далее. При таких обстоятельствах предполагается, что соединение, обладающее ингибирующим действием на клеточную адгезию, будет представлять собой прекрасное противовоспалительное лекарственное средство или противоаллергическое лекарственное средство. Например,Proc. Natl. Acad. Sci. U.S.A., vol.88, pp.355-359(1991) указывает, что N-(флуоренил-9-метоксикарбонил)аминокислоты подавляют реакции в различных воспалительных моделях животных путем ингибирования адгезии лейкоцитов, и выдержка из American Federation for ClinicalResearch Annual Meeting, 6 мая 1991 года, указывает, что те же серии соединений ингибируют адгезию лейкоцитов на сосудистых эндотелиальных клетках посредством ингибирования экспрессии адгезионных молекул (CD18 и тому подобных) на лейкоцитах. Как обсуждалось,предполагается, что соединения, обладающие ингибирующим действием на клеточную адгезию, будут пригодными в качестве фармацевтических агентов для профилактики и лечения вышеуказанных заболеваний и нарушений. Однако соединения, описанные в различных известных литературных источниках,включая указанные выше, не являются достаточными для оказания достаточного ингибирующего воздействия на клеточную адгезию, и желательна разработка соединения, обладающего более сильным ингибирующим действием на клеточную адгезию. 3 Язвенный колит и болезнь Крона представляют собой хронические трудноизлечимые заболевания, для которых не разработано полного излечения. Для терапии язвенного колита и болезни Крона использовали стероидные агенты, такие как преднизолон, 5-аминосалициловую кислоту (5-ASA), Салазосульфапиридин(SASP) и тому подобные. При этом стероидные агенты часто вызывают серьезные побочные эффекты, такие как луноликость, гипергликемия, повышение объема мочи, ингибирование функций коры надпочечников и тому подобные,а другие лекарственные средства не дают достаточного терапевтического эффекта. Следовательно, имеется серьезная потребность в терапевтическом агенте, способном заменить эти лекарственные средства. Также из вышеуказанных публикаций известны противоаллергический агент и противовоспалительный агент, основанные на ТАФ антагонистическом действии, терапевтический агент при панкреатите и желудочное ингибирующее лекарственное средство, основанные на антагонистическом действии к ССК и антагонистическом действии к гастрину, и терапевтические агенты при воспалительных, аллергических заболеваниях и автоиммунных заболеваниях,которые основаны на ингибирующем действии клеточной адгезии, и тому подобные, но терапевтический агент при язвенном колите или болезни Крона, основанный на ингибирующем действии клеточной адгезии, известен не был. Описание изобретения Изобретатели изыскивали соединение, обладающее сильным ингибирующим действием клеточной адгезии, с целью разработки терапевтического агента для воспалительных кишечных заболеваний, таких как язвенный колит и болезнь Крона, и установили, что оптически активное соединение формулы (1), его фармацевтически приемлемая соль или гидрат эффективно ингибируют экспрессию Mac-1 (CD11b),VCAM-1 и Е-селектина, являющихся адгезионными молекулами, ответственными за болезненные состояния при воспалительном заболевании кишечника и существенно подавляют увеличение веса кишечника, вызываемое началом колита в экспериментах с использованием модели колита на животных, что привело к завершению изобретения. Соответственно, в настоящем изобретении предложено следующее.(1) Тиенотриазолодиазепиновое соединение формулы (1)R3 представляет собой алкил, имеющий 1-4 атома углерода; гидроксиалкил, имеющий 1-4 атома углерода, алкокси, имеющий 1-4 атома углерода, фенил, необязательно имеющий заместитель, или пиридил, необязательно имеющий заместитель, его фармацевтически приемлемая соль или его гидрат.(2) Тиенотриазолодиазепиновое соединение (1) выше, где в формуле (1) Х представляет собой хлор, и R1 и R2 оба представляют собой метил, его фармацевтически приемлемая соль или его гидрат.(3) Тиенотриазолодиазепиновое соединение (1) выше, где соединение формулы (1) представляет собой (S)-2-[4-(4-хлорфенил)-2,3,9 триметил-6 Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил]-N-(4-гидроксифенил)ацетамид, его фармацевтически приемлемая соль или его гидрат.(5) Лекарственное средство, содержащее тиенотриазолодиазепиновое соединение формулы (1)R3 представляет собой алкил, имеющий 1-4 атома углерода; гидроксиалкил, имеющий 1-4 атома углерода, алкокси, имеющий 1-4 атома углерода, фенил, необязательно имеющий заместитель, или пиридил, необязательно имеющий заместитель, его фармацевтически приемлемая соль или его гидрат.(6) Лекарственное средство согласно (5) выше, содержащее тиенотриазолодиазепиновое соединение формулы (1), где Х представляет собой хлор, и R1 и R2 оба представляют собой метил, его фармацевтически приемлемую соль или его гидрат.(7) Лекарственное средство согласно (5) выше, где соединение формулы (1) представляет собой(8) Лекарственное средство согласно (5) выше, которое является терапевтическим агентом для лечения воспалительного заболевания кишечника.(9) Лекарственное средство согласно (5) выше, которое является терапевтическим агентом для лечения язвенного колита.(10) Лекарственное средство согласно (5) выше, которое является терапевтическим агентом для лечения болезни Крона.(12) Лекарственное средство согласно (11) выше, которое является терапевтическим агентом для лечения воспалительного заболевания кишечника.(13) Лекарственное средство согласно (11) выше, которое является терапевтическим агентом для лечения язвенного колита.(14) Лекарственное средство согласно (11) выше, которое является терапевтическим агентом для лечения болезни Крона. Соединение по настоящему изобретению характеризуется наличием заместителя, имеющего амидную связь, представленного формулой-(CH2)aCONH-R3 в 6-положении подобно формуле (1) и определенной конфигурацией (S конфигурацией) заместителя. Кроме того, сочетание заместителей в 2-, 3-и 9-положениях, являющихся алкилами,такими как метил, и заместитель в 4-положении,представляющий собой 4-галогенфенил, имеющий галоген в пара-положении, является важным. Задача настоящего изобретения впервые была достигнута посредством тиенотриазолодиазепинового соединения, имеющего такое сочетание заместителей в 2-, 3-, 4-, 6- и 9 положениях. В формуле (1) каждый символ означает следующее. Галоген в Х представляет собой хлор, бром, фтор или иод, предпочтительным является хлор. Алкил, имеющий 1-4 атома углерода, в R1, R2 и R3 представляет собой метил,этил, пропил, изопропил, бутил, изобутил, вторбутил или трет-бутил, предпочтительно метил. Гидроксиалкил,имеющий 1-4 атома углерода, в 6 тельно имеющий, в качестве заместителя, один или два из галогена (например, хлор, бром, фтор и тому подобные), алкила, имеющего 1-4 атома углерода (например, метил, этил и тому подобные), гидрокси, гидроксиалкила, имеющего 1-4 атома углерода (например, гидроксиметил, гидроксиэтил и тому подобные), амино и нитро, и примерами которого являются 4-гидроксифенил, 4-аминофенил, 3-хлорфенил и тому подобные. Пиридил, необязательно имеющий заместитель, в определении радикала R3 представляет пиридил, имеющий, в качестве заместителя, 1 или 2 из галогена (например, хлор, бром,фтор и тому подобные), алкила, имеющего 1-4 атома углерода (например, метил, этил и тому подобные), гидрокси, амино, нитро и алкокси,имеющего 1-4 атома углерода (например, метокси, этокси и тому подобные), и примерами которого являются 3-пиридил, 2-метокси-3 пиридил, 4-метокси-3-пиридил, 1,2,3,4-тетрагидро-2-оксохинолин-6-ил и тому подобные. Фармацевтически приемлемые соли соединений по изобретению представляют собой,например, соли присоединения кислот с неорганической кислотой (например, хлористоводородной кислотой, бромистоводородной кислотой, серной кислотой, фосфорной кислотой и азотной кислотой) или с органической кислотой(например, уксусной кислотой, пропионовой кислотой, янтарной кислотой, гликолевой кислотой, молочной кислотой, яблочной кислотой,винной кислотой, лимонной кислотой, малеиновой кислотой, фумаровой кислотой, метансульфоновой кислотой, бензолсульфоновой кислотой, п-толуолсульфоновой кислотой и аскорбиновой кислотой) и соли с неорганическим основанием (например, гидроксидом натрия, гидроксидом калия, гидроксидом кальция, гидроксидом магния, гидроксидом цинка, гидроксидом аммония и тому подобными), органическим основанием (например, метиламином, диэтиламином, триэтиламином, дициклогексиламином,триэтаноламином, этилендиамином, трисгидроксиметиламинометаном, хинином, гуанидином, цинхонином и тому подобными) или аминокислотой (например, лизином, орнитином,аргинином, аланином и тому подобными). С точки зрения объекта настоящего изобретения эти соли, предпочтительно, являются нетоксичными. Кроме того, также включены гидраты(S)-2-[4-(4-хлорфенил)-2,3,9-триметил-6 Нтиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин 6-ил]-N-(4-гидроксифенил)ацетамид следующей формулы, и его дигидрат является наиболее предпочтительным с точки зрения стабильности. Соединение формулы (1) по настоящему изобретению может быть получено взаимодействием соединения формулы (2) с соединением формулы (3), как показано следующим уравнением реакции. где каждый символ является таким, как определено выше. Взаимодействие осуществляют в подходящем растворителе, который не ингибирует реакцию, таком как органический растворитель(например, тетрагидрофуран, диэтиловый эфир,диизопропиловый эфир, диоксан, дихлорметан,хлороформ, четыреххлористый углерод, дихлорэтан, этилацетат, бензол, толуол, ксилол, диметилформамид, диметилацетамид и диметилсульфоксид) в присутствии, когда необходимо,основания, тионилгалогенида, галогенида органической кислоты или конденсирующего агента при температуре от -60 С до температуры кипения растворителя. Примеры используемых при необходимости оснований включают гидроксиды щелочных металлов, такие как гидроксид натрия и гидроксид калия, карбонаты щелочных металлов, такие как карбонат натрия и карбонат калия, бикарбонаты щелочных металлов, такие как бикарбонат натрия и бикарбонат калия, гидриды щелочных металлов, такие как гидрид натрия,алкоксиды щелочных металлов, такие как метилат натрия и трет-бутилат калия, и органические основания, такие как триэтиламин, пиридин,пиколин и N-метилморфолин. Гидроксид щелочного металла, карбонат щелочного металла или бикарбонат щелочного металла можно использовать в двухфазной системе из вышеуказанного органического растворителя и воды с 8 использованием, когда необходимо, межфазного катализатора, такого как бромид тетрабутиламмония и иодид бензилтриэтиламмония. Примерами тионилгалогенида являются тионилхлорид и тионилбромид. Галогенид органической кислоты предпочтительно образует смешанный ангидрид кислоты вместе с карбоновой кислотой формулы (2) и представлен примерами этилхлорформиата, изобутилхлорформиата и пивалоилхлорида. Конденсирующий агент предпочтительно представляет собой агент, использующийся для амидного синтеза, и представлен примерами дициклогексилкарбодиимида (DCC), гидрохлорида N-этил-N'-(диметиламинопропил)карбодиимида (WSC), дифенилфосфорилазида (DPPA), иодида N-метил-2 хлорпиридиния, гексафторфосфата бензотриазол-1-ил-окси-трис(диметиламино)фосфония(реагент Вор), хлорида 2-хлор-1,3-диметилимидазолиния и молекулярными ситами. Полученные таким образом соединения (1) по настоящему изобретению могут быть выделены из реакционных смесей и очищены известными в данной области способами, такими как перекристаллизация и колоночная хроматография. Для получения солей традиционным способом соединения формулы(1) обрабатывают неорганической кислотой (например, хлористоводородной кислотой,бромистоводородной кислотой, серной кислотой, фосфорной кислотой и азотной кислотой,органической кислотой (например, уксусной кислотой, пропионовой кислотой, янтарной кислотой, гликолевой кислотой, молочной кислотой, яблочной кислотой, винной кислотой, лимонной кислотой, малеиновой кислотой, фумаровой кислотой, метансульфоновой кислотой,бензолсульфоновой кислотой, п-толуолсульфоновой кислотой и аскорбиновой кислотой), неорганическим основанием (например, гидроксидом натрия, гидроксидом калия, гидроксидом кальция, гидроксидом магния, гидроксидом цинка и гидроксидом аммония), органическим основанием (например, метиламином, диэтиламином, триэтиламином, дициклогексиламином,триэтаноламином, этилендиамином, трисгидроксиметиламинометаном, хинином, гуанидином и цинхонином) или аминокислотой (например, лизином, орнитином, аргинином и аланином). Соединение формулы (2) может быть получено следующим образом. Соединение формулы (4) 9 где каждый символ является таким, как определено выше, взаимодействует с диалкилкарбонатом, таким как диэтилкарбонат и диметилкарбонат, в присутствии основания, такого как, этилат натрия, метилат натрия, гидрид натрия, трет-бутилат калия, диизопропиламид лития и бутиллитий, для введения в 6-положение алкоксикарбонила, такого как этоксикарбонил и метоксикарбонил, и взаимодействует с галогенэфиром формулы (5)Q-(CH2)aCOOR4 (5) где Q представляет собой галоген, такой как хлор и бром, и R4 представляет собой алкил,такой как метил и этил, с получением соединения формулы (6) где R5 представляет собой алкил, такой как метил и этил, и другие символы являются такими,как определено выше. Соединение формулы (6) подвергают гидролизу в воде или смешанном растворителе из воды и подходящего растворителя (например,метанол, этанол, тетрагидрофуран и диоксан) в присутствии основания, такого как гидроксид лития, гидроксид натрия, гидроксид калия, карбонат натрия, карбонат калия, бикарбонат натрия и гидроксид бария, при температуре от 0 С до температуры кипения используемого растворителя и далее подвергают декарбоксилированию путем подкисления реакционной системы с использованием кислоты, такой как хлористоводородная кислота, серная кислота, уксусная кислота, бромистоводородная кислота, трифторуксусная кислота и трифторметансульфоновая кислота, при этом получают соединение формулы (7) где каждый символ является таким, как определено выше. Из соединения формулы (6), в зависимости от условий гидролиза, может быть получено соединение формулы (8) где каждый символ является таким, как определено выше, который представляет собой промежуточное соединение для соединения формулы(7). Соединение формулы (7) может быть получено непосредственно взаимодействием соединения формулы (4) с соединением формулы(5) в инертном растворителе, таком как тетрагидрофуран, диоксан, диэтиловый эфир, бензол,толуол и диметилформамид, в присутствии основания (например, гидроксида натрия, третбутилата калия, диизопропиламида лития и бутиллития) при температуре от -50 С до 0 С и гидролизом получаемого соединения. Оптически активные соединения формулы(7) могут быть получены, например, следующими способами. Способ А Соединение формулы (7) или (8) конвертируют в диастереомерную соль с оптически активным амином и разделяют кристаллизацией или перекристаллизацией. Примеры оптически активных аминов для образования соли включают (1R,2S)-(-)-2 амино-1,2-дифенилэтанол, (1S,2R)-(+)-2-амино 1,2-дифенилэтанол,D-(-)-аргинин,L-(+)аргинин, бруцин, цинхонин, цинхонидин, (+)дегидробиэтиламин, L-(+)-лизин, (R)-(+)-1-(1 нафтил)этиламин, (S)-(-)-1-(1-нафтил)этиламин,(R)-(+)-1-фенэтиламин, (S)-(-)-1-фенэтиламин,хинин, и стрихнин, и кристаллизацию осуществляют в растворителе, таком как метанол, этанол, 1-пропанол, 2-пропанол, ацетон, этилацетат и ацетонитрил. Полученное таким образом оптически активное соединение формулы (8) подвергают гидролизу в воде или в смешанном растворителе из воды и подходящего растворителя(например, метанол, этанол, тетрагидрофуран и диоксан) в присутствии основания, такого как гидроксид лития, гидроксид натрия, гидроксид калия, карбонат натрия, карбонат калия, бикарбонат натрия и гидроксид бария, при температуре от 0 С до температуры кипения используемого растворителя и далее подвергают декарбоксилированию с использованием кислоты,такой как хлористоводородная кислота, серная кислота, бромистоводородная кислота, лимонная кислота, уксусная кислота, трифторуксусная кислота и трифторметансульфоновая кислота,при этом может быть получено оптически активное соединение формулы (7). 11 Способ (В) Соединение формулы (7) или (8) превращают в диастереомерный сложный эфир с оптически активным спиртом и разделяют. Соединение формулы (7) или (8) этерифицируют оптически активным спиртом, таким как (R)-(-)-2-бутанол, (S)-(+)-2-бутанол, (+)ментол, (-)-ментол, (R)-(+)-1-фенилэтанол и (S)(-)-1-фенилэтанол традиционным способом; разделяют колоночной хроматографией, перекристаллизацией и тому подобными; и подвергают гидролизу в воде или в смешанном растворителе из воды и подходящего растворителя(например, метанол, этанол, тетрагидрофуран и диоксан) в присутствии основания, такого как гидроксид лития, гидроксид натрия, гидроксид калия, карбонат натрия, карбонат калия, бикарбонат натрия и гидроксид бария, при температуре от 0 С до температуры кипения используемого растворителя. В случае соединения формулы (8), соединение дополнительно подвергают декарбоксилированию с использованием кислоты, такой как хлористоводородная кислота, серная кислота, бромистоводородная кислота, лимонная кислота, уксусная кислота,трифторуксусная кислота и трифторметансульфоновая кислота, при этом может быть получено оптически активное соединение формулы (7). Способ (С) Соединение формулы (6), (7) или (8) превращают в диастереомерную соль с оптически активной сульфоновой кислотой и разделяют кристаллизацией или перекристаллизацией. Примеры оптически активной сульфоновой кислоты для получения соли включают (+)10-камфорсульфоновую кислоту, (-)-10-камфорсульфоновую кислоту, (+)-3-бромкамфор-8 сульфоновую кислоту и (-)-3-бромкамфор-8 сульфоновую кислоту. Кристаллизацию осуществляют в растворителе, таком как метанол, этанол, 1-пропанол, 2-пропанол, ацетон, этилацетат и ацетонитрил. Полученное таким образом оптически активное соединение формулы (6) или(8) подвергают гидролизу в воде или в смешанном растворителе, состоящем из воды и подходящего растворителя (например, метанол, этанол, тетрагидрофуран и диоксан) в присутствии основания, такого как гидроксид лития, гидроксид натрия, гидроксид калия, карбонат натрия,карбонат калия, бикарбонат натрия и гидроксид бария при температуре от 0 С до температуры кипения, используемого растворителя, и далее подвергают декарбоксилированию с использованием кислоты, такой как хлористоводородная кислота, серная кислота, бромистоводородная кислота, лимонная кислота, уксусная кислота,трифторуксусная кислота и трифторметансульфоновая кислота, при этом может быть получено оптически активное соединение формулы (7). Вышеуказанное соединение формулы (4) синтезируют следующим образом. где каждый символ является таким, как определено выше, полученное с использованием соединения формулы (9) где каждый символ является таким, как определено выше, способом, описанным в публикациях, не прошедших экспертизы патентов Японии 79185/1989 и 156982/1989, и соединение формулы (11)(11) взаимодействуют, при этом получают соединение формулы (4). Альтернативно, соединение формулы (12) где каждый символ является таким, как определено выше, полученное взаимодействием соединения формулы (10) с гидразингидратом,взаимодействует с уксусной кислотой формулы(13) ее реакционноспособным производным или соединением формулы (14) Н 3 СС(ОR6)3(14) 6 где R представляет собой алкил, такой как метил и этил, при этом получают соединение формулы (4). Взаимодействие между соединением формулы (10) и соединением формулы (11) обычно протекает в растворителе, инертном к реакции(например, бензол, толуол, ксилол, тетрагидрофуран, диоксан и их смешанный растворитель),в присутствии органической кислоты (например, уксусная кислота и пропионовая кислота),неорганической кислоты (например, хлористоводородная кислота и серная кислота) или силикагеля при температуре от комнатной до температуры кипения используемого растворителя в течение от 30 мин до 5 ч. Взаимодействие между соединением формулы (10) и гидразингидратом обычно протекает в растворителе, инертном к реакции (например, метанол, этанол, про 13 панол, изопропиловый спирт и бутанол) при 040 С в течение от примерно 5 мин до 3 ч. Взаимодействие между соединением формулы (12) и соединением формулы (13), его реакционноспособным производным или соединением формулы (14) протекает в растворителе,инертном к реакции (например, бензол, толуол,ксилол, тетрагидрофуран, диоксан и их смешанный растворитель), в присутствии органической кислоты (например, уксусная кислота и пропионовая кислота), неорганической кислоты (например, хлористоводородная кислота и серная кислота) или силикагеля при температуре от комнатной до температуры кипения используемого растворителя в течение от 30 мин до 6 ч с использованием, когда необходимо, ловушки Дина-Старка. Соединение формулы (1) по настоящему изобретению, полученное, как указано выше, и содержащий его фармацевтический агент полезны в качестве терапевтического агента, профилактического лекарственного средства или рецидивного профилактического лекарственного средства при воспалительных заболеваниях кишечника, вызываемых клеточной адгезией,таких как язвенный колит и болезнь Крона, у млекопитающих, включая человека, обезьяну,корову, лошадь, собаку, кошку, кролика, крысу и тому подобных. Соединение по изобретению может использоваться для профилактики и лечения венозной недостаточности и венозных язв или для поддержания ремиссии при обоих заболеваниях. При использовании соединения по изобретению в качестве фармацевтического агента соединение по изобретению смешивают с фармацевтически приемлемыми носителями (например, эксципиентами, связующими веществами, дезинтеграторами, нейтрализующими добавками, корригентами, эмульгирующими агентами, разбавителями и солюбилизирующими добавками) с получением фармацевтической композиции или фармацевтического препарата(например, таблетки, пилюли, капсулы, гранулы, порошки, сиропы, эмульсии, эликсиры, суспензии, растворы, инъекции, препараты для переливания и суппозитории), которые могут вводиться пациентам перорально или парентерально. Из фармацевтической композиции может быть обычными способами составлена рецептура фармацевтического препарата. В настоящем описании под парентеральным введением подразумевается подкожная инъекция, внутривенная инъекция, внутримышечная инъекция, интраперитонеальная инъекция, переливание и тому подобное. Препарат для инъекции, такой как стерильная водная или масляная суспензии для инъекции, может быть получен способом,известным в данной области с использованием подходящего диспергирующего агента, смачивающего агента и суспендирующего агента. 14 Стерильный препарат для инъекции может быть стерильным инъецируемым раствором (например, водным раствором) или суспензией в разбавителе или растворителе, который нетоксичен и применяется для парентерального введения. Примеры подходящих наполнителей и растворителей включают воду, раствор Рингера, изотонический солевой раствор и тому подобные. Кроме того, в качестве растворителя или суспендирующего растворителя может обычно использоваться стерильное нелетучее масло. С этой целью может использоваться любое нелетучее масло или жирная кислота, и их примеры включают природное, синтетическое или полусинтетическое липидное масло или жирную кислоту и природные, синтетические или полусинтетические моно-, ди- или триглицериды. Суппозитории для ректального введения могут быть получены при смешении лекарственного средства с подходящим нераздражающим наполнителем, таким как масло какао и полиэтиленгликоли, которые являются твердыми при нормальной температуре и жидкими при температуре кишечника, и которые расплавляются в прямой кишке с высвобождением лекарственного средства. Твердая лекарственная форма для перорального введения может представлять собой,например, порошок, гранулу, таблетку, пилюлю или капсулу, упомянутые выше. В этих лекарственных формах активное соединение может быть смешано, по меньшей мере, с одной добавкой, такой как сахароза, лактоза, целлюлозный сахар, маннит, мальтит, декстран, крахмалы, агар, альгинаты, хитины, хитозаны, пектины, трагант, гуммиарабик, желатины, коллагены, казеин, альбумин, синтетические или полусинтетические полимеры и глицерины. Продукт,имеющий такую лекарственную форму, обычно может дополнительно содержать различные добавки, такие как инертные разбавители, смазки, такие как стеарат магния, консерванты, такие как п-гидроксибензоат натрия и сорбиновые кислоты, антиоксиданты, такие как аскорбиновая кислота, -токоферол и цистеин, дезинтеграторы, связующие вещества, загустители, буферы, подсластители, вкусовые добавки, отдушки и тому подобное. Таблетки и пилюли,кроме того, могут быть дополнительно покрыты энтеросолюбильной оболочкой. Жидкий препарат для перорального введения представлен примерами фармацевтически приемлемых эмульсии, сиропа, эликсира, суспензии, раствора и тому подобными, которые могут содержать инертный разбавитель, обычно используемый в данной области, такой как вода. Доза определяется в соответствии с возрастом, весом тела, общим состоянием здоровья, полом, диетой, временем введения, путем введения, скоростью выделения, сочетанием лекарственных препаратов, болезненным состоянием подвергаемого лечению пациента и 15 другими факторами. Соединение по изобретению, его фармацевтически приемлемая соль и его гидрат обладают низкой токсичностью и могут использоваться безопасно. Дневная доза,которая изменяется в соответствии с условиями и весом тела пациента, типом соединения, путем введения и тому подобным, составляет примерно 0,1-500 мг/пациент/день в случае подкожного, внутривенного, внутримышечного или внутриректального введения, и примерно 0,5-1000 мг/пациент/день для перорального введения. Настоящее изобретение далее описано более подробно со ссылкой на примеры получения исходных материалов, примеры, примеры составов и экспериментальные примеры, которые не ограничивают настоящее изобретение. Пример 1 получения исходного материала. 4-Хлорфенилцианометилкетон, морфолин и этилметилкетон растворяют в этаноле и суспендируют серу. Суспензию кипятят с обратным холодильником в течение 10 ч. После завершения реакции растворитель выпаривают при пониженном давлении и остаток растворяют в хлороформе. Смесь промывают водой и сушат над безводным сульфатом магния. По каплям добавляют хлорацетилхлорид и смесь кипятят с обратным холодильником в течение 1 часа. После завершения реакции полученную смесь промывают насыщенным водным раствором бикарбоната натрия и сушат над безводным сульфатом магния, и растворитель выпаривают при пониженном давлении. К остатку добавляют метанол и кристаллизуют, получая N-(2-(3(4-хлорбензоил)-4,5-диметил)тиенил)хлорацетамид. Это соединение растворяют в тетрагидрофуране и суспендируют в растворе иодид натрия. Суспензию кипятят с обратным холодильником в течение 2 ч. Реакционную смесь охлаждают до -50 С с помощью сухого льдаацетона и добавляют жидкий аммиак с последующим перемешиванием. После завершения реакции растворитель выпаривают при пониженном давлении и остаток растворяют в этилацетате. После промывания водой смесь сушат над безводным сульфатом магния и растворитель выпаривают при пониженном давлении. Остаток растворяют в изопропиловом спирте и добавляют уксусную кислоту. Смесь кипятят с обратным холодильником в течение 5 ч. Растворитель выпаривают при пониженном давлении и остаток растворяют в хлороформе. Смесь промывают насыщенным водным раствором бикарбоната натрия и сушат над безводным 16 сульфатом магния. Растворитель выпаривают при пониженном давлении и кристаллизация из этилацетата дает 5-(4-хлорфенил)-6,7-диметил 1,2-дигидро-3 Н-тиено[2,3-е][1,4]диазепин-2-он. 5-(4-Хлорфенил)-6,7-диметил-1,2-дигидро 3 Н-тиено[2,3-е][1,4]диазепин-2-он растворяют в хлороформе и при перемешивании добавляют пентасульфид дифосфора. Смесь кипятят с обратным холодильником в течение 3 ч. После завершения реакции реакционную смесь нейтрализуют насыщенным водным раствором бикарбоната натрия, промывают водой и сушат над безводным сульфатом магния. Растворитель выпаривают при пониженном давлении и остаток суспендируют в метаноле. К суспензии при охлаждении добавляют 100% гидразин гидрат и смесь перемешивают при комнатной температуре в течение 2 ч. После завершения реакции осажденные кристаллы собирают фильтрацией,получая 5-(4-хлорфенил)-6,7-диметил-1,2-дигидро-3 Н-тиено[2,3-е][1,4]диазепин-2-гидразон,температура плавления 226 С (разложение). Это соединение суспендируют в толуоле и добавляют триэтилортоацетат. Смесь перемешивают при 80 С в течение 4 ч. После завершения реакции растворитель выпаривают при пониженном давлении и полученные неочищенные кристаллы перекристаллизовывают из этилацетата, получая 4-(4-хлорфенил)-2,3,9-триметил-6 Н-тиено[3,2-f][1,2,4]триазоло[4,4-а]диазепин, температура плавления не менее чем 250 С. 1[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин (50 г) растворяют в диэтилкарбонате (500 мл) в потоке азота и добавляют при комнатной температуре при перемешивании 60% гидрид натрия. После кипячения с обратным холодильником в течение 2 ч реакционную смесь охлаждают ледяной водой и добавляют этилбромацетат. После перемешивания при комнатной температуре в течение 4 ч реакционную смесь выливают в холодный 5% водный раствор уксусной кислоты и экстрагируют хлороформом. После промывания водой экстракт сушат над безводным сульфатом магния и фильтруют. Фильтрат концентрируют при пониженном давлении и остаток подвергают колоночной хроматографии на силикагеле. Целевую фракцию концентрируют при пониженном давлении и полученные кристаллы (95 17 г) суспендируют в этаноле (910 мл). Суспензию перемешивают при 5 С при охлаждении льдом и добавляют 1 н. водный раствор гидроксида натрия (570 мл). После перемешивания при комнатной температуре в течение 7 ч полученную смесь нейтрализуют уксусной кислотой (90 мл) и концентрируют при пониженном давлении. Полученные неочищенные кристаллы перекристаллизовывают из смешанного растворителя этанол (400 мл)-вода (250 мл), получая 71 г Этанол (500 мл) добавляют к -[4-(4 хлорфенил)-6-этоксикарбонил-2,3,9-триметил 6 Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил]уксусной кислоте (43 г) и смесь перемешивают при комнатной температуре. Добавляют 2 н. гидроксид натрия (182 мл), и смесь перемешивают при 50 С в течение ночи. После завершения реакции этанол выпаривают и остаток доводят до рН 4-5 уксусной кислотой. Затем полученную смесь перемешивают при 60 С в течение 30 мин и охлаждают до комнатной температуры. Смесь экстрагируют хлороформом и органический слой промывают насыщенным солевым раствором. Слой сушат над безводным сульфатом магния и концентрируют при пониженном давлении. Полученные кристаллы перекристаллизовывают из хлороформа-метанола,получая 20 г -[4-(4-хлорфенил)-2,3,9-триметил-6 Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4] диазепин-6-ил]уксусную кислоту, температура плавления 287-290 С. Пример получения исходного соединения 4.[4,3-а][1,4]диазепин-6-ил]уксусную кислоту (82 г) и цинхонидин (50 г) тщательно растворяют в метаноле (1 л) и растворитель выпаривают, получая аморфный продукт. Добавляют этилацетат (980 мл) и аналогичным образом растворяют аморфный продукт. Смесь оставляют на ночь при комнатной температуре и осажденную соль удаляют фильтрованием с помощью отсасывания. Растворитель выпаривают из фильтрата(76% энантиомерный избыток) при пониженном давлении и к остатку добавляют хлороформ(500 мл). Смесь промывают дважды 10% хлористоводородной кислотой и органический слой сушат над безводным сульфатом магния и концентрируют при пониженном давлении. К остатку (62 г) добавляют этилацетат (3720 мл) и остаток полностью растворяют. Полученную смесь оставляют на ночь при комнатной температуре и осажденный рацемат удаляют фильтрованием и отсасыванием. Растворитель выпаривают из фильтрата при пониженном давлении и к остатку (43 г) (94% энантиомерный избыток) добавляют этанол (500 мл). При перемешивании при комнатной температуре добавляют 2 н. водный раствор (182 мл) гидроксида натрия и смесь перемешивают при 50 С в течение ночи. При завершения реакции этанол выпаривают и полученную смесь доводят до рН 4 уксусной кислотой. Смесь перемешивают при 60 С в течение 30 мин. Реакционную смесь экстрагируют хлороформом и органический слой промывают насыщенным солевым раствором и сушат над безводным сульфатом магния. После концентрирования слоя при пониженном давлении к остатку (32 г) (92% энантиомерный избыток) добавляют этанол (1920 мл) и смесь перемешивают. Нерастворившийся рацемат удаляют фильтрованием с помощью отсасывания,и растворитель из фильтрата выпаривают при пониженном давлении. Остаток кристаллизуют из хлороформа, получая S-изомер [(S)-4-(4-хлорфенил)-2,3,9-триметил-6 Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил]уксусной кислоты] (20 г), температура плавления 167-169 С в виде белых порошкообразных кристаллов(99% энантиомерный избыток). R-изомер [(R)[4-(4-хлорфенил)-2,3,9-триметил-6 Н-тиено[3,3f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил] уксусной кислоты], температура плавления 166170 С, получают аналогичной обработкой кристаллов, осажденных в виде цинхонидиновой соли. Оптическую чистоту (энантиомерный избыток) определяют методом ВЭЖХ при следующих условиях: Условия определения: использованная колонка - Ultron ES-OVM(аналитическая колонка); подвижная фаза 1/15 водный раствор первичного кислого фосфата калия : 1/15 водный раствор вторичного кислого фосфата натрия : ацетонитрил = 333:500:120 скорость потока - 1 мл/мин; время удерживания - примерно 4,5 мин (Sизомер), примерно 5,5 мин (R-изомер).(1,2 мл) добавляют к смешанному растворителю из диметилформамида (30 мл) и тетрагидрофурана (15 мл). Смесь охлаждают до -10 С и при указанной температуре по каплям добавляют пивалоилхлорид (1,0 мл). Через тридцать минут добавляют по каплям при указанной температуре раствор 4-аминофенола (0,99 г) в диметилформамиде (20 мл) и смесь перемешивают при комнатной температуре в течение 7,5 ч. После завершения реакции тетрагидрофуран выпаривают и добавляют насыщенный солевой раствор(200 мл). Смесь экстрагируют этилацетатом и органический слой промывают насыщенным солевым раствором, сушат над безводным сульфатом магния и концентрируют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле (этилацетат:метанол=10:1) и кристаллизуют из изопропилового спирта, получая 620 мг (S)-2-[4-(4 хлорфенил)-2,3,9-триметил-6 Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил]-N-(4 гидроксифенил)ацетамида в виде бледнорозовых порошкообразных кристаллов, температура плавления 215-220 С. Пример 2(S)-2-[4-(4-Хлорфенил)-2,3,9-триметил-6 Нтиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин 6-ил]-N-(4-гидроксифенил)ацетамид (5 г) растворяют в этаноле (25 мл) и, нагревая при 50 С,порциями добавляют воду (25 мл). Осажденные кристаллы собирают фильтрованием, получая 4,8 г дигидрата (S)-2-[4-(4-хлорфенил)-2,3,9 триметил-6 Н-тиено[3,2-f][1,2,4]триазоло[4,3-а](2,73 мл) добавляют к смешанному растворителю из диметилформамида (70 мл) и тетрагидрофурана (30 мл). Смесь охлаждают до -5 С и при указанной температуре добавляют по каплям пивалоилхлорид (2,38 мл). Через десять минут добавляют по каплям при указанной температуре раствор метиламина (0,69 г) в диметилформамиде (5 мл) и смесь перемешивают при комнатной температуре в течение 2 ч. К реакционной смеси добавляют воду и смесь экстрагируют этилацетатом. Экстракт промывают водой и сушат над безводным сульфатом магния. Растворитель выпаривают и остаток перекристаллизовывают из воды/метанола, получая 2,29 г 1/4 гидрат (S)-2-[4-(4-хлорфенил)-2,3,9-триметил-6 Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4] диазепин-6-ил]-N-метилацетамида, температура плавления 143-145 С.(2,73 мл) добавляют к смешанному растворителю из диметилформамида (70 мл) и тетрагидрофурана (30 мл). Смесь охлаждают до -5 С и при указанной температуре добавляют по каплям пивалоилхлорид (2,38 мл). Через десять минут добавляют по каплям при указанной температуре раствор этаноламина (1,17 г) в тетрагидрофуране (10 мл) и смесь перемешивают при комнатной температуре в течение 2 ч. К реакционной смеси добавляют воду и смесь экстрагируют этилацетатом. Экстракт промывают водой и сушат над безводным сульфатом магния. Растворитель выпаривают и остаток очищают колоночной хроматографией (хлороформ : метанол = 50:1) и перекристаллизовывают из этилацетата, получая 2,29 г 1/4 гидрат (S)-2-[4-(4 хлорфенил)-2,3,9-триметил-6 Н-тиено[3,2-f](диметиламино)фосфония (3,6 г) и смесь перемешивают при комнатной температуре в течение 12 ч. После завершения реакции добавляют воду (200 мл) и смесь экстрагируют этилацетатом. Экстракт промывают насыщенным солевым раствором и сушат над безводным сульфатом магния. После выпаривания растворителя при пониженном давлении остаток подвергают колоночной хроматографии на силикагеле и полученные кристаллы перекристаллизовывают из толуола, получая 0,56 г (S)-N-(4-аминoфенил)-2-[4-(4-хлорфенил)-2,3,9-триметил-6 Нтиено[3,2-f]-[1,2,4]триазоло[4,3-а][1,4]диазепин 6-ил]ацетамида, температура плавления 169173 С. Пример 6(S)-[4-(4-хлорфенил)-2,3,9-триметил-6 Нтиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин 6-ил]уксусную кислоту (2,64 г) растворяют в диметилформамиде (30 мл). Смесь охлаждают на ледяной бане и последовательно добавляют 1-гидроксибензотриазол (1,08 г), N-диметиламинопропил-N'-этилкарбодиимид гидрохлорид(1,51 г) и триэтиламин (1,08 мл), после чего перемешивают. Через 5 мин к реакционной смеси добавляют 3-аминопиридин (0,66 г) и смесь перемешивают при комнатной температуре в течение ночи. Реакционную смесь выливают в воду и полученные кристаллы очищают колоночной хроматографией (хлороформ : метанол = 50:1). Кристаллы превращают в гидрохлорид с использованием этанола/хлористоводородной кислоты в этилацетате и перекристаллизовывают из этанола/этилацетата, получая 0,88 г гидрохлорида (S)-2-[4-(4-хлорфенил)-2,3,9-триметил-6 Н-тиено[3,2-f][12,4]триазоло[4,3-а][1,4] диазепин-6-ил]-N-(3-пиридил)ацетамида, температура плавления 198-201 С, []D25=-22,6(с=1, метанол). Следующие соединения получают аналогичными способами, как указано в примерах выше. Пример 7(S)-2-[4-(4-хлорфенил)-2,3,9-триметил-6 Нтиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин 6-ил]-N-метоксиацетамид 1/4 гидрат, температура плавления 230-231 С, []D26=+13,7 (с=1,0,метанол). Пример рецептуры 1. Соединение по изобретению (0,5 части),лактозу (25 частей), кристаллическую целлюлозу (35 частей) и кукурузный крахмал (3 части) тщательно перемешивают и хорошо размешивают со связующим веществом, полученным из кукурузного крахмала (2 части). Перемешанный продукт пропускают через сито 16 меш, сушат в печи при 50 С и пропускают через сито 24 меш. Полученный таким образом перемешанный продукт, кукурузный крахмал (8 частей), кристаллическую целлюлозу (11 частей) и тальк (9 частей) хорошо перемешивают, прессуют в таблетки, содержащие 0,5 мг активного ингредиента на таблетку. Полученные таблетки могут быть покрыты энтеросолюбильной оболочкой с получением покрытых энтеросолюбильной оболочкой таблеток, которые могут быть дополнительно превращены в таблетки, покрытые сахаром. Пример рецептуры 2. Соединение по изобретению (1 часть) и лактозу (90 частей) тщательно смешивают и перемешивают хорошо со связующим веществом, полученным из подходящего количества метилцеллюлозы. Перемешанный продукт пропускают через сито 16 меш и сушат в печи при 50 С. Высушенные гранулы продавливают через сито 32 меш и хорошо смешивают с подхо 23 дящим количеством диоксида кремния, получая 1%-ный порошок. Фармакологическое действие соединения по изобретению было показано следующим образом. В экспериментах, (S)-2-[4-(4-хлорфенил)-2,3,9-триметил-6 Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил]-N-(4-гидроксифенил)ацетамид (далее называемое как соединение 1) и (S)-2-[4-(4-хлорфенил)-2,3,9-триметил-6 Нтиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин 6-ил]-N-(4-гидроксифенил)ацетамид дигидрат(далее называемое как соединение 2) используют в качестве исследуемых соединений. В качестве контрольного соединения в эксперименте 1 и эксперименте 2 используют соединение формулы (А) примера 8 публикации, не прошедшей экспертизы патента Японии 243691/1990,т.е.[5-(2-хлорфенил)-7-(морфолинокарбонилэтил)-10-метил-3,4-дигидро-2 Н,7 Н-циклопента[4,5]тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин, которое далее называется соединением для сравнения]. Эксперимент 1: действие на экспрессиюCD11b человеческой гистициоцитной лейкемической клеточной линии U937. Исследовалось действие на экспрессиюMac-1, который является одной из адгезионных молекул, экспрессируемых на поверхности лейкоцитных клеток. Клетки U937 суспендируют вCO2. После однократного промывания клеток средой RPMI1640, добавляют крысиное моноклональное антитело против CD11b человека (2 мкг/мл) и планшеты оставляют на 1 ч при охлаждении льдом. Клетки промывают дважды и добавляют конъюгированное пероксидазой антитело против иммуноглобулина крысы (1 мкг/мл). Клетки оставляют в течение 1 ч при охлаждении льдом. Клетки промывают 3 раза и добавляют пероксидазный субстрат(офенилендиамин) для окрашивания. Планшеты оставляют в течение 15 мин при комнатной температуре и при 490 нм с помощью считывания для 96-луночных микропланшетов измеряют оптическую плотность, используемую как индикатор экспрессии CD11b антигена. В таблице 1 представлены значения IС 50(мкМ), полученные путем расчета % ингибирования, когда оптическая плотность при добавлении PDB или без добавления PDB взята как 100% и 0%, соответственно. 24 Таблица 1 Ингибирующее действие на Соединение экспрессию CD11b (IС 50, мкМ) Соединение 2 0,03 Соединение для сравнения 3U937 клетках. С другой стороны, соединение для сравнения демонстрирует активность, не более чем 1/100 активности соединения 2. Эксперимент 2: ингибирующее действие на экспрессию VCAM-1 и Е-селектина в эндотелиальных клетках пупочной вены человекаHUVEC суспендируют в 199 среде, содержащей 20% зародышевой телячьей сыворотки,20 мкг/мл фактора роста эндотелиальных клеток, полученного из бычьего мозга, и 100 мкг/мл гепарина, наносят на 96-луночные планшеты для микрокультур, покрытые коллагеном, и культивируют при 37 С в 5% СO2. Когда клетки вырастают до слияния слоя, к ним добавляют факторнекроза опухоли (20 ед/мл для индуцирования экспрессии VCAM-1, 100 ед/мл для индуцирования экспрессии Еселектина) и исследуемое соединение, после чего дополнительно культивируют в течение 5 ч. Клетки промывают один раз 199 средой и добавляют мышиное моноклональное антитело против VCAM-1 человека (2 мкг/мл) или крысиное моноклональное антитело против Еселектина человека (2 мкг/мл). Клетки оставляют на один час при комнатной температуре. Клетки промывают дважды и добавляют конъюгированное пероксидазой антитело против иммуноглобулина мыши или антитело против иммуноглобулина крысы. Клетки оставляют в течение 1 часа при комнатной температуре. Клетки промывают 3 раза и добавляют в качестве пероксидазного субстрата 2,2'-азино-бис(3-этилбензотиазолин-6-сульфоновую кислоту). Планшеты оставляют на 15 мин при комнатной температуре и при 405 нм/490 нм с помощью считывателя для 96-луночных микропланшетов измеряют оптическую плотность, используемую как индикатор экспрессии VCAM-1 или Еселектина. В таблице 2 представлены значения IC50(мкМ), полученные путем расчета % ингибирования, когда оптическая плотность с добавлением или без добавления фактора а некроза опухоли взята за 100% и 0%, соответственно. Соединение Соединение 2 Соединение для сравнения Как показано в таблице 2, установлено, что соединение 2 ингибирует экспрессию VCAM-1 и Е-селектина на HUVEC. С другой стороны, 25 ингибирующее действие на экспрессию VCAM1 соединения для сравнения составляет не более чем 1/90 такового, для соединения 2, и ингибирующее действие экспрессии Е-селектина составляет не более чем 1/130 активности соединения 2. Эксперимент 3: влияние на инфильтрацию лейкоцитов, индуцированную тиогликолятной(ТГ) средой. Один (1) мл ТГ среды инъецируют в перитонеальную полость мышам BALB/c, на 0 день и на 4 день, лейкоциты, инфильтрованные в перитонеальную полость, собирают с использованием 3 мл забуференного фосфатом физиологического раствора, содержащего 0,02% ЭДТК. Концентрацию лейкоцитов (клетки/мл) определяют с помощью автоматического счетчика клеток крови. Общее число инфильтрованных лейкоцитов (X) рассчитывают из концентрации лейкоцитов (А клеток/мл) по следующей формуле: Х=3 А,допуская, что инфильтрованные лейкоциты гомогенно распределялись в извлеченных жидкостях. Исследуемое соединение суспендируют в 0,5% гидроксипропилметилцеллюлозе (Metolose) и вводят перорально (0,1 мл/10 г веса тела) в дни с 0 по 3 после инъекции ТГ среды. Соединение по изобретению ингибирует индуцированную ТГ-средой инфильтрацию лейкоцитов доза-зависимым образом и подавляет инфильтрацию лейкоцитов в место воспаления путем ингибирования клеточной адгезии также in vivo. Эксперимент 4: влияние на адгезию лейкоцитов, индуцированную липополисахаридами(ЛПС). Сообщалось, что при введении ЛПС мышам индуцируется зависимая от адгезионной молекулы Мас-1 адгезия лейкоцитов, лейкоциты инфильтруются в легкие, печень и так далее, и в результате снижается число лейкоцитов в периферической крови (Morisaki et al., Clin. Immunol.Immunopathol, 61, 365-375, 1991). Влияние на ЛПС-индуцированную адгезию лейкоцитов исследовали, используя в качестве индикатора адгезии лейкоцитов снижение количества лейкоцитов периферической крови. Раствор ЛПС (50 нг/мл в физиологическом растворе, 0,5 мл/мышь) инъецируют в перитонеальную полость мышам BALB/c. Через шесть часов после ЛПС-инъекции подсчитывают число лейкоцитов периферической крови с помощью автоматического счетчика клеток крови. Исследуемые соединения суспендируют в 0,5% гидроксипропилметилцеллюлозе (Metolose) и вводят перорально (0,1 мл/10 г веса тела), с 4 дней перед инъекцией ЛПС до дня инъекции ЛПС. Соединения по изобретению ингибируют доза-зависимым образом уменьшение лейкоци 001732 26 тов, вызванное ЛПС-индуцированной адгезией лейкоцитов. Эксперимент 5: влияние на индуцированный тринитробензолсульфоновой кислотой(TNBS) колит у крысы. Колит индуцируют путем внутрикишечной инъекции раствора TNBS (60 мг/мл в 50% EtOH,500 мкл) крысам SD. Через семь дней крыс подвергают аутопсии и толстую кишку (8 см от ануса) иссекают и взвешивают. Измеряют миелопероксидазную (МПО) активность в ткани кишечника, используя в качестве индикатора число инфильтрованных лейкоцитов. То есть, кишку гомогенизируют и трижды повторяют цикл замораживанияоттаивания ткани. Супернатант, полученный центрифугированием, анализируют на МПО активность с использованием пероксидазного субстрата (о-фенилендиамин). Единицы МПО в супернатанте подсчитывают с использованием в качестве стандарта коммерческого МПО. Увеличение веса кишечника и возрастание активности МПО, определенные, как указано выше,были взяты в качестве индикаторов степени развития колита. Исследуемое соединение суспендируют в 0,5% растворе гидроксипропилметилцеллюлозы (Metolose) и вводят перорально(0,4 мл/100 мг) или внутрикишечно (0,2 мл/крысу) в течение 5 дней, начиная со дня инъекции TNBS. Результаты взвешивания кишечника и МПО активности представлены далее. Несенсибили 0 0,4570,079 зированные СенсибилиКонтроль 0 6,2115,106 зированные ная группа СенсибилиСоеди 0,01 0,7160,158 Р 0,05 зированные нение 1 СенсибилиСоеди 0,1 0,654+0,109 Р 0,05 зированные нения 1 СенсибилиСоеди 1 0,676+0,172 Р 0,05 зированные нение 1 МПО активСоедиДоза ность (Ед/мл нение (мг/сайт) стандартное отклонение) Несенсибили 0 0,4280,100 зированные КонтрольСенсибили 0 0,7960,557 ная группа зированные СенсибилиСоеди 0,01 0,3540,081 Р 0,01 зированные нение 2 СенсибилиСоеди 0,1 0,3340,069 Р 0,01 зированные нение 2 СенсибилиСоеди 1 0,3450,097 Р 0,01 зированные нение 2(3) Действие соединения 2 при пероральном введении Таблица 5 А Обработка Несенсабилизирован 0 0,4340,065 ные КонтрольСенсибили 0 1,4340,651 ная группа зированные СенсибилиСоеди 0,3 1,5680,222 нет зированные нение 2 СенсибилиСоеди 1 0,7690,222 Р 0,05 зированные нение 2 СенсибилиСоеди 3 0,7400,142 Р 0,05 зированные нение 2 28 ингибируют увеличение веса кишечника и лейкоцитную инфильтрацию, вызываемую началом колита у крыс, что позволяет предположить полезность соединений по изобретению в качестве терапевтических или профилактических лекарственных средств при воспалительных заболеваниях кишечника (язвенный колит и болезнь Крона) и у человека. Эксперимент 6: влияние на индуцированный карагеном колит у кроликов. Смешанную эмульсию 1% -деградированного карагена и полного адъюванта Freund подкожно инъецируют кроликам для сенсибилизации. Начиная с 7-го дня (день 0) от сенсибилизации -деградированный караген (2501000 мг/день/кролик) вводят принудительно перорально в течение 8 недель для индуцирования колита. На следующий день (56 день) после окончания введения -деградированного карагена кроликов подвергают аутопсии и оценивают нарушения в толстой кишке с использованием аномального исследования слизистой эпителии образцов тканей, уровня инфильтрации воспалительных клеток и тому подобного в качестве индексов. Исследуемые соединения (10 мг/кг) вводят последовательно от 0 дня до 8 недель. Результаты представлены следующим образом. Таблица 6 Значениестандартное Соединение Значимостьотклонение Контроль 10,92,0 Соединение 2 5,30,6 Р 0,05 Эксперимент 7: исследование токсичности. Соединение 2 многократно вводят перорально самкам крыс в течение 10 дней. При дозе 300 мг/кг случаев смерти не наблюдалось. Кроме того, не было выявлено аномальностей в общем состоянии, весе тела, приеме пищи, при гематологических тестах, биохимических тестах, анализе мочи, взвешивании органов или при биопсии. Как следует из экспериментальных примеров, описанных выше, соединение по настоящему изобретению обладает (1) ингибирующим действием на адгезию лейкоцитов к эндотелиальным клеткам пупочной вены человека (HUVEC) путем ингибирования экспрессии CD11b на лейкоцитах, (2) ингибирующим действием на экспрессию VCAM-1 и Е-селектина на HUVEC,и (3) ингибирующим действием на инфильтрацию лейкоцитов in vivo. Такие влияния позволяют предположить, что соединение по настоящему изобретению полезно в качестве профилактического и терапевтического лекарственного средства при различных заболеваниях, при которых в начало и развитие болезни включена клеточная адгезия. Действительно, значительное подавление воспалений было продемонстрировано в экспериментах с использованием модели колита на животных. Соединение формулы (1) по настоящему изобретению, полученное как описано выше, и содержащий его фармацевтический агент являются полезными в качестве терапевтического агента, профилактического лекарственного средства или рецидивного профилактического лекарственного средства при воспалительных заболеваниях кишечника, вызываемых клеточной адгезией, таких как язвенный колит и болезнь Крона, у млекопитающих, включая человека, обезьяну, корову,лошадь, собаку, кошку, кролика, крысу и тому подобных. Кроме того, соединение по изобретению может использoваться для профилактики и лечения венозной недостаточности и венозных язв или для поддержания ремиссии обоих заболеваний. Кроме того, так как низкая токсичность соединения по изобретению была установлена в экспериментах на животных, то соединение полезно в качестве высокобезопасного фармацевтического продукта. Данная заявка основана на заявке 243793/1996, поданной в Японии, содержание которой включено в данное описание в качестве ссылки. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Тиенотриазолодиазепиновое соединение формулы (1)R3 представляет собой алкил, имеющий 1-4 атома углерода, гидроксиалкил, имеющий 1-4 атома углерода, алкокси, имеющий 1-4 атома углерода,фенил, необязательно имеющий заместитель, или пиридил, необязательно имеющий заместитель,его фармацевтически приемлемая соль или его гидрат. 2. Тиенотриазолодиазепиновое соединение по п.1, где в формуле (1) Х представляет собой хлор иR1 и R2 оба представляют собой метил, его фармацевтически приемлемая соль или его гидрат. 3. Тиенотриазолодиазепиновое соединение по п.1, где соединение формулы (1) представляет собой(S)-2-[4-(4-хлорфенил)-2,3,9-триметил-6 Нтиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6 30 ил]-N-(4-гидроксифенил)ацетамид, его фармацевтически приемлемую соль или его гидрат. 4. (S)-2-[4-(4-хпорфенил)-2,3,9-триметил-6 Нтиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6 ил]-N-(4-гидроксифенил)ацетамид дигидрат. 5. Лекарственное средство, содержащее тиенотриазолодиазепиновое соединение формулы (1)R3 представляет собой алкил, имеющий 1-4 атома углерода, гидроксилалкил, имеющий 1-4 атома углерода, алкокси, имеющий 1-4 атома углерода, фенил, необязательно имеющий заместитель,или пиридил, необязательно имеющий заместитель,его фармацевтически приемлемую соль или его гидрат. 6. Лекарственное средство по п.5, содержащее тиенотриазолодиазепиновое соединение формулы(1), где Х представляет собой хлор и R1 и R2 оба представляют собой метил, его фармацевтически приемлемую соль или его гидрат. 7. Лекарственное средство по п.5, где соединение формулы (1) представляет собой (S)-2-[4-(4xлopфeнил)-2,3,9-тpимeтил-6H-тиeнo[3,2-f][1,2,4] триазоло[4,3-а][1,4]диазепин-6-ил]-N-(4-гидроксифенил)ацетамид. 8. Лекарственное средство по п.5, которое представляет собой терапевтический агент при воспалительном заболевании кишечника. 9. Лекарственное средство по п.5, которое представляет терапевтический агент при язвенном колите. 10. Лекарственное средство по п.5, которое представляет терапевтический агент при болезни Крона. 11. Лекарственное средство, содержащее (S)2-[4-(4-хлорфенил)-2,3,9-триметил-6 Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил]-N-(4 гидроксифенил)ацетамид дигидрат. 12. Лекарственное средство по п.11, которое представляет терапевтический агент при воспалительном заболевании кишечника. 13. Лекарственное средство по п.11, которое представляет терапевтический агент при язвенном колите. 14. Лекарственное средство по п.11, которое представляет терапевтический агент при болезни Крона.
МПК / Метки
МПК: A61K 31/5517, C07D 495/14, A61P 1/04
Метки: средство, соединения, лекарственное, тиенотриазолодиазепиновые
Код ссылки
<a href="https://eas.patents.su/16-1732-tienotriazolodiazepinovye-soedineniya-i-lekarstvennoe-sredstvo.html" rel="bookmark" title="База патентов Евразийского Союза">Тиенотриазолодиазепиновые соединения и лекарственное средство</a>
Предыдущий патент: Композиции, комплексы включения фармацевтически приемлемой соли зипразидона и циклодекстрина и соли зипразидона
Следующий патент: Производные эритромицина, способ их получения и применение
Случайный патент: Стабильные препараты лаквинимода