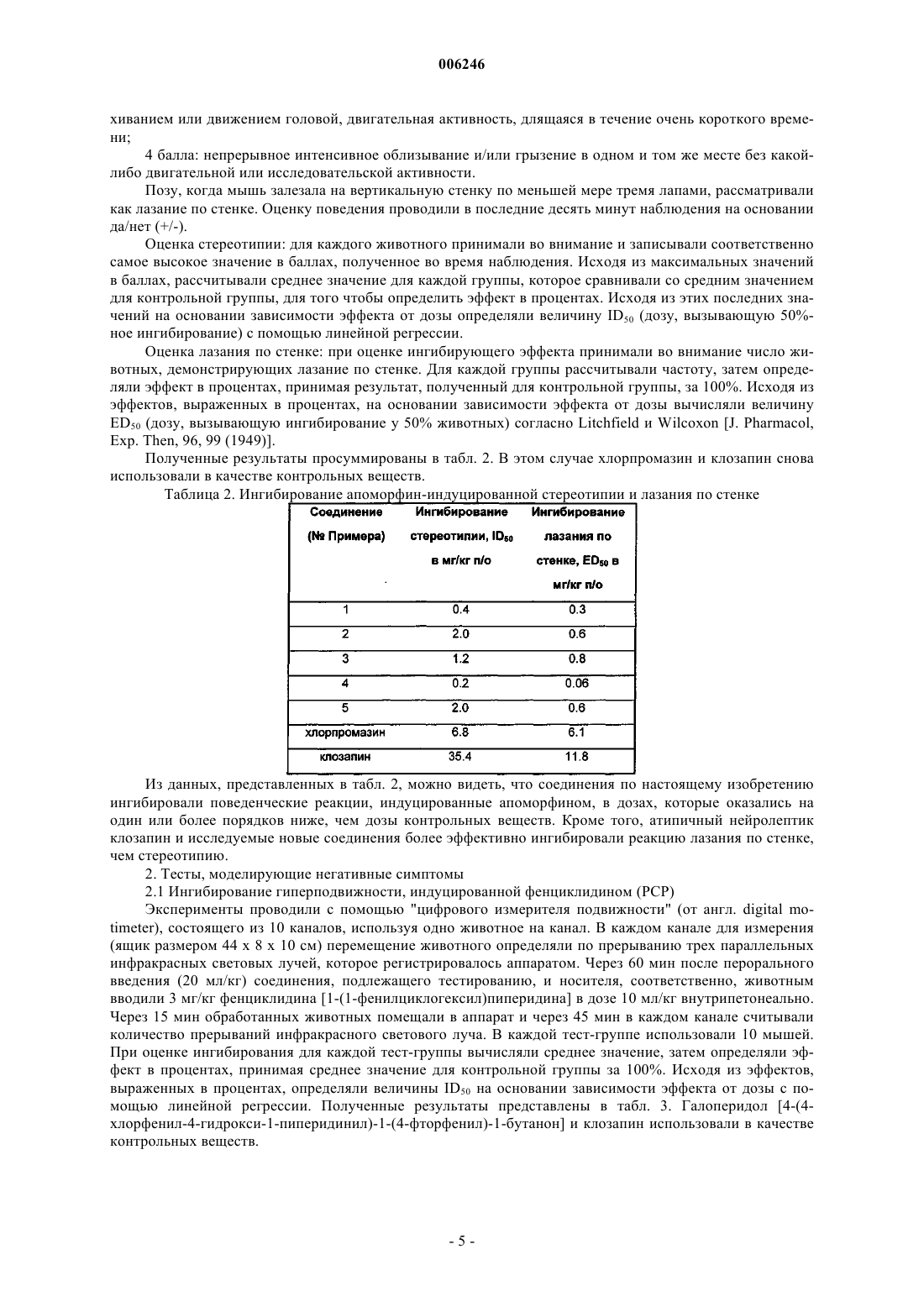
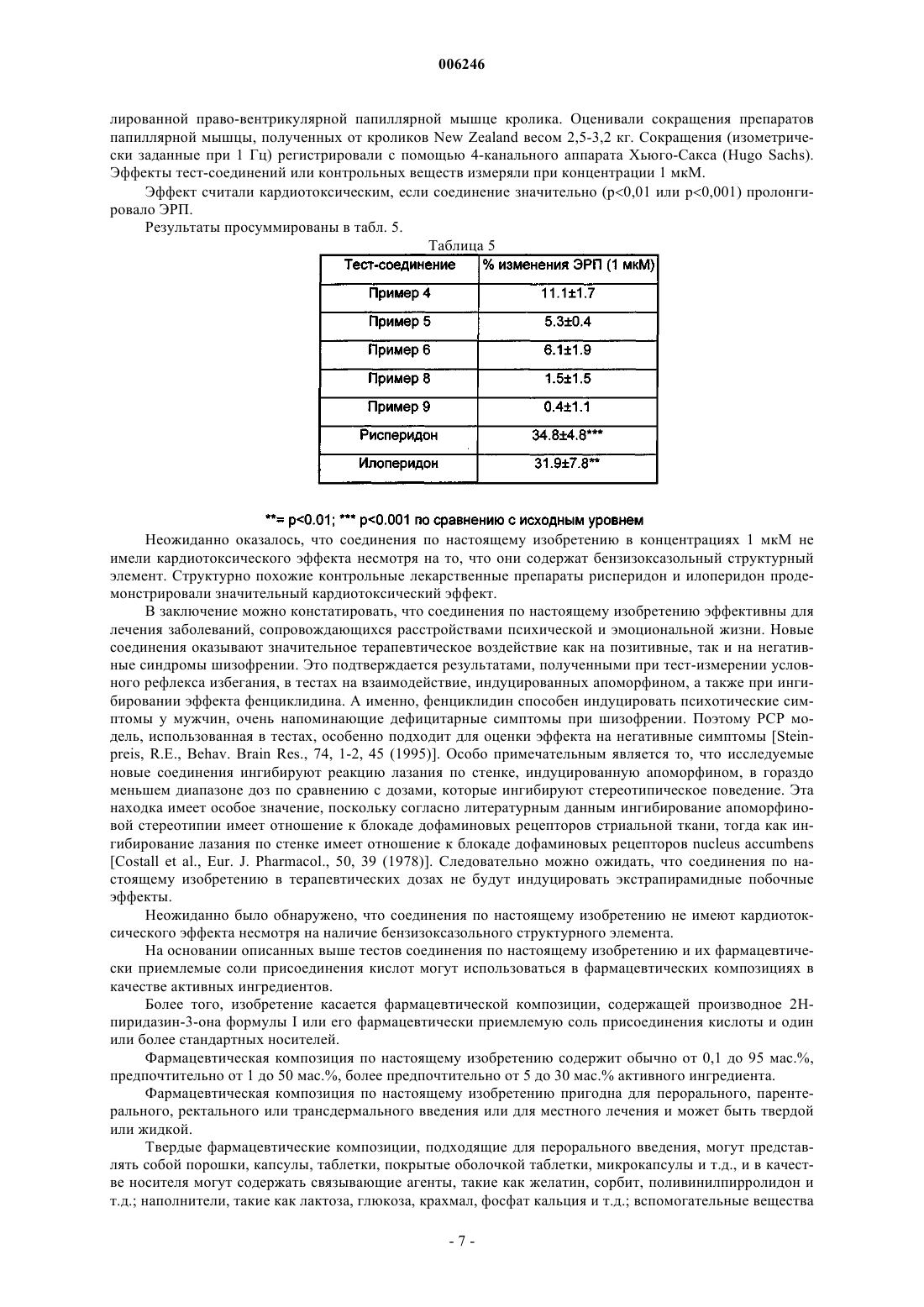
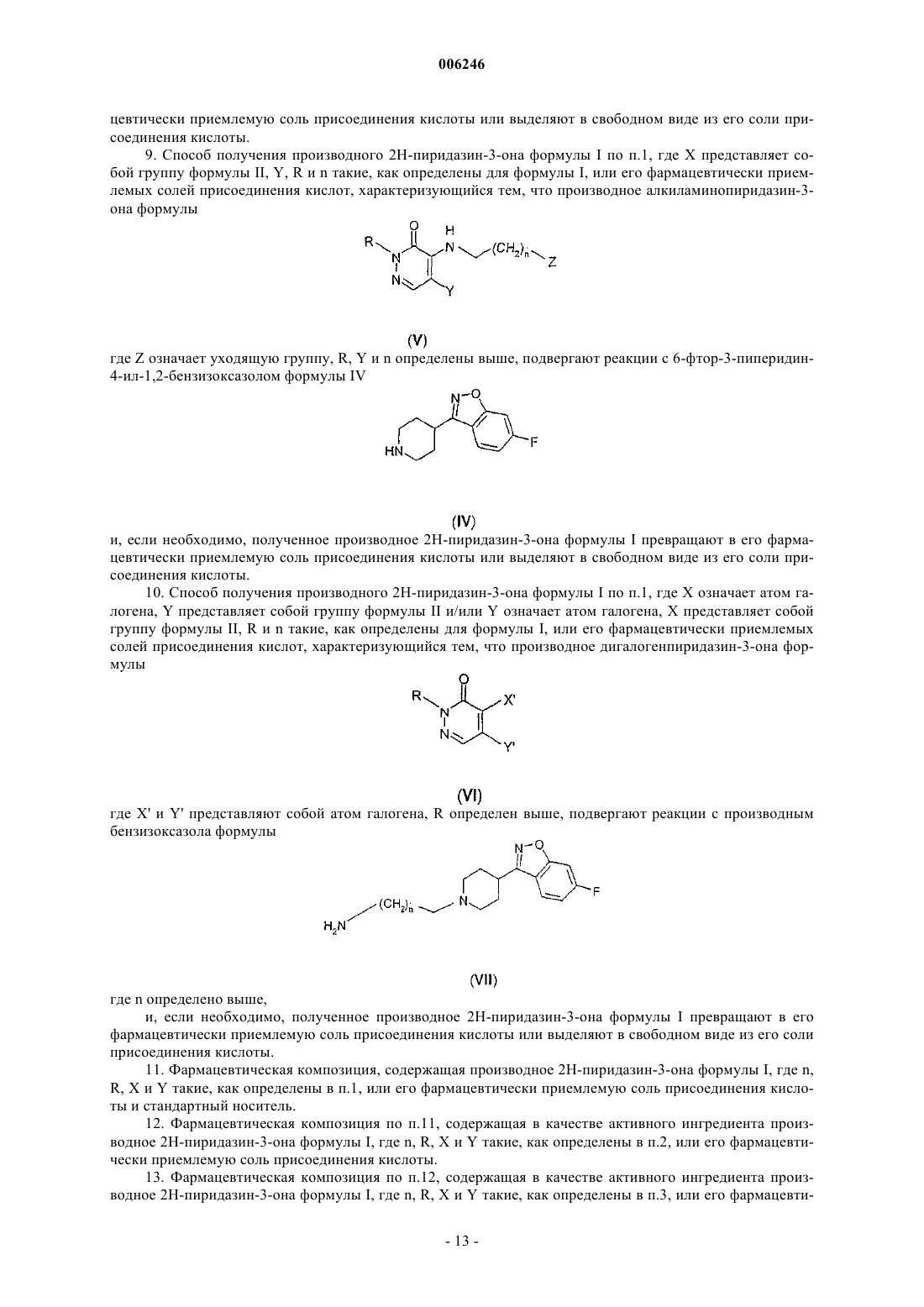
Производные 2н-пиридазин-3-она, фармацевтические композиции, содержащие эти производные, и способ получения активного ингредиента
Номер патента: 6246
Опубликовано: 27.10.2005
Авторы: Паллаги Каталин, Леваи Дьёрди, Миклошне Ковач Анико, Шимиг Дьюла, Гачальи Иштван, Шмидт Эва, Вельман Янош, Рацне Байногель Юдит, Сенаши Габор, Эдьед Андраш, Котаи Надь Петер, Баркоци Йожеф
Формула / Реферат
1. Производное 2H-пиридазин-3-она формулы
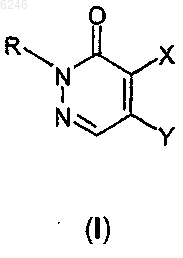
где R означает атом водорода или C1-4-алкильную группу,
X и Y независимо представляют собой атом водорода, атом галогена или группу формулы
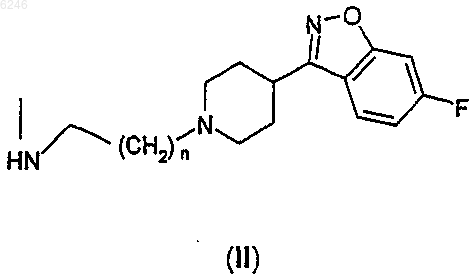
при условии, что один из X и Y всегда представляет собой группу формулы II, а другой радикал представляет собой атом водорода или атом галогена, где в формуле II n имеет значение 1 или 2, и
его фармацевтически приемлемые соли присоединения кислот.
2. Производное 2H-пиридазин-3-она общей формулы I по п.1, где
R означает водород или C1-4-алкил,
X означает водород или галоген,
Y означает группу общей формулы II и
n означает 1 или 2,
и его фармацевтически приемлемые соли присоединения кислот.
3. Соединения по п.2, где
R означает метил,
X означает хлор,
Y означает группу общей формулы II и
n означает 1 или 2,
и их фармацевтически приемлемые соли присоединения кислот.
4. Соединение по п.3
4-хлор-5-[2-[4-(6-фтор-1,2-бензизоксазол-3-ил)пиперидин-1-ил]этиламино]-2-метил-2H-пиридазин-3-он и его фармацевтически приемлемые соли присоединения кислот.
5. Соединение по п.3
4-хлор-5-[3-[4-(6-фтор-1,2-бензизоксазол-3-ил)пиперидин-1-ил]пропиламино]-2-метил-2H-пиридазинон и его фармацевтически приемлемые соли присоединения кислот.
6. Производные 2H-пиридазин-3-она общей формулы I по п.1, где
R представляет собой водород или C1-4-алкил;
X означает группу общей формулы II;
Y означает водород или хлор и n означает 1 или 2,
и их фармацевтически приемлемые соли присоединения кислот.
7. Производные 2H-пиридазин-3-она общей формулы I по п.6, где
R представляет собой водород или метил,
X представляет собой группу общей формулы II,
Y означает хлор и n означает 1 или 2,
и их фармацевтически приемлемые соли присоединения кислот.
8. Способ получения производного 2H-пиридазин-3-она формулы I по п.1, где Y представляет собой группу формулы II, X, R и n такие, как определены для формулы I, или его фармацевтически приемлемых солей присоединения кислот, характеризующийся тем, что производное алкиламинопиридазин-3-она формулы
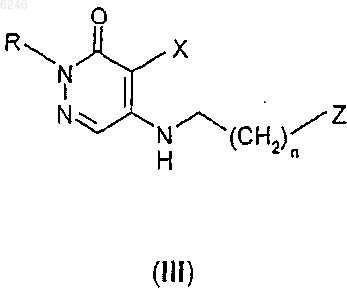
где Z означает уходящую группу, R, X и n определены выше, подвергают реакции с 6-фтор-3-пиперидин-4-ил-1,2-бензизоксазолом формулы
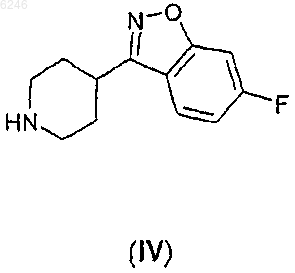
и, если необходимо, полученное производное 2H-пиридазин-3-она формулы I превращают в его фармацевтически приемлемую соль присоединения кислоты или выделяют в свободном виде из его соли присоединения кислоты.
9. Способ получения производного 2H-пиридазин-3-она формулы I по п.1, где X представляет собой группу формулы II, Y, R и n такие, как определены для формулы I, или его фармацевтически приемлемых солей присоединения кислот, характеризующийся тем, что производное алкиламинопиридазин-3-она формулы
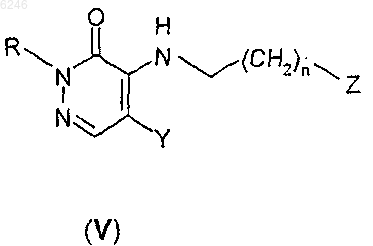
где Z означает уходящую группу, R, Y и n определены выше, подвергают реакции с 6-фтор-3-пиперидин-4-ил-1,2-бензизоксазолом формулы IV
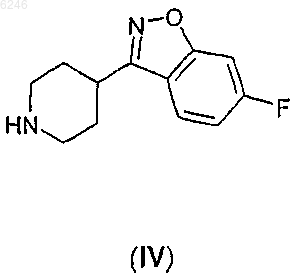
и, если необходимо, полученное производное 2H-пиридазин-3-она формулы I превращают в его фармацевтически приемлемую соль присоединения кислоты или выделяют в свободном виде из его соли присоединения кислоты.
10. Способ получения производного 2H-пиридазин-3-она формулы I по п.1, где X означает атом галогена, Y представляет собой группу формулы II и/или Y означает атом галогена, X представляет собой группу формулы II, R и n такие, как определены для формулы I, или его фармацевтически приемлемых солей присоединения кислот, характеризующийся тем, что производное дигалогенпиридазин-3-она формулы
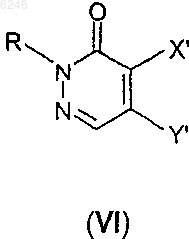
где X' и Y' представляют собой атом галогена, R определен выше, подвергают реакции с производным бензизоксазола формулы

где n определено выше;
и, если необходимо, полученное производное 2H-пиридазин-3-она формулы I превращают в его фармацевтически приемлемую соль присоединения кислоты или выделяют в свободном виде из его соли присоединения кислоты.
11. Фармацевтическая композиция, содержащая производное 2H-пиридазин-3-она формулы I, где n, R, X и Y такие, как определены в п.1, или его фармацевтически приемлемую соль присоединения кислоты и стандартный носитель.
12. Фармацевтическая композиция по п.11, содержащая в качестве активного ингредиента производное 2H-пиридазин-3-она формулы I, где n, R, X и Y такие, как определены в п.2, или его фармацевтически приемлемую соль присоединения кислоты.
13. Фармацевтическая композиция по п.12, содержащая в качестве активного ингредиента производное 2H-пиридазин-3-она формулы I, где n, R, X и Y такие, как определены в п.3, или его фармацевтически приемлемую соль присоединения кислоты.
14. Фармацевтическая композиция по п.11, содержащая в качестве активного ингредиента 4-хлор-5-[2-[4-(6-фтор-1,2-бензизоксазол-3-ил)пиперидин-1-ил]этиламино]-2-метил-2H-пиридазин-3-он или его фармацевтически приемлемую соль присоединения кислоты.
15. Фармацевтическая композиция по п.11, содержащая в качестве активного ингредиента 4-хлор-5-[3-[4-(6-фтор-1,2-бензизоксазол-3-ил)пиперидин-1-ил]пропиламино]-2-метил-2H-пиридазин-3-он или его фармацевтически приемлемую соль присоединения кислоты.
16. Способ лечения, отличающийся тем, что пациенту, страдающему от заболевания, сопровождающегося расстройствами психической и эмоциональной жизни, вводят нетоксическое количество производного 2H-пиридазин-3-она формулы I, где n, R, X и Y такие, как определены в п.1, или его фармацевтически приемлемой соли присоединения кислоты.
17. Применение производного 2H-пиридазин-3-она формулы I, где n, R, X и Y определены в п.1, или его фармацевтически приемлемой соли присоединения кислоты для получения фармацевтической композиции, имеющей нейролептический эффект.
18. Применение производного 2H-пиридазин-3-она формулы I, где n, R, X и Y определены в п.1, или его фармацевтически приемлемой соли присоединения кислоты в качестве фармацевтически активного ингредиента.
19. Применение по п.18, где фармацевтически активный ингредиент представляет собой нейролептический фармацевтически активный ингредиент.
Текст
006246 Область изобретения Изобретение касается новых производных 2 Н-пиридазин-3-она, фармацевтических композиций, содержащих эти производные в качестве активного ингредиента, и способа получения активного ингредиента. Новые соединения обладают нейролептическим эффектом и могут быть использованы в первую очередь для лечения шизофрении. Предпосылки изобретения Психические заболевания, включая клинические картины аффективных расстройств (шизофрении,страха, депрессии), представляют большую проблему в медицинской науке. Около 1% населения страдает от шизофрении. Однако современная лекарственная терапия не совсем подходит для лечения этого заболевания. Клинически шизофрения характеризуется двумя синдромами, которые существенно различаются по этиологии и реакции на лекарственную терапию. Они представляют собой так называемые позитивные или продуктивные симптомы (галюцинации, бред) и негативные или дефицитарные симптомы (эмоциональная жизнь становится пустой, однообразной) [Crow, T.J., Brit. Med. J., 280, 66 (1980)]. Считают, что формирование продуктивных симптомов осуществляется благодаря гиперфункции мезолимбической дофаминергической системы [Kahn, R.S. and Davis, K.L., The Fourth Reneration of Progress,editor: Bloom, F.E. and Kupfer, D.J., Raves Press, New York, p. 1215 (1995)], и эти симптомы могут хорошо контролироваться с помощью так называемых классических нейролептиков (галоперидола, хлорпромазина). Однако в случае негативных симптомов характерной чертой является гипофункция мезолимбической дофаминергической системы [Knable, M.B. and Winberger, D.M., Psychopharmacology, 11, 123(1997)], и в этом случае упомянутые выше лекарственные препараты являются неэффективными, более того, они могут быть причиной ухудшения негативных симптомов. Тем не менее так называемые типичные нейролептики (галоперидол, хлорпромазин), которые в первую очередь являются антагонистами дофаминовых D2-рецепторов, составляют основу современной терапии. Поэтому, как указано выше, они имеют многочисленные неблагоприятные побочные эффекты и неэффективны в лечении одного из синдромов шизофрении (негативных симптомов) [Ellenbroek, B.A., Pharmacol. Then, 57, 1 (1993)]. После открытия 5-НТ 2A-рецепторов [Leysen et al., Biochem. Pharmacol., 27, 307 (1978)] возросла роль лекарственных средств, взаимодействующих с этими рецепторами, при лечении шизофрении. Клозапин был первым лекарственным препаратом, который связывался с 5-НТ 2A-рецепторами сильнее, чем с D2 рецепторами, и не имел неблагоприятных побочных эффектов, которые характерны для типичных лекарственных препаратов, кроме того, клозапин хорошо контролировал также негативные симптомы [Melzer,H.Y., Schizophr. Bull., 17, 263 (1991)]. 3 а клозапином последовало несколько новейших нейролептиков последнего поколения, таких как оланзапин, сероквел и т.д., однако клозапин можно рассматривать в качестве стандартного атипичного нейролептика. Упомянутые выше современные атипичные лекарственные препараты в равной степени эффективны как в случае позитивных симптомов (галлюцинации,бред), так и в случае негативных симптомов (пустота и однообразие эмоциональной жизни), характеризующих шизофрению. Производные 3-(1-замещенный-4-пиперидинил)-1,2-бензизоксазола, имеющие нейролептическую активность, описаны в статье из J. Med. Chem., 28(6), 761-769 (1985). Производные 3(2 Н)-пиридазинона,имеющие противоаритмический эффект, известны из патента US 5395934. Цель настоящего изобретения состоит в получении новых соединений, имеющих нейролептический эффект, которые оказывают благоприятное влияние на оба синдрома шизофрении, являются более эффективными, чем клозапин, и не обладают ни экстрапирамидными, ни эндокринными побочными эффектами. Краткое описание изобретения В частности, изобретение касается новых производных 2 Н-пиридазин-3-она формулы где R означает атом водорода или С 1-4-алкильную группу;X и Y независимо представляют собой атом водорода, атом галогена или группу формулы-1 006246 при условии, что один из X и Y всегда представляет собой группу формулы II, а другой радикал представляет собой атом водорода или атом галогена, где в формуле II n имеет значение 1 или 2, и их фармацевтически приемлемых солей присоединения кислот. Описание предпочтительных реализаций Было обнаружено, что производные 2 Н-пиридазин-3-она, замещенные (6-фтор-1,2-бензизоксазол-3 ил)пиперидин-1-илалкиламинофуппой, оказывают самый благоприятный нейролептический эффект и могут быть использованы для лечения обоих синдромов шизофрении. В описании и формуле изобретения С 1-4-алкильная группа представляет собой метильную группу,этильную группу, изопропильную группу, н-пропильную группу, н-бутильную группу, втop-бутильную группу, изобутильную группу или трет-бутильную группу, предпочтительно метильную группу. Атом галогена представляет собой атом фтора, хлора, брома или йода, предпочтительно атом хлора. Под фармацевтически приемлемыми солями присоединения кислот производных 2 Н-пиридазин-3 она формулы I подразумевают нетоксические соли присоединения кислот этих соединений, образованные с неорганическими кислотами, такими как соляная кислота, бромисто-водородная кислота, серная кислота, фосфорная кислота и т.д. или с органическими кислотами, такими как муравьиная кислота, уксусная кислота, малеиновая кислота, фумаровая кислота, молочная кислота, винная кислота, янтарная кислота, лимонная кислота, бензолсульфокислота, п-тоулуолсульфокислота, метансульфокислота и т.д. Предпочтительная подгруппа соединений по настоящему изобретению состоит из производных 2 Нпиридазин-3-она формулы I и их фармацевтически приемлемых солей присоединения кислот, гдеX представляет собой группу формулы II;Y означает атом водорода или атом галогена, R и n такие, как определены для формулы I. В пределах указанной подгруппы особенно предпочтительными производными 2 Н-пиридазин-3 она формулы I и их фармацевтически приемлемыми солями присоединения кислот являются производные, где Y означает атом водорода или атом хлора, R означает атом водорода или метильную группу, X представляет собой группу формулы II, где n такое, как определено для формулы I. Другая предпочтительная подгруппа соединений по настоящему изобретению состоит из производных 2 Н-пиридазин-3-она формулы I и их фармацевтически приемлемых солей присоединения кислот,гдеY означает группу формулы II;X представляет собой атом водорода или атом галогена, R и n такие, как определены для формулы I. В пределах указанной подгруппы особенно предпочтительными производными 2 Н-пиридазин-3 она формулы I и их фармацевтически приемлемыми солями присоединения кислот являются производные, где X представляет собой атом хлора, R означает метильную группу, Y представляет собой группу формулы II, где n такое, как определено для формулы I. Из особенно предпочтительных соединений, определенных выше, подходят следующие соединения: 4-хлор-5-2-[4-(6-фтор-1,2-бензизоксазол-3-ил)пиперидин-1-ил]этиламино-2-метил-2H-пиридазин 3-он, 4-хлор-5-3-[4-(6-фтор-1,2-бензизоксазол-3-ил)пиперидин-1-ил]пропиламино-2-метил-2 Н-пиридазин-3-он, и их фармацевтически приемлемые соли присоединения кислот. Соединения изобретения получают следующим образом: а) для получения производного 2 Н-пиридазин-3-она формулы I, где Y представляет собой группу формулы II, X, R и n такие, как определены для формулы I, производное алкиламинопиридазин-3-она формулыb) для получения производного 2 Н-пиридазин-3-она формулы I, где X представляет собой группу формулы II, Y, R и n такие, как определены для формулы I, производное алкиламинопиридазин-3-она формулы где Z означает уходящую группу, R, Y и n определены выше, подвергают реакции с 6-фтор-3-пиперидин 4-ил-1,2-бензизоксазолом формулы IV; или с) для получения производного 2 Н-пиридазин-3-она формулы I, где X означает атом галогена, Y представляет собой группу формулы II и/или Y означает атом галогена, X представляет собой группу формулы II, R и n такие, как определены для формулы I, производное дигалогенпиридазин-3-она формулы где n указано выше,и, если необходимо, полученное производное 2 Н-пиридазин-3-она формулы I превращают в его фармацевтически приемлемую соль присоединения кислоты или выделяют в свободном виде из его соли присоединения кислоты. Способы а), b) и с) изобретения выполняют в соответствии со способами, известными из литературы [например, March, J.: Advanced Organic Chemistry, Reactions, Mechanism and Structure, 4th edition, JohnWileySons, New York, 1992]. В случае способа с) изобретения в зависимости от исходных соединений обычно образуется смесь соединений формулы I, т.е. соединения формулы I, где X представляет собой группу формулы II и Y означает атом галогена, и соединения формулы I, где X означает атом галогена, иY представляет собой группу формулы II, R и n такие, как определены для формулы I. Компоненты смеси разделяют стандартными способами препаративной органической химии, например с помощью фракционированной кристаллизации. Производное 2 Н-пиридазин-3-она формулы I может быть подвергнуто реакции с неорганической или органической кислотой способом, известным per se, для получения его фармацевтически приемлемой соли присоединения кислоты или может быть выделено в свободном виде из его соли присоединения кислоты с использованием подходящего неорганического или органического основания. Производные алкиламинопиридазин-3-она формул III и V, использующиеся в качестве исходных веществ, могут быть получены по способу, описанному в международной патентной заявкеPCT/HU98/00054. 6-Фтор-3-пиперидин-4-ил-1,2-бензизоксазол формулы IV был описан в статье из J. Med. Chem.,28(6), 761-769 (1985). Производные дигалогенпиридазин-3-она формулы VI также известны [J. Chem. Soc, 1948, 2192,2194]. Производное бензизоксазола формулы VII может быть получено из 6-фтор-3-пиперидин-4-ил-1,2 бензизоксазола формулы IV путем аминоалкилирования способом, известным из литературы [Arch.Pharm., 329(1), 3-10 (1996); J. Med. Chem., 28(12), 1934-1943 (1985)]. Фармакологическую активность производных 2 Н-пиридазин-3-она формулы I исследовали в сле-3 006246 дующих тестах. 1. Способы моделирования позитивных симптомов 1.1. Ингибирование условного рефлекса избегания (УРИ) Антипсихотический (нейролептический) эффект измеряли путем определения ингибирования приобретенного условного рефлекса избегания (от англ. conditioned avoiding reflex). В начале обучения для экспериментов использовали самцов крыс Wistar с весом тела от 120 до 150 г. Экспериментальный аппарат представлял собой так называемый "шатл-бокс" (от англ. shuttle-box - ящик, в котором животное может передвигаться туда и обратно), состоящий из двух помещений размером 24 х 24,5 х 23 см, отделенных друг от друга стенкой. Эти два помещения были соединены проходом размером 6 х 9 см. Во время теста задача животных заключалась в том, чтобы в случае соответствующего предупредительного сигнала (раздражителя) перейти через проход из одного помещения в другое, избежав таким образом наказания (безусловного раздражителя). Предупредительный (условный) раздражитель появлялся в помещении, где находилось животное. Условный раздражитель (УР) представлял собой мерцающий (1 Гц) белый свет, длившийся 15 с. Безусловный раздражитель (БР) представлял собой случайный электрошок,приложенный к конечности животного с силой тока 0,6 мА, который появлялся в последние 5 с действия условного раздражителя. Переход животного из одного помещения "шатл-бокса" в другое во время действия условного раздражителя рассматривали как рефлекс избегания, тогда как его переход во время действия безусловного раздражителя рассматривали как рефлекс бегства. Оба рефлекса подкреплялись реальным раздражителем, и испытание прекращали. Интервал между испытаниями составлял 15 с, в день проводили 80 испытаний. Эффективность обучения определяли как соотношение числа успешных реакций избегания к общему числу испытаний в процентах. Эффект нейролептиков определяли на животных,демонстрирующих эффективность обучения по меньшей мере 75% после стабилизации условного рефлекса. Тест-соединения вводили крысам один раз в неделю за 1 ч до серии экспериментов. При оценке эффекта нейролептиков в каждой группе в качестве контроля использовали поведение животных накануне эксперимента. На основе полученных данных определяли 50%-ную ингибирующую дозу (ID50). Эти значения представлены в табл. 1. Хлорпромазин [2-хлор-10-(3-диметиламинопропил)фенотиазин] и клозапин [8-хлор-11-(4-метил-1 пиперазинил)-5 Н-дибензо[b,е][1,4]диазепин] использовали в качестве контрольных веществ. Таблица 1. Ингибирование условного рефлекса избегания Результаты, представленные в табл. 1, показывают, что каждое из исследуемых соединений по настоящему изобретению эффективно ингибировало условный рефлекс избегания. Их эффективность превышала эффективность контрольных молекул по меньшей мере на один порядок относительно абсолютной величины. 1.2 Ингибирование апоморфиновой стереотипии и лазания по стенке у мышей В этих экспериментах использовали самцов мышей NMRI с весом тела от 20 до 24 г. Животных обрабатывали соответственно носителем и тест-соединением (20 мл объема/кг веса тела), затем через 30 мин их помещали для привыкания в клетки из проволоки размером 12 х 12 с х 12 см, которые могли закрывать пластинами из плексигласа. Через 30 мин мышам вводили подкожно 1 мл/кг апоморфин гидрохлорида в объеме 10 мл/кг. Оценку стереотипического поведения начинали сразу же после обработки апоморфином и продолжали в течение 25 мин. Оценку проводили с помощью шкалы, имеющей пять градаций: 0 баллов: нормальное поведение, соответствующее поведению контрольных животных; 1 балл: перманентная исследовательская активность, принюхивание или движение головой в сторону время от времени; 2 балла: интенсивное непрерывное движение головой или принюхивание, периодическая исследовательская активность; 3 балла: облизывание, кусание или грызение время от времени, сменяющееся интенсивным приню-4 006246 хиванием или движением головой, двигательная активность, длящаяся в течение очень короткого времени; 4 балла: непрерывное интенсивное облизывание и/или грызение в одном и том же месте без какойлибо двигательной или исследовательской активности. Позу, когда мышь залезала на вертикальную стенку по меньшей мере тремя лапами, рассматривали как лазание по стенке. Оценку поведения проводили в последние десять минут наблюдения на основании да/нет (+/-). Оценка стереотипии: для каждого животного принимали во внимание и записывали соответственно самое высокое значение в баллах, полученное во время наблюдения. Исходя из максимальных значений в баллах, рассчитывали среднее значение для каждой группы, которое сравнивали со средним значением для контрольной группы, для того чтобы определить эффект в процентах. Исходя из этих последних значений на основании зависимости эффекта от дозы определяли величину ID50 (дозу, вызывающую 50%ное ингибирование) с помощью линейной регрессии. Оценка лазания по стенке: при оценке ингибирующего эффекта принимали во внимание число животных, демонстрирующих лазание по стенке. Для каждой группы рассчитывали частоту, затем определяли эффект в процентах, принимая результат, полученный для контрольной группы, за 100%. Исходя из эффектов, выраженных в процентах, на основании зависимости эффекта от дозы вычисляли величинуED50 (дозу, вызывающую ингибирование у 50% животных) согласно Litchfield и Wilcoxon [J. Pharmacol,Exp. Then, 96, 99 (1949)]. Полученные результаты просуммированы в табл. 2. В этом случае хлорпромазин и клозапин снова использовали в качестве контрольных веществ. Таблица 2. Ингибирование апоморфин-индуцированной стереотипии и лазания по стенке Из данных, представленных в табл. 2, можно видеть, что соединения по настоящему изобретению ингибировали поведенческие реакции, индуцированные апоморфином, в дозах, которые оказались на один или более порядков ниже, чем дозы контрольных веществ. Кроме того, атипичный нейролептик клозапин и исследуемые новые соединения более эффективно ингибировали реакцию лазания по стенке,чем стереотипию. 2. Тесты, моделирующие негативные симптомы 2.1 Ингибирование гиперподвижности, индуцированной фенциклидином (РСР) Эксперименты проводили с помощью "цифрового измерителя подвижности" (от англ. digital motimeter), состоящего из 10 каналов, используя одно животное на канал. В каждом канале для измерения(ящик размером 44 х 8 х 10 см) перемещение животного определяли по прерыванию трех параллельных инфракрасных световых лучей, которое регистрировалось аппаратом. Через 60 мин после перорального введения (20 мл/кг) соединения, подлежащего тестированию, и носителя, соответственно, животным вводили 3 мг/кг фенциклидина [1-(1-фенилциклогексил)пиперидина] в дозе 10 мл/кг внутрипетонеально. Через 15 мин обработанных животных помещали в аппарат и через 45 мин в каждом канале считывали количество прерываний инфракрасного светового луча. В каждой тест-группе использовали 10 мышей. При оценке ингибирования для каждой тест-группы вычисляли среднее значение, затем определяли эффект в процентах, принимая среднее значение для контрольной группы за 100%. Исходя из эффектов,выраженных в процентах, определяли величины ID50 на основании зависимости эффекта от дозы с помощью линейной регрессии. Полученные результаты представлены в табл. 3. Галоперидол [4-(4 хлорфенил-4-гидрокси-1-пиперидинил)-1-(4-фторфенил)-1-бутанон] и клозапин использовали в качестве контрольных веществ. Из табл. 3 можно видеть, что исследуемые соединения по настоящему изобретению ингибировали увеличение двигательной активности, индуцированной фенциклидином, гораздо более эффективно, чем контрольные вещества. 3. Каталептогенный эффект Каталептогенный эффект изучали по способу Morpurgo [Morpurgo, С, Arch. Int. Pharmacodyn., 137, 84(1962)]. Для исследований использовали самцов крыс Wistar с весом тела от 220 до 240 г. Передние лапы крысы,одну за другой, помещали на клейкий ограничитель и наблюдали, способно ли животное выдержать необычную позу. Нормальное (некаталептическое) животное удаляет лапу из ограничителя в течение 10 с измерения. Если животное оставляет лапу на ограничителе в течение этого времени, то это ригидное состояние, сопровождающееся миотонией, оценивают как каталепсию. Для каждого исследуемого соединения определяли минимальную эффективную дозу (МЭД). Полученные результаты представлены в табл. 4. Галоперидол и рисперидон [3-2-[-4(6-фтор-1,2-бензизоксазол-3-ил)пиперидинил]этил-6,7,8,9-тетрагидро-2-метил-4 Н-пиридо[1,2-а]пиримидин-4 он] использовали в качестве контрольных веществ. В табл. 4 дается также соотношение дозы, которая индуцирует каталепсию, и величины ID50, характеризующей ингибирование условного рефлекса избегания (УРИ). Таблица 4. Каталептогенный эффект Из данных табл. 4 очевидно, что соединения по настоящему изобретению индуцируют каталепсию в значительно более высоком диапазоне доз (различие является по меньшей мере 3-кратным), чем контрольные вещества. Сравнение диапазона терапевтических доз и доз, индуцирующих каталепсию, показывает, что соединения формулы I имеют гораздо более предпочтительный профиль побочных эффектов,чем контрольные вещества. 4. Отсутствие кардиотоксического эффекта Кардиотоксический эффект определяли in vitro на изолированной правовентрикулярной папиллярной мышце кролика. Способ Использовали модифицированный способ Hackett с соавт. (1990) (Hacket, A.M., Mc Donald S.J., P.,Schweingruber, F. and Gartwaite, S. M.: Simple in vitro method to characterize antiarrhythmic agents. J. Pharmacol. Methods, 23, 107-116, 1990). Эффективный рефракторный период (ЭРП) измеряли in vitro на изо-6 006246 лированной право-вентрикулярной папиллярной мышце кролика. Оценивали сокращения препаратов папиллярной мышцы, полученных от кроликов New Zealand весом 2,5-3,2 кг. Сокращения (изометрически заданные при 1 Гц) регистрировали с помощью 4-канального аппарата Хьюго-Сакса (Hugo Sachs). Эффекты тест-соединений или контрольных веществ измеряли при концентрации 1 мкМ. Эффект считали кардиотоксическим, если соединение значительно (р 0,01 или р 0,001) пролонгировало ЭРП. Результаты просуммированы в табл. 5. Таблица 5 Неожиданно оказалось, что соединения по настоящему изобретению в концентрациях 1 мкМ не имели кардиотоксического эффекта несмотря на то, что они содержат бензизоксазольный структурный элемент. Структурно похожие контрольные лекарственные препараты рисперидон и илоперидон продемонстрировали значительный кардиотоксический эффект. В заключение можно констатировать, что соединения по настоящему изобретению эффективны для лечения заболеваний, сопровождающихся расстройствами психической и эмоциональной жизни. Новые соединения оказывают значительное терапевтическое воздействие как на позитивные, так и на негативные синдромы шизофрении. Это подтверждается результатами, полученными при тест-измерении условного рефлекса избегания, в тестах на взаимодействие, индуцированных апоморфином, а также при ингибировании эффекта фенциклидина. А именно, фенциклидин способен индуцировать психотические симптомы у мужчин, очень напоминающие дефицитарные симптомы при шизофрении. Поэтому РСР модель, использованная в тестах, особенно подходит для оценки эффекта на негативные симптомы [Steinpreis, R.E., Behav. Brain Res., 74, 1-2, 45 (1995)]. Особо примечательным является то, что исследуемые новые соединения ингибируют реакцию лазания по стенке, индуцированную апоморфином, в гораздо меньшем диапазоне доз по сравнению с дозами, которые ингибируют стереотипическое поведение. Эта находка имеет особое значение, поскольку согласно литературным данным ингибирование апоморфиновой стереотипии имеет отношение к блокаде дофаминовых рецепторов стриальной ткани, тогда как ингибирование лазания по стенке имеет отношение к блокаде дофаминовых рецепторов nucleus accumbens[Costall et al., Eur. J. Pharmacol., 50, 39 (1978)]. Следовательно можно ожидать, что соединения по настоящему изобретению в терапевтических дозах не будут индуцировать экстрапирамидные побочные эффекты. Неожиданно было обнаружено, что соединения по настоящему изобретению не имеют кардиотоксического эффекта несмотря на наличие бензизоксазольного структурного элемента. На основании описанных выше тестов соединения по настоящему изобретению и их фармацевтически приемлемые соли присоединения кислот могут использоваться в фармацевтических композициях в качестве активных ингредиентов. Более того, изобретение касается фармацевтической композиции, содержащей производное 2Hпиридазин-3-она формулы I или его фармацевтически приемлемую соль присоединения кислоты и один или более стандартных носителей. Фармацевтическая композиция по настоящему изобретению содержит обычно от 0,1 до 95 мас.%,предпочтительно от 1 до 50 мас.%, более предпочтительно от 5 до 30 мас.% активного ингредиента. Фармацевтическая композиция по настоящему изобретению пригодна для перорального, парентерального, ректального или трансдермального введения или для местного лечения и может быть твердой или жидкой. Твердые фармацевтические композиции, подходящие для перорального введения, могут представлять собой порошки, капсулы, таблетки, покрытые оболочкой таблетки, микрокапсулы и т.д., и в качестве носителя могут содержать связывающие агенты, такие как желатин, сорбит, поливинилпирролидон и т.д.; наполнители, такие как лактоза, глюкоза, крахмал, фосфат кальция и т.д.; вспомогательные вещества-7 006246 для таблетирования, такие как стеарат магния, тальк, полиэтиленгликоль, двуокись кремния и т.д.; увлажняющие агенты, такие как лаурилсульфат натрия и т.д. Жидкие фармацевтические композиции, подходящие для перорального введения, могут представлять собой растворы, суспензии или эмульсии и в качестве носителя могут содержать, например, суспендирующие агенты, такие как желатин, карбоксиметил-целлюлоза и т.д.; эмульгаторы, такие как сорбитан моноолеат и т.д.; растворители, такие как вода, масла, глицерин, пропиленгликоль, этанол и т.д.; консерванты, такие как метил-п-гидроксибензоат и т.д. Фармацевтические композиции, подходящие для парентерального введения, обычно представляют собой стерильные растворы активного ингредиента. Лекарственные формы, перечисленные выше, а также другие лекарственные формы известны perse,см., например, Remington's Pharmaceutical Sciences, 18th Edition, Mack Publishing Co.,Easton, USA (1990). Фармацевтическая композиция обычно содержит определенную дозу лекарственного средства. Стандартная доза для взрослых пациентов составляет от 0,1 до 1000 мг соединения формулы I или его фармацевтически приемлемой соли присоединения кислоты в сутки в рассчете на 1 кг веса тела. Суточная доза может вводиться одной порцией или несколькими порциями. Реальная доза зависит от многих факторов и определяется врачом. Фармацевтическую композицию приготавливают путем смешивания соединения формулы I или его фармацевтически приемлемой соли присоединения кислоты с одним или более носителями и последующего получения фармацевтической композиции по способу, известному perse. Полезные способы известны из литературы, например из Remington's Pharmaceutical Sciences, упомянутого выше. Одна подгруппа фармацевтических композиций по настоящему изобретению содержит в качестве активного ингредиента производное 2H-пиридазин-3-она формулы I, где X представляет собой группу формулы II, Y означает атом водорода или атом галогена, R и n, такие как определены для формулы I,или его фармацевтически приемлемую соль присоединения кислоты. В пределах этой подгруппы предпочтительная фармацевтическая композиция содержит в качестве активного ингредиента производное 2H-пиридазин-3-она, где R означает атом водорода или метильную группу, Y означает атом водорода или атом хлора, X и n определены выше, или его фармацевтически приемлемую соль присоединения кислоты. Другая подгруппа фармацевтических композиций по настоящему изобретению содержит в качестве активного ингредиента производное 2 Н-пиридазин-3-она формулы I, где X означает атом водорода или атом галогена, Y представляет собой группу формулы II, R и n такие, как определены для формулы I, или его фармацевтически приемлемую соль присоединения кислоты. В пределах этой подгруппы предпочтительная фармацевтическая композиция содержит в качестве активного ингредиента производное 2H-пиридазин-3-она, где R означает атом водорода или метильную группу, X означает атом водорода или атом хлора, X и n такие, как определены выше, или его фармацевтически приемлемую соль присоединения кислоты. Особенно предпочтительная фармацевтическая композиция содержит в качестве активного ингредиента 4 хлор-5-2-[4-(6-фтор-1,2-бензизоксазол-3-ил)пиперидин-1-ил]этиламино-2-метил-2-пиридазин-3-он, 4-хлор-53-[4-(6-фтор-1,2-бензизоксазол-3-ил)пиперидин-1-ил]пропиламино-2-метил-2H-пиридазин-3-он, или их фармацевтически приемлемые соли присоединения кислот. Изобретение также касается применения соединения формулы I или его фармацевтически приемлемой соли присоединения кислоты для получения фармацевтической композиции, имеющей нейролептический эффект. Кроме того, изобретение касается способа лечения, при котором пациенту, страдающему от заболевания, сопровождающегося расстройствами психической и эмоциональной жизни, особенно, от шизофрении, вводят нетоксическое количество производного 2 Н-пиридазин-3-она формулы I или его фармацевтически приемлемой соли присоединения кислоты. Изобретение дополнительно поясняется с помощью следующих примеров. Пример 1. Получение 4-2-[4-(6-фтор-1,2-бензизоксазол-3-ил)пиперидин-1-ил]этиламино-5-хлор 2-метил-2 Н-пиридазин-3-она. Смесь 1,5 г (5,7 ммоль) 2-[4-(6-фтор-1,2-бензизоксазол-3-ил)пиперидин-1-ил]этиламина, 50 см 3 диоксана, 0,93 г (5,2 ммоль) 4,5-дихлор-2-метил-2H-пиридазин-3-она и 1,38 г карбоната калия кипятят при перемешивании в течение 24 ч. Затем реакционную смесь фильтруют, упаривают и грубый продукт подвергают хроматографии на силикагеле с использованием смеси гексана и ацетона (3:1) в качестве элюента. Фракции, содержащие продукт, объединяют, упаривают, остаток суспендируют в диэтиловом эфире,фильтруют и высушивают. Таким образом получают 0,74 г (35.4%) названного соединения. Т.пл.: 108-109 С. Анализ для C19H21CIFN5O2 (405.86) вычислено: С 56,23%, Н 5,22%, N 17,26%, Cl 8,74%; найдено: С 55,80%, Н 5,17%, N 16,99%, Cl 8,52%. ИК(КВr): 3290, 1630, 1607, 1554. 1 Н-ЯМР (CDCl3, i400): 7,76 (м, 1 Н), 7,50 (с, 1 Н), 7,24 (д.д, J1=1,7 Гц, J2=8,5 Гц, 1 Н), 7,07 (д.т, Jд=1,8(м, 4 Н). 13 С-ЯМР (CDCl3, i400): 164,07 (д, J=251,0 Гц), 163,81, 160,83, 156,37, 139,79, 139,07, 122,81, 117,15,112,37 (д, J=25,6 Гц), 97,38 (д, J=26,7 Гц), 57,44, 53,06, 40,53, 39,93, 34,34, 30,31. Пример 2. Получение 4-3-[4-(6-фтор-1,2-бензизоксазол-3-ил)пиперидин-1-ил]пропиламино-5 хлор-2-метил-2H-пиридазин-3-она Смесь 1,12 г (4 ммоль) 4-(3-бромпропиламино)-5-хлор-2-метил-2H-пиридазин-3-она, 20 см 3 ацетонитрила, 1,05 г (4,8 ммоль) 6-фтор-3-пиперидин-4-ил-1,2-бензизоксазола и 0,87 см 3 триэтиламина кипятят при перемешивании в течение 2 ч. Затем реакционную смесь упаривают и в грубый продукт прибавляют 30 см 3 воды. Водный слой экстрагируют три раза, каждый раз используя 30 см 3 этилацетата. Объединенные органические фазы промывают дважды, каждый раз используя 30 см 3 воды, и высушивают над безводным сульфатом магния. После фильтрации органическую фазу упаривают и полученный грубый продукт перекристаллизовывают из 2-пропанола. Таким образом получают 1,1 г (65,8%) названного продукта. Т.пл.: 117-119 С. Анализ для C20H23ClFN5O2 (419,89) вычислено: С 57,21%, Н 5,52%, N 16,68%, Cl 8,44%; найдено: С 56,94%, Н 5,50%, N 16,57%, Cl 8,43%. ИК (КВr): 3200, 1611, 1493. 1 Н-ЯМР (CDCl3, i400): 8,16 (уш.д.д, J1=5,3 Гц, J2=8,3 Гц, 1 Н), 7,47 (с, 1 Н), 7,23 (м, 2 Н), 7,04 (т.д,JT=2,1 Гц, JT=8,9 Гц, 1 Н), 3,92 (к, J=6,1 Гц, 2 Н), 3,75 (с, 3 Н), 3,14 (м, 3 Н), 2,58 (м, 2 Н), 2,34 (м, 2 Н), 2,18(168 ммоль) 6-фтор-3-пиперидин-4-ил-1,2-бензизоксазола, 4,48 г (32 ммоль) карбоната калия и 0,27 г (1,6 ммоль) йодида калия кипятят при перемешивании в течение 24 ч. Затем реакционную смесь упаривают и грубый продукт подвергают хроматографии на силикагеле с использованием смеси гексана, этилацетата и метанола (1:1:0,2) в качестве элюента. Фракции, содержащие продукт, объединяют, упаривают, остаток суспендируют в диэтиловом эфире, фильтруют и высушивают. Таким образом получают 1,94 г (30,0%) названного соединения. Т.пл.: 198-200 С. Анализ: для C19H21ClFN5O2: вычислено: С 56,23%, Н 5,22%, N 17,26%, Cl 8,74%; найдено: С 55,80%, Н 5,17%, N 16,99%, Cl 8,52%. ИК(КВr): 3348, 1615, 1494. 1 Н-ЯМР (CDCl3, i400): 12,82 (с, 1 Н), 8,22 (уш.д.д, J1=5,6 Гц, J2=8,2 Гц, 1 Н), 7,73 (д, J=8,0 Гц, 1 Н),7,32 (м, 3 Н), 3,81 (м, 2 Н), 3,4-3,0 (м, 5 Н), 2,4-2,0 (м, 6 Н), 1,84 (м, 2 Н). 13 С-ЯМР (CDCl3, i400): 166,05 (д, J=250,3 Гц), 163,15 (д, J=14,5 Гц), 161,22, 156,94, 140,03, 139,53,124,05 (д, J=11,1 Гц), 117,19, 112,55 (д, J=25,3 Гц), 105,43, 97,20 (д, J=27,5 Гц), 56,06, 52,95, 42,74, 33,51,29,53, 26,73. Пример 4. Получение 4-хлор-5-2-[4-(6-фтор-1,2-бензизоксазол-3-ил)пиперидин-1-ил]этиламино 2-метил-2H-пиридазин-3-она Смесь 1,9 г (8,6 ммоль) 4-хлор-5-(2-хлорэтиламино)-2-метил-2 Н-пиридазин-3-она, 40 см 3 ацетонитрила, 2,07 г (9,4 ммоль) 6-фтор-3-пиперидин-4-ил-1,2-бензизоксазола, 2,36 г (32 ммоль) карбоната калия и 0,17 г (1,6 ммоль) йодида калия кипятят при перемешивании в течение 24 ч. Затем реакционную смесь фильтруют через слой угля, содержащий сульфат магния, и органический слой упаривают. Грубый продукт растворяют в этилацетате, промывают водой и органический слой высушивают над безводным сульфатом магния. После фильтрации органическую фазу упаривают и полученный грубый продукт перекристаллизовывают из этилацетата. Таким образом получают 2,8 г (80,5%) названного продукта. Т.пл.: 145-147 С. Анализ: для C19H21ClFN5O2 (405,86) вычислено: С 56,23%, Н 5,22%, N 17,26%, Cl 8,74%; найдено: С 55,73%, Н 5,26%, N 16,98%, Cl 8,98%. ИК(КВr): 3278, 1635, 1616. 1 Н-ЯМР (CDCl3, i400): 7,66 (д.д, J1=5,1 Гц, J2=8,7 Гц, 1 Н), 7,56 (с, 1 Н), 7,25 (д.д, J1=2,1 Гц, J2=8,5 Гц,1 Н), 7,07 (т.д, Jд=2,1 Гц, JT=8,8 Гц, 1 Н), 5,62 (уш.т, 1 Н), 3,76 (с, 3 Н), 3,40 (к, J=5,6 Гц, 2 Н), 3,13 (м, 1 Н),3,04 (м, 2 Н), 2,75 (т, J=6,0 Гц, 2 Н), 2,32 (м, 2 Н), 2,10 (м, 4 Н). 13 С-ЯМР (CDCl3, i400): 164,03 (д, J=250,6 Гц), 163,81 (д, J=13,4 Гц), 160,71, 157,75, 144,04, 125,62,122,35 (д, J=11.1 Гц), 117,13, 112,39 (д, J=25.6 Гц), 107,40, 97,40 (д, J=27,1 Гц), 56,02, 52,92, 40,11, 39,23,-9 006246 34,20, 30,48. Пример 5. Получение 4-хлор-5-3-[4-(6-фтор-1,2-бензизоксазол-3-ил)пиперидин-1-ил]пропиламино-2 метил-2H-пиридазин-3-она Смесь 2,4 г (10 ммоль) 4-хлор-5-(2-хлорпропиламино)-2-метил-2 Н-пиридазин-3-она, 40 см 3 ацетонитрила, 2,46 г (11 ммоль) 6-фтор-3-пиперидин-4-ил-1,2-бензизоксазола, 2,8 г карбоната калия и 0,18 г йодида калия кипятят при перемешивании в течение 24 ч. Затем реакционную смесь охлаждают до комнатной температуры и фильтруют. Отфильтрованное вещество суспендируют в 100 см 3 воды при перемешивании и фильтруют снова. Отфильтрованный грубый продукт перекристаллизовывают из ацетонитрила. Таким образом получают 2,4 г (57,3%) названного соединения. Т.пл.: 200-202 С. Анализ: для C20H23ClFN5C2 (419.89) вычислено: С 57,21%, Н 5,52%, N 16,68%, Cl 8,44%; найдено: С 56,78%, Н 5,48%, N 16,38%, Cl 8,44%. ИК(КВr): 3348, 1606. 1 Н-ЯМР (ДМСО-d6, i400): 8,00 (д.д, J1=5,3 Гц, J2=8,7 Гц, 1 Н), 7,91 (с, 1 Н), 7,68 (д.д, J1=2,1 Гц, J2=9,1 Гц, 1 Н), 7,28 (-д.т.м, Jд=2,1 Гц, JT=9,0 Гц, 1 Н), 6,94 (уш.т, J=5,7 Гц, 1 Н), 3,58 (с, 3 Н), 3,42 (к, J=6,1 Гц,2 Н), 3,16 (м, 1 Н), 3,00 (м, 2 Н), 2,43 (т, J=6,3 Гц, 2 Н), 2,07 (м, 4 Н), 1,89 (м, 2 Н), 1,74 (кв, J=6,4 Гц, 2 Н). 13 С-ЯМР (ДМСО-d6, i400): 163,81 (д, J=248,0 Гц), 163,15 (д, J=14,1 Гц), 161,56, 156,92, 144,84,126,58, 123,89 (д, J=11,1 Гц), 117,44, 112,65 (д, J=25,2 Гц), 104,34, 97,27 (д, J=27,5 Гц), 56,07, 53,18, 41,66,39,59, 33,52, 30,20, 26,08. Пример 6. Получение 5-2-[4-(6-фтор-1,2-бензизоксазол-3-ил)пиперидин-1-ил]этиламино-2-метил 2H-пиридазин-3-она Смесь 3,67 г (16,4 ммоль) 5-(2-хлорэтиламино)-2-метил-2 Н-пиридазин-3-она, 90 см 3 ацетонитрила,4,05 г (18,4 ммоль) 6-фтор-3-пиперидин-4-ил-1,2-бензизоксазола, 6,84 г карбоната калия и 0,37 г йодида калия кипятят при перемешивании в течение 24 ч. Затем реакционную смесь охлаждают до комнатной температуры и фильтруют. К отфильтрованному веществу прибавляют 100 см 3 воды и водную фазу экстрагируют пять раз, каждый раз используя 50 см 3 дихлорметана. Объединенные органические фазы промывают водой, высушивают над безводным сульфатом магния, фильтруют и упаривают при пониженном давлении. Полученный остаток суспендируют в диэтиловом эфире и фильтруют. Полученный грубый продукт перекристаллизовывают из ацетонитрила. Таким образом получают 3,4 г (55,9%) названного соединения. Т.пл.: 200-202 С. Анализ: для C19H22FN5O2 (371,42) вычислено: С 61,44%, Н 5,97%, N 18,86%; найдено: С 62,00, Н 5,98%, N 18,84%. ИК(КВr):3261, 1620, 1571, 1114. 1 Н-ЯМР (CDCl3, i400): 8,01 (д.д, J1=5,4 Гц, J2=8,6 Гц, 1 Н), 7,68 (д.д, J1=2,1 Гц, J2=9,1 Гц, 1 Н), 7,53 (с,1 Н), 7,28 (д.д, J1=2,1 Гц, J2=8,5 Гц, 1 Н), 6,80 (уш.т, J=5,9 Гц, 1 Н), 5,51 (с, 1 Н), 3,47 (с, 3 Н), 3,16 (м, 1 Н),3,15 (м, 2 Н), 3,01 (м, 2 Н), 2,52 (м, 2 Н), 2,19 (м, 2 Н), 2,05 (м, 2 Н), 1,84 (м,2 Н). 13 С-ЯМР (ДМСО-d6, i400): 163,80 (д, J=247,6 Гц), 163,16 (д, J=14,1 Гц), 161,52, 161,03, 149,17,131,01, 123,95 (д, J=11,4 Гц), 117,44, 112,65 (д, J=25,2 Гц), 97,50 (д, J=27,5 Гц), 94,40, 56,11, 53,16, 39,49,38,29, 33,54, 30,22. Пример 7. Получение 5-3-[4-(6-фтор-1,2-бензизоксазол-3-ил)пиперидин-1-ил]пропиламино-2 метил-2H-пиридазин-3-она Смесь 4,12 г (17,3 ммоль) 5-(3-хлорпропиламино)-2-метил-2 Н-пиридазин-3-он гидрохлорида, 100 см 3 ацетонитрила, 4,29 г (19,5 ммоль) 6-фтор-3-пиперидин-4-ил-1,2-бензизоксазола, 7,24 г карбоната калия и 0,39 г йодида калия кипятят при перемешивании в течение 24 ч. Затем реакционную смесь охлаждают до комнатной температуры и фильтруют. К отфильтрованному веществу прибавляют 150 см 3 воды и водный слой экстрагируют 5 раз, каждый раз используя 90 см 3 дихлорметана. Объединенные органические фазы промывают водой, насыщенной хлоридом натрия, высушивают над сульфатом магния и фильтруют через активный уголь. Органический слой упаривают при пониженном давлении, полученный остаток суспендируют в диэтиловом эфире, затем фильтруют. Грубый продукт перекристаллизовывают из ацетонитрила. Таким образом получают 4,14 г (62,2%) названного соединения. Т.пл.: 163-165 С. Анализ: для C20H24FN5O2 (385,44) вычислено: С 62,32%, Н 6,28%, N 18,17%; найдено: С 62,18%, Н 6,27%, N 18,09%. ИК(КВr): 3264, 1624, 1591, 1119. 1 Н-ЯМР (CDCl3, i400): 7,71 (д.д, J1=5,0 Гц, J2=8,7 Гц, 1 Н), 7,32 (с, 1 Н), 7,26 (д.д, J1=2,1 Гц, J2=8,4 Гц,1 Н), 7,10 (д.т, Jд=2,1 Гц, JT=8,8 Гц, 1 Н), 6,48 (шир, 1 Н), 5,65 (д, J=2,7 Гц, 1 Н), 3,66 (с, 3 Н), 3,22 (м, 5 Н),2,72 (м, 2 Н), 2,42 (м, 2 Н), 2,42 (м, 4 Н), 1,93 (м, 2 Н). 13 С-ЯМР (ДМСО-d6, i400): 164,26 (д, J=251,8 Гц), 164,00 (д, J=13,7 Гц), 162,23, 160,42, 148,81,- 10006246 130,69, 122,29 (д, J=11,1 Гц), 117,22, 112,61 (д, J=25,2 Гц), 97,52 (д, J=26,7 Гц), 96,38, 57,21, 53,22, 42,31,38,94, 33,70, 30,16, 23,92. Пример 8. Получение 5-2-[4-(6-фтор-1,2-бензизоксазол-3-ил)пиперидин-1-ил]этиламино-4-хлор 2H-пиридазин-3-она Смесь 5,6 г (22,2 ммоль) 5-(3-бромэтиламино)-4-хлор-2H-пиридазин-3-она, 16 см 3 абсолютного диметилформамида, 5,62 г (25,5 ммоль) 6-фтор-3-пиперидин-4-ил-1,2-бензизоксазола, 8,85 см 3 триэтиламина и 0,44 г йодида калия перемешивают при 60 С в течение 2 ч. Затем реакционную смесь охлаждают до комнатной температуры и по каплям прибавляют раствор 5,46 г карбоната натрия в 50 см 3 воды. Эту смесь перемешивают в течение получаса, полученную суспензию фильтруют и вещество, отделенное посредством фильтрации, промывают 3 раза, каждый раз используя 20 см 3 воды. Полученный грубый продукт растворяют в смеси ацетонитрила и воды (9:1) при кипячении, фильтруют горячим и маточную жидкость упаривают до трети первоначального объема. Затем маточную жидкость охлаждают ледяной водой и перемешивают в течение 2 ч. Полученные кристаллы фильтруют. Таким образом получают 6,75 г (77,6%) названного соединения. Т.пл.: 229-231 С. Анализ: для C18H19ClFN5O2 (391,84) вычислено: С 55,18%, Н 4,89%, Cl 9,05%, N 17,87%; найдено: С 54,79%, Н 4,94%, Cl 8,75%, N 17,56%. ИК(КВr): 3305, 3141, 1641, 1607. 1 Н-ЯМР (ДМСО-d6, i400): 12,58 (уш.с, 1 Н), 7,96 (д.д, J1=5,3 Гц, J2=8,8 Гц, 1 Н), 7,88 (с, 1 Н), 7,68 (д.д,J1=2,1 Гц, J2=9,1 Гц, 1 Н), 7,30 (т.д, Jд=2,1 Гц, JT= 9,1 Гц, 1 Н), 6,42 (уш.т, J=5,.9 Гц, 1 Н), 3,47 (к, J=6,1 Гц, 2 Н), 3,15 (м, 1 Н), 3,01 (м, 2 Н), 2,57 (т, J=6,2 Гц, 2 Н), 2,23 (м, 2 Н), 2,02 (м, 2 Н), 1,80 (м, 2 Н). 13 С-ЯМР (ДМСО-d6, i400): 163,79 (д, J=248,0 Гц), 163,18 (д, J=14,1 Гц), 161,46, 157,98, 145,28,128,09, 127,96, 123,90 (д, J=11,0 Гц), 123,80 (д, J=8,7 Гц), 117,37 (д, J=0,8 Гц), 112,72 (д, J=24,0 Гц), 112,66(д, J=24,8 Гц), 104,40, 97,61 (д, J=27,1 Гц), 97,45 (д, J=27,5 Гц), 57,23, 57,40, 53,12, 39,70, 33,54, 33,44,30.40. Пример 9. Получение 5-2-[4-(6-фтор-1,2-бензизоксазол-3-ил)пиперидин-1-ил]этиламино-2Hпиридазин-3-она Смесь 2,72 г (12,9 ммоль) 5-(2-хлорэтиламино)-2H-пиридазин-3-он гидрохлорида, 11 см 3 абсолютного диметилформамида, 5,0 г (22,7 ммоль) 6-фтор-3-пиперидин-4-ил-1,2-бензизоксазола, 6,3 см 3 триэтиламина и 0,21 г йодида калия перемешивают при температуре кипения в течение 8 ч. Затем реакционную смесь охлаждают до комнатной температуры и фильтруют. К маточной жидкости прибавляют по каплям раствор 2,6 г бикарбоната натрия в 40 см 3 воды. Полученный осадок фильтруют, суспендируют в 100 мл дихлорметана, перемешивают в течение 30 мин, затем снова фильтруют. Полученный грубый продукт перекристаллизовывают из смеси воды и ацетонитрила (4:1). Образовавшиеся кристаллы фильтруют. Таким образом получают 2,98 г (64,6%) названного соединения. Т.пл.: 97-99 С. Анализ: для C18H20FN5O2 (357,39) вычислено: С 60,49%, Н 5,64%, N 19,60%; найдено: С 59,97%, Н 5,74%, N 19,28%. ИК(Кbr): 3261, 1616, 1272, 1176. 1 Н-ЯМР (ДМСО-d6, i400): 11,92 (уш.с, 1 Н), 8.00 (д.д, J1=5,0 Гц, J2=8,8 Гц, 1 Н), 7,68 (д.д, J1=2,2 Гц,J2=9,2 Гц, 1 Н), 7,52 (д, J=2,6 Гц, 1 Н), 7,28 (т.д. Jд=2,2 Гц, JT=9,0 Гц, 1 Н), 6,84 (уш.т, J=5,2 Гц, 1 Н), 5,42 (д,J=2,4 Гц, 1 Н), 3,15 (м, 1 Н), 3,01 (м, 2 Н), 3,02 (м, 2 Н), 2,56 (т, J=6,5 Гц, 2 Н), 2,20 (м, 2 Н), 2,03 (м, 2 Н), 1,87 где R означает атом водорода или C1-4-алкильную группу;X и Y независимо представляют собой атом водорода, атом галогена или группу формулы при условии, что один из X и Y всегда представляет собой группу формулы II, а другой радикал представляет собой атом водорода или атом галогена, где в формуле II n имеет значение 1 или 2,и его фармацевтически приемлемые соли присоединения кислот. 2. Производное 2 Н-пиридазин-3-она общей формулы I по п.1, гдеR означает водород или C1-4-алкил;X означает водород или галоген;Y означает группу общей формулы II иn означает 1 или 2,и его фармацевтически приемлемые соли присоединения кислот. 3. Соединения по п.2, гдеY означает группу общей формулы II иn означает 1 или 2,и их фармацевтически приемлемые соли присоединения кислот. 4. Соединение по п.3 4-хлор-5-[2-[4-(6-фтор-1,2-бензизоксазол-3-ил)пиперидин-1-ил]этиламино]-2-метил-2H-пиридазин 3-он и его фармацевтически приемлемые соли присоединения кислот. 5. Соединение по п.3 4-хлор-5-[3-[4-(6-фтор-1,2-бензизоксазол-3-ил)пиперидин-1-ил]пропиламино]-2-метил-2 Н-пиридазинон и его фармацевтически приемлемые соли присоединения кислот. 6. Производные 2H-пиридазин-3-она общей формулы I по п.1, гдеR представляет собой водород или С 1-4-алкил;X означает группу общей формулы II;Y означает водород или хлор и n означает 1 или 2,и их фармацевтически приемлемые соли присоединения кислот. 7. Производные 2 Н-пиридазин-3-она общей формулы I по п.6, гдеR представляет собой водород или метил;X представляет собой группу общей формулы II;Y означает хлор и n означает 1 или 2,и их фармацевтически приемлемые соли присоединения кислот. 8. Способ получения производного 2H-пиридазин-3-она формулы I по п.1, где Y представляет собой группу формулы II, X, R и n такие, как определены для формулы I, или его фармацевтически приемлемых солей присоединения кислот, характеризующийся тем, что производное алкиламинопиридазин-3 она формулы и, если необходимо, полученное производное 2 Н-пиридазин-3-она формулы I превращают в его фарма- 12006246 цевтически приемлемую соль присоединения кислоты или выделяют в свободном виде из его соли присоединения кислоты. 9. Способ получения производного 2 Н-пиридазин-3-она формулы I по п.1, где X представляет собой группу формулы II, Y, R и n такие, как определены для формулы I, или его фармацевтически приемлемых солей присоединения кислот, характеризующийся тем, что производное алкиламинопиридазин-3 она формулы и, если необходимо, полученное производное 2H-пиридазин-3-она формулы I превращают в его фармацевтически приемлемую соль присоединения кислоты или выделяют в свободном виде из его соли присоединения кислоты. 10. Способ получения производного 2 Н-пиридазин-3-она формулы I по п.1, где X означает атом галогена, Y представляет собой группу формулы II и/или Y означает атом галогена, X представляет собой группу формулы II, R и n такие, как определены для формулы I, или его фармацевтически приемлемых солей присоединения кислот, характеризующийся тем, что производное дигалогенпиридазин-3-она формулы где X' и Y' представляют собой атом галогена, R определен выше, подвергают реакции с производным бензизоксазола формулы где n определено выше,и, если необходимо, полученное производное 2 Н-пиридазин-3-она формулы I превращают в его фармацевтически приемлемую соль присоединения кислоты или выделяют в свободном виде из его соли присоединения кислоты. 11. Фармацевтическая композиция, содержащая производное 2 Н-пиридазин-3-она формулы I, где n,R, X и Y такие, как определены в п.1, или его фармацевтически приемлемую соль присоединения кислоты и стандартный носитель. 12. Фармацевтическая композиция по п.11, содержащая в качестве активного ингредиента производное 2H-пиридазин-3-она формулы I, где n, R, X и Y такие, как определены в п.2, или его фармацевтически приемлемую соль присоединения кислоты. 13. Фармацевтическая композиция по п.12, содержащая в качестве активного ингредиента производное 2 Н-пиридазин-3-она формулы I, где n, R, X и Y такие, как определены в п.3, или его фармацевти- 13006246 чески приемлемую соль присоединения кислоты. 14. Фармацевтическая композиция по п.11, содержащая в качестве активного ингредиента 4-хлор-5[2-[4-(6-фтор-1,2-бензизоксазол-3-ил)пиперидин-1-ил]этиламино]-2-метил-2 Н-пиридазин-3-он или его фармацевтически приемлемую соль присоединения кислоты. 15. Фармацевтическая композиция по п.11, содержащая в качестве активного ингредиента 4-хлор-5[3-[4-(6-фтор-1,2-бензизоксазол-3-ил)пиперидин-1-ил]пропиламино]-2-метил-2 Н-пиридазин-3-он или его фармацевтически приемлемую соль присоединения кислоты. 16. Способ лечения, отличающийся тем, что пациенту, страдающему от заболевания, сопровождающегося расстройствами психической и эмоциональной жизни, вводят нетоксическое количество производного 2 Н-пиридазин-3-она формулы I, где n, R, X и Y такие, как определены в п.1, или его фармацевтически приемлемой соли присоединения кислоты. 17. Применение производного 2 Н-пиридазин-3-она формулы I, где n, R, X и Y определены в п.1,или его фармацевтически приемлемой соли присоединения кислоты для получения фармацевтической композиции, имеющей нейролептический эффект. 18. Применение производного 2 Н-пиридазин-3-она формулы I, где n, R, X и Y определены в п.1,или его фармацевтически приемлемой соли присоединения кислоты в качестве фармацевтически активного ингредиента. 19. Применение по п.18, где фармацевтически активный ингредиент представляет собой нейролептический фармацевтически активный ингредиент.
МПК / Метки
МПК: C07D 413/14, A61K 31/50
Метки: способ, содержащие, эти, 2н-пиридазин-3-она, ингредиента, фармацевтические, производные, композиции, активного, получения
Код ссылки
<a href="https://eas.patents.su/15-6246-proizvodnye-2n-piridazin-3-ona-farmacevticheskie-kompozicii-soderzhashhie-eti-proizvodnye-i-sposob-polucheniya-aktivnogo-ingredienta.html" rel="bookmark" title="База патентов Евразийского Союза">Производные 2н-пиридазин-3-она, фармацевтические композиции, содержащие эти производные, и способ получения активного ингредиента</a>
Предыдущий патент: Гидрохлорид 4-[4-(2-пирролилкарбонил)-1-пиперазинил]-3-трифторметилбензоилгуанидина
Следующий патент: Целебное масло
Случайный патент: Способ изготовления контейнера для транспортировки и/или хранения радиоактивных предметов