Кристаллический агомелатин (форма-viii), способ его получения, применение и содержащая его фармацевтическая композиция
Номер патента: 23278
Опубликовано: 31.05.2016
Авторы: Шань Ханьбинь, Хуан Ю, Ю Сюй, Чжу Сюйянь, Юань Чжэдун, Лон Цин
Формула / Реферат
1. Кристаллическая форма VIII агомелатина, имеющая на рентгеноструктурной диаграмме следующие величины брэгговского угла 2θ:

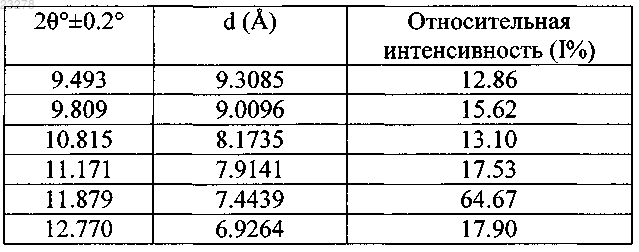
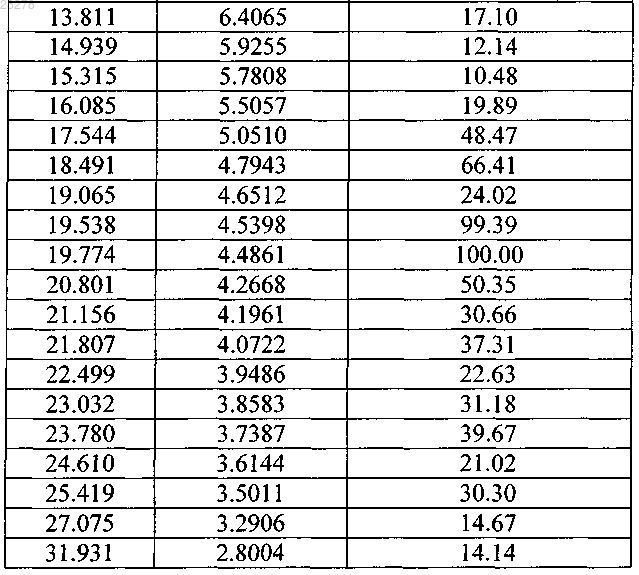
2. Кристаллическая форма VIII агомелатина по п.1, имеющая следующие величины межплоскостного кристаллического расстояния d, брэгговского угла 2θ и относительной интенсивности:
3. Кристаллическая форма VIII агомелатина по п.1 или 2, характеризуемая его диаграммой ДСК, содержащей эндотерму с температурой начала при 97-98°C, площадью эндотермического пика не ниже чем 90%, предпочтительно 95-99%.
4. Способ получения кристаллической формы VIII агомелатина по любому из пп.1-3, в котором соединение агомелатина формулы (II) растворяют в уксусной кислоте, к которой затем добавляют ацетат натрия, сопровождая добавлением по каплям воды к этой реакционной смеси, которую затем взбалтывают при температуре 7-13°C, чтобы вызвать кристаллизацию, с последующим отделением кристаллов из раствора
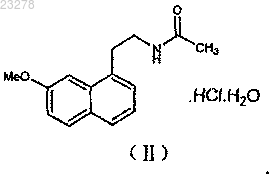
5. Способ получения по п.4, в котором молярное соотношение соединения агомелатина формулы (II) и ацетата натрия составляет 1:1-1.5, наиболее оптимально 1:1-1.1.
6. Способ получения по п.4 или 5, в котором соотношение объема уксусной кислоты к воде составляет 1:15-30.
7. Способ получения по любому из пп.4-6, в котором, когда температура получившейся реакционной смеси достигает 12-18°C, в особенности 15°C, по каплям добавляется вода, чтобы вызвать кристаллизацию.
8. Способ получения по любому из пп.4-7, в котором по каплям добавляется вода к получившейся реакционной смеси, которая затем взбалтывается при температуре 10°C, чтобы вызвать кристаллизацию.
9. Способ получения по любому из пп.4-8, в котором после добавления ацетата натрия реакционная смесь нагревается до 40-80°C; указанный раствор тогда оставляют для самостоятельного охлаждения и по каплям добавляется вода, чтобы вызвать кристаллизацию.
10. Фармацевтическая композиция, обладающая активностью агониста рецепторов мелатонинергической системы и антагониста 5HT2C рецептора, включающая кристаллическую форму VIII агомелатина по любому из пп.1-3 и фармацевтически приемлемые вспомогательные вещества или эксципиенты.
11. Фармацевтическая композиция по п.10, применяемая для получения лекарственного средства для лечения заболеваний мелатонинергической системы.
12. Фармацевтическая композиция по п.10, применяемая для получения лекарственного средства для лечения нарушений сна, стресса, тревоги, сезонного аффективного расстройства, тяжелой депрессии, сердечно-сосудистых заболеваний, болезней пищеварительной системы, бессонницы и усталости, навлеченной нарушением биоритма, шизофрении, фобий или депрессии.
13. Применение формы VIII агомелатина по любому из пп.1-3 для лечения заболеваний мелатонинергической системы.
14. Применение кристаллической формы VIII агомелатина по любому из пп.1-3 для лечения нарушений сна, стресса, тревоги, сезонного аффективного расстройства, тяжелой депрессии, сердечно-сосудистых заболеваний, болезней пищеварительной системы, бессонницы и усталости, навлеченной нарушением биоритма, шизофрении, фобий или депрессии.
Текст
КРИСТАЛЛИЧЕСКИЙ АГОМЕЛАТИН (ФОРМА-VIII), СПОСОБ ЕГО ПОЛУЧЕНИЯ,ПРИМЕНЕНИЕ И СОДЕРЖАЩАЯ ЕГО ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ Изобретение обеспечивает кристаллическую форму VIII агомелатина, имеющую на рентгеноструктурной диаграмме следующие величины брэгговского угла 2: способ ее получения, применение и фармацевтическую композицию. Указанная кристаллическая форма является стабильной и имеет хорошую воспроизводимость. Посредством тестов стабильности было найдено превосходство по сравнению с кристаллической формой VI с точки зрения стабильности. Вследствие этого,кристаллическая форма VIII настоящего изобретения обладает преимуществами в фармацевтическом получении.(71)(73) Заявитель и патентовладелец: ШАНХАЙ ИНСТИТЬЮТ ОФ ФАРМАСЬЮТИКЛ ИНДАСТРИ (CN); ЛЕ ЛАБОРАТУАР СЕРВЬЕ (FR) Область техники Настоящее изобретение относится к смешанной кристаллической форме агомелатина, N-[2-(7 метокси-1-нафтил)этил]ацетамид, способу его получения, применению и фармацевтической композиции. Уровень техники Агомелатин, с химическим названием N-[2-(7-метокси-1-нафтил)этил]ацетамид и торговым названием Вальдоксан, имеет следующую химическую структуру: Он проявляет двойной эффект, действуя не только как агонист рецепторов мелатонинергической системы, но также и как антагонист 5HT2C рецептора. Его свойства означают, что он является активным в центральной нервной системе, особенно в лечении тяжелой депрессии, сезонного аффективного расстройства, нарушений сна, сердечно-сосудистых заболеваний, болезней пищеварительной системы, бессонницы и усталости, навлеченной нарушением биоритма, расстройств пищевого поведения и ожирением. Агомелатин - первый мелатонинергический антидепрессант и эффективен при лечении депрессии и улучшении параметров сна, не затрагивая сексуальную функцию. Получение и терапевтическое применение агомелатина раскрыто в европейском патентеEP0447285. Ввиду фармацевтической ценности указанного соединения важно получить очень чистую, стабильную кристаллическую форму с хорошей воспроизводимостью для него, чтобы соединение было выгодным для фармацевтического получения и достаточно стабильно для длительного хранения, не имея определенных требований в отношении температуры, света, влажности или уровней кислорода. Китайские патенты CN200510071611.6, CN200610108396.7, CN200610108394.8, CN200610108395.2,CN200910047329.2, CN200910245029.5 раскрыли сведения про различные кристаллические формы так же, как и способы получения агомелатина. Среди них, в CN200910047329.2, опубликованы сведения про кристаллическую форму VI, полученную посредством процесса перекристаллизации в уксусной кислоте и воде, которая имеет превосходящую растворимость по сравнению с большинством существующих раскрытых кристаллических форм,таким образом обладая уникальной ценностью относительно ее свойств в фармацевтическом препарате. Однако, помещая кристаллическую форму VI в чрезвычайные условия (высокая температура 60C) в течение 10 дней, могут произойти небольшие количества кристаллического перехода. Исследователи сосредоточились на поиске кристаллической или смешанной кристаллической формы, обладающей большей стабильностью, без компромисса с точки зрения растворимости. Выгодно, посредством исследования различных процессов получения и сравнений стабильности,изобретатель нашел смешанную кристаллическую форму, которая при помещении в чрезвычайные условия предлагает превосходящую стабильность по сравнению с кристаллической формой VI. Указанный смешанный кристалл достигает большей стабильности, не ставя под угрозу превосходную растворимость кристаллической формы VI. Он предлагает большую воспроизводимость и в чрезвычайных условиях,стабильность в процессе получения, таким образом очень увеличивая выполнимость фармацевтического препарата. Область изобретения Цель настоящего изобретения состоит в том, чтобы обеспечить смешанную кристаллическую форму агомелатина, форма VIII, в то же время также обеспечить способ получения. При сравнении с кристаллической формой VI указанная форма VIII предлагает большую стабильность при высокой температуре. Кроме того, она показывает ценные фармацевтические свойства препарата. Смешанная кристаллическая форма VIII агомелатина в настоящем изобретении может применяться в лечении болезней мелатонинергический системы, нарушений сна, стресса, беспокойства, сезонного аффективного расстройства, тяжелой депрессии, сердечно-сосудистых заболеваний, болезней пищеварительной системы, бессонницы и усталости, навлеченной нарушением биоритма, шизофрении, фобий и депрессий. Настоящее изобретение также направлено на возможность обеспечить способ получения формыVIII агомелатина, который является простым в действии и предлагает хорошую воспроизводимость. Дополнительная цель настоящего изобретения состоит в том, чтобы обеспечить фармацевтическую композицию, которая включает смешанную кристаллическую форму VIII агомелатина этого изобретения, так же как фармацевтически приемлемые вспомогательные вещества или наполнители. Упомянутая фармацевтическая композиция может быть сформирована для применения различными путями введения, особенно когда введение или перорально, или через инъекцию. Согласно природе и тяжести болезни лечение может быть назначено путем отрегулированной дозировки, основанной на возрасте и весе пациента. Дозировка может изменяться между 0.1 мг и 1 г в день,-1 023278 которая вводится только один раз или несколько раз. Следующие примеры рентгеноструктурных диаграмм формы VIII агомелатина настоящего изобретения используют межплоскостное кристаллическое расстояние d, брэгговский угол 2 и относительную интенсивность (I%), чтобы показать: При применении рентгенодифракции для измерения кристаллизации настоящего изобретения, иногда из-за измерительного оборудования или условий испытания, измеренные пики показывают небольшие отклонения в измерении; более определенно, например, может быть отклонение в измерении величины 2 приблизительно 0.2; даже если применяется чрезвычайно точное оборудование, может быть замечено отклонение приблизительно 0.1. В результате при определении каждой кристаллической структуры это отклонение должно быть учтено. Условия испытания XRD для указанной формы VIII агомелатина настоящего изобретения: модель прибора: рентгеновский дифрактометр Bruker D8 ADVANCE; параметры эксперимента: детектор: детектор LynxEye; источник излучения: CuK 40 кВ 40 Ма; монохроматор: Ni фильтр-диск; расходимость щели: 1;DivH.L.Slit: 1.0 мм; датчик: датчик LynxEye; способ сканирования: 9-0 непрерывное сканирование; диапазон сканирования: 345; шаг длины: 0.02; скорость сканирования: 8.0/мин; время сканирования: 5 мин; температура сканирования: комнатная температура. Условия испытания для диаграммы ДСК изменения абсорбции указанной формы VIII агомелатина настоящего изобретения: модель прибора: NETZSCH DSC 204F1; условия эксперимента: тип тигля: стандартный алюминиевый тигль (перфорированный); защитный газ: азот высокой чистоты 20 мл/мин; продувочный газ: азот высокой чистоты 60 мл/мин; скорость нагрева: 10C/мин; температурный диапазон: комнатная температура 140C. Величина начала эндотермического пика диаграммы ДСК изменения абсорбции настоящего изобретения характеризуется: диапазоном величин начала, составляющим 97-98C, площадью эндотермического пика, составляющей не ниже чем 90%, с предпочтительным соотношением, являющимся 95-99%. При применении ДСК для измерения кристаллов настоящего изобретения, иногда вследствие изме-2 023278 рительного оборудования или условий испытания, измеренные пики показывают небольшие отклонения в измерении; более определенно, например, может быть отклонение в измерении величины начала приблизительно 1C, даже если используется чрезвычайно точное оборудование, может быть замечено отклонение приблизительно 0.5C. В результате, при определении каждой кристаллической структуры должно быть учтено это отклонение. Условия ТГА испытания настоящего изобретения: модель прибора NETZSCH TG 209F1; экспериментальные условия: тип тигля: Al2O3; продувочный газ: N2 20 мл/мин; защитный газ: N2 10 мл/мин; температурный диапазон: комнатная температура 300C; скорость нагрева: 10C/мин. Способ получения формы VIII настоящего изобретения включает растворение соединения агомелатина формулы (II) (агомелатин-HCl-H2O) в уксусной кислоте, к которой затем добавляют ацетат натрия,к этой реакционной смеси затем по каплям добавляют воду и взбалтывают при температуре 7-13C, чтобы вызвать кристаллизацию с последующим отделением кристаллов из раствора. В настоящем изобретении, как описано, нет особых требований с точки зрения количества уксусной кислоты, которая должна добавляться до тех пор, пока применено достаточное количество, чтобы растворить сырье, в то время как нагревание также может быть соответственно применено для облегчения растворения. Молярное соотношение соединения агомелатина формулы (II) и ацетата натрия предпочтительно составляет порядка 1:1-1.5, наиболее оптимально 1:1-1.1. В способе получения настоящего изобретения, как описано, соотношение объема уксусной кислоты к воде составляет 1:15-30. В предпочтительном варианте осуществления способа получения агомелатина форма VIII в настоящем изобретении, когда температура получившейся реакционной смеси достигает 12-18C, и в особенности когда около 15C, по каплям добавляется вода, чтобы вызвать кристаллизацию. В дополнительном предпочтительном варианте осуществления, когда по каплям добавляется вода к получившейся реакционной смеси, взбалтывание затем проводят при температуре около 10C. Этот процесс может выполняться свыше около 1.5 ч, чтобы вызвать кристаллизацию. В другом предпочтительном варианте осуществления, после добавления ацетата натрия, реакционная смесь нагревается до 40-80C, затем добавляется соответствующее, неотмеренное, количество активированного угля, сопровождаемое взбалтыванием и фильтрованием; указанный раствор тогда оставляют для самостоятельного охлаждения, и по каплям добавляется вода, чтобы вызвать кристаллизацию. Форма агомелатина VIII, обеспеченная настоящим изобретением, может быть применена в сочетании с фармацевтически приемлемыми вспомогательными веществами или эксципиентами для фармацевтических препаратов. Настоящее изобретение приводит к новой форме VIII агомелатина, с большей стабильностью по сравнению со стабильностью кристаллическую форму VI, таким образом обладая преимуществами в производстве с точки зрения стабильности. Согласно китайской заявке на патент CN 201010126254.X соединение агомелатина формулы (II),как ранее описано, может быть получено посредством следующего способа получения, где указанный способ получения включает реакцию агомелатина с различными формами HCl, чтобы сформировать гидрат. Эти два метода следующие: агомелатин сначала растворяют в содержащем воду органическом растворителе, после которого добавляют газообразный HCl, твердые кристаллы промывают и затем сушат; или иначе агомелатин добавляют к растворителю, содержащему HCl, и затем промывают и сушат твердые кристаллы. Если используется первый метод, избыток HCl может привести к уменьшению выхода продукта, в то время как во втором методе количество существующего HCl, в растворителе легко контролируемо. Поэтому предпочтительным является второй метод. Определенно, агомелатин может быть добавлен к содержащему воду органическому растворителю,сопровождаемому добавлением по капле растворителя, содержащего HCl. Твердые кристаллы затем промывают и затем сушат. Аналогично, также возможно добавить агомелатин к органическому растворителю, сопровождае-3 023278 мому добавлением по капле водного раствора, содержащего HCl. Твердые кристаллы затем промывают и затем сушат. Полное содержание справочных документов, цитируемых или упомянутых в этом изобретении, сделано посредством ссылки. Описание чертежей Фиг. 1 показывает ренттеноструктурную диаграмму формы VIII в варианте осуществления 1 настоящего изобретения. Фиг. 2 показывает диаграмму ДСК изменения абсорбции формы VIII в варианте осуществления 1 настоящего изобретения. Фиг. 3 показывает рентгеноструктурную диаграмму формы VIII в варианте осуществления 2 настоящего изобретения. Фиг. 4 показывает диаграмму ДСК изменения абсорбции формы VIII в варианте осуществления 2 настоящего изобретения. Фиг. 5 показывает рентгеноструктурную диаграмму формы VIII в варианте осуществления 3 настоящего изобретения. Фиг. 6 показывает диаграмму ДСК изменения абсорбции формы VIII в варианте осуществления 3 настоящего изобретения. Фиг. 7 показывает кривую термогравиметрического анализа ТГА продукта в варианте осуществления 5 настоящего изобретения. Детали вариантов осуществления Следующие варианты осуществления дополнительно описывают настоящее изобретение, но не ограничивают его объем. Вариант осуществления 1. 14 г соединения агомелатина формулы (II) растворили в 55 мл уксусной кислоты, к которой потом добавили 4.5 г ацетата натрия, потом смесь нагрели до 60C, после чего добавили 0.5 г активированного угля. Взбалтывание проводили в течение 2 ч, после чего смесь профильтровали; потом при температуре 15C добавили по каплям 1 л воды. Раствор постепенно становится мутным, и при температуре 10C проводили взбалтывание более чем 1.5 ч, с последующей фильтрацией, затем промывали и высушивали отфильтрованный осадок при 45C под вакуумом до тех пор, пока не достигли постоянной массы, что привело к 9.6 г белого твердого вещества (см. фиг. 1 для рентгеноструктурной диаграммы; см. фиг. 2 для диаграммы ДСК изменения абсорбции). Вариант осуществления 2. 140 г соединения агомелатина формулы (II) растворили в 490 мл уксусной кислоты, к которой потом добавили 60 г ацетата натрия; потом смесь нагрели до 60C, после чего добавили 1.4 г активированного угля. Взбалтывание проводили в течение 1 ч, после чего смесь профильтровали; потом при температуре 15C добавили по каплям 8.8 л воды. Раствор постепенно становится мутным, и при температуре 10C взбалтывание проводили более чем 1.5 ч, с последующей фильтрацией, затем промывали и высушивали отфильтрованный осадок при 45C под вакуумом до тех пор, пока не достигли постоянной массы, что привело к 94 г белого твердого вещества (см. фиг. 3 для рентгеноструктурной диаграммы; см. фиг. 4 для диаграммы ДСК изменения абсорбции). Вариант осуществления 3. 66 г соединения агомелатина формулы (II) растворили в 230 мл уксусной кислоты, к которой потом добавили 21 г ацетата натрия; потом смесь нагрели до 60C, после чего добавили 1.3 г активированного угля. Взбалтывание проводили в течение 1 ч, после чего смесь профильтровали; потом при температуре 15C добавили по каплям 6.9 л воды. Раствор постепенно становится мутным, и при температуре 10C взбалтывание проводили более чем 1.5 ч, с последующей фильтрацией, затем промывали и высушивали отфильтрованный осадок при 50C под вакуумом до тех пор, пока не достигли постоянной массы, что привело к 49 г белого твердого вещества (см. фиг. 5 для рентгеноструктурной диаграммы; см. фиг. 6 для диаграммы ДСК изменения абсорбции). Вариант осуществления 4. Кристаллические формы агомелатина VI и VIII (полученные из варианта осуществления 2), каждую, поместили в термостатические контейнеры при температуре 40C и хранили в течение 20 дней, стабильность этих образцов изучили, применяя способ высокоэффективной жидкостной хроматографии. 1. Измерение чистоты образца. Условия хроматографирования. Октадецилсилан химически связывающий диоксид кремния применили в качестве сорбента; смешанный раствор 10 ммоль/л фосфатного буфера (доведенного до уровняpH 7.0 гидроксидом натрия) и ацетонитрила в соотношении 2:7 по объему выступал в роли подвижной фазы; температура колонки 40C; и длина волны определения 220 нм. Чистоту измеряли, применяя метод внутреннего стандарта. В подвижной фазе кристаллические формы VI и VIII растворяли в 1 мг/мл растворов, 10 мкл каждого из которых потом вводили в жидкостный хроматограф, регистрируя их хроматограммы. 2. Испытание образца. Способ измерения чистоты эталонного образца применили с измерениями, сделанными, применяя метод внешнего стандарта, результаты можно увидеть в табл. I. Таблица I 3. Измерение растворимости в воде. Метод ВЭЖХ применили, чтобы определить растворимость в воде, с измерениями, сделанными,применяя метод внешнего стандарта. Результаты показаны в табл. II. Таблица II 4. Определение кристаллической стабильности. Измеряющие применение фармакопейного способа оценки стабильности: 1) фактор воздействия испытания (экспонированный в течение 10 дней): высокая температура (60C), облучение (4500 лк), высокая влажность (92.5% ОВ, 25C); 2) ускоренное испытание (герметически запечатанный в течение 6 месяцев): температура 30C, влажность 65% ОВ; 3) длительное испытание (герметически запечатанный в течение 12 месяцев): температура 25C, влажность 60%ОВ. Таблица III Как можно увидеть из результатов испытания, форма VIII агомелатина настоящего изобретения очевидно предполагает большую стабильность при высокой температуре и сопоставимую растворимость, если сравнивать с кристаллической формой VI. Способ е приготовления предполагает хорошую воспроизводимость. В дополнение, она проявляет ценные свойства фармацевтического препарата. 5. Изучение приготовления и стабильности фармацевтических композиций (кристаллическая форма, чистота и содержание). Подвергнуты фармакопейному способу оценки стабильности и фактору воздействия испытания (10 дней экспозиция): высокая температура (60C), облучение (4500 лк), высокая влажность (92.5% ОВ,25C); ускоренное испытание (герметически запечатанный в течение 6 месяцев): температура 30C,влажность 65% ОВ; длительное испытание (герметически запечатанный в течение 12 месяцев): температура 25C, влажность 60% ОВ. Результаты оценки показали, что при вышеуказанных условиях ни кристаллическая форма, ни чистота, ни содержание продукта не претерпевают никаких изменений. Следовательно, результаты испытания фармацевтических ингредиентов и капсул этого продукта показывают, что форма VIII имеет больший потенциал в фармацевтическом производстве. Вариант осуществления 5. Соединение агомелатина формулы (II). 10 г агомелатина добавили к 100 мл раствора этилацетата. При температуре 10C 4.6 г водного раствора HCl (36%) добавили медленно, по каплям. Потом проводили взбалтывание в течение 1 ч, с последующей фильтрацией и полученное твердое вещество дважды промыли в 10 мл этилацетата, потом высушили при температуре 40C, чтобы получить 10.2 г формы II белого твердого вещества; чистота: 99.8%, выход: 88.7%.Cl элементный анализ: Теоретически рассчитанное значение: содержание Cl 11.91 мас.%. Измеренное значение: содержание Cl 11.86 мас.%. Определение содержания кристаллизационной воды соединения агомелатина формулы (II). Рассчитанное теоретически содержания кристаллизационной воды C15H17NO2HClH2O составляет 6.06 мас.%. 5.1. Метод Фишера (Chinese Pharmacopoeia 2010 издание, приложение VIIIM). Продукт, полученный из варианта осуществления 5, измеряли согласно методу Фишера, как упоминалось выше, и зарегистрированное содержание кристаллизационной воды было 6.15 мас.%. 5.2. Термогравиметрический анализ (Chinese Pharmacopoeia 2010 издание, приложение VIIIQ). Продукт, полученный из варианта осуществления 5, измеряли согласно термогравиметрическому анализу, как упоминалось выше, и зарегистрированная потеря кристаллизационной воды была 6.67 мас.%, т.е. содержание кристаллизационной воды изначального продукта было 6.67 мас.%. Для кривой ТГА см. фиг. 7. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Кристаллическая форма VIII агомелатина, имеющая на рентгеноструктурной диаграмме следующие величины брэгговского угла 2: 2. Кристаллическая форма VIII агомелатина по п.1, имеющая следующие величины межплоскостного кристаллического расстояния d, брэгговского угла 2 и относительной интенсивности: 3. Кристаллическая форма VIII агомелатина по п.1 или 2, характеризуемая его диаграммой ДСК,содержащей эндотерму с температурой начала при 97-98C, площадью эндотермического пика не ниже чем 90%, предпочтительно 95-99%. 4. Способ получения кристаллической формы VIII агомелатина по любому из пп.1-3, в котором соединение агомелатина формулы (II) растворяют в уксусной кислоте, к которой затем добавляют ацетат натрия, сопровождая добавлением по каплям воды к этой реакционной смеси, которую затем взбалтывают при температуре 7-13C, чтобы вызвать кристаллизацию, с последующим отделением кристаллов из раствора 5. Способ получения по п.4, в котором молярное соотношение соединения агомелатина формулы(II) и ацетата натрия составляет 1:1-1.5, наиболее оптимально 1:1-1.1. 6. Способ получения по п.4 или 5, в котором соотношение объема уксусной кислоты к воде составляет 1:15-30. 7. Способ получения по любому из пп.4-6, в котором, когда температура получившейся реакционной смеси достигает 12-18C, в особенности 15C, по каплям добавляется вода, чтобы вызвать кристаллизацию. 8. Способ получения по любому из пп.4-7, в котором по каплям добавляется вода к получившейся реакционной смеси, которая затем взбалтывается при температуре 10C, чтобы вызвать кристаллизацию. 9. Способ получения по любому из пп.4-8, в котором после добавления ацетата натрия реакционная смесь нагревается до 40-80C; указанный раствор тогда оставляют для самостоятельного охлаждения и по каплям добавляется вода, чтобы вызвать кристаллизацию. 10. Фармацевтическая композиция, обладающая активностью агониста рецепторов мелатонинергической системы и антагониста 5HT2C рецептора, включающая кристаллическую форму VIII агомелатина по любому из пп.1-3 и фармацевтически приемлемые вспомогательные вещества или эксципиенты. 11. Фармацевтическая композиция по п.10, применяемая для получения лекарственного средства для лечения заболеваний мелатонинергической системы. 12. Фармацевтическая композиция по п.10, применяемая для получения лекарственного средства для лечения нарушений сна, стресса, тревоги, сезонного аффективного расстройства, тяжелой депрессии,сердечно-сосудистых заболеваний, болезней пищеварительной системы, бессонницы и усталости, навлеченной нарушением биоритма, шизофрении, фобий или депрессии. 13. Применение формы VIII агомелатина по любому из пп.1-3 для лечения заболеваний мелатонинергической системы. 14. Применение кристаллической формы VIII агомелатина по любому из пп.1-3 для лечения нарушений сна, стресса, тревоги, сезонного аффективного расстройства, тяжелой депрессии, сердечнососудистых заболеваний, болезней пищеварительной системы, бессонницы и усталости, навлеченной нарушением биоритма, шизофрении, фобий или депрессии.
МПК / Метки
МПК: A61P 1/00, C07C 233/18, A61P 25/00, A61P 9/00, A61P 25/20, A61K 31/165, A61P 25/22, A61P 25/24, C07C 231/24
Метки: кристаллический, получения, агомелатин, фармацевтическая, применение, композиция, способ, содержащая, форма-viii
Код ссылки
<a href="https://eas.patents.su/15-23278-kristallicheskijj-agomelatin-forma-viii-sposob-ego-polucheniya-primenenie-i-soderzhashhaya-ego-farmacevticheskaya-kompoziciya.html" rel="bookmark" title="База патентов Евразийского Союза">Кристаллический агомелатин (форма-viii), способ его получения, применение и содержащая его фармацевтическая композиция</a>
Предыдущий патент: Терапия неврологических заболеваний на основе баклофена и акампросата
Следующий патент: Способ лечения экспериментального хронического орхоэпидидимита
Случайный патент: Антикоррозионная изоляционная лента