Производные 3-алкоксиизоксазол-4-илзамещенных 2-аминокарбоновых кислот
Номер патента: 1625
Опубликовано: 25.06.2001
Авторы: Бегесе Клаус Петер, Банг-Андерсен Бенни, Крогсгор-Ларсен Повл, Мольтсен Ленс Сибюлле
Формула / Реферат
1. Производное (3-алкоксиизоксазол-4-ил)замещенной 2-аминокарбоновой кислоты или его серосодержащий аналог общей формулы I или II
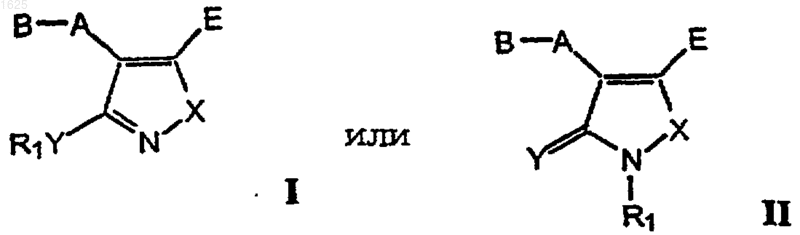
где R1 представляет водород, C1-6-алкил, С2-6-алкенил, С2-6-алкинил, циклоалк(ен)ил, циклоалк(ен)ил-С1-6-алк(ен/ин)ил или фенил-С1-6-алк(ен/ин)ил, причем фенильная группа необязательно замещена СF3, галогеном, C1-6-алкилом или C1-6-алкокси;
А представляет связь или спейсер, выбранный из C1-6-алкилена, С2-6-алкенилена или С2-6-алкинилена и циклоалкилена;
В представляет группу -CRa(NRbRc)-COOR5, где Ra-Rc независимо представляют собой водород или C1-6-алкил и R5 имеет те же значения, что и R1, или представляет пивалоилоксиметил, или В представляет группу формулы III
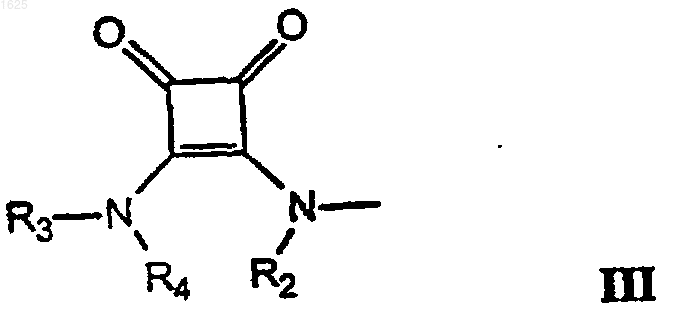
где R2, R3 и R4 выбирают независимо из группы, состоящей из
a) водорода, C1-6-алкила, С2-6-алкенила, С2-6-алкинила, циклоалк(ен)ила, циклоалк(ен)ил-С1-6-алк(ен/ин)ила, фенил-С1-6-алкила, тиенил-С1-6-алкила, и
b) C1-6-алкила, С2-6-алкенила и С2-6-алкинила, в которых один или несколько атомов углерода заменены на N, О и/или S, или
R3 и R4 соединяются, образуя в результате С2-6-алкиленовую, C2-6-алкениленовую или С2-6-алкиниленовую группы; или
R4 и R2 соединяются с образованием C1-3-алкиленовой, С2-3-алкениленовой или С2-3-алкиниленовой группы, необязательно моно- или дизамещенной гидрокси или метилом, или с образованием групп СН2-O-СН2;
Е представляет COOR6, где R6 имеет те же значения, что и R5;
Х представляет О или S;
Y представляет О или S;
и его фармацевтически приемлемая соль.
2. Соединение по п.1, отличающееся тем, что имеет формулу I.
3. Соединение по п.1, отличающееся тем, что имеет формулу II.
4. Соединение по любому из пп.1-3, где Е представляет группу СООR6, где R6 не является водородом, а предпочтительно R6 представляет C1-6-алкил, фенил-С1-6-алк(ен/ин)ил или пивалоилоксиметил.
5. Соединение по любому из пп.1-3, где Е представляет СО-ОН.
6. Соединение по любому из пп.1-5, где В представляет группу формулы -CRa(NRbRc)-COOR5.
7. Соединение по п.6, где Rb и Rc представляют водород, a Ra представляет водород или C1-6-алкил, предпочтительно водород или метил.
8. Соединение по п.6 или 7, где R5 представляет водород.
9. Соединение по п.6 или 7, где R5 не является водородом, а предпочтительно R5 представляет C1-6-алкил, фенил-C1-6-алк(ен/ин)ил или пивалоилоксиметил.
10. Соединение по любому из пп.1-5, где В представляет группу формулы III.
11. Соединение по п.10, где R2, R3 и R4 представляют водород или C1-6-алкил, или R4 и R2 соединяются с образованием C1-3-алкиленовой группы.
12. Соединение по п.11, где каждый из R2, R3 и R4 представляет водород.
13. Соединение по любому из пп.1-12, где Х представляет кислород.
14. Соединение по любому из пп.1-12, где Х представляет серу.
15. Соединение по любому из пп.1-14, где Y представляет кислород.
16. Соединение по любому из пп.1-14, где Y представляет серу.
17. Соединение по любому из пп.1-16, где R1 представляет C1-6-алкил, С2-6-алкенил или С2-6-алкинил, предпочтительно метил, этил, пропил или пропаргил.
18. Соединение по любому из пп.1-17, где А представляет связь или C1-3-алкилен, предпочтительно метилен.
19. Соединение по п.2, где А представляет связь или C1-3-алкилен, В представляет группу формулы -СН(NH2)-COOH или группу формулы III, где каждый из R3, R4 и R2 представляет водород, Х и Y оба представляют кислород и R1 представляет C1-6-алкил, С2-6-алкенил или С2-6-алкинил, предпочтительно метил, этил, пропил или пропаргил.
20. Фармацевтическая композиция, отличающаяся тем, что включает соединение по любому из пп.1-19 вместе с фармацевтически приемлемым носителем или разбавителем.
21. Применение соединения по любому из пп.1-20 для получения фармацевтической композиции для лечения церебральной ишемии, болезни Гентингтона, эпилептических нарушений, болезни Паркинсона, болезни Альцгеймера, шизофрении, боли, депрессии или страха.
Текст
1 Область техники, к которой относится изобретение Настоящее изобретение относится к новому классу производных (3-алкоксиизоксазол-4 ил)замещенных 2-аминокарбоновых кислот и их серосодержащим аналогам. Эти соединения являются лигандами рецепторов для возбудительных аминокислот (ЕАА), в частности, лигандами рецепторов для АМРА и/или NMPA, полезными при лечении церебральной ишемии, болезни Гентингтона, эпилептических нарушений,болезни Паркинсона, болезни Альцгеймера, шизофрении, боли, депрессии и страха. Предпосылки создания изобретения В результате широких исследований в последние три десятилетия механизмов возбуждения в центральной нервной системе (ЦНС) теперь существует единое мнение, что (S)глутамат (Glu) является главным ЕААнейротрансмиттером в ЦНС (Lodge, D., Excitatory Amino Acids in Health and Disease. J. WileySons: Chichester, 1988; Wheal, H., Thomson, A.,Excitatory Amino Acids and Synaptic Transmission. Academic Press: London, 1991; Meldrum,B.S., Excitatory Amino Acids Antagonists. Blackwell Sci Publ.: Oxford, 1991; Krogsgaard-Larsen,P., Hansen, J.J., Excitatory Amino Acids Receptors:Gluнейтротрансмиссия опосредуется большим числом рецепторов, разделяемых, по меньшей мере,на четыре различных семейства рецепторов,называемых классами рецепторов для NMDA,АМРА, каиновой кислоты и метаботропными рецепторами (Monaghan, D.T., et al., Ann. Rev.(эксцитотоксичность), является очень важным фактором при церебральной ишемии после эмболии, травмы головы, асфиксии, субарахноидального кровотечения,остановки сердца и других ситуаций (Lodge, D., 1988, цит. выше; Meldrum, D.S., 1991, цит. выше). На животных моделях показано, что повреждения,вызванные различными ишемическими состояниями, можно затормозить посредством введения Glu-антагонистов. Таким образом, хотя относительное значение различных ЕААрецепторов в явлениях, лежащих в основе ишемических инсультов, неясно, сходятся во мнении, что антагонисты ЕАА-рецепторов являются потенциальными лечебными средствами при таких состояниях. Накапливающиеся результаты, получаемые на разных направлениях нейрохимических и фармакологических исследований, наводят на 2 мысль, что разрушенные ЕАА-рецепторные механизмы, вероятно, включая эксцитотоксичность, играют некую роль при болезни Гентингтона (Young, А.В., et al., Science, 1988, 241,981-983),эпилептических нарушенияхChichester 1992, pp. 352-375) и депрессии (Trullas, R., Skolnick, P., Eur. J. Pharmacol., 1990, 185,1-10, и Trullas et al., Eur. J. Pharmacol., 1991, 203,379-385). Так, оказывается, что пониженная функция ЕАА-рeцепторов играет некую роль,например, при шизофрении (Deutsch, S.I., et al.,Clin. Neuro-pharmacol., 1989, 12, 1-13) и некоторых клинических симптомах, проявляющихся при болезни Альцгеймера (Greenamyre, J.T., etal., Prog. Neuro-Psychopharmacol.Biol. Psychiat., 1988, 12, 421-430). Возможно, что эксцитотоксичность, так же, как и гипоактивность ЕАА, включаются в сложные механизмы, связанные с болезнью Альцгеймера (Greenamyre,J.T., 1988, цит. выше; Greenamyre, J.T., Maragos,W.F., 1993, цит. выше). Соответственно считается, что лиганды ЕАА-рецепторов полезны при лечении церебральной ишемии, болезни Гентингтона, эпилептических нарушений, болезни Паркинсона, болезни Альцгеймера, страха, шизофрении, депрессии и боли. Большинство испытанных до сих пор агонистов ЕАА-рецепторов показывают более или менее явную нейротоксичность на модельных системах, и следовательно клиническое применение таких соединений может быть ограниченным (Carlsson, М., Carlsson, A., Trends. Neurosci., 1990, 13, 272-276; Willetts, J., Balster, R.L.,Leander, J.D., Trends. Pharmacol. Sci., 1990, 11,423-428). С другой стороны, для терапии могут представлять интерес частичные ЕАА-агонисты,показывающие подходящий баланс агонизма и антагонизма, ср. вышеприведенные показания(Greenamyre, J.T., 1988. цит. выше; Christensen,I.T., et al., Drug. Des. Del., 1989, 5, 57-71; Francis,Р.Т., et al., J. Neurochem., 1993, 60, 1589-1604). Частичные агонисты могут, в силу своего профиля антагонистов ЕАА, показывать терапевтически полезную нейрозащиту и в то же время быть достаточно агонистическими, чтобы предотвращать полную блокировку нейротранс 3 миссии, опосредуемой рeцептором для определения ЕАА. Есть сообщения, что АТРА - 5-третбутильный аналог АМРА RS)-2-амино-3-(3 гидрокси-5-метилизоксазол-4-ил)пропионовая кислота) системно активен, хотя нет сообщений о нейротоксическом действии на животных(Ornstein, P.L., et al., J.Med. Chem., 1993, 36,2046-2048; Lauridsen, J., Honore, Т., KrogsgaardLarsen. P., J. Med. Chem., 1985, 28, 668-672). Обнаружено, что подобно самой АМРА,ряд моно- и бициклических аналогов АМРА показывают селективное агонистическое действие в отношении АМРА-рецепторов (Hansen,J.J., Krogsgaard-Larsen, P., Med. Res. Rev., 1990,10, 55-94; Krogsgaard-Larsen, P., Hansen, J.J.,1992, цит. выше). Один из таких аналогов (RS)-2-амино-3-(3-гидрокси-5-фенилизоксазол 4-ил)пропионовая кислота (АРРА), в котором метильная группа AМРА заменена фенильной группой, показывает слабый, но уникальный профиль частичного агониста (Christensen, I.T.,et al., 1989, цит. выше). АСРА RS)-2-амино-3-(3-карбоксиокси-5 метилизоксазол-4-ил)-пропионовая кислота) описывается как мощный агонист АМРАрецепторов (Madsen, U., and Wong, E., J., Med.Chem., 1992, 35, 107-111). Кроме того, в WO-A1 95/12587 в качестве лигандов ЕАА-рецепторов описывается класс соединений (5-арилизоксазол-4-ил)- или (5 арилизотиазол-4-ил)замещенных 2-аминокарбоновых кислот. Как видно из описанного выше, для лечения различных упомянутых выше болезней весьма желательны ненейротоксичные лиганды рецепторов для ЦНС-активных ЕАА, и соответственно предметом настоящего изобретения являются такие новые лекарственные средства. Краткое изложение сущности изобретения Установлено, что новый класс производных (3-алкокси-изоксазол-4-ил)замещенных 2 аминокарбоновых кислот и их серосодержащие аналоги являются лигандами ЕАА-рецепторов, в частности, лигандами АМРА- и/или NMDAрецепторов. Соответственно настоящее изобретение относится к новому классу соединений общей формулы I или II где R1 представляет водород, C1-6-алкил, С 2-6 алкенил, С 2-6-алкинил, циклоалк(ен)ил, циклоалк(ен)ил-С 1-6-алк(ен/ин)ил или фенил-С 1-6 алк(ен/ин)ил, причем фенильная группа необязательно замещена СF3, галогеном, C1-6-алкилом или C1-6-алкокси; А - связь или спейсер, выбранный из C1-6 алкилена, С 2-6-алкенилена, С 2-6-алкинилена и циклоалкилена; 4 В - группа -CRa(NRbRc)-COOR5, где Ra-Rc независимо водород или C1-6-алкил, и R5 имеет те же значения, что и R1, или представляет пивалоилоксиметил, или В представляет группу формулы III где R2, R3 и R4 выбирают независимо из группы,состоящей изb) C1-6-алкила, С 2-6-алкенила и С 2-6 алкинила, в которых один или несколько атомов углерода заменены на N, О и/или S; илиR3 и R4 соединяются, образуя в результате С 2-6-алкилен, C2-6-алкенилен или С 2-6-алкинилен,или R4 и R2 соединяются с образованием С 1-3 алкиленовой, С 2-3-алкениленовой или С 2-3 алкиниленовой группы, необязательно моноили дизамещенной гидрокси или метилом, или с образованием группы СН 2-O-СН 2; Е - COOR6, где R6 имеет те же значения,что и R5; Х - О или S; Y - О или S; и их фармацевтически приемлемым солям. В другом аспекте изобретение относится к способу получения новых соединений формул I или II. Еще в одном своем аспекте изобретение относится к фармацевтической композиции,содержащей новое соединение формулы I или II вместе с подходящим фармацевтически приемлемым носителем или разбавителем. Еще в одном своем аспекте изобретение относится к применению соединения формулы I или II для получения фармацевтической композиции для лечения церебральной ишемии, болезни Гентингтона, эпилептических нарушений,болезни Паркинсона, болезни Альцгеймера, шизофрении, боли, депрессии или страха. Обнаружено, что некоторые соединения данного изобретения являются лигандами АМРА-рецепторов с афинностью при микромолярных концентрациях, а некоторые соединения связываются с рецепторами для NMDA. Кроме того, обнаружено, что некоторые из соединений изобретения являются агонистами, в то время как другие соединения являются антагонистами. Таким образом, соединения изобретения полезны при лечении церебральной ишемии, болезни Гентингтона, эпилептических нарушений, болезни Паркинсона, болезни Aльцгеймера, шизофрении, боли, депрессии и страха. Соединения, в которых R5 и/или R6 не представляют водород, являются пролекарствами соответствующих соединений, в которых R5 и R6 представляют водород. 5 Подробное описание изобретения Некоторые из соединений общих формул I или II могут существовать в виде их оптических изомеров, и такие оптические изомеры также охватываются данным изобретением. В общих формулах I или II термин C1-6 алкил предназначен для обозначения линейной или разветвленной алкильной группы с 1-6 атомами С, в том числе, таких как метил, этил, 1 пропил, 2-пропил, 1-бутил, 2-бутил, 2-метил-2 пропил и т.п. Подобным образом С 2-6-алкенил и С 2-6-алкинил обозначают соответствующие линейные или разветвленные группы с 2-6 атомами С, а C1-6-алкилен, С 2-6-алкенилен и С 2-6 алкинилен обозначают такие линейные или разветвленные двухвалентные группы. Циклоалкил обозначает соответствующую группу с 3-7 атомами углерода, а термин C1-6-алкокси обозначает соответствующие группы, содержащие C1-6 или С 2-6 алкильную,С 2-6-алкенильную алкинильную группы, определенные выше. Термин алк(ен/ин)ил означает, что группа может представлять алкильную, алкенильную или алкинильную группу. Термин связь (при определении А) означает, что В может присоединяться непосредственно в положении 4 изоксазольного кольца. Галоген обозначает фтор, хлор, бром или иод. Некоторые из соединений общей формулыI или II могут существовать в виде фармацевтически приемлемых солей, которые также охватываются данным изобретением. Соли соединений общей формулы I или II являются солями, образованными с нетоксичными органическими кислотами, например, малеиновой, фумаровой, бензойной, аскорбиновой, щавелевой, винной, молочной и яблочной кислотой, или с неорганическими кислотами,например, хлористоводородной, бромистоводородной, серной, фосфорной и азотной кислотой,или они могут представлять соли неорганических оснований, такие как соли щелочных металлов, например, натриевые, калиевые или литиевые соли, соли щелочноземельных металлов,например, кальциевые или магниевые соли, или соли аммония, или соли органических оснований. В формулах I и II А, предпочтительно,представляет связь или C1-3-алкилен, наиболее предпочтительно - метилен. В, предпочтительно, представляeт группу-CRa(NRbRc)-COOR5, где Rb-Rc представляют водород, a Ra представляет водород или C1-6 алкил, обычно метил, или группу формулы III,где R2, R3 и R4 представляют водород или C1-6 алкил, или R4 и R2 соединяются с образованиемC1-3-алкиленовой группы. Наиболее предпочтительно, В представляет -СН(NH2)-СООН или группу формулы III, где каждый из R2, R3 и R4 представляет водород. Предпочтительно Е представляет СООН. 6 Другая подгруппа включает соединения, в которых Е представляет СООR6, где R6 не является Н. Соответственно, в предпочтительной подгруппе соединений изобретения Х и Y представляют О. Другими подгруппами являются подгруппы, где Х представляет О, а Y представлят S; Y представляет О, а Х представляет S; и Х и Y представляют соответственно S.R1, предпочтительно, представляет C1-6 алкил, C2-6-алкенил или С 2-6-алкинил. Особенно предпочтительными группами R1 являются метил, этил, пропил, бутил и пропаргил. В предпочтительном варианте воплощения изобретения соединение представляет соединение формулы I, где А представляет связь илиC1-3-алкилен, В представляет -СН(NH2)-СООН или группу формулы III, где каждый из R3, R4 иR2 представляет водород, Х и Y - оба - представляют кислород и R1 представляет C1-6-алкил, С 2-6 алкенил или С 2-6-алкинил. Особенно подходящими группами R1 являются метил, этил, пропил, бутил или пропаргил. В сооответствии с изобретением, соединения формул I или II получают следующими способами. Ради простоты, реакции а)-е) и g)-h) показаны только для соединений формулы I. Те же способы могут применяться в отношении соединений формулы II. а) Чтобы получить соединение формулы I,где В представляет -CRa(NRbRc)-COOR5, где RaRc и R5 имеют установленные ранее значения, и,по меньшей мере, один из Rb, R5 и R6 представляет водород, осуществляют отщепление защитной группы от соединения общей формулы где R1, А, Х и Y имеют установленные ранее значения, Ra' -Rc', Е' и R5' имеют значения, установленные для Ra-Rc и Е и R5 соответственно,или они являются защитными группами при условии, что, по меньшей мере, одна из групп Е', R5' и Rc' является защитной группой.b) Чтобы получить соединение формулы I,где В представляет группу -CRa(NRbRc)-COOR5,где Rb, Rc и R5 все являются водородами, осуществляют отщепление защитной группы от соединения общей формулы V где R1, А, Y, Х и Е' имеют установленные ранее значения. с) Чтобы получить соединение формулы I,где В представляет группу формулы III, осуществляют реакцию присоединения-элимирования 7 соединения общей формулы VI с соединением общей формулы VII где R1-R4, A, X, Y и Е' имеют установленные ранее значения.d) Чтобы получить соединение формулы I,где В представляет группу формулы III, где R4 и соединяются с образованиемC1-3R2 алкиленовой, С 2-3-алкениленовой или С 2-3 алкиниленовой группы, необязательно моноили дизамещенной гидрокси или метилом, осуществляют реакцию соединения формулы VIII где R1, R3, А, X, Y и Е' имеют установленные ранее значения;R4 и R2 соединяются с образованием группы, определение которой дается выше, и ВОС представляет трет-бутоксикарбонил с 3,4 диэтокси-3-циклобутен-1,2-дионом, и затем замыкают кольцо и отщепляют защитную группу. е) Чтобы получить соединение формулы I,где В представляет группу формулы III, и один или несколько R2-R4 отличаются от водорода,осуществляют алкилирование соединения формулы IX где R1, R2, R3, R4, А, X, Y и Е' имеют установленные ранее значения, причем, по меньшей мере, один из R2-R4 представляет водород.f) Чтобы получить соединение формулы I или II, осуществляют алкилирование соединения общей формулы Х где А, X, Y и Е' имеют установленные ранее значения, и В' представляет В, за исключением значений, данных при определении Rb, водороды Rc и R5 заменяют защитной группой, алкилирующим агентом R1'Z, где R1' представляетR1, за исключением того, что он не может быть водородом, причем посредством этого получают смесь соединений XI и XII 8 где А, X, Y, Е' и В' имеют установленные выше значения, и затем соединения разделяют и отщепляют защитные группы.g) Чтобы получить соединение формулы I,где R5 и/или R6 отличаются от водорода, осуществляют этерификацию соединения формулы где R1, R2, R3, R4, А, X, Y и Ra-Rc имеют установленные выше значения.h) Чтобы получить соединение формулы I,где В представляет группу -CRa(NRbRc) -COOR5,где Ra, Rb, Rc и R5 все являются водородами, и Е представляет СООН, в виде определенного чистого энантиомера, соединение формулы XV подвергают реакции синтеза бислактимаминокислот по Щелькопфу (Schollkopf) и последующему отщеплению защитной группы от полученного бис-лактимэфира формулы XVI где X, Y, Ra и R1 имеют установленные ранее значения, и А' имеет значения, определенные для А, за исключением того, что А не может представлять собой связь. В способе изобретения предпочтительными защитными группами являются следующие группы: в случае Е=СООН - 4,5-дигидро-4,4 диметилоксазол-2-ил, C1-6-алкил или бензильная группа; в случае R5=водород - C1-6-алкил; и в случае Rb=водород - C1-6-алкилкарбонил. Стадию отщепления защитной группы по способу а) осуществляют посредством обработки соединения формулы IV подходящей водной кислотой, обычно - 0,5-12 N водным раствором НСl, водным 48%-ным раствором НВr или насыщенным раствором НВr в уксусной кислоте. Отщепление защитной группы можно также осуществить постадийно с использованием водных кислот и водных оснований, традиционнопоследовательно в водной кислоте, такой как 0,5-12 N НСl, водном основании, таком как 1-8 9 Исходные вещества формулы IV удобно получать из 3-алкокси-4-метилизоксазол-5 карбоновой кислоты (WO 95/12587, А 1) посредством полного отщепления защитных групп в водной кислоте в соответствии с описанными выше условиями отщепления защитной группы,необязательной этерификации 3-гидрокси-4 метилизоксазол-5-карбоновой кислоты и последующего алкилирования подходящим галогенидом или просто посредством алкилирования. За этим следует бромирование 4 метилизоксазольной группы и последующее алкилирование предшественником аминокислоты, например, диэтилацетамидомалонатом. Другие 4-алкилизоксазолы можно получить путем удлинения цепи, например, при алкилировании цианидом или диэтилмалонатом и последующей трансформации до первичного алкилгалогенида или альдегида. Галогенид можно обработать так, как описано выше. Альдегид можно использовать в качестве исходного вещества для получения соединений общей формулы V. При способе b) стадию отщепления защитной группы осуществляют посредством обработки соединения формулы V подходящей водной кислотой или водным основанием, предпочтительно 0,5-0,8 N соляной кислотой. Отщепление защитной группы можно также осуществить постадийно путем использования водных кислот и водных оснований, как описано выше для способа а). Гидантоиновое кольцо можно также расщепить посредством использования водного раствора Ва(ОН)2, водной 10-70%-ной серной кислоты или при использовании ферментов, таких как гидантоиназы. Расщепление гидантоинового кольца можно осуществить или до, или после отщепления защитной группы от группы Е. Группу R1 можно снова ввести посредством алкилирования после полного отщепления защитных групп от промежуточного гидантоинового соединения. Гидантоиновые кольца в соединениях общей формулы V подходящим образом образуются по способам, описанным Ware, Е., Chem.Rev., 1950, 46, 403-470. Расщепление гидантоинового кольца удобно осуществлять методами,аналогичными описанным в Curry, К., et al., J.Med. Chem., 1988, 31, 864-867; Farrington, G.K.,et al., J. Med. Chem., 1987, 30, 2062-2067; Grunevald, G.L., et al., J. Med. Chem., 1980, 23, 754758, Hiroi, К., et al., Chem. Pharm. Bull., 1968, 16,444-447; или в Stark, G.R., et al., J. Biol. Chem.,1963, 238, 214-226. Исходные вещества для получения соединений формулы V можно получить так, как описано выше в случае получения исходных веществ для способа а). Если А представляет связь, альдегид можно получить из бромметильного соединения посредством бромирования и последующей трансформации в альдегид. Реакцию присоединения-элимирования по способу с) удобно осуществлять в протонном 10 органическом растворителе, таком как спирт,предпочтительно в присутствии подходящего неорганического основания, такого как водный раствор NaOH, при комнатной температуре. Промежуточные соединения формулы VII можно получить способами, описанными в Cohen,S., et al., J. Amer. Chem. Soc., 1966, 88, 15331536, EP-A2-0496561, или в Kinney, W.A., et al.,J. Med. Chem., 1992, 35, 4720-4726. Промежуточные соединения общей формулы VI легко получить с помощью синтеза первичных аминов по Габриэлю, как описано вSheehan, J.C., et al., J. Am. Chem. Soc., 1950, 72,2786-88. Исходные алкилгалогениды для этого синтеза удобно получать так, как это описано в отношении исходных веществ, используемых при способе а), см. выше. Отщепление защитных групп удобно осуществлять с использованием водной кислоты или водного основания, предпочтительно 0,5 -8N НСl или водного 0,5-8 N раствора NaOH, или при комнатной температуре, или при повышенных температурах. При способе d) реакцию и последующие замыкание кольца и отщепление защитных групп осуществляют так, как описано в Kinney,W.A., et al., EP-A2-0496561. Исходные вещества формулы VIII можно получить посредством взаимодействия, например, 4-бромметилизоксазола, полученного так,как это описано в отношении исходных веществ при способе а), с защищенным одной ВОСгруппой алкилендиамином, см. EP-A2-0496561. Алкилирование соединений общей формулы IX по способу е) удобно осуществлять в инертном органическом растворителе, таком как подходящий спирт, кетон или диметилформамид, предпочтительно в присутствии подходящего основания, такого как гидрид натрия, карбонат калия или триэтиламин, как описано вKinney, W.A., EP-A2-0496561. Исходные вещества формулы IX можно получить по способу с). При способе f) отщепление защитных групп от соединений общих формул XI и XII осуществляют так, как это описано при способе а), или с использованием раствора хлористоводородной кислоты в диэтиловом эфире, или другим способом отщепления защитной группы в неводной среде. Исходное вещество Х получают так, как это описано выше в отношении исходных веществ в способе а). При способе g) этерификацию можно осуществлять способами, хорошо известными в технике, например, посредством обработки кислым раствором спирта. Исходные вещества получают по способу а)-е) или h). Расщепление соединений общей формулыI удобно осуществлять посредством образования диастереомерных солей с использованием оптически активных кислот или оснований, например, 1-фенилэтиламина. В некоторых случаях расщепление удобно осуществлять путем 11 образования диастереомерных соединений и последующего разделения диастереомеров посредством флэш-хроматографии или кристаллизации. Некоторые диастереомеры можно удобно получать посредством асимметричного синтеза при использовании синтеза бислактимаминокислот по Schllkopf, ср. способ h). При этом синтезе исходные вещества являются алкилгалогенидами, полученными так, как описано выше в случае исходных веществ для способа а). Защитная группа для 5 карбоксиизоксазольной группы представляет предпочтительно 2-оксазолиновую группу, полученную из соответствующего 5 цианоизоксазола (WO 95/12587, А 1) путем конденсации с аминоспиртом. Соли соединений изобретения легко получают способами, хорошо известными в технике,т.е. посредством взаимодействия соединения или с эквивалентным количеством кислоты или основания в смешивающемся с водой растворителе, таком как ацетон или этанол, с выделением соли посредством концентрирования и охлаждения, или при реакции с избытком кислоты или основания в не смешивающемся с водой растворителе, таком как этиловый эфир или хлороформ, с непосредствнным выделением нужной соли. Эти соли можно также получить классическим способом двойного разложения соответствующих солей. Соединения общей формулы I и их фармацевтически приемлемые соли присоединения кислот можно вводить любым подходящим способом, например, перорально или парентерально, и соединения могут находиться в любой подходящей для такого введения форме, например, в форме таблеток, капсул, порошков, сиропов или растворов или дисперсий для инъекции. Эффективная суточная доза для соединения общей формулы I или его фармацевтически приемлемой соли составляет от 10 мкг/кг до 50 мг на кг массы тела. Примеры В дальнейшем изобретение поясняется с помощью примеров, которые не следует рассматривать как ограничивающие данное изобретение. Все температуры плавления определяют на приборе SMP-20, Buchi, и они являются нескорректированными. Спектры 1H ЯМР и 13 С ЯМР регистрируют на спектрометре Brucker, 250 МГц (250,13 МГц в случае 1H ЯМР и 62,90 МГц в случае 13 С ЯМР) с использованием в качестве стандарта ТМС, если нет иных указаний. Масс-спектры получают на системе MSMS Quattro от VG Biotech, Fisons Instruments,соединенный с модульной системой ВЭЖХ HP 1050. В генератор рассеянных электронов с помощью автоматического пробоотборника со скоростью потока 30 мкл/мин вводят 20-50 мкл образца (10 мкг/мл), растворенного в смеси 1% уксусной кислоты в смеси ацетонитрила с водой(1:1) или в смеси ацетонитрила с водой и водным раствором аммиака (25%) (25:25:1) (цвиттерионы). Спектры регистрируют при стандартных условиях для получения информации о молекулярной массе (М+Н)+) или (М-Н). Фон вычитают. Аналитическую ВЭЖХ осуществляют на колонке 150 х 4,6 мм, Lichrocart 250-4 (Merck),элюируют при 35 С метанолом с 0,01 М раствором ацетата аммония, рН 8 (3:2), со скоростью 1 мл/мин. Используемое оборудование составляют насос для ВЭЖХ L6200, колоночный термостат L5025 и УФ-детектор VIS L4000A (установленный на 230 нм). Чистоту диастетермеров,выраженную в виде избытка диастереомера (de),вычисляют по площади пиков. Анализ методом хиральной ВЭЖХ осуществляют на колонке 150 х 4,6 мм с SumichiralOA-5000, элюируемой при температуре окружающей среды 5 мМ раствором CuSO4 (водн.) со скоростью 1 мл/мин. Используемое оборудование составляют автоматический пробоотборник AS 2000, насос для ВЭЖХ L6200, колоночный термостат Т 6300, УФ-детектор VIS L4250(установленный на 240 нм) и устройство сопряжения с компьютером D 6000 - все от MerckHitachi. Чистоту энантиомеров, выраженную в виде избытка энантиомера (ее), вычисляют по площади пиков. Пример 1. Гидрат(соедин.1) 1) 3-Гидрокси-4-метилизоксазол-5-карбоновая кислота. 3-Этокси-4-метилизоксазол-5-карбоновую кислоту (15 г, 88 ммоль) и 47% НВr (водн.) (150 мл) кипятят с обратным холодильником в течение 6 ч. Раствор охлаждают и собирают фильтрацией кристаллическое, названное в заголовке соединение (8,7 г, 69%); т.пл. 257-259 С. К кислому фильтрату добавляют воду (100 мл) и экстрагируют диэтиловым эфиром (6 х 400 мл). Органические экстракты промывают рассолом(100 мл), сушат (MgSO4) и концентрируют в вакууме, и получают неочищенное целевое соединение (3,0 г, 24%). Общий выход составляет 93%. На последующей стадии используют смесь этих двух сборов. 2) Этил-3-гидрокси-4-метилизоксазол-5 карбоксилат. 3-Гидрокси-4-метилизоксазол-5-карбоновую кислоту (6,0 г, 42 ммоль) и насыщенный раствор НСl в EtOH (110 мл) кипятят с обратным холодильником в течение 4 ч. Раствор концентрируют в вакууме, и остаток растворяют вEtOAc, сушат (MgSO4) и концентрируют в вакууме, и получают неочищенное названное в заголовке соединение (7,2 г, 100%). Небольшой образец перекристаллизовывают (EtOAc с гептаном), и получают бесцветное кристаллическое вещество; т.пл. 133-134 С. Неочищенный про 13 дукт используют на последующей стадии без дополнительной очистки. 3) Этил-3-метокси-4-метилизоксазол-5 карбоксилат. Смесь этил-3-гидрокси-4-метилизоксазол 5-карбоксилата (1,0 г, 5,8 ммоль), йодистого метила (0,4 мл, 5,8 ммоль) и К 2 СО 3 (1,6 г, 11,7 ммоль) в ДМФА (40 мл) греют при 40 С в течение 1 ч. Смесь выливают в смесь воды со льдом(100 мл) и экстрагируют диэтиловым эфиром (3 х 100 мл). Органические экстракты промывают водой (2 х 50 мл), рассолом (50 мл), сушат(MgSO4) и концентрируют в вакууме (0,8 г,74%). Процедуру повторяют, чтобы получить сырой продукт, эквивалентный 17,5 ммоль исходного вещества, и подвергают его флэшхроматографии (силикагель, элюент - смесь дихлорметана с диэтиловым эфиром, 9:1), и получают неочищенное целевое соединение в виде желтого масла (1,4 г, 43%), которое используют на последующей стадии без дополнительной очистки. 4) Этил-4-(бромметил)-3-метоксиизоксазол 5-карбоксилат. Этил-3-метокси-4-метилизоксазол-5 карбоксилат (1,3 г, 7,0 ммоль), NBS (Nбромсукцинимид) (1,4 г, 7,9 ммоль), дибензоилпероксид (каталитическое количество) и тетрахлорметан (40 мл) кипятят с обратным холодильником в течение 10 ч. Смесь охлаждают,фильтруют и концентрируют в вакууме, и получают сырое целевое соединение в виде желтого масла (1,8 г, 97%). Неочищенный продукт используют на последующей стадии без дополнительной очистки. 5) Этил-2-ацетамидо-2-(этоксикарбонил)3-[5-(этоксикарбонил)-3-метоксиизоксазол-4 ил]пропионат. Смесь диэтилацетамидомалоната (1,6 г, 7,4 ммоль) и трет-бутоксида калия (0,9 г, 8,0 ммоль) в N-метилпирролидоне (30 мл) перемешивают при комнатной температуре в течение 30 мин. Добавляют этил-4-(бромметил)-3-метоксиизоксазол-5-карбоксилат (1,8 г, 6,8 ммоль) в Nметилпирролидоне (10 мл) (темп. 22-28 С), и получающуюся в результате смесь перемешивают при комнатной температуре в течение 1,5 ч. Реакционную смесь выливают в смесь льда с водой (100 мл), и водную фазу экстрагируют EtOAc (3 х 150 мл). Органические экстракты промывают водным раствором третбутоксида калия, водой (100 мл) и рассолом(100 мл), сушат (МgSO4) и концентрируют в вакууме. После флэш-хроматографии (силикатель, элюент - смесь EtOAc с гептаном, 1:1) получают сырое целевое соединние (1,8 г, 66%). Небольшой образец перекристаллизовывают(EtOAc с гептаном), и получают бесцветное кристаллическое вещество; т.пл. 78-80 С. Сырой продукт используют на последующей стадии без дополнительной очистки.(соед.1). Суспензию этил-2-ацетамидо-2-(этоксикарбонил)-3-[5-(этоксикарбонил)-3-метоксиизоксазол-4-ил]пропионата (1,2 г, 3,0 ммоль) в 0,5 М НСl (100 мл) кипятят с обратным холодильником в течение 48 ч. Смесь охлаждают,промывают дихлорметаном (100 мл) и диэтиловым эфиром (2 х 100 мл), фильтруют и концентрируют в вакууме. Добавляют воду (5 мл) и доводят рН примерно до 3, добавляя растворNaOH (0,1 М и 1 М). Водную фазу уменьшают в объеме в вакууме (2 мл) и собирают выпавший осадок фильтрацией. Осадок перемешивают в воде (2 мл) при комнатной температуре в течение 24 ч, и после фильтрации получают соединение 1 (70 мг, 10%); т. пл. 222-225 С (разл.). 1(ДМСО-d6) d 22,70, 52,38, 57,32, 103,25, 159,43,165,95, 170,66 (2 С). M.-c. M+H)+ m/e 231. Элементный анализ: (С 8 Н 10N2O60,25 Н 2O) вычислено: С-40,94; Н-4,51; N-11,94; найдено: С-41,01, Н-4,37, N-11,91. Подобным образом получают перечисленные ниже соединения.(RS)-2-амино-3-(5-карбокси-2,3 дигидро-2-метил-3-оксоизоксазол-4-ил)пропионовой кислоты (соед. 5). Этил-2,3-дигидро-2,4-диметил-3-оксоизоксазол-5-карбоксилат. Смесь этил-3-гидрокси-4-метилизоксазол 5-карбоксилата (2,0 г, 11,7 ммоль) и К 2 СО 3 (4,0 г, 29 ммоль) в этаноле (50 мл) греют при 40 С в течение 26 ч. Через 1 ч добавляют йодистый метил (0,8 мл, 13 ммоль), и осуществляют добавление еще 3 раза в течение последующих 25 ч. Раствор фильтруют и уменьшают его объем в вакууме (согласно 1H ЯМР, получают смесь целевого соединения и этил-3-метокси-4 метилизоксазол-5-карбоксилата, 1:1). Флэшхроматография (силикатель, элюент - смесь дихлорметана с диэтиловым эфиром, 9:1, затем 1:1) дает этил-3-метокси-4-метилизоксазол-5 карбоксилат в виде желтого масла (0,40 г, 18%) и целевое соединение (0,45 г, 21%). Небольшой образец последнего вещества перекристаллизовывают (EtOAc/гептан), и получают бесцветное кристаллическое вещество с т.пл. 64-65 С. Сырое целевое соединение используют на последующей стадии без дополнительной очистки. Гидрат(RS)-2-амино-3-(5-карбокси-2,3 дигидро-2-метил-3-оксоизоксазол-4-ил) пропионовой кислоты (соед.5). Названное в заголовке соединение получают способом, аналогичным способу, примера 1, стадии 2)-6), с использованием продукта, полученного выше на стадии 1) (70 мг, бесцветные кристаллы, 72%). Т.пл. 211-212 С (разл.). 1 Н ЯМР (ДМСО-d6)2,87 (дд, 1 Н); 2,97(ДМСО-d6)23,10, 32,32, 51,79, 106,51, 158,59,162,37, 166,64, 170,35. M.-c. M+H)+) m/e 231. Элементный анализ: (C8H10N2O60,25 Н 2 О) вычислено: С-40,94; Н-4,51; N-11,94; найдено: С-40,93, Н-4,55, N-11,71. Подобным образом получают соединение моногидрат (RS)-2-амино-3-(5-карбокси-2-этил 2,3-дигидро-3-оксоизоксазол-4-ил)пропионовой кислоты (соед. 6). 1(2,6 г, 7,1 ммоль), 5,4 М NaOMe в МеОН (0,6 мл,3,4 ммоль) и EtOH (80 мл) перемешивают при комнатной температуре в течение 30 мин. Добавляют уксусную кислоту (2,2 мл, 39,3 ммоль) и 2-амино-2-метилпропан-1-ол (1,8 мл, 18,8 ммоль), и получающуюся в результате смесь кипятят с обратным холодильником в течение 20 ч. Реакционную смесь охлаждают, добавляют воду (100 мл) и экстрагируют EtOAc (3 х 100 мл). Органические экстракты промывают 1 М раствором NaOH, рассолом, сушат (МgSO4) и упаривают в вакууме. Остаток растворяют вEtOH (60 мл), добавляют раствор КОН (1,8 г, 32 ммоль) в воде (12 мл), и смесь перемешивают при комнатной температуре в течение 20 ч.EtOH удаляют в вакууме, добавляют воду (80 мл), и водную фазу экстрагируют EtOAc (3 х 100 мл). Органические экстракты промывают рассолом, сушат (МgSO4) и упаривают в вакууме. Флэш-хроматография (силикагель, элюент EtOAc с гептаном и триэтиламином, 75:25:1) дает неочищенное целевое соединение в виде желтого масла (2,0 г, 52%). 2) 4-(Бромметил)-5-(4,5-дигидро-4,4 диметил-1,3-оксазол-2-ил)-3-этоксиизоксазол. 5-(4,5-Дигидро-4,4-диметил-1,3-оксазол-2 ил)-3-этокси-4-метилизоксазол (2,0 г, 8,9 ммоль), NBS (1,75 г, 9,8 ммоль) и тетрахлорметан (150 мл) кипятят с обратным холодильником в течение 5 ч. Смесь охлаждают,фильтруют и концентрируют в вакууме. Флэшхроматография (силикатель, элюент - толуол сEtOAc и триэтиламином, 100:10:1) дает целевое соединение в виде желтого масла (2,0 г, 74%). 3) (2S,5R)-2,5-Дигидро-2-[5-(4,5-дигидро 4,4-диметил-1,3-оксазол-2-ил)-3-этоксиизоксазол-4-ил]метил-5-изопропил-3,6-диметоксипиразин и(2R,5R)-2,5-дигидро-2-[5-(4,5 дигидро-4,4-диметил-1,3-оксазол-2-ил)-3 этоксиизоксазол-4-ил]метил 5-изопропил-3,6 диметоксипиразин. К предварительно охлажденному (-78 С) раствору (2R)-(-)-2,5-дигидро-2-изопропил-3,6 диметоксипиразина (0,5 мл, 2,8 ммоль) в безводном тетрагидрофуране (8 мл) добавляют 1,6 М раствора бутиллития в гексане (1,9 мл, 3,0 ммоль). Продолжают перемешивание при -78 С в течение 10 мин, добавляют 4-(бромметил)-5(4,5-дигидро-4,4-диметил-1,3-оксазол-2-ил)-3 этоксиизоксазол (0,85 г, 2,8 ммоль), растворенный в тетрагидрофуране (5 мл), и получающуюся в результате смесь перемешивают при -78 С в течение 4,5 ч. Реакционную смесь нагревают до комнатной температуры и концентрируют в вакууме. Остаток растворяют в диэтиловом эфире (40 мл) и выливают в смесь льда с водой(40 мл). Слои разделяют, и водную фазу экстрагируют диэтиловым эфиром (2 х 40 мл). Органические экстракты промывают рассолом, сушатEtOAc, 3:1) дает названное в заголовке (2S,5R)соединение в виде желтого масла (0,65 г, 57%),de = 99,2% (время удержания прибл. 38 мин). Дополнительное элюирование дает неочищенное целевое (2R,5R)-соединение в виде желтого масла (38 мг, 3%). 4) (2R,5S)-2,5-Дигидро-2-[5-(4,5-дигидро 4,4-диметил-1,3-оксазол-2-ил)-3-этоксиизоксазол-4-ил]метил-5-изопропил-3,6-диметоксипиразин и (2S,5S)-2,5-дигидро-2-[5-(4,5-дигидро 4,4-диметил-1,3-оксазол-2-ил)-3-этоксиизоксазол-4-ил]метил-5-изопропил-3,6-диметоксипиразин. Целевые соединения получают с помощью процедуры, описанной выше на стадии 3), с использованием в качестве исходного вещества(2S)-(+)-2,5-дигидро-2-изопропил-3,6 диметоксипиразина. Флэш-хроматография (силикагель, элюент - гептан с EtOAc, 3:1) дает названное в заголовке (2R,5S)-соединение в виде желтого масла (0,8 г, 54%), de99,2% (время удержания прибл. 38 мин). Дополнительное элюирование дает неочищенное целевое(2S,5S)-соединение в виде желтого масла (60 мг,4%). 5) (S)-2-Амино-3-(5-карбокси-3-этоксиизоксазол-4-ил)-пропионовая кислота (соед. (3)-2). Суспензию (2S,5R)-2,5-дигидро-2-[5-(4,5 дигидро-4,4-диметил-1,3-оксазол-2-ил)-3 этоксиизоксазол-4-ил]метил-5-изопропил-3,6 диметоксипиразина (0,6 г, 1,5 ммоль) в 1 М трифторуксусной кислоте (200 мл) кипятят с обратным холодильником в течение 5 ч. Реакционную смесь концентрируют в вакууме (2 мл), остаток растворяют в воде (50 мл) и промывают EtOAc (3 х 50 мл). Водную фазу фильтруют, упаривают в вакууме досуха, и остаток обрабатывают водой (10 мл). Осадок, который образуется, перемешивают при комнатной температуре в течение 24 ч, собирают посредством фильтрации и перекристаллизовывают (вода), и получают соединение (S)-2 в виде бесцветных кристаллов (0,12 г, 33%); т.пл. 259-261 С (разл.); ее 99% (время удержания прибл. 30 мин). 1H ЯМР (ДМСО-d6)1,34 (т, 3 Н); 2,90 (дд,1 Н); 3,03 (дд, 1 Н); 3,96 (дд, 1 Н); 4,23 (к, 2 Н). М.с. М+Н)+) m/е 245. Элементный анализ: (C9H12N2O6) вычислено: С-44,27; Н-4,95; N-11,47; найдено: С-44,45, Н-4,96, N-11,46. 6) (R)-2-Амино-3-(5-карбокси-3-этоксиизоксазол-4-ил)-пропионовая кислота (соед. (R)-2). К раствору (2R,5S)-2,5-дигидро-2-[5-(4,5 дигидро-4,4-диметил-1,3-оксазол-2-ил)-3 этоксиизоксазол-4-ил]метил-5-изопропил-3,6 диметоксипиразина (0,6 г, 1,5 ммоль) в МеОН (7 мл) при перемешивании добавляют 0,25 М НС 1(74 мл, 7,4 ммоль), и получающуюся в результате смесь перемешивают при комнатной температуре в течение 2 ч. Доводят рН примерно до 7,добавляя водный раствор аммиака (0,5 М), и удаляют МеОН в вакууме. Доводят рН до 8-9, 001625 18 добавляя водный раствор аммиака (0,5 М), и водную фазу экстрагируют EtOAc (4 х 50 мл). Органические экстракты промывают рассолом,сушат (МgSO4) и концентрируют в вакууме. Остаток суспендируют в 1 М НСl, и смесь кипятят с обратным холодильником в течение 4,5 ч. Реакционную смесь концентрируют в вакууме(2 мл), остаток растворяют в воде (50 мл) и промывают EtOAc (3 х 50 мл). Водную фазу фильтруют, упаривают в вакууме досуха, и остаток обрабатывают водой (10 мл). Осадок, который образовался, перемешивают при комнатной температуре в течение 2 ч, собирают посредством фильтрации и перекристаллизовывают (вода), и получают соединение (R)-2 в виде бесцветных кристаллов (0,13 г, 36%); т.пл. 258260 С (разл.); ее 99% (время удержания прибл. 50 мин.). 1 Н ЯМР (ДМСО-d6)1,34 (т, 3 Н); 2,90 (дд,1 Н); 3,03 (дд, 1 Н); 3,96 (дд, 1 Н); 4,23 (к, 2 Н). М.с. M+H)+) m/e 245. Элементный анализ: (C9H12N2O6) вычислено: С-44,27; Н-4,95; N-11,47; найдено: С-44,56, Н-4,95, N-11,53. Пример 4. ГидратN-[(Диметиламино)метилиден]-3-этокси-4 метилизоксазол-5-карбоксамид. Раствор 3-этокси-4-метилизоксазол-5 карбоксамида (3,5 г, 21 ммоль) в N,Nдиметилформамиддиметилацетале (15 мл) перемешивают при 120 С в течение 15 мин. После охлаждения собирают целевое соединение в виде бесцветного кристаллического веществаN-[(диметиламино)метилиден]-3-этокси-4 метилизоксазол-5-карбоксамид (1,8 г, 8,0 ммоль). Реакционную смесь перемешивают при 90 С в течение 15 мин, и затем оставляют при комнатной температуре для кристаллизации, и получают чистое целевое соединение (1,2 г,77%); т.пл. 194-196 С. Добавляют воду (40 мл),и водную фазу экстрагируют EtOAc (3 х 30 мл). Органические экстракты промывают рассолом,сушат (МgSO4) и концентрируют в вакууме, и получают неочищенное целевое соединение (0,3 г, 20%). Обе партии вещества объединяют. 3-(3-Этокси-4-метилизоксазол-5-ил)-1 тритил-1 Н-1,2,4-триазол. К 3-(3-этокси-4-метилизоксазол-5-ил)-1 Н 1,2,4-триазолу (1,1 г, 5,7 ммоль), триэтиламину(2,5 мл, 18 ммоль) и ДМФА (20 мл) добавляют тритилхлорид (1,6 г, 5,7 ммоль) в ДМФА (5 мл). Смесь перемешивают при комнатной температуре в течение 5 ч и выливают в смесь льда с водой (200 мл). Водную фазу экстрагируют ди 19 этиловым эфиром (3 х 200 мл), и органические экстракты промывают водным растворомNа 2 СО 3 (10%) (200 мл) и рассолом (200 мл). Раствор сушат (Na2SO4) и концентрируют в вакууме, и получают сырое целевое соединение(EtOAc), и получают отдельный изомер в виде бесцветного кристаллического вещества; т.пл. 181-183 С. Сырое вещество используют на последующей стадии без дополнительной очистки. 3-[(4-Бромметил)-3-этоксиизоксазол-5-ил]1-тритил-1 Н-1,2,4-триазол. Смесь 3-(3-этокси-4-метилизоксазол-5-ил)1-тритил-1 Н-1,2,4-триазола (2,4 г, 5,5 ммоль) иNBS (1,1 г, 6,2 ммоль) в тетрахлорметане (50 мл) кипятят с обратным холодильником в течение 3 ч. Реакционную смесь охлаждают, фильтруют и концентрируют в вакууме, и получают неочищенное соединение (2,8 г). Сырой продукт используют на последующей стадии без дополнительной очистки. Этил-2-ацетамидо-3-[3-этокси-5-(1-тритил 1 Н-1,2,4-триазол-3-ил)изоксазол-4-ил]-2-(этоксикарбонил)пропионат. Смесь диэтилацетамидомалоната (1,3 г, 6,0 ммоль) и трет-бутоксида калия (0,73 г, 6,5 ммоль) в N-метилпирролидоне (30 мл) перемешивают при комнатной температуре в течение 30 мин. Добавляют 3-[(4-бромметил)-3 этоксиизоксазол-5-ил]-1-тритил-1 Н-1,2,4 триазолNметилпирролидоне (20 мл) (темп. 22-28 С), и получающуюся в результате смесь перемешивают при комнатной температуре в течение 2 ч. Реакционную смесь выливают в смесь льда с водой (250 мл), и водную фазу экстрагируютEtOAc (3 х 250 мл). Органические экстракты промывают водным раствором трет-бутоксида калия и рассолом, сушат (Na2SO4) и концентрируют в вакууме. Флэш-хроматография (силикатель, элюент EtOAc с гептаном и триэтиламином, 50:50:2) дает соединение (2,2 г, 62%); т.пл. 145-149 С. Гидрат(RS)-2-амино-3-[3-этокси-5-(1 Н 1,2,4-триазол-3-ил)-изоксазол-4-ил]пропионовой кислоты (соед. 7). Суспензию этил-2-ацетамидо-3-[3-этокси 5-(1-тритил-1 Н-1,2,4-триазол-3-ил)изоксазол-4 ил]-2-(этоксикарбонил)пропионата (1,5 г, 2,3 ммоль) в 1 М НСl (150 мл) кипятят с обратным холодильником в течение 24 ч. Раствор охлаждают, промывают диэтиловым эфиром (2 х 150 мл) и дихлорметаном (150 мл), фильтруют и концентрируют в вакууме. Добавляют воду (5 мл), и доводят рН примерно до 3,5 путем добавления раствора NaOH (0,1 М и 1 М), и посредством фильтрации получают соединение 7 (0,35 г,56%). Т.пл. 225-227 С (разл.). 1(RS)-2-Aмино-3-[3-этокси-5-(5-тетразолил) изоксазол-4-ил]-пропионовая кислота (соед.8). Целевое соединение получают из 2 ацетамидо-3-[3-этокси-5-(тетразол-5-ил) изоксазол-4-ил]-2-(этоксикарбонил)пропионата по способу, аналогичному способу, описанному в примере 4. Пример 6.(RS)-2-Амино-3-(5-карбокси-3-гидроксиизоксазол-4-ил)пропионовую кислоту (3,5 г,11,8 ммоль) и раствор НСl в этаноле (50 мл) кипятят с обратным холодильником в течение 2,5 ч и упаривают в вакууме досуха. Получают этил-(RS)-2-амино-3-(5-этоксикарбонил-3-гидроксиизоксазол-4-ил)пропионат (4,15 г, 100%). К раствору этил-(RS)-2-амино-3-(5-этоксикарбонил-3-гидроксиизоксазол-4-ил) пропионата (4,15 г, 11,7 ммоль) в смеси воды и 1,4 диоксана (1:1, 50 мл) добавляют смесь ди-третбутилдикарбоната (3,1 г, 14 ммоль), триэтиламина (3,8 г, 37 ммоль) и 1,4-диоксана (15 мл), и получающуюся в результате смесь перемешивают при комнатной температуре в течение 16 ч. Выпаривают 1,4-диоксан в вакууме, и водную фазу подкисляют разбавленной соляной кислотой. Водную фазу экстрагируют этилацетатом, и органические экстракты промывают водой, рассолом, сушат (MgSO4) и концентрируют в вакууме. Флэш-хроматография (SiO2, элюент гептан с этилацетатом и уксусной кислотой (1:1,4%) дает этил-(RS)-2-трет-бутоксикарбониламино-3-(5-этоксикарбонил-3-гидроксиизоксазол-4-ил)пропионат в виде масла (4,1 г, 92%). Смесь этил-(RS)-2-трет-бутоксикарбониламино-3-(5-этоксикарбонил-3-гидроксиизоксазол-4-ил)пропионата (3,2 г, 8,6 ммоль) и К 2 СО 3 (2,4 г, 17,2 ммоль) в ацетоне (40 мл) нагревают до образования флегмы. Добавляют бензилбромид (2,2 г, 12,9 ммоль), и смесь кипятят с обратным холодильником в течение 1,5 ч. Реакционную смесь концентрируют в вакууме,и подвергают остаток флэш-хроматографии 21 изоксазол-4-ил]пропионата (0,65 мг, 1,4 ммоль) и 1 М раствора NaOH (50 мл) кипятят с обратным холодильником в течение 16 ч. Смесь охлаждают (5 С), подкисляют разбавленной соляной кислотой и концентрируют в вакууме. Остаток перекристаллизовывают из воды и получают (RS)-2-амино-3-(3-бензилокси-5-карбоксиизоксазол-4-ил) пропионовую кислоту (0,1 г,23%). Т.пл. 209-211 С (разл.). 1 Н ЯМР (ДМСО-d6)2,95 (дд, 1 Н); 3,05(дд, 1 Н); 3,99 (т, 1 Н), 5,26 (с, 2 Н); 7,31-7,52 (м,5 Н). М.-с. М+Н)+) m.е 307. Элементный анализ: вычислено: С-54,89; Н-4,62; N-9,15; найдено: С-54,31, Н-4,56, N-8,97. Подобным образом получают перечисленные ниже соединения.(дд, 1 Н); 3,99 (дд, 1 Н), 4,73 (д,2 Н); 5,29 (дд, 1 Н); 5,44 (дд, 1 Н); 6,05 (дк, 1 Н). Также подобным образом можно получить (RS)2-амино-3-[3-(транс-2-бутенокси)(3 мл) добавляют к раствору (RS)-2-амино-3-(5 карбокси-3-этоксиизоксазол-4-ил)пропионовой кислоты (1,0 г, 4,1 ммоль) в смеси воды с 1,4 диоксаном (1:1, 10 мл) и получающуюся в результате смесь перемешивают при комнатной температуре в течение 16 ч. Испаряют 1,4 диоксан в вакууме, и подкисляют водную фазу разбавленной соляной кислотой. Водную фазу экстрагируют этилацетатом, и органические экстракты промывают водой и рассолом, сушат(MgSO4), концентрируют в вакууме и подвергают флэш-хроматографии (SiO2, элюент - этилацетат с этанолом и уксусной кислотой (3:1,4%). Получают (RS)-2-[(трет-бутоксикарбонил) амино]-3-(5-карбокси-3-этоксиизоксазол-4 ил)пропионовую кислоту (1,4 г, 100%). К смеси (RS)-2-[(трет-бутоксикарбонил) амино]-3-(5-карбокси-3-этоксиизоксазол-4-ил) пропионовой кислоты (1,4 г, 4,1 ммоль) и бензилбромида (1,4 г, 8,2 ммоль) в смеси бензола с тетрагидрофураном (4:1) добавляют 1,8 диазабицикло[5.4.0]ундец-7-ен (1,3 г, 8,6 ммоль), и получающуюся в результате смесь кипятят с обратным холодильником в течение 3 ч. Смесь фильтруют и упаривают в вакууме. Флэш-хроматография (SiO2, элюэнт - этилацетат с гептаном (1:3) дает бензил-(RS)-2-[(третбутоксикарбонил)амино]-3-(5-бензилоксикарбонил-3-этоксиизоксазол-4-ил)пропионат в виде масла (1,9 г, 86%). Смесь бензил-(RS)-2-[(трет-бутоксикарбонил)амино]-3-(5-бензилоксикарбонил-3-этоксиизоксазол-4-ил)пропионата (1,9 г, 3,6 ммоль) и насыщенного раствора НСl в диэтиловом эфире(40 мл) кипятят с обратным холодильником в течение 2 ч. Образовавшиеся кристаллы собирают фильтрацией, перемешивают с этилацетатом и собирают фильтрацией (0,53 г, 32%). Т.пл. 142-144 С. 1 Н ЯМР (ДМСО-d6)1,32 (т, 3 Н); 3,17 (дд,1 Н); 3,25 (дд, 1 Н), 4,17-4,32 (м, 3 Н); 5,09 (дд,2 Н); 5,39 (с, 2 Н); 7,24-7,53 (м, 10 Н). М.-с. М+Н)+) m/е 425. Элементный анализ: вычислено: С-59,93; Н-5,48; N-6,08; найдено: С-59,70; Н-5,49; N-6,26. 23 Пример 9. Оксалат этил-(RS)-2-амино-3-(3-этокси-5 этоксикарбонилизоксазол-4-ил)пропионата (соед. 5). Смесь (RS)-2-амино-3-(5-карбокси-3-этоксиизоксазол-4-ил)-пропионовой кислоты (2,0 г,8,2 ммоль) и раствора НСl в этаноле (35 мл) кипятят с обратным холодильником в течение 3 ч,и получают этил-(RS)-2-амино-3-(5-карбокси-3 этоксиизоксазол-4-ил)пропионат. Этил-(RS)-2 амино-3-(5-карбокси-3-этоксиизо-ксазол-4 ил)пропионат (0,6 г) добавляют к разбавленному раствору NaOH, и водную фазу экстрагируют этилацетатом. Органические экстракты промывают рассолом, сушат (MgSO4), фильтруют и упаривают досуха в вакууме. Остаток растворяют в ацетоне (6 мл), и добавляют раствор щавелевой кислоты (0,14 г, 1,6 ммоль) в ацетоне (6 мл), и образовавшийся осадок собирают фильтрацией (110 мг, 10%). Т.пл. 159-161 С. 1[4-(2-Амино-3,4-диоксоциклобут-1-ен-1 ил)аминометил]-3-этоксиизоксазол-5-карбоновая кислота (соед. 17). Этил-3-этокси-4-метилизоксазол-5-карбоксилат. Ацетилхлорид (25 мл, 0,35 ммоль) при 0 С добавляют к EtOH (250 мл), и раствор перемешивают при 0 С в течение 20 мин. Добавляют раствор 3-этокси-4-метилизоксазол-5 карбоновой кислоты (WO 95/12587, А 1) (18 г,0,10 моль) в EtOH (20 мл), и получающуюся в результате смесь кипятят с обратным холодильником в течение 4 ч. Смесь охлаждают, добавляют раствор NаНСО 3 (200 мл) и экстрагируют диэтиловым эфиром (3 х 300 мл). Органические экстракты сушат (MgSO4) и концентрируют в(18 г, 86%). Этил-4-бромметил-3-этоксиизоксазол-5 карбоксилат. Этил-3-этокси-4-метилизоксазол-5-карбоксилат (18 г, 91 ммоль), NBS (17,5 г, 100 ммоль), дибензоилпероксид (1 г, 4,1 ммоль) в тетрахлорметане (500 мл) кипятят с обратным холодильником в течение 16 ч. Смесь охлаждают, фильтруют и концентрируют в вакууме, и получают названное в заголовке неочищенное соединение (24,5 г, 97%). Этил-3-этокси-4-фталимидометилизоксазол-5-карбоксилат. Раствор этил-4-бромметил-3-этоксиизоксазол-5-карбоксилата (5 г, 17,9 ммоль) в ДМФА (85 мл) добавляют при 90 С к суспензии фталимида калия (3,6 г, 19,7 ммоль) в ДМФА(125 мл). Получающуюся в результате смесь перемешивают при 90 С в течение 40 мин, затем охлаждают и концентрируют в вакууме. Добавляют воду (250 мл), и водную фазу экстрагируют диэтиловым эфиром (2 х 200 мл). Органические экстракты сушат (MgSO4) и концентрируют в вакууме, и получают сырой продукт реакции,который перекристаллизовывают(EtOH), и получают целевое соединение (3,70 г,60%); т.пл. 93-94 С. Гидрохлорид 4-аминометил-3-этоксиизоксазол-5-карбоновой кислоты. Раствор этил-3-этокси-4-фталимидометилизоксазол-5-карбоксилата в 1 М раствореNaOH кипятят с обратным холодильником в течение 45 мин. Смесь охлаждают, добавляют концентрированную НСl и экстрагируют диэтиловым эфиром (3 х 400 мл). Органические экстракты концентрируют в вакууме, добавляют 1 М НСl (600 мл), и кипятят с обратным холодильником в течение 1 ч. После охлаждения смесь промывают диэтиловым эфиром (3 х 600 мл) и концентрируют в вакууме, и получают сырой продукт реакции, который перекристаллизовывают (уксусная кислота) и получают соединение (1,5 г, 82%); т.пл. 215-216 С (разл.).[4-(2-Амино-3,4-диоксоциклобут-1-ен-1 ил)аминометил]-3-этоксиизоксазол-5-карбоновая кислота. К раствору гидрохлорида 4-аминометил-3 этоксиизоксазол-5-карбоновой кислоты (1,2 г,5,4 ммоль) и 3-амино-4-этоксициклобут-3-ен 1,2-диона (0,60 г, 5,9 ммоль) в EtOH (300 мл) добавляют 1 М раствор NaOH (12 мл). Получающуюся в результате суспензию перемешивают при комнатной температуре в течение 16 ч, затем концентрируют в вакууме, добавляют воду (100 мл) и промывают EtOAc (2 х 100 мл). Доводят рН примерно до 3, добавляя 1 М НСl. Выпавший осадок отфильтровывают и перекристаллизовывают (вода), и получают целевое соединение в виде желтого порошка (0,71 г,47%). Т.пл. 236-238 С (разл.).m/e 282. Элементный анализ: (С 11 Н 11N3 О 62,25 Н 2O) вычислено: С-41,06; Н-4,86; N-13,06; найдено: С-41,16, Н-4,46, N-12,96. Фармакология Соединения изобретения испытывают перечисленными ниже вполне признанными и заслуживающими доверия методами. Связывание [3H] АМРА. При этом испытании путем измерения способности к вытесению [3H]AMPA из АМРАрецепторов определяют аффинность лекарственного средства к АМРА-рецепторам. Испытание проводят по модифицированному варианту метода Нопоге, Т., and Nielsen,M., Neurosci. Lett., 1985, 54, 27-32. Испытание проводят в присутствии KSCN. Это означает,что помечаются только места связывания с высоким сродством к [3H]АМРА. Используемые мембранные препараты получают по методу Ransom, R.W., and Stec., J.Neurochem., 1988, 51, 830-836. Модель кортикального клина. Модель кортикального клина представляет испытание, при котором срезы головного мозга крысы исследуют in vitro, чтобы количественно определить действие лигандов на различныеGlu-рецепторы и оценить фармакологический профиль лигандов (т.е., соотношение агонистических и антагонистических свойств). Испытание проводят так, как описано в Harrison, N.L.,and Simmonds, М.А., Br. J. Pharmacol., 1985, 84,381-391, в измененном варианте по Wheatley,P.L., Br. J. Pharmacol., 1986, 87, 159P. Таблица 1 Кортикальный клин СоедиПрофиль ЕС 50, pK1 Подтип нение мкМ рeцептора 1 Агонист 1,2 АМРА 2 Агонист 4,8 АМРАNMDA Результаты Обнаружено, что данные соединения являются лигандами рецепторов для возбудительных аминокислот (ЕАА). Обнаружено, что некоторые из этих соединений являются агонистами рецепторов для АМРА, а другие соединения являются селективными антагонистами 26 АМРА- или NMDA-рецепторов. Соединения показывают активность в микромолярном интервале. Примеры композиций Фармацевтические композиции данного изобретения можно получить традиционными в технике способами. Например, таблетки можно получить посредством смешивания активного ингредиента с обычными адъювантами и/или разбавителями и последующего прессования смеси в обычной таблетирующей машине. Примерами адъювантов или разбавителей являются кукурузный крахмал, лактоза, тальк, стеарат магния, желатин, лактоза, смолы и подобные вещества. Можно использовать любой другой адъювант или добавку - красители, ароматизаторы, консерванты и т.п., при условии, что они совместимы с активными ингредиентами. Растворы для инъекций можно получить путем растворения активного ингредиента и приемлемых добавок в части носителя, предпочтительно - стерильной воде, доведения раствора до нужного объема, стерилизации раствора и наполнения подходящих ампул или флаконов. Можно добавить любую подходящую добавку, обычно применяемую в технике, такую как агенты токсичности, консерванты, антиоксиданты и т.п. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Производное (3-алкоксиизоксазол-4 ил)замещенной 2-аминокарбоновой кислоты или его серосодержащий аналог общей формулы I или II где R1 представляет водород, C1-6-алкил, С 2-6 алкенил, С 2-6-алкинил, циклоалк(ен)ил, циклоалк(ен)ил-С 1-6-алк(ен/ин)ил или фенил-С 1-6 алк(ен/ин)ил, причем фенильная группа необязательно замещена СF3, галогеном, C1-6-алкилом или C1-6-алкокси; А представляет связь или спейсер, выбранный из C1-6-алкилена, С 2-6-алкенилена или С 2-6-алкинилена и циклоалкилена; В представляет группу -CRa(NRbRc)COOR5, где Ra-Rc независимо представляют собой водород или C1-6-алкил и R5 имеет те же значения, что и R1, или представляет пивалоилоксиметил, или В представляет группу формулы III где R2, R3 и R4 выбирают независимо из группы,состоящей изb) C1-6-алкила, С 2-6-алкенила и С 2-6 алкинила, в которых один или несколько атомов углерода заменены на N, О и/или S, илиR4 и R2 соединяются с образованием C1-3 алкиленовой, С 2-3-алкениленовой или С 2-3 алкиниленовой группы, необязательно моноили дизамещенной гидрокси или метилом, или с образованием групп СН 2-O-СН 2; Е представляет COOR6, где R6 имеет те же значения, что и R5; Х представляет О или S;Y представляет О или S; и его фармацевтически приемлемая соль. 2. Соединение по п.1, отличающееся тем,что имеет формулу I. 3. Соединение по п.1, отличающееся тем,что имеет формулу II. 4. Соединение по любому из пп.1-3, где Е представляет группу СООR6, где R6 не является водородом, а предпочтительно R6 представляетC1-6-алкил, фенил-С 1-6-алк(ен/ин)ил или пивалоилоксиметил. 5. Соединение по любому из пп.1-3, где Е представляет СО-ОН. 6. Соединение по любому из пп.1-5, где В представляет группу формулы -CRa(NRbRc)COOR5. 7. Соединение по п.6, где Rb и Rc представляют водород, a Ra представляет водород илиC1-6-алкил, предпочтительно водород или метил. 8. Соединение по п.6 или 7, где R5 представляет водород. 9. Соединение по п.6 или 7, где R5 не является водородом, а предпочтительно R5 представляет C1-6-алкил, фенил-C1-6-алк(ен/ин)ил или пивалоилоксиметил. 28 10. Соединение по любому из пп.1-5, где В представляет группу формулы III. 11. Соединение по п.10, где R2, R3 и R4 представляют водород или C1-6-алкил, или R4 иC1-3 алкиленовой группы. 12. Соединение по п.11, где каждый из R2,R3 и R4 представляет водород. 13. Соединение по любому из пп.1-12, где Х представляет кислород. 14. Соединение по любому из пп.1-12, где Х представляет серу. 15. Соединение по любому из пп.1-14, гдеY представляет кислород. 16. Соединение по любому из пп.1-14, гдеY представляет серу. 17. Соединение по любому из пп.1-16, гдеR1 представляет C1-6-алкил, С 2-6-алкенил или С 2-6 алкинил, предпочтительно метил, этил, пропил или пропаргил. 18. Соединение по любому из пп.1-17, где А представляет связь или C1-3-алкилен, предпочтительно метилен. 19. Соединение по п.2, где А представляет связь или C1-3-алкилен, В представляет группу формулы -СН(NH2)-COOH или группу формулыIII, где каждый из R3, R4 и R2 представляет водород, Х и Y оба представляют кислород и R1 представляет C1-6-алкил, С 2-6-алкенил или С 2-6 алкинил, предпочтительно метил, этил, пропил или пропаргил. 20. Фармацевтическая композиция, отличающаяся тем, что включает соединение по любому из пп.1-19 вместе с фармацевтически приемлемым носителем или разбавителем. 21. Применение соединения по любому из пп.1-20 для получения фармацевтической композиции для лечения церебральной ишемии,болезни Гентингтона, эпилептических нарушений, болезни Паркинсона, болезни Альцгеймера, шизофрении, боли, депрессии или страха.
МПК / Метки
МПК: A61P 9/10, C07D 261/12, A61K 31/42
Метки: кислот, 3-алкоксиизоксазол-4-илзамещенных, производные, 2-аминокарбоновых
Код ссылки
<a href="https://eas.patents.su/15-1625-proizvodnye-3-alkoksiizoksazol-4-ilzameshhennyh-2-aminokarbonovyh-kislot.html" rel="bookmark" title="База патентов Евразийского Союза">Производные 3-алкоксиизоксазол-4-илзамещенных 2-аминокарбоновых кислот</a>
Предыдущий патент: Способ получения эластичных полиуретановых формованных изделий с плотной поверхностью и ячеистым ядром
Следующий патент: Способ получения силиконовой эластомерной композиции для использования в косметических продуктах
Случайный патент: Мебельная конструкция, такая как убирающаяся кровать с убирающимися ножками












