Способ получения зрелых дендритных клеток для индуцирования иммунного ответа и применение полученных клеток
Номер патента: 15266
Опубликовано: 30.06.2011
Авторы: Джанджоугазиан Каринэ, Цеутен Джаспер, Киркин Алексей
Формула / Реферат
1. Способ получения зрелых дендритных клеток для индуцирования иммунного ответа, экспрессирующих на своей поверхности CD1a, CD14низкий, CD83, CD86, IL-10низкий, CCR7 и IL-12p70 и имеющих стабильный фенотип низкого продуцирования IL-10, при котором клетки-предшественники и незрелые дендритные клетки культивируют в присутствии факторов созревания и дифференцировки, таких как GM-CSF, IL-4 и TNF-a, при температуре от 31 до 37°C.
2. Способ по п.1, где температура составляет 34°C.
3. Способ по любому из пп.1 и 2, где клетки-предшественники являются аутологическими клетками-предшественниками.
4. Способ по любому из пп.1-3, где клетки-предшественники выбирают из миелоидных клеток-предшественников или стволовых клеток.
5. Способ по п.4, где миелоидные клетки-предшественники являются моноцитами.
6. Популяция дендритных клеток, получаемых способом по любому из пп.1-5, где указанные клетки экспрессируют CD1a, CD14низкий, CD83, CD86, IL-10низкий, CCR7 и IL-12p70 и где указанные клетки имеют стабильный фенотип низкого продуцирования IL-10.
7. Применение популяции клеток по п.6 для стимуляции и/или экспансии Т-клеток.
8. Применение по п.7, где указанные T-клетки являются аутологическими Т-клетками.
9. Применение по пп.7 и 8, которое осуществляют in vitro.
10. Применение популяции клеток по п.6 для индуцирования иммунного ответа у субъекта.
11. Фармацевтическая композиция для индуцирования иммунного ответа, включающая популяцию дендритных клеток по п.6.
12. Фармацевтическая композиция по п.11 для индуцирования иммунного ответа против злокачественных образований и инфекционных болезней.
Текст
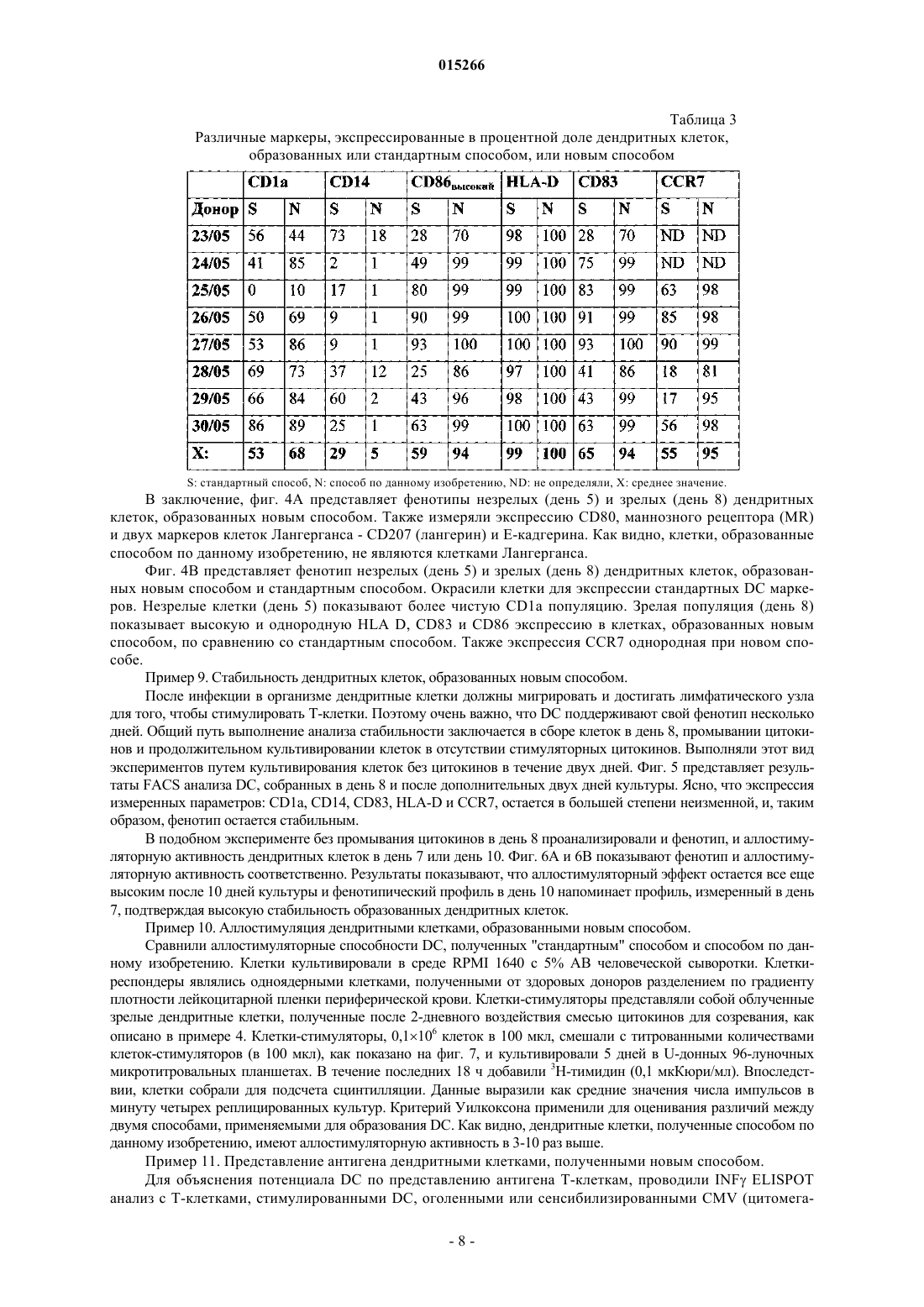
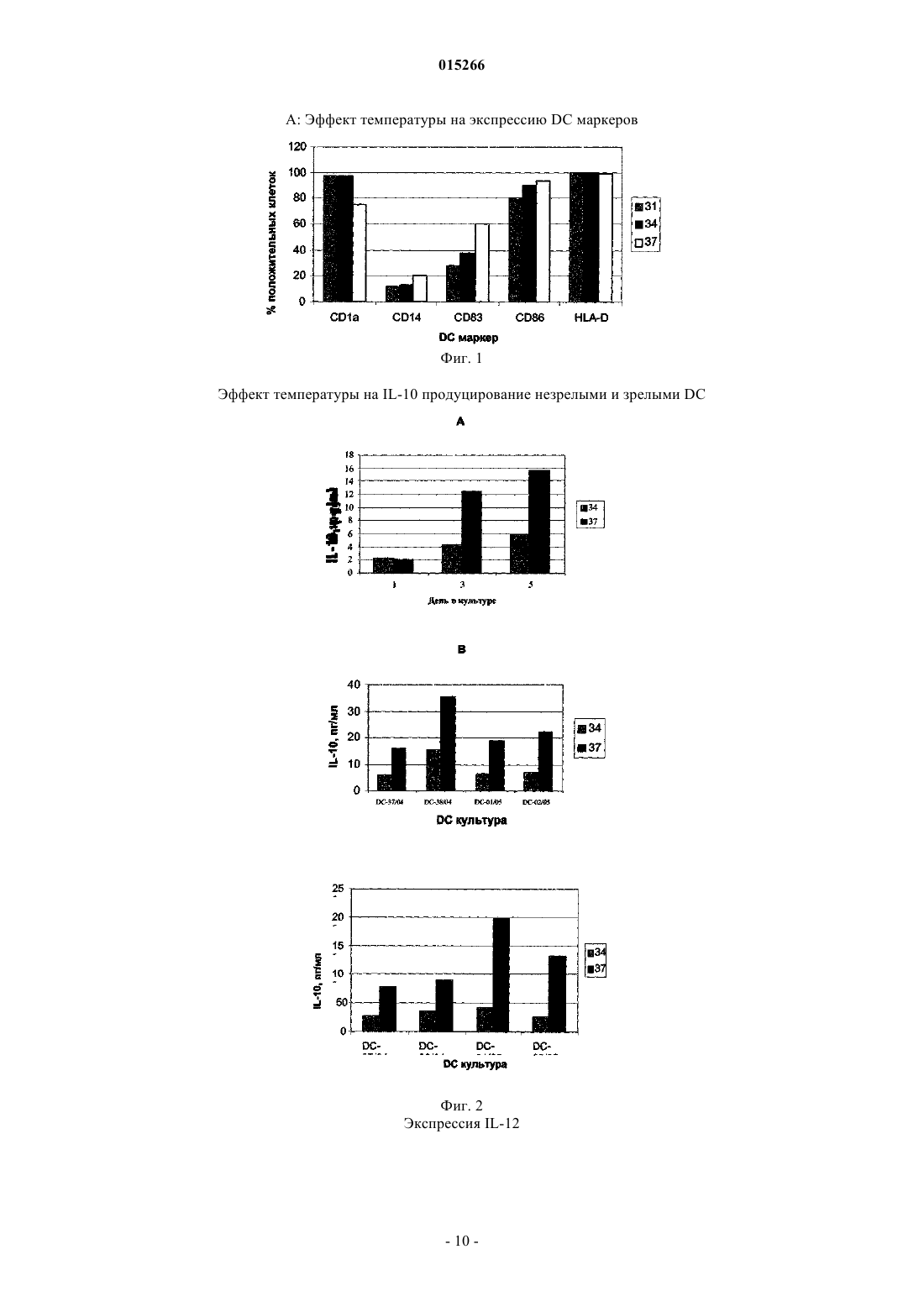
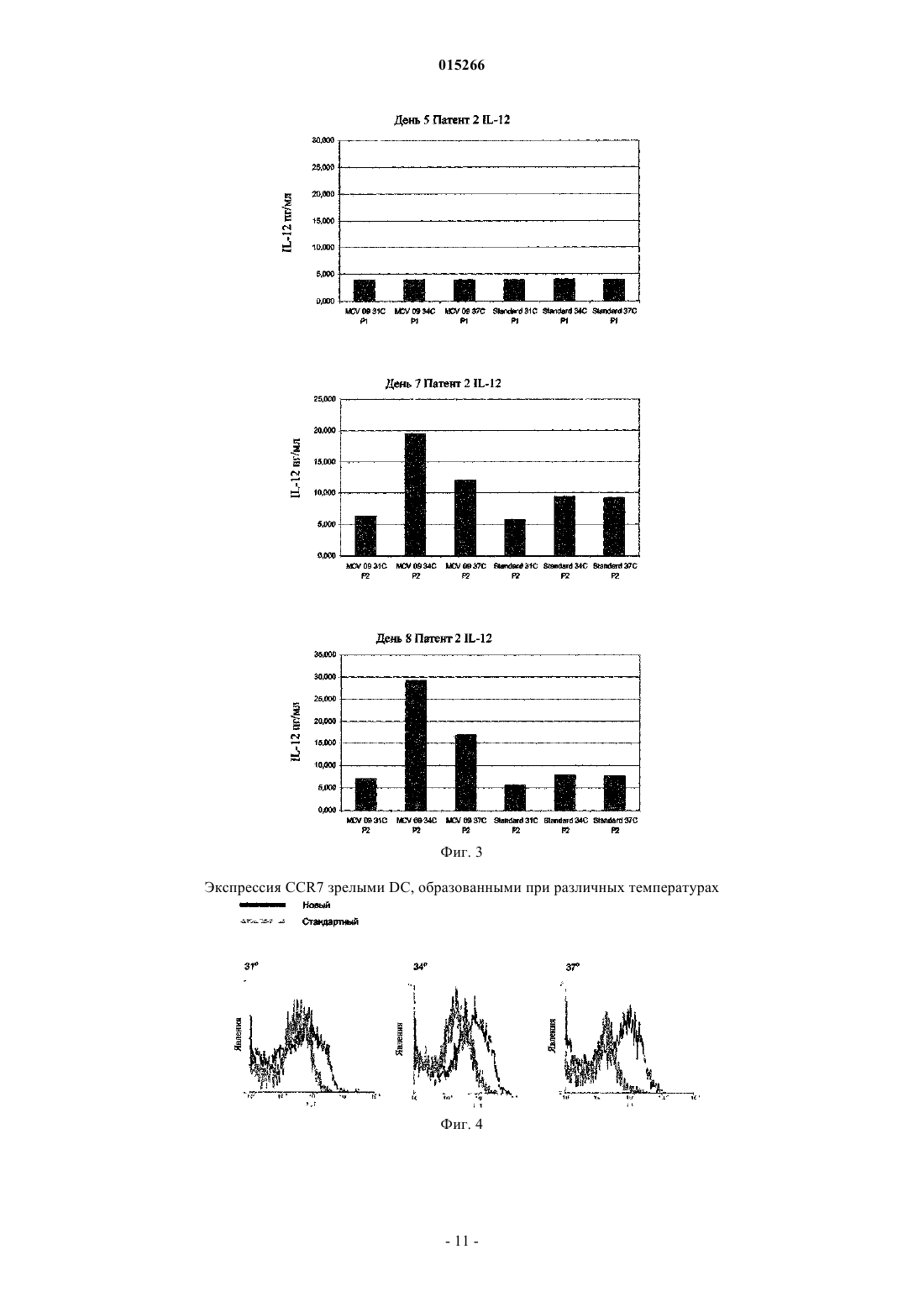
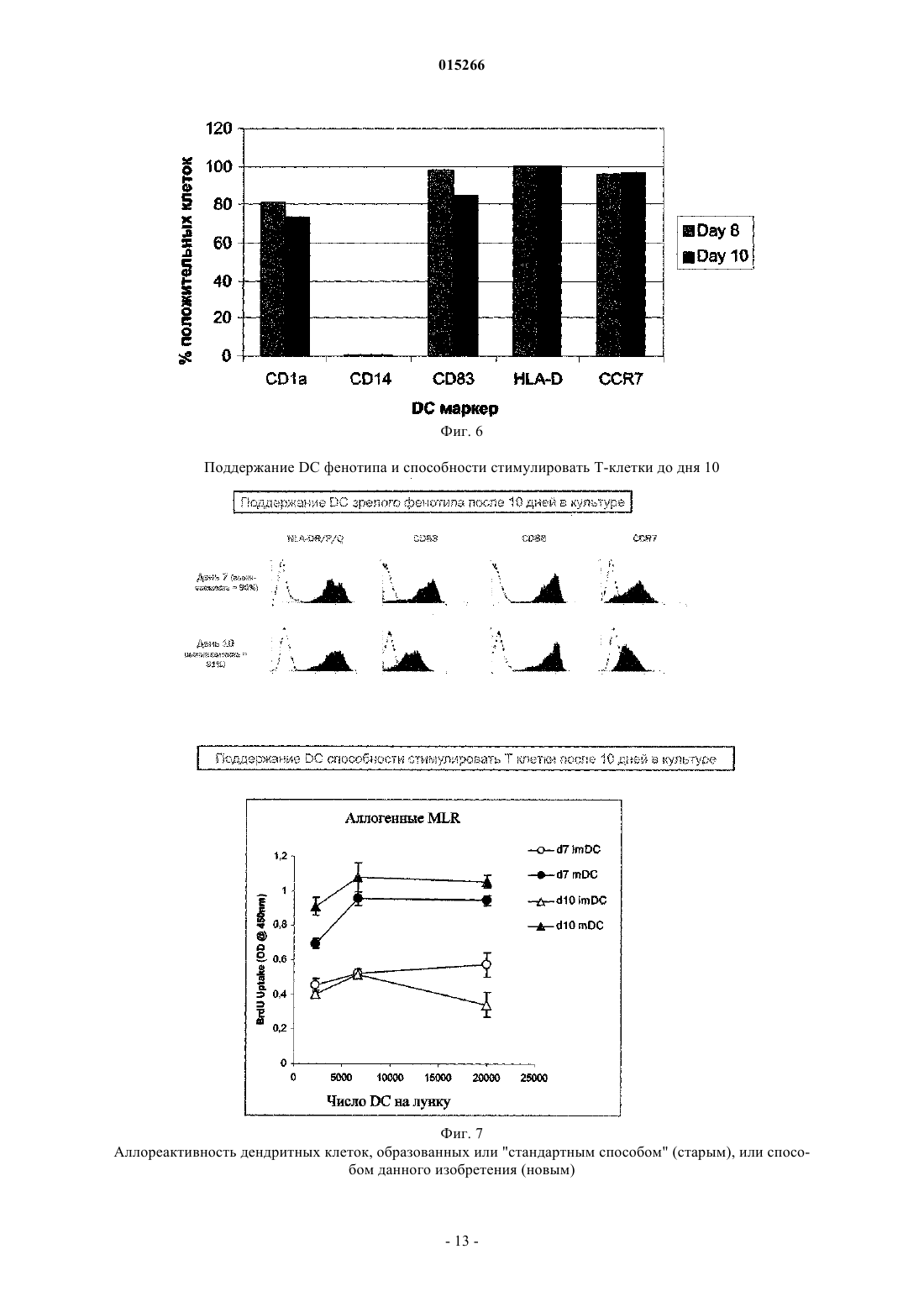
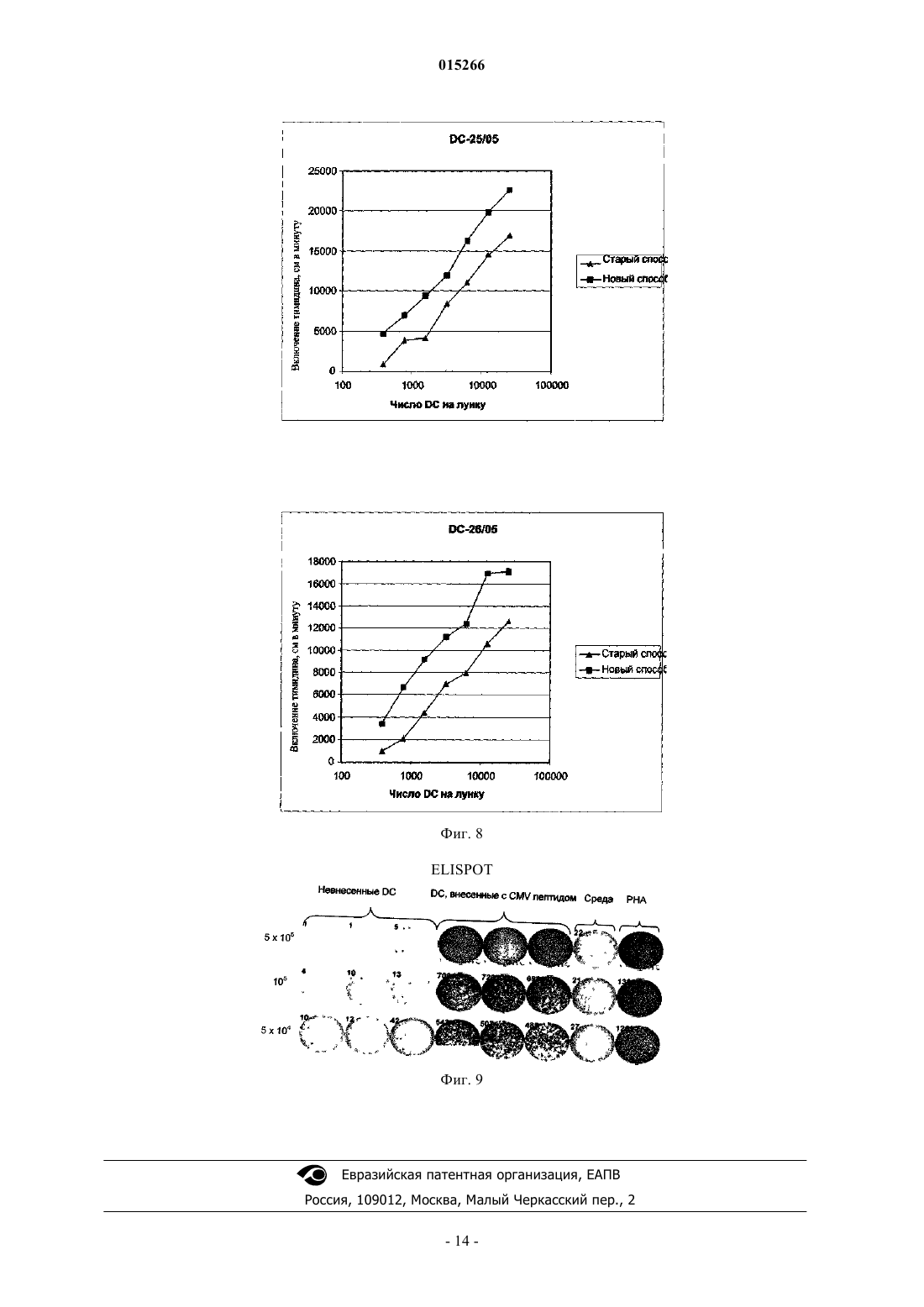
СПОСОБ ПОЛУЧЕНИЯ ЗРЕЛЫХ ДЕНДРИТНЫХ КЛЕТОК ДЛЯ ИНДУЦИРОВАНИЯ ИММУННОГО ОТВЕТА И ПРИМЕНЕНИЕ ПОЛУЧЕННЫХ КЛЕТОК Данное изобретение касается в определенных вариантах осуществления способа получения дендритных клеток путем применения температур ниже 37C во время развития клетокпредшественников и незрелых дендритных клеток. В некоторых вариантах осуществления данное изобретение касается популяций дендритных клеток и их применения. 015266 Область техники Данное изобретение касается способов и средств, применяемых для индуцирования иммунных ответов против злокачественных образований и инфекционных болезней. Более конкретно, данное изобретение относится к улучшенным способам образования представляющих антиген клеток. Предпосылки изобретения Иммунная терапия на основе дендритных клеток, при которой используют природные механизмы представления антигена, представляет собой наиболее многообещающий нетоксический способ лечения рака. Его можно использовать как самостоятельное лечение или как вспомогательное для других типов терапии, таких как, например, хирургическое вмешательство, облучение и химиотерапия. Стратегия основана на ex vivo манипуляции и реинтродукции клеточных продуктов для обхода иммунных компетентностей с целью индуцирования специфичных к опухоли иммунных ответов. Таким образом, основной целью такой иммунной терапии на основе дендритных клеток является индукция специфичных к опухоли эффекторных клеток in vivo, и последние успехи сфокусированы на CD8+ цитотоксическихT-лимфоцитах (CTL), способных распознавать и убивать опухолевые клетки. Кроме того, для лечения инфекционных болезней, таких как, например, ВИЧ (вирус иммунодефицита человека), могут быть полезны стратегии вакцинации на основе дендритных клеток. Представление антигена Индукция специфичных к опухоли иммунных ответов требует включения специальных представляющих антиген клеток (АРС), экспрессирующих молекулы главного комплекса гистосовместимости(МНС), а также связанных мембран и выделяемых костимуляторных молекул. К тому же, такие АРС должны быть способны поглощать, процессировать и представлять антигены в ассоциации с молекулами МНС. Дендритные клетки (DC) представляют собой специальные АРС иммунной системы со способностью активировать и наивные, и T-клетки памяти. Стадии, ведущие к созреванию DC, ассоциированы с определенными свойствами клеток. Незрелые DC особенно полезны при поглощении внеклеточных антигенов путем фагоцитоза или пиноцитоза и процессировании антигенов к пептидам в эндоцитотическом компартменте, таком как эндосомы и фагосомы. Здесь пептиды связаны с молекулами МНС класса II. Незрелые DC также обладают уникальной способностью вводить пептиды из экзогенных протеинов путь МНС класса I презентации, процесс, названный кросс-презентация. Способность эффективно стимулировать иммунный ответ активацией CD4+ типа 1 хелперныхT-клеток (Th1 клеток) и CD8+ цитотоксических T-клеток (CTL) критически зависит от зрелых DC. Только полностью созревшие DC, обеспеченные панелью связанных с мембранами костимуляторных и вспомогательных молекул, таких как, например, CD40, CD80, CD83, CD86 и МНС класса II, могут эффективно индуцировать пролиферацию и дифференциацию антигенспецифичных T-лимфоцитов 1. Фундаментальная роль костимуляторной активности DC заключается в обеспечении выделяемыми цитокинами, в частности IL-12p70. Его роль в активации T-клеток и их поляризации для Th1 типа ответа была четко показана Heufler et al. (1996)1. К тому же достаточная корреляция между присутствием IL-12 экспрессирующих зрелых DC в опухоли и выживанием пациента была представлена Inoue et al. (2005). Зрелые DC для цели вакцинации должны продуцировать ограниченные количества ингибирующего Th1 клетки цитокина IL-10.CCR7 является рецептором для хемокинов CCL19 и CCL21, которые продуцируются клетками стромы в лимфатических узлах. DC, экспрессирующие достаточные уровни активированных CCR7, мигрируют в лимфатический узел в ответ на CCL19 или CCL212. Здесь они встречают Т-лимфоциты и могут инициировать иммунный ответ. Протоколы образования зрелых DC Описано множество протоколов образования зрелых DC. В настоящее время в наиболее часто применяемом "стандартном" протоколе для индукции DC используют смесь созревания, включающуюIL-1 бета, IL-6, TNF-альфа и простагландин E2. Несмотря на миграционную активность из-за CCR7 и иммуностимуляторную активность in vivo, DC, созревший с помощью этой смеси, образует DC с пониженной способностью продуцировать IL12 р 703. Вторая группа протоколов созревания DC включает полиинозиновую:полицитидиловую кислоту,поли-(I:C). Ее обычно применяют в комбинации с цитокинами, такими как TNF альфа, IL-1 бета,IFN-гамма и IFN-альфа. DC, образованная этим способом, продуцирует IL-12 р 70, но они обычно экспрессируют низкие уровни CCR7. Низкие уровни экспрессии CCR7, характеризующиеся получением DC в присутствии поли-(I:C), ограничивают их in vivo миграцию в лимфатические узлы. Недавно опубликованная заявка на патент США US 2005/0003533 A1 раскрыла способ созревания дендритных клеток, экспрессирующих CCR7, который впоследствии при стимуляции CD40L мог бы индуцировать продуцирование IL-12p70. Все еще существует необходимость развития стандартизированных способов для образования зрелых дендритных клеток, экспрессирующих высокие уровни активированных CCR7, и которые также продуцируют достаточное количество IL-12p70. К тому же, несмотря на попытки множества исследователей, вакцина на основе дендритных клеток-1 015266 для применения в терапии рака вообще обеспечила слабую клиническую эффективность иммунных ответов. Эти вакцины, главным образом, были получены ex vivo манипуляцией и введением антигена аутологических DC. Повышенные требования по отношению к безопасности пациента нуждаются в высоком уровне воспроизводимости и соответствия с нормативными требованиями. Таким образом, существует строгая необходимость в способах, которые получают должным образом обеспеченные DC, эффективно индуцирующие иммунные ответы и, в частности, обеспечивающие улучшенные клинические ответы. Кроме того, ex vivo образованные DC можно было бы также реализовать как терапевтическую вакцину в лечение некоторых хронических инфекционных болезней, таких как ВИЧ и гепатит B и C, где традиционный подход с вакциной не является эффективным. Результаты предклинических и первых клинических 4-5 исследований показали, что основанная на DC иммунотерапия могла бы быть перспективной стратегией для лечения пациентов с хроническими инфекциями ВИЧ-1 и гепатита B и C. Поскольку при раковой иммунотерапии эффективный клинический ответ против этих межклеточных инфекционных агентов связан с индукцией Th1 хелперного ответа, необходимого для развития CD8+ эффекторных клеток 5. Поэтому можно предположить, что ex vivo образованные дендритные клетки будут обладать одинаковыми характеристиками для лечения и рака, и хронических инфекционных болезней. Раскрытие данного изобретения В первом аспекте данное изобретение касается способа образования дендритных клеток путем применения температур ниже 37C во время развития клеток-предшественников в незрелые дендритные клетки. Во втором аспекте данное изобретение касается популяции дендритных клеток, где указанные клетки получили способом образования дендритных клеток путем применения температур ниже 37C во время развития клеток-предшественников в незрелые дендритные клетки. В третьем аспекте данное изобретение касается фармацевтической композиции, включающей популяцию дендритных клеток, где указанные клетки получили способом образования дендритных клеток путем применения температур ниже 37C во время развития клеток-предшественников в незрелые дендритные клетки. В четвертом аспекте данное изобретение касается применения популяции клеток, где указанные клетки получили способом образования дендритных клеток путем применения температур ниже 37C во время развития клеток-предшественников в незрелые дендритные клетки для стимуляции и/или экспансии T-клеток. В пятом аспекте данное изобретение касается применения популяции клеток, где указанные клетки получают способом образования дендритных клеток путем применения температур ниже 37C во время развития клеток-предшественников в незрелые дендритные клетки для индуцирования иммунного ответа у субъекта. В шестом аспекте данное изобретение касается применения популяции клеток, где указанные клетки получают способом образования дендритных клеток путем применения температур ниже 37C во время развития клеток-предшественников в незрелые дендритные клетки, для получения лекарственного средства для лечения или предупреждения рака или инфекционных болезней. Краткое описание графических материалов Данное изобретение представлено детально ниже со ссылкой на графические материалы, в которых фиг. 1 иллюстрирует эффект температуры на важные костимуляторные и вспомогательные поверхностные молекулы DC; фиг. 2 - эффект температуры на количество IL-10, продуцируемое DC в течение начальных дней культуры (A) и продуцируемое незрелыми DC (B) и зрелыми DC (C); фиг. 3 - эффект температур 31, 34 и 37C на продукцию IL-12p70 незрелыми (A) и зрелыми (B, C) дендритными клетками, образованными новым способом и стандартным способом; фиг. 4 - эффект низкой температуры на экспрессию CCR7; фиг. 5 - фенотип незрелых и зрелых DC, образованных способом по данному изобретению (A) и по сравнению со "стандартным" способом (B); фиг. 6 - фенотипическую стабильность зрелых DC со временем; фиг. 7 - фенотип и аллостимуляторную (MLR) активность DC на день 7 и день 10; фиг. 8 - аллостимуляторную активность DC, образованных способом по данному изобретению и(ферментативный иммуносорбентный анализ с применением электрофореза) анализ). Детальное описание данного изобретения Данное изобретение описано в деталях ниже. С целью объяснения необходимо применять следующие определения, и всякий раз, когда следует, выражения, применяемые в единственном числе, также следует использовать во множественном числе и наоборот."Этап дифференциации", как применяется здесь, означает этап, где клеткам предоставляется возможность дифференцироваться в ответ на определенные факторы дифференциации."Этап созревания", как применяется здесь, означает этап, где клеткам предоставляется возможность созревать в ответ на присутствие факторов созревания."Пониженная температура"' или "сниженная температура", как применяется здесь, означает, что температура ниже 37C. Способ образования дендритных клеток является хорошо известным способом J.H. Peters, который первым описал способность моноцитов трансформироваться в подобные DC клетки in vitro, сначала спонтанно, а позже в присутствие GM-CSF и IL-46. После публикаций Romani et al. (1994)7 и SallustoLanzavecchia (1994)8 моноциты, культивируемые в присутствие этих двух цитокинов, стали широко применять для получения DC. Методика начинается с выделения моноцитов из периферической крови и их культуры в присутствие GM-CSF и IL-4 в течение 5-7 дней. Полученные клетки обладают свойствами незрелых DC, характеризующихся низкими уровнями костимуляторных молекул и высокой эндоцитарной активностью. Во время созревания, индуцированого LPS, TNF-альфа или другими агентами созревания, клетки существенно активируют костимуляторные и вспомогательные молекулы, такие как, например, CD40, CD80, CD83 и CD86, и подавляют эндоцитарную активность.In vitro культуру тканей обычно держат при 37C. Известно, что клетки Лангерганса функционально активны при окружающей температуре кожи 29-31C, и немногочисленные исследования подтверждают биологический эффект in vitro пониженных температур культуры в клеточных системах, таких как, например, клетки яичника китайского хомячка (CHO) и альвеолярных макрофагов свиньи. В отличие от работы Basu et al. (2003) Int. Immunal., 15(9): 1053-61, исследующих эффект температур, подобных температурам при лихорадке, на DC активацию и созревание, пониженные температуры проанализированы только в немногих случаях по их эффекту на рост клеток млекопитающих. Dexter etal. (1977) предложили применение 33C для культивирования гематопоэтических стволовых клеток 9.Athanasas-Platsis et al. (1995) обнаружили, что экспрессия маркеров клеток Лангерганса CD1a на моноцитах активировали во время 24-часового культивирования при 34C по сравнению с 37C10. Никто не раскрыл, как получить незрелые или зрелые дендритные клетки применением пониженных температур. В одном варианте осуществления данное изобретение касается способа образования дендритных клеток применением температур ниже 37C во время развития клеток-предшественников в незрелые дендритные клетки.IL-10 является негативным регулятором DC развития и продуцируется во время активации линии моноцитных клеток в присутствие GM-CSF11. Kirkley et al. (2003) сообщили, что IL-10 продуцирование линией макрофаговых клеток, стимулированное LPS, было существенно снижено в ответ на уменьшение температуры инкубации от 37 до 31C12. Сниженная температура, включенная в способ данного изобретения, может, таким образом, обеспечить улучшенные условия для образования DC путем, например,низкой концентрации IL-10. Проанализировали эффект культивируемых моноцитов в присутствии GM-CSF и IL-4 при различных температурах (31, 34 и 37C) на уровень экспрессии CD1a незрелых DC, молекулы, чрезвычайно чувствительной к ингибиторному эффекту IL-10. Заявители обнаружили, что DC, образованная при более низких температурах, имела более высокие уровни своей экспрессии. Все дальнейшие эксперименты выполняли при 34C. Следующее принципиальное наблюдение заключалось в том, что IL-10 уровни,определяемые в супернатантах культур, были действительно существенно ниже, чем в культуре при более низкой температуре. В одном варианте осуществления данное изобретение касается способа, где образованные дендритные клетки являются зрелыми дендритными клетками. В одном варианте осуществления данное изобретение касается способа, где развитие клетокпредшественников и незрелых дендритных клеток включает дифференциацию указанных клеток. В одном варианте осуществления данное изобретение касается способа, где температура во время дифференциации ниже 37C. В одном варианте осуществления данное изобретение касается способа, где температура составляет от 31 до 37C. Температура может быть любой из температур 31, 32, 33, 34, 35 или 36C. В одном варианте осуществления данное изобретение касается способа, где температура составляет 34C. В одном варианте осуществления данное изобретение касается способа, где клетки-предшественники являются аутологическими клетками-предшественниками. В одном варианте осуществления данное изобретение касается способа, где клетки-предшественники выбирают из миелоидных клеток-предшественников или стволовых клеток. В одном варианте осуществления данное изобретение касается способа, где миелоидные клеткипредшественники являются моноцитами.-3 015266 В другом варианте осуществления данное изобретение касается популяции дендритных клеток, образованных способом по данному изобретению. В одном варианте осуществления данное изобретение касается популяция дендритных клеток, где указанные клетки экспрессируют CCR7 и/или IL-12 р 70. В одном варианте осуществления данное изобретение касается популяции дендритных клеток, где указанные клетки экспрессируют CD1a, CD14 низкий, CD83, CD86 и IL-10 низкий. В одном варианте осуществления данное изобретение касается популяции дендритных клеток, дополнительно включающей по меньшей мере один антиген, представленный в ассоциации с МНС молекулой на поверхности клетки. В одном варианте осуществления данное изобретение касается популяции дендритных клеток, где указанный по меньшей мере один антиген является опухолевым антигеном. В одном варианте осуществления данное изобретение касается популяции дендритных клеток, где указанный опухолевый антиген выбран из группы, включающей антиген рака яичка, антиген линиеспецифической дифференциации, опухолевый надэкспрессированный антиген, мутированный или аберрантно экспрессированный антиген и вирусный антиген. В дополнительном варианте осуществления данное изобретение касается применения популяции дендритных клеток, как определено выше, для стимуляции и/или экспансии T-клеток. В одном варианте осуществления данное изобретение касается применения популяции дендритных клеток для стимуляции или экспансии T-клеток, где указанные T-клетки являются аутологическимиT-клетками. В одном варианте осуществления данное изобретение касается применения популяции дендритных клеток для стимуляции или экспансии T-клеток, где указанное применение является in vitro применением. В еще одном варианте осуществления данное изобретение касается применения популяции дендритных клеток для индуцирования иммунного ответа у субъекта. В другом варианте осуществления данное изобретение касается фармацевтической композиции,включающей популяцию дендритных клеток, где указанная популяция определена выше. В одном варианте осуществления данное изобретение касается применения фармацевтической композиции как лекарственного средства. В одном варианте осуществления данное изобретение касается фармацевтической композиции,включающей популяцию дендритных клеток и дополнительно включающей традиционные вспомогательные агенты и наполнители. В альтернативном варианте осуществления данное изобретение касается применения дендритных клеток для получения лекарственного средства для лечения или предупреждения рака или инфекционных болезней. В одном варианте осуществления данное изобретение касается применения популяции дендритных клеток для получения лекарственного средства для лечения или предупреждения рака или инфекционных болезней, где указанный рак выбран из группы, включающей меланому, рак груди, рак толстой кишки и рак легкого, или может быть каким-либо видом рака. В одном варианте осуществления данное изобретение касается применения популяции дендритных клеток для получения лекарственного средства для лечения или предупреждения рака или инфекционных болезней, где инфекционные болезни выбраны из группы, включающей ВИЧ и гепатит или другие хронические инфекционные болезни. Примеры Данное изобретение теперь проиллюстрировано следующими примерами, которые не предназначены для ограничения каким-либо путем. Пример 1. Образование дендритных клеток при пониженной температуре. Дендритные клетки типично образуются из лейкоцитарной пленки, полученной из банка крови. 60 мл лейкоцитарной пленки разбавляют 60 мл фосфатным буфферезированным солевым раствором Дюльбекко без Ca и без Mg (DPBS, продукт No. BE17-512F, Cambrex, Belgium) и применяют для четырех 50-мл пробирок, каждая из которых содержит 15 мл Lymphoprep (продукт No. 1053980, AXIS-SHIELDPoC AS, Norway). После центрифугирования (460 г, 30 мин, 20C) 10-20 мл верхнего слоя плазмы переносят в отдельные пробирки. Рассчитали, что это составляет приблизительно 40% плазмы (разбавленной плазмы). Окончательное приготовление плазмы включает добавление гепарина (25 международных единиц/мл) и центрифугирование (1500 г, 15 мин, 4C). Одноядерные клетки собрали с раздела двух сред,дважды разбавили содержащим EDTA (этилендиаминтетрауксусная кислота) DPBS и промыли 4-5 центрифугированиями, сначала при 250 г, второй раз при 200 г, а затем при 150 г, все центрифугирование осуществляли при 4C 12 мин. Перед последним центрифугированием клетки подсчитали с помощью счетчика Coulter (Beckman Coulter, модель Z2), а количество моноцитов оценили как число клеток со средним размером около 9 мкм. Клетки можно хранить при -80C (в разбавленной плазме с 10% DMSO,107 моноцитов на сосуд) или использовать непосредственно в экспериментах.L-глутамина и 2% плазмы) при концентрации 2106 моноцитов/мл 5 мл клеточной суспензии поместили в Т 25 не-ТС-обработанные колбы Falcon. Через 1 ч адсорбции при 37C неадгерентные клетки удалили,адгерентные клетки дважды промыли теплым RPMI 1640 и в каждую колбу добавили 7 мл культуральной среды (RPMI 1640 дополненная 2 мМ L-глутамина и 1% плазмы). Колбы поместили в различные температуры: 31, 34 и 37C, в отдельные CO2-инкубаторы. Добавили факторы дифференциации GM-CSF и IL-4 при окончательных концентрациях 100 и 50 нг/мл соответственно в день 1, 3 и 5. Добавили TNF-альфа при окончательной концентрации 10 нг/мл в день 6 для индуцирования созревания и подняли температуру до 37C в течение последних 24 ч инкубации. В день 7 клетки собрали и определили их фенотип анализом FACS (рассеивание возбужденной флуоресценции сортированных клеток). Клетки окрасили с помощью прямых конъюгированных антителCD1a-фикоэритрина (РЕ), CD14-флуоресцина изотиоцианата (FITC), CD83-PE, CD86-PE, HLA-DR,-P,-QFITC (все от Pharmingen, Beckton Dickinson, Brondby, Denmark) и CCR7-FITC (RD Systems Europe,Abington, UK). Применяли контроли приемлемых изотипов. Образцы анализировали с помощью проточного питометра FACS Calibur (Beckton Dickinson) и программного обеспечения CTLLQuest (BecktonDickinson). Результат соответствующих экспериментов показан на фиг. 1. Меньше клеток, культивируемых при сниженных температурах, экспрессировали CD1a, по сравнению с клетками, культивируемыми при 37C,тогда как меньше CD83 и CD86 положительных клеток наблюдали для клеточных популяций, культивируемых при низких температурах. Средний индекс флуоресценции (MFI) для CD1a был в два раза выше в культуре при 31 и 34C по сравнению с 37C. Оцененная в процентах степень созревания DC, экспрессирующих CD83 и CD86, была ниже при 31-34C. Это отражает или более низкую чувствительность к факторам созревания клеток, культивируемых при сниженной температуре, или то, что для процесса их созревания необходима температура 37C. Пример 2. Эффект пониженной температуры на продуцирование IL-10. Продуцирование IL-10, который является отрицательным регулятором DC, изучали во время дифференциации моноцитов в дендритные клетки. Измеряли его концентрацию в культуральном супернатанте, взятом в дни 1, 3 и 5. Продуцирование IL-10 измеряли сэндвич-ELISA (твердофазный иммуноферментный анализ), что включает иммобилизованное антитело (Ab), стандарт или образец, биотинилированное определение Ab и HRP (пероксидаза хрена)-стрептавидин, с помощью набора "Ready-Set-Go" от eBioscience, главным образом, по рекомендациям изготовителя с некоторыми модификациями. После продолжавшегося в течение ночи связывания иммобилизованного Ab в 96-луночных планшетах Nuncmaxisorp и промывания этап блокирования продлили по меньшей мере на 3 ч при комнатной температуре. Стандартный график получили по семи серийным разведениям стандарта, начиная с 200 пг/мл IL-10. Стандарты и образцы инкубировали при комнатной температуре на протяжении 2 ч с последующей инкубацией при 4C на протяжении ночи. Следующие этапы выполняли по протоколу производителя. Раствор тетраметилбензидинового субстрата из того же набора использовали в ферментной реакции HRP, а после завершения реакции измеряли оптическую плотность с поправкой на длину волны как разницу между считываниями при 490 и 620 нм. Результаты одного из таких экспериментов представлены на фиг. 2A. Спонтанное продуцирование IL-10 моноцитами было низким в течение первого дня и существенно активировалось после добавления GM-CSF и IL-4 в день 1. Клетки, культивируемые при 34C до дня 5, продуцировали, в общем, существенно более низкие количества IL-10 по сравнению с клетками,культивируемыми при 37C. Анализ нескольких культур DC в день 5 показал похожий график (фиг. 2B). Сниженное продуцирование IL-10 при 34C по сравнению с 37C продолжалось даже после промывания клеток в день 5, при помещении их при 37C, добавлении агента созревания в день 6 и сбора супернатантов в день 8 (фиг. 2C). Эти результаты показывают, что клетки, культивируемые при температурах ниже 37C, приобретают стабильный фенотип низкого продуцирования IL-10. Пример 3. Эффект пониженной температуры на продуцирование IL-12 р 70. Заявитель также исследовал эффект температуры на продуцирование IL-12 р 70. ПродуцированиеIL-12p70 измерили с помощью сэндвич-ELISA, что включает иммобилизованное Ab, стандарт или образец, биотинилированное определение Ab и HRP-стрептавидин. Набор "DuoSet ELISA developmentSystem" для IL-12p70 (RD Systems) использовали главным образом по рекомендациям изготовителя с некоторыми модификациями. После продолжавшегося в течение ночи связывания иммобилизованногоAb в 96-луночных планшетах Nunc maxisorp и промывания этап блокирования продлили по меньшей мере на 3 ч при комнатной температуре. Стандартный график получили по семи серийным разведениям стандарта, начиная с 500 пг/мл IL-12p70. Стандарты и образцы инкубировали при комнатной температуре на протяжении 2 ч с последующей инкубацией при 4C на протяжении ночи. Следующие этапы выполняли по протоколу производителя. Смесь перекиси водорода с тетраметилбензидином использовали как раствор субстрата для HRP, а после окончания ферментной реакции измеряли оптическую плотность с поправкой на длину волны как разницу между считываниями при 490 и 620 нм.-5 015266 Таблица 1 Эффект температуры в течение первых 5 дней культуры на продуцирование IL-12p70 во время созревания, индуцированного имитацией МСМ Как можно видеть (табл. 1), клетки, полученные при 34C, продуцируют существенно более высокие уровни IL-12p70. Пример 4. Выбор пластиковой емкости культуры тканей. Сравнили два типа пластиковых емкостей культуры тканей: полистирол нетканевой культуры (PS)(продукт No. 353813, Т 25 BD-Bioscience, USA) и пластиковую емкость Primaria (продукт No. 353813,Т 25 BD-Bioscience, USA). Эксперимент установил подобие в методике, описанной в примере 1, использующей пластиковые поверхности, предварительно обработанные за 15-45 мин 2% аутологической плазмой в качестве источника компонентов, таких как, например, межклеточные компоненты, подобные фибриногену и фибронектину, в безсывороточной среде AIM-V при 34C до дня 5, после чего культуры выдерживали при 37C. Агенты созревания: TNF альфа, IL-1 бета, IL-6 и простагландин E2, добавили в день 6, а культуры собрали в день 8. Клетки-предшественники имеют в зависимости от условия выращивания возможность развиваться в макрофаги или DC. Через несколько дней в культивируемых клетках, предназначенных для развития в макрофаги, будут формироваться культуры адгерентных клеток, тогда как клетки, предназначенные для развития в DC, будут формировать культуры более свободно прикрепленных клеток. Сначала равное число клеток было высеяно и прикреплено к различным пластиковым емкостям культур ткани. Проверка культур DC со дня 6 световой микроскопией показала существенно меньшее число адгерентных клеток в пластиковой емкости Primaria по сравнению с клетками, растущими на другом типе пластика. В общем, культуры, растущие в пластиковой емкости Primaria, также оказались более "чистыми", т.е. имели меньше продуктов разрушения, отражая меньшую степень смерти клеток во время созревания. Проанализировали применение различной концентрации плазмы для предварительной обработки пластиковой емкости. Незначительные отличия в свойствах DC наблюдали при обработке пластиковой емкости Primaria 2, 10, 20 или 40% плазмой (данные не показаны). Однако отметили, что количество загрязняющих лимфоцитов снижалось с повышением концентрации плазмы до 10%. Поэтому включили этап обработки пластиковой емкости Primaria 10% плазмой в способе, описанном в эксперименте 1, в следующие эксперименты. В следующих экспериментах сравнили способ данного изобретения со "стандартным способом",который выполняли, как описано ниже, если не определено иное. Дендритные клетки типично образовывались из лейкоцитарной пленки, полученной из банка крови. 60 мл лейкоцитарной пленки растворили 60-мл безкальциевом и безмагниевом фосфатном буфферезированном солевом растворе Дюльбекко (DPBS, продукт No. BE17-512F, Cambrex, Belgium) и поместили в четыре 50-мл пробирки, каждая из которых содержала 15 мл Lymphoprep (продукт No. 1053980, AXISSHIELD PoC AS, Norway). После центрифугирования (460 г, 30 мин, 20C) 10-20 мл верхнего слоя плазмы перенесли в отдельные пробирки. Одноядерные клетки собрали с границы разделения, разбавили в два раза PBS EDTA без кальция и магния и промыли с помощью трех центрифугирований, первое при 250 г, второе при 175 г, а последнее при 110 г, все центрифугирование выполняли при 4C 12 мин. Перед последним центрифугированием клетки подсчитали с помощью счетчика Coulter (Beckman Coulter, модель Z2), а количество моноцитов определили как число клеток со средним размером около 9 мкм. Клетки ресуспендировали в адсорбционной среде (RPMI 1640 (Cambrex), дополненной 2 мМL-глутамина и 1% инактивированной нагреванием аутологической плазмы) при концентрации 2106 моноцитов/мл. 5 мл клеточной суспензии поместили в T25 необработанные колбы Primaria. Через 1 ч адсорбции при 37C неадгерентные клетки удалили, а в каждую колбу добавили 5 мл среды культивирования (RPMI 1640, дополненной 2 мМ L-глутамина и 1% плазмы). В день 1 среду заменили свежей средой. В день 3 добавили 2 мл среды. В день 5 все неадгерентные клетки собрали и поместили в T25 колбах Primaria со свежей средой.-6 015266 Колбы поместили при 37C в CO2-инкубатор. Факторы дифференциации GM-CSF и IL-4 при окончательных концентрациях 100 и 50 нг/мл соответственно добавили в день 1, 3 и 5.TNF- или смесь цитокина (IL-1, IL-6, TNF- и PGE-2) добавили в день 6 для индуцирования созревания. В день 7 клетки собрали, а их фенотип определили анализом FACS. Пример 5. Продуцирование IL-12p70 фиг. 3 иллюстрирует измерение продуцирования IL-12p70 за два дня (день 7 и 8). Показали, что дендритные клетки, образованные новым способом, продуцируют существенно более высокие количества IL-12p70, чем дендритные клетки, образованные стандартным способом. Пример 6. Экспрессия CCR7. Для изучения эффекта низкой температуры на экспрессию CCR7 применили смесь созревания,включающую IL-1 бета, IL-6, TNF-альфа и простагландин E2, вместо использования только TNF-альфа. Результат экспериментов, представленный на фиг. 1 В, является сравнением трех различных температур с новым способом и стандартным способом. Можно увидеть, что экспрессия CCR7 более высокая при новом способе по сравнению со стандартным способом. Также проанализировали функциональную экспрессию CCR7 рецептора дендритной клеткой, образованной новым способом в стандартном анализе миграции (Chemotx Disposable Chemotaxis System (Модель 116-5) от Neuro Probe, Gaithersburg, MD, USA). Наблюдали миграцию дендритных клеток по направлению к хемокинам CCL19 с DC, образованными новым способом (данные не показаны), подтверждая экспрессию функционального CCR7 рецептора. Пример 7. Выход клеток. Описанный здесь новый способ также показал повышение выхода клеток по сравнению со стандартным способом. В трех различных повторностях выявили более высокий выход клеток при всех анализированных температурах (31, 34 и 37C) по новому способу в сравнении со стандартным способом. См. табл. 2. Таблица 2 Пример 8. Вариации маркеров от пробы к пробе DC, образованных способом по данному изобретению. В соответствии с требованиями GMP для продуцирования дендритных клеток в медицинских целях должны наблюдаться низкие вариации от пробы к пробе в свойствах дендритных клеток. С этой целью выполняли получение дендритных клеток из крови 8 различных доноров в течение трехнедельного периода, используя те же серии всех используемых реагентов и 0,5% аутологической плазмы в качестве дополнения к среде AIM-V. Для сравнения выполняли продуцирование DC с помощью "стандартного" способа (37C). Эксперименты выполняли на размороженных РВМС (мононуклеары периферической крови). В табл. 3 приведены свойства DC, образованных в этих экспериментах. В отличие от высокой вариабельности в свойствах DC, образованных "стандартным" способом, наблюдается очень низкая степень вариабельности в свойствах DC, полученных новым способом.-7 015266 Таблица 3 Различные маркеры, экспрессированные в процентной доле дендритных клеток,образованных или стандартным способом, или новым способомS: стандартный способ, N: способ по данному изобретению, ND: не определяли, X: среднее значение. В заключение, фиг. 4A представляет фенотипы незрелых (день 5) и зрелых (день 8) дендритных клеток, образованных новым способом. Также измеряли экспрессию CD80, маннозного рецептора (MR) и двух маркеров клеток Лангерганса - CD207 (лангерин) и E-кадгерина. Как видно, клетки, образованные способом по данному изобретению, не являются клетками Лангерганса. Фиг. 4B представляет фенотип незрелых (день 5) и зрелых (день 8) дендритных клеток, образованных новым способом и стандартным способом. Окрасили клетки для экспрессии стандартных DC маркеров. Незрелые клетки (день 5) показывают более чистую CD1a популяцию. Зрелая популяция (день 8) показывает высокую и однородную HLA D, CD83 и CD86 экспрессию в клетках, образованных новым способом, по сравнению со стандартным способом. Также экспрессия CCR7 однородная при новом способе. Пример 9. Стабильность дендритных клеток, образованных новым способом. После инфекции в организме дендритные клетки должны мигрировать и достигать лимфатического узла для того, чтобы стимулировать T-клетки. Поэтому очень важно, что DC поддерживают свой фенотип несколько дней. Общий путь выполнение анализа стабильности заключается в сборе клеток в день 8, промывании цитокинов и продолжительном культивировании клеток в отсутствии стимуляторных цитокинов. Выполняли этот вид экспериментов путем культивирования клеток без цитокинов в течение двух дней. Фиг. 5 представляет результаты FACS анализа DC, собранных в день 8 и после дополнительных двух дней культуры. Ясно, что экспрессия измеренных параметров: CD1a, CD14, CD83, HLA-D и CCR7, остается в большей степени неизменной, и, таким образом, фенотип остается стабильным. В подобном эксперименте без промывания цитокинов в день 8 проанализировали и фенотип, и аллостимуляторную активность дендритных клеток в день 7 или день 10. Фиг. 6A и 6B показывают фенотип и аллостимуляторную активность соответственно. Результаты показывают, что аллостимуляторный эффект остается все еще высоким после 10 дней культуры и фенотипический профиль в день 10 напоминает профиль, измеренный в день 7, подтверждая высокую стабильность образованных дендритных клеток. Пример 10. Аллостимуляция дендритными клетками, образованными новым способом. Сравнили аллостимуляторные способности DC, полученных "стандартным" способом и способом по данному изобретению. Клетки культивировали в среде RPMI 1640 с 5% AB человеческой сыворотки. Клеткиреспондеры являлись одноядерными клетками, полученными от здоровых доноров разделением по градиенту плотности лейкоцитарной пленки периферической крови. Клетки-стимуляторы представляли собой облученные зрелые дендритные клетки, полученные после 2-дневного воздействия смесью цитокинов для созревания, как описано в примере 4. Клетки-стимуляторы, 0,1106 клеток в 100 мкл, смешали с титрованными количествами клеток-стимуляторов (в 100 мкл), как показано на фиг. 7, и культивировали 5 дней в U-донных 96-луночных микротитровальных планшетах. В течение последних 18 ч добавили 3H-тимидин (0,1 мкКюри/мл). Впоследствии, клетки собрали для подсчета сцинтилляции. Данные выразили как средние значения числа импульсов в минуту четырех реплицированных культур. Критерий Уилкоксона применили для оценивания различий между двумя способами, применяемыми для образования DC. Как видно, дендритные клетки, полученные способом по данному изобретению, имеют аллостимуляторную активность в 3-10 раз выше. Пример 11. Представление антигена дендритными клетками, полученными новым способом. Для объяснения потенциала DC по представлению антигена T-клеткам, проводили INF ELISPOT анализ с T-клетками, стимулированными DC, оголенными или сенсибилизированными CMV (цитомега-8 015266 ловирус) пептидом. Анализ INF ELISPOT выбрали, поскольку он обеспечивает четкий результат на отдельном клеточном уровне и поскольку T-клетки после столкновения с антигеном, представленным АРС,высвобождают INF. Данную вирусную модель выбрали, поскольку используемый CMV пептид рестриктирован по HLA-A2, а донорный материал, как известно, был HLA-A2 положительным, и 80% популяции обладало ответом CMV. Фиг. 8 представляет результаты анализа ELISPOT, показывающие, что существует сильный ответ от T-клеток, стимулированных DC, введенными с CMV пептидом, показывая,что эти DC способны представлять антиген T-клеткам. Ссылки. 1. Heufler, C., Koch, F., Stanzl, U., Topar, G., Wysocka, M., Trinchieri, G., Enk, A., Steinman, R.M., Romani, N., and Schuler, G. Interleukin-12 is produced by dendritic cells and mediates T helper 1 development assecretion by RAW 264.7 cells, Scand. J. Immunol., 58: 51-58, 2003. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения зрелых дендритных клеток для индуцирования иммунного ответа, экспрессирующих на своей поверхности CD1a, CD14 низкий, CD83, CD86, IL-10 низкий, CCR7 и IL-12p70 и имеющих стабильный фенотип низкого продуцирования IL-10, при котором клетки-предшественники и незрелые дендритные клетки культивируют в присутствии факторов созревания и дифференцировки, таких какGM-CSF, IL-4 и TNF-, при температуре от 31 до 37C. 2. Способ по п.1, где температура составляет 34C. 3. Способ по любому из пп.1, 2, где клетки-предшественники являются аутологическими клеткамипредшественниками. 4. Способ по любому из пп.1-3, где клетки-предшественники выбирают из миелоидных клетокпредшественников или стволовых клеток. 5. Способ по п.4, где миелоидные клетки-предшественники являются моноцитами. 6. Популяция дендритных клеток, получаемых способом по любому из пп.1-5, где указанные клетки экспрессируют CD1a, CD14 низкий, CD83, CD86, IL-10 низкий, CCR7 и IL-12p70 и где указанные клетки имеют стабильный фенотип низкого продуцирования IL-10. 7. Применение популяции клеток по п.6 для стимуляции и/или экспансии Т-клеток. 8. Применение по п.7, где указанные T-клетки являются аутологическими Т-клетками. 9. Применение по пп.7, 8, которое осуществляют in vitro. 10. Применение популяции клеток по п.6 для индуцирования иммунного ответа у субъекта. 11. Фармацевтическая композиция для индуцирования иммунного ответа, включающая популяцию дендритных клеток по п.6. 12. Фармацевтическая композиция по п.11 для индуцирования иммунного ответа против злокачественных образований и инфекционных болезней.-9 015266 А: Эффект температуры на экспрессию DC маркеров Фиг. 1 Эффект температуры на IL-10 продуцирование незрелыми и зрелыми DC Фиг. 3 Экспрессия CCR7 зрелыми DC, образованными при различных температурах- 11015266 Сравнение фенотипа незрелых и зрелых DC, образованных новым способом Фиг. 5A Сравнение между DC, образованными по новому способу, и DC, образованными по стандартному способу Фиг. 7 Аллореактивность дендритных клеток, образованных или "стандартным способом" (старым), или способом данного изобретения (новым)
МПК / Метки
МПК: A61P 31/12, A61K 39/00, A61P 35/00, C12N 5/00
Метки: зрелых, способ, применение, ответа, индуцирования, получения, клеток, иммунного, дендритных, полученных
Код ссылки
<a href="https://eas.patents.su/15-15266-sposob-polucheniya-zrelyh-dendritnyh-kletok-dlya-inducirovaniya-immunnogo-otveta-i-primenenie-poluchennyh-kletok.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения зрелых дендритных клеток для индуцирования иммунного ответа и применение полученных клеток</a>
Предыдущий патент: Комплексное хлорсодержащее удобрение с модифицирующими добавками для хмеля и способ его внесения
Следующий патент: Совместные кристаллы пирролидинонов
Случайный патент: Сульфонилпроизводные в качестве новых ингибиторов гистон-деацетилазы