Способ получения интерферона-бета
Номер патента: 13263
Опубликовано: 30.04.2010
Авторы: Сарасват Вибхор, Чудасама Дхармедра, Мендиратта Санджеев К.
Формула / Реферат
1. Способ получения интерферона-бета (IFN-b) в клетке-хозяине Escherichia coli, включающий:
a) обеспечение клетки-хозяина E.coli, которая способна продуцировать указанный белок; и
b) культивирование клетки в условиях, эффективных для индукции продукции указанного белка в среде, включающей комплексный источник азота, выбранный из группы, содержащей ферментативный гидролизат желатина, ферментативный гидролизат казеина и триптон или их комбинации, такие как ферментативный гидролизат желатина и ферментативный гидролизат казеина, или ферментативный гидролизат желатина и триптон, или ферментативный гидролизат казеина и триптон, или ферментативный гидролизат желатина, ферментативный гидролизат казеина и триптон, или любые из указанных отдельных источников азота или из указанных комбинаций в сочетании с дрожжевым экстрактом, где способ осуществляется при рН примерно от 6,5 до 7,0 и при температуре примерно 37°С, причем культуральная среда включает тиамин в концентрации по меньшей мере от 3 до 12 г/л.
2. Способ по п.1, где концентрация комплексного источника азота составляет от примерно 10 до примерно 30 г/л.
3. Способ по п.1 или 2, где комплексный источник азота представляет собой ферментативный гидролизат желатина.
4. Способ по любому из пп.1 или 2, где комплексный источник азота представляет собой триптон.
5. Способ по любому из пп.1 или 2, где комплексный источник азота представляет собой ферментативный гидролизат казеина.
6. Способ по любому из предыдущих пунктов, где концентрация тиамина в культуральной среде составляет предпочтительно 7 г/л.
7. Способ по любому из предыдущих пунктов, где среда дополнительно включает источник углерода, выбранный из группы, содержащей глюкозу, фруктозу, мальтозу, глицерин, галактозу и их комбинации.
8. Способ по любому из предыдущих пунктов, где источник углерода выбран из глюкозы или глицерина.
9. Способ по любому из предыдущих пунктов, где среда включает катионы натрия в концентрации примерно 50-100 мМ.
10. Способ по любому из предыдущих пунктов, где IFN-b имеет аминокислотную последовательность SEQ ID NO: 1.
11. Способ по любому из предыдущих пунктов, где уровень экспрессии IFN-b на конечной стадии осуществления способа составляет по меньшей мере 15% от общего белка.
12. Композиция для получения IFN-b в клетке-хозяине E.coli, включающая:
a) клетку-хозяин E.coli, способную продуцировать указанный белок;
b) культуральную среду, содержащую комплексный источник азота, выбранный из группы, включающей ферментативный гидролизат желатина, ферментативный гидролизат казеина и триптон или их комбинации, такие как ферментативный гидролизат желатина и ферментативный гидролизат казеина, или ферментативный гидролизат желатина и триптон, или ферментативный гидролизат желатина, ферментативный гидролизат казеина и триптон, или любые из указанных отдельных источников азота или из указанных комбинаций, в сочетании с дрожжевым экстрактом; источник углерода, выбранный из группы, включающей глюкозу и глицерин, тиамин, в концентрации по меньшей мере от 3 до 12 г/л и катионы натрия в концентрации от 60 до 80 мМ.
Текст
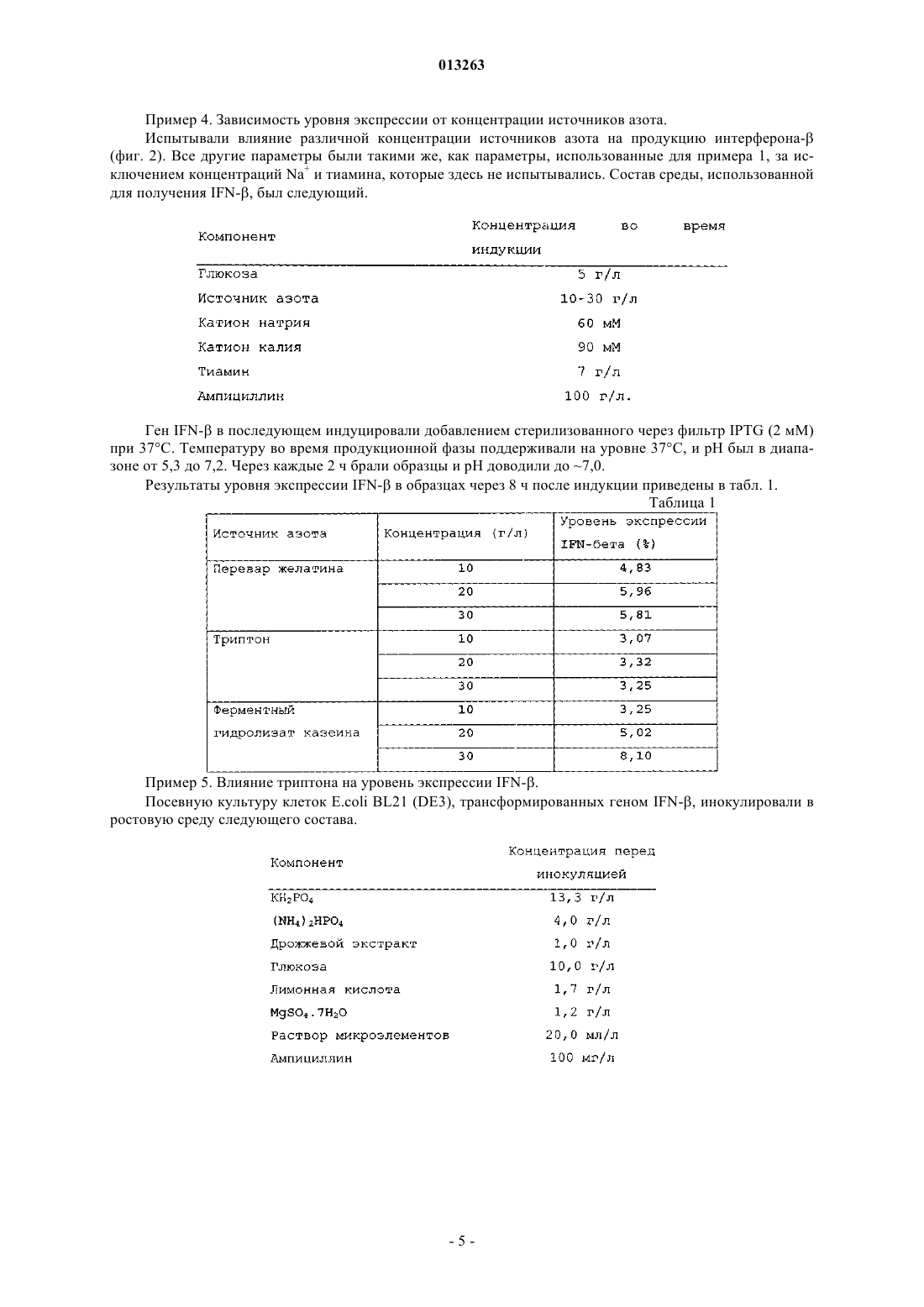
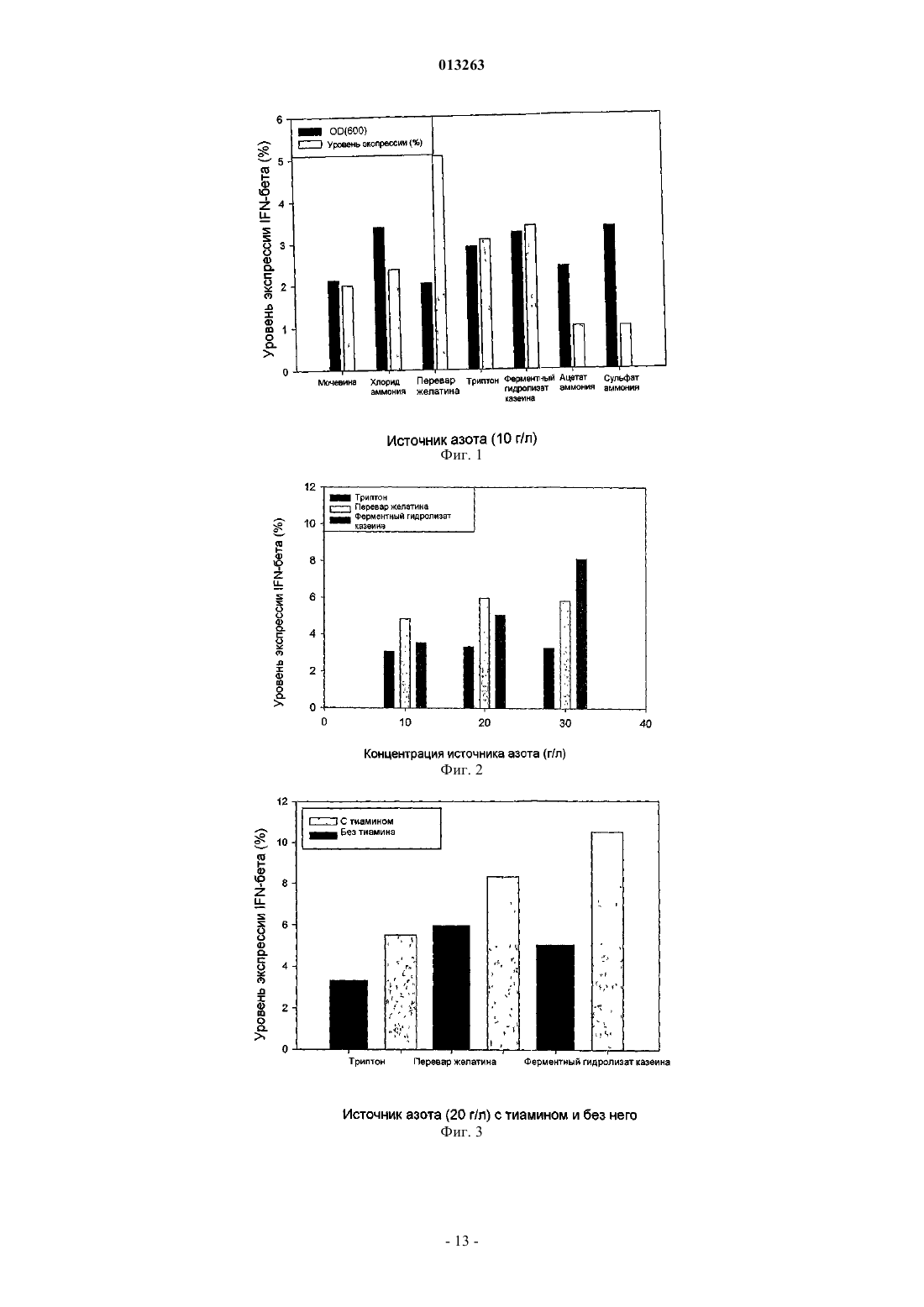
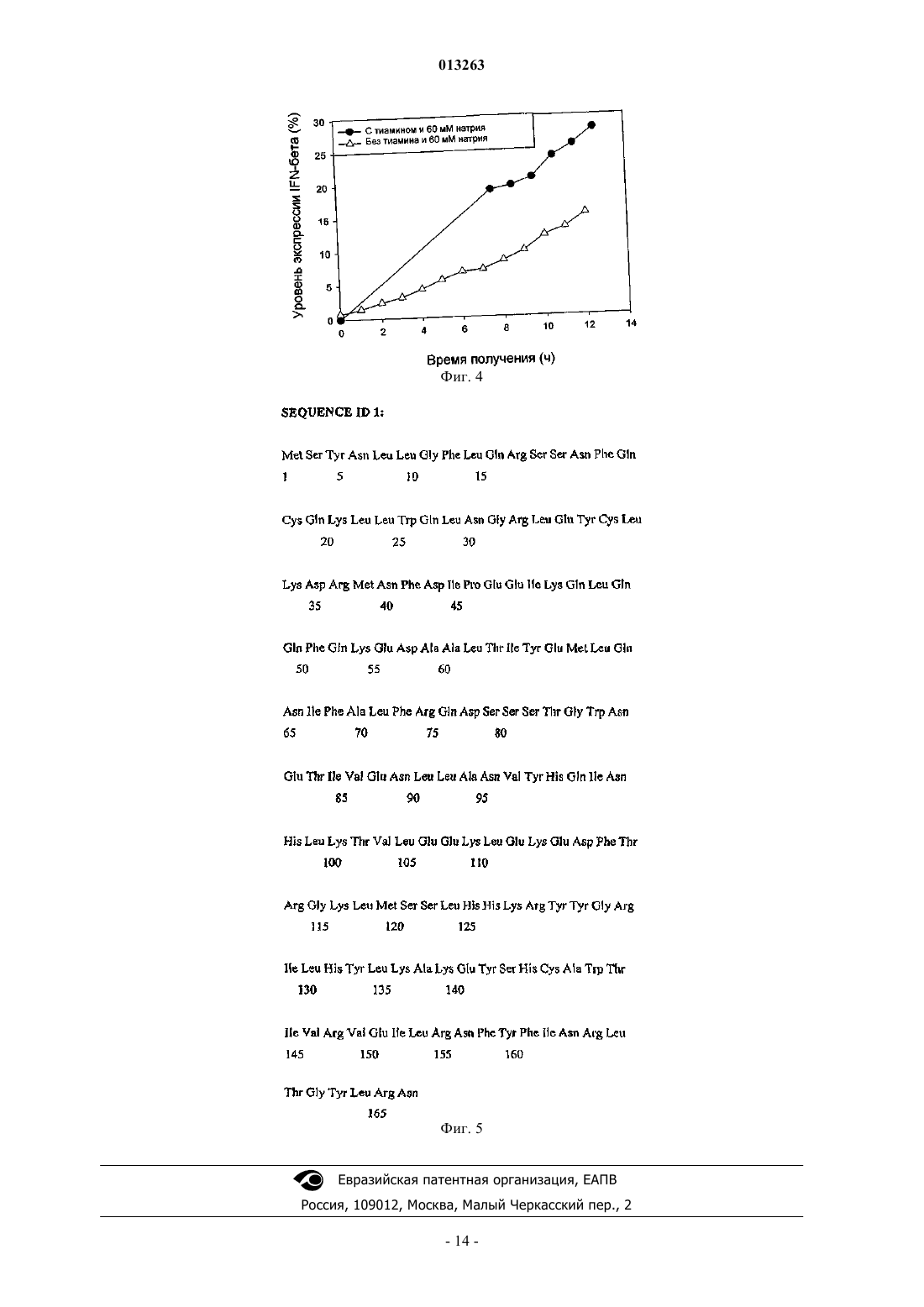
013263 Область, к которой относится изобретение Настоящее изобретение относится к новому способу получения интерферона-бета с улучшенным выходом ферментации. Описание предшествующего уровня техники У людей были идентифицированы 3 основных типа интерферонов: альфа-, бета- и гаммаинтерфероны. Они продуцируются разнообразными клетками после воздействия вирусов, митогенов,полинуклеотидов и т.д. Они обладают противовирусными, антипролиферативными и иммуномодулирующими свойствами. IFN- используется в качестве эффективного лечения по поводу рассеянного склероза [Corboy J.R. et al., Current Treatment Options in Neurology, 5, 35-54 (2003)], гепатита В и гепатита С. Бетасерон, аналог человеческого IFN-, где серин методами генной инженерии был замещен цистеином в положении 17, известен как IFN-1b (патент США 4588585). Молекула представляет собой небольшой полипептид из 165 аминокислот с одной дисульфидной связью и продуцируется в виде не гликозилированного белка. Гликозилированный вариант IFN-, известный как IFN-1a, имеет углеводородную цепь в положении 80 и экспрессирован в клетках яичников китайских хомячков (СНО) [ConradtIFN- первоначально получали индукцией лейкоцитов обработкой их вирусами. Но терапевтическое применение интерферона-, полученного таким образом, сомнительно ввиду высокой вероятности присутствия в таких препаратах различных загрязняющих материалов (например, вирусов). Рекомбинантная технология сделала возможным получение IFN-, который лишен вирусного загрязнения. Нативный IFN- представляет собой гликопротеид, и о его получении в клетках млекопитающих, насекомых и дрожжей было сообщено соответственно в публикациях Mantei et al., Nature 297: 128 (1982); Ohnoet al., Nucl Acid. Res. 10: 967 (1982); и Smith et al., Mol. Cell. Biol. 3: 2156 (1983). В патенте США 5795779 (McCormick et al.) раскрыто крупномасштабное получение IFN- из рекомбинантных клеток СНО. В патенте США 5554513 (Revel et al.) раскрыты 2 подтипа IFN- и описаны способы получения его в клетках СНО. Но все промышленные способы культивирования клеток животных связаны с техническими трудностями, подобными более длительному времени осуществления способа, потребности в поддержании жестких условий культивирования, высокой стоимости культуральных сред и т.д. Также было показано, что гликозилирование не играет роли в биологической активности белкаD. Fahey, J. Interferon Res. 2 (3), 421 (1982)], ввиду этого снижая преимущество проведения получения у обычно используемого хозяина, E.coli. Этой технологией были получены различные рекомбинантные белки у E.coli [Saraswat et al. FEMS Microbiology Lett., 179, 367-73 (1999); HolowachukRuhoff, ProteinBiotechnol. 11, 45-81 (1995)]. IFN- был клонирован и экспрессирован в E.coli (Taniguchi, et al., Gene 10,11-15 (1980). В ЕР 0048970 (Goeddel et al.) описана микробная продукция интерферона зрелых человеческих фибробластов. Как и для любого терапевтического белка, желательно получать высокие уровни интерферона- в коммерческих целях. В ЕР 0036776 (Kield et al.) раскрыты новые векторы на основе системы промотера-оператора триптофана для эффективного получения гетерологичного белка в бактериях. В патенте США 4686191 (Itoh et al.) раскрыты способы получения эффективной экспрессии интерферона- в E.coli путем использования улучшенных векторов с промотером trp для увеличения эффективности синтеза белка. В патенте США 4499188 (Konrad et al.) раскрыто решение проблемы мониторинга уровней репрессора во время культивирования, когда промотор trp используется для получения интерферона-. Mizukami et al. в патенте США 4746608 предлагают способ культивирования рекомбинантного микроорганизма при температуре на 10-25 С ниже, чем оптимальная температура роста, для получения высокого выхода интерферона-. Ben-Bassat et al. в патенте США 4656132 раскрывают решение проблемы более низких выходов интерферона- добавлением эффективного количества растворимого в воде алканола с 1-4 атомами углерода и/или смеси аминокислот, которая поддерживает бактериальный рост во время поздней фазы культивирования. Cousens et al. в патенте США 5866362 предложили получение интерферона- в виде белковых агрегатов выращиванием клеток-хозяев в среде, включающей эффективное количество Cu, так, что они образуют тельца включений в клетке-хозяине, из которой выделяется и очищается белок. Но ни один из способов не мог достичь удовлетворительных уровней интерферона-. Ввиду гидрофобной природы интерферона- синтезированный белок препятствует клеточному росту и, таким образом, получение интерферона- на значимо высоких уровнях не достигается.Dorin et al. в патенте США 5814485 раскрывают определенные условия, которые увеличивают экспрессию гидрофобного полипептида, подобного интерферону-, в трансформированных клеткаххозяевах Решающими условиями изобретения (патент США 5814485) являются концентрация ионов калия не более чем 120 мМ, и/или концентрация ионов натрия не более чем 40 мМ, и/или рН от 4,8 до 6,8 во время индукции продукции белка. Настоящее изобретение раскрывает уровень продукции интерферона-, аналогичный более высокому уровню продукции интерферона-, раскрытый в патенте США 5814485, индукцией продукции белка в условиях, которые зависят от поддержания низких уровней концентраций ионов калия и натрия в продуктивной среде. Это достигается тщательным выбором источника азота и других питательных веществ/добавок перед фазой продукции или во время нее. Краткое описание сущности изобретения В одном аспекте настоящее изобретение предоставляет способ получения рекомбинантного интерферона- в больших количествах, используя селективные условия культивирования. В другом аспекте настоящее изобретение предоставляет высокие уровни интерферона- при уровнях концентрации ионов K+ и Na+, которые выше, чем уровни, рекомендовавшиеся в предшествующем уровне техники, тщательным выбором источника азота и других питательных веществ в продукционной и/или в предпродукционной среде. В одном из своих аспектов настоящее изобретение предоставляет высокие уровни интерферонапри рН, более высоком, чем рекомендовано в предшествующем уровне техники, для получения высокого выхода интерферона-. В еще одном аспекте настоящее изобретение получает значимо высокие уровни IFN- с использованием способа ферментации, при котором условия культивирования более эффективны по затратам, чем способы предшествующего уровня техники. Краткое описание чертежей На фиг. 1 показан эффект различных источников азота на уровень экспрессии IFN-. Эксперименты проводили во встряхиваемых колбах, где серые столбики указывают на уровни экспрессии, полученные комплексными и неорганическими источниками азота, а именно ацетатом аммония, хлоридом аммония,сульфатом аммония, ферментным гидролизатом казеина, переваром желатина, триптоном и мочевиной(10 г/л во время добавления индуктора), а черные столбики указывают на оптическую плотность (при 600 нм) в соответствующей точке времени. Все величины получены из образцов через 8 ч после индукции. На фиг. 2 показан эффект различных концентраций выбранных источников азота на уровень экспрессии IFN-. Эксперименты проводили во встряхиваемых колбах, где уровни экспрессии показаны при различных концентрациях (10, 20 и 30 г/л, во время добавления IPTG (изопропилтиогалактозида комплексных источников азота: ферментного гидролизата казеина (темно-серые столбики), перевара желатина (светло-серые столбики) и триптона (черные столбики). На фиг. 3 показан эффект тиамина с различными источниками азота и калия на уровень экспрессииIFN-. Эксперименты проводили во встряхиваемых колбах, где сравнение уровня экспрессии показано между триптоном, переваром желатина и ферментным гидролизатом казеина с тиамином (серые столбики) и без тиамина (черные столбики) (6-7 г/л во время добавления индуктора). На фиг. 4 показан эффект комбинации триптона с тиамином и высокой концентрации катиона натрия на уровень экспрессии IFN-. Эксперименты проводили в ферментерах, где сравнение уровней экспрессии было показано между культуральной средой, включающей тиамин и высокий уровень катиона натрия (60 мМ) , и культуральной средой без тиамина и высоким уровнем катиона натрия . На фиг. 5 показана аминокислотная последовательность IFN- (SEQ ID NO: 1). Описание изобретения Настоящее изобретение относится к новому способу ферментации для получения интерферонапри высоких уровнях экспрессии. Были изучены различные условия культивирования для высокого уровня продукции белка интерферона- с использованием трансформированных Escherichia coli, ведущие к альтернативному, высокоэффективному способу получения. Настоящее изобретение раскрывает условия культивирования для повышенного выхода продукта. Настоящее изобретение описано в деталях ниже. Можно использовать любой полипептид интерферона- (также именуемый здесь IFN-). Термин интерферон- и IFN- относится к нативному IFN-, его мутеинам, фрагментам, гибридам, аналогам и производным, проявляющим биологическую активность или активность связывания с рецепторами,составляющую по меньшей мере 60% нативного IFN-, или сохраняющим по меньшей мере 80% идентичность аминокислот с SEQ ID NO: 1 (аминокислотной последовательностью человеческого IFN-). Ген IFN-, используемый в настоящем изобретении, представляет собой мутированную форму нативного гена, где 17-я аминокислота, серин, была замещена на цистеин методами генной инженерии в соответствии с патентом США 4588585. Этот мутированный аналог человеческого IFN- известен какIFN-1b. Источник гена нативного IFN-, используемого в настоящем изобретении, представляет собой линию клеток легочных фибробластов человека, MRC 5, от NCCS, Pune, India. Описанная выше мутация была внесена в этот ген с использованием стандартных методик молекулярной биологии, описанных в предшествующем уровне техники. Подходящие клетки-хозяева, предпочтительно Escherichia coli, трансформируются подходящим вектором экспрессии, включающим кодирующую последовательность IFN- и подходящий промотор,выбранный из t7, tac и аналогичных промоторов, наряду с другими компонентами вектора, используя методики трансформации, хорошо известные в данной области. Штамм Escherichia coli для настоящего изобретения выбран из группы, включающей Escherichia coli BL21 (DE3) и ее производные. Предпочтительно клетка-хозяин представляет собой Escherichia coli BL21 (DE3), которая депонирована в ATCC под номером ATCC 47092. Источник Escherichia coli BL21 (DE3), используемого в настоящем изобретении,является Stratagene, USA. Трансформированные клетки-хозяева первоначально культивировали в условиях для роста при циклической ферментации. Культуральные среды, используемые в способе по настоящему изобретению,включают источники углерода и энергии, выбранные из группы, включающей глюкозу, глицерин, фруктозу, мальтозу, галактозу и им подобные или их смеси, источник азота, выбранный из группы, состоящей из дрожжевого экстракта, триптона, пепетона, ферментного гидролизата казеина, гидролизата казеина соевых бобов, желатина и им подобных, подходящие соли/питательные вещества, выбранные из группы,состоящей из лимонной кислоты, хлорида калия, хлорида натрия, сульфата магния, диаммонийгидрофосфата, дигидрофосфата калия, бутирата натрия, тиамина, глицина и хлорида цинка. рН поддерживается на уровне примерно 5-8. Температура поддерживается на уровне примерно 30-40 С. Другие условия ферментации, подобные аэрации и перемешиванию, инокуляции, времени инокуляции и т.д., выбираются как обычно специалистом в данной области. Ограничиваемая субстратом циклическая ферментация (однозагрузочная для производства партии) начинается, как только концентрация субстрата в культуральной среде окажется на уровне примерно 0,5 г/л или менее. После достижения плотности клеток 1-30 г/л сухой клеточной массы и концентрации глюкозы менее чем 0,5 г/л проводили добавление предпродукционной среды. Предпродукционная среда включает источник азота, выбранный из группы, содержащей комплексные источники азота, такие как триптон, ферментный гидролизат казеина (СЕН), гидролизат казеина соевых бобов, перевар желатина и им подобных, их комбинации друг с другом и их комбинации с дрожжевым экстрактом, подходящие соли/питательные вещества, выбранные из группы, состоящей из лимонной кислоты, хлорида калия, хлорида натрия, сульфата магния, диаммонийгидрофосфата, дигидрофосфата калия, бутирата натрия, тиамина, глицина и хлорида цинка, подходящие антибиотики, подобные ампициллину, канамицину и т.д.,которые выбираются в соответствии с требованиями способа. рН поддерживается на уровне примерно 6,3-8, предпочтительно на уровне рН 6,5-7,0, и температура поддерживается на уровне примерно 2540 С, предпочтительно на уровне примерно 37 С. Общая концентрация K+ в культуральной среде больше чем 120 мМ, и концентрация Na+ больше чем 40 мМ, предпочтительно в диапазоне 60-80 мМ. Источник углерода можно не добавлять к предпродукционной среде. Индукция продукции белка осуществляется после добавления предпродукционной среды. Подходящий индуктор можно добавить в виде одной загрузки, множества загрузок или непрерывным образом. Непрерывную подачу продукционной среды (в режиме подачи для производства партии) начинают сразу после добавления индуктора. Продукционная среда включает источник углерода в дополнение к ингредиентам предпродукционной среды. Подходящий источник углерода можно выбрать из группы, состоящей из глицерина, глюкозы, фруктозы, мальтозы, галактозы и им подобных или их смесей. Предпочтительным источником углерода по настоящему изобретению является глюкоза. рН поддерживается на уровне примерно 6,3-8,0, предпочтительно на уровне рН 6,5-7,0, и температура поддерживается на уровне примерно 25-40 С, предпочтительно на уровне примерно 37 С. Все другие условия ферментации выбираются в соответствии с принципами, известными в предшествующем уровне техники. В течение продукционной фазы ферментации общая концентрация K+ в культуральной среде больше чем 120 мМ и концентрация Na+ больше чем 40 мМ. Через 5-24 ч культуральную среду удаляют и подвергают переработке ниже по потоку в соответствии с методиками, описанными в данной области. Способ по настоящему изобретению приводит к получению гидрофобных белков, подобных IFN- с большим выходом (уровень экспрессии в диапазоне от 4 до 28% общего клеточного белка), по данным денситометрической оценки с использованием полос белка, полученных способом SDS-PAGE (электрофорезом на полиакриламидном геле с додецилсульфатом натрия). Приведенные ниже примеры дополнительно описывают изобретение. Эти примеры представлены в качестве иллюстраций и никоим образом не должны рассматриваться как ограничивающие изобретение. Пример 1. Экспрессия IFN- в средах, включающих ферментный гидролизат казеина, натрий и тиамин. Культуру клеток E.coli BL21 (DE3), трансформированных геном IFN-, выращивали в средеLuria-Bertini (рН 7,0) с ампициллином (100 мг/л) в течение 14 ч при 37 С и 200 об/мин в инкубаторе с перемешиванием. Затем биомассу в асептических условиях удаляли центрифугированием при 7135g в течение 15 мин при 20 С и в асептических условиях повторно суспендировали в продукционной среде.-3 013263 Состав среды, использованной для получения IFN-, был следующий. Ген IFN- в последующем индуцировали добавлением стерилизованного через фильтр IPTG (2 мМ) при 37 С. Температуру во время продукционной фазы поддерживали на уровне 37 С и рН был в диапазоне от 5,3 до 7,2. Через каждые 2 ч брали образцы и рН доводили до примерно 7,0. Уровень экспрессииIFN- в образце через 8 ч после инкубации составлял 10,49%, по данным денситометрического измерения с использованием полос белка, полученных при помощи SDS-PAGE. Пример 2. Экспрессия IFN- в средах, включающих триптон, натрий и тиамин. Эксперимент выполняли таким же образом, как в примере 1, за исключением наличия триптона в качестве источника азота при получении среды, имеющей следующий состав. Ген IFN- в последующем индуцировали добавлением стерилизованного через фильтр IPTG (2 мМ) при 37 С. Температуру во время продукционной фазы поддерживали на уровне 37 С и рН был в диапазоне от 5,3 до 7,2. Через каждые 2 ч брали образцы и рН доводили до 7,0. Уровень экспрессии IFN- в образце через 8 ч после инкубации составлял 7,15%. Пример 3. Влияние различных источников азота на уровень экспрессии на уровне встряхиваемой колбы. Культуру клеток E.coli BL21 (DE3), трансформированных геном IFN-, выращивали в средеLuria-Bertini (рН 7,0) с ампициллином (100 мг/л) в течение 14 ч при 37 С и 200 об/мин в инкубаторе с перемешиванием. Затем биомассу в асептических условиях удаляли центрифугированием при 7135g в течение 15 мин при 20 С и в асептических условиях повторно суспендировали в продукционной среде. Состав среды, использованной для получения IFN-, был следующий. Использованными источниками азота в эксперименте были ацетат аммония, хлорид аммония, сульфат аммония, ферментный гидролизат казеина, перевар желатина, триптон и мочевина. Ген IFN- в последующем индуцировали добавлением стерилизованного через фильтр IPTG (2 мМ) при 37 С. Температуру во время продукционной фазы поддерживали на уровне 37 С и рН был в диапазоне от 5,3 до 7,2. Через каждые 2 ч брали образцы и рН доводили до 7,0. Уровни экспрессии IFN- в образцах через 8 ч после инкубации показаны на фиг. 1.-4 013263 Пример 4. Зависимость уровня экспрессии от концентрации источников азота. Испытывали влияние различной концентрации источников азота на продукцию интерферона(фиг. 2). Все другие параметры были такими же, как параметры, использованные для примера 1, за исключением концентраций Na+ и тиамина, которые здесь не испытывались. Состав среды, использованной для получения IFN-, был следующий. Ген IFN- в последующем индуцировали добавлением стерилизованного через фильтр IPTG (2 мМ) при 37 С. Температуру во время продукционной фазы поддерживали на уровне 37 С, и рН был в диапазоне от 5,3 до 7,2. Через каждые 2 ч брали образцы и рН доводили до 7,0. Результаты уровня экспрессии IFN- в образцах через 8 ч после индукции приведены в табл. 1. Таблица 1 Пример 5. Влияние триптона на уровень экспрессии IFN-. Посевную культуру клеток E.coli BL21 (DE3), трансформированных геном IFN-, инокулировали в ростовую среду следующего состава. Добавление следующей среды при ограничиваемом субстратом однозагрузочном режиме привело к большому увеличению биомассы. В фазе роста использовали гидроксид аммония в качестве регулятора рН для поддержания рН в диапазоне от 6,8 до 7,0. Температуру поддерживали на уровне 37 С. После достижения оптической плотности примерно 50 AU (произвольных единиц) (при 600 нм) добавляли предпродукционную среду для получения следующих концентраций отдельных компонентов указанной среды в культуральном бульоне. Экспрессию гена IFN- индуцировали добавлением стерилизованного через фильтр раствора IPTG(2 мМ) в культуральный бульон. Следующую продукционную среду в последующем добавляли для увеличения уровня экспрессии IFN-. В продукционной фазе использовали гидроксид аммония в качестве регулятора рН для поддержания рН 7,0. Температуру поддерживали на уровне 37 С. По данным определения SDS-PAGE, уровень экспрессии IFN- в образце через 12 ч после индукции составил 15,24%. Пример 6. Влияние ферментного гидролизата казеина на уровень экспрессии IFN-. Эксперимент выполняли таким же образом, как в примере 5, за исключением того, что в примере 6 вместо применения триптона в качестве главного источника азота использовали ферментный гидролизат казеина. Конечные концентрации ферментного гидролизата казеина были 10 и 20 г/л соответственно в прединдукционной и продукционной средах. По данным определения при помощи SDS-PAGE уровень экспрессии IFN- в образце через 12 ч после индукции составил 24,76%. Пример 7. Влияние комбинации трипсина и дрожжевого экстракта на уровень экспрессии IFN-. Эксперимент выполняли таким же образом, как в примере 5, за исключением того, что в примере 7 вместо применения дрожжевого гидролизата казеина в качестве главного источника азота использовали комбинацию триптона и дрожжевого экстракта. Конечные концентрации триптона и дрожжевого экстракта в культуральном бульоне после добавления прединдукционной среды были соответственно 10 и 5 г/л. Концентрации триптона и дрожжевого экстракта в продукционной среде также составляли соответственно 10 и 5 г/л. По данным определения SDS-PAGE уровень экспрессии IFN- в образце через-6 013263 12,5 ч после индукции составил 7,82%. Пример 8. Влияние различных концентраций тиамина на уровень экспрессии. Культуру клеток E.coli BL21 (DE3), трансформированных геном IFN-, выращивали в средеLuria-Bertini (pH 7,0) с ампициллином (100 мг/л) в течение 14 ч при 37 С и 200 об/мин в инкубаторе с перемешиванием. Затем биомассу в асептических условиях удаляли центрифугированием и повторно суспендировали в продукционной среде. Состав продукционной среды был следующим. Ген IFN- в последующем индуцировали добавлением стерилизованного через фильтр IPTG (2 мМ) при 37 С. Температуру во время продукционной фазы поддерживали на уровне 37 С. Через каждые 2 ч брали образцы и рН доводили до 7,0. Уровни экспрессии IFN- в образцах через 8 ч после инкубации Пример 9. Влияние комбинации тиамина с различными источниками азота на уровень экспрессии. Культуру клеток Е.coli BL21 (DE3), трансформированных геном IFN-, выращивали в средеLuria-Bertini (pH 7,0) с ампициллином (100 мг/л) в течение 14 ч при 37 С и 200 об/мин в инкубаторе с перемешиванием. Затем биомассу в асептических условиях удаляли центрифугированием и повторно суспендировали в продукционной среде. Состав продукционной среды был следующим. Влияние тиамина контролировали для трех источников азота, т.е. перевара желатина, ферментного гидролизата казеина и триптона. Ген IFN- в последующем индуцировали добавлением стерилизованного через фильтр IPTG (2 мМ) при 37 С. Температуру во время продукционной фазы поддерживали на уровне 37 С. Через каждые 2 ч брали образцы и рН доводили до 7,0. Уровни экспрессии IFN- в образцах через 8 ч после инкубации (фиг. 3) показаны в табл. 3. Пример 10. Влияние катиона натрия на уровень экспрессии. Культуру клеток E.coli BL21 (DE3), трансформированных геном IFN-, выращивали в средеLuria-Bertini (pH 7,0) с ампициллином (100 мг/л) в течение 14 ч при 37 С и 200 об/мин в инкубаторе с перемешиванием. Затем биомассу в асептических условиях удаляли центрифугированием при 7135g в течение 15 мин при 20 С и в асептических условиях повторно суспендировали в продукционной среде. Состав среды, использованной для получения IFN-, был следующий. Ген IFN- в последующем индуцировали добавлением стерилизованного через фильтр IPTG (2 мМ) при 37 С. Температуру во время продукционной фазы поддерживали на уровне 37 С и рН - в диапазоне от 6,62 до 7,52. Через каждые 2 ч брали образцы и рН доводили до 7,0. По данным определения при помощи SDS-PAGE уровни экспрессии IFN- в образцах через 8 ч после индукции показаны в табл. 4. Таблица 4 Пример 11. Влияние комбинации тиамина, высокой концентрации катиона натрия и триптона на уровень экспрессии. Посевную культуру клеток E.coli BL21 (DE3), трансформированных геном IFN-, инокулировали в ростовую среду следующего состава. Добавление следующей среды при ограничиваемом субстратом однозагрузочном режиме привело к большому увеличению биомассы. В фазе роста использовали гидроксид аммония в качестве регулятора рН для поддержания рН в диапазоне от 6,8 до 7,0. Температуру поддерживали на уровне 37 С. После достижения оптической плотности примерно 50 AU (при 600 нм) добавляли предпродукционную среду. Среда А. Получение без высокого содержания катиона натрия и тиамина. Предпродукционная среда. Экспрессию гена IFN- индуцировали добавлением в асептических условиях стерилизованного через фильтр IPTG (2 мМ). Продукционная питающая среда. В продукционной фазе использовали гидроксид аммония в качестве регулятора рН для поддержания рН 7,0. Температуру поддерживали на уровне 37 С.-9 013263 Среда В. Получение с высоким содержанием катиона натрия и тиамина. Предпродукционная среда. Экспрессию гена IFN- индуцировали добавлением в асептических условиях стерилизованного через фильтр IPTG (2 мМ). Продукционная питающая среда. В продукционной фазе гидроксид аммония использовали в качестве регулятора рН для поддержания рН 7,0. Температуру поддерживали на уровне 37 С. Общая концентрация катионов натрия и калия в бесклеточных средах во время продукционной фазы была соответственно 109-10110,9-10,1 мМ и 163-11816,3-11,8 мМ. Измерения содержания катионов калия и натрия в бесклеточном культуральном бульоне производили, используя спектры атомного поглощения. Динамика увеличения уровней экспрессии показана на фиг. 4. Уровни экспрессии IFN-, полученные в средах А и В, составили соответственно 15,24 и 27,32% по данным денситометрического измерения с использованием полос белка, полученных при помощи SDS-PAGE. Выход IFN- в среде В составил 2 г/л. Преимущества способа. 1. Способ по настоящему изобретению дает более высокую экспрессию IFN-, чем способы предшествующего уровня техники. 2. Способ по настоящему изобретению коммерчески более жизнеспособен, поскольку нет необходимости жесткого контроля концентрации натрия или калия в среде для поддержания ее на очень низком уровне. 3. Способ по настоящему изобретению легче выполнять, чем способы предшествующего уровня техники. 4. Весь способ по настоящему изобретению очень эффективен по затратам.a) обеспечение клетки-хозяина E.coli, которая способна продуцировать указанный белок; иb) культивирование клетки в условиях, эффективных для индукции продукции указанного белка в среде, включающей комплексный источник азота, выбранный из группы, содержащей ферментативный гидролизат желатина, ферментативный гидролизат казеина и триптон или их комбинации, такие как ферментативный гидролизат желатина и ферментативный гидролизат казеина, или ферментативный гидролизат желатина и триптон, или ферментативный гидролизат казеина и триптон, или ферментативный гидролизат желатина, ферментативный гидролизат казеина и триптон, или любые из указанных отдельных источников азота или из указанных комбинаций в сочетании с дрожжевым экстрактом, где способ осуществляется при рН примерно от 6,5 до 7,0 и при температуре примерно 37 С, причем культуральная среда включает тиамин в концентрации по меньшей мере от 3 до 12 г/л. 2. Способ по п.1, где концентрация комплексного источника азота составляет от примерно 10 до примерно 30 г/л. 3. Способ по п.1 или 2, где комплексный источник азота представляет собой ферментативный гидролизат желатина. 4. Способ по любому из пп.1 или 2, где комплексный источник азота представляет собой триптон. 5. Способ по любому из пп.1 или 2, где комплексный источник азота представляет собой ферментативный гидролизат казеина. 6. Способ по любому из предыдущих пунктов, где концентрация тиамина в культуральной среде составляет предпочтительно 7 г/л. 7. Способ по любому из предыдущих пунктов, где среда дополнительно включает источник углерода, выбранный из группы, содержащей глюкозу, фруктозу, мальтозу, глицерин, галактозу и их комбинации. 8. Способ по любому из предыдущих пунктов, где источник углерода выбран из глюкозы или глицерина. 9. Способ по любому из предыдущих пунктов, где среда включает катионы натрия в концентрации примерно 50-100 мМ. 10. Способ по любому из предыдущих пунктов, где IFN- имеет аминокислотную последовательность SEQ ID NO: 1. 11. Способ по любому из предыдущих пунктов, где уровень экспрессии IFN- на конечной стадии осуществления способа составляет по меньшей мере 15% от общего белка. 12. Композиция для получения IFN- в клетке-хозяине E.coli, включающая:a) клетку-хозяин E.coli, способную продуцировать указанный белок;b) культуральную среду, содержащую комплексный источник азота, выбранный из группы, включающей ферментативный гидролизат желатина, ферментативный гидролизат казеина и триптон или их комбинации, такие как ферментативный гидролизат желатина и ферментативный гидролизат казеина,или ферментативный гидролизат желатина и триптон, или ферментативный гидролизат желатина, ферментативный гидролизат казеина и триптон, или любые из указанных отдельных источников азота или из указанных комбинаций, в сочетании с дрожжевым экстрактом; источник углерода, выбранный из группы, включающей глюкозу и глицерин, тиамин в концентрации по меньшей мере от 3 до 12 г/л и катионы натрия в концентрации от 60 до 80 мМ.
МПК / Метки
МПК: C12N 1/20, C07K 14/565
Метки: получения, интерферона-&beta, способ
Код ссылки
<a href="https://eas.patents.su/15-13263-sposob-polucheniya-interferona-beta.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения интерферона-бета</a>
Предыдущий патент: Пероральные твёрдые лекарственные формы, содержащие низкую дозу эстрадиола
Следующий патент: Производные n-(гетероарил)-1н-индол-2-карбоксамидов и их применение в качестве лигандов ваниллоидного рецептора trpv1
Случайный патент: Промежуточное соединение для получения паклитаксела и способ получения промежуточного соединения