Способ получения n-монозамещённых β- аминоспиртов
Формула / Реферат
1. Способ получения N-монозамещенного b-аминоспирта формулы
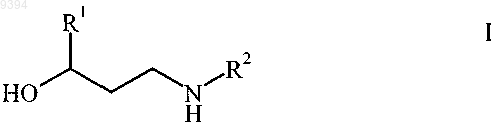
и/или соли присоединения протонной кислоты, в которой R1 и R2 независимо выбирают из группы, включающей линейный или разветвленный С1-8алкил, C3-8циклоалкил, фенил, нафтил, фуранил, бензофуранил, тиенил, бензо[b]тиенил и арилалкил, где алкильная часть арилалкильного остатка представляет собой линейный C1-4алкил, а арильную часть выбирают из группы, включающей фенил, нафтил, фуранил, бензофуранил, тиенил и бензо[b]тиенил, каждый арил или арилалкил может быть необязательно замещен галогеном, линейным или разветвленным C1-4алкилом, линейной или разветвленной C1-4алкоксигруппой, C3-6циклоалкилом, CF3, C2F5, OCF3 или OC2F5, заключающийся в том, что
а) проводят взаимодействие в смеси, включающей
(1) метилкетон формулы

в которой R1 имеет указанные выше значения,
(2) соединение формулы
![]()
и/или соли присоединения протонной кислоты, в которой R2 имеет указанные выше значения, и
(3) формальдегид или источник формальдегида, выбранный из группы, включающей водный раствор формальдегида, 1,3,5-триоксан, параформальдегид и их смеси, в присутствии растворителя, выбранного из группы, включающей воду, алифатические спирты, циклоалифатические спирты и их смеси, и необязательно протонную кислоту с получением b-аминокетона формулы
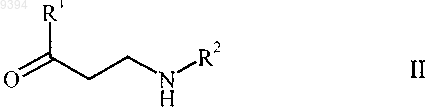
и/или соли присоединения протонной кислоты, и
(б) восстановление карбонильной группы полученного b-аминокетона с получением соединения формулы I и/или соли присоединения протонной кислоты, при этом первую стадию осуществляют при давлении в интервале от 1,5 до 10 бар.
2. Способ по п.1, где соединение формулы V присутствует в количестве, по крайней мере, эквимолярном по отношению к соединению формулы IV.
3. Способ по одному из пп.1, 2, где протонная кислота представляет собой карбоновую или неорганическую кислоту, кислоты предпочтительно выбирают из группы, включающей муравьиную кислоту, уксусную кислоту, пропионовую кислоту, щавелевую кислоту, малоновую кислоту, бензойную кислоту, HF, HCl, HBr, HI, H2SO4 и Н3РО4, однощелочной малонат, щелочные гидросульфаты, щелочные гидрофосфаты и щелочные гидрокарбонаты.
4. Способ по одному из пп.1-3, где алифатические или циклоалифатические спирты выбирают из группы, включающей линейные или разветвленные C1-12спирты, циклоалифатические C5-8спирты, ди- и/или триэтиленгликоли или их моноС1-4алкил- или ацетилпроизводные, каждый из указанных спиртов содержит от 1 до 3 гидроксильных групп.
5. Способ по п.4, где спирт выбирают из группы, включающей метанол, этанол, пропанол, изопропиловый спирт, бутанол, изобутанол, трет-бутанол, бутанол-2, пентанол-1, пентанол-2, пентанол-3, гексанол-1, гексанол-2, циклопентанол, циклогексанол, этандиол-1,2, пропандиол-1,2, бутандиол-1,2, бутандиол-2,3, бутандиол-1,4, пропантриол-1,2,3, гексантриол-1,2,6, диэтиленгликоль, монометиловый эфир диэтиленгликоля, моноэтиловый эфир диэтиленгликоля, монобутиловый эфир диэтиленгликоля, моноацетат диэтиленгликоля, триэтиленгликоль, монометиловый эфир триэтиленгликоля, моноэтиловый эфир триэтиленгликоля, монобутиловый эфир триэтиленгликоля и моноацетат триэтиленгликоля.
6. N-монозамещенный b-кетоамин формулы
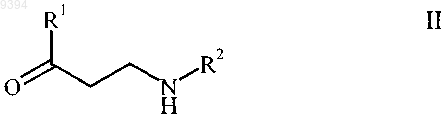
и его соли присоединения протонных кислот, где R1 представляет собой фуранил, бензофуранил, тиенил, бензо[b]тиенил и где R2 выбирают из группы, включающей линейный или разветвленный C1-8 алкил, C3-8циклоалкил.
7. N-монозамещенный b-кетоамин формулы
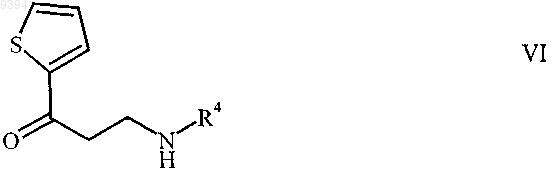
и его соли присоединения протонных кислот, где R4 представляет собой метил, этил, изобутил и трет-бутил.
8. 3-(Метиламино)-1-(фуран-2-ил)пропан-1-он формулы
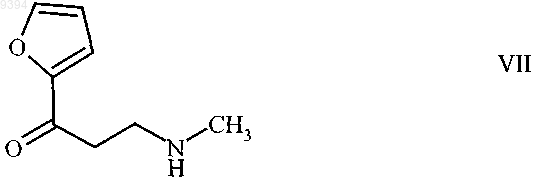
и его соли присоединения протонных кислот.
9. 3-(Метиламино)-1-(2-нафтил)пропан-1-он формулы
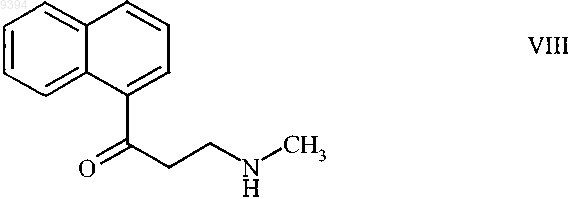
и его соли присоединения протонных кислот.
10. Способ получения N-монозамещенного b-кетоамина формулы II
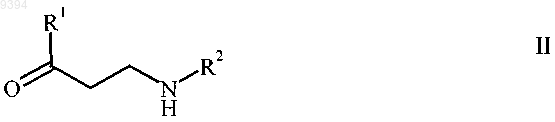
и/или его соли присоединения протонных кислот, где R1 и R2 независимо выбирают из группы, включающей линейный или разветвленный С1-8алкил, С3-8циклоалкил, фенил, нафтил, фуранил, бензофуранил, тиенил, бензо[b]тиенил и арилалкил, где алкильная часть арилалкильного остатка представляет собой линейный С1-4алкил, а арильную часть выбирают из группы, включающей фенил, нафтил, фуранил, бензофуранил, тиенил и бензо[b]тиенил, каждый арил или арилалкил может быть необязательно замещен галогеном, линейным или разветвленным С1-4алкилом, линейной или разветвленной С1-4 алкоксигруппой, С3-6циклоалкилом, CF3, C2F5, OCF3 или OC2F5, причем способ включает взаимодействие
(1) метилкетона формулы

где R1 принимает значения, определенные выше,
(2) соединения формулы
![]()
и/или соли присоединения протонной кислоты, где R2 принимает значения, определенные выше, и
(3) формальдегида или источника формальдегида, выбранного из группы, включающей формальдегид в водном растворе, 1,3,5-триоксан, параформальдегид, или их смеси, в присутствии растворителя, выбранного из группы, включающей воду, алифатические спирты, циклоалифатические спирты и их смеси, и необязательно протонной кислоты, с получением соединения формулы
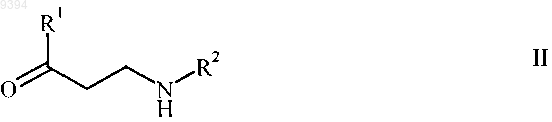
и/или солей присоединения протонной кислоты, где R1 и R2 принимают значения, определенные выше, причем реакция протекает при давлении в интервале от 1,5 до 10 бар.
11. Способ по п.10, где соединение формулы V присутствует в количестве не менее эквимолярного по отношению к соединению формулы IV.
12. Способ по одному из пп.10, 11, где протонная кислота представляет собой карбоновую или неорганическую кислоту, кислоты предпочтительно выбирают из группы, включающей муравьиную кислоту, уксусную кислоту, пропионовую кислоту, щавелевую кислоту, малоновую кислоту, бензойную кислоту, HF, HCl, HBr, HI, H2SO4 и Н3РО4, однощелочной малонат, щелочные гидросульфаты, щелочные гидрофосфаты и щелочные гидрокарбонаты.
13. Способ по одному из пп.11, 12, где алифатические или циклоалифатические спирты выбирают из группы, включающей линейные или разветвленные С1-12спирты, циклоалифатические С5-8спирты, ди- и/или триэтиленгликоли или их моноС1-4алкил или ацетилпроизводные, каждый из указанных спиртов содержит от 1 до 3 гидроксильных групп.
14. Способ по п.13, где спирт выбирают из группы, включающей метанол, этанол, пропанол, изопропиловый спирт, бутанол, изобутанол, трет-бутанол, бутанол-2, пентанол-1, пентанол-2, пентанол-3, гексанол-1, гексанол-2, циклопентанол, циклогексанол, этандиол-1,2, пропандиол-1,2, бутандиоы-1,2, бутандиол-2,3, бутандиол-1,4, пропантриол-1,2,3, гексантриол-1,2,6, диэтиленгликоль, монометиловый эфир диэтиленгликоля, моноэтиловый эфир диэтиленгликоля, монобутиловый эфир диэтиленгликоля, моноацетат диэтиленгликоля, триэтиленгликоль, монометиловый эфир триэтиленгликоля, моноэтиловый эфир триэтиленгликоля, монобутиловый эфир триэтиленгликоля и моноацетат триэтиленгликоля.
Текст
009394 Настоящее изобретение относится к способу получения N-монозамещенных -аминоспиртов формулы и/или соли присоединения протонной кислоты путем прямого получения N-монозамещенных кетоаминов формулы и/или соли присоединения протонной кислоты.N-монозамещенные -аминоспирты формулы (I), такие как (S)-(-)-3-N-метиламино-1-(2-тиенил)-1 пропанол (LY293628) представляют собой полезные ключевые промежуточные продукты и строительные блоки для приготовления фармацевтически активных соединений, таких как (S)-(+)-метил-[3-(1 нафтилокси)-3-(2-тиенил)пропил]аминS)-дулоксетин) (Liu H. и др., Chirality 12, 2000, cc.26-29), потенциально нейроактивные соединения, которые эффективно ингибируют захват серотонина и норэфедрина В последующем описании термины амин или амины включают их соответствующие соли присоединения протонных кислот. Прямое приготовление N-монозамещенных -кетоаминов формулы II дает альтернативный и экономически предпочтительный источник промышленного производства N-монозамещенных аминоспиртов формулы I. Соединения формулы II были впервые синтезированы в 1922 году по реакции кетонов с формальдегидом и первичными или вторичными алкиламинами в присутствии хлороводородной кислоты (Mannich,C. и др., Chem.Ber. 55, 1922, cc.356-365). В этих реакциях с первичными алкиламинами образование гидрохлоридов третичных -кетоаминов формулы преобладает над образованием гидрохлоридов вторичных -кетоаминов формулы II. Эти открытия были подтверждены Blicke и др., (J.Am.Chem.Soc., 64, 1942, сс.451-454) и Becker и др., (Wiss. Z. Tech.Hochsch. Chem. Leuna-Merseburg, 11, 1969,38-41). Согласно Mannich и др. перегонка с паром третичных -кетоаминов формулы III приводит к образованию вторичных -кетоаминов формулы II с весьма удовлетворительными выходами, которое сопровождается образованием виниловых соединений и других побочных продуктов. Несмотря на потерю более чем 50% исходных соединений и в связи с недостатком альтернативных процессов, такой способ до сих пор используется для получения вторичных -кетоаминов. Другим недостатком известных в настоящее время способов получения -кетоаминов является необходимость отделения желательных промежуточных соединений формулы II от нежелательных побочных продуктов формулы III. В заявках ЕР-А-457 559 и ЕР-А 650 965 описано получение N,N-диметиламиноспиртов с использованием реакций типа реакции Манниха взаимодействия метилкетонов с параформальдегидом и диметиламином, за которым следует восстановление карбонильной группы. После реакции гидроксильной группы, дающей производные алкиловых или ариловых простых эфиров, один метальный радикал удаляют с образованием N-монозамещенных соединений, что требует проведения искусных и дорогостоящих реакций. У Becker и др. описано незначительное количество примеров с выходами приблизительно 60% Nмонометил -кетоаминов с использованием оксалатов N-метиламмония в качестве источника азота. Тем-1 009394 не менее, процесс, описанный Becker и др., не является благоприятным, поскольку он сильно зависит от применения аминооксалатов. В отличие от свободных аминов или соответствующих гидрохлоридов оксалаты первичных аминов не выпускаются промышленностью, и их приготовление требует дополнительных стадий синтеза и очистки. Использование оксалатов не является благоприятным еще и потому, что требует дополнительных восстановительных процессов на следующей стадии, в которых происходит восстановление кетоновых промежуточных продуктов в соединения, названные в заглавии. Ни один из известных процессов получения N-монозамещенных -аминоспиртов формулы I и их простых эфиров не включает, не предполагает или не рассматривает промежуточные продукты, подобные N-монозамещенным -кетоаминам формулы II в данном изобретении. Хотя до сих пор много усилий предпринимается, чтобы найти новые способы получения, способ прямого синтеза N-монозамещенных-кетоаминов и последующее восстановление в N-монозамещенные -аминоспирты, предложенный в настоящем изобретении, до сих пор описан не был. В основу изобретения была положена задача разработать альтернативный и эффективный способ для синтеза N-монозамещенных -аминоспиртов и их производных с высокими выходами. Более того,предлагаемый способ должен обеспечивать высокие выходы независимо от стерических аспектов и использованных амино- или карбонильных соединений. Указанные задачи решаются с помощью признаков, представленных в п.1 формулы изобретения. Исходными веществами были имеющиеся в продаже метилкетоны и первичные амины и/или соли присоединения протонной кислоты, которые подвергали взаимодейтсвию с формальдегидом в присутствии растворителя и необязательно протонной кислоты при давлении выше 1,5 бар с образованием в результате с высокими выходами N-монозамещенных -кетоаминов, которые можно напрямую восстановить в желательные N-монозамещенные -аминоспирты. Еще одним преимуществом описываемого процесса является то, что высокие выходы Nмонозамещенных -кетоаминов могут быть достигнуты прямым использованием гидрохлорида метиламина, который является легкодоступным, дешевым и удобным в обращении, поскольку он представляет собой твердое вещество. В настоящем изобретении предлагается способ получения соединения формулы и/или соли присоединения протонной кислоты, в которой R1 и R2 независимо представляют собой алкил, циклоалкил, арил и или арилалкил, каждый из которых необязательно дополнительно замещен алкильной, алкокси группой и/или галогеном, заключающийся в том, что а) проводят взаимодействие в смеси, содержащей в которой R1 имеет указанные выше значения,(2) соединение формулыV и/или соли присоединения протонной кислоты, в которой R имеет указанные выше значения, и(3) формальдегид или источник формальдегида, выбранный из группы, включающей водный раствор формальдегида, 1,3,5-триоксан, параформальдегид и их смеси, в присутствии растворителя, выбранного из группы, включающей воду, алифатические спирты, циклоалифатические спирты и их смеси,и необязательно протонную кислоту с получением соединения формулы и/или соли присоединения протонной кислоты, и(б) восстановление карбонильной группы названного -аминокетона с получением соединения формулы I и/или соли присоединения протонной кислоты, при этом первую стадию осуществляют при давлении выше 1,5 бар. В одном из предпочтительных вариантов R1 и R2 независимо друг от друга могут обозначать линейный или разветвленный C1-8 алкил, C3-8 циклоалкил, фенил, нафтил, фуранил, бензофуранил, тиенил,бензо[b]тиенил или арилалкил, где алкильная часть арилалкильной группы представляет собой линейныйC1-4 алкил, а арильную часть выбирают из группы, включающей фенил, нафтил, фуранил, бензофуранил,тиенил и бензо[b]тиенил,Каждый арил или арилалкил необязательно замещен галогеном, линейным или разветвленным C1-4-2 009394 алкилом, C3-6 циклоалкилом, CF3, C2F5, OCF3 или OC2F5. Особенно предпочтительно, когда R1 представляет собой фуранил или тиенил. Также особенно предпочтительно, когда R2 представляет собой линейный или разветвленный С 1-8 алкил. Еще более предпочтительно, когда R2 представляет собой метил, этил, пропил, изопропил, бутил,изобутил или трет-бутил. Предпочтительно, соединение формулы V используют как свободный амин и/или соль присоединения протонной кислоты. Особенно предпочтительными являются свободные амины, формиаты, ацетаты,оксалаты, гидрохлориды, гидробромиды или их смеси. Еще более предпочтительными являются свободные амины и/или гидрохлориды. В одном из предпочтительных вариантов соединение формулы V присутствует в количестве, по меньшей мере, эквимолярном по отношению к соединению формулы IV. Особенно предпочтительно,чтобы молярное отношение соединения формулы V к соединению формулы IV находилось между 1 и 2. В одном из предпочтительных вариантов растворитель включает воду, алифатический или циклоалифатический спирт или их смесь. Особенно предпочтительными спиртами являются линейные или разветвленные C1-12 спирты, циклоалифатические C5-8 спирты, ди- и/или триэтиленгликоли или их моно C1-4 алкил- или ацетилпроизводные, каждый из указанных спиртов содержит от 1 до 3 гидроксильных групп. В качестве примера указанных выше спиртов можно назвать метанол, этанол, пропанол, изопропиловый спирт, бутанол, изобутанол, трет-бутанол, бутанол-2, пентанол-1, пентанол-2, пентанол-3, гексанол-1, гексанол-2, циклопентанол, циклогексанол, этандиол-1,2, пропандиол-1,2, бутандиол-1,2, бутандиол-2,3, бутандиол-1,4, пропантриол-1,2,3, гексантриол-1,2,6, диэтиленгликоль, монометиловый эфир диэтиленгликоля, моноэтиловый эфир диэтиленгликоля, монобутиловый эфир диэтиленгликоля, моноацетат диэтиленгликоля, триэтиленгликоль, монометиловый эфир триэтиленгликоля, моноэтиловый эфир триэтиленгликоля, монобутиловый эфир триэтиленгликоля, и моноацетат триэтиленгликоля. Предпочтительно указанные спирты представляют собой этанол, пропанол, изопропиловый спирт,бутанол, изобутанол, трет-бутанол, диэтиленгликоль или триэтиленгликоль. Протонная кислота может представлять собой любую органическую или неорганическую кислоту,кислоты предпочтительно выбирают из группы, включающей муравьиную кислоту, уксусную кислоту,пропионовую кислоту, щавелевую кислоту, малоновую кислоту, бензойную кислоту, HF, HCl, HBr, HI,H2SO4, и Н 3 РО 4. В предпочтительном варианте протонной кислотой может служить кислая соль многоосновной органической или неорганической кислоты, например однощелочные малонаты, щелочные гидросульфаты, щелочные гидрофосфаты и щелочные гидрокарбонаты. Более предпочтительно, чтобы протонная кислота выбиралась из группы, включающей муравьиную кислоту, уксусную кислоту, пропионовую кислоту, щавелевую кислоту, HCl и HBr, более предпочтительно она выбирается из группы,включающей муравьиную кислоту, уксусную кислоту, HCl и HBr. Предпочтительно реакционную стадию а) проводят или при добавлении солей присоединения к аминам или протонным кислотам, поскольку даже перегнанные свободные -аминокетоны формулы II имеют тенденцию к разложению и образованию побочных продуктов при хранении, в то время как соответствующие соли присоединения можно хранить длительное время без разложения. В продуктах соотношение свободного амина и его соли соответствует соотношению добавленных солей присоединения аминов и протонных кислот к общему количеству амина в реакционной стадии а). В одном из предпочтительных вариантов давление при осуществлении стадии а) составляет выше 1,5 бар, более предпочтительно находится в интервале от 1,5 до 10 бар и особенно предпочтительно в интервале от 1,5 до 5 бар. В отличие от Becker и др. описываемый способ в целом позволяет осуществить прямое получениеN-монозамещенных -кетоаминов и их солей присоединения протонных кислот. Продукты, полученные в соответствии с предложенным способом, могут быть восстановлены или могут быть впоследствии использованы в качестве реагентов без дальнейшего превращения в другие соли. В изобретении предлагается также соединение формулы и его соли присоединения протонных кислот,где R1 представляет собой фуранил, бензофуранил, изобензофуранил, тиенил или бензо[b]тиенил,каждый из которых необязательно замещен галогеном, линейным или разветвленным С 1-4 алкилом, линейной или разветвленной С 1-4 алкоксигруппой, С 3-6 циклоалкилом, CF3, C2F5, OCF3 или OC2F5 и где R2 выбирают из группы, включающей линейный или разветвленный C1-8 алкил, С 3-8 циклоалкил, фенил, нафтил, фуранил, бензофуранил, тиенил, бензо[b]тиенил и арилалкил, где алкильная часть арилалкильного остатка представляет собой линейный С 1-4 алкил, а арильную часть выбирают из группы, включающей фенил, фуранил, бензофуранил, тиенил и бензо[b]тиенил, каждый арил или арилалкил может быть необязательно замещен галогеном, линейным или разветвленным С 1-4 алкилом, линейной или разветвлен-3 009394 ной С 1-4 алкоксигруппой, С 3-6 циклоалкилом, CF3, C2F5, OCF3 или OC2F5, за исключением соединения, в котором R1 представляет собой тиенил, a R2 представляет собой бензил. В настоящем изобретении предлагается также соединение формулы и его соли присоединения протонных кислот, где R4 представляет собой метил, этил, изобутил и трет-бутил. В настоящем изобретении предлагается также соединение формулы и его соли присоединения протонных кислот. В настоящем изобретении предлагается также соединение формулы и его соли присоединения протонных кислот. В настоящем изобретении предлагается также способ получения соединения формулы II и/или его соли присоединения протонных кислот, где R1 и R2 независимо представляют собой алкил, циклоалкил, арил или арилалкил, каждых из которых необязательно замещен алкил, алкоксигруппой и/или галогеном, причем способ включает взаимодействие смеси, включающей(V) и/или соли присоединения протонной кислоты, где R2 принимает значения, определенные выше, и(3) формальдегид или источник формальдегида, выбранный из группы, включающей формальдегид в водном растворе, 1,3,5-триоксан, параформальдегид, или их смеси, в присутствии растворителя, выбранного из группы, включающей воду, алифатические спирты, циклоалифатические спирты и их смеси,и необязательно протонную кислоту, с образованием соединения формулы и/или солей присоединения протонной кислоты, где R1 и R2 принимают значения, определенные выше, причем взаимодействие проводят при давлении выше 1,5 бар. В предпочтительном варианте R1 и R2 независимо обозначают линейный или разветвленный С 1-8 алкил, С 3-8 циклоалкил, фенил, нафтил, фуранил, бензофуранил, тиенил, бензо[b]тиенил и арилалкил, где алкильная часть арилалкильного остатка представляет собой линейный С 1-4 алкил, а арильную часть выбирают из группы, включающей фенил, нафтил, фуранил, бензофуранил, тиенил и бензо[b]тиенил, каждый арил или арилалкил может быть необязательно замещен галогеном, линейным или разветвленным С 1-4 алкилом, линейной или разветвленной С 1-4 алкоксигруппой, С 3-6 циклоалкилом, CF3, C2F5, OCF3 илиOC2F5. Особенно предпочтительно, чтобы R1 представлял собой фуранил или тиенил. Также особенно предпочтительно, чтобы R2 представлял собой линейный или разветвленный С 1-8 алкил. Еще более предпочтительно, чтобы R2 представлял собой метил, этил, пропил, изопропил, бутил, изобутил или третбутил. Предпочтительно, соединение формулы V может быть использовано в виде свободного амина и/или его соли присоединения протонной кислоты. Особенно предпочтительными являются свободные амины,-4 009394 формиаты, ацетаты, оксалаты, гидрохлориды, гидробромиды или их смеси. Еще более предпочтительными являются свободные амины или гидрохлориды. В одном из предпочтительных вариантов соединение формулы V присутствует в количестве, по крайней мере, эквимолярном по отношению к соединению формулы IV. Особенно предпочтительно, чтобы молярное отношение соединения формулы V к соединению формулы IV составляло от 1 до 2. В предпочтительном варианте растворитель включает воду, алифатический или циклоалифатический спирт или их смесь. Особенно предпочтительно, чтобы спирты представляли собой линейные или разветвленные алифатические C1-12 спирты, циклоалифатические C5-8 спирты, ди- и/или триэтиленгликоли или их моно C1-4 алкил- или ацетилпроизводные, причем каждый из указанных спиртов содержал от 1 до 3 гидроксильных групп. Примерами указанных спиртов являются метанол, этанол, пропанол, изопропиловый спирт, бутанол, изобутанол, трет-бутанол, бутанол-2, пентанол-1, пентанол-2, пентанол-3, гексанол-1, гексанол-2,циклопентанол, циклогексанол, этандиол-1,2, пропандиол-1,2, бутандиол-1,2, бутандиол-2,3, бутандиол 1,4, пропантриол-1,2,3, гексантриол-1,2,6, диэтиленгликоль, монометиловый эфир диэтиленгликоля, моноэтиловый эфир диэтиленгликоля, монобутиловый эфир диэтиленгликоля, моноацетат диэтиленгликоля, триэтиленгликоль, монометиловый эфир триэтиленгликоля, моноэтиловый эфир триэтиленгликоля,монобутиловый эфир триэтиленгликоля, и моноацетат триэтиленгликоля. Предпочтительно указанные спирты представляют собой этанол, пропанол, изопропиловый спирт,бутанол, изобутанол, трет-бутанол, диэтиленгликоль или триэтиленгликоль. Протонная кислота может представлять собой любую органическую или неорганическую кислоту,кислоты предпочтительно выбирают из группы, включающей муравьиную кислоту, уксусную кислоту,пропионовую кислоту, щавелевую кислоту, малоновую кислоту, бензойную кислоту, HF, HCl, HBr, HI,H2SO4 и Н 3 РО 4. В предпочтительном варианте протонной кислотой может служить кислая соль многоосновной органической или неорганической кислоты, например однощелочные малонаты, щелочные гидросульфаты, щелочные гидрофосфаты и щелочные гидрокарбонаты. Более предпочтительно выбирают протонную кислоту из группы, включающей муравьиную кислоту, уксусную кислоту, пропионовую кислоту, щавелевую кислоту, HCl и HBr, еще более предпочтительно выбирать ее из группы, включающей муравьиную кислоту, уксусную кислоту, HCl и HBr. В одном из предпочтительных вариантов давление при осуществлении реакции составляет выше 1,5 бар, более предпочтительно находится в интервале от 1,5 до 10 бар и особенно предпочтительно в интервале от 1,5 до 5 бар. Подробное описание сущности изобретения. В настоящем изобретении предлагается способ получения N-монозамещенного -аминоспирта формулы и/или соли присоединения протонной кислоты, в которой R1 и R2 независимо выбирают из группы,включающей линейный или разветвленный C1-8 алкил, C3-8 циклоалкил, фенил, нафтил, фуранил, бензофуранил, тиенил, бензо[b]тиенил и арилалкил, где алкильная часть арилалкильного остатка представляет собой линейный C1-4 алкил, а арильную часть выбирают из группы включающей фенил, нафтил, фуранил,бензофуранил, тиенил и бензо[b]тиенил, каждый арил или арилалкил может быть необязательно замещен галогеном, линейным или разветвленным C1-4 алкилом, линейной или разветвленной C1-4 алкоксигруппой,C3-6 циклоалкилом, CF3, C2F5, OCF3 или OC2F5, заключающийся в том, что а) проводят взаимодействие в смеси, включающей в которой R1 имеет указанные выше значения,(2) соединение формулы(V) и/или соли присоединения протонной кислоты, в которой R2 имеет указанные выше значения, и(3) формальдегид или источник формальдегида, выбранный из группы, включающей водный раствор формальдегида, 1,3,5-триоксан, параформальдегид и их смеси, в присутствии растворителя, выбранного из группы, включающей воду, алифатические спирты, циклоалифатические спирты и их смеси,и необязательно протонную кислоту с получением -аминокетона формулы-5 009394 и/или соли присоединения протонной кислоты, и(б) восстановление карбонильной группы полученного -аминокетона с получением соединения формулы I, и/или соли присоединения протонной кислоты, при этом первую стадию осуществляют при давлении в интервале от 1,5 до 10 бар. Соединение формулы V присутствует в количестве по крайней мере эквимолярном по отношению к соединению формулы IV. Протонная кислота представляет собой карбоновую или неорганическую кислоту, кислоты предпочтительно выбирают из группы, включающей муравьиную кислоту, уксусную кислоту, пропионовую кислоту, щавелевую кислоту, малоновую кислоту, бензойную кислоту, HF, HCl, HBr, HI, H2SO4 и Н 3 РО 4,однощелочной малонат, щелочные гидросульфаты, щелочные гидрофосфаты и щелочные гидрокарбонаты. Алифатические или циклоалифатические спирты выбирают из группы, включающей линейные или разветвленные C1-12 спирты, циклоалифатические C5-8 спирты, ди- и/или триэтиленгликоли, или их моноC1-4 алкил- или ацетилпроизводные, каждый из указанных спиртов содержит от 1 до 3 гидроксильных групп. Предпочтительно спирт выбирают из группы, включающей метанол, этанол, пропанол, изопропиловый спирт, бутанол, изобутанол, трет-бутанол, бутанол-2, пентанол-1, пентанол-2, пентанол-3, гексанол-1, гексанол-2, циклопентанол, циклогексанол, этандиол-1,2, пропандиол-1,2, бутандиол-1,2, бутандиол-2,3, бутандиол-1,4, пропантриол-1,2,3, гексантриол-1,2,6, диэтиленгликоль, монометиловый эфир диэтиленгликоля, моноэтиловый эфир диэтиленгликоля, монобутиловый эфир диэтиленгликоля, моноацетат диэтиленгликоля, триэтиленгликоль, монометиловый эфир триэтиленгликоля, моноэтиловый эфир триэтиленгликоля, монобутиловый эфир триэтиленгликоля и моноацетат триэтиленгликоля. В изобретении предлагается также N-монозамещенный -кетоамин формулы и его соли присоединения протонных кислот, где R1 представляет собой фуранил, бензофуранил,тиенил, бензо[b]тиенил и где R2 выбирают из группы, включающей линейный или разветвленный C1-8 алкил, C3-8 циклоалкил. В настоящем изобретении предлагается также N-монозамещенный -кетоамин формулы и его соли присоединения протонных кислот, где R4 представляет собой метил, этил, изобутил и трет-бутил. В настоящем изобретении предлагается также 3-(метиламино)-1-(фуран-2-ил)пропан-1-он формулы и его соли присоединения протонных кислот. В настоящем изобретении предлагается также 3-(метиламино)-1-(2-нафтил)пропан-1-он формулы и его соли присоединения протонных кислот. В настоящем изобретении предлагается также способ получения N-монозамещенного -кетоамина формулы II и/или его соли присоединения протонных кислот, где R1 и R2 независимо выбирают из группы,включающей линейный или разветвленный C1-8 алкил, C3-8 циклоалкил, фенил, нафтил, фуранил, бензофуранил, тиенил, бензо[b]тиенил и арилалкил, где алкильная часть арилалкильного остатка представляет собой линейный C1-4 алкил, а арильную часть выбирают из группы, включающей фенил, нафтил, фура-6 009394 нил, бензофуранил, тиенил и бензо[b]тиенил, каждый арил или арилалкил может быть необязательно замещен галогеном, линейным или разветвленным C1-4 алкилом, линейной или разветвленной C1-4 алкоксигруппой, C3-6 циклоалкилом, CF3, C2F5, OCF3 или OC2F5, причем способ включает взаимодействие где R1 принимает значения, определенные выше,(2) соединения формулы и/или соли присоединения протонной кислоты, где R2 принимает значения, определенные выше, и(3) формальдегида или источника формальдегида, выбранного из группы, включающей формальдегид в водном растворе, 1,3,5-триоксан, параформальдегид или их смеси, в присутствии растворителя,выбранного из группы, включающей воду, алифатические спирты, циклоалифатические спирты и их смеси, и необязательно протонной кислоты, с получением соединения формулы и/или солей присоединения протонной кислоты, где R1 и R2 принимают значения, определенные выше, причем реакция протекает при давлении в интервале от 1,5 до 10 бар. Соединение формулы V присутствует в количестве не менее эквимолярного по отношению к соединению формулы IV. Протонная кислота представляет собой карбоновую или неорганическую кислоту, кислоты предпочтительно выбирают из группы, включающей муравьиную кислоту, уксусную кислоту, пропионовую кислоту, щавелевую кислоту, малоновую кислоту, бензойную кислоту, HF, HCl, HBr, HI, H2SO4 и Н 3 РО 4,однощелочной малонат, щелочные гидросульфаты, щелочные гидрофосфаты и щелочные гидрокарбонаты. Алифатические или циклоалифатические спирты выбирают из группы, включающей линейные или разветвленные C1-12 спирты, циклоалифатические C5-8 спирты, ди- и/или триэтиленгликоли или их моноC1-4 алкил или ацетил производные, каждый из указанных спиртов содержит от 1 до 3 гидроксильных групп. Предпочтительно спирт выбирают из группы, включающей метанол, этанол, пропанол, изопропиловый спирт, бутанол, изобутанол, трет-бутанол, бутанол-2, пентанол-1, пентанол-2, пентанол-3, гексанол-1, гексанол-2, циклопентанол, циклогексанол, этандиол-1,2, пропандиол-1,2, бутандиол-1,2, бутандиол-2,3, бутандиол-1,4, пропантриол-1,2,3, гексантриол-1,2,6, диэтиленгликоль, монометиловый эфир диэтиленгликоля, моноэтиловый эфир диэтиленгликоля, монобутиловый эфир диэтиленгликоля, моноацетат диэтиленгликоля, триэтиленгликоль, монометиловый эфир триэтиленгликоля, моноэтиловый эфир триэтиленгликоля, монобутиловый эфир триэтиленгликоля и моноацетат триэтиленгликоля. Ниже изобретение проиллюстрировано на примерах, не ограничивающих его объем. Общая методика для примеров 1-8 Смесь метилкетона (1 эквивалент, экв.), первичного алкиламина и/или его соли присоединения (от 1,1 до 1,5 экв.), формальдегида (от 1,4 до 1,5 экв.), растворителя, необязательно в присутствии протонной кислоты, нагревают в автоклаве при общем давлении выше 1,5 бар в течение 5-24 ч. После этого реакционную смесь охлаждают до 20 С. Необязательно растворитель можно частично или полностью удалить,а растворитель, подобный этилацетату или изопропиловому спирту, может быть добавлен при интенсивном перемешивании, если необходимо ускорить осаждение продукта. Суспензию охлаждают (от 0 до 20 С) и после осаждения фильтруют (от 0,5 до 10 ч), необязательно отмывают и сушат, получают бледно-желтый до белого порошок с выходом от 50 до 75%. Продукт можно, если необходимо, перекристаллизовать из изопропилового спирта и/или этилацетата. Если устойчивость свободного основания достаточна при нормальных условиях, экстракция органическим растворителем и водной щелочью позволяет получить свободное основание. Общая методика для сравнительных примеров 1-6. Смесь метилкетона (1 экв.), первичного алкиламина и/или его соли присоединения (от 1,1 до 1,5 экв.), формальдегида (от 1,0 до 1,5 экв.), необязательно в присутствии протонной кислоты, нагревают с обратным холодильником в кипящем растворителе от 5 до 24 ч. После этого смесь охлаждают до 20 С. Необязательно растворитель можно частично или полностью удалить, а растворитель, подобный этилацетату или изопропиловому спирту, может быть добавлен при интенсивном перемешивании, если необходимо ускорить осаждение продукта. Суспензию охлаждают (от 0 до 20 С) и после осаждения фильтруют (от 0,5 до 10 ч), необязательно отмывают и сушат, получают бледно-желтый до белого порошок с выходом от 30 до 45%. Продукт можно, если необходимо, перекристаллизовать из изопропилового спирта и/или этилацетата. Пример 1. Гидрохлорид 3-(метиламино)-1-(тиофен-2-ил)пропан-1-она (II, R1 обозначает тиофен-2-7 009394 ил, R2 обозначает метил). 2-Ацетилтиофен (25,5 г, 200 миллимолей); гидрохлорид метиламина (14,9 г, 220 миллимолей, 1,1 экв.); параформальдегид (8,2 г, 280 миллимолей, 1,4 экв.); HCl концентрированная (1,0 г); этанол (100 мл); 110 С в течение 9 ч; приблизительно от 2 до 2,5 бар; удаление этанола (50 мл) под вакуумом; добавление этилацетата (200 мл); выход приблизительно 71%. 1 Н-ЯМР(ДМСО-(d6, 400 МГц): 9,16 (2 Н, синглет, уширенный), 8,07 (2 Н, двойной дублет, J=5,0,1,0), 8,01 (1 Н, двойной дублет, J=3,8, 1,0), 7,29 (1H, двойной дублет, J=5,0, 3,8), 3,49 (2 Н, триплет), 2,56(3 Н, синглет). 13 С-ЯМР(ДМСО-d6, 100 МГц): 189,9, 142,7, 135,4, 133,8, 128,8, 43,1, 34,6, 32,4. Пример 2. Гидрохлорид 3-(метиламино)-1-(тиофен-2-ил)пропан-1-она (II, R1 обозначает тиофен-2 ил, R2 обозначает метил). 2-Ацетилтиофен (24,9 г, 197 миллимолей); гидрохлорид метиламина (14,8 г, 219 миллимолей, 1,1 экв.); параформальдегид (8,3 г, 276 миллимолей, 1,4 экв.); HCl концентрированная (1,1 г); изопропиловый спирт (100 мл); 110 С в течение 8 ч; приблизительно от 2 до 2,5 бар; добавление изопропилового спирта (50 мл); выход приблизительно 65%. Сравнительный пример 1. Гидрохлорид 3-(метиламино)-1-(тиофен-2-ил)пропан-1-она (II, R1 обозначает тиофен-2-ил, R2 обозначает метил). 2-Ацетилтиофен (7,9 г, 300 миллимолей); гидрохлорид метиламина (30,4 г, 450 миллимолей, 1,5 экв.); параформальдегид (12,6 г, 420 миллимолей, 1,4 экв.); HCl концентрированная (1,5 г); изопропиловый спирт (200 мл); кипячение с обратным холодильником (82 С) в течение 8 ч; добавление этилацетатаR обозначает метил). 2-Ацетилфуран (7,5 г, 68 миллимолей); гидрохлорид метиламина (6,9 г, 102 миллимоля, 1,5 экв.); параформальдегид (3,1 г, 102 миллимоля, 1,5 экв.); HCl концентрированная (1,15 г); этанол (35 мл); 110 С в течение 8 ч; приблизительно от 2 до 2,5 бар; удаление этанола (30 мл) под вакуумом; добавление этилацетата (50 мл); выход приблизительно 64%. 1 Н-ЯМР(ДМСО-(d6, 400 МГц): 9,0 (2 Н, синглет, уширенный), 8,05 (1 Н, мультиплет), 7,53 (1 Н, м),6,77 (1 Н, м), 3,34 (2 Н, триплет), 3,2 (2 Н, мультиплет), 2,57 (3 Н, синглет, уширенный). Сравнительный пример 5. Гидрохлорид 3-(метиламино)-1-(фуран-2-ил)пропан-1-она (II, R1 обозначает фуран-2-ил, R обозначает метил). 2-Ацетилфуран (11,0 г, 100 миллимолей); гидрохлорид метиламина (10,1 г, 150 миллимолей, 1,5 экв.); параформальдегид (4,1 г, 140 миллимолей, 1,4 экв.); НС 1 концентрированная (0,5 г); бутанол (70 мл); нагревание с обратным холодильником (108 С) в течение 7 ч; добавление этилацетата (100 мл); выход приблизительно 44%. Пример 7. Гидрохлорид 3-(метиламино)-1-фенилпропан-1-она (II, R1 обозначает фенил, R2 обозначает метил). 2-Ацетофенон (21,0 г, 175 миллимолей); гидрохлорид метиламина (17,5 г, 263 миллимоля, 1,5 экв.); параформальдегид (7,9 г, 263 миллимоля, 1,5 экв.); HCl концентрированная (1,1 г); этанол (130 мл); 115 С в течение 24 ч; приблизительно от 2 до 2,5 бар; добавление этилацетата (170 мл); выход приблизительно 52%. 1 Н-ЯМР(ДМСО-d6, 400 МГц): 9,2 (2 Н, синглет, уширенный), 8,0 (2 Н, мультиплет), 7,7 (1 Н, мультиплет), 7,6 (2 Н, мультиплет), 3,55 (2 Н, триплет), 3,21 (2 Н, триплет), 2,59 (3 Н, синглет). Пример 8. Гидрохлорид 3-(метиламино)-1-(2-нафтил)пропан-1-она (II, R1 обозначает 2-нафтил, R2 обозначает метил). 2-Ацетонафтон (8,5 г, 50 миллимолей); гидрохлорид метиламина (5,1 г, 75 миллимолей, 1,5 экв.); параформальдегид (2,1 г, 75 миллимолей, 1,5 экв.); HCl концентрированная (0,3 г); этанол (35 мл); 117 С в течение 14 ч; приблизительно от 2 до 2,5 бар; удаление этанола (35 мл) под вакуумом; добавление этилацетата (50 мл); выход приблизительно 60%. 1 Н-ЯМР(ДМСО-d6, 400 МГц): 9,3 (2 Н, синглет, уширенный), 8,74 (1H, синглет), 8,17 (1 Н, дублет),8, 0 (3 Н, мультиплет), 7,7 (2 Н, мультиплет), 3,70 (2 Н, триплет), 3,28 (2 Н, мультиплет), 2,60 (3 Н, синглет). Сравнительный пример 6. Гидрохлорид 3-(метиламино)-1-(2-нафтил)пропан-1-она (II, R1 обозначает 2-нафтил, R2 обозначает метил). 2-Ацетонафтон (17,0 г, 100 миллимолей); гидрохлорид метиламина (10,1 г, 150 миллимолей, 1,5 экв.); параформальдегид (4,1 г, 140 миллимолей, 1,4 экв.); HCl концентрированная (0,5 г); этанол (70 мл); кипячение с обратным холодильником (78 С) в течение 5 ч; удаление этанола (30 мл) под вакуумом; добавление этилацетата (100 мл); выход приблизительно 42%. Пример 9. 3-(метиламино)-1-(тиофен-2-ил)пропан-1-ол (I, R1 обозначает тиофен-2-ил, R2 обозначает трет-бутил). К смеси гидрохлорида 3-(метиламино)-1-(тиофен-2-ил)пропан-1-она (10,3 г, 50 миллимолей) и этанола (35 мл) при 4 С добавляли гидроксид натрия (4,0 г 50%-ного водного раствора) в течение приблизительно 5 мин. После этого, чистый борогидрид натрия (0,95 г, 25 миллимолей, 1,0 экв.) добавляли несколькими порциями в течение приблизительно 30 мин. После окончания прибавления суспензию перемешивали в течение 4 ч при той же температуре, затем добавляли по каплям ацетон (10,0 мл) в течение 5 мин и смесь перемешивали еще 10 мин. Затем добавляли воду (20 мл). После этого смесь концентрировали приблизительно в пять раз путем перегонки под вакуумом, а остаток экстрагировали трет-бутилметиловым эфиром (2 порции по 20 мл). Собранные органические фазы окончательно концентрировали путем вакуумной перегонки, получали оранжевое масло, которое самопроизвольно кристаллизовалось после нескольких часов. Окончательно было получено оранжевое твердое вещество (7,2 г, 84%-ный выход). Это вещество можно затем использовть без дальнейшей очистки. 1 Н-ЯМР(ДМСО-d6, 400 МГц): 7,35 (1 Н, двойной дублет, J=4,8, 1,0), 6,94 (1 Н, двойной дублет,J=4,88, 3,6), 6,9 (1 Н, двойной дублет, J=3,6, 1,0), 4,90 (1 Н, триплет), 3,7 (2 Н, мультиплет), 2,56 (2 Н, мультиплет), 2,25 (3 Н, синглет), 1,79 (2 Н, квадруплет). 13 С-ЯМР(ДМСО-d6, 100 МГц): 150,9, 126,3, 123,7, 122,3, 67,8, 48,5, 38,7, 36,0. Пример 10. 3-(изобутиламино)-1-(тиофен-2-ил)пропан-1-ол (I, R1 обозначает тиофен-2-ил, R2 обозначает метил). К смеси гидрохлорида 3-(изобутиламино)-1-(тиофен-2-ил)пропан-1-она (4,2 г, 19,4 миллимолей) и этанола (10 мл) при 4 С добавляли гидроксид натрия (1,6 г 50%-ного водного раствора) в течение при-9 009394 близительно 20 мин. После этого чистый борогидрид натрия (0,37 г, 9,7 миллимолей, 1,0 экв.) добавляли несколькими порциями в течение приблизительно 30 мин. После окончания прибавления суспензию перемешивали в течение 4 ч при той же температуре, затем добавляли по каплям ацетон (10,0 мл) в течение 20 мин и смесь перемешивали еще 10 мин. Осадок затем удаляли путем фильтрации, а смесь концентрировали путем перегонки под вакуумом с образованием оранжевого масла. Полученный продукт очищали методом колоночной хроматографии с использованием смеси хлористого метилена/метанола/гидроксида аммония в соотношении 40:10:1 (по объему) в виде 25%-ного водного раствора. Получали 3,1 г (76%ный выход) продукта. 1 Н-ЯМР(ДМСО-d6, 400 МГц): 7,20 (1H, двойной дублет, J=4,8, 1,0), 6,98 (1H, двойной дублет),6,94 (1H, двойной дублет, J=4,8, 3,6), 5,20 (1 Н, двойной дублет), 4,98 (2 Н, уширенный), 3,02 (1 Н, мультиплет), 2,93 (1 Н, мультиплет), 2,43 (2 Н, симметр. мультиплет), 2,03 (1 Н, мультиплет), 1,97 (1 Н, мультиплет), 1,80 (1 Н, септет), 0,85 (6 Н, дублет). 13 С-ЯМР(ДМСО-d6, 100 МГц): 150,9, 126,3, 123,8, 122,5, 72,1, 48,5, 37,4, 28,2, 20,8. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения N-монозамещенного -аминоспирта формулы и/или соли присоединения протонной кислоты, в которой R1 и R2 независимо выбирают из группы,включающей линейный или разветвленный С 1-8 алкил, C3-8 циклоалкил, фенил, нафтил, фуранил, бензофуранил, тиенил, бензо[b]тиенил и арилалкил, где алкильная часть арилалкильного остатка представляет собой линейный C1-4 алкил, а арильную часть выбирают из группы, включающей фенил, нафтил, фуранил, бензофуранил, тиенил и бензо[b]тиенил, каждый арил или арилалкил может быть необязательно замещен галогеном, линейным или разветвленным C1-4 алкилом, линейной или разветвленной C1-4 алкоксигруппой, C3-6 циклоалкилом, CF3, C2F5, OCF3 или OC2F5, заключающийся в том, что а) проводят взаимодействие в смеси, включающей в которой R1 имеет указанные выше значения,(2) соединение формулы и/или соли присоединения протонной кислоты, в которой R2 имеет указанные выше значения, и(3) формальдегид или источник формальдегида, выбранный из группы, включающей водный раствор формальдегида, 1,3,5-триоксан, параформальдегид и их смеси, в присутствии растворителя, выбранного из группы, включающей воду, алифатические спирты, циклоалифатические спирты и их смеси,и необязательно протонную кислоту с получением -аминокетона формулы и/или соли присоединения протонной кислоты, и(б) восстановление карбонильной группы полученного -аминокетона с получением соединения формулы I и/или соли присоединения протонной кислоты, при этом первую стадию осуществляют при давлении в интервале от 1,5 до 10 бар. 2. Способ по п.1, где соединение формулы V присутствует в количестве, по крайней мере, эквимолярном по отношению к соединению формулы IV. 3. Способ по одному из пп.1, 2, где протонная кислота представляет собой карбоновую или неорганическую кислоту, кислоты предпочтительно выбирают из группы, включающей муравьиную кислоту,уксусную кислоту, пропионовую кислоту, щавелевую кислоту, малоновую кислоту, бензойную кислоту,HF, HCl, HBr, HI, H2SO4 и Н 3 РО 4, однощелочной малонат, щелочные гидросульфаты, щелочные гидрофосфаты и щелочные гидрокарбонаты. 4. Способ по одному из пп.1-3, где алифатические или циклоалифатические спирты выбирают из группы, включающей линейные или разветвленные C1-12 спирты, циклоалифатические C5-8 спирты, дии/или триэтиленгликоли или их моноС 1-4 алкил- или ацетилпроизводные, каждый из указанных спиртов содержит от 1 до 3 гидроксильных групп. 5. Способ по п.4, где спирт выбирают из группы, включающей метанол, этанол, пропанол, изопропиловый спирт, бутанол, изобутанол, трет-бутанол, бутанол-2, пентанол-1, пентанол-2, пентанол-3, гексанол-1, гексанол-2, циклопентанол, циклогексанол, этандиол-1,2, пропандиол-1,2, бутандиол-1,2, бутандиол-2,3, бутандиол-1,4, пропантриол-1,2,3, гексантриол-1,2,6, диэтиленгликоль, монометиловый эфир- 10009394 диэтиленгликоля, моноэтиловый эфир диэтиленгликоля, монобутиловый эфир диэтиленгликоля, моноацетат диэтиленгликоля, триэтиленгликоль, монометиловый эфир триэтиленгликоля, моноэтиловый эфир триэтиленгликоля, монобутиловый эфир триэтиленгликоля и моноацетат триэтиленгликоля. 6. N-монозамещенный -кетоамин формулы и его соли присоединения протонных кислот, где R1 представляет собой фуранил, бензофуранил,тиенил, бензо[b]тиенил и где R2 выбирают из группы, включающей линейный или разветвленный C1-8 алкил, C3-8 циклоалкил. 7. N-монозамещенный -кетоамин формулы и его соли присоединения протонных кислот, где R4 представляет собой метил, этил, изобутил и трет-бутил. 8. 3-(Метиламино)-1-(фуран-2-ил)пропан-1-он формулы и его соли присоединения протонных кислот. 9. 3-(Метиламино)-1-(2-нафтил)пропан-1-он формулы и его соли присоединения протонных кислот. 10. Способ получения N-монозамещенного -кетоамина формулы II и/или его соли присоединения протонных кислот, где R1 и R2 независимо выбирают из группы,включающей линейный или разветвленный С 1-8 алкил, С 3-8 циклоалкил, фенил, нафтил, фуранил, бензофуранил, тиенил, бензо[b]тиенил и арилалкил, где алкильная часть арилалкильного остатка представляет собой линейный С 1-4 алкил, а арильную часть выбирают из группы, включающей фенил, нафтил, фуранил, бензофуранил, тиенил и бензо[b]тиенил, каждый арил или арилалкил может быть необязательно замещен галогеном, линейным или разветвленным С 1-4 алкилом, линейной или разветвленной С 1-4 алкоксигруппой, С 3-6 циклоалкилом, CF3, C2F5, OCF3 или OC2F5, причем способ включает взаимодействие где R1 принимает значения, определенные выше,(2) соединения формулы и/или соли присоединения протонной кислоты, где R2 принимает значения, определенные выше, и(3) формальдегида или источника формальдегида, выбранного из группы, включающей формальдегид в водном растворе, 1,3,5-триоксан, параформальдегид, или их смеси, в присутствии растворителя,выбранного из группы, включающей воду, алифатические спирты, циклоалифатические спирты и их смеси, и необязательно протонной кислоты, с получением соединения формулы и/или солей присоединения протонной кислоты, где R1 и R2 принимают значения, определенные выше, причем реакция протекает при давлении в интервале от 1,5 до 10 бар. 11. Способ по п.10, где соединение формулы V присутствует в количестве не менее эквимолярного- 11009394 по отношению к соединению формулы IV. 12. Способ по одному из пп.10, 11, где протонная кислота представляет собой карбоновую или неорганическую кислоту, кислоты предпочтительно выбирают из группы, включающей муравьиную кислоту, уксусную кислоту, пропионовую кислоту, щавелевую кислоту, малоновую кислоту, бензойную кислоту, HF, HCl, HBr, HI, H2SO4 и Н 3 РО 4, однощелочной малонат, щелочные гидросульфаты, щелочные гидрофосфаты и щелочные гидрокарбонаты. 13. Способ по одному из пп.11, 12, где алифатические или циклоалифатические спирты выбирают из группы, включающей линейные или разветвленные С 1-12 спирты, циклоалифатические С 5-8 спирты, дии/или триэтиленгликоли или их моноС 1-4 алкил или ацетилпроизводные, каждый из указанных спиртов содержит от 1 до 3 гидроксильных групп. 14. Способ по п.13, где спирт выбирают из группы, включающей метанол, этанол, пропанол, изопропиловый спирт, бутанол, изобутанол, трет-бутанол, бутанол-2, пентанол-1, пентанол-2, пентанол-3,гексанол-1, гексанол-2, циклопентанол, циклогексанол, этандиол-1,2, пропандиол-1,2, бутандиол-1,2,бутандиол-2,3, бутандиол-1,4, пропантриол-1,2,3, гексантриол-1,2,6, диэтиленгликоль, монометиловый эфир диэтиленгликоля, моноэтиловый эфир диэтиленгликоля, монобутиловый эфир диэтиленгликоля,моноацетат диэтиленгликоля, триэтиленгликоль, монометиловый эфир триэтиленгликоля, моноэтиловый эфир триэтиленгликоля, монобутиловый эфир триэтиленгликоля и моноацетат триэтиленгликоля.
МПК / Метки
МПК: C07D 333/22, C07C 213/08, C07C 221/00, C07D 307/46, C07C 225/12
Метки: аминоспиртов, n-монозамещённых, beta, способ, получения
Код ссылки
<a href="https://eas.patents.su/14-9394-sposob-polucheniya-n-monozameshhyonnyh-beta-aminospirtov.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения n-монозамещённых β- аминоспиртов</a>


















