Кристаллическое производное пиразола
Формула / Реферат
1. Кристаллическая форма, форма I, 4-[5-(4-фторфенил)-3-(трифторметил)-1Н-пиразол-1-ил]бензолсульфонамида, характеризующаяся порошковой рентгенограммой, включающей пики, выраженные в градусах (+0,1ш) угла-тета: 14,0, 18,9, 21,3, 21,9 и 25,7, полученной с использованием CuKa1 рентгеновского излучения (длина волны=1,5406 Е).
2. Способ превращения формы II, характеризующейся порошковой рентгенограммой, включающей пики, выраженные в градусах (+0,1ш) угла-тета: 4,4, 13,3, 18,0, 22,5 и 27,1, 4-[5-(4-фторфенил)-3-(трифторметил)-1Н-пиразол-1-ил]бензолсульфонамида в кристаллическую форму по п.1, включающий:
(a) смешение суспензии формы II 4-[5-(4-фторфенил)-3-(трифторметил)-1Н-пиразол-1-ил]бензолсульфонамида в соответствующем растворителе при температуре от 0 до 60шС;
(b) перемешивание суспензии при температуре от 0 до 60шС в течение от 24 до 72 ч; и
(с) собирание кристаллов формы I.
3. Способ по п.2, в котором растворитель выбирают из группы, состоящей из воды, метанола, этанола, изопропанола, ацетона, ацетонитрила, метиленхлорида, толуола и тетрагидрофурана и их смесей.
4. Способ превращения кристаллической формы, формы II, 4-[5-(4-фторфенил)-3-(трифторметил)-1Н-пиразол-1-ил]бензолсульфонамида в кристаллическую форму по п.1, включающий:
(a) растворение указанной формы II в смешивающемся с водой растворителе, в котором растворимость формы II, характеризующейся порошковой рентгенограммой, включающей пики, выраженные в градусах (+0,1ш) угла-тета: 4,4, 13,3, 18,0, 22,5 и 27,1, составляет больше чем 2 мг/мл при температуре от 10 до 60шС;
(b) осаждение соединения в результате добавления воды;
(c) перемешивание суспензии стадии ii) в течение от 2 до 72 ч при температуре от 15 до 45шС; и
(d) собирание кристаллов формы I.
5. Способ по п.4, в котором растворитель выбирают из группы, состоящей из этанола, ацетона, ацетонитрила, тетрагидрофурана, диоксана и диметилформамида.
6. Фармацевтическая композиция, которая включает кристаллическую форму по п.1.
7. Фармацевтическая композиция по п.6, которая дополнительно включает фармацевтически приемлемый носитель или наполнитель.
8. Способ предотвращения или лечения состояния воспаления у животных путем введения животному терапевтически эффективного количества кристаллической формы по п.1.
9. Способ по п.8, в котором указанное животное выбирают из группы, состоящей из крупного рогатого скота, овец, коз, лошадей, свиней, птиц, кошек, собак и людей.
10. Применение композиции по п.6 при производстве лекарственного препарата для предотвращения или лечения состояния воспаления у животного.
11. Способ получения кристаллической формы по п.1, включающий стадии:
(a) смешение от 1,0 до 1,6 молей алкилтрифторацетата на моль 4-фторацетофенона, от 1,0 до 1,5 молей алкоксида металла на моль 4-фторацетофенона, и известного количества 4-фторацетофенона с получением смеси;
(b) объединение смеси со стадии (а) с комбинацией от 415 до 1245 мл воды на моль 4-фторацетофенона, от 1,1 до 2,0 молей концентрированной хлористо-водородной кислоты на моль 4-фторацетофенона, от 0,8 до 1,2 молей 4-сульфонамидфенилгидразин гидрохлорида на моль 4-фторацетофенона, и количества соответствующего растворителя таким образом, чтобы суммарное количество растворителя в смеси составляло от 550 до 1660 мл на моль 4-фторацетофенона;
(c) добавление к смеси количества затравки кристаллов формы I 4-[5-(4-фторфенил)-3-(трифторметил)-1Н-пиразол-1-ил]бензолсульфонамида в расчете на 4-фторацетофенон;
(d) собирание кристаллов формы I.
12. Способ по п.11, дополнительно включающий добавление на стадии (а) к смеси до 1380 мл соответствующего растворителя на моль 4-фторацетофенона.
13. Способ по п.12, в котором спиртом является 2-пропанол.
14. Способ по п.11, в котором алкоксид металла выбирают из группы, состоящей из метоксида натрия, этоксида натрия, изопропоксида натрия, третичного бутоксида натрия, метоксида лития, этоксида лития, изопропоксида лития, третичного бутоксида лития, метоксида калия, этоксида калия, изопропоксида калия и тритичного бутоксида калия и их смесей.
15. Способ по п.14, в котором алкоксидом металла является метоксид натрия.
16. Способ по п.11, дополнительно включающий стадию, следующую за стадией (а), содержащую нагревание смеси при температуре выше температуры окружающей среды до температуры кипения с обратным холодильником до момента окончания реакции.
17. Способ по п.16, дополнительно включающий стадию, следующую за стадией нагревания, содержащую охлаждение смеси до температуры от -5 до 30шС.
18. Способ по п.11, в котором стадия (b) включает добавление смеси к комбинации воды, хлористо-водородной кислоты, 4-сульфонамидофенилгидразин гидрохлорида.
19. Способ по п.11, в котором растворителем стадии (b) является спирт.
20. Способ по п.19, в котором спиртом является 2-пропанол.
21. Способ по п.11, дополнительно включающий стадию, следующую за стадией (b), содержащую нагревание смеси при температурах выше температуры окружающей среды до температуры кипения с обратным холодильником до момента окончания реакции.
22. Способ по п.21, дополнительно включающий стадию, следующую за стадией нагревания, содержащую стабилизацию смеси при температуре от температуры окружающей среды до температуры 71,5шС.
23. Способ по п.11, в котором количество затравки составляет от 0,0001 до 50 мас.%.
24. Способ по п.23, в котором количество затравки составляет от 0,001 до 5 мас.%.
25. Способ по п.23, в котором количество затравки составляет от 0,01 до 0,5 мас.%.
26. Способ по п.11, дополнительно включающий стадию, следующую за стадией (с), содержащую нагревание смеси при температуре от 40шС до менее чем 71,5шС в течение от 1 до 10 ч.
27. Способ по п.26, дополнительно включающий стадию, следующую за стадией нагревания, содержащую охлаждение смеси до температуры от -5 до 30шС.
28. Способ по п.11, дополнительно включающий стадию, следующую за стадией (с), содержащую фильтрацию смеси и промывку кристаллов формы I соответствующим растворителем или водой или их смесью.
29. Способ по п.28, в котором растворителем является спирт.
30. Способ по п.29, в котором спиртом является 2-пропанол.
31. Способ по п.11, дополнительно включающий стадию, следующую за стадией (d), содержащую сушку кристаллов формы I при температуре от 15 до 80шС.
32. Способ получения кристаллической формы по п.1, включающий стадии:
(a) смешение от 1,2 до 1,45 молей алкилтрифторацетата на моль 4-фторацетофенона, от 1,1 до 1,35 молей алкоксида металла на моль 4-фторацетофенона и известного количества 4-фторацетофенона с получением смеси;
(b) объединение смеси со стадии (а) с комбинацией от 650 до 870 мл воды на моль 4-фторацетофенона, от 1,2 до 1,7 молей концентрированной хлористо-водородной кислоты на моль 4-фторацетофенона, от 0,9 до 1,1 молей 4-сульфонамидофенилгидразин гидрохлорида на моль 4-фторацетофенона, и количества соответствующего растворителя таким образом, чтобы суммарное количество растворителя в смеси составляло от 600 до 1000 мл на моль 4-фторацетофенона;
(c) добавление к смеси количество затравки кристаллов формы I 4-[5-(4-фторфенил)-3-(трифторметил)-1Н-пиразол-1-ил]бензолсульфонамида в расчете на 4-фторацетофенон;
(d) собирание кристаллов формы I.
33. Способ по п.32, дополнительно включающий добавление на стадии (а) к смеси до 900 мл соответствующего растворителя на моль 4-фторацетофенона.
34. Способ по п.33, в котором спиртом является 2-пропанол.
35. Способ по п.32, в котором алкоксид металла выбирают из группы, состоящей из метоксида натрия, этоксида натрия, изопропоксида натрия, третичного бутоксида натрия, метоксида лития, этоксида лития, изопропоксида лития, третичного бутоксида лития, метоксида калия, этоксида калия, изопропоксида калия и тритичного бутоксида калия и их смесей.
36. Способ по п.35, в котором алкоксидом металла является метоксид натрия.
37. Способ по п.32, дополнительно включающий стадию, следующую за стадией (а), содержащую нагревание смеси при температуре выше температуры окружающей среды до температуры кипения с обратным холодильником до момента окончания реакции.
38. Способ по п.37, дополнительно включающий стадию, следующую за стадией нагревания, содержащую охлаждение смеси до температуры окружающей среды.
39. Способ по п.32, в котором стадия (b) включает добавление смеси к комбинации воды, хлористо-водородной кислоты, 4-сульфонамидофенилгидразин гидрохлорида.
40. Способ по п.32, в котором растворителем стадии (b) является спирт.
41. Способ по п.40, в котором спиртом является 2-пропанол.
42. Способ по п.32, дополнительно включающий стадию, следующую за стадией (b), содержащую нагревание смеси при температурах выше температуры окружающей среды до температуры кипения с обратным холодильником до момента окончания реакции.
43. Способ по п.42, дополнительно включающий стадию, следующую за стадией нагревания, содержащую стабилизацию смеси при температуре от 40 до 65шС.
44. Способ по п.33, в котором количество затравки составляет от 0,0001 до 50 мас.%.
45. Способ по п.44, в котором количество затравки составляет от 0,001 до 5 мас.%.
46. Способ по п.44, в котором количество затравки составляет от 0,01 до 0,5 мас.%.
47. Способ по п.32, дополнительно включающий стадию, следующую за стадией (с), содержащую нагревание смеси при температуре от 50 до менее чем 71,5шС в течение от 3 до 8 ч.
48. Способ по п.47, дополнительно включающий стадию, следующую за стадией нагревания, содержащую охлаждение смеси до температуры окружающей среды.
49. Способ по п.32, дополнительно включающий стадию, следующую за стадией (с), содержащую фильтрацию смеси, и промывку кристаллов формы I соответствующим растворителем, или водой, или их смесью.
50. Способ по п.49, в котором растворителем является спирт.
51. Способ по п.50, в котором спиртом является 2-пропанол.
52. Способ по п.32, дополнительно включающий стадию, следующую за стадией (d), содержащую сушку кристаллов формы I при температуре от 30 до 65шС.
Текст
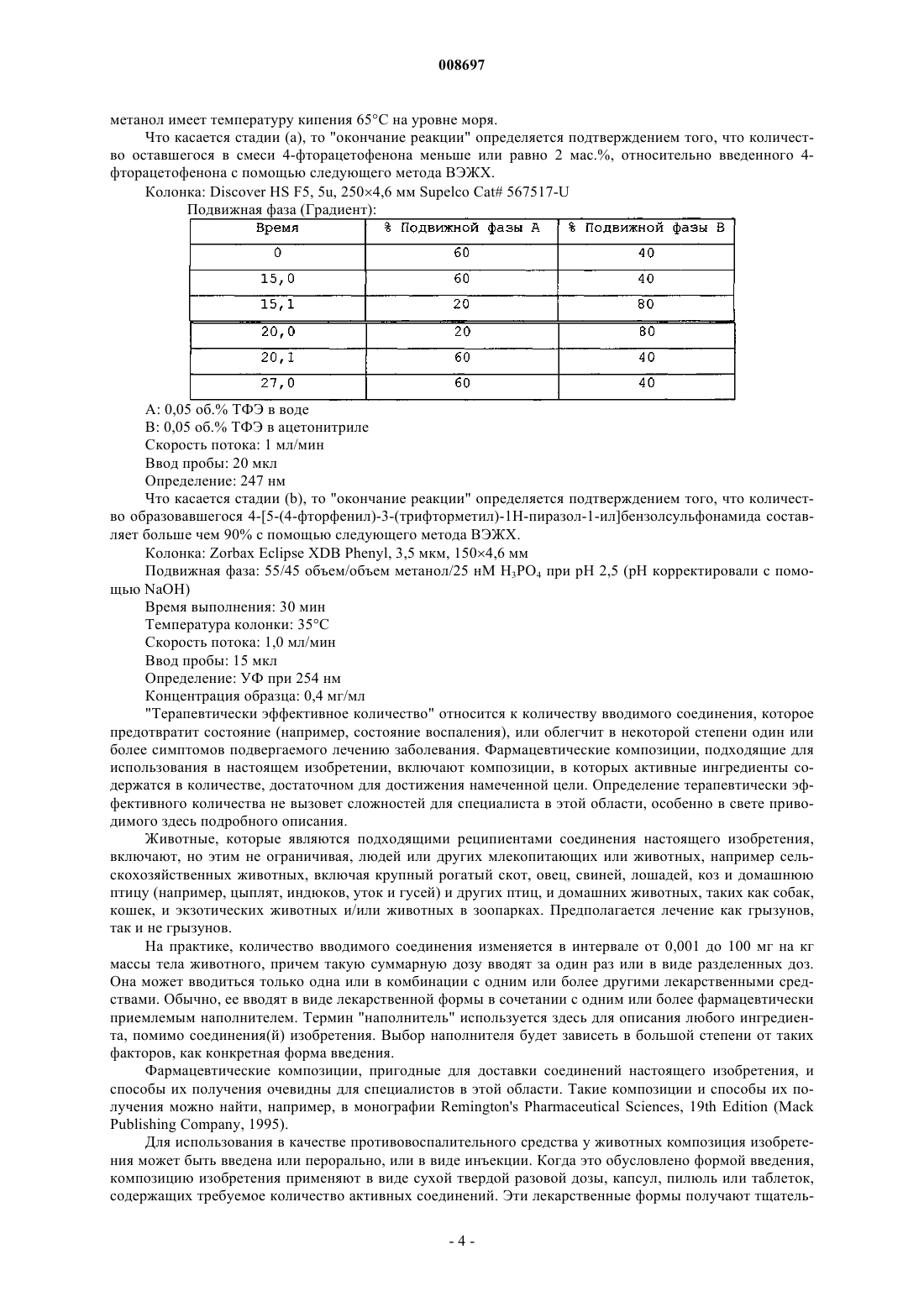
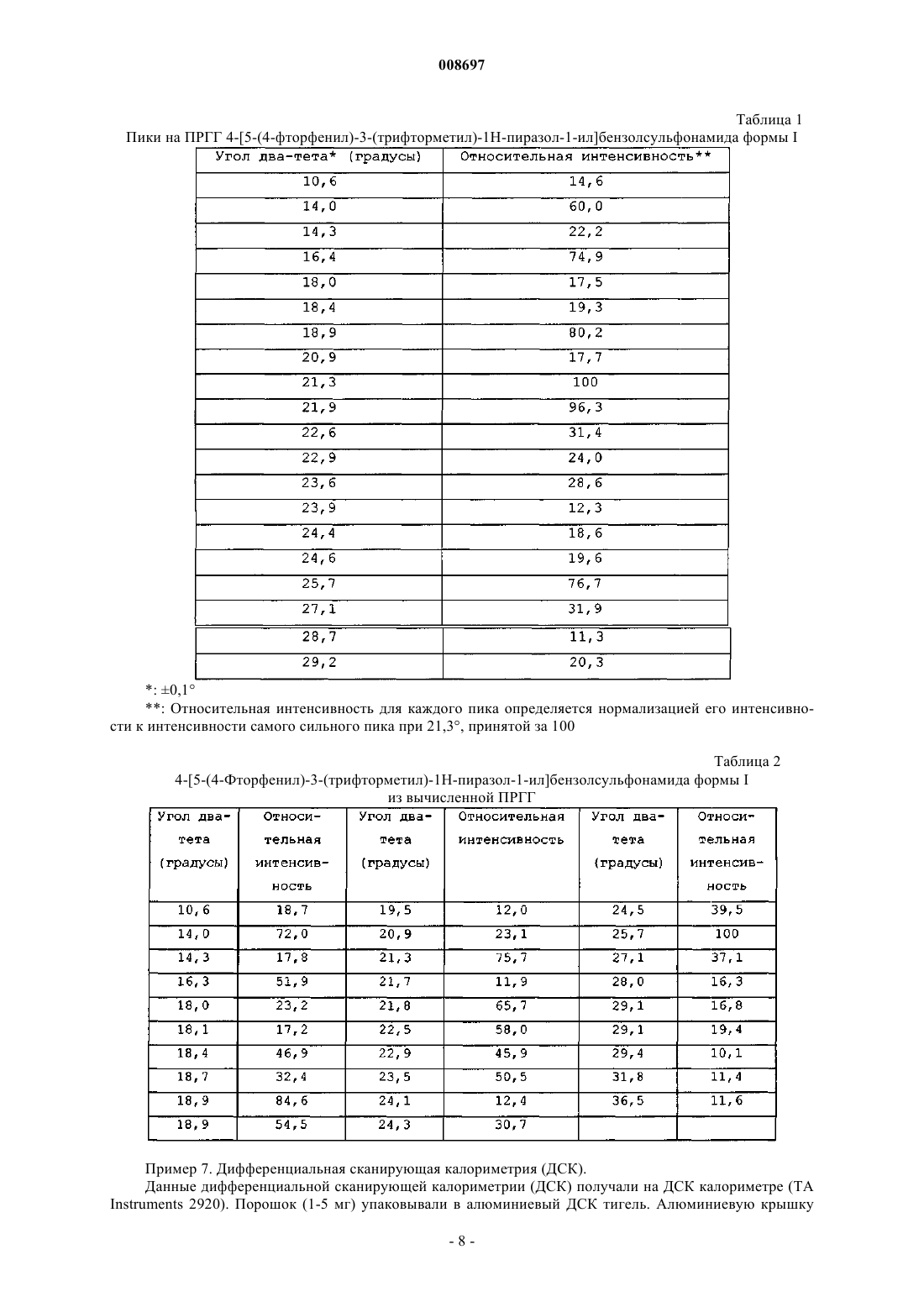
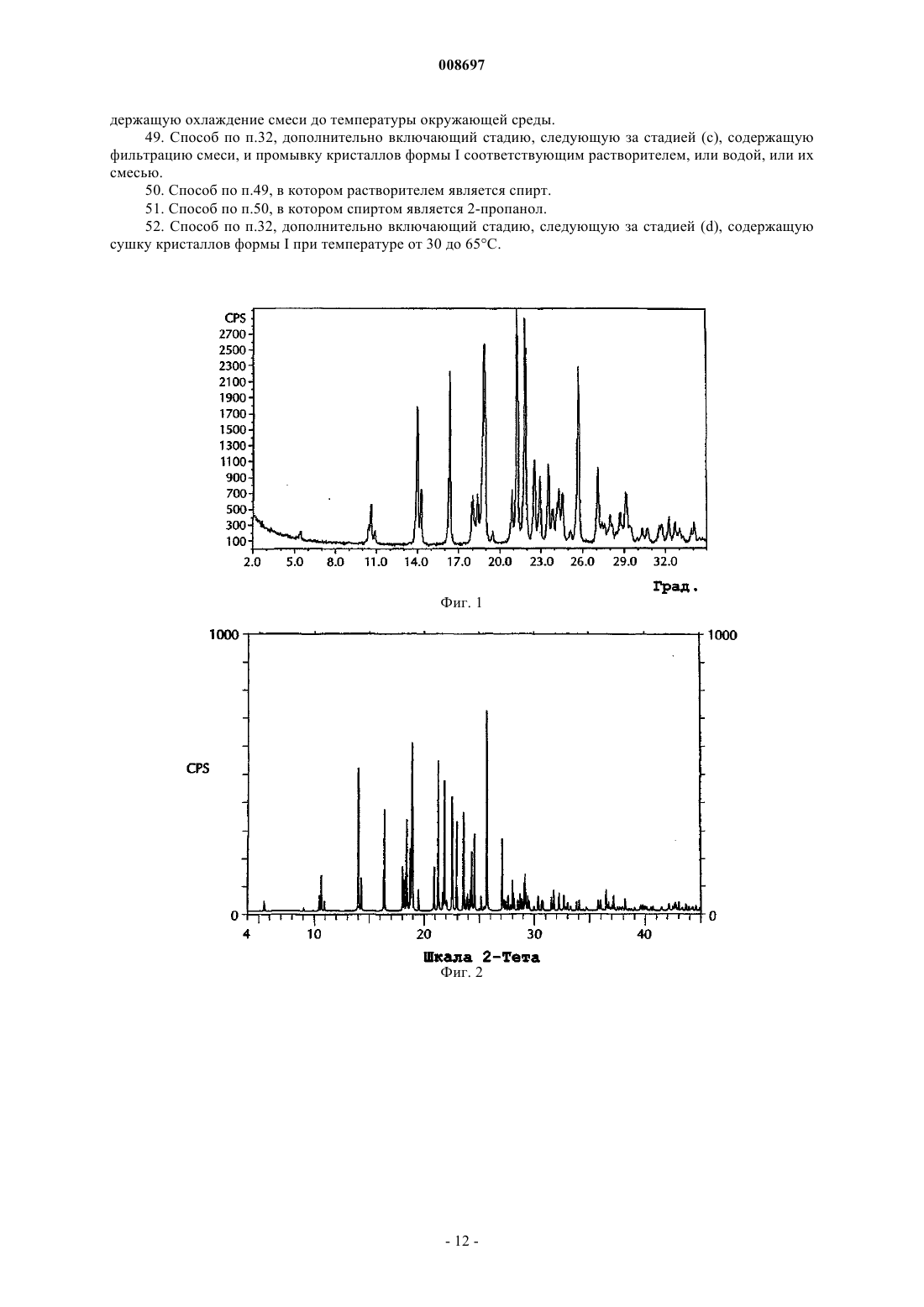
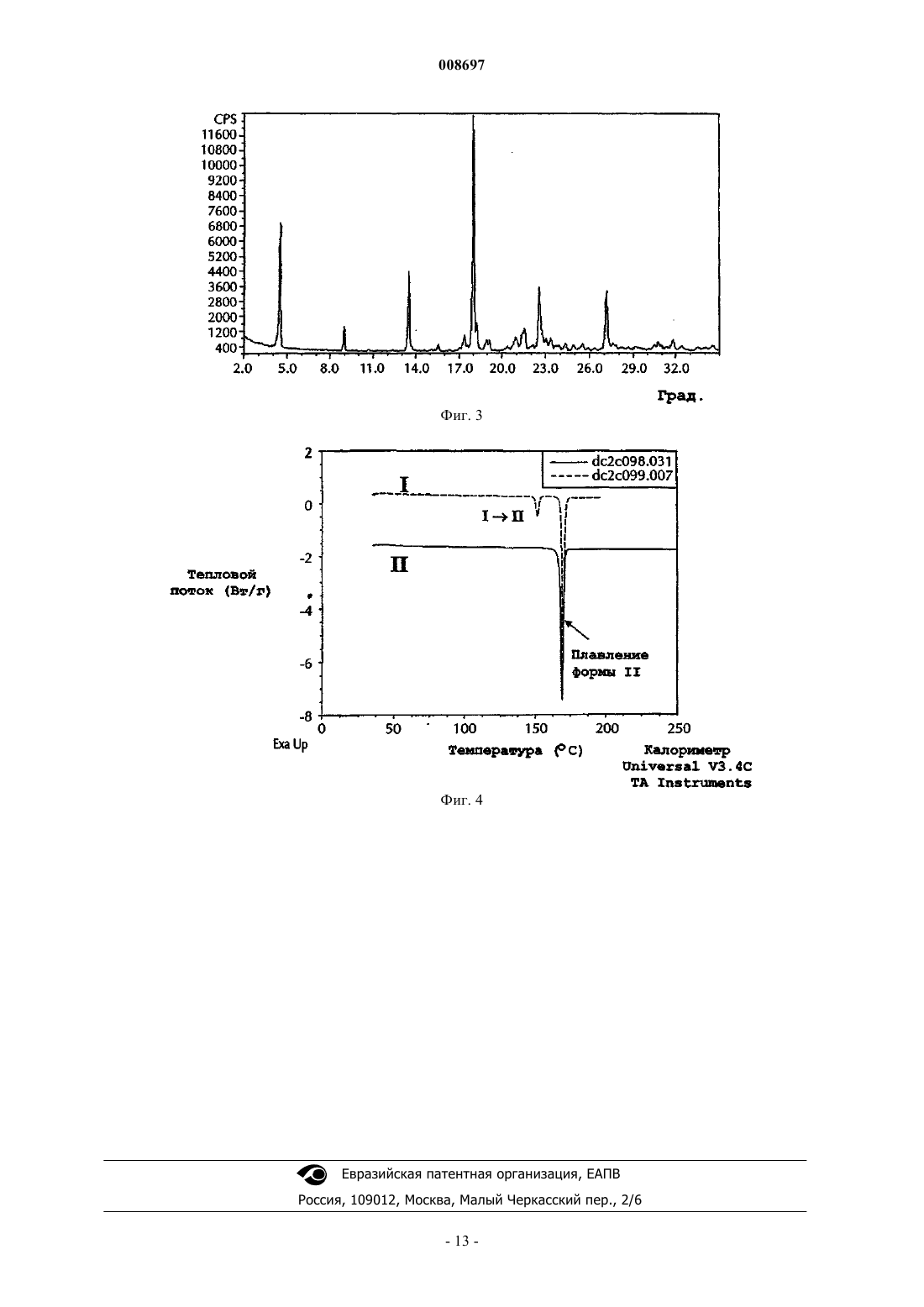
008697 Область техники, к которой относится изобретение Настоящее изобретение относится к кристаллическим формам 4-[5-(4-фторфенил)-3(трифторметил)-1 Н-пиразол-1-ил]бензолсульфонамида и способам получения, взаимного превращения, и выделения таких кристаллов. Уровень техники 5-Фенилпиразолил-1-бензолсульфонамиды относится к новому классу синтетических соединений с высокой СОХ-2 ингибиторной активностью, применяемых для лечения артрита и других состояний, связанных с воспалением. 4-[5-(4-Фторфенил)-3-(трифторметил)-1 Н-пиразол-1-ил]бензолсульфонамид является 5-фенилпиразолил-1-бензолсульфонамидом, имеющим следующее строение: Формула I Соединение формулы I раскрыто в Патентах США 5466823 (Tally et.al.) и 5521207 (Graneto). Содержание этих патентов приводится в качестве ссылки. Несмотря на то, что получение соединений формулы I раскрыто, в описании ничего не говорится о его выделении и его кристаллических формах. Поэтому необходимо знать полиморфное поведение соединения для разработки стабильных способов его получения, исключения проблем при таблетировании,разрушения таблетки, роста кристаллов в суспензиях и происходящего в результате концентрирования,осаждения из суспензий, так же как и таких проблем химического производства, как фильтруемость, и обеспечения аналитической воспроизводимости (см. Analysis of Organic Polymorphs, A Review; Threlfall,T.L., Analyst, 120, pp. 2435-2459). Сущность изобретения В одном аспекте настоящее изобретение предлагает кристаллическую форму I 4-[5-(4-фторфенил)3-(трифторметил)-1 Н-пиразол-1-ил]бензолсульфонамида, характеризующуюся порошковой рентгенограммой, включающей пики, выраженные в градусах (0,1) угла два тета, 14,0, 18,9, 21,3, 21,9 и 25,7,полученной с помощью CuK1 рентгеновского излучения (длина волны=1,5406 ). В другом аспекте изобретения предлагается способ для превращения кристаллической формы II 4-[5-(4-фторфенил)-3(трифторметил)-1 Н-пиразол-1-ил]бензолсульфонамида в кристаллическую форму I, включающий: i) смешение суспензии формы II 4-[5-(4-фторфенил)-3-(трифторметил)-1 Н-пиразол-1-ил]бензолсульфонамида в соответствующем растворителе при температуре от 0 до 60 С; ii) перемешивание суспензии при температуре от 0 до 60 С в течение от 24 до 72 ч; и iii) собирание кристаллов формы I. В другом аспекте изобретения растворитель в указанном способе выбирают из группы, состоящей из воды, метанола,этанола, изопропанола, ацетона, ацетонитрила, метиленхлорида, толуола и тетрагидрофурана и их смесей. Дополнительным аспектом изобретения является способ превращения кристаллической формы II 4[5-(4-фторфенил)-3-(трифторметил)-1 Н-пиразол-1-ил]бензолсульфонамида в кристаллическую форму I,включающий: (i) растворение указанной формы II в смешивающимся с водой растворителе, в котором растворимость формы II больше чем 2 мг/мл при температуре от 10 до 60 С; (ii) осаждение соединения добавлением воды; (iii) перемешивание суспензии со стадии (ii) от 2 до 72 ч при температуре от 15 до 45 С; и (iv) собирание кристаллов формы I. В другом аспекте изобретения растворитель для этого способа выбирают из группы, состоящей из этанола, ацетона, ацетонитрила, тетрагидрофурана, диоксана и диметилформамида. В дополнительном аспекте изобретение предлагает фармацевтическую композицию, которая включает соединение формулы I кристаллической формы I. В другом аспекте изобретения фармацевтическая композиция дополнительно включает фармацевтически приемлемый носитель или наполнитель. Еще одной целью настоящего изобретения является разработка способа предотвращения или лечения воспалительных состояний у животных использованием терапевтически эффективного количества новой композиции настоящего изобретения. Дополнительной целью настоящего изобретения является использование новой композиции настоящего изобретения в производстве лекарственного средства для предотвращения или лечения воспалительных состояний у животных. Дополнительной целью изобретения является получение кристаллической формы I 4-[5-(4 фторфенил)-3-(трифторметил)-1 Н-пиразол-1-ил]бензолсульфонамида в результате: стадии (а) смешения от 1,0 до 1,6 молей, или предпочтительно от 1,2 до 1,45 молей, или более предпочтительно от 1,25 до 1,35 молей, алкилтрифторацетата на моль 4-фторацетофенона с от 1,0 до 1,5 молей, или предпочтительно от 1,1 до 1,35 молей, или более предпочтительно от 1,15 до 1,25 молей, алкок-1 008697 сида металла на моль 4-фторацетофенона, и известного количества 4-фторацетона с получением смеси. На этой стадии необязательно добавляют до 1380 мл, или предпочтительно до 900 мл, или более предпочтительно до 490 мл соответствующего растворителя, предпочтительно 2-пропанола. Смесь стадии (а) необязательно нагревают с обратным холодильником при температуре от температуры выше окружающей среды до температуры кипения, или предпочтительно при температуре от 40 до 70 С, или более предпочтительно от 50 до 60 С, от 1 до 24 ч, или предпочтительно от 1 до 10 ч, или более предпочтительно от 1 до 4 ч, или более предпочтительно до тех пор, пока не закончится реакция. После такого нагревания необязательно, чтобы смесь затем охлаждали до температуры от -5 до 30 С, или более предпочтительно до температуры окружающей среды; стадии (b), на которой смесь со стадии (а) объединяют с или предпочтительно добавляют к комбинации от 415 до 1245 мл, или предпочтительно от 650 до 870 мл, или более предпочтительно от 725 до 795 мл воды на моль 4-фторацетофенона, плюс от 1,1 до 2,0 молей, или предпочтительно от 1,2 до 1,7 молей, или более предпочтительно от 1,3 до 1,5 молей концентрированной соляной кислоты на моль 4 фторацетофенона, плюс от 0,8 до 1,2 молей, или предпочтительно от 0,9 до 1,1 молей, или более предпочтительно от 0,95 до 1,05 молей 4-сульфоноамидофенилгидразин гидрохлорида на моль 4 фторацетофенона, и количество соответствующего растворителя, предпочтительно C1-С 6 спирт, или более предпочтительно 2-пропанол, так чтобы суммарное количество растворителя в смеси составляло от 550 до 1660 мл, или предпочтительно от 600 до 1000 мл, или более предпочтительно от 650 до 750 мл на моль 4-фторацетофенона. Смесь стадии (b) необязательно нагревают с обратным холодильником при температуре от температуры выше окружающей среды до температуры кипения, или предпочтительно при температуре от 40 до 70 С, или более предпочтительно от 50 до 60 С, от 1 до 24 ч, или предпочтительно от 1 до 10 ч, или более предпочтительно от 1 до 4 ч, или более предпочтительно до тех пор, пока не закончится реакция. После такого нагревания необязательно, чтобы смесь затем стабилизировали при температуре окружающей среды от 71 С, или от 40 до 65 С, или более предпочтительно от 50 до 60 С; стадии (с), на которой затем добавляют к смеси количество затравки, или предпочтительно от 0,0001 до 50 мас.%, или более предпочтительно от 0,001 до 5 мас.%, или более предпочтительно от 0,01 до 0,5 мас.%, кристаллов формы I 4-[5-(4-фторфенил)-3-(трифторметил)-1 Н-пиразол-1-ил]бензолсульфонамида по отношению к 4-фторацетофенону. Смесь стадии (с) необязательно нагревают при температуре от 40 до менее чем 71,5 С, или предпочтительно от 50 до менее чем 71,5 С, или более предпочтительно при температуре от 50 до 60 С, от 1 до 10 ч, или предпочтительно от 3 до 8 ч, или более предпочтительно от 5 до 7 ч. После такого нагревания смесь затем необязательно охлаждают до температуры от -5 до 30 С, или более предпочтительно до температуры окружающей среды. Смесь необязательно фильтруют и промывают соответствующим растворителем, предпочтительно спиртом, более предпочтительно 2-пропанолом, или водой или их смесью. Количество растворителя необязательно составляет от 300 до 1500 мл, или предпочтительно от 600 до 1060 мл, или более предпочтительно от 800 до 860 мл, на моль 4-фторацетофенона, и количество воды составляет от 100 до 700 мл, или предпочтительно от 285 до 545 мл, или более предпочтительно от 385 до 445 мл, на моль 4-фторацетофенона; стадии (d), на которой затем собирают кристаллы формы I. Кристаллы формы I необязательно сушат при температуре от 15 до 80 С, или предпочтительно от 30 до 65 С, более предпочтительно от 50 до 60 С. В другом аспекте изобретения алкоксид металла стадии (а) выбирают из группы, состоящей из метоксида натрия, этоксида натрия, изопропоксида натрия, третичного бутоксида натрия, метоксида лития,этоксида лития, изопропоксида лития, третичного бутоксида лития, метоксида калия, этоксида калия,изопропоксида калия и тритичного бутоксида калия и их смесей, или предпочтительно из метоксида натрия. Эти и другие цели очевидны для специалистов в этой области. Краткое описание чертежей На фиг. 1 представлена полученная порошковая рентгенограмма (ПРГГ) формы I 4-[5-(4-фторфенил)-3-(трифторметил)-1 Н-пиразол-1-ил]бензолсульфонамида. На фиг. 2 представлена вычисленная порошковая рентгенограмма (ПРГГ) формы I 4-[5-(4 фторфенил)-3-(трифторметил)-1 Н-пиразол-1-ил]бензолсульфонамида. На фиг. 3 представлена порошковая рентгенограмма (ПРГГ) формы II 4-[5-(4-фторфенил)-3(трифторметил)-1 Н-пиразол-1-ил]бензолсульфонамида. На фиг. 4 представлены данные дифференциальной сканирующей калориметрии (ДСК) форм I и II 4-[5-(4-фторфенил)-3-(трифторметил)-1 Н-пиразол-1-ил]бензолсульфонамида. Подробное описание изобретения Селективный СОХ-2 ингибитор 4-[5-(4-фторфенил)-3-(трифторметил)-1 Н-пиразол-1-ил]бензолсульфонамид Формула I был описан в Патентах США 5466823 и 5521207. Описание раскрывает синтез соединения, но в нем ничего не говорится о кристаллической форме, в которой его получают. В примерах описано, что следующая методика, представленная в этих патентах, приводит к кристаллической форме II, образование которой подтверждали порошковой рентгенограммой (ПРГГ). Авторы изобретения обнаружили, что эта кристаллическая форма является нестабильной по отношению к другой форме, форме I, при температуре окружающей среды и давлении. Формы можно различить по их ПРГГ (порошковым рентгенограммам). Определения В настоящем изобретении "смешивающийся с водой" означает способный смешиваться с водой и растворяться в воде в любых пропорциях. В настоящем изобретении "безводный кристаллический" относится к кристаллу, который не содержит существенных количеств воды. Содержание воды может определяться известными в технике методами, включающими, например, титрование по Фишеру. Предпочтительно, чтобы безводная кристаллическая форма содержала не больше 1 мас.% воды, более предпочтительно не больше 0,5 мас.% воды, и более предпочтительно не больше 0,1 мас.% воды. В настоящем изобретении "стабильное" при испытании на стабильность нерасфасованного лекарственного средства означает, что по меньшей мере около 90 мас.%, предпочтительно по меньшей мере около 95 мас.% и более предпочтительно около 99 мас.% нерасфасованного лекарственного средства остается неизменным после хранения в рекомендуемых условиях в течение рекомендуемого времени."ДСК" означает дифференциальную сканирующую калориметрию. Термин "алкил", если не указано иначе, когда он используется или один, или с другими терминами,такими так "трифторацетат", охватывает линейный или разветвленный алкил, имеющий от одного до четырех углеродных атомов, или предпочтительно два углеродных атома. Неограничивающие примеры включают такие группы, как метил, этил, н-пропил, изопропил, н-бутил, т-бутил, изобутил и втор-бутил."Алкоксиды металлов" являются солями металлов со спиртом. Обычно, алкоксиды металлов содержат в качестве металла натрий, литий или калий. В этом изобретении они используются в форме спиртового раствора. Обычно, спирт соответствует спирту алкоксида. Неограничивающие примеры алкоксидов металлов включают метоксид натрия, этоксид натрия, изопропоксид натрия, третичный бутоксид натрия, метоксид лития, этоксид лития, изопропоксид лития, третичный бутоксид лития, метоксид калия, этоксид калия, изопропоксид калия, третичный бутоксид калия и их смеси. Затравка является методом использования одного или более кристаллов для образования большего количества кристаллов из смеси, раствора или суспензии. Количество затравки является количеством вещества, которое при введении в смесь, раствор или суспензию способно вызвать образование требуемой формы соединения. Согласно теории это количество может быть очень маленьким, но на практике используют большее количество. Это количество может быть любым приемлемым с точки зрения использования количеством и является достаточным для инициирования образования требуемой формы соединения. В качестве неограничивающего примера количества от 0,0001 до 50 мас.% соединения для затравки на основе рассматриваемого соединения могут быть использованы. Термин "С" при использовании в отношении температуры означает градусы Цельсия."Температура окружающей среды" является температурой воздуха вокруг объекта. Это температура внутри комнаты, которая обычно составляет от 15 до 25 С. Способ кипячения с обратным холодильником используется в химии для подвода тепла к реакциям в течение длительного периода времени. Согласно этому способу жидкую реакционную смесь помещают в сосуд, открытый только сверху. Этот сосуд соединяют с вертикальным холодильником, так что любые выделяемые пары конденсируются опять в жидкость и возвращаются назад в реакционный сосуд. Затем сосуд сильно нагревают в процессе проведения реакции. Преимущество этого способа заключается в том, что сосуд можно оставлять в течение длительного периода времени без необходимости добавлять дополнительно растворитель или опасения, что жидкость в реакционном сосуде выкипит досуха. Кроме того, так как данный растворитель будет всегда кипеть при конкретной температуре, реакция будет осуществляться при этой же температуре. Так как различные растворители кипят при различных температурах, за счет тщательного выбора растворителя можно регулировать температуру реакции. "Температура кипячения с обратным холодильником" относится здесь к температуре, при которой кипит конкретный растворитель при использовании этого способа. Например, 2-пропанол имеет температуру кипения 82 С;-3 008697 метанол имеет температуру кипения 65 С на уровне моря. Что касается стадии (а), то "окончание реакции" определяется подтверждением того, что количество оставшегося в смеси 4-фторацетофенона меньше или равно 2 мас.%, относительно введенного 4 фторацетофенона с помощью следующего метода ВЭЖХ. Колонка: Discover HS F5, 5u, 2504,6 мм Supelco Cat 567517-U Подвижная фаза (Градиент): А: 0,05 об.% ТФЭ в воде В: 0,05 об.% ТФЭ в ацетонитриле Скорость потока: 1 мл/мин Ввод пробы: 20 мкл Определение: 247 нм Что касается стадии (b), то "окончание реакции" определяется подтверждением того, что количество образовавшегося 4-[5-(4-фторфенил)-3-(трифторметил)-1 Н-пиразол-1-ил]бензолсульфонамида составляет больше чем 90% с помощью следующего метода ВЭЖХ. Колонка: Zorbax Eclipse XDB Phenyl, 3,5 мкм, 1504,6 мм Подвижная фаза: 55/45 объем/объем метанол/25 нМ Н 3 РО 4 при рН 2,5 (рН корректировали с помощью NaOH) Время выполнения: 30 мин Температура колонки: 35 С Скорость потока: 1,0 мл/мин Ввод пробы: 15 мкл Определение: УФ при 254 нм Концентрация образца: 0,4 мг/мл"Терапевтически эффективное количество" относится к количеству вводимого соединения, которое предотвратит состояние (например, состояние воспаления), или облегчит в некоторой степени один или более симптомов подвергаемого лечению заболевания. Фармацевтические композиции, подходящие для использования в настоящем изобретении, включают композиции, в которых активные ингредиенты содержатся в количестве, достаточном для достижения намеченной цели. Определение терапевтически эффективного количества не вызовет сложностей для специалиста в этой области, особенно в свете приводимого здесь подробного описания. Животные, которые являются подходящими реципиентами соединения настоящего изобретения,включают, но этим не ограничивая, людей или других млекопитающих или животных, например сельскохозяйственных животных, включая крупный рогатый скот, овец, свиней, лошадей, коз и домашнюю птицу (например, цыплят, индюков, уток и гусей) и других птиц, и домашних животных, таких как собак,кошек, и экзотических животных и/или животных в зоопарках. Предполагается лечение как грызунов,так и не грызунов. На практике, количество вводимого соединения изменяется в интервале от 0,001 до 100 мг на кг массы тела животного, причем такую суммарную дозу вводят за один раз или в виде разделенных доз. Она может вводиться только одна или в комбинации с одним или более другими лекарственными средствами. Обычно, ее вводят в виде лекарственной формы в сочетании с одним или более фармацевтически приемлемым наполнителем. Термин "наполнитель" используется здесь для описания любого ингредиента, помимо соединения(й) изобретения. Выбор наполнителя будет зависеть в большой степени от таких факторов, как конкретная форма введения. Фармацевтические композиции, пригодные для доставки соединений настоящего изобретения, и способы их получения очевидны для специалистов в этой области. Такие композиции и способы их получения можно найти, например, в монографии Remington's Pharmaceutical Sciences, 19th Edition (MackPublishing Company, 1995). Для использования в качестве противовоспалительного средства у животных композиция изобретения может быть введена или перорально, или в виде инъекции. Когда это обусловлено формой введения,композицию изобретения применяют в виде сухой твердой разовой дозы, капсул, пилюль или таблеток,содержащих требуемое количество активных соединений. Эти лекарственные формы получают тщатель-4 008697 ным и равномерным смешением активного ингредиента с соответствующими такими тонко измельченными разбавителями, как крахмал, лактоза, тальк, стеарат магния, растительными смолами, и другими аналогичными веществами. Такие формы разовых доз могут различаться в широких пределах с точки зрения их суммарной массы и содержания противовоспалительного средства в зависимости от таких факторов, как вид подвергаемого лечению животного, тяжесть и тип воспаления, и масса животного. Подбор композиции таблеток обсуждается в монографии Pharmaceutical Dosage Forms: Tablets, Vol. 1, byH. Lieberman and L.Lachman (Marcel Dekker, New York, 1980). Альтернативно, противовоспалительные композиции настоящего изобретения могут быть введены животным парентерально, например, инъекцией внутрь рубца, внутримышечной или подкожной инъекцией, при которой активные ингредиенты растворены или диспергированы в жидком носителе. Для парентерального введения активные материалы удобно смешивать с соответствующим носителем, предпочтительно различными видами растительных масел, таких как арахисовое масло, хлопковое масло, и другими подобными. Другие парентеральные носители, такие как органические препараты, использующие солкеталь, пропиленгликоль, глицериновый формаль, и водные парентеральные формы также используют, часто в комбинации с различными пропорциями. Активное соединение или соединения растворяют или суспендируют в парентеральной форме введения; такие формы обычно содержат от 0,005 до 5 мас.% активного соединения. Подробное описание изобретения В следующем описании изобретения описаны конкретные варианты осуществления, в которых изобретение может быть применено. Эти варианты осуществления описаны достаточно подробно, чтобы специалист в этой области мог применить изобретение на практике. Могут быть использованы и другие варианты осуществления, и логические и другие изменения могут быть сделаны без отклонения от объема изобретения. Поэтому, следующее подробное описание не следует рассматривать как ограничение, и объем изобретения определяется только прилагаемой формулой изобретения, наряду с полным объемом аналогий, для которых такая формула изобретения правомочна. Форма II является кристаллической формой, полученной по методике, описанной в патенте США 5466823. Способы получения кристаллической формы I представлены в следующих неограничивающих описаниях и примерах. В одном способе 4-[5-(4-фторфенил)-3-(трифторметил)-1 Н-пиразол-1-ил]бензолсульфонамид кристаллической формы II может быть суспендирован и смешан в соответствующем растворителе, в котором концентрация лекарственного средства выше, чем его предельная растворимость, при температуре от 0 до 60 С. Подходящим растворителем является один из тех, в котором растворимость лекарственного средства выше чем 1 мг/мл и меньше чем 800 мг/мл. Примеры подходящих растворителей включают, но этим не ограничивая, воду, метанол, этанол, изопропанол, ацетон, ацетонитрил, метиленхлорид, толуол,и тетрагидрофуран и их смеси. Суспензию перемешивают при температуре от 0 до 60 С в течение от 24 до 72 ч. Кристаллы формы I собирают фильтрацией. В другой методике кристаллическая форма I может быть получена из раствора 4-[5-(4-фторфенил)3-(трифторметил)-1 Н-пиразол-1-ил]бензолсульфонамида в соответствующем смешивающемся с водой растворителе, в котором растворимость соединения выше чем 2 мг/мл, добавлением воды при температуре от 10 до 60 С. Примеры подходящих растворителей для получения формы I из формы II включают этанол, ацетон, ацетонитрил, тетрагидрофуран, диоксан и диметилформамид. Вслед за исходным осаждением при помощи воды суспензию перемешивают в течение от 24 до 72 ч при температуре от 15 до 45 С, и форму I кристаллов собирают фильтрацией. Приготовление 1. Приготовление 4-[5-(4-фторфенил)-3-(трифторметил)-1 Н-пиразол-1-ил]бензолсульфонамида формы II. Следующая методика является в основном идентичной методике примера 1 Патента США 5521207 с непринципиальным изменением, связанным с использованием 4-фторацетофенона вместо 4-хлорацетофенона в качестве исходного реагента. Стадия 1. Приготовление 4,4,4-трифтор-1-[4-(фтор)фенил]бутан-1,3-диона. Этилтрифторацетат (2,35 г, 1,66 ммоль) помещали в 50 мл круглодонную колбу, и растворяли в метил-трет-бутиловом эфире (7,5 мл). К перемешиваемому раствору добавляли 25 мас.% метоксида натрия(4,0 мл, 17,7 ммоль) через капельную воронку в течение 2 мин. Далее растворяли 4-фторацетофенон (2,1 г, 15 ммоль) в метил-трет-бутиловом эфире (2 мл) и добавляли по каплям в реакционную среду в течение 5 мин. После перемешивания в течение ночи (15,75 ч) добавляли 3N НСl (7,0 мл). Органические слои собирали, промывали рассолом, сушили над MgSO4, фильтровали и концентрировали под вакуумом с получением 3,2 г бледно-оранжевого твердого вещества. Твердое вещество перекристаллизовывали из изооктана с получением 2,05 г диона. Стадия 2. Приготовление 4-[5-(4-фторфенил)-3-(трифторметил)-1 Н-пиразол-1-ил]бензолсульфонамида. 4-Сульфонамидофенилгидразин гидрохлорид (982 мг, 4,4 ммоль) добавляли к перемешиваемому раствору 4,4,4-трифтор-1-[4-(фтор)фенил]бутан-1,3-диона (0,936 г, 4,0 ммоль) в этаноле (50 мл). Реакционную смесь кипятили с обратным холодильником и перемешивали в течение 20 ч. После охлаждения до-5 008697 комнатной температуры реакционную смесь концентрировали под вакуумом. Остаток переносили в этилацетат и промывали водой и рассолом и сушили над MgSO4, фильтровали и концентрировали под вакуумом с получением коричневого твердого вещества, которое перекристаллизовывали из этилацетата и изооктана с получением 4-[5-(4-фторфенил)-3-(трифторметил)-1 Н-пиразол-1-ил]бензолсульфонамида 0,8 г. 1MS m/e ES-(M-H) 384 т.к. 167-171 С. Приготовление 2. Приготовление 4-[5-(4-фторфенил)-3-(трифторметил)-1 Н-пиразол-1-ил]бензолсульфонамида формы I без выделения кристаллической формы II. Следующая методика описывает общий способ получения кристаллической формы I 4-[5-(4 фторфенил)-3-(трифторметил)-1 Н-пиразол-1-ил]бензолсульфонамида без выделения кристаллической формы II. Часть А. 4-Фторацетофенон (1 мольных эквивалентов) объединяют со смесью алкилтрифторацетата(1,0-1,6 мольных эквивалентов), алкоксида металла (1,0-1,5 мольных эквивалентов) и необязательно с соответствующим растворителем (до 10 л на 1 кг 4-фторацетофенона). Эта смесь может быть нагрета вплоть до температуры кипения с обратным холодильником (для достижения окончания реакции)."Соответствующим растворителем" для этой части А является C1-С 6 насыщенный алифатический спирт,включая с линейной, разветвленной цепью, и циклические спирты. Неограничивающие примеры подходящих растворителей включают такие спирты, как метанол, этанол, изопропанол и другие подобные и их смеси. Часть В. Смесь, полученную в части А, объединяют со смесью 4-сульфонамидофенилгидразин гидрохлорида (0,8-1,2 молярных эквивалентов в расчете на 4-фторацетофенон) и водной соляной кислоты(1,1-2,0 молярных эквивалента в расчете на 4-фторацетофенон) в воде (3-9 л на 1 кг 4-фторацетофенона). При необходимости соответствующий растворитель может быть добавлен так, чтобы суммарное количество растворителя, присутствующего в части В, находилось в интервале 4-12 л на 1 кг 4-фторацетофенона. Реакционная смесь может быть нагрета до температур кипения с обратным холодильником(для достижения окончания реакции). После окончания реакции в смесь вносят затравку кристаллов формы I (0,0001 мас.%, в расчете на 4-фторацетофенон или более) при температурах ниже 71,5 С. Твердые вещества выделяют фильтрацией и они могут быть промыты и/или повторно суспендированы в подходящем растворителе. Продукт может быть высушен при температурах до 80 С. "Подходящим растворителем" для этой части В является C1-С 6 насыщенный алифатический спирт, включая линейный, с разветвленной цепью, или циклические спирты, и вода и их смеси. Следующая методика описывает предпочтительный способ получения кристаллической формы I 4[5-(4-фторфенил)-3-(трифторметил)-1 Н-пиразол-1-ил]бензолсульфонамида без выделения кристаллической формы II. 2-Пропанол (70 мл) и этилтрифторацетат (27,15 г, 0,191 моль) добавляют в первый сосуд с последующим смыванием остатков 2-пропанолом (10 мл). Далее добавляют в сосуд 25% метоксид натрия в метаноле (37,5 г, 0,174 моль) с последующим смыванием 2-пропанолом (10 мл). Далее, 4 фторацетофенон (20 г, 0,145 моль) добавляют с последующим смыванием 2-пропанолом (10 мл). Содержимое сосуда нагревают до 55 С и выдерживают при этой температуре в течение 2 ч, затем охлаждают до температуры окружающей среды. Воду (110 мл), концентрированную соляную кислоту (20,0 г, 0,203 моль) и 4-сульфонамидофенилгидразин гидрохлорид (32,4 г, 0,145 моль) добавляют во второй сосуд с последующим смыванием водой (10 мл). Содержимое первого сосуда добавляют во второй сосуд с последующим смыванием остатков 2-пропанолом (60 мл). Объединенное содержимое нагревают при 70 С в течение 2 ч, затем охлаждают до 55 С и вносят затравку в количестве 10 мг (0,05 мас.%, относительно 4-фторацетофенона) формы I 4-[5-(4-фторфенил)-3-(трифторметил)-1 Н-пиразол-1-ил]бензолсульфонамида. Содержимое выдерживают при 55 С в течение 6 ч, затем охлаждают до температуры окружающей среды и фильтруют. Продукт промывают 50% водным 2-пропанолом (120 мл) и водой (60 мл),затем сушат под вакуумом при 55 С с получением полиморфа 4-[5-(4-фторфенил)-3-(трифторметил)-1 Нпиразол-1-ил]бензолсульфонамида требуемой формы (44,8 г, 80%). Изобретение описывается более подробно следующими неограничивающими примерами. Примеры Пример 1. Деионизированную воду, 1 мл, тщательно смешивали с изопропиловым спиртом, 1 мл, в 20 мл стеклянной емкости. 4-[5-(4-Фторфенил)-3-(трифторметил)-1 Н-пиразол-1-ил]бензолсульфонамид формыII (258,6 мг) добавляли в емкость. Вводили магнитную мешалку и емкость плотно закрывали крышкой. Суспензию перемешивали при 200 об./мин в течение 30 мин. Наблюдалось образование густой пастообразной суспензии. Перемешивание прекращали и давали возможность емкости постоять в течение 3 дней. Часть суспензии удаляли и сушили на промокательной бумаге. Порошковая рентгенограмма этого твердого вещества приведена на фиг. 1. Температура плавления нескольких выделенных кристаллов,наблюдаемая под микроскопом с нагревательным столиком, составляла 148-152 С. Однако эту область температур не удается наблюдать с соответствующей воспроизводимостью из-за перехода формы I в-6 008697 форму II при температурах от 140 до 155 С. Пример 2. 380 мг формы II суспендировали в 2 мл этанола. Часть соединения растворялось, но некоторый избыток твердого соединения суспендировался в растворе. Образующуюся суспензию перемешивали с помощью магнитной мешалки при температуре от 20 до 30 С в течение 2 недель. В конце этого периода твердое вещество отфильтровывали и идентифицировали с помощью ПРГГ как соединение формы I. Пример 3. 1,5 г формы II добавляли к 2 мл ацетонитрила с получением суспензии. Суспензию перемешивали при помощи магнитной мешалки при температуре от 20 до 30 С в течение 2 недель. В конце периода твердое вещество отфильтровывали и идентифицировали с помощью ПРГГ как соединение формы I. Пример 4. 0,5 г формы II добавляли к 2 мл смеси метанол + вода (1:1 по объему) с получением суспензии. Суспензию перемешивали при помощи магнитной мешалки при температуре от 20 до 30 С в течение 4 недель. В конце периода твердое вещество отфильтровывали и идентифицировали с помощью ПРГГ как соединение формы I. Пример 5. 81,5 кг 4-[5-(4-фторфенил)-3-(трифторметил)-1 Н-пиразол-1-ил]бензолсульфонамида полностью растворяли в 81,5 кг этанола (6 объемов) при 40 С и фильтровали при этой температуре. 154 л воды (9 объемов) добавляли к раствору в течение 1 ч при температуре 40 С с последующим охлаждением до 20 С. Суспензию перемешивали при 20 С в течение 24 ч и фильтровали с получением 4-[5-(4 фторфенил)-3-(трифторметил)-1 Н-пиразол-1-ил]бензолсульфонамида в форме I. Пример 6. Снятие порошковых рентгенограмм. Порошковую рентгенограмму получали с использованием установки Scintag X2 Advanced Diffraction System (под контролем Scintag DMS/NT 1.30a и операционной среды Microsoft Windows NT 4.0). В системе применяется медный источник рентгеновского излучения (45 кВ и 40 ма) для получения CuK1 излучения с длиной волны 1,5406 и твердотельный детектор, охлаждаемый за счет эффекта Пелтиера. Апертуру луча регулировали с использованием сведения трубки и антирассеивающих щелей 2 и 4 мм и антирассеивающего детектора и приемных щелей 0,5 и 0,2 мм шириной. Данные регистрировали от 2 до 35 (два-тета) с использованием шага сканирования 0,03/шаг с временем счета одна секунда на шаг. Для экспериментов использовали круглые, загружаемые сверху алюминиевые держатели фирмы Scintag с углублением диаметром 12 мм. Порошки упаковывали в держатель и осторожно прижимали стеклянной пластинкой для обеспечения компланарности между поверхностью образца и поверхностью держателя образца. Для специалиста в области кристаллографии очевидно, что относительные интенсивности различных пиков в таблицах, приведенных ниже, могут меняться из-за ряда таких факторов, как, например,ориентационные эффекты кристаллов в рентгеновском луче или чистота анализируемого материала или степень кристалличности образца. Положения пика могут также сдвигаться при изменениях высоты образца, но приведенные в таблицах определенные положения пика будут в основном оставаться. Для специалиста в области кристаллографии также очевидно, что измерения с использованием различной длины волны, согласно уравнению Брэгга - n=2dsinQ, будут приводить к различным сдвигам. Такие дополнительные ПРГГ, полученные с использованием альтернативных длин волн, рассматриваются как альтернативные изображения ПРГГ кристаллических материалов настоящего изобретения и, по существу, входящие в объем настоящего изобретения. Для формы I вычисляли 2-тета углы, d-параметры решетки и относительные интенсивности из структуры монокристалла, используя модуль "Reflex Powder Diffraction" программы Accelrys MaterialsStudio [version 2.2]. Соответствующие параметры моделирования были в каждом случае следующие: Длина волны=1,540562(Сu K) Фактор поляризации=0,5 Псевдоконтур Фойгта (U=0,01, V=-0,001, W=0,002) Экспериментальные и вычисленные ПРГГ для формы I и экспериментальные рентгенограммы для формы II приведены на фиг. 1, 2 и 3 соответственно. Главные пики на ПРГГ формы I 4-[5-(4-фторфенил)3-(трифторметил)-1 Н-пиразол-1-ил]бензолсульфонамида представлены в табл. 1. Главные пики формы 1 4-[5-(4-фторфенил)-3-(трифторметил)-1 Н-пиразол-1-ил]бензолсульфонамида из вычисленных ПРГГ представлены в табл. 2. Форма I проявляет индивидуальные дифракционные пики при 14,0, 18,9, 21,3,21,9, и 25,7 угла два-тета 0,1.-7 008697 Таблица 1 Пики на ПРГГ 4-[5-(4-фторфенил)-3-(трифторметил)-1 Н-пиразол-1-ил]бензолсульфонамида формы I: Относительная интенсивность для каждого пика определяется нормализацией его интенсивности к интенсивности самого сильного пика при 21,3, принятой за 100 Таблица 2 4-[5-(4-Фторфенил)-3-(трифторметил)-1 Н-пиразол-1-ил]бензолсульфонамида формы I из вычисленной ПРГГ Пример 7. Дифференциальная сканирующая калориметрия (ДСК). Данные дифференциальной сканирующей калориметрии (ДСК) получали на ДСК калориметре (ТА-8 008697 помещали на верх тигля и герметически закрывали. Закрытый тигель помещали в ячейку для образца вместе с пустым тиглем, используемым для сравнения. Температуры повышали от 30 до 250 С при скорости 10 С/мин, если не было указано иначе. Термическую ячейку продували сухим азотом при 50 мл/мин. Для сбора данных использовали программу ТА Instruments Thermal Solutions for NT (version 1.3L) и для анализа данных использовали программу Universal Analysis for NT (version 2.4F). Как видно на фиг. 4, ДСК формы I проявляет эндотермический фазовый переход из формы I в форму II при температуре от 140 до 155 С. Пример 8. Термодинамическая зависимость между формами I и II. В этом примере описана температура перехода между формами I и II. Формы I и II являются энантиотропными, тем самым означая, что один полиморф является устойчивым при температурах ниже температуры перехода, Tt, а другой полиморф является устойчивым при температурах выше Tt. Две твердых фазы имеют равные свободные энергии при температуре перехода. Знание зависимости термодинамической устойчивости является необходимым для выбора соответствующих условий кристаллизации для получения формы I, и для разработки лекарственного средства и его промышленного производства. Важно определить Tt для получения и последующей переработки нерасфасованного лекарственного средства. Материалы и методы Материалы. Используемым в этом исследовании образцом формы I был образец 100% чистоты согласно анализу с помощью ВЭЖХ. Форму II получали нагреванием формы I до 155 С в течение 3 дней в сухом термошкафу и охлаждали до комнатной температуры. Согласно анализу с помощью ВЭЖХ, этот образец формы II не содержал продуктов химического разложения. Методы. Суспензионная кристаллизация. Зависимость относительной устойчивости между формами I и II при конкретной температуре устанавливали суспендированием смеси двух полиморфов в толуоле в закрытой стеклянной емкости, которую приводили к равновесию при интересующей температуре. Сначала добавляли избыток одного твердого полиморфа для насыщения толуола в стеклянную емкость при выбранной температуре. Другой полиморф добавляли по меньшей мере на полчаса позже. Суспензию перемешивали непрерывно в течение по меньшей мере трех дней. Часть суспензии отбирали и немедленно отфильтровывали. Отфильтрованное твердое вещество анализировали с помощью рентгеновского анализа для идентификации равновесного твердого вещества при этой температуре. Равновесный полиморф является термодинамически более устойчивым при конкретной температуре. Повторением эксперимента при различных температурах получали значение Tt. Результаты Суспензионная кристаллизация. Результаты суспензионной кристаллизации показали, что при температуре более чем 71,5 С смесь форм I и II всегда превращается в форму II, но при температуре ниже чем 71,0 С форма I являлась равновесной твердой фазой. Поэтому форма I термодинамически более стабильна при температуре ниже чем 71,0 С, а форма II более стабильна при температуре выше чем 71,5 С.Tt должна находиться между 71,0 и 71,5 С. Обсуждение Важно определить Tt для получения и дальнейшей переработки нерасфасованного лекарственного средства. Например, стадия, включающая кристаллизацию из раствора, часто предшествует окончательному выделению нерасфасованного лекарственного средства. Если Tt для требуемой формы лежит ниже температуры кристаллизации, может представлять трудность кристаллизовать лекарственное средство как чистую фазу. Другим примером является сушка гранул, содержащих лекарственное средство, после мокрой грануляции. Если температура сушки будет выше, чем Tt, может происходить неконтролируемое изменение полиморфа лекарственного средства. Изменения, в свою очередь, могут воздействовать на последующую переработку, чистоту и характеристики конечных продуктов. Было определено, что температура перехода, Tt, составляет приблизительно 71 С при использовании суспензионной кристаллизации. Так как форма I является более стабильной при температурах ниже 71 С и становится метастабильной по отношению к форме II при температурах выше 71 С, кристалл формы I должен поддерживать свою стабильность в твердом состоянии в нормальном интервале температур при кристаллизации и хранении, до тех пор пока температура составляет меньше 71 С. Настоящее изобретение описано подробно и со ссылкой на различные конкретные и предпочтительные варианты осуществления и методы. Однако предполагается, что могут быть сделаны многие изменения и модификации, не выходя за объем изобретения.-9 008697 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Кристаллическая форма, форма I, 4-[5-(4-фторфенил)-3-(трифторметил)-1 Н-пиразол-1 ил]бензолсульфонамида, характеризующаяся порошковой рентгенограммой, включающей пики, выраженные в градусах (0,1) угла-тета: 14,0, 18,9, 21,3, 21,9 и 25,7, полученной с использованием CuK1 рентгеновского излучения (длина волны=1,5406 ). 2. Способ превращения формы II, характеризующейся порошковой рентгенограммой, включающей пики, выраженные в градусах (0,1) угла-тета: 4,4, 13,3, 18,0, 22,5 и 27,1, 4-[5-(4-фторфенил)-3(трифторметил)-1 Н-пиразол-1-ил]бензолсульфонамида в кристаллическую форму по п.1, включающий:(a) смешение суспензии формы II 4-[5-(4-фторфенил)-3-(трифторметил)-1 Н-пиразол-1 ил]бензолсульфонамида в соответствующем растворителе при температуре от 0 до 60 С;(b) перемешивание суспензии при температуре от 0 до 60 С в течение от 24 до 72 ч; и(с) собирание кристаллов формы I. 3. Способ по п.2, в котором растворитель выбирают из группы, состоящей из воды, метанола, этанола, изопропанола, ацетона, ацетонитрила, метиленхлорида, толуола и тетрагидрофурана и их смесей. 4. Способ превращения кристаллической формы, формы II, 4-[5-(4-фторфенил)-3-(трифторметил)1 Н-пиразол-1-ил]бензолсульфонамида в кристаллическую форму по п.1, включающий:(a) растворение указанной формы II в смешивающемся с водой растворителе, в котором растворимость формы II, характеризующейся порошковой рентгенограммой, включающей пики, выраженные в градусах (0,1) угла-тета: 4,4, 13,3, 18,0, 22,5 и 27,1, составляет больше чем 2 мг/мл при температуре от 10 до 60 С;(c) перемешивание суспензии стадии ii) в течение от 2 до 72 ч при температуре от 15 до 45 С; и(d) собирание кристаллов формы I. 5. Способ по п.4, в котором растворитель выбирают из группы, состоящей из этанола, ацетона, ацетонитрила, тетрагидрофурана, диоксана и диметилформамида. 6. Фармацевтическая композиция, которая включает кристаллическую форму по п.1. 7. Фармацевтическая композиция по п.6, которая дополнительно включает фармацевтически приемлемый носитель или наполнитель. 8. Способ предотвращения или лечения состояния воспаления у животных путем введения животному терапевтически эффективного количества кристаллической формы по п.1. 9. Способ по п.8, в котором указанное животное выбирают из группы, состоящей из крупного рогатого скота, овец, коз, лошадей, свиней, птиц, кошек, собак и людей. 10. Применение композиции по п.6 при производстве лекарственного препарата для предотвращения или лечения состояния воспаления у животного. 11. Способ получения кристаллической формы по п.1, включающий стадии:(a) смешение от 1,0 до 1,6 молей алкилтрифторацетата на моль 4-фторацетофенона, от 1,0 до 1,5 молей алкоксида металла на моль 4-фторацетофенона, и известного количества 4-фторацетофенона с получением смеси;(b) объединение смеси со стадии (а) с комбинацией от 415 до 1245 мл воды на моль 4 фторацетофенона, от 1,1 до 2,0 молей концентрированной хлористо-водородной кислоты на моль 4 фторацетофенона, от 0,8 до 1,2 молей 4-сульфонамидфенилгидразин гидрохлорида на моль 4 фторацетофенона, и количества соответствующего растворителя таким образом, чтобы суммарное количество растворителя в смеси составляло от 550 до 1660 мл на моль 4-фторацетофенона;(c) добавление к смеси количества затравки кристаллов формы I 4-[5-(4-фторфенил)-3(трифторметил)-1 Н-пиразол-1-ил]бензолсульфонамида в расчете на 4-фторацетофенон;(d) собирание кристаллов формы I. 12. Способ по п.11, дополнительно включающий добавление на стадии (а) к смеси до 1380 мл соответствующего растворителя на моль 4-фторацетофенона. 13. Способ по п.12, в котором спиртом является 2-пропанол. 14. Способ по п.11, в котором алкоксид металла выбирают из группы, состоящей из метоксида натрия, этоксида натрия, изопропоксида натрия, третичного бутоксида натрия, метоксида лития, этоксида лития, изопропоксида лития, третичного бутоксида лития, метоксида калия, этоксида калия, изопропоксида калия и тритичного бутоксида калия и их смесей. 15. Способ по п.14, в котором алкоксидом металла является метоксид натрия. 16. Способ по п.11, дополнительно включающий стадию, следующую за стадией (а), содержащую нагревание смеси при температуре выше температуры окружающей среды до температуры кипения с обратным холодильником до момента окончания реакции. 17. Способ по п.16, дополнительно включающий стадию, следующую за стадией нагревания, содержащую охлаждение смеси до температуры от -5 до 30 С. 18. Способ по п.11, в котором стадия (b) включает добавление смеси к комбинации воды, хлористоводородной кислоты, 4-сульфонамидофенилгидразин гидрохлорида.- 10008697 19. Способ по п.11, в котором растворителем стадии (b) является спирт. 20. Способ по п.19, в котором спиртом является 2-пропанол. 21. Способ по п.11, дополнительно включающий стадию, следующую за стадией (b), содержащую нагревание смеси при температурах выше температуры окружающей среды до температуры кипения с обратным холодильником до момента окончания реакции. 22. Способ по п.21, дополнительно включающий стадию, следующую за стадией нагревания, содержащую стабилизацию смеси при температуре от температуры окружающей среды до температуры 71,5 С. 23. Способ по п.11, в котором количество затравки составляет от 0,0001 до 50 мас.%. 24. Способ по п.23, в котором количество затравки составляет от 0,001 до 5 мас.%. 25. Способ по п.23, в котором количество затравки составляет от 0,01 до 0,5 мас.%. 26. Способ по п.11, дополнительно включающий стадию, следующую за стадией (с), содержащую нагревание смеси при температуре от 40 С до менее чем 71,5 С в течение от 1 до 10 ч. 27. Способ по п.26, дополнительно включающий стадию, следующую за стадией нагревания, содержащую охлаждение смеси до температуры от -5 до 30 С. 28. Способ по п.11, дополнительно включающий стадию, следующую за стадией (с), содержащую фильтрацию смеси и промывку кристаллов формы I соответствующим растворителем или водой или их смесью. 29. Способ по п.28, в котором растворителем является спирт. 30. Способ по п.29, в котором спиртом является 2-пропанол. 31. Способ по п.11, дополнительно включающий стадию, следующую за стадией (d), содержащую сушку кристаллов формы I при температуре от 15 до 80 С. 32. Способ получения кристаллической формы по п.1, включающий стадии:(a) смешение от 1,2 до 1,45 молей алкилтрифторацетата на моль 4-фторацетофенона, от 1,1 до 1,35 молей алкоксида металла на моль 4-фторацетофенона и известного количества 4-фторацетофенона с получением смеси;(b) объединение смеси со стадии (а) с комбинацией от 650 до 870 мл воды на моль 4 фторацетофенона, от 1,2 до 1,7 молей концентрированной хлористо-водородной кислоты на моль 4 фторацетофенона, от 0,9 до 1,1 молей 4-сульфонамидофенилгидразин гидрохлорида на моль 4 фторацетофенона, и количества соответствующего растворителя таким образом, чтобы суммарное количество растворителя в смеси составляло от 600 до 1000 мл на моль 4-фторацетофенона;(c) добавление к смеси количество затравки кристаллов формы I 4-[5-(4-фторфенил)-3(трифторметил)-1 Н-пиразол-1-ил]бензолсульфонамида в расчете на 4-фторацетофенон;(d) собирание кристаллов формы I. 33. Способ по п.32, дополнительно включающий добавление на стадии (а) к смеси до 900 мл соответствующего растворителя на моль 4-фторацетофенона. 34. Способ по п.33, в котором спиртом является 2-пропанол. 35. Способ по п.32, в котором алкоксид металла выбирают из группы, состоящей из метоксида натрия, этоксида натрия, изопропоксида натрия, третичного бутоксида натрия, метоксида лития, этоксида лития, изопропоксида лития, третичного бутоксида лития, метоксида калия, этоксида калия, изопропоксида калия и тритичного бутоксида калия и их смесей. 36. Способ по п.35, в котором алкоксидом металла является метоксид натрия. 37. Способ по п.32, дополнительно включающий стадию, следующую за стадией (а), содержащую нагревание смеси при температуре выше температуры окружающей среды до температуры кипения с обратным холодильником до момента окончания реакции. 38. Способ по п.37, дополнительно включающий стадию, следующую за стадией нагревания, содержащую охлаждение смеси до температуры окружающей среды. 39. Способ по п.32, в котором стадия (b) включает добавление смеси к комбинации воды, хлористоводородной кислоты, 4-сульфонамидофенилгидразин гидрохлорида. 40. Способ по п.32, в котором растворителем стадии (b) является спирт. 41. Способ по п.40, в котором спиртом является 2-пропанол. 42. Способ по п.32, дополнительно включающий стадию, следующую за стадией (b), содержащую нагревание смеси при температурах выше температуры окружающей среды до температуры кипения с обратным холодильником до момента окончания реакции. 43. Способ по п.42, дополнительно включающий стадию, следующую за стадией нагревания, содержащую стабилизацию смеси при температуре от 40 до 65 С. 44. Способ по п.33, в котором количество затравки составляет от 0,0001 до 50 мас.%. 45. Способ по п.44, в котором количество затравки составляет от 0,001 до 5 мас.%. 46. Способ по п.44, в котором количество затравки составляет от 0,01 до 0,5 мас.%. 47. Способ по п.32, дополнительно включающий стадию, следующую за стадией (с), содержащую нагревание смеси при температуре от 50 до менее чем 71,5 С в течение от 3 до 8 ч. 48. Способ по п.47, дополнительно включающий стадию, следующую за стадией нагревания, со- 11008697 держащую охлаждение смеси до температуры окружающей среды. 49. Способ по п.32, дополнительно включающий стадию, следующую за стадией (с), содержащую фильтрацию смеси, и промывку кристаллов формы I соответствующим растворителем, или водой, или их смесью. 50. Способ по п.49, в котором растворителем является спирт. 51. Способ по п.50, в котором спиртом является 2-пропанол. 52. Способ по п.32, дополнительно включающий стадию, следующую за стадией (d), содержащую сушку кристаллов формы I при температуре от 30 до 65 С.
МПК / Метки
МПК: A61K 31/415, A61P 29/00, C07D 231/12
Метки: производное, пиразола, кристаллическое
Код ссылки
<a href="https://eas.patents.su/14-8697-kristallicheskoe-proizvodnoe-pirazola.html" rel="bookmark" title="База патентов Евразийского Союза">Кристаллическое производное пиразола</a>
Предыдущий патент: Реактор с несколькими вертикальными трубами и объединенной транспортировкой
Следующий патент: Способ отделения nh3 от смеси, содержащей nh3, co2 и h2o
Случайный патент: Содержащие диарилацетиленгидразид ингибиторы тирозинкиназы