Замещенные изохинолины в качестве нервно-мышечных блокаторов ультракраткосрочного действия
Номер патента: 2224
Опубликовано: 28.02.2002
Авторы: Сэйвэриз Джон Джозеф, Своринджен Рой Арчибальд, Сэймэно Винсент, Пэйтел Сэнджей Шешикент, Бигхэм Эрик Кливленд, Борос Эрик Юджин, Бозуэлл Грейди Ивэн
Формула / Реферат
1. Соединение формулы (I)
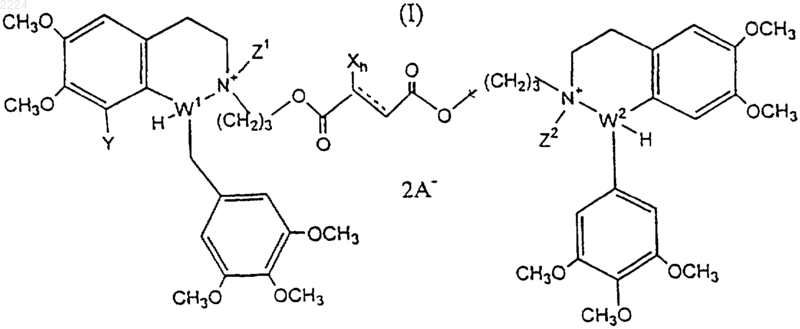
где Х представляет собой галоген,
h равно числу от 1 до 2,
Y представляет собой водород или метокси,
Z1 и Z2 представляют собой метил,
W1 и W2 представляют собой углерод, и
А представляет собой фармацевтически приемлемый анион.
2. Соединение формулы (I), которое включает в себя
дихлорид (Z)-2-хлор-4-{3-[(1S,2R)-6,7-диметокси-2-метил-1-(3,4,5-триметоксифенил)-1,2,3,4-тетрагидро-2-изохинолинио]пропил}-1-{3-{(1R,2S)-6,7-диметокси-2-метил-1-[(3,4,5-триметоксифенил)метил]-1,2,3,4-тетрагидро-2-изохинолинио}пропил}-2-бутендиоата,
дихлорид 2,2-дифтор-4-{3-[(1S,2R)-6,7-диметокси-2-метил-1-(3,4,5-триметоксифенил)-1,2,3,4-тетрагидро-2-изохинолинио]пропил}-1-{3-{(1R,2S)-6,7-диметокси-2-метил-1-[(3,4,5-триметоксифенил)метил]-1,2,3,4-тетрагидро-2-изохинолинио}пропил}бутандиоата,
дихлорид (Z)-4-{3-[(1S,2R)-6,7-диметокси-2-метил-1-(3,4,5-триметоксифенил)-1,2,3,4-тетрагидро-2-изохинолинио]пропил}-1-{3-{(1R,2S)-6,7-диметокси-2-метил-1-[(3,4,5-триметоксифенил)метил]-1,2,3,4-тетрагидро-2-изохинолинио}пропил}-2-фтор-2-бутендиоата и
дихлорид 2,2-дифтор-4-{3-[(1S,2R)-6,7-диметокси-2-метил-1-(3,4,5-триметоксифенил)-1,2,3,4-тетрагидро-2-изохинолинио]пропил}-1-{3-{(1R,2S)-2-метил-6,7,8-триметокси-1-[(3,4,5-триметоксифенил)метил]-1,2,3,4-тетрагидро-2-изохинолинио}пропил}бутандиоата.
3. Фармацевтический состав, содержащий соединение по п.1 или 2 в сочетании с одним или более чем одним фармацевтически приемлемым носителем.
4. Способ индуцирования нервно-мышечного паралича у млекопитающего, при котором указанному млекопитающему вводят эффективное индуцирующее нервно-мышечный паралич количество соединения по п.1 или 2.
5. Применение соединения по п.1 или 2 в качестве нервно-мышечного блокатора.
6. Применение соединения по п.1 или 2 для изготовления лекарства для индуцирования нервно-мышечной блокады.
7. Соединение формулы (II)
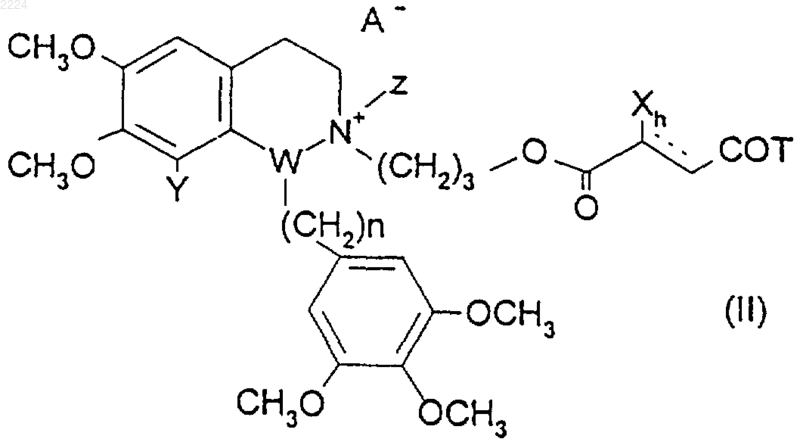
где Х представляет собой галоген,
Т представляет собой гидроксил или галогенид,
Y представляет собой водород или метокси,
Z представляет собой метил,
W представляет собой углерод, n равно 0 или 1, h равно 1 или 2, и
А представляет собой фармацевтически приемлемый анион.
8. Способ получения соединения формулы (Ib)
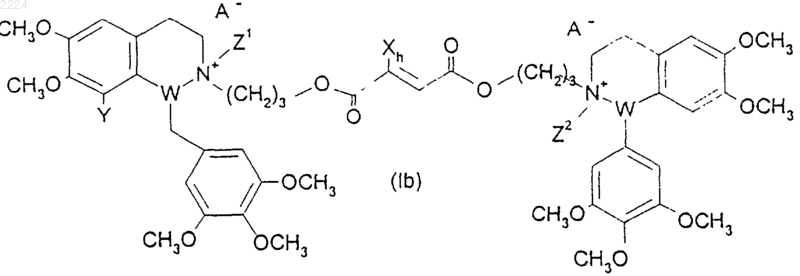
где h равно 1, а
X, Y, Z1, Z2, W1, W2 и А такие, как определено в п.1,
при котором соединение формулы (Ia)
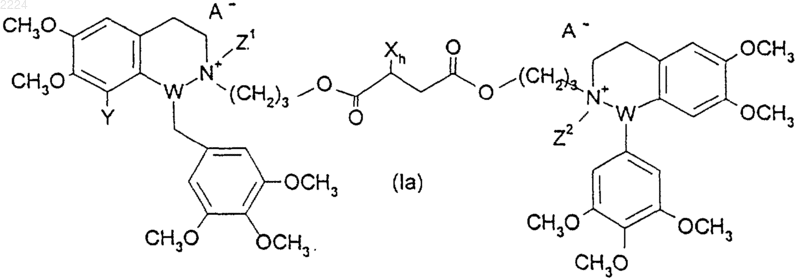
где h равно 2, а
X, Y, Z1, Z2, W1, W2 и А такие, как определено в п.1,
подвергают взаимодействию с основанием в полярном апротонном растворителе.
9. Способ получения соединения формулы (I), при котором соединение формулы (II), как оно определено в п.7, подвергают взаимодействию с соединением формулы (III)
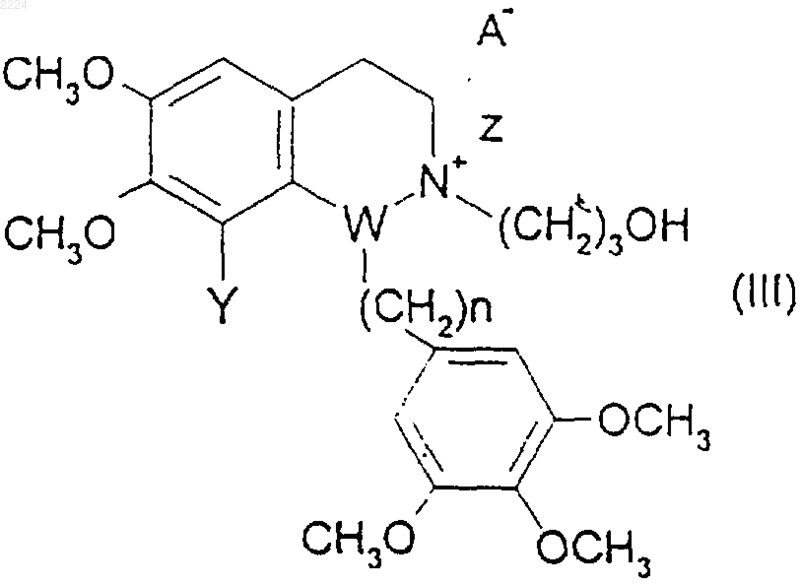
где Y представляет собой водород или метокси,
Z представляет собой метил,
W представляет собой углерод,
n равно 0 или 1, и
А представляет собой фармацевтически приемлемый анион,
в органическом растворителе.
Текст
1 Настоящее изобретение относится к новым соединениям, способам получения таких соединений, содержащим их фармацевтическим композициям и их применению в качестве нервномышечных блокаторов ультракраткосрочного действия. Агенты, вызывающие нервно-мышечную блокаду, используют в анестезии для обеспечения релаксации скелетных мышц во время хирургической операции или во время интубации трахеи. Нервно-мышечные блокаторы обычно классифицируют как по механизму их действия(деполяризующие и недеполяризующие), так и по продолжительности их действия (ультракраткосрочное, краткосрочное, промежуточное и длительное) [Bedford, R., "From the FDA", Anesthesiology, (82)1, 33 а, 1995]. Недеполяризующие агенты, вызывающие нервно-мышечную блокаду, включают в себя агенты длительного действия, такие как d-тубокурарин, панкуроний,галламин, диаллил токсиферин и токсиферин,агенты промежуточной длительности действия,такие как атракурий и векуроний, и агенты краткосрочного действия, такие как мивакурий[патенты США 4179507, 4701460, 4761418 и 5454510]. Традиционные недеполяризующие агенты, когда их применяют в качестве релаксантов скелетных мышц, обычно имеют продолжительность действия от 20 до 180 мин. В настоящее время в клинической практике не используют недеполяризующие агенты нервномышечной блокады ультракраткосрочного действия. Деполяризующие агенты включают в себя сукцинилхолин и декаметоний. Вследствие их деполяризующего механизма действия, эти агенты могут иметь сильные побочные эффекты, такие как остановка сердца и смерть, гиперкалиемия, злокачественная гипертермия, сильная мышечная боль, сердечные аритмии, повышенное внутриглазное давление и повышенное внутрижелудочное напряжение. Традиционные деполяризующие агенты имеют более короткую продолжительность действия, например от 10 до 15 мин у людей. Сукцинилхолин имеет быстрое наступление действия и ультракороткий срок действия, и это единственный нервномышечный блокатор ультракраткосрочного действия, применяемый в клинической практике. Несмотря на профиль его нежелательных побочных эффектов, нет других доступных агентов ультракраткосрочного действия, и поэтому в настоящее время это предпочтительный агент для экстренного применения. Ультракороткий срок действия чрезвычайно важен в экстренных ситуациях. Применение агентов более длительного действия может привести к серьезным повреждениям мозга и смерти. Недеполяризующие агенты обычно считаются более безопасными и более желательными в клиническом отношении, чем деполяризующие агенты. Клиницисты давно осознали необ 002224 2 ходимость в недеполяризующих нервномышечных блокаторах ультракраткосрочного действия [Miller, R.D. Anesthesia and Analgesia 61(9), 721, 1982 и Belmont, M. R., Current Opinion in Anesthesiology, 8, 362, 1995]. Однако недеполяризующие агенты могут проявлять побочные эффекты, не связанные конкретно с их механизмом или продолжительностью действия. Например, агенты длительного действия панкуроний и галламин оказывают действие на автономную нервную систему и могут вызывать ускорение сердцебиения (тахикардию). Агенты промежуточной продолжительности действия и краткосрочного действия, такие как бесилат атракурия и хлорид мивакурия, также могут вызывать побочный эффект - высвобождение гистамина. Высвобождение гистамина оказывает нежелательное действие на кровяное давление и сердцебиение, и некоторые врачи считают, что высвобождение больших количеств гистамина может вызывать опасную для жизни анафилаксию у некоторых больных. Теперь установлено, что соединения формулы (I) являются сильными недеполяризующими агентами нервно-мышечной блокады ультракраткосрочного действия, например,примерно от 5 до 15 мин, что должно обеспечить как более высокую безопасность по сравнению с известными деполяризующими агентами ультракраткосрочного действия, например сукцинилхолином, так и более низкую способность высвобождать гистамин по сравнению с другими недеполяризующими агентами, такими как атракурий и мивакурий. Кроме того, они имеют быстрое начало действия, и оно обратимо под действием известных агентов отмены,таких как неостигмин, причем оба эти свойства очень важны в экстренных ситуациях и при других обстоятельствах. Эти агенты сохраняют свое ультракраткосрочное действие и быстрое спонтанное выделение при введении либо болюсом, либо непрерывной инфузией, и не имеют кумулятивных эффектов, наблюдаемых при использовании других нервно-мышечных блокаторов (панкуроний, векуроний). Таким образом, соединения по настоящему изобретению должны обеспечивать значительное преимущество в экстренных, обычных хирургических и послеоперационных условиях. Соответственно, согласно настоящему изобретению предложены соединения формулы где Х представляет собой галоген, h равно числу от 1 до 2, Y представляет собой водород или 3 метокси, Z1 и Z2 представляют собой метил, W1 и W2 представляют собой углерод, и А представляет собой фармацевтически приемлемый анион. Соединения формулы (I) содержат две замещенные изохинолиниевые группировки, соединенные алифатическим линкером. Эти две замещенные изохинолиниевые группировки можно удобно различать, ссылаясь на них как на "левую основную группировку" и "правую основную группировку", причем левая основная часть содержит W1, а правая основная часть содержит W2. Алифатический линкер представляет собой часть соединения формулы (I), обозначенную следующей формулой (i)( -) указывает на двойную или простую связь. Подходящим классом соединений формулы (I) являются соединения, в которых Х представляет собой хлор или фтор. Особенно предпочтительными галогеновыми замещениями являются монохлор-, монофтор- и дифторзамещения. Часть соединения формулы (I), представляющая собой алифатический линкер, как он описан формулой (i), включает в себя бутандиоатную или бутендиоатную группировку. Соответственно, соединения формулы (I), где алифатический линкер включает в себя бутендиоатную группировку, могут существовать либо в конфигурации Е, либо в конфигурации Z, либо в виде смеси изомеров Е и Z. Предпочтительно бутендиоатная группировка соединений формулы (I) представляет собой фумарат. Термин "фумарат", как он используется в данном документе, обозначает бутендиоатную группировку, в которой две эфирные карбонильные группы транс-ориентированы одна относительно другой. Предпочтительным классом соединений формулы (I) являются соединения, в которых алифатический линкер представляет собой бутандиоатную группировку, Х представляет собой хлор или фтор, и h равно 2. Особенно предпочтительным классом соединений формулы (I) являются соединения, в которых алифатический линкер представляет собой бутандиоатную группировку, Х представляет собой фтор, и h равно 1 или 2. Соединения формулы (I), где алифатический линкер представляет собой бутандиоатную группировку, Х представляет собой фтор, и h равно 2, наиболее предпочтительны. Другим предпочтительным классом соединений формулы (I) являются соединения, в которых алифатический линкер представляет собой бутендиоатную группировку, а Х представляет собой хлор или фтор. Особенно предпочти 002224 4 тельный класс соединений формулы (I) включает в себя такие соединения, в которых алифатический линкер представляет собой бутендиоатную группировку, Х представляет собой хлор или фтор, h равно 1, а бутендиоатная группировка представляет собой фумарат. Соединения формулы (I), где алифатический линкер является бутендиоатной группировкой, Х представляет собой хлор, и h равно 1, наиболее предпочтительны. Соединения формулы (I) содержат четыре хиральных центра. Атомы углерода (обозначенные как W1 и W2) и каждый четвертичный атом азота в изохинолиниевых группировках являются хиральными. Каждый из этих четырех хиральных центров независимо может существовать либо в конфигурации R, либо в конфигурации S. Соответственно специалистам должно быть понятно, что каждое соединение, описываемое формулой (I), может существовать в шестнадцати различных оптических изомерных формах. Объем настоящего изобретения охватывает любой и каждый изомер соединений формулы (I) либо индивидуально, либо в смеси с другими изомерами, и все смеси таких изомеров. Приемлемо, когда W1 находится в Rконфигурации, N, присоединенный к Z1, находится в S-конфигурации, W2 находится либо вR-, либо в S-конфигурации, и N, присоединенный к Z2, находится либо в R-, либо в Sконфигурации. Предпочтительно W1 находится в R-конфигурации, N, присоединенный к Z1,находится в S-конфигурации, W2 находится в Sконфигурации, и N, присоединенный к Z2, находится либо в R-, либо в S-конфигурации. Соединения формулы (I), где W1 находится в Rконфигурации, W2 находится в S-конфигурации,N, присоединенный к Z1, находится в Sконфигурации и N, присоединенный к Z2, находится в R-конфигурации, наиболее предпочтительны. В частности, предпочтительные соединения формулы (I) включают в себя дихлорид 5 дихлорид 2,2-дифтор-4-3-[(1S,2R)-6,7 диметокси-2-метил-1-(3,4,5-триметоксифенил)1,2,3,4-тетрагидро-2-изохинолинио]пропил-13-(1R,2S)-2-метил-6,7,8-триметокси-1-[(3,4,5 триметоксифенил)метил]-1,2,3,4-тетрагидро-2 изохинолиниопропилбутандиоата. Поскольку фармакологическая активность соединений по изобретению присуща катиону,природа аниона А- является относительно несущественной. Однако в терапевтических целях предпочтительно, чтобы он был фармацевтически приемлемым для реципиента этих соединений. Примеры фармацевтически приемлемых анионов включают в себя йодид, мезилат, тозилат, бромид, хлорид, гидросульфат, сульфат/2,фосфат/3, гидрофосфат/2, ацетат, бесилат, сукцинат/2, малеат, нафталинсульфонат и пропионат. И фармацевтически приемлемые соли, и соли, которые не являются приемлемыми в этом отношении, могут быть полезными для выделения и/или очистки соединений по изобретению. Неприемлемые соли могут быть также полезными в том отношении, что их можно превращать в приемлемые соли способами, которые хорошо известны в данной области. Соединения формулы (I) используют в качестве агентов нервно-мышечной блокады во время хирургических операций, для интубации трахеи или во время электрошоковой терапии. Их можно вводить парентерально, например внутримышечной или внутривенной инъекцией раствора. Соответственно согласно настоящему изобретению предложен также способ продуцирования мышечной релаксации у млекопитающего, при котором млекопитающему вводят эффективное вызывающее нервно-мышечную блокаду количество соединения формулы (I). Дозировка для каждого субъекта может варьировать, однако, внутривенное количество или дозировка соединений формулы (I), подходящие для достижения паралича у млекопитающих,должны составлять от 0,01 до 5,0 мг/кг веса тела и наиболее предпочтительно от 0,02 до 0,5 мг/кг веса тела, причем в расчете на массу дикатиона, который является активным ингредиентом. Дозировка для внутримышечного введения в 2-8 раз превышает внутривенную дозу. В еще одном аспекте настоящего изобретения предложены соединения формулы (I) для применения в терапии, например для индуцирования нервно-мышечной блокады в хирургии или для интубации трахеи. Согласно настоящему изобретению предложено также применение соединения формулы (I) в изготовлении лекарства для индуцирования нервно-мышечной блокады у млекопитающего, включая человека. Хотя соединения формулы (I) можно вводить как активные химические соединения,предпочтительно представлять их в форме фармацевтического состава для парентерального введения. Соответственно согласно настоящему изобретению предложен фармацевтический со 002224 6 став, который содержит соединение формулы(I), как оно определено в данном документе ранее, и фармацевтически приемлемый носитель. В случаях, когда фармацевтический состав предназначен для парентерального введения,этот состав может быть водным или неводным раствором или смесью жидкостей, которая может содержать бактериостатические агенты,антиоксиданты, буферы или другие фармацевтически приемлемые добавки. Альтернативно,соединения могут быть представлены в виде лиофилизированных твердых веществ для растворения в воде (для инъекций) или декстрозных или солевых растворах. Такие составы обычно представляют в стандартных лекарственных формах, таких как ампулы или одноразовые устройства для инъекций. Они могут быть представлены также в многодозовых формах,таких как флакон, из которого можно извлечь подходящую дозу. Все такие составы должны быть стерильными. Подходящая доза для достижения нервномышечной блокады у взрослых людей (150 фунтов или 70 кг) составляет от 0,5 до 150 мг, более предпочтительно от 3,5 до 50 мг. Соединения по изобретению можно вводить до или после деполяризующих агентов, названных выше, но не одновременно с ними. Так, подходящий фармацевтический парентеральный препарат для введения людям предпочтительно будет содержать от 0,1 до 20 мг/мл соединений формулы (I) в растворе, или кратное этому для многодозовых флаконов. Простым и предпочтительным составом является раствор соединения формулы (I) в воде или растворе декстрозы. Его можно приготовить путем растворения соединения в апирогенной стерильной воде или в воде, содержащей декстрозу, с использованием консервантов или без консервантов, и стерилизации этого раствора. Или же его можно приготовить путем растворения стерильного соединения в апирогенной стерильной воде или в декстрозном стерильном растворе в асептических условиях. Особенно предпочтительные составы имеют рН примерно от 2,0 до 5,0. Соединения формулы (I) можно также вводить путем инфузии декстрозного раствора или солевого раствора, например раствора Рингера, с помощью капельницы. Соединения можно также вводить в других растворителях (обычно в смеси растворителя с водой), таких как спирт, полиэтиленгликоль и диметилсульфоксид. Их также можно вводить внутримышечно (с помощью капельницы, если требуется) в виде суспензии или раствора. Общее описание способов Если не указано иначе, Y, Хh, и А- в последующих формулах являются такими, как определено выше в формуле (I). W соответствует W1 и W2 формулы (I), Z соответствует Z1 и Z2 формулы (I), а Х 1h и Х 2h соответствуют Xh формулы(I). Если не указано иначе, Т представляет собой гидроксил или галогенид. Еще одним аспектом настоящего изобретения является способ получения соединений формулы (I). Соединения формулы (I) могут быть получены взаимодействием двух эквивалентов соединения формулы (III) где Y представляет собой водород или метокси,Z представляет собой метил, W представляет собой углерод, n равно 0 или 1, и А представляет собой фармацевтически приемлемый анион, с одним эквивалентом соединения формулы (VII) в апротонном растворителе. Предпочтительный способ связывания соединений формулы (III) с соединениями формулы (VII) включает в себя смешивание производного дикислоты или хлорангидрида дикислоты (VII) (где Т представляет собой гидроксил или галогенид, например Cl), с двумя эквивалентами соединения формулы (III) в хлорированном органическом растворителе при температуре окружающей среды или при повышенной температуре. Согласно еще одному аспекту настоящего изобретения предложен другой способ получения соединений формулы (I). Соединения формулы (I) могут быть получены путем связывания двух разных соединений формулы (III) с одним эквивалентом соединения формулы (VII). Реакции такого типа предпочтительно проводят путем приготовления эквимолярного раствора двух разных соединений формулы (III) в хлорированном органическом растворителе с последующим добавлением одного эквивалента производного хлорангидрида дикислоты (VII) (например, Т представляет собой Cl). Эта методика приводит к образованию статистической смеси трех разных соединений формулы (I) (без учета стереохимических соображений и химических особенностей линкера), и главным компонентом этой смеси всегда является соединение формулы (I), содержащее две различные основные группировки, т.е. соединение формулы (I) с разными основными группировками. Одно или более чем одно такое соединение может быть выделено из смеси хроматографическими методами. После этого традиционными методами ионного обмена могут быть введены фармацевтически приемлемые противоионы (А-). Соединения формулы (III), где n равно 0, являются новыми промежуточными соединениями для 8 получения соединения формулы (I) и представляют собой еще один аспект этого изобретения. Соединения формулы (III) могут быть получены двумя общими способами, которые составляют еще один аспект этого изобретения. Первый способ включает в себя кватернизацию соединений формулы (V) (как они определены здесь) где Y представляет собой водород или метокси,Z представляет собой метил, W представляет собой углерод, и n равно 0 или 1, соединениями формулы (VIII) (как они определены здесь) где заместитель А в (VIII) является подходящей уходящей группой (например, А представляет собой I, Br, Cl, OSO2Me, ОSО 2 РhСh3) и соответствует аниону А-; и возможно превращение аниона (А-) в полученном соединении формулы(III) в другой анион (А-) традиционными способами ионного обмена. Взаимодействие соединений формулы (V) с соединениями формулы (VIII) предпочтительно проводят в полярных апротонных растворителях при повышенных температурах в присутствии карбоната натрия. Соединения формулы(III), полученные этим способом, образуются в виде смесей цис/транс-стереоизомеров, и разделение цис/транс-изомеров (III) обычно требует использования хроматографических методов,причем термины цис и транс относятся к пространственной ориентации арильной группы,присоединенной к W, относительно ориентации алканольной группы, присоединенной к N. Второй способ получения соединений формулы (III) включает в себя алкоголиз или гидролиз цвиттерионных соединений формулы где Y представляет собой водород или метокси,Z представляет собой метил, W представляет собой углерод, и n равно 0 или 1. Алкоголиз соединения формулы (IX) можно проводить в любом подходящем спирте в присутствии неорганической кислоты, и предпочтительно его проводят в метанольных растворах хлористого водорода при температуре окружающей среды. Соединения формулы (IX) 9 получают кватернизацией соединений формулы(V) циклическими сульфатами формулы (IV) Взаимодействие соединений формулы (V) с соединениями формулы (IV) предпочтительно проводят в полярных апротонных растворителях при повышенных температурах. Соединения формулы (IX), полученные этим способом, образуются в виде смесей цис/транс-изомеров,однако, цис/транс-смеси соединений формулы(IX) могут быть разделены селективной кристаллизацией транс-изомера соединений формулы (IX) из этой смеси. Селективную кристаллизацию транс-изомеров соединений формулы(IX) предпочтительно осуществляют с использованием полярных апротонных растворителей,таких как ацетонитрил или ацетон. Это предпочтительный способ получения соединений формулы (III), особенно транс-изомеров соединений формулы (III), где алканольная боковая цепь СН 2)3 ОН) и фенильные (n=0) и бензильные (n=1) заместители транс-ориентированы относительно друг друга в пространстве, и этот способ представляет собой еще один аспект настоящего изобретения. Другой аспект изобретения составляет новый способ получения соединений формул (I) и(II). Получение соединений формулы (I) включает в себя связывание соединения формулы (II) где Т представляет собой гидроксил и галогенид, Y представляет собой водород или метокси, Z представляет собой метил, W представляет собой углерод, n равно 0 или 1, h равно 1 или 2,и А представляет собой фармацевтически приемлемый анион, с соединением формулы (III). Взаимодействие предпочтительно проводят путем добавления соединения формулы (III) к производному кислоты или хлорангидрида кислоты (II) (где Т представляет собой гидроксил или галогенид, например Cl) в хлорированном органическом растворителе при температуре окружающей среды или при повышенных температурах. Хлорангидридные производные соединений формулы (II) (например, где Т представляет собой Сl), могут быть получены из соответствующих карбоновых кислот соединений формулы (II) (например, где Т представляет 10 собой ОН) способами, которые хорошо известны специалистам. Соединения формулы (II) (например, где Т представляет собой ОН) получают раскрытием кольца соединений формулы (VI) (как они определены здесь) с использованием соединений формулы (III). Эту реакцию предпочтительно проводят смешиванием соединений формул (III) и (VI) в хлорированных органических растворителях при температуре окружающей среды или при повышенных температурах. При необходимости, эту реакцию можно активизировать добавлением катализатора, такого как имидазол. После этого может следовать введение фармацевтически приемлемых противоионов (А-) традиционными методами ионного обмена. Раскрытие кольца галогенированных циклических ангидридов соединений формулы (VI) (например, Х представляет собой Сl или F) с использованием соединений формулы (III) может происходить селективно с получением соединений формулы(II) (например, Х представляет собой Сl или F, Т представляет собой ОН). В этой реакции гидроксильная группа в соединении (III) предпочтительно взаимодействует по карбонильной группе соединений формулы (VI), соседней с атомом галогена. Этот способ является предпочтительным способом получения соединений формулы(I) с разными основными группировками. Соединения формулы (II) являются новыми промежуточными продуктами в получении соединений формулы (I) и представляют собой еще один аспект изобретения. Согласно еще одному аспекту настоящего изобретения предложен способ превращения соединения формулы (II) в другое соединение формулы (II). Моногалогенированные алкендиоаты формулы (IIb) (например, Х представляет собой Сl или F, h равно 1) могут быть получены способом, который включает в себя удаление галогеноводорода (НХ 2) из вицинальных дигалогеноалкандиоатов формулы(IIа) (например, X1 и X2 независимо представляют собой Cl или F, Т представляет собой гидроксил или галогенид, h равно 1) Соединения формулы (IIа) получают взаимодействием соединения формулы (III) с соединениями формулы (VIa) (Х=Вr, Cl, F и h равно 1) Эти реакции предпочтительно проводят смешиванием соединений формул (III) и (VIa) в хлорированных органических растворителях при температуре окружающей среды или при повышенных температурах. При необходимости, эти реакции можно активизировать добавлением катализатора, такого как имидазол. Эти способы можно осуществлять с последующим введением фармацевтически приемлемого противоиона (А-) традиционными методами ионного обмена. Трансформацию соединений формулы (IIа) в соединения формулы (IIb) обычно осуществляют путем обработки (IIа) избытком третичного амина, такого как триэтиламин, в полярных апротонных или хлорированных растворителях при 0 С. В этом процессе исключения атом водорода (Н), соседний с кислородом карбонила эфира в (IIа) (-положение относительно карбонила эфира), отнимается селективно. Полученные соединения формулы (IIb) могут быть превращены в моногалогенированные алкендиоаты формулы (I) описанными здесь способами. Согласно еще одному аспекту настоящего изобретения предложен способ превращения одного соединения формулы (I) в другое соединение формулы (I). Моногалогенированные алкендиоаты формулы (Ib) могут быть получены удалением галогеноводорода (НХ) из геминальных дигалогеналкандиоатов формулы (Iа) (например, Х представляет собой Сl или F, h равно 2). Удаление НХ из соединений формулы (Iа) предпочтительно проводят с использованием карбоната калия в полярных растворителях, таких как диметилформамид, при температуре окружающей среды. Моногалогенбутендиоаты формулы (I) с разными основными группировками (например,Х представляет собой Сl или F, h равно 1) существуют в виде смесей региоизомеров 1:1, когда их синтезируют указанным способом, при котором два эквивалента соединения формулы (III) подвергают взаимодействию с одним эквивалентом соединения формулы (VIII). Однако моногалогенбутендиоаты формулы (I) с разными основными группировками (например, Х представляет собой Br, Cl, F; h равно 1) существуют в виде чистых региоизомеров, когда их синтезируют указанными способами, при которых соединения формулы (Ia) превращают в соединения формулы (Ib) или соединения формулы (IIа) превращают в соединения формулы (IIb). Таким образом, эти два последних способа предпочтительны для получения моногалогенбутендиоатов формулы (I) с разными основными группировками. Производные алкендиоатов формул (I) и(II) могут существовать как геометрические изомеры Е и Z; однако аналоги моногалогенированных бутендиоатов формулы (I) предпочтительно существуют в виде галогенфумаратов, в которых две эфирные карбонильные группы транс-ориентированы одна относительно другой. Соединения формулы (I) также могут существовать в виде смесей диастереоизомеров, и один или более чем один диастереоизомер может быть выделен из смеси традиционными методами, например хроматографическими методами. Соединения формул (IV), (V) и (VI), производные хлорангидрида кислоты (VII), и соединения формулы (VIII) имеются в продаже или их можно получить общеизвестными способами получения соединений аналогичной структуры. Чистые энантиомеры соединения(V) могут быть получены общеизвестными способами асимметрического синтеза, классическими методами разделения или хиральной препаративной ВЭЖХ. Экспериментальная часть Температуры плавления не скорректированы. Все реактивы использовали без очистки. Аналитическую высокоэффективную жидкостную хроматографию (ВЭЖХ) проводили на колонке LiChrosorb 4250 мм с 5 мк Si60 (Е.Merck, Darmstadt, Германия) при объемной ско 13 рости потока 1,6 мл/мин. Подвижная фаза состояла из смесей 0-25% метанола (МеОН) и дихлорметана (СH2 Сl2, содержащих 0,25 мл/л метансульфоновой кислоты. Разделение жидкостной хроматографией среднего давления(ЖХСД) выполняли на двойных картриджахPorasil 15-20 мк (Waters/Milliроrе, Milford, МА,США), элюируя смесями 0-20% MeOH/CH2Cl2,содержащими 0,25 мл/л метансульфоновой кислоты. Спектры протонного ядерного магнитного резонанса (1 ЯМР) всех продуктов соответствовали предполагаемым структурам. Массспектры (МС) (электрораспылительный способ ионизации, поток положительных ионов) приведены в форме m/z (положительный ион с зарядом +2, относительная интенсивность). Элементные анализы выполнялись лабораториейAtlantic Microlab, Norcross, Georgia. Хлорфумарилхлорид получали по известной (Akhtar, M.; Botting, P.N.; Cohen, M.A. Tetrahedron 1987, 43, 5899-5908) методике. Производные 3,4-дигидроизохинолина получали циклизацией по Bishler-Napieralski соответствующих амидов с использованием оксихлорида фосфора (Whaley, K.W.; GovindachariOrg. Reactions 1951, 6, 74-150). Рацемические производные 1,2,3,4-тетрагидроизохинолина получали восстановлением их 3,4-дигидроизохинолиновых предшественников боргидридом натрия/метанолом. N-Метилирование производных 1,2,3,4-тетрагидроизохинолина проводили с использованием формалина/ муравьиной кислоты (Kaluszner, A.; Galun А. В.J. Org. Chem. 1961, 26, 3536-3537). Нижеследующие исходные материалы получали хиральным каталитическим гидрированием их соответствующих 3,4-дигидроизохинолинов по методике, аналогичной известной(1S)-6,7-диметокси-2-метил-1-(3,4,5-триметоксифенил)-1,2,3,4-тетрагидроизохинолин. Нижеследующий исходный материал получали классическим разделением его соответствующего производного 3,4-дигидроизохинолина по методике, аналогичной известной(1S)-6,7-диметокси-2-метил-1-(3,4,5-триметоксифенил)-1,2,3,4-тетрагидроизохинолин. Нижеследующие исходные материалы получали классическим разделением их соответствующих рацемических смесей по методике,аналогичной известной (патент США 4761418, 2 августа 1988 г):(45,0 г; 0,30 моль), карбоната натрия (4,0 г; 0,038 моль) и 2-бутанона (600 мл) добавляли 3 хлорпропанол (25 мл; 28,3 г; 0,30 моль), и суспензию нагревали до температуры образования флегмы в течение 18 ч в атмосфере азота. Растворитель выпаривали, и остаток растворяли в Н 2 О и промывали этилацетатом(EtOAc). Водную фазу перемешивали со смолойDowex 18-50 (1,0 л), фильтровали и насыщали хлоридом натрия. Эту водную смесь экстрагировали хлороформом (СНСl3), и объединенные органические слои сушили и концентрировали с получением смеси указанных в заголовке(1S,2R)- и (1S,2S)-продуктов (1:3, соответственно) в виде белого твердого вещества (69,5 г; выход 99%): МС m/z432 (M+, 9).(R)-(-)-5'-Метоксилауданозин (23,5 г; 61,0 ммоль) подвергали процедуре, дающей смесь указанных в заголовке (1R,2S)- и (1R,2R)продуктов (2,3:1 соответственно) в виде желтого гигроскопичного твердого вещества (31,5 г; выход 100%). Изомеры разделяли ЖХСД (12% МеОН/СН 2 Сl2, 0,25 мл/л метансульфоновой кислоты). Меньший по количеству изомер (1R,2R) элюировался первым. Соответствующие фракции объединяли и большую часть МеОН удаляли выпариванием с СНСl3. Оставшийся СНСl3 раствор промывали смесью солевого раствора и Н 2O (1:1), сушили и концентрировали с получением (1R,2S)-продукта, указанного в заголовке,(10,4 г; выход 35%), и (1R,2R)-продукта, указанного в заголовке, (3,7 г; выход 13%), в виде желтых гигроскопичных твердых веществ: МС 3-(1R,2S)-6,7-диметокси-2-метил-1-[(3,4,5 триметоксифенил)метил]-1,2,3,4-тетрагидро-2 изохинолиниопропил-2-бутендиоата (1:1). К раствору смеси продуктов стадии (а) (2,4 г; 5,1 ммоль) и (1R,2S)-изомера из стадии (б)(2,34 г; 4,9 ммоль) в 1,2-дихлорэтане (ДХЭ) (30 мл) добавляли хлорфумарилхлорид (0,83 г; 4,4 ммоль) и перемешивали этот раствор при комнатной температуре (к.т.) в течение 18 ч. Растворитель выпаривали, а оставшийся остаток очищали ЖХСД (5-20% MeOH/CH2Cl2, 0,25 мл/л метансульфоновой кислоты). Соответствующие фракции объединяли и большую часть МеОН удаляли выпариванием с СНСl3. Оставшийся раствор в СНСl3 промывали смесью солевого раствора с водой (1:1), сушили и концентрировали. Лиофилизация дала смесь указанных в заголовке продуктов в соотношении 1:1 в виде белого твердого вещества (0,70 г; выход 15%): МС m/z 496 (М 2+, 100). Нижеследующие соединения получали по методике, аналогичной примеру синтеза 1.(а) (2R,3R)-2,3-Дихлорянтарный ангидрид. Раствор малеинового ангидрида (10,6 г; 108 ммоль) и бензоилпероксида (5 мг, 0,02 ммоль) в СНСl3 (250 мл) насыщали газообразным хлором, и полученный ярко-желтый раствор перемешивали при комнатной температуре(к.т.) в течение 5 ч. Остаточный хлор удаляли с током азота и реакционную смесь частично концентрировали. Четыре порции белого твердого продукта, указанного в заголовке, получали фильтрацией (11,9 г; выход 65%), т.пл. 9092 С.(2 мл) перемешивали в течение ночи при к.т. Эту смесь концентрировали, а оставшееся твердое вещество перетирали с ЕtOАс и растворяли в MeCN (25 мл). При 0 С по каплям добавляли раствор 1,8-диазабицикло[5.4.0]ундец-7-ена(DBU) (1,68 г; 11,0 ммоль) в MeCN (6 мл) и перемешивали реакционную смесь при температуре ледяной бани в течение 1 ч. Растворитель выпаривали, а оставшееся твердое вещество растворяли в СНСl3 (150 мл). Этот раствор промывали смесью солевого раствора и воды (2:1),содержащей метансульфоновую кислоту (4 мг/мл), и солевым раствором. Органический слой сушили и концентрировали с получением продукта, указанного в заголовке, в виде пены(в) (Пример 2.01). Дихлорид (Z)-2-хлор-43-[(1S,2R)-6,7-диметокси-2-метил-1-(3,4,5-триметоксифенил)-1,2,3,4-тетрагидро-2-изохинолинио]пропил-1-3-(1R,2S)-6,7-диметокси-2 метил-1-[(3,4,5-триметоксифенил)метил]1,2,3,4-тетрагидро-2-изохинолиниопропил-2 бутендиоата. Раствор оксалилхлорида (36 ммоль) в СH2 Сl2 (18 мл) добавляли по каплям к перемешиваемому раствору продукта стадии (б) (2,22 г; 3,61 ммоль) в ДХЭ (25 мл). Эту реакционную смесь перемешивали в течение 1 ч при к.т., а затем нагревали при температуре образования флегмы в течение 5 мин. Избыток оксалилхлорида удаляли в вакууме и полученную пену растворяли в ДХЭ (15 мл). Добавляли раствор смеси продуктов стадии (а) примера синтеза 1 (2,00 г; 3,58 ммоль) в ДХЭ (5 мл), и полученный раствор перемешивали в течение ночи при к.т. Растворитель выпаривали, и смесь очищали ЖХСД,как описано в примере синтеза 1, стадия (в). 17 Лиофилизация дала продукт, указанный в заголовке, в виде белого твердого вещества (731 мг,выход 19%): MC m/z 496 (М 2+, 100). Нижеследующие соединения получали по методике, аналогичной примеру синтеза 2.MC m/z 511 (М 2+, 100). Пример синтеза 3. (Способ Б). Альтернативный способ получения соединения примера 2.01.(а) 2,2-Диоксид 1,3-диокса-2-тиана. К раствору 1,3-пропандиола (50 г; 0,65 моль) в четыреххлористом углероде (ССl4) (650 мл) добавляли тионилхлорид (57,5 мл, 93,7 г; 0,79 моль) и в течение 1,5 ч нагревали эту смесь до образования флегмы. Этот раствор охлаждали до 0 С и разбавляли MeCN (550 мл) с последующим последовательным добавлением хлоргидрата рутения (III) (81 мг; 0,39 ммоль), периодата натрия (210,0 г; 0,98 моль) и Н 2O (980 мл). Полученную оранжевую смесь перемешивали при к.т. в течение 1,5 ч, а затем разбавляли диэтиловым эфиром (Et2O) (6 л). Отделенную органическую фазу промывали водой, насыщенным NaHCO3 и солевым раствором. Et2O слой сушили и фильтровали через слой силикагеля. Фильтрат концентрировали, и полученное масло обрабатывали диэтиловым эфиром (50 мл) и гексанами (100 мл) и хранили при 5 С в течение 18 ч. Фильтрация полученного осадка дала соединение, указанное в заголовке, в виде не совсем белого твердого вещества (79,0 г; выход 87%): т.пл. 54-56 С. 18 вали при 65 С в течение 5 ч. Смесь охлаждали до к.т., и полученный осадок собирали фильтрацией и перетирали с MeCN с получением соединения, указанного в заголовке, в виде не совсем белого порошка (30,0 г; выход 60%): т.пл. 207-209 С; МС m/z 534 (М+23, 60), 512 (М+1,30), 432 (М-SO3, 100).(в) Хлорид (1S,2R)-6,7-диметокси-2-(3 гидроксипропил)-2-метил-1-(3,4,5-триметоксифенил)-1,2,3,4-тетрагидро-2-изохинолининия. Ацетилхлорид (35 мл; 38,8 г; 0,49 моль) по каплям добавляли к охлажденному во льду МеОН (350 мл), и полученный раствор перемешивали в течение 10 мин. Добавляли продукт со стадии (б) (28,1 г; 0,05 моль) и перемешивали реакционную смесь при к.т. в течение 6 ч. Этот раствор нейтрализовали осторожным добавлением избытка NaHCO3 и твердые вещества отфильтровывали с помощью слоя целита. Фильтрат упаривали, а остаток растворяли в СНСl3. Полученное твердое вещество отфильтровывали посредством слоя целита и промывали СН 3 Сl. Фильтрат упаривали, оставшийся остаток растворяли в Н 2 О и водный раствор насыщали хлоридом натрия. Водную фазу экстрагировали СН 3 Сl, а органические слои сушили и концентрировали с получением соединения, указанного в заголовке, в виде гигроскопичного белого твердого вещества (25,0 г; выход 98%): МС m/z 432 (М+, 100).(1R)-(-)-5-Метоксилауданозин (52,6 г; 0,13 ммоль) подвергали процедуре (б). Полученный материал перетирали с ацетоном с получением продукта, указанного в заголовке, в виде не совсем белого порошка (49,3 г; выход 69%): т.пл. 191-193 С; МС m/z 526 (М+1, 100).(е) Монохлорид (Z)-2-хлор-1-3-(1R,2S)6,7-диметокси-2-метил-1-[(3,4,5-триметоксифенил)метил]-1,2,3,4-тетрагидро-2-изохинолинио пропилводород 2-бутендиоата. Раствор продукта стадии (д) (15 г; 31,1 ммоль) и продукта стадии (а) примера синтеза 2(6,4 г; 37 ммоль) в CH2Cl2 (50 мл) перемешивали в течение ночи при к.т. Эту реакционную смесь разбавляли СН 2 Сl2 (150 мл), охлаждали до -20 С и по каплям добавляли триэтиламин (18,2 мл; 130,4 ммоль). Реакционную смесь нагревали до 0 С, добавляли к ней СНСl3 (200 мл), и эту смесь промывали смесью солевого раствора с водой (2:1), содержащей метансульфоновую 19 кислоту (4 мг/мл). СНСl3 слой отделяли и объединенные водные слои насыщали хлоридом натрия, подкисляли концентрированной соляной кислотой (HCl) (9 мл) и снова экстрагировали СНСl3. Объединенные СНСl3 слои сушили и концентрировали, и полученную пену перетирали с Et2OH. Продукт в виде желто-коричневого твердого вещества, указанный в заголовке, собирали фильтрованием (16,3 г; выход 86%): спектральные данные идентичны данным продукта, указанного в заголовке стадии (б) примера синтеза 2.(ж) (Пример 3.01). Дихлорид (Z)-2-хлор-43-[(1S,2R)-6,7-диметокси-2-метил-1-(3,4,5 триметоксифенил)-1,2,3,4-тетрагидро-2-изохинолинио]пропил-1-3-(1R,2S)-6,7-диметокси 2-метил-1-[(3,4,5-триметоксифенил)метил]1,2,3,4-тетрагидро-2-изохинолиниопропил-2 бутендиоата. Продукт стадии (е) (7,0 г; 11,4 ммоль) обрабатывали оксалилхлоридом, а затем подвергали взаимодействию с продуктом стадии (в) (6,62 г; 11,9 ммоль) как описано в примере синтеза 2,стадия (в). Реакционную смесь концентрировали и полученный материал очищали ЖХСД как описано в примере синтеза 1, стадия (в). Лиофилизация дала продукт, указанный в заголовке,в виде белого твердого вещества (8,7 г; выход 72%): спектральные данные идентичны данным для продукта, указанного в заголовке стадии (в) примера синтеза 2. Пример синтеза 4. (Способ В). Альтернативный способ получения соединений примеров 2.01 или 3.01.(а) Монохлорид (Е)-2-хлор-1-3-(1R,2S)6,7-диметокси-2-метил-1-[(3,4,5-триметоксифенил)метил]-1,2,3,4-тетрагидро-2-изохинолинио пропилводород 2-бутендиоата. К раствору продукта стадии (д) примера синтеза 3 (2,5 г; 5,2 ммоль) и имидазола (0,35 г,5.2 ммоль) в CH2Cl2 (35 мл) при -15 С добавляли раствор хлормалеинового ангидрида (0,69 г; 5,2 ммоль) в CH2Cl2 (10 мл). Через 10 мин эту смесь разбавляли СН 3 Сl и промывали смесью солевого раствора и Н 2O (2:1), содержащей метансульфоновую кислоту (4 мг/мл). Органические слои промывали солевым раствором, сушили и упаривали с получением соединения,указанного в заголовке, в виде желтого гигроскопичного твердого вещества: МС m/z 578 (M+,100).(б) (Пример 4.01). Дихлорид (Z)-2-хлор-43-[(1S,2R)-6,7-диметокси-2-метил-1-(3,4,5 триметоксифенил)-1,2,3,4-тетрагидро-2-изохинолинио]пропил-1-3-(1R,2S)-6,7-диметокси 2-метил-1-[3,4,5-триметоксифенил)метил]1,2,3,4-тетрагидро-2-изохинолиниопропил-2 бутендиоата. Раствор продукта стадии (а) (198 мг; 0,32 ммоль), оксалилхлорида (281 мкл, 3,2 ммоль) и диметилформамида (ДМФ) (1 капля) в CH2Cl2 (4 20 мл) нагревали при температуре образования флегмы в течение 2 ч. Эту смесь упаривали совместно с CH2Cl2 и сушили в вакууме. Остаток растворяли в ДХЭ (5 мл), добавляли смесь продуктов стадии (а) примера синтеза 1 (300 мг; 0,64 ммоль) и перемешивали эту смесь при к.т. в течение 18 ч. Растворитель выпаривали, и неочищенный материал очищали, как описано в примере синтеза 1, стадия (в). Лиофилизация дала продукт, указанный в заголовке, в виде белого твердого вещества (80 мг; выход 23%): спектральные данные идентичны данным для продукта, указанного в заголовке стадии (в) примера синтеза 2. Нижеследующее соединение получали по методике, аналогичной примеру синтеза 4.(а) Ангидрид 2,2-дифторянтарной кислоты. Смесь 2,2-дифторянтарной кислоты (1,15 г; 7,46 моль), тионилхлорида (4 мл, 20,6 ммоль) и бензола (4 мл) нагревали при температуре образования флегмы в течение 2,5 ч. Смесь фильтровали и фильтрат концентрировали с получением продукта, указанного в заголовке, в виде масла, которое кристаллизовалось при стоянии(б) Монохлорид 2,2-дифтор-1-3(1R,2SR)-6,7-диметокси-2-метил-1-[(3,4,5 триметоксифенил)метил]-1,2,3,4-тетрагидро-2 изохинолиниопропилводород бутендиоата. Раствор смеси (3:1) смеси продуктов стадии (б) примера синтеза 1 (2,7 г; 5,60 моль) и продукта стадии (а) (838 мг; 6,16 ммоль) в ДХЭ(80 мл) перемешивали в течение ночи при к.т. Растворитель выпаривали с получением смеси(1R,2S)- и (1R,2R)-продукта (3:1 соответственно), указанного в заголовке, в виде желтого гигроскопичного твердого вещества (3,5 г; 5,60 ммоль, выход 100%): МС m/z 582 (M+, 70).(в) (Пример 5.01). Дихлорид 2,2-дифтор-43-[(1S,2R)-6,7-диметокси-2-метил-1-(3,4,5 триметоксифенил)-1,2,3,4-тетрагидро-2-изохинолинио]пропил-1-3-(1R,2S)-6,7-диметокси 2-метил-1-[(3,4,5-триметоксифенил)метил]1,2,3,4-тетрагидро-2-изохинолиниопропил)бутандиоата. Смесь продуктов стадии (б) (2,0 г; 3,24 ммоль) обрабатывали оксалилхлоридом, а затем подвергали взаимодействию со смесью продуктов стадии (а) примера синтеза 1 (1,73 г; 3,10 ммоль) как описано в примере синтеза 2, стадия(в). Эту реакционную смесь концентрировали и полученный материал очищали ЖХСД, как описано в примере синтеза 1, стадия (в). Лиофили 21 зация дала продукт, указанный в заголовке, в виде белого твердого вещества (466 мг, выход 27%): МС m/z 498 (M2+, 100). Пример синтеза 6. (Способ Б). Альтернативный способ получения соединения примера 5.01.(а) Монохлорид 2,2-дифтор-1-3-(1R,2S)6,7-диметокси-2-метил-1-[(3,4,5-триметоксифенил)метил]-1,2,3,4-тетрагидро-2-изохинолинио-пропилводород бутандиоата. Продукт стадии (д) примера синтеза 3 (3,0 г; 6,22 ммоль) обрабатывали аналогично тому,как описано в примере синтеза 5, стадия (б). Продукт, указанный в заголовке, получали в виде гигроскопичного желтого вещества (3,21 г; выход 83%): спектральные данные соответствовали предполагаемой структуре.(б) (Пример 6.01). Дихлорид 2,2-дифтор-43-[(1S,2R)-6,7-диметокси-2-метил-1-(3,4,5-триметоксифенил)-1,2,3,4-тетрагидро-2-изохинолинио]пропил-1-3-(1R,2S)-6,7-диметокси-2 метил-1-[3,4,5-триметоксифенил)метил]-1,2,3,4 тетрагидро-2-изохинолиниопропил-бутандиоата. Продукт стадии (а) (3,0 г; 4,85 ммоль) обрабатывали оксалилхлоридом, а затем подвергали взаимодействию со смесью продуктов стадии(а) примера синтеза 1 (2,44 г; 4,37 ммоль), как описано в примере синтеза 1, стадия (в). Реакционную смесь концентрировали и полученный материал очищали ЖХСД, как описано в примере синтеза 1, стадия (в). Лиофилизация дала продукт, указанный в заголовке, в виде белого твердого вещества (1,3 г; выход 37%): спектральные данные были идентичны данным для продукта стадии (в) примера синтеза 5. Нижеследующие соединения получали по методике аналогично примеру синтеза 6. 22 Пример синтеза 7. Альтернативный способ получения соединений примеров 5.01 и 6.01.(а) (Пример 7.01). Дихлорид 2,2-дифтор-43-[(1S,2R)-6,7-диметокси-2-метил-1-(3,4,5-триметоксифенил)-1,2,3,4-тетрагидро-2-изохинолинио]пропил-1-3-(1R,2S)-6,7-диметокси-2 метил-1-[(3,4,5-триметоксифенил)метил]1,2,3,4-тетрагидро-2-изохинолиниопропилбутандиоата. Неразбавленный оксалилхлорид (25 мл; 0,28 моль) по каплям добавляли к раствору продукта стадии (а) примера синтеза 6 (7,0 г; 11,0 ммоль) в ДХЭ (150 мл). Раствор перемешивали при к.т. в течение 3,5 ч. Растворитель и избыток оксалилхлорида удаляли при пониженном давлении, а оставшуюся пену вновь растворяли в ДХЭ (35 мл). Добавляли продукт стадии (в) примера синтеза 3 (4,7 г; 10,0 ммоль) в ДХЭ (35 мл) и перемешивали реакционную смесь в течение ночи при к.т. Растворитель выпаривали и продукт очищали ЖХСД как описано в примере синтеза 1, стадия (в). Лиофилизация дала продукт, указанный в заголовке, в виде белого твердого вещества (5,63 г; выход 53%) со спектральными данными, идентичными данным для продукта, указанного в заголовке стадии (в) примера синтеза 5. Нижеследующее соединение получали по методике, аналогичной примеру синтеза 7.(Пример 8.01). Дихлорид (Z)-4-3-[(1S,2R)6,7-диметокси-2-метил-1-(3,4,5-триметоксифенил)-1,2,3,4-тетрагидро-2-изохинолинио] пропил-1-[3-(1R,2S)-6,7-диметокси-2-метил-1[(3,4,5-триметоксифенил)метил]-1,2,3,4-тетрагидро-2-изохинолиниопропил-2-фтор-2 бутендиоата. Твердый К 2 СО 3 (97 мг, 0,702 ммоль) добавляли к раствору продукта, указанного в заголовке примера синтеза 7 (750 мг; 0,702 ммоль),в ДМФ (5 мл) и перемешивали смесь при к.т. в течение 1 ч, а затем фильтровали. Фильтрат разбавляли СН 3 Сl (50 мл) и промывали смесью солевого раствора и Н 2O (1:1, рН 1). Органический слой сушили и концентрировали, а остаток перетирали с Et2OH и очищали как описано в примере синтеза 1, стадия (в). Продукт, указанный в заголовке, получали в виде белого порошка (404 мг; 0,385 ммоль; выход 52%): MCm/z 488 (M2+, 80). Нижеследующее соединение получали по методике, аналогичной примеру синтеза 8.(Пример 8.02). Дихлорид (Z)-4-3-[(1S,2R)6,7-диметокси-2-метил-1-(3,4,5-триметоксифе 23 нил)-1,2,3,4-тетрагидро-2-изохинолинио] пропил-1-3-(1R,2S)-2-метил-6,7,8-триметокси-1-[(3,4,5-триметоксифенил)метил]-1,2,3,4 тетрагидро-2-изохинолиниопропил-2-фтор-2 бутендиоата. Анализ. Рассчитано для С 54 Н 71N2 О 15 Сl2F5H2O: С,55,52; Н 6,99; N, 2,40; Cl, 6,07. Найдено: С, 55,52; Н, 6,96; N, 2,40; Cl, 6,15. Биологическая активность Кошек анестезировали альфа-хлоралозой(80 мг/кг) и пентобарбиталом (10 мг/кг) внутрибрюшинно [J.J.Savarese Anesthesia and Analgesia,Vol. 52, No 6, November-December, (1973)]. Малоберцовый нерв раздражали прямоугольными импульсами при супермаксимальном напряжении при частоте 0,15 Гц и регистрировали вызванные подергивания передней берцовой мышцы. Макаков-резусов анестезировали кетамином (5 мг/кг) и пентобарбиталом (5 мг/кг), которые вводили внутримышечно или внутривенно. Анестезию поддерживали смесью галотана(40%). Общий малоберцовый нерв супермаксимально стимулировали прямоугольными импульсами продолжительностью 0,2 мс при частоте 0,15 Гц. Судорожные сокращения регистрировали через сухожилие мышцы-разгибателя пальцев стопы. У всех животных интубировали трахею и поддерживали вентиляцию на уровне 12-15 мл/кг, 18-28 вздохов в минуту. Животных, которые не получали ингаляционные анестетики,вентилировали комнатным воздухом. В левую бедренную вену и артерию вставляли канюли для введения лекарственных средств и для регистрации артериального давления, соответственно. Внутривенно вводили соединения формулыI, перечисленные в таблице. ЕD95, т.е. доза соединений формулы (I), необходимая для того,чтобы вызвать 95% блокирование судорожной реакции, дана в таблице. Отсутствие данных для конкретных параметров или конкретных номеров примеров указывает, что данные не были получены.ED95, мг/кг Начало, Длительность,Высвобождение Комментарий мин мин гистамина, мг/кг 0,1-0,15 1,2-1,5 3,3-7,0 3,2-6,4 0,3 0,8 0,07 3,1 1,2 0,06 10,5 1,2-1,6 0,05-0,08 1 9,5-5,5 3,2-6,4 То же самое для 3.01 и 4.01 0,3 0,3 3,5 0,05-0,07 1 3,5 6,0 3,2-6,4 То же самое для 6.01 и 7.01 0,25 0,04 7,0 0,035 32,0 3,2 0,12 1 9,5 6,4 0,006 4,0 3,2 8,0-9,0 где Х представляет собой галоген,h равно числу от 1 до 2,Y представляет собой водород или метокси,Z1 и Z2 представляют собой метил,W1 и W2 представляют собой углерод, и А представляет собой фармацевтически приемлемый анион. 2. Соединение формулы (I), которое включает в себя дихлорид дихлорид (Z)-4-3-[(1S,2R)-6,7-диметокси 2-метил-1-(3,4,5-триметоксифенил)-1,2,3,4 тетрагидро-2-изохинолинио]пропил-1-3(1R,2S)-6,7-диметокси-2-метил-1-[(3,4,5 триметоксифенил)метил]-1,2,3,4-тетрагидро-2 изохинолиниопропил-2-фтор-2-бутендиоата и дихлорид 2,2-дифтор-4-3-[(1S,2R)-6,7 диметокси-2-метил-1-(3,4,5-триметоксифенил)1,2,3,4-тетрагидро-2-изохинолинио]пропил-13-(1R,2S)-2-метил-6,7,8-триметокси-1-[(3,4,5 триметоксифенил)метил]-1,2,3,4-тетрагидро-2 изохинолиниопропилбутандиоата. 3. Фармацевтический состав, содержащий соединение по п.1 или 2 в сочетании с одним или более чем одним фармацевтически приемлемым носителем. 4. Способ индуцирования нервномышечного паралича у млекопитающего, при котором указанному млекопитающему вводят эффективное индуцирующее нервно-мышечный паралич количество соединения по п.1 или 2. 5. Применение соединения по п.1 или 2 в качестве нервно-мышечного блокатора. 6. Применение соединения по п.1 или 2 для изготовления лекарства для индуцирования нервно-мышечной блокады. 7. Соединение формулы (II) где Х представляет собой галоген,Т представляет собой гидроксил или галогенид,Y представляет собой водород или метокси,Z представляет собой метил,W представляет собой углерод, n равно 0 или 1, h равно 1 или 2, и А представляет собой фармацевтически приемлемый анион. 26 8. Способ получения соединения формулыX, Y, Z1, Z2, W1, W2 и А такие, как определено в п.1,при котором соединение формулы (Ia)X, Y, Z1, Z2, W1, W2 и А такие, как определено в п.1,подвергают взаимодействию с основанием в полярном апротонном растворителе. 9. Способ получения соединения формулы(I), при котором соединение формулы (II), как оно определено в п.7, подвергают взаимодействию с соединением формулы (III) где Y представляет собой водород или метокси,Z представляет собой метил,W представляет собой углерод,n равно 0 или 1, и А представляет собой фармацевтически приемлемый анион,в органическом растворителе.
МПК / Метки
МПК: C07D 217/20, A61K 31/47, A61P 41/00
Метки: изохинолины, замещенные, действия, ультракраткосрочного, нервно-мышечных, качестве, блокаторов
Код ссылки
<a href="https://eas.patents.su/14-2224-zameshhennye-izohinoliny-v-kachestve-nervno-myshechnyh-blokatorov-ultrakratkosrochnogo-dejjstviya.html" rel="bookmark" title="База патентов Евразийского Союза">Замещенные изохинолины в качестве нервно-мышечных блокаторов ультракраткосрочного действия</a>
Предыдущий патент: Составы на основе зипразидона
Следующий патент: Танк
Случайный патент: Способ повышения нефтеотдачи


















