Опиоидные соединения, замещенные карбоксамидогруппой
Формула / Реферат
1. Соединение формулы (I)
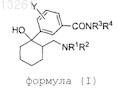
где R1и R2, каждый независимо, являются выбранными из группы, состоящей из водорода, С1-С4-алкила и алкилдиила, где R1 и R2, взятые совместно с атомами, к которым они присоединены, образуют моноциклическое кольцо;
R3 и R4, каждый независимо, являются выбранными из группы, состоящей из водорода, С1-С4-алкила, С3-7-циклоалкила и алкилдиила, где R3и R4, взятые совместно с атомами, к которым они присоединены, образуют моноциклическое кольцо;
Y представляет собой водород, С1-С4-алкил, С1-С4-алкокси, галоген или трифторметил;
и его фармацевтически приемлемые энантиомеры, диастереомеры, таутомеры, сольваты и соли.
2. Соединение по п.1, в котором R1 и R2, каждый независимо, являются выбранными из группы, состоящей из водорода и C1-4-алкила.
3. Соединение по п.1, в котором R1 и R2, каждый независимо, являются выбранными из группы, состоящей из водорода и метила.
4. Соединение по п.1, в котором R1 и R2, каждый, представляют собой метил.
5. Соединение по п.1, в котором R3 и R4, каждый независимо, являются выбранными из группы, состоящей из водорода, C1-4-алкила, С3-7-циклоалкила и C1-4-алкилдиила, где R3 и R4, взятые совместно с атомами, к которым они присоединены, образуют моноциклическое кольцо.
6. Соединение по п.1, в котором R3 и R4, каждый независимо, являются выбранными из группы, состоящей из водорода, метила и циклопропила.
7. Соединение по п.1, в котором R3 и R4, каждый, представляют собой водород.
8. Соединение по п.1, в котором Y представляет собой водород, C1-4-алкил, С1-4-алкокси или галоген.
9. Соединение по п.1, в котором Y представляет собой водород, метил или метокси.
10. Соединение по п.1, в котором Y представляет собой водород.
11. Соединение по п.1 в виде его 1R,2R/1S,2S-энантиомерной пары.
12. Соединение, выбранное из группы, состоящей из
3-[(1-RS,2-SR)-2-[(диметиламино)метил]-1-гидроксициклогексил]бензамида;
3-[(1-RS,2-RS)-2-[(диметиламино)метил]-1-гидроксициклогексил]бензамида;
(-)-3-[(1R,2R)-rel-2-[(диметиламино)метил]-1-гидроксициклогексил]бензамида;
(+)-3-[(1S,2S)-rel-2-[(диметиламино)метил]-1-гидроксициклогексил]бензамида;
3-[(1-RS,2-RS)-2-[(диметиламино)метил]-1-гидроксициклогексил]-N,N-диэтилбензамида;
N-циклопропил-3-[(1-RS,2-RS)-2-[(диметиламино)метил]-1-гидроксициклогексил]бензамида и
3-[(1-RS,2-RS)-2-[(диметиламино)метил]-1-гидроксициклогексил]-N-метилбензамида.
13. Соединение, выбранное из группы, состоящей из
(-)-3-[(1R,2R)-rel-2-[(диметиламино)метил]-1-гидроксициклогексил]бензамида и
(+)-3-[(1S,2S)-rel-2-[(диметиламино)метил]-1-гидроксициклогексил]бензамида.
14. Соединение, представляющее собой (+)-3-[(1S,2S)-rel-2-[(диметиламино)метил]-1-гидроксициклогексил]бензамид.
15. Фармацевтическая композиция, содержащая соединение по п.1 и фармацевтически приемлемый носитель.
16. Способ лечения боли у пациента, в котором предусмотрен прием пациентом терапевтически эффективного количества соединения по п.1.
17. Фармацевтическая композиция, содержащая соединение по п.14 и фармацевтически приемлемый носитель.
18. Способ лечения боли у пациента, в котором предусмотрен прием пациентом терапевтически эффективного количества соединения по п.14.
Текст
013261 Перекрестная ссылка на родственные заявки По данной заявке испрашивается приоритет в соответствии с предварительной заявкой США 60/571298, поданной 14 мая 2004, полное содержание которой приведено в данном описании в качестве ссылки в полном объеме. Заявление относительно федерального субсидирования исследования и разработки Описанные ниже исследование и разработка настоящего изобретения не субсидировались федеральным правительством. Уровень техники Гидрохлорид трамадола, (1RS,2RS)-2-(диметиламино)метил-1-(3-метоксифенил)циклогексанолHCl(трамадол), является анальгетиком центрального действия, который имеет неожиданное отличие от морфина, прототипа истинного опиоидного анальгетика. Хотя трамадол был введен в клиническую практику в 1970-е без предположения о различиях в механизме действия с опиоидами, данные, накопленные на данное время в предклинических исследованиях, клинических испытаниях, эпидемиологических сообщениях и широко распространенного применения на пациентах, показали, что различие имеет место. Трамадол является анальгетиком центрального действия, атипичным в том, что его эффективность, как кажется, может быть приписана множественным механизмам действия. Соединение и его энантиомеры связываются с -опиоидными рецепторами грызунов и человека со слабым сродством и с меньшим сродством к - или -опиоидным рецепторам. O-дезметильный метаболит трамадола связывается с более высоким сродством, чем исходное соединение, но, тем не менее, с гораздо меньшим сродством, чем морфин. Таким образом, активация -опиоидных рецепторов, как кажется, является одним из компонентов механизма действия трамадола, но недостаточна сама по себе для объяснения антиноцицептивной и анальтезирующей активности и эффективности трамадола. Второй, неопиоидный компонент был постулирован из нескольких данных наблюдений, которые включают в себя неполную обратимость налоксона в большинстве моделей на животных и в клинических испытаниях на людях; и затухание его антиноцицептивного или анальтезирующего эффекта при действии неопиоидных антагонистов. Таким образом, результаты являются совместимыми с двойственным механизмом действия, опиоидным и неопиоидным, с преобладанием механизма действия, возможно зависящим от вида, пути назначения или индивидуальной природы боли. Было предположено, что источник двойственности механизма возникает из различной фармакологии двух энантиомеров трамадола,причем один является более подобным опиоидам, чем другой энантиомер. Анальгетики, которые оказывают воздействие через -опиоидный рецептор, обычно представляют собой фенолы и эфиры фенолов. Они часто страдают тем недостатком, что они метаболически инактивируются путем конверсии в глюкурониды, которые быстро выводятся из организма. Было найдено, что карбоксамидная группа является эффективным биоизостерным заменитилем для фенольной группы в определенного вида бензоморфанах и морфинанах, что привело к серии опиоидов с превосходным временем биологической жизни (Wentland M.P. et al. Bioorg. Med. Chem. Lett., 2001, 11(5), 623-6; WentlandGMBH Assignee). Разновидность аналогов трамадола впервые описана в международной заявкеWO 03/048113, опубликованной 12 июня 2003 (Senanayake С.Н. et al., Seprecor Assignee). Таким образом,существует необходимость ингибировать метаболическую инактивацию трамадола, которая происходит через превращение его гидроксиметаболита в соответствующий глюкуронид. В настоящем изобретении метоксизаместитель трамадола был заменен на карбоксамидогруппу. Сущность изобретения Настоящее изобретение относится к карбоксамидозамещенным опиоидным соединениям, представленным формулой (I) где R1 и R2, каждый независимо, являются выбранными из группы, состоящей из водорода, низшего алкила и алкилдиила, где R1 и R2, взятые совместно с атомами, к которым они присоединены, образуют моноциклическое кольцо;R3 и R4, каждый независимо, являются выбранными из группы, состоящей из водорода, низшего алкила, С 3-7-циклоалкила и алкилдиила, где R3 и R4, взятые совместно с атомами, к которым они присоединены, образуют моноциклическое кольцо;-1 013261 и их фармацевтически приемлемым энантиомерам, диастереомерам, таутомерам, сольватам и солям. Краткое описание чертежей Фиг. 1 показывает антигипералгезический эффект соединений 3 и 4 в модели воспалительной боли на крысах, индуцированной инъекцией CFA и инфракрасным светом. Фиг. 2 показывает анальгезирующий эффект соединения 3 в модели невропатической боли с перевязкой спинального нерва (SNL). Фиг. 3 показывает результаты исследования развития толерантности к антиаллодиническому эффекту соединения 3. Фиг. 4 показывает результаты исследования развития толерантности к антиаллодиническому эффекту морфина. Подробное описание изобретения Варианты осуществления настоящего изобретения включают в себя те соединения формулы (I), гдеR1 и R2 , каждый независимо, являются выбранными из группы, состоящей из водорода и С 1-4-алкила. Варианты осуществления настоящего изобретения включают в себя те соединения формулы (I) , гдеR1 и R2, каждый независимо, являются выбранными из группы, состоящей из водорода и метила. Варианты осуществления настоящего изобретения включают в себя те соединения формулы (I), гдеR1 и R2, каждый, представляют собой метил. Варианты осуществления настоящего изобретения включают в себя те соединения формулы (I) , гдеR3 и R4, каждый независимо, являются выбранными из группы, состоящей из водорода, C1-4-алкила, С 3-7 циклоалкила и C1-4-алкилдиила, где R3 и R4, взятые совместно с атомами, к которым они присоединены,образуют моноциклическое кольцо. Варианты осуществления настоящего изобретения включают в себя те соединения формулы (I), гдеR3 и R4, каждый независимо, являются выбранными из группы, состоящей из водорода, метила и циклопропила. Варианты осуществления настоящего изобретения включают в себя те соединения формулы (I), гдеR3 и R4, каждый, представляют собой водород. Варианты осуществления настоящего изобретения включают в себя те соединения формулы (I), гдеY представляет собой водород или галоген. Варианты осуществления настоящего изобретения включают в себя те соединения формулы (I), гдеY представляет собой водород, метил или метокси. Варианты осуществления настоящего изобретения включают в себя те соединения формулы (I), гдеY является водородом. Далее вариант осуществления настоящего изобретения включает в себя те соединения формулы (I),которые представляют собой их 1R,2R/1S,2S-энантиомерные пары. Приводимые в качестве примера соединения по настоящему изобретению включают в себя 3-[(1-RS,2-SR)-2-[(диметиламино)метил]-1-гидроксициклогексил]бензамид; 3-[(1-RS,2-RS)-2-[(диметиламино)метил]-1-гидроксициклогексил]бензамид;N-циклопропил-3-[(1-RS,2-RS)-2-[(диметиламино)метил]-1-гидроксициклогексил]бензамид и 3-[(1-RS,2-RS)-2-[(диметиламино)метил]-1-гидроксициклогексил]-N-метилбензамид. Соединения по настоящему изобретению могут также присутствовать в форме фармацевтически приемлемых солей. Для применения в медицине соли соединений настоящего изобретения принадлежат к нетоксичным "фармацевтически приемлемым солям" (лит.: International J. Pharm., 1986, 33, 201-217; J.Pharm. Sci, 1997 (Jan), 66, 1, 1). Однако другие соли могут применяться при получении соединений согласно настоящему изобретению или их фармацевтически приемлемых солей. Репрезентативные органические или неорганические кислоты включают в себя без ограничения соляную, гидробромную, гидроиодную, хлорную, серную, азотную, фосфорную, уксусную, пропионовую, гликолевую, молочную, янтарную, малеиновую, фумаровую, яблочную, винную, лимонную, бензойную, миндальную, метансульфоновую, гидроксиэтансульфоновую, бензолсульфоновую, щавелевую, памоиковую, нафталин-2-сульфоновую,пара-толуолсульфоновую, циклогексансульфамовую, салициловую, сахариновую или трифторуксусную кислоту. Репрезентативные органические или неорганические основания включают в себя без ограничения основные или катионные соли, такие как бензатиновую, хлорпрокаиновую, холиновую, диэтаноламиновую, этилендиаминовую, меглюминовую, прокаиновую, алюминиевую, кальциевую, литиевую, магниевую, калиевую, натриевую и цинковую. Когда соединения согласно настоящему изобретению являются хиральными, они, согласно этому,могут существовать как энантиомеры. Кроме того, соединения могут существовать как диастереомеры. Понятно, что все такие стереоизомеры и их рацемические смеси включены в объем притязаний настоящего изобретения. Помимо этого, некоторые кристаллические формы для этих соединений могут существовать как полиморфы и в таком качестве предназначаться для включения в настоящее изобретение.-2 013261 Кроме того, некоторые соединения могут образовывать сольваты с водой (например, гидраты) или обычными органическими растворителями, и такие сольваты также предназначены для включения в область настоящего изобретения. До тех пор пока не утверждается иное, термин "алкильная группа" относится к насыщенной линейной или разветвленной цепи, состоящей целиком из 1-8 атомов углерода, замещенных атомами водорода,предпочтительно 1-6 атомов углерода, замещенных атомами водорода, и наиболее предпочтительно 1-4 атомов углерода, замещенных атомами водорода. До тех пор пока не утверждается иное, термин "алкоксигруппа" относится к спиртовому радикалу,полученному путем удаления атома водорода от гидроксильного кислорода спирта, имеющего насыщенную линейную или разветвленную углеводородную цепь. Углеводородная цепь состоит целиком из 1-8 атомов углерода, замещенных атомами водорода, предпочтительно 1-6 атомов углерода, замещенных атомами водорода, и наиболее предпочтительно 1-4 атомов углерода, замещенных атомами водорода. Новые карбоксамидные опиоидные соединения по настоящему изобретению являются полезными модуляторами -опиоидного рецептора. В частности, настоящие карбоксамидные опиоидные соединения являются модуляторами -опиоидного рецептора, применимыми как анальгетики. Далее, настоящие карбоксамидные опиоидные соединения представляют собой модуляторы -опиоидного рецептора, применимые как анальгетики с улучшенными фармакокинетическими свойствами. Примеры боли, находящиеся в области настоящего изобретения, включают в себя, но не ограничены ими, центрально опосредованную боль, периферически опосредованную боль, боль, связанную с конструктивным или легким повреждением ткани, боль, связанную с прогрессирующим заболеванием, такую как боль при раке, невропатическую боль и острую боль, такую как вызываемая резким повреждением, травмой или хирургическим вмешательством и хроническую боль, такую как вызываемая невропатическими состояниями, периферийной невропатией при диабете, пост-герпетической невралгией, невралгией тройничного нерва,посттравматическими болевыми синдромами или группой их, или головные боли при мигрени. Применимость настоящих соединений в качестве модуляторов -опиоидного рецептора может быть определена согласно описанным здесь методикам. Вариантом осуществления изобретения является фармацевтическая композиция, содержащая один или несколько соединений данного изобретения в соединении с фармацевтически приемлемым носителем. Другим вариантом осуществления является фармацевтическая композиция, приготовленная путем смешения любого из соединений, описанных выше, и фармацевтически приемлемого носителя. Следующим вариантом осуществления является способ для приготовления фармацевтической композиции, содержащий смешивание любого из соединений, описанных выше и фармацевтически приемлемого носителя. Другой вариант осуществления настоящего изобретения состоит в способе лечения боли, модулируемого -опиоидным лигандом. В способе лечения боли, модулируемой -опиоидным лигандом, пациенту, нуждающемуся в этом,назначали любое из соединений, описанное здесь, в терапевтически эффективной дозе для модулирования -опиоидного рецептора. Соединение может быть назначено пациенту, нуждающемуся в лечении,любым традиционным путем назначения, включая без ограничения пероральный, назальный, сублингвальный, глазной, наружный, ректальный, вагинальный и парентеральный (например, подкожный,внутримышечный, внутрикожный, внутривенный и т.д.). Другой вариант осуществления изобретения состоит в способе лечения боли у пациента, уже толерантного к одному или нескольким -опиоидным препаратам, иным, чем соединение или соединения,описанные здесь, который включает в себя назначение субъекту, нуждающемуся в этом, любого из соединений, определенных здесь, в терапевтически эффективной дозе для модулирования -опиоидного рецептора. Соединение может быть назначено пациенту, нуждающемуся в лечении, любым традиционным путем назначения, включая без ограничения пероральный, назальный, сублингвальный, глазной,наружный, ректальный, вагинальный и парентеральный (например, подкожный, внутримышечный, внутрикожный, внутривенный и т.д.). Терапевтически эффективная доза для применения настоящих соединений или их фармацевтической композиции содержит дозу, варьирующую от около 0,001 до приблизительно 1000 мг, в частности от около 0,1 до приблизительно 500 мг или более предпочтительно от около 1 до приблизительно 250 мг активного ингредиента в день для среднего (70 кг) человека. Карбоксамидозамещенные опиоиды, описанные здесь, могут быть назначаемы в уменьшенной дозировке по сравнению с их гидрокси аналогами,поскольку это допустимо их улучшенным фармакокинетическим профилем. При пероральном назначении фармацевтическая композиция, предпочтительно предоставляемая в форме таблеток, включающих в себя 0,01, 0,05, 0,1, 0,5, 1,0, 2,5, 5,0, 10,0, 15,0, 25,0, 50,0, 100, 150, 200,250 и 500 мг активного ингредиента для симптоматической корректировки дозы применительно к находящемуся на лечении пациенту. Преимущественно соединения по настоящему изобретению могут назначаться в виде одиночной разовой дозы или общая суточная доза может быть назначена в раздельных дозах два, три или четыре раза в день. Для специалиста в данной области очевидно, что терапевтически эффективная доза активных со-3 013261 единений изобретения или их фармацевтическая композиция будет изменяться согласно желаемому эффекту. Следовательно, оптимальные дозировки для назначения легко могут быть определены и будут изменяться в зависимости от индивидуального применяемого соединения, режима назначения, интенсивности получения и прогресса в состоянии заболевания. Кроме того, факторы, связанные с индивидуальным пациентом, находящимся на лечении, включая возраст пациента, вес, режим питания и время назначения, будут приводить к необходимости корректировки дозы к соответствующему терапевтическому уровню. Соединения настоящего изобретения могут быть назначены в любой из вышеупомянутых композиций и режимах дозировки или посредством тех композиций и режимов дозировки, которые установлены в данной области всякий раз, когда в качестве модуляторов -опиоидного рецептора требуется применение соединений изобретения для пациента, имеющего такую необходимость. В настоящем описании, особенно на схемах и примерах, применены следующие сокращения:TEA = триэтиламин. Общие способы синтеза Репрезентативные соединения по настоящему изобретению могут быть синтезированы согласно общим синтетическим способам, описанным ранее, и проиллюстрированы более четко на нижеследующих схемах. Так как схемы являются иллюстрациями, изобретение не должно быть истолковано как ограниченное только представленными химическими реакциями и условиями. Получение различных исходных веществ, применяемых на схемах, хорошо известно для специалиста в данной области. Во время любого способа получения соединений по настоящему изобретению может быть необходимо и/или желательно защищать чувствительные или реакционноспособные группы, присутствующие в любой из обсуждаемых молекул. Это может быть достигнуто способами традиционных защитных групп,таких как те, что описаны в Protective Groups in Organic Chemistry, ed. J.F.W. McOmie, Plenum Press, 1973; и T.W. GreeneP.G.M. Wuts, Protective Groups in Organic Synthesis, John WileySons, 1991. Защитные группы могут быть удалены на подходящей последующей стадии с применением способов, известных в данной области. Репрезентативные соединения по настоящему изобретению могут быть синтезированы способами,представленными на схеме А. Циклогексанон А 1 может быть превращен с использованием реакции Манниха с формальдегидом и амином формулы А 2 в соединение формулы A3, где R1 и R2 определены ранее. Y-функционализированный арилмагниевый реагент формулы А 4, полученный согласно литературным данным (Knochel P. et al. Synlett., 2003, 6, 885-887), может быть добавлен к кетону формулы A3,что приводит к соединению формулы А 5. Обработка соединения формулы А 5 гидроксиданионом приводит к карбоксамидзамещенным соединениям формулы А 6. Схема В представляет альтернативный синтетический путь к соединениям по настоящему изобретению. Обработка ангидридом трифторметансульфоновой кислоты Y-функционализированного производного метаболита трамадола В 1, который может быть синтезирован с использованием способов, известных из литературы, приводит к соединениям формулы В 2. Схема В Соединения формулы В 2 могут быть превращены в соединения формулы В 3 через реакцию метоксикарбонилирования с использованием пропускания газообразного монооксида углерода через метанол в присутствии палладиевого катализатора и лиганда, такого как 1,1'-бис(дифенилфосфино)ферроцен. Соединения формулы В 3 могут быть омылены с применением щелочи с образованием соответствующей карбоновой кислоты В 4. Соединения формулы В 4 далее могут быть переведены в соединения формулы (I) путем сочетания карбоксильной группы с амином формулы В 5 в присутствии соответствующего связующего агента, такого как HATU, в апротонном растворителе. Диастереомеры по настоящему изобретению могут быть разделены хроматографией на обращенной фазе или нормальной фазе или путем фракционной кристаллизации. Рацемические соединения по настоящему изобретению могут быть разделены на индивидуальные энантиомеры с использованием способов, известных из литературы (ЕР 786450). Специальные примеры Специфические соединения, которые являются репрезентативными, получали в настоящем изобретении согласно нижеследующим примерам и последовательностям реакций; примеры и диаграммы, обозначающие последовательности реакций, представлены в ходе иллюстрации с целью понимания изобретения и не должны быть истолкованы любым способом для ограничения изобретения, изложенного в формуле изобретения, прилагаемой ниже. Настоящие соединения могут также применяться как интермедиаты в последующих примерах для получения дополнительных соединений по настоящему изобретению. Не было сделано попытки оптимизировать выходы, полученные в любой из реакций. Для специалиста в данной области известно, как увеличить такие выходы через общепринятые вариации в продолжительностях реакции, температурах, растворителях и/или реагентах. Реагенты приобретали в коммерческих источниках. Спектры ядерного магнитного резонанса (ЯМР) для атомов водорода измеряли в указанном растворителе с использованием тетраметилсилана (TMS) в качестве внутреннего стандарта на спектрометре Bruker Biospin, Inc. DPX-300 (при 300 МГц). Величины представляли в частях на миллион слабопольного сдвига от TMS. Масс-спектры (MS) измеряли на спектрометре Micromass Platform LC или спектрометре Agilent LC с применением электроспрей-методики. Стереоизомерные соединения могут быть охарактеризованы как рацемические смеси или как их отдельные диастереомеры и энантиомеры с использованием рентгеноструктурного анализа и других способов,известных для специалиста в данной области. В частности, хиральные разделения получали методом препаративной ВЭЖХ с использованием колонки типа Prochrom LC50 на Dynamic Axial Compression. Оптические вращения определяли с применением поляриметра Perkin-Elmer, модель 241. До тех пор,пока не утверждается иное, вещества, использованные в примерах, получали от легкодоступных коммерческих поставщиков или синтезировали стандартными способами, известными для специалиста в области химического синтеза. Замещающие группы, которые варьируют в примерах, являются атомом водо-5 013261 рода до тех пор, пока не утверждается иное. Методика А. 3-[(2-Диметиламинометил]-1-гидроксициклогексил]бензонитрил. 2 М раствор изопропилмагний хлорида в THF (5,4 мл, 2 М раствора в THF, 10,9 ммоль) добавляли по каплям к раствору 3-иодобензонитрила (2 г, 8,7 ммоль) в THF (20 мл) при 0 С. После перемешивания в течение 30 мин, добавляли 2-диметиламинометилциклогексанон и удаляли баню со льдом. Через 1 ч реакцию останавливали насыщенным водным хлоридом аммония (20 мл) и добавляли этилацетат (40 мл). Органическую фазу отделяли, затем экстрагировали водным раствором 1 N соляной кислоты (220 мл). Кислотные экстракты объединяли, затем рН доводили до щелочной среды действием 2 N раствора гидроксида натрия. Затем щелочной раствор экстрагировали хлороформом (320 мл). Органические экстракты объединяли, высушивали (K2 СО 3), фильтровали и концентрировали при уменьшенном давлении,что приводило к 3-[(2-диметиламино)метил]-1-гидроксициклогексил]бензонитрилу в виде смеси четырех диастереомеров (1,66 г, 73%). Пример 1. 3-[(1-RS,2-SR)-2-[(Диметиламино)метил]-1-гидроксициклогексил]бензамид, соединение 1. Образец 3-[(2-диметиламино)метил]-1-гидроксициклогексил]бензонитрила (методика А, 1,66 г,6,4 ммоль) в виде смеси диастереомеров растворяли в трет-бутаноле (20 мл), добавляли порошкообразный гидроксид калия (1,8 г, 32,1 ммоль) и реакцию доводили до кипения с обратным холодильником в течение 1 ч. После охлаждения реакции добавляли хлороформ (50 мл) и воду (50 мл). Органический слой отделяли, высушивали (K2 СО 3), фильтровали и концентрировали, что дало 3-[(2-диметиламино)метил]-1 гидроксициклогексил]бензамид в виде смеси диастереомеров(1,6 г, 93%). Смесь очищали на колонке с обращенной фазой С-18 с 0,5% раствором ацетата аммония в воде и ацетонитрилом в качестве элюентов. Соединение 1, 3-[(1-RS,2-SR)-2-[(диметиламино)метил]-1-гидроксициклогексил]бензамид, элюировалось первым. Следующим элюировалось соединение 2, 3-[(1-RR,2-SS)-2-[(диметиламино)метил]-1-гидроксициклогексил]бензамид. Альтернативный способ разделения соединений 1 и 2 использует изократическую смесь 85:15 0,01 М сульфата натрия в воде (нормализованного до рН 2,5 серной кислотой) и метанола и колонку С-18, которую промывали чистым метанолом между прогонами. Чистые фракции отделенного соединения 2 и чистые фракции разделенного соединения 1 обрабатывали раздельно, но идентично: растворители упаривали, и результирующую смесь (чистый изомер + вода + 0,01 М раствор ацетата аммония в воде(нормализованный до рН 2,5 серной кислотой инжектировали на колонке С-18, предварительно промытой водой для удаления любых солей. Впоследствии чистая диастереомерная смесь смывалась с колонки градиентом воды и метанола. Пример 2. 3-[(1-RS,2-RS)-[(2-Диметиламино)метил]-1-гидроксициклогексил]бензамид, соединение 2. Вышеупомянутое соединение элюировалось вторым в разделении, описанным в примере 1: CI-MS(M+H) m/z=277. Пример 3. (-)-3-[(1R,2R)-rel-[(2-Диметиламино)метил]-1-гидроксициклогексил]бензамид, соединение 3. Затем 3-[(1-RS,2-RS)-2-[(диметиламино)метил]-1-гидроксициклогексил]бензамид расщепляли с применением колонки Chiralpak AD с использованием 100% ацетонитрила в качестве элюента и 100% этанола для промывки колонки между каждым инжектированием, что приводило к (-)-3-[(1R,2R)-rel-2[(диметиламино)метил]-1-гидроксициклогексил]бензамиду (2,25 г): MS: m/z 277,0 (МН+); []25D -33,5(с 1, CHCl3). Аналитическая ВЭЖХ на обращенной фазе (градиент 10-90% MeCN, 0,1% водная TFA)[]25D +33,6 (с 1, CHCl3). Аналитическая ВЭЖХ на обращенной фазе (градиент 10-90% MeCN, 0,1% водная TFA) tR=1,49 мин, 99%. 1 Н ЯМР (CDCl3)1,35-1,43 (с, 1 Н), 1,55-1,65 (м, 2 Н), 1,66-1,68 (м, 3 Н), 1,74-1,80 (м, 1 Н), 1,88 (д, 1 Н,J=13,2 Гц), 2,02-2,06 (м, 3 Н), 2,18 (с, 6 Н), 2,43-2,45 (м, 1 Н), 5,75 (с, 1 Н), 6,46 (с, 1 Н), 7,43 (т, 1 Н, J=7,7 Гц),7,69-7,72 (м, 2 Н), 8,01 (с, 1 Н). Методика В. 3-[(1-RS,2-RS)-2-[(диметиламино)метил]-1-гидроксициклогексил]фениловый эфир трифторметансульфоновой кислоты. 1,0 г 60% NaH в масле помещали в колбу и промывали гексаном. NaH суспендировали в 20 млCH2Cl2 и охлаждали в бане со льдом. Добавляли 3-[(1-RS,2-RS)-2-[(диметиламино)метил]-1-гидроксициклогексил]фенол (6,3 г 0,024 моль) в CH2Cl2 (20 мл). После перемешивания в течение 1 ч добавляли по каплям раствор ангидрида трифторметансульфоновой кислоты (6 мл в 10 мл CH2Cl2). Удаляли баню со льдом и перемешивали реакцию при комнатной температуре в течение 2 ч. Реакционную смесь промывали водой, насыщенным соляным раствором и высушивали (Na2SO4). Растворитель упаривали, что дало 11 г масла. Остаток пропускали через колонку с силикагелем (4:1, CH2Cl2:МеОН), что дало 7,9 г(83%) 3-[(1-RS,2-RS)-2-[(диметиламино)метил]-1-гидроксициклогексил]фенилового эфира трифторметансульфоновой кислоты. MS m/z=233 (M-OTf). Методика С. Метил 3-[(1-RS,2-RS)-[(2-диметиламино)метил]-1-гидроксициклогексил]бензоат. В автоклав помещали 3-[(1-RS,2-RS)-2-[(диметиламино)метил]-1-гидроксициклогексил]фениловый эфир трифторметансульфоновой кислоты (6,8 г, 0,018 моль), DMF (130 мл), МеОН (54 мл), DPPF (380 мг,8 моль%), Pd(OAc)2 (163 мг, 4 моль%) и TEA (5,4 мл). Газообразный монооксид углерода пропускали через реакционную смесь в течение 5 мин и автоклав закрывали и нагревали до 100 С в течение 2 ч. После охлаждения реакцию выливали в воду и экстрагировали со смесью 70:30 Et20:EtOAc (3 раза). Органические экстракты объединяли, промывали водой, насыщенным соляным раствором, высушивали(Na2SO4) и фильтровали. Растворитель упаривали в вакууме и остаток пропускали через колонку с силикагелем (смесь CH2Cl2:MeOH:NH4OH с соотношением 90:10:1), что дало 2,5 г (48%) вышеупомянутого соединения. MS m/z=292 (MH+). 1 Н ЯМР (CDCl3)8,2-7,4 (Ar, 4H), 3,9 (с, 3 Н), 2,3 (д, 1 Н), 2,1 (с, 6 Н), 1,9-1,3 (м, 10 Н). Методика D. 3-[(1-RS,2-RS)-[(2-Диметиламино)метил]-1-гидроксициклогексил]бензойная кислота. Смесь метил 3-[(1-RS, 2-RS)-2-[(диметиламино)метил]-1-гидроксициклогексил]бензоата (2,5 г,8,6 ммоль), МеОН (20 мл) и 3 N NaOH (9 мл) кипятили с обратным холодильником в течение 1,5 ч. МеОН упаривали в вакууме и остаток подкисляли действием HCl (конц.). Растворитель упаривали в вакууме и остаток растирали в порошок с Et2O. Твердое вещество высушивали за ночь в вакууме, что дало 2,2 г (92%) 3-[(1-RS, 2-RS)-2-[(диметиламино)метил]-1-гидроксициклогексил]бензойной кислоты. Пример 5. 3-[(1-RS,2-RS)-2-[(диметиламино)метил]-1-гидроксициклогексил]-N,N-диэтилбензамид,соединение 5. Навеску 3-[(1-RS,2-RS)-2-[(диметиламино)метил]-1-гидроксициклогексил]бензойной кислоты (0,1 г, 0,36 ммоль), CH2Cl2 (5 мл) и диэтиламин (0,08 мл, 0,36 ммоль) помещали в колбу и перемешивали в течение 5 мин. К реакции добавляли HATU (0,13 г, 0,36 ммоль) и перемешивание продолжали в течение 2 ч. Добавляли воду и отделяли органическую фазу, промывали еще раз водой, высушивали (Na2SO4) и фильтровали. Фильтрат упаривали в вакууме и остаток пропускали через колонку с силикагелем (смесь CH2Cl2:МеОН:NH4OH с соотношением 90:10:1), что дало 42 мг (35%) 3-[(1-RS,2-RS)-2-[(диметиламино)метил]-1-гидроксициклогексил]-N,Nдиэтилбензамида. MS m/z=333 (MH+). 1 Н ЯМР (CDCl3)7,7-7,2 (Ar, 4 Н), 3,6 и 3,2 (ушир.кв, 4 Н), 2,4 (дд, 1 Н), 2,1 (с, 6 Н), 2,0-1,5 (м, 10 Н),1,1 (ушир.т, 6 Н). Пример 6. N-Циклопропил-3-[(1-RS,2-RS)-2-[(диметиламино)метил]-1-гидроксициклогексил]бензамид, соединение 6. Указанное соединение получали с 45% выходом, применяя методику из примера 5, с заменой диэтиламина на циклопропиламин.MS m/z=317 (MH+); 1 Н ЯМР (CDCl3)7,7-7,2 (Ar, 4 Н); 2,1 (с, 6 Н); 2,0-1,5 (м, 12 Н); 0,5 (2 т, 4 Н). Пример 7. 3-[(1-RS,2-RS)-2-[(Диметиламино)метил]-1-гидроксициклогексил]-N-метилбензамид. Указанное соединение получали с 37% выходом, применяя методику из примера 5, с заменой диэтиламина на N-метиламин. MS m/z=291 (МН+); 1 Н ЯМР (CDCl3)7,7-7,2 (Ar, 4H), 2,9 (д, 3 Н); 2,1 (с, 6 Н), 2,3-1,5 (м, 10 Н). Соединения 1-7 формулы (I) в табл. 1 были синтезированы с применением методик, описанных выше. Биологические примеры Пример 1. Исследование связывания - и -опиоидного рецептора головного мозга крыс. Активность соединений по изобретению в качестве опиоидов была продемонстрирована в анализе связывания - и -опиоидного рецептора головного мозга крыс, как описано ниже. Методика. Самцов крыс Wistar (150-250 г, VAF, Charles River, Kingston, NY) умерщвляли путем смещения шейных позвонков и их головные мозги удаляли и немедленно помещали в ледяной буфер TRIS-HCl(50 мМ, рН 7,4). Передний мозг отделяли от остатков мозга коронарным сечением, начиная дорзально от колликулы и проходя снизу через границу средний мозг-варолиев мост. После отсекания передний мозг гомогенизировали в буфере TRIS в гомогенизаторе Teflon-glass. Гомогенат разбавляли до концентрации 1 г ткани передней доли мозга на 100 мл TRIS буфера и центрифугировали при 39000G в течение 10 мин. Осадок повторно суспендировали в том же самом объеме буфера TRIS посредством нескольких кратких пульсаций в гомогенизаторе Polytron. Такое получение частиц применяли для исследований связывания опиоидного рецептора. После инкубирования с -опиоидным селективным белковым лигандом[3 Н]-DAMGO или -опиоидным селективным лигандом [3 Н]-DPDPE при 25 С, содержимое пробирок фильтровали через фильтр Whatman GF/B на клеточном коллекторе Brandel. Пробирки и фильтры промывали три раза 4 мл 10 мМ раствора HEPES (рН 7,4) и радиоактивность, связанную с фильтрами, измеряли с использованием сцинтилляционной жидкости Formula 989 (New England Nuclear, Boston, MA) в сцинтилляционном счетчике. Анализ. Данные использовали для вычисления величины Ki с применением программы GraphPad Prism. Пример 2. Исследование [35S]GTPS-связывания -опиоидных СНО-клеточных мембран человека. Получение мембран.-СНО клеточные мембраны человека приобретали от Receptor Biology, Inc. (Baltimore, MD). Около 10 мг/мл мембранного белка суспендировали в растворе, содержащем 10 мМ TRIS-HCl, рН 7,2, 2 мМEDTA, 10% сахарозы. Мембраны сохраняли при 4-8 С. К 15 мл холодного буфера для исследования, содержащего 50 мМHEPES, рН 7,6, 5 мМ MgCl2, 100 мМ NaCl, 1 мМ DTT и 1 мМ ЭДТА добавляли 1 мл мембран. Суспензию мембраны гомогенизировали два раза с применением Polytron и центрифугировали при 3000 об/мин в течение 10 мин. Супернатант затем центрифугировали при 18000 об/мин в течение 20 мин. Осадок повторно суспендировали с применением Polytron в 10 мл буфера для исследования. Методика инкубирования. Осадок мембран (20 мкг/мл) предварительно инкубировали с бусами для анализа сцинтилляционного приближения (SPA, 10 мг/мл) при 25 С в течение 45 мин в буфере для исследования. Бусы SPA(5 мг/мл) связывали с мембранами (10 мкг/мл), затем инкубировали с 0,5 нМ [35S]GTPS в том же самом буфере HEPES, содержащем 50 мкМ GDP в общем объеме 200 мкл. Для стимулирования [35S]GTPSсвязывания применяли диапазон концентраций агонистов рецептора. Базальное связывание тестировали в отсутствие агониста и неспецифическое связывание тестировали в присутствии 10 мкМ немеченногоGTPS. Радиоактивность измеряли на Packard TopCount. Данные. Данные рассчитывали по следующей формуле:% базального=(стимулированное-неспецифическое)100/(базальное-неспецифическое),% ингибирования=(%базальное от 1 мкМ DAMGO-% базальное от соединения)100/(% базальное от 1 мкМ DAMGO-100). Исследование [35S] GTPS-связывания в NG108-15 клеточной мембране. Получение мембран. Клеточные мембраны NG108-15 закупали от Applied Cell Sciences (Rockville, MD). Порцию мембранного белка, объемом 8 мг/мл, суспендировали в растворе, содержащем 10 мМ TRIS-HCl, рН 7,2, 2 мМ EDTA, 10% сахарозы. Мембраны сохраняли при 4-8 С. Порцию мембран, объемом 1 мл, добавляли к 10 мл холодного буфера для исследования, содержащего 50 мМ TRIS, рН 7,6, 5 мМ MgCl2, 100 мМ NaCl, 1 мМ DTT и 1 мМEGTA. Суспензию мембраны гомогенизировали два раза в Polytron и центрифугировали при 3000 об/мин в течение 10 мин. Супернатант жидкости затем центрифугировали при 18000 об/мин в течение 20 мин. Осадок повторно суспендировали в 10 мл буфера для исследования с использованием Polytron. Методика инкубирования. Осадок мембран (75 мкг/мл) предварительно инкубировали с бусами SPA (10 мг/мл) при 25 С в течение 45 мин в буфере для исследования. Бусы SPA (5 мг/мл) связывали с мембранами (37,5 мкг/мл),затем инкубировали с 0,1 нМ [35S] GTPS в том же самом TRIS буфере, включающем в себя 100 мкМGDP в общем объеме 200 мкл. Для стимулирования [35S] GTPS-связывания применяли диапазон концентраций агонистов рецептора. Базальное связывание тестировали в отсутствие агониста и неспецифическое связывание тестировали в присутствии 10 мкМ немеченного GTPS. Радиоактивность измеряли на счетчике Packard TopCount. Данные. Расчеты производили следующим образом: Пример 3. Модель воспалительной боли на крысах, индуцированная инъекцией CFA и инфракрасным светом. Интерплантарная инъекция грызунам полного адъюванта по Фрейнду (CFA) приводила к сильной,постоянной воспалительной реакции, характеризующейся хронической и четкой гипералгезией как к термическим, так и механическим раздражителям. Эти эффекты имели пик между 24-72 ч после инъекции, и могли длиться в течение от нескольких дней до нескольких недель. Для оценки способности соединений к ингибированию термической гипералгезии самцам крыс Sprague-Dawley (200-350 г) делали интерплантарную инъекцию (1:1 CFA:физиологический раствор, 100 мкл) в их левую заднюю лапу. Через 24 ч инкубационного периода измеряли задержки реакции на стимуляторе Radiant Heat Paw (RH) и сравнивали с исходными реакциями (пред-CFA). Аппарат RH автоматически регистрировал сдвиг лапы с поверхности стекла. В дальнейший анализ включали только тех крыс, у которых было отмечено по меньшей мере 25% уменьшение в задержке реакции от исходного (например, гипералгезия). После определения пост-CFA задержки крысам перорально вводили дозу (2,5 мл/кг) тестируемого соединения или наполнителя (гидроксипропилметилцеллюлоза, НРМС). Процентное игибирование гипералгезии вычисляли для каждого животного с применением следующей формулы:(отклик при обработке-пост-CFA отклик)/(пред-CFA-отклик-пост-CFA отклик)100. Таким образом, возвращение к нормальным пред-CFA пороговым величинам определяли как 100% эффективность, в то время как отсутствие изменений по сравнению с пост-CFA величиной составляло 0% эффективность. Среднее % обращение гипералгезии затем вычисляли для каждой обрабатываемой группы (n=6-8 крыс/группу). Соединения 3 и 4 являлись антигипералгезическими на этой модели (см. фиг. 1). Пример 4. Модель невропатической боли с перевязкой спинального нерва (SNL).-9 013261 Животные. Самцы крыс Sprague Dawley, весом от 145 до 165 г (приблизительно 6-недельного возраста) были получены от Harlan (Indianapolis, IN). Питание и вода находились в свободном доступе и поддерживался режим 12 ч света и 12 ч темноты. Животных группировали по клеткам в специфической беспатогенной,бесконтактной среде и позволяли акклиматизироваться в течение не менее чем 1 недели. После хирургического вмешательства животных размещали индивидуально в поликарбонатные клетки с твердым полом и с автоматическим увлажняющими устройствами при 22 С и относительной влажности 60%. Все животные находились на рационе Harland Tekland8604. Хирургия. Анестезию осуществляли с применением изофлурановой (IsoVet) ингаляции в камере для введения (3-5% в 2 л/мин О 2). После опрокидывания животное удаляли и помещали в конусную маску для носа, которая доставляла ингаляционный изофлуран (0,5-2,5% при 2 л/мин О 2). Спинную тазовую область выбривали и очищали асептическим хлоргексидиновым скрабом, 70% спиртом и 5% раствором хлоргексидина. Животное удерживали в положении лежа на животе на подогревающем коврике и осуществляли хирургическую методику, описанную Kim и Chung (1992). Левые параспинальные мышцы отделяли от остистого отростка на уровне от поясничного 4 до крестцового 2 (L4-S2). Когда мышцы были отделены,поперечный отросток L6 удаляли с применением небольших костных кусачек. После этого становились видимы спинные нервы L4 и L5. Затем L5 изолировали и перевязывали с применением шелковой нити 6-0. Теплый физиологический раствор и дозу антибиотика продолжительного действия назначали немедленно после операции до восстановления из анестезии. Исследование механической аллодинии. Через по меньшей мере одну неделю после хирургического вмешательства животных индивидуально помещали в тестирующую клетку Lucite с дном из проволочной сетки. Механическую (осязательную) аллодинию измеряли посредством записывания давления, при котором поврежденная лапа отдергивалась при ступенчатом стимулировании (нити по Von Frey, варьирующие от 4,0 до 148,1 mN, эквивалентных от 0,25 до 15 g давления), применялись к подошвенной поверхности лапы (между подушечками пальцев) по методике Chaplan (1994), для того чтобы вычислить порог отдергивания лапы (PWT). Нормальные крысы могут выдерживать по меньшей мере давление в 15 g без реакции. SNL крысы могут отвечать на небольшое давление, такое как 0,25 g. Крыс включали в это исследование, только если их PWT был ниже 4,0 g. Тестирование соединений по Von Frey. Животных использовали для тестирования соединения между 2 и 8 неделями после операции. Животных всегда предварительно тестировали на исходный порог отдергивания в день тестирования. Через 16 ч, быстро, PWT исследовали через 30 мин, 1, 2 и 4 ч после введения дозы. Исследование доза-отклик проводилось во время максимального эффекта. Исследования проводились слепым способом. Статистический анализ. Данные были нормализованы и результаты представлены как % максимального возможного эффекта (МРЕ) лекарства.% МРЕ=( g/силы-исходной g/силы)/(15 g/силы-исходной g/силы)100. Эффект примера соединений представлен в табл. 3, и соединение 3 имело ED50 величину 17 мг/кг после 2 ч (см. фиг. 2). Таблица 3 Эффект соединений в модели перевязки спинального нерва Пример 5. Исследование развития толерантности. Развитие толерантности к анальгезирующему эффекту -опиоидных соединений хорошо известно. Развитие толерантности к антиаллодиническому эффекту соединения 3 было исследовано путем назначения соединения крысам с перевязкой спинального нерва в течение пяти дней. Антиаллодинический эффект соединения оценивали на первый и пятый день. Введение дозы в течение пяти дней не уменьшало антиаллодинический эффект соединения; эффект соединения был тем же или слабо увеличивался при повторном введении дозы (см. фиг. 3). Напротив, толерантность к антиаллодиническому эффекту типичного -опиоидного морфина быстро развивалась, через пять дней введения дозы антиаллодинический эффект становился небольшим или отсутствовал (см. фиг. 4).- 10013261 Пример 6. Метаболическая стабильность. Метаболическая стабильность соединения 3 была исследована с применением нескольких подходов. Соединение инкубировали с микросомами печени мыши, крысы, собаки и человека и измеряли процент соединения, остающийся через десять минут. Соединение являлось метаболически стабильным на всех исследованных видах. Прежде всего, не наблюдалось метаболизма соединения в этих тестовых условиях в микросомах печени человека. Таблица 4 Метаболическая стабильность in vitro соединения 3 на нескольких видах (% соединения, остающегося после 10 мин инкубирования с микросомами печени) В продолжительном исследовании на микросомах печени человека процент остающегося соединения определяли при нескольких временах инкубирования (30, 60 и 90 мин). In vitro период полуразложения соединения определяли как более 100 мин. В исследовании с применением рекомбинантных Р 450 изоформных вариантов человека соединение представляло собой только слабый ингибитор (IC5010 мкМ) для всех тестированных изоформных вариантов, 3 А 4, 2D6, 2 С 9, 2 С 19 и 1 А 2. В исследовании с применением микросом печени человека in vitro не было обнаружено глюкуронидации соединения. Обобщая эти несколько исследований метаболизма in vitro, подчеркивают необычную метаболическую стабильность соединения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы (I) где R1 и R2, каждый независимо, являются выбранными из группы, состоящей из водорода, С 1-С 4 алкила и алкилдиила, где R1 и R2, взятые совместно с атомами, к которым они присоединены, образуют моноциклическое кольцо;R3 и R4, каждый независимо, являются выбранными из группы, состоящей из водорода, С 1-С 4 алкила, С 3-7-циклоалкила и алкилдиила, где R3 и R4, взятые совместно с атомами, к которым они присоединены, образуют моноциклическое кольцо;Y представляет собой водород, С 1-С 4-алкил, С 1-С 4-алкокси, галоген или трифторметил; и его фармацевтически приемлемые энантиомеры, диастереомеры, таутомеры, сольваты и соли. 2. Соединение по п.1, в котором R1 и R2, каждый независимо, являются выбранными из группы, состоящей из водорода и C1-4-алкила. 3. Соединение по п.1, в котором R1 и R2, каждый независимо, являются выбранными из группы, состоящей из водорода и метила. 4. Соединение по п.1, в котором R1 и R2, каждый, представляют собой метил. 5. Соединение по п.1, в котором R3 и R4, каждый независимо, являются выбранными из группы, состоящей из водорода, C1-4-алкила, С 3-7-циклоалкила и C1-4-алкилдиила, где R3 и R4, взятые совместно с атомами, к которым они присоединены, образуют моноциклическое кольцо. 6. Соединение по п.1, в котором R3 и R4, каждый независимо, являются выбранными из группы, состоящей из водорода, метила и циклопропила. 7. Соединение по п.1, в котором R3 и R4, каждый, представляют собой водород. 8. Соединение по п.1, в котором Y представляет собой водород, C1-4-алкил, С 1-4-алкокси или галоген. 9. Соединение по п.1, в котором Y представляет собой водород, метил или метокси. 10. Соединение по п.1, в котором Y представляет собой водород. 11. Соединение по п.1 в виде его 1R,2R/1S,2S-энантиомерной пары. 12. Соединение, выбранное из группы, состоящей из 3-[(1-RS,2-SR)-2-[(диметиламино)метил]-1-гидроксициклогексил]бензамида;(+)-3-[(1S,2S)-rel-2-[(диметиламино)метил]-1-гидроксициклогексил]бензамида. 14. Соединение, представляющее собой (+)-3-[(1S,2S)-rel-2-[(диметиламино)метил]-1-гидроксициклогексил]бензамид. 15. Фармацевтическая композиция, содержащая соединение по п.1 и фармацевтически приемлемый носитель. 16. Способ лечения боли у пациента, в котором предусмотрен прием пациентом терапевтически эффективного количества соединения по п.1. 17. Фармацевтическая композиция, содержащая соединение по п.14 и фармацевтически приемлемый носитель. 18. Способ лечения боли у пациента, в котором предусмотрен прием пациентом терапевтически эффективного количества соединения по п.14.
МПК / Метки
МПК: C07C 237/00
Метки: соединения, карбоксамидогруппой, опиоидные, замещенные
Код ссылки
<a href="https://eas.patents.su/14-13261-opioidnye-soedineniya-zameshhennye-karboksamidogruppojj.html" rel="bookmark" title="База патентов Евразийского Союза">Опиоидные соединения, замещенные карбоксамидогруппой</a>
Предыдущий патент: Способ и технологическая схема извлечения пропана
Следующий патент: Пероральные твёрдые лекарственные формы, содержащие низкую дозу эстрадиола
Случайный патент: Способ улучшения выживаемости после размораживания криоконсервированного биологического материала посредством стимуляции гидростатическим сжатием












