Применение [d-meala]3-[etval]4-циклоспорина для лечения инфекции гепатита с и фармацевтическая композиция, включающая [d-meala]3-[etval]4-циклоспорин
Номер патента: 12650
Опубликовано: 30.12.2009
Авторы: Дюмон Жан-Морис, Вуаньо Грегуар, Моверне Ролан-Ив, Скальфаро Пьетро
Формула / Реферат
1. Применение [D-MeAla]3-[EtVal]4-CsA для изготовления лекарственного средства, предназначенного для лечения инфекции вируса гепатита С (HCV) или для предотвращения рецидива HCV у пациента.
2. Применение по п.1, отличающееся тем, что указанное лекарственное средство дополнительно содержит, по меньшей мере, второй компонент, который является активным в отношении инфекции HCV.
3. Фармацевтическая композиция для лечения инфекции HCV или для предотвращения рецидива HCV, включающая в качестве активных компонентов эффективное количество [D-MeAla]3-[EtVal]4-CsA и эффективное количество второго компонента, который является активным в отношении инфекции HCV.
4. Фармацевтическая композиция по п.3, отличающаяся тем, что она дополнительно включает фармацевтически приемлемый носитель и, необязательно, разбавитель.
5. Способ лечения инфекции HCV или предотвращения рецидива HCV у пациента, включающий введение пациенту эффективного количества [D-MeAla]3-[EtVal]4-CsA.
6. Способ по п.5, включающий дополнительное введение второго компонента, который является активным в отношении инфекции HCV.
Текст
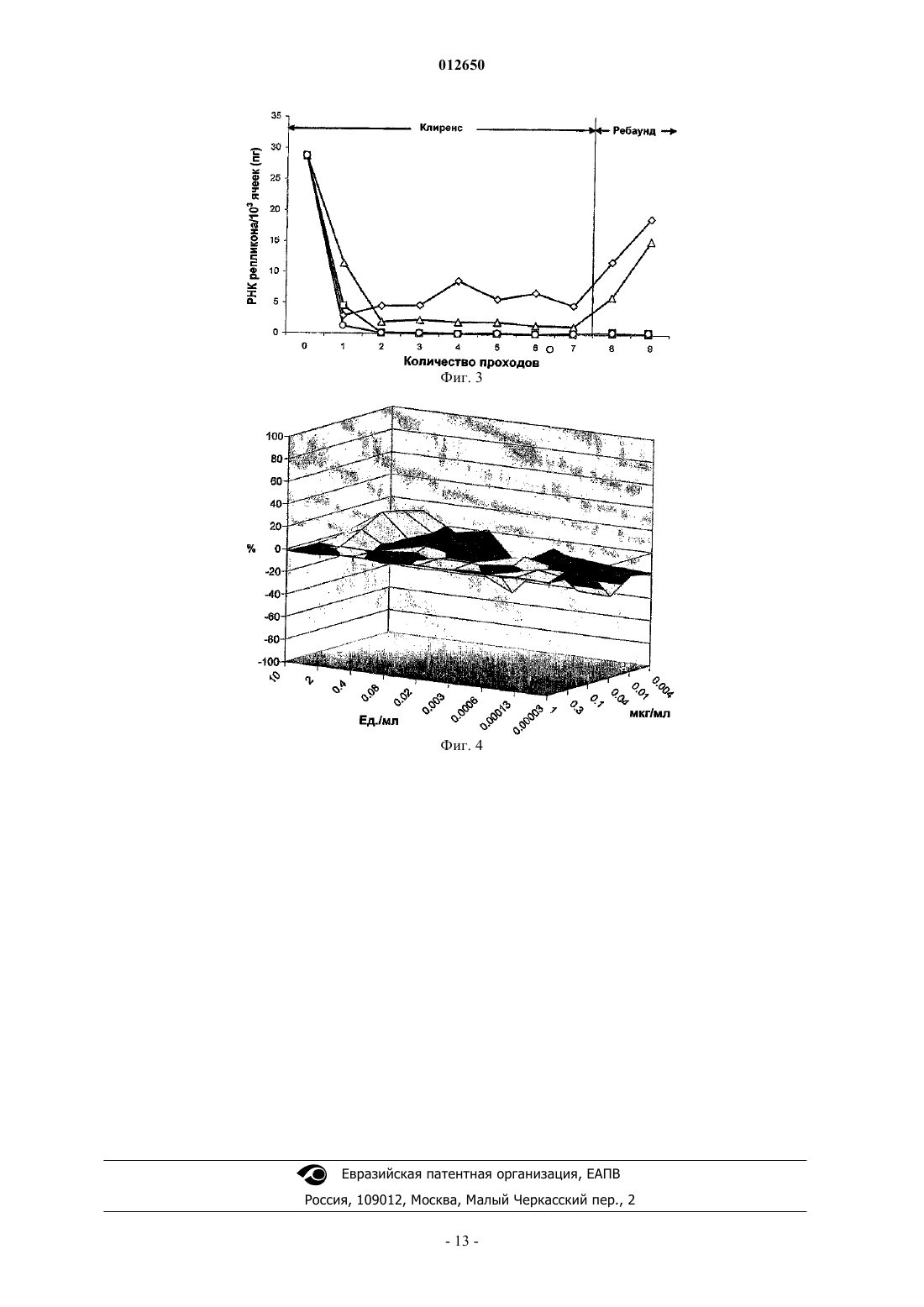
012650 Область техники Настоящее изобретение относится к применению циклоспорина для лечения инфекции вируса гепатита С (hepatitis С virus, HCV) и к фармацевтической композиции, включающей циклоспорин. Предшествующий уровень техникиHCV был клонирован и охарактеризован приблизительно 15 лет назад Choo и др. (см. Science 244,(1989), 359-362). HCV принадлежит к семейству флавивирусов (Flaviviridae) и включает нуклеокапсид,покрытый оболочкой, и однонитевой геном РНК положительной полярности (см. Bartenschlager et al.,Antiviral Res. 60, (2003), 91-102). HCV передается, прежде всего, с кровью, продуктами из крови и вертикальным переносом в течение беременности. Введение диагностических испытаний для скрининга продуктов крови значительно уменьшило скорость распространения новой инфекции. Однако HCV остается серьезной медицинской проблемой. В настоящее время приблизительно 170 млн человек инфицировано HCV. Начальное протекание инфекции обычно неострое. Однако иммунная система часто неспособна к освобождению от вируса, и люди с хроническими инфекциями подвергаются высокому риску заболевания циррозом печени и гепатоцеллюлярной карциномой (см. Poynardet al., Lancet 349, (1997), 825-832). Какая-либо доступная вакцина отсутствует, а терапевтические варианты очень ограничены (см.Manns et al., Indian J. Gastroenterol. 20 (Suppl. 1), (2001), C47-51; Tan et al., Nat. Rev. Drug Discov. 1,(2002), 867-881). Текущая терапия базируется на комбинации интерферона-альфа и рибавирина. Эта терапия вызывает устойчивый антивирусный отклик у 85-90% пациентов, инфицированных генотипами 2 и 3, но, к сожалению, только приблизительно у 45% пациентов, инфицированных наиболее распространенным генотипом 1. Кроме того, побочные эффекты существенны и включают миалгию, артралгию, головную боль,повышенную температуру, тяжелую депрессию, лейкопению и гематолитическую анемию. Очевидно, что для лечения инфекции HCV, особенно, например, в случае предотвращения повторения HCV требуются дополнительные терапии с более высокой антивирусной активностью и лучшим профилем безопасности. Чтобы установить безопасный профиль, для клинического лечения инфекцииHCV особенно важны такие критерии, как низкая цитотоксичность, а также цитостатический эффект и высокий индекс селективности. Новый подход к лечению инфекции HCV с использованием циклоспоринов был недавно описан клиническими наблюдениями (см. Teraoka et al., Transplant Proa, 1988, 20, (3 suppl. 3), 868-876, и Inoue etvitro внутриклеточную репликацию HCV субгеномного репликона при клинически достижимых концентрациях препарата (см. Watashi et al., Hepatology 38, 2003, 1282-1288, и Nakagawa et al., BBRC 313, 2004,42-47). Обе группы предположили, что анти-HCV действие CsA не связано с иммуносупрессивной активностью, основанной на наблюдениях, сделанных с использованием соответственно иммуносупрессивного макролида, т.е. соединения, известного под названием FK 506, и неиммуносупрессивного производного циклоспорина А, т.е. соединения, известного под названием NIM 811 или [Melle]4-CsA. Nakagawa и др. считают, что расширение применений CsA может вызвать существенные проблемы из-за его широко известных иммуносупрессивных свойств, и полагают, что один из методов решения этой проблемы заключается в том, чтобы принять во внимание использование неиммуносупрессивных аналогов циклоспорина. В течение последних 15 лет проводилось множество исследований в области химии лекарств с целью идентифицировать такие неиммуносупрессивные аналоги циклоспорина, и NIM 811 является одним из самых представительных соединений, обладающим таким качеством.Ko и др. в заявке на патент ЕР 0484281, касающейся их неиммуносупрессивных свойств, сообщали о NIM 811, наряду с девятью другими производными циклоспорина А, и рассматривали его как являющийся потенциально полезным в лечении инфекции ВИЧ и профилактике СПИДа. Синтез этих производных включал модификацию аминокислот в положениях 4 и/или 5 циклоспорина А. Изменяя аминокислоты в положениях 2 и/или 6 циклоспорина A, Sigal и др. синтезировали в сумме 61 аналог циклоспорина и заметили, что такие химические модификации вызывают уменьшение иммуносупрессивной активности (см. Sigal et al., J. Exp. Med., 173, 1991, 619-628). Последующие попытки модифицирования аминокислоты в положении 3 циклоспорина А с целью получения неиммуносупрессивных соединений были описаны, в частности, у Barrire и др. вWenger и др. синтезировали ряд соединений, которые отличаются от циклоспорина А в положении 3, в котором они содержат N-метилированную, небольшую гидрофобную или нейтральную аминокислоту, иную чем глицин, и в положении 4, в котором они содержат N-метилированную или Nэтилированную гидрофобную или нейтральную аминокислоту, иную чем лейцин. Указанные авторы сообщают, что эти соединения имеют высокую эффективность ингибирования репликации HIV-1 и, по существу, не обладают иммуносупрессивной активностью (см. публикацию международной заявки-1 012650 Сущность изобретения Задача настоящего изобретения заключается в том, чтобы обеспечить клинициста новой терапией при лечении инфекции HCV, особенно, например, в случае предотвращения рецидива HCV. Эта терапия должна предлагать более высокую антивирусную активность и лучший профиль безопасности по сравнению с уже проверенным или недавно предложенным лечением. Авторы настоящего изобретения неожиданным образом обнаружили, что введение HCVинфицированному пациенту особого соединения, а именно [D-MeAla]3-[EtVal]4-CsA, соответствует вышеупомянутым требованиям. Они заметили, что в дополнение к своему неиммуносупрессивному свойству [D-MeAla]3-[EtVal]4-CsA имеет значительно более высокое сродство к циклофилинам, чье повышенное сродство соотносится с повышенной эффективностью в отношении ингибирования репликацииHCV. Соответственно один из объектов настоящего изобретения относится к применению [D-MeAla]3[EtVal]4-CsA для изготовления лекарственного продукта, предназначенного для лечения инфекции HCV у пациента. О [D-MeAla]3-[EtVal]4-CsA сообщали Wenger и др. в WO 00/01715 и ему был приписан регистрационный номер CAS 254435-95-5. Он представляет собой циклический ундекапептид, описываемый следующей формулой:MeVal представляет собой N-метил-L-валин. Общепринятая нумерация положений аминокислот, в общем случае используемых в отношении циклоспорина А, показана под формулой. Это достигается путем использования сложных названий,включающих первую часть, указывающую на идентичность остатков, которые отличаются от тех же остатков в циклоспорине А с указанием их положения, и вторую часть, обозначенную как "CsA", указывающую на то, что все другие остатки являются идентичными тем же остаткам в циклоспорине А. Например, [Melle]4-CsA представляет собой циклоспорин, который является идентичным циклоспорину А за исключением того, что MeLeu в положении 4 заменен на Melle (N-метил-L-изолейцин). Краткое описание графических материалов Настоящее изобретение будет объясняться далее посредством следующих примеров и графических материалов, в которых фиг. 1 представляет гистограмму "доза-ответ", полученную с помощью анализа люциферазы в инфицированных клетках Huh-7-Lunet; фиг. 2 представляет гистограмму "доза-ответ", полученную с помощью анализа люциферазы в инфицированных клетках Huh-7,5-Lunet; фиг. 3 представляет кривые "клиренс-ответ" в инфицированных клетках Huh-9-13; фиг. 4 отражает трехмерное представление "доза-ответ" в комбинации с IFN/[D-MeAla]3-[EtVal]4CsA. Сведения, подтверждающие возможность осуществления изобретения Сложившиеся медицинские применения циклоспорина А связаны со способностью этого соединения подавлять клеточный иммунный ответ путем предотвращения продуцирования и высвобождения нескольких аутокринных факторов роста Т-клетки, включая интерлейкин 2 (IL-2), от активизированных Т-клеток (см. Borel (1989) Transplant. Proceed. 21, 810-815; Kronke et al. (1984) Proc. Natl. Acad. Sci. USA 81, 5214-5218; Faulds et al. (1993) Drugs 45, 953-1040). При попадании в клетки циклоспорин А связывается с циклофилинами с высоким сродством (см. Handschumacher et al. (1984) Science 226, 544-547). Поскольку среди различных биологических функций они обладают активностью пептидилпролил цистранс-изомеразы (PPIase), она может быть измерена in vitro (см. Fischer et al. (1989) Nature 337, 476-478;Takahashi и др. (1989) Nature 337, 473-475). Критическим для иммуносупрессивного действия циклоспорина А является взаимодействие между комплексом "циклофилин-циклоспорин А" и кальций- и кальмодулин-зависимой серин/треонин фосфатазой 2 В (кальцинейрин) (см. Hauske (1993) DNP 6, 705-711,Friedman et al. (1991) Cell 66, 799-806; Liu et al. (1991) Cell 66, 807-815). Образование этого тройного комплекса приводит к ингибированию активности фосфатазы кальцинейрина (см. Jain et al. (1993) Nature 365, 352-355; Rao et al. (1997) Annu. Rev. Immunol. 15, 707-747; Crabtree (1999) Cell 96, 611-614). Кальцинейрин способствует селективному дефосфорилированию нуклеарного фактора активированных Т-2 012650 лимфоцитов (NF-AT), который затем перемещается к ядру, где он связывается с белком активатора 1 и трансактивирует целевые гены, включая IL-2 ген. Полагают, что из-за аминокислот в положениях 3 и 4 [D-MeAla]3-[EtVal]4-CsA обладает существенно пониженной способностью взаимодействовать с кальцинейрином, как показано транскрипционным и иммунологическим анализом, а также значительно большим сродством к циклофилинам, как показано анализом ингибирования активности пептидилпролил цис-транс-изомеразы. Активность пептидилпролил цис-транс-изомеразы (PPIase) циклофилинов определяли, используя адаптированную методику от Kofron и др. (см. Biochemistry 30, 6127-6134 (1991); J. Am. Chem. Soc. 114,2670-2675 (1992. N-сукцинилированный Ala-Ala-Pro-Phe-пара-нитро-анилин (Suc-AAPF-pNA, Bachem,Bubendorf, Швейцария) использовали в качестве субстрата. Анализ основывался на предпочтительном расщеплении химотрипсином транс-изоформы связи Phe-pNA в тетрапептиде Ala-Ala-Pro-Phe-pNA. Это расщепление высвобождает фрагмент паранитроанилина, который может быть обнаружен и определен количественно при 390 нм (=11814 M-1 см-1) (Schutkowski et al. (1995) Biochemistry 34, 13016-13026). цистранс-Изомеризация катализируется циклофилином (PPIase, EC 5.2.1.8). После смешения CsA или другого циклоспорина (итоговые концентрации 10-9-210-5 М получены из сконцентрированных в 1000 раз имеющихся в продаже растворов в этаноле) с 0,1 мкг циклофилина (Sigma) в общем объеме 1,5 мл 40 мМ раствора HEPES, pH 7,9 и инкубации в течение 50 мин на льду реакционную смесь переносили в кювету,которую выдерживали при 10 С в спектрофотометре Varian. После добавления 3,75 мг химотрипсина(70 мкл раствора химотрипсина в 10 мМ HCl) реакцию инициировали добавлением 10 мкл 3,2 мМ раствора Suc-AAPF-pNA в 0,5 М LiCl/трифторэтанол. Реакцию контролировали в течение 3 мин и из полученных данных определяли начальную константу скорости. Для контроля начальную константу скорости определяли также для параллельной реакции, в которой отсутствовал циклофилин. Кривые "концентрация-ответ" строили для циклоспорина А и других циклоспоринов, и значения IC50 (ИК 50, 50%-ная ингибирующая концентрация) различных циклоспоринов выражали относительно ингибирующей концентрации циклоспорина А (1,0). Значение, меньшее 1, означает, что соединение имеет более высокое сродство к циклофилину, чем CsA. Первоначально для оценки иммуносупрессивной активности циклоспоринов использовали NF-ATзависимый анализ репортера (Baumann et al. (1992) Transplant. Proc. 24, 43-48). Т-клетки Jurkat, устойчиво трансфицированные репортерной структурой, содержащей бактериальный ген -галактозидазы под контролем промотора IL-2 гена, были получены от G. Zenke, Novartis Pharma AG, Basel, Швейцария. Клетки выращивали в среде RPM11640 с добавлением 10% эмбриональной телячьей сыворотки, инактивированной при высокой температуре, 100 Ед/мл пенициллина, 100 мкг/мл стрептомицина, 2 мМ глутамина,50 мкМ 2-меркаптоэтанола и 100 ед./мл гигромицина В. Клетки стимулировали добавлением 2,4 мкМ форбол-12-миристат-13-ацетата и 75 мкг/мл фитогемагглютинина в присутствии или в отсутствие циклоспорина А или другого циклоспорина (итоговые концентрации 10-9-210-5 М получены из сконцентрированных в 1000 раз имеющихся в продаже растворов в этаноле). После инкубации в течение 20 ч при 37 С клетки собирали и лизировали в 50 мМ Na2HPO4 (pH 9,0), 10 мМ KCl, 1 мМ MgSO4, 1%-ном растворе Triton X-100, 0,5 мМ 4-этилумбеллиферилD-галактозида (Sigma, Buchs, Швейцария). Реакция с-галактозидазой проходила в течение 1 ч в темноте при комнатной температуре. Флуоресцентный 4 метилумбеллиферон анализировали флуорометрически в надосадочной жидкости (длина волны возбуждения 355 нм; длина волны испускания 460 нм). Кривые "концентрация-ответ" строили для циклоспорина А и других циклоспоринов и значения IC50 различных циклоспоринов выражали относительно соответствующего значения для циклоспорина А (1,0). Значение, большее 1, означает, что соединение является менее иммуносупрессивным, чем CsA. Результаты, полученные в результате эксперимента, показаны в табл. 1 ниже. Таблица 1 Циклофилинсвязывающая (PPlase) и иммуносупрессивная (IL-2) активности CsA и других циклоспоринов Данные, приведенные в табл. 1, показали, что определенные замены в положении 4 (т.е. Val, Ile) значительно уменьшают иммуносупрессивную активность (измеренную как ингибирование IL-2 экспрессии), а также ощутимо увеличивают циклофилинсвязывающую активность (измеренную как ингибирование PPIase активности циклофилина). Замещение в положении 3 приводило к дальнейшему существенному увеличению циклофилинсвязывающей активности (в 2 раза или больше; ср. [D-MeAla]3[EtVal]4-CsA). Соединение имело более высокую циклофилинсвязывающую активность и более низкую остаточную иммуносупрессивную активность, чем [Melle]4-CsA, являющийся лучшим эталонным соединением, известным из литературы. Соединение [Melle]4-CsA также известно как NIM811.-3 012650 Неиммуносупрессивная активность [D-MeAla]3-[EtVal]4-CsA. В подтверждающем анализе иммуносупрессивную активность CsA, [Melle]4-CsA и [D-MeAla]3[EtVal]4-CsA оценивали с использованием смешанной лимфоцитной реакции. В этом анализе циклоспорины растворяли в этаноле (10 мг/мл). Смешивали свежевыделенные клетки CD4+ PBMCs от двух здоровых доноров с последующей инактивацией путем облучения одной из популяций (клетки стимулятора;S). Через пять дней совместного культивирования в присутствии или в отсутствие циклоспорина(1 мкг/мл) определяли пролиферативный ответ неинактивированной популяции клетки (клетки респондера; R) путем введения [3 Н]-тимидина. Анализ проводили перекрестно с двумя популяциями клетки, причем каждую инактивировали и стимулировали по очереди. Стимуляцию (%) клеток респондера рассчитывали по формуле процент возбуждения=100(образец с циклоспорином-фон)/(образец без циклоспорина-фон). Образец представляет собой смесь клеток респондера и стимулятора. Фон представляет собой контроль, в котором смешаны только клетки стимулятора. Результаты приведены в табл. 2. Они показывают, что и [Melle]4-CsA и [D-MeAla]3-[EtVal]4-CsA в значительной степени лишены иммуносупрессивной активности. Таблица 2 Пролиферативный ответ клеток CD4+ PBMCs в присутствии/в отсутствие циклоспориновR1S2 относится к сокультуре клеток респондера от донора 1 и клеток стимулятора от донора 2.N обозначает количество измерений. Высокая анти-HCV активность и низкий цитотоксический/цитостатический эффект [D-MeAla]3[EtVal]4-CsA. Как упоминалось ранее, инфекция вирусного гепатита С (HCV) представляет собой серьезную проблему для здоровья, потому что постоянно инфицированные пациенты подвергаются высокому риску развития хронических заболеваний печени, включая цирроз печени и гепатоцеллюлярную карциному. Известная из предшествующего уровня техники терапия (способы лечения) не подходит для большой части последней популяции, а также связана с существенными побочными эффектами. До недавнего времени развитию более эффективных терапий (способов лечения) препятствовало отсутствие соответствующей модели репликации HCV in vitro, которая позволяет осуществлять скрининг потенциально активных соединений до оценки в клинических испытаниях на человеке. Это препятствие было преодолено развитием генетически измененных мини-геномов HCV (репликонов), которые самоамплифицируются в культивируемых клетках гепатомы до высоких уровней (Lohmann et al. Science 285, (1999), 110113). Эта система репликона HCV быстро стала стандартным инструментом для изучения репликацииHCV, патогенеза и живучести (Bartenschlager et al. Antiviral Res. 60, (2003), 91-102). Геном HCV состоит из однонитевой РНК, которая содержит единственную открытую рамку считывания для полипротеинов из приблизительно 3000 аминокислот. Трансляция этого полипротеина инициируется на внутреннем сайте входа в рибосому (IRES), расположенном на 5' конце РНК. Полипротеин HCV расщепляется по меньшей мере на десять белков. Они включают капсидный белок С, оболочечные белки Е 1 и Е 2, возможный виропориновый белок р 7, неструктурные белки NS2 и NS3, имеющие активность серинпротеиназы, а также активность АТФазы/хеликазы, NS4A, индуцирующий мембранную сеть белок NS4B, NS5A и РНКзависимая РНК-полимераза NS5B. Первым успешным репликоном была бицистронная РНК, содержащая в направлении от 5' до 3' IRES HCV кодирующую последовательность для неомицин фосфотрансферазы,IRES от вируса энцефалокардита и кодирующие последовательности для белков HCV от NS3 до NS5. Можно показать, что после введения в клетки Huh-7 и селекции с использованием G418 (генетицин),этот репликон может автономно реплицироваться до высоких уровней (1000-5000 копий на клетку)(Lohmann et al., 1999). Характеристика системы показала, что эффективность репликации зависит от разрешения (пермиссивности) клетки хозяина и, что важно, от выбора адаптивных мутаций культуры клетки в кодирующих последовательностях белка HCV. Было обнаружено, что репликация является чувствительной к интерферону-альфа, что обеспечивает свидетельство пригодности системы для скрининга лекарств, которые являются эффективными in vivo. Также были сконструированы различные репликоны, в-4 012650 которых кодирующая последовательность "неомицин-фосфотрансфераза" была заменена, например, кодирующей последовательностью люциферазы или последовательностями, кодирующими слитый белок"люцифераза-убихитин-неомицин фосфотрансфераза". Репликация последних различных репликонов может быть проанализирована с помощью подходящего анализа люциферазы, тогда как репликация прежнего репликона требует определения числа копий РНК.(полимеразной ценной реакции обратной транскриптазы), что накопление РНК HCV в клетках МН-14,содержащих репликон HCV, ингибируется CsA, а не иммуносупрессивным макролидом FK506 и неиммуносупрессивным производным CsA PSC 833. Их анализы, которые включали 7-дневное воздействие активных агентов на клетки, показали, что титр РНК HCV уменьшается примерно в 200 раз в присутствии 1 мкг/мл циклоспорина А. Они далее обнаружили, что неиммуносупрессивный циклоспорин[Melle]4-CsA также ингибирует репликацию HCV. Результаты указывали на то, что [Melle]4-CsA примерно так же эффективен в снижении титра РНК HCV, как и CsA. Для того чтобы определить, имеет ли циклоспорин согласно настоящему изобретению анти-HCV активность и, если он имеет такую активность, то какова эта активность по сравнению с активностьюCsA и [Melle]4-CsA, были выполнены эксперименты, чтобы сравнить ингибирующие эффекты CsA,[Melle]4-CsA и [D-MeAla]3-[EtVal]4-CsA в системах репликона HCV. В анализах использовали клетки Huh 5-2, которые содержали бицистронную РНК, кодирующую слитый белок люцифераза-убихитин-неомицин фосфотрансфераза светлячка, и белки HCV NS3-5. Вирусные последовательности были получены из вируса HCV генотипа 1b. Клетки выращивали в средеRPMI 1640 (производитель Gibco) с добавлением 10%-ной эмбриональной телячьей сыворотки, 2 мМ глутамина (производитель Life Technologies), 1 заменимой аминокислоты (производитель Life Technologies), 100 ед/мл пенициллина, 100 мкг/мл стрептомицина и 250 мкг/мл G418 (Генетицин, Geneticin,производитель Life Technologies) при 37 С и 5% СО 2. Для антивирусного анализа (репликации) клетки высевали при плотности 7000 клеток на лунку в 96-луночный планшет View PlatesTM (производительPackard) в той же самой среде, за исключением G418. После 24-часовой инкубации среду удаляли, добавляли последовательные разбавления испытуемых соединений в среде и клетки инкубировали в течение еще 72 ч. Антивирусное действие оценивали с помощью анализа люциферазы или количественной RT-PCR. Для выполнения анализов люциферазы среду удаляли, а клетки промывали с использованием фосфатного буфера PBS. После лизиса в 50 мкл буфера Glo-lysis (производитель Promega) в течение 15 мин к клеточным лизатам добавляли 50 мкл реагента для анализа люциферазы Stead-Glo Lusiferase Assay Reagent(производитель Promega). Активность люциферазы измеряли с использованием люминометра и сигнал от каждой тестовой ячейки выражали как процент от сигнала, измеренного в ячейках культур, не подвергаемых воздействию тестового соединения. Распределение клеток и цитостатические эффекты оценивали в параллельных культурах в стандартном 96-луночном планшете (Beckton-Dickinson) с использованием МТТ анализа (CellTiter 96R AQueousNon-Radioactive Cell Proliferation Assay, Promega). В этом анализе 3-(4,5-диметилтиазол-2-ил)-5-(3 карбоксиметоксифенил)-2-(4-сульфофенил)-2 Н-тетразолий (MTS) восстанавливался биологически до формазана, который количественно определялся при 498 нм в планшет-ридере. Продуцирование формазана непосредственно связано с числом живых клеток. В анализе RT-PCR количественно определяли область репликонов неомицина с использованием датчиков последовательности ABI PRISM 7700 (Applied Biosystems, Foster City, CA). Прямыми и обратными используемыми праймерами являлись 5'-CCGGCTACCTGCCCATTC-3' и 5'CCAGATCATCCTGATCGACAAG-3' соответственно. Флуорогенной пробой являлось соединение 5'ACATCGCATCGAGCGAGCACGTAC-3'. В качестве внутренней контрольной пробы использовалась плазмида, содержащая часть генной последовательности неомицин фосфотрансферазы. Результаты этих экспериментов позволили вычислить для различных циклоспоринов ЕС 50, которая представляет собой эффективную концентрацию, необходимую для ингибирования репликации репликона HCV на 50%, а также СС 50, которая представляет собой концентрацию, необходимую для ингибирования пролиферации экспоненциально растущих клеток на 50%, и индекс селективности SI, который является отношением СС 50 к ЕС 50. В табл. 3 показаны значения, полученные от клеток Huh 5-2, с использованием анализов активности люциферазы для оценки эффективности репликации и МТТ анализов для калибровки анализов люциферазы и для оценки цитостатических эффектов соединений. В соответствии с наблюдениями Watashi и др.(2003), обсуждаемыми выше, CsA и [Melle]4-CsA имели сходную анти-HCV активность (репликацию). Неожиданным образом, [D-MeAla]3-[EtVal]4-CsA оказался значительно более сильнодействующим,чем CsA и [Melle]4-CsA. Также было отмечено, что 50%-ная цитостатическая концентрация (СС 50) для[D-MeAla]3-[EtVal]4-CsA была значительно выше, чем значения, определенные для CsA и [Melle]4-CsA. Соответственно, было обнаружено, что [D-MeAla]3-[EtVal]4-CsA имеет значительно более высокий индекс селективности по сравнению с двумя другими циклоспоринами. Аналогичные эксперименты, в ко-5 012650 торых значения ЕС 50 были получены из определений титров РНК, с использованием количественной RTPCR, привели к подобным заключениям. Значения SI, равные 45, 73 и 625, были получены для CsA,[Melle]4-CsA и [D-MeAla]3-[EtVal]4-CsA соответственно. Звездочки указывают, что представлено более низкое из двух независимо определенных значений. Таблица 3 ЕС 50, СС 50 и значения SI, определенные из анализов люциферазы репликации РНК HCV и МТТ анализов цитотоксичности в клетках Huh 5-2, включающих содержащий люциферазу мини-репликон HCV Антивирусная активность [D-MeAla]3-[EtVal]4-CsA, измеренная в инфицированных клеткахмишенях с рекомбинантным HCV. Анти-HCV активность [D-MeAla]3-[EtVal]4-CsA по сравнению с CsA далее определяли в системах культуры, приближающихся к обстановке in vivo. В методе использовали клетки гепатомы (гепатоаденомы), которые были инфицированы инфекционной полноразмерной химерной структурой HCV или тем же самым вирусом, который модифицировали, чтобы он нес ген рецептора люциферазы. После обработки инфицированных клеток с помощью циклоспорина согласно изобретению или CsA измеряли активность люциферазы, непосредственно связанную с ингибированием вирусной репликации. Для инокуляции клеток гепатоаденомы в этих анализах использовали инфекционные вирусы полноразмерного HCV химерного генома между штаммами HCV J6 и JFH1 (Jc1). Структуру Jc1 вируса так же изменяли, чтобы получить бицистронный геном, несущий ген репортера люциферазы (Jc1-Luc). Спустя 24 и 96 ч после трансфекции транскриптов РНК геномов путем электропорации клеток Huh-7,5 собирали надосадочную жидкость клеточных культур. Надосадочную жидкость отфильтровывали(0,45 мкМ) и определяли CCID50 (инфекционная доза клеточной культуры 50) на мл с использованием анализа ограниченного разбавления согласно Lindenbach и др. (Science, 309 (2005), 623-626). CCID50 составляли 1,3105 для Jc1 и 4,2103 для Jc1-Luc. В анализах использовали клетки Huh-7-Lunet или Huh-7,5 (Lohmann et al., Science 285 (5424), (1999),110-113). Клетки выращивали в среде Игла, модифицированной по Дальбекко (Dulbecco's modified Eagle's Medium, DMEM; производитель Gibco), с добавленнием 10% эмбриональной бычьей сыворотки,инактивированной при высокой температуре (FCS) (Integra), 1 заменимой аминокислоты (Gibco), 100 Ед/мл пенициллина (Gibco), 100 мкг/мл стрептомицина (Gibco) или 25 мкг/мл гигромицина (Gibco) дляHuh-моноклеток при 37 С и 5% СО 2. Для антивирусных анализов (репликации) клетки Huh-7-Lunet иHuh-7,5 высевали при плотности 2104 или 4104 клетки на лунку 12-луночного планшета. 24 ч спустя среду заменяли на 0,5 мл вирусного материала Jc1-Luc (12-луночный планшет) или 0,25 мл Jc1 вирусного материала (12-луночный планшет). Через 4 ч вирусный инокулят заменяли средой, содержащей различные концентрации CsA или [D-MeAla]3-[EtVal]4-CsA и затем инкубировали в течение еще 72 ч. Ингибирование вирусной репликации оценивали с помощью анализа люциферазы. Для выполнения анализа люциферазы клетки собирали, промывали фосфатным буфером (PBS) и лизировали в буфере для лизиса люциферазы (1%-ный Тритон Х-100, 25 мМ глицилглицин, 15 мМ MgSO4, 4 мМ EGTA и 1 мМDTT). Активность люциферазы светлячка измеряли согласно Krieger и др. (J. Virol., 75 (10), (2001), 46144624). Вкратце, после одного цикла заморозки/таяния, клетки повторно суспендировали и 100 мкл лизата клетки смешивали с 360 мкл аналитического буфера (25 мМ глицилглицина, 15 мМ MgSO4, 1 мМ DTT,2 мМ АТР, 15 мМ буфера фосфата калия, pH 7,8) и 200 мкл раствора субстрата (200 мМ люциферина,25 мМ глицилглицина). В конце измеряли люминесценцию с использованием люминометра LumatLB9507 (Berthold) на 20 образцов. В этих примерах (фиг. 1 и 2) и [D-MeAla]3-[EtVal]4-CsA (белые столбцы), и CsA (черные столбцы) приводили к антивирусной активности, зависимой от дозы, в силу чего оказалось, что [D-MeAla]3[EtVal]4-CsA снова превосходит CsA, таким образом, подтверждая данные, полученные с субгеномными репликонами. Требовалась в 10 раз большая концентрация CsA, чтобы привести к тому же самому ингибирующему эффекту репликации, что и циклоспорин согласно изобретению. Высокое сродство циклоспорина согласно изобретению по отношению к циклофилину. В вышеупомянутых наблюдениях Watashi и др. (2003) и Nagakawa и др. (2003), анти-HCV эффект был связан со связывающей способностью циклоспоринов по отношению к циклофилинам. Чтобы определить более мощный ингибитор PPIase активности циклофилина, например циклофилина А, и, следовательно, репликации HCV, для циклофилинов измеряли влияние CsA, [Melle]4-CsA и [D-MeAla]-[EtVal]4CsA на активность PPIase. В анализах использовался коммерчески доступный рекомбинантный циклофилин человека (Sigma). Активность PPIase циклофилинов определяли с использованием спектрофотометрического анализа,-6 012650 включающего химотрипсин, согласно Garcia-Echverria и др. (BBRC, 191 (1993), 70-75). Этот способ основывается на высокой трансселективности химотрипсина для пептидов типа N-сукцинил-ala-ala-prophe-п-нитроанилид. Расщепление пептидов высвобождало фрагмент паранитроанилина, который может быть обнаружен и количественно определен при 390 нм. Гидролиз цис-формы ограничивался скоростью цис-транс-изомеризации, осуществляемой с помощью циклофилина А. Пептид выдерживали в 25 нМ растворе LiCl в 2,2,2-трифторэтаноле при 470 мМ, чтобы увеличить популяцию цис-конформера пептидов. Анализ выполняли на спектрофотометре с расщепленным пучком и температуру водяной бани устанавливали на 5 С. Циклофилин (общая концентрация фермента 7500 пмоль/мг; Sigma) растворяли до концентрации 20 нМ в буфере (35 мМ HEPES и 0,26 мг/мл химотрипсина (удельная активность 50 единиц/мг), pH 7,8 с помощью KOH) и инкубировали в течение 6 мин при комнатной температуре, а затем в течение 54 мин на водяной бане. CsA, [Melle]4-CsA или [D-MeAla]3-[EtVal]4-CsA добавляли соответственно к этим инкубациям, используя диапазон концентраций 2-50 нМ. Затем в кювету с образцом добавляли 3,5 мл инкубированного циклофилина. Кювета сравнения содержала пробу смеси, в которой реакция уже завершилась, для компенсации луча сравнения. Пептид добавляли при концентрации 25 мкМ для инициирования реакции, и изменение поглощения контролировали в 10 точках данных в секунду. Для контроля скорости определяли также для параллельной реакции, в которой отсутствовал циклофилин. Эти холостые скорости гидролиза пептида (т.е. в отсутствие циклофилина) вычитали из скоростей в присутствии циклофилина А. Начальные скорости реакции, полученные из анализов PPIase следовых количеств веществ в течение времени, анализировали с помощью регрессионного анализа первого порядка, используя преобразование первого порядка, по изменению поглощения при 390 нм. Общую концентрацию фермента (Et),константу диссоциации ингибитора (Ki) и константу скорость-определяющей реакции рассчитывали с помощью программного обеспечения FigSyS (2003, Biosoft) путем аппроксимации данных, полученных из регрессионного анализа в уравнении тесного связывания мультипротеина ингибитора. Уравнение тесного связывания мультипротеина ингибитора имело следующую формулу: где b определяют как b=-(EtP+I+Ki) и с определяется как с=EtРI.Et, Ki и k рассчитывали на компьютере один раз для данного набора данных, затем строили графическое представление данных, и линия соответствовала точкам, предполагающим тесное связывание ингибитора с единственным белком, определяемое следующими уравнениями: где В=EtР+I+Ki и С=EtРI. Таблица 4 Е, Ki и значения k циклофилина А для CsA, [Melle]4-CsA и [D-MeAla]3-[EtVal]4-CsA, определенные из анализов активности PPIase. Самое низкое значение Ki циклофилина А, наблюдаемое для циклоспорина согласно изобретению,подтверждало большую потенциальную возможность антивирусной активности, специфичности и индекса селективности (как упомянуто выше) по сравнению с CsA и [Melle]4-CsA. Как ни странно, неиммуносупрессивный [D-MeAla]3-[EtVal]4-CsA показал почти в 6 раз более высокое сродство по отношению к циклофилину по этому примеру по сравнению с другим неиммуносупрессивным циклоспорином[Melle]4-CsA. Вышеописанный эксперимент показал, что [D-MeAla]3-[EtVal]4-CsA является более эффективным ингибитором репликации HCV, чем любой другой испытанный циклоспорин. Эта повышенная антиHCV активность соотносится с повышенной циклофилинсвязывающей активностью [D-MeAla]3-[EtVal]4CsA. Клиренс репликона HCV и "ребаунд" эффект (эффект отмены). Рецидив инфекции HCV представляет собой главную проблему болезни, особенно при проведении потенциально эффективного лечения, например при применении циклоспорина и/или интерферона. Для того чтобы изучить, отражена ли более высокая анти-HCV активность циклоспорина согласно изобретению по сравнению с CsA в отношении способности соединения более эффективно лечить клетки, производящие репликон HCV от них, проводили анализ клетки in vitro, основанный на присутствии селективного препарата G418, для рекомбинантного продуцированного репликона. В анализах использовали клетки Huh-9-13, клетки гепатоаденомы человека (Huh-7) (Lohmann et al.,Science 285 (5424), (1999), 110-113) Клетки выращивали в стандартной полной среде DMEM без воздействия G418. Клетки культивировали в присутствии CsA или [D-MeAla]3-[EtVal]4-CsA (оба при концен-7 012650 трации 0,5 или 1 мкг/мл) или оставляли необработанными в течение 7 последовательных проходов. Выполняли контрольный анализ для того, чтобы гарантировать, что отсутствие селективного воздействияG418 не повлияет на содержание репликона HCV в течение нескольких проходов. Чтобы подтвердить,что клетки Huh-9-13, которые уже обрабатывали в течение 7 дней с помощью [D-MeAla]3-[EtVal]4-CsA,действительно очистились от их репликона, селекцию проб G418 (1000 мкг/мл) повторно начинали в течение еще 2 проходов. Только те клетки, которые все еще несли репликон HCV, были способны размножаться в этих условиях, а клетки без репликона погибали в присутствии G418 в течение фазы отмены. Реакцию RT-PCR выполняли на экстрактах вирусного РНК образцов, отобранных в различных точках прохода. Прямыми и обратными используемыми правмерами являлись 5'CCGGCTACCTGCCCATTC-3' и 5'-CCAGATCATCCTGATCGACAAG-3' соответственно. Флуорогенной пробой являлось соединение 5'-ACATCGCATCGAGCGAGCACGTAC-3'. В качестве внутренней контрольной пробы использовалась плазмида, содержащая часть генной последовательности неомицин фосфотрансферазы. Результаты анализировали и выражали как количество репликона РНК (нанограмм) в 1000 клеток и использовали для построения графика. Результаты этих экспериментов (фиг. 3) показали превосходящий антивирусный эффект [DMeAla]3-[EtVal]4-CsA по сравнению с CsA в этом стандартном клеточном анализе in vitro. Циклоспорин согласно изобретению неожиданно показал вируцидный эффект, а не только вирустатический эффект как другой иммуносупрессивный CsA. Действительно, когда обработанные с помощью [D-MeAla]3[EtVal]4-CsA клетки Huh-9-13 (кружки и квадратики на фиг. 3) снова культивировали в присутствииG418 (фаза отмены), культуры погибали в отличие от клеток, обработанных с помощью CsA (ромбики и треугольники). Обе культуры, обработанные с помощью CsA для 7 последовательных проходов, были способны размножаться в присутствии G418. Это подтвердило, что [D-MeAla]3-[EtVal]4-CsA способен вылечивать клетки Huh-9-13 от их репликона HCV. Комбинация лекарств. Интерферон (IFN) является частью общеупотребительной терапии инфекции HCV. Эффект комбинации [D-MeAla]3-[EtVal]4-CsA / IFN- 2 а оценивали, используя метод Prichard и Shipman (Antiviral Res,1990, 14, 181-205). Вкратце, теоретический аддитивный эффект рассчитывается исходя из кривых "дозаответ" индивидуальных соединений по уравнению формулы где X представляет собой ингибирование, оказанное одним только [D-MeAla]3-[EtVal]4-CsA, aZ представляет собой эффект, произведенный комбинацией [D-MeAla]3-[EtVal]4-CsA с IFN- 2 а. Теоретическую совокупную поверхность вычитают из фактической экспериментальной поверхности, приводя к горизонтальной поверхности, которая соответствует нулевой плоскости; когда комбинация аддитивна, поверхность, которая находится выше нулевой плоскости, указывает на синергический эффект комбинации, а поверхность ниже нулевой плоскости указывает на антагонизм. Антивирусный анализ выполняли, по существу, как описано выше для клеток Huh 5-2 за исключением того, что соединения добавляли в шахматном порядке. Для каждого соединения использовали три репликационных планшета, чтобы измерить кривую "доза-ответ" для каждого индивидуального соединения. Данные, полученные от всех трех планшетов, использовали для расчета теоретической совокупной поверхности. Исследования комбинации для каждой пары соединений также производили трижды. Данные анализировали на дисперсность с помощью теста ANOVA. Незначительная синергическая активность была отмечена при самых высоких используемых концентрациях IFN- 2 а, но в целом объединенную анти-HCV активность [D-MeAla]3-[EtVal]4-CsA с IFN2 а можно рассматривать как аддитивную (фиг. 4). Результаты с [D-MeAla]3-[EtVal]4-CsA могут быть просуммированы следующим образом.[D-MeAla]3-[EtVal]4-CsA имеет более высокую анти-HCV активность и является менее цитотоксичным, чем CsA, как показано в субгеномной системе репликона HCV. Это было подтверждено в клеточной культуре гепатоаденомы, инфицированной полноразмерным инфекционным химерным геном из штаммов HCV J6 и JFH1.[D-MeAla]3-[EtVal]4-CsA способен лечить клетки от их HCV репликона более эффективно, чем CsA. Эти эффекты связаны с более выраженным сродством к связыванию циклофилина. Анти-HCV активность комбинации [D-MeAla]3-[EtVal]4-CsA/IFN- 2 а аддитивна.[D-MeAla]3-[EtVal]4-CsA может применяться для лечения пациентов, инфицированных HCV. Активное соединение может вводиться любым обычно используемым способом. Оно может вводиться парентерально, например, в форме инъецируемых растворов или суспензий, или в форме инъецируемых осаждаемых составов. Предпочтительно оно будет применяться перорально в форме растворов или суспензий для питья, таблеток или капсул. Фармацевтические композиции для перорального введения,включающие циклоспорин согласно изобретению, описаны в примерах. Примеры показывают, что такие фармацевтические композиции в характерном случае включают циклоспорин согласно изобретению и-8 012650 одно или более фармацевтически приемлемых веществ-носителей. Как правило, эти композиции являются концентрированными и перед введением должны быть объединены с соответствующим разбавителем,например водой. Фармацевтические композиции для парентерального введения в характерном случае также включают один или более наполнителей. Необязательные наполнители включают изотонический агент, буфер или другой pH-регулирующий агент и консервант. Эти наполнители могут быть добавлены для сохранения композиции и для достижения предпочтительных диапазонов pH (приблизительно 6,57,5) и осмотических свойств (приблизительно 300 мосм/L). Дополнительные примеры композиций циклоспорина для орального применения могут быть найдены в патентах США 5525590 и 5639724 и заявке на патент США 2003/0104992. Требуемая дозировка циклоспорина согласно изобретению для перорального применения от ежедневного до трех раз в неделю может составлять приблизительно от 1 до приблизительно 100 мг/кг, предпочтительно приблизительно от 1 до приблизительно 20 мг/кг. Для внутривенного введения соответствующая дозировка может быть приблизительно от 1 до приблизительно 50 мг/кг, предпочтительно приблизительно от 1 до приблизительно 25 мг/кг. Под эффективным количеством циклоспорина согласно изобретению понимают такое количество, которое при неоднократном введении пациенту, нуждающемуся в лечении инфекции HCV, в ходе терапевтического режима приводит к объективному клиническому ответу, такому как статистически существенное уменьшение титра HCV сыворотки или существенное уменьшение активности ALT сыворотки у пациента. Была выполнена начальная фаза 1 клинических испытаний, чтобы определить безопасность оральных доз [D-MeAla]3-[EtVal]4-CsA при приеме внутрь и определить фармакокинетический профиль и безопасный профиль лекарственного вещества. Испытания показали, что дозы от 50 до 1600 мг в микроэмульсии в воде хорошо переносятся. Наблюдались умеренные и непродолжительные побочные эффекты, включая тошноту, рвоту, боль в животе, умеренные головные боли. Эти побочные эффекты не были связаны с дозой. Клиницистом должны быть учтены многочисленные факторы при определении пробных доз для проверки эффективности фармацевтической композиции, включающей циклоспорин по настоящему изобретению, в отношении инфекции HCV. Первичными среди них являются токсичность и период полувыведения выбранного циклоспорина согласно изобретению. Дополнительные факторы включают вес пациента, возраст пациента, общее состояние пациента (включая существенные системные или серьезные заболевания, включая декомпенсированное заболевание печени, тяжелое заболевание костного мозга, существовавшее ранее, и другие вирусные инфекции), стадию инфекции HCV (острую против хронической), на что указывают, например, уровни аланиновой аминотрансферазы (ALT) сыворотки, специфический генотип HCV, предыдущая терапия инфекции HCV, прием пациентом других лекарств и т.п. Курс лечения обычно требует повторного введения фармацевтической композиции по изобретению. Как правило, адекватная доза препарата обычно применяется (вводится) 3-7 раз в неделю, и продолжительность лечения может быть приблизительно от 4 недель до 6 месяцев, предпочтительно приблизительно от 4 недель до приблизительно 12 месяцев. Лечение может сопровождаться определениями HCV в сыворотке и измерением уровней ALT сыворотки. Конечной точкой лечения является вирологический ответ,т.е. отсутствие HCV в конце курса лечения, спустя несколько месяцев после начала лечения или спустя несколько месяцев после завершения лечения HCV в сыворотке может быть измерен на уровне РНК такими способами как количественная RT-PCR или Нозерн-блоттинг, или на уровне белкаиммунологическим ферментным анализом или усовершенствованным хемилюминесцентным иммуноанализом вирусных белков. Конечная точка может также включать определение уровня ALT сыворотки в нормальном диапазоне. Фармацевтическая композиция согласно настоящему изобретению может включать один или более других компонентов, активных в отношении инфекции HCV, в дополнение к циклоспорину по настоящему изобретению, как, например, другое антивирусное лекарственное вещество, например рибавирин,или интерферон-альфа циклоспорин по изобретению и такой другой активный компонент могут вводиться вместе как часть одной и той же фармацевтической композиции или могут вводиться по отдельности как часть соответствующей схемы приема, разработанной для получения преимуществ комбинированного лечения. Соответствующая схема приема, количество каждой вводимой дозы и конкретные интервалы между приемами каждого активного агента будут зависеть от конкретной комбинации используемых активных агентов, состояния пациента, которого лечат, и других факторов, обсуждаемых в предыдущем разделе. Такие дополнительные активные компоненты в общем случае будут вводиться в количествах, меньших или равных тем, в которых они являются эффективными как отдельные терапевтические средства. Одобренные Управлением по контролю за продуктами и лекарствами США (FDA) дозировки для таких активных средств, которые уже получили одобрение FDA для применения на людях, опубликованы и доступны специалистам в данной области. Все патенты, заявки на патенты и публикации, которые цитируются в настоящей работе, рассматриваются как включенные в настоящее описание посредством ссылки во всей их полноте. Изобретение далее детально описано посредством следующих примеров. Примеры представлены для целей иллюстрации специалисту в данной области техники и не предназначены для ограничения-9 012650 объема изобретения, как оно описано в формуле изобретения. Таким образом, изобретение не должно рассматриваться как ограниченное представленными примерами, но должно рассматриваться как охватывающее любое и все изменения, которые являются очевидными на основании представленного здесь описания. Пример 1. Синтез [D-MeAla]3-[EtVal]4-CsA.(Переведено из докторской диссертации Jean Francois Guichou, озаглавленной "De nouveaux analogues de Cyclosporin A comme agent anti-HIV-1" (Новые аналоги циклоспорина в качестве агентов против ВИЧ-1), Faculte des Sciences, University of Lausanne, CH-1015 Lausanne, Швейцария (2001. Синтез H-MeLeu-Val-MeLeu-Ala-D-Ala-MeLeu-MeLeu-MeVal-MeBmt(OAc)-Abu-Sar-OMe. 4-Диметиламинопиридин (DMAP) (41,5 ммоль; 5,8 г) добавляли к раствору циклоспорина (CsA)(8,3 ммоль; 10 г) в 100 мл уксусного ангидрида. Раствор перемешивали в течение 18 ч при комнатной температуре. Реакционную смесь затем разбавляли 600 мл этилацетата и промывали дважды водой и четыре раза насыщенным водным раствором бикарбоната натрия. Органическую фазу сушили над безводным Na2SO4, фильтровали и растворитель испаряли при пониженном давлении. Полученный желтый остаток хроматографировали на силикагеле (элюент: дихлорметан/метанол 98:2) и перекристаллизовали из эфира. Выделяли 9,5 г MeBmt (OAc)-CsA в виде белого порошка с выходом 92%. Тетрафторборат триметилоксония (22,5 ммоль, 3,3 г) добавляли к раствору MeBmt(OAc)-Cs(7,5 ммоль; 9,4 г) в 60 мл дихлорметана. После 16 ч выдерживания при комнатной температуре добавляли 35 мл 0,26 М раствора метилата натрия в метаноле. Через 1 ч добавляли 35 мл метанола и 35 мл 2 н. раствора серной кислоты и реакционную смесь перемешивали в течение еще 15 мин, нейтрализовали доpH 6,0 с помощью насыщенного раствора KHCO3 (28 мл) и экстрагировали дважды этилацетатом. Органическую фазу промывали 2 раза насыщенным раствором NaCl, сушили над безводным Na2SO4 и фильтровали. Затем растворитель испаряли под уменьшенным давлением. Остаток хроматографировали на силикагеле (элюент: этилацетат/метанол 5:1). Получали 7,3 г H-MeLeu-Val-MeLeu-Ala-D-Ala-MeLeuMeLeu-MeVal-MeBmt(OAc)-Abu-Sar-OMe (выход: 76%).(4,6 ммоль; 7 г) в 48 мл тетрагидрофуране. Через 2 ч растворитель испаряли и неочищенный продукт хроматографировали на силикагеле (элюенты: метил-трет-бутиловый эфир (МТВЕ)/этилацетат 9:1 (1); МТВЕ/метанол 9:1 (2. Получали 5,8 г Ph-NH-C(S)-MeLeu-Val-MeLeu-Ala-D-Ala-MeLeu-MeLeu-MeValMeBmt(OAc)-Abu-Sar-OMe (выход 90%). 13,8 мл трифторуксусной кислоты добавляли к раствору последнего соединения (4 ммоль; 5,6 г) в 290 мл дихлорметана. После 1 ч реакции смесь нейтрализовывали, используя KHCO3, и разбавляли 500 мл дихлорметана. Органическую фазу промывали 2 раза насыщенным раствором NaCl, сушили над безводным Na2SO4 и фильтровали. Затем испаряли растворитель при пониженном давлении. Остаток хроматографировали на силикагеле (элюенты: МТВЕ/этилацетат 9:1 (1); МТВЕ/метанол 3:1 (2. Получали 2,8 г H-Val-MeLeu-Ala-D-Ala-MeLeu-MeLeu-MeVal-MeBmt(OAc)-Abu-Sar-OMe (выход 61%).(0,96 ммоль; 0,32 г) в 15 мл дихлорметана. Через 15 мин дихлорметан испаряли и остаток извлекали этилацетатом. Органическую фазу промывали последовательно насыщенным раствором NaHCO3,10%-ным раствором лимонной кислоты и насыщенным раствором NaCl, а затем сушили над безводнымNa2SO4 и концентрировали. Хроматография на силикагеле (в смеси этилацет/метанол 98:2) давала 1,14 г(90%) Boc-D-MeAla-EtVal-Val-MeLeu-Ala-D-Ala-MeLeu-MeLeu-MeVal-MeBmt(OAc)-Abu-Sar-OMe. Последний продукт (0,64 ммоль; 0,93 г) растворяли в 45 мл безводного метанола и небольшими порциями с интервалом в 15 мин в течение 3 ч 30 мин добавляли боргидрид натрия (25,5 ммоль; 0,96 г). Через 4 ч реакционную смесь охлаждали до 0 С, гидролизовали добавлением 10%-ной лимонной кислоты и концентрировали. Остаток извлекали этилацетатом. Органическую фазу промывали 10%-ным раствором лимонной кислоты и насыщенным раствором NaCl, а затем сушили над безводным Na2SO4 и концентрировали. После хроматографии на силикагеле (в смеси этилацетат/метанол 95:5) получали 0,63 г- 10012650 Синтез H-D-MeAla-EtVal-Val-MeLeu-Ala-D-Ala-MeLeu-MeLeu-MeVal-MeBmt-Abu-OH. Метансульфокислоту (3,18 ммоль; 2,060 мл) добавляли к раствору Boc-D-MeAla-EtVal-Val-MeLeuAla-D-Ala-MeLeu-MeLeu-MeVal-MeBmt(OAc)-Abu-NMe-CH2-СН 2-ОН (0,425 ммоль; 610 мг) в 42,5 мл метанола и смесь нагревали 50 С и выдерживали при этой температуре. Ход реакции контролировали с помощью HPLC и масс-спектрометрии. Через 80 ч смесь охлаждали до 0 С и гидролизовали добавлением 1 М раствора NaHCO3. Метанол удаляли и остаток извлекали этилацетатом. Органическую фазу промывали 1 М раствором NaHCO3 и затем насыщенным раствором NaCl, сушили над безводным Na2SO4 и концентрировали. Продукт (557 мг), H-D-MeAla-EtVal-Val-MeLeu-Ala-D-Ala-MeLeu-MeLeu-MeValMeBmt(OAc)-Abu-O-CH2-CH2-NHMe, использовали в следующей стадии без очистки. Продукт (0,42 ммоль; 557 мг) растворяли в 20 мл метаноле и объединяли в инертной атмосфере с раствором метилата натрия (1,26 ммоль) в 1,26 мл метаноле. Через 18 ч при комнатной температуре реакционную смесь охлаждали до 0 С и добавляли по каплям гидроксид натрия (4,2 ммоль; 168 мг) в 5 мл воды. Через 21 ч при комнатной температуре реакционную смесь снова охлаждали до 0 С и нейтрализовали 1 М раствором KHSO4. Метанол удаляли, а остаток растворяли в этилацетате. Органическую фазу промывали полунасыщенным раствором NaCl, сушили над безводным Na2SO4 и концентрировали. Продукт (335 мг; 64%), H-D-MeAla-EtVal-Val-MeLeu-Ala-D-Ala-MeLeu-MeLeu-MeVal-MeBmt-Abu-OH, использовали в следующей стадии без очистки.ES/MS: m/z: 1235,5 [М+Н+], 618,2 [М+2 Н+]. Синтез [D-MeAla]3-[EtVal]4-CsA. В инертной атмосфере раствор H-D-MeAla-EtVal-Val-MeLeu-Ala-D-Ala-MeLeu-MeLeu-MeValMeBmt-Abu-OH (0,162 ммоль; 200 мг) и симм.-коллидина (1,78 ммоль; 0,24 мл) в 50 мл дихлорметана добавляли по каплям к раствору (7-азабензотриазол-1-илокси)трипирролидинофосфоний гексафторфосфата (РуАОР, 0,486 ммоль; 254 мг) в 3,2 л дихлорметана. Через 72 ч реакционную смесь гидролизовали добавлением 10%-го раствора Na2CO3. Дихлорметан испаряли и остаток извлекали этилацетатом. Органическую фазу промывали последовательно 0,1 н. раствором HCl и насыщенным раствором NaCl, сушили над безводным Na2SO4 и концентрировали. Неочищенный продукт очищали на силикагеле с образованием 110 мг (59%) [D-MeAla]3-[EtVal]4-CsA.ES/MS: m/z: 1217,6 [M+H+], 609,3 [M+2H+]. Пример 2. Композиции циклоспорина согласно изобретению для перорального применения. Количества выражены в массовых процентах. Пример А: Индивидуальные компоненты композиций А-Г и способы получения этих композиций описаны в заявке на патент Великобритании 2222770. ФОРМУЛА ИЗОБРЕТЕНИЯ 3 1. Применение [D-MeAla] -[EtVal]4-CsA для изготовления лекарственного средства, предназначенного для лечения инфекции вируса гепатита С (HCV) или для предотвращения рецидива HCV у пациента. 2. Применение по п.1, отличающееся тем, что указанное лекарственное средство дополнительно содержит, по меньшей мере, второй компонент, который является активным в отношении инфекции HCV. 3. Фармацевтическая композиция для лечения инфекции HCV или для предотвращения рецидиваHCV, включающая в качестве активных компонентов эффективное количество [D-MeAla]3-[EtVal]4-CsA и эффективное количество второго компонента, который является активным в отношении инфекцииHCV. 4. Фармацевтическая композиция по п.3, отличающаяся тем, что она дополнительно включает фармацевтически приемлемый носитель и, необязательно, разбавитель. 5. Способ лечения инфекции HCV или предотвращения рецидива HCV у пациента, включающий введение пациенту эффективного количества [D-MeAla]3-[EtVal]4-CsA. 6. Способ по п.5, включающий дополнительное введение второго компонента, который является активным в отношении инфекции HCV.
МПК / Метки
МПК: A61K 38/13, A61P 31/14
Метки: применение, гепатита, d-meala]3-[etval]4-циклоспорина, фармацевтическая, инфекции, d-meala]3-[etval]4-циклоспорин, включающая, лечения, композиция
Код ссылки
<a href="https://eas.patents.su/14-12650-primenenie-d-meala3-etval4-ciklosporina-dlya-lecheniya-infekcii-gepatita-s-i-farmacevticheskaya-kompoziciya-vklyuchayushhaya-d-meala3-etval4-ciklosporin.html" rel="bookmark" title="База патентов Евразийского Союза">Применение [d-meala]3-[etval]4-циклоспорина для лечения инфекции гепатита с и фармацевтическая композиция, включающая [d-meala]3-[etval]4-циклоспорин</a>
Предыдущий патент: 3 – аминоциклопентанкарбоксамиды в качестве модуляторов хемокиновых рецепторов
Следующий патент: Система затемнения оконных и других застеклённых панелей
Случайный патент: Система автоматической регулировки усиления для многопользовательских систем цифровой передачи данных по электрической сети с использованием очу-модуляции