Композиции ифосфамида для парентерального введения и способ их получения
Номер патента: 12368
Опубликовано: 30.10.2009
Авторы: Правин Кумар Суббаппа, Риванкар Санджита Ханурмеш, Паи Срикантх Аннаппа, Дафтари Гаутам Винод
Формула / Реферат
1. Стабильные прозрачные водные композиции ифосфамида, имеющие пониженную токсичность, предназначенные для парентерального введения и содержащие
ифосфамид до 1100 мг/мл композиции и
2-гидроксипропил-b-циклодекстрин.
2. Композиции ифосфамида по п.1, где молярное замещение гидроксипропильными группами в 2-гидроксипропил-b-циклодекстрине составляет 0,05-2.
3. Композиции ифосфамида по п.1 или 2, где молярное замещение гидроксипропильными группами в 2-гидроксипропил-b-циклодекстрине составляет 0,3-1,5.
4. Композиции ифосфамида по любому из пп.1-3, где молярное замещение гидроксипропильными группами в 2-гидроксипропил-b-циклодекстрине составляет 0,5-1,2.
5. Композиции ифосфамида по любому из пп.1-4, где молярное отношение ифосфамида к 2-гидроксипропил-b-циклодекстрину находится в пределах 100:0,1-1:300.
6. Композиции ифосфамида по любому из пп.1-5, где молярное отношение ифосфамида к 2-гидроксипропил-b-циклодекстрину находится в пределах 100:0,25-1:100.
7. Композиции ифосфамида по любому из пп.1-6, где молярное отношение ифосфамида к 2-гидроксипропил-b-циклодекстрину находится в пределах 100:1-1:20.
8. Композиции ифосфамида по любому из пп.1-7, где молярное отношение ифосфамида к 2-гидроксипропил-b-циклодекстрину находится в пределах 100:3,3-1:2,5.
9. Композиция ифосфамида по п.1, дополнительно содержащая фармацевтически приемлемые добавки, которые выбраны из группы веществ, таких как буферы, агенты тоничности, консерванты, хелатирующие агенты, антиокислители, антикристаллизующие агенты.
10. Композиции ифосфамида по любому из пп.1-9, где содержание ифосфамида в композиции составляет 1-200 мг/мл.
11. Композиции ифосфамида по любому из пп.1-10, где содержание ифосфамида в композиции составляет 10-100 мг/мл.
12. Композиции ифосфамида по любому из пп.1-11, где содержание ифосфамида в композиции составляет 40-50 мг/мл.
13. Композиции ифосфамида по любому из пп.1-9, где содержание ифосфамида в композиции составляет 200-500 мг/мл.
14. Композиции ифосфамида по любому из пп.1-9, где содержание ифосфамида в композиции составляет 500-1000 мг/мл.
15. Композиции ифосфамида по любому из пп.1-14, где композиция имеет рН между 3,0 и 9,0.
16. Композиции ифосфамида по любому из пп.1-15, где композиция имеет рН между 5,0 и 8,0.
17. Композиции ифосфамида по п.9, где буферный агент выбран из группы буферных агентов, таких как дигидрофосфат натрия, гидрофосфат натрия, гидрофосфат калия, дигидрофосфат калия, фосфорная кислота, гидрохлорид гистидина, гидроксид натрия, хлористо-водородная кислота и их смеси.
18. Композиции ифосфамида по п.17, где буферным агентом является смесь дигидрофосфата натрия и гидрофосфата натрия.
19. Способ получения композиций ифосфамида по любому из пп.1-18, содержащий стадии:
i) приведения в состояние тесного контакта ифосфамида, 2-гидроксипропил-b-циклодекстрина и воды,
ii) придания стерильности композиции, полученной в конце стадии (i).
20. Способ получения композиций ифосфамида по п.19, дополнительно содержащий добавление требуемых количеств фармацевтически приемлемых добавок при приведении в состояние тесного контакта ифосфамида, 2-гидроксипропил-b-циклодекстрина и воды.
21. Способ получения композиций ифосфамида по любому из пп.19-20, где композиции придают стерильность пропусканием через стерильный 0,2 мкм фильтр стерилизующего сорта.
22. Способ получения композиций ифосфамида по любому из пп.19-21, содержащий дополнительные стадии переноса асептически стерильной композиции в стерильные контейнеры, продувания воздуха в головном пространстве контейнеров инертным газом и герметизации контейнеров.
23. Способ получения композиций ифосфамида по любому из пп.19-22, где молярное замещение гидроксипропильными группами в 2-гидроксипропил-b-циклодекстрине составляет 0,05-2.
24. Способ получения композиций ифосфамида по любому из пп.19-23, где молярное замещение гидроксипропильными группами в 2-гидроксипропил-b-циклодекстрине составляет 0,3-1,5.
25. Способ получения композиций ифосфамида по любому из пп.19-24, где молярное замещение гидроксипропильными группами в 2-гидроксипропил-b-циклодекстрине составляет 0,5-1,2.
26. Способ получения композиций ифосфамида по любому из пп.19-25, где молярное отношение ифосфамида к 2-гидроксипропил-b-циклодекстрину составляет 100:0,1-1:300.
27. Способ получения композиций ифосфамида по любому из пп.19-26, где молярное отношение ифосфамида к 2-гидроксипропил-b-циклодекстрину составляет 100:0,25-1:100.
28. Способ получения композиций ифосфамида по любому из пп.19-27, где молярное отношение ифосфамида к 2-гидроксипропил-b-циклодекстрину составляет 100:1-1:20.
29. Способ получения композиций ифосфамида по любому из пп.19-28, где молярное отношение ифосфамида к 2-гидроксипропил-b-циклодекстрину составляет 100:3,3-1:2,5.
30. Способ получения композиций ифосфамида по п.20, где указанные фармацевтически приемлемые добавки выбраны из группы веществ, таких как буферы, агенты тоничности, консерванты, хелатирующие агенты, антиокислители, антикристаллизующие агенты.
31. Способ получения композиций ифосфамида по любому из пп.19-30, где содержание ифосфамида композиции составляет 1-200 мг/мл.
32. Способ получения композиций ифосфамида по любому из пп.19-31, где содержание ифосфамида композиции составляет 10-100 мг/мл.
33. Способ получения композиций ифосфамида по любому из пп.19-32, где содержание ифосфамида композиции составляет 40-50 мг/мл.
34. Способ получения композиций ифосфамида по любому из пп.19-30, где содержание ифосфамида композиции составляет 200-500 мг/мл.
35. Способ получения композиций ифосфамида по любому из пп.19-30, где содержание ифосфамида композиции составляет 500-1000 мг/мл.
36. Способ получения композиций ифосфамида по любому из пп.19-35, где рН композиции находится между 3,0-9,0.
37. Способ получения композиций ифосфамида по любому из пп.19-36, где рН композиции находится между 5,0-8,0.
38. Способ получения композиций ифосфамида по п.30, где буферный агент выбран из группы буферных агентов, таких как дигидрофосфат натрия, гидрофосфат натрия, гидрофосфат калия, дигидрофосфат калия, гидрохлорид гистидина, гидроксид натрия и их смеси.
39. Способ получения композиций ифосфамида по п.38, где буферный агент представляет собой смесь дигидрофосфата натрия и гидрофосфата натрия.
40. Стабильная прозрачная водная композиция ифосфамида, имеющая пониженную токсичность и предназначенная для парентерального введения, по п.1, где каждый миллилитр композиции содержит

41. Стабильная прозрачная водная композиция ифосфамида, имеющая пониженную токсичность и предназначенная для парентерального введения, по п.1, где каждый миллилитр композиции содержит
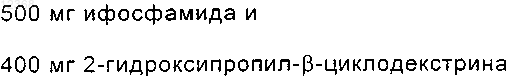
42. Стабильная прозрачная водная композиция ифосфамида, имеющая пониженную токсичность и предназначенная для парентерального введения, по п.1, где каждый миллилитр композиции содержит
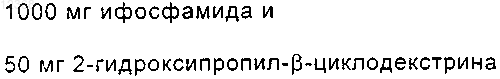
Текст
012368 Область изобретения Данное изобретение относится к композициям ифосфамида для парентерального применения. Это изобретение в частности относится к стабильным, прозрачным, водным композициям ифосфамида,имеющим пониженную токсичность и предназначенным для парентерального введения. Это изобретение более конкретно относится к композициям ифосфамида, содержащим кроме ифосфамида 2-гидроксипропилциклодекстрин (обозначаемый здесь далее "HPBCD"). Уровень техники изобретения Двумя основными группами, используемыми при лечении злокачественного заболевания являются алкилирующие агенты и антиметаболиты. Ифосфамид является одним из широко применяемых противонеопластических лекарственных средств, относящихся к группе алкилирующих агентов. Химически ифосфамид является 2-оксидом 3-(2-хлорэтил)-2-[(2-хлорэтил)амино]тетрагидро-2 Н 1,3,2-оксафосорина и представлен формулой Ифосфамид представляет собой белый кристаллический гигроскопичный порошок, имеющий низкую точку плавления 40 С. Порошок имеет растворимость в воде приблизительно 100 мг/мл. Ифосфамид применяют при лечении различных солидных опухолей, в том числе опухоли шеи, эндометрия, легких, яичников, яичек и тимуса, а также саркомы, и при лечении лимфомы Беркитта. Лечение ифосфамидом ассоциируется с серьезными побочными действиями, подобными геморрагическому циститу, миелосупрессии, сердечной аритмии, расстройству деятельности ЦНС, нефротоксичности гематологическим и желудочно-кишечным реакциям. Указывается, что LD50 у мышей при внутривенном введении составляет 338 мг/кг массы тела. Комбинация с урозащитным агентом месной снижает число случаев геморрагического цистита. Поэтому месну обычно вводят внутривенно при дозе 20% дозы ифосфамида в нулевое время (время введения ифосфамида) и затем после 4 и 8 ч. Ифосфамид вводят внутривенно либо инъекцией, либо инфузией в виде разбавленного раствора,содержащего меньше чем 4 мас./об.% ифосфамида. Ифосфамид является очень восприимчивым к гидролитическому разрушению и, в соответствии с этим, обычно требуется быстрое введение такого раствора. Поэтому коммерчески он преимущественно является доступным в сухой форме и его поставляют в виде стерильного, упакованного сухого порошка для растворения в воде для инъекции перед введением. Однако низкая точка плавления и гигроскопическая природа ифосфамида делают необходимым наполнение порошка с большой предосторожностью с поддержанием аккуратно как температуры, так и влажности для получения стерильного продукта. Кроме того, пролонгированное хранение сухого порошка также приводит к агломерации и пожелтению, что, в свою очередь, приводит к снижению скорости растворения, что, таким образом, удлиняет время, требуемое для пересоздания. Для преодоления трудностей, связанных с термической и гидролитической восприимчивостью,требовалась лиофилизация данного лекарственного средства. Однако процесс лиофилизации является процессом, расходующим довольно много времени и требующим специальное оборудование. Нежелательным является подвергание персонала действию сильно токсичного ифосфамида, имеющего место во время пересоздания лиофилизованного продукта. Поэтому предпринимаются попытки получения прозрачных, жидких композиций ифосфамида, которые должны быть стабильными на протяжении периода времени для парентерального введения. В патенте США 4952575 описано получение раствора в этаноле ифосфамида, содержащего 96-100% этанола. Даже если, как было показано, разрушение ифосфамида является минимальным, использование растворителей при такой высокой концентрации приводит к другим проблемам, таким как летучесть,манипуляция во время производства, смешиваемость с кровью при введении. Как таковой спирт является фармакологически активным и может также действовать на пациента при введении спиртового раствора ифосфамида. Имеется два патента, в которых используют полиолы для получения стабильных жидких композиций, содержащих оксафосфориновые соединения, а именно в патенте США 4879286 описывается изобретение, в котором циклофосфамид изготовлен в виде раствора, готового для разбавления. В этом изобретении используют органические полиолы, а именно пропиленгликоль и полиэтиленгликоль и их смеси в качестве растворителя и также 0-50% воды. Вода может быть частично заменена 10-30% этанола. В WO 0202125 описана жидкая фармацевтическая композиция для парентерального введения, содержащая ифосфамид, растворитель и, необязательно, общепринятые фармацевтические носители и эксципиенты. В соответствии с этим изобретением растворитель содержит 35-75% низшего спирта и 25-65% полиола. В то время, когда низшим спиртом обычно является этанол, полиольный растворитель представляет собой пропиленгликоль, глицерин и/или полиэтиленгликоль. Как в патенте США 4879286, так и в WO 0202125 парентеральное введение больших количеств полиолов и спиртов приводит к появлению других проблем, подобных боли и раздражению при инъекции,-1 012368 гемолизу ототоксичности, сердечно-сосудистым действиям, действиям на ЦНС и припадку. Это может также привести к гиперосмолярности и молочному ацидозу у пациентов с пониженной почечной деятельностью. В WO 99118973 описана стабильная, готовая к применению жидкость ифосфамида, в которой использовали хлорид натрия в качестве стабилизирующего агента. В изобретении описана также композиция 10-500 мг/мл ифосфамида, содержащая мочевину, хлорид натрия и дигидрофосфат натрия. Указывается, что композиции изобретения являются стабильными, но не приводится указания о безопасности и токсичности композиции. Более высокая концентрация мочевины в препарате может привести к осложнениям подобным гемолизу, раздражению, флебиту и тромбозу у места инъекции и повышенным концентрациям аммиака в крови и мочевины у пациентов с ухудшенной печеночной и почечной функцией. В WO 03/051297 A2 описана готовая к применению водная композиция ифосфамида, содержащая 40-400 мМ (10-100 мг/мл) ифосфамида в фармацевтически приемлемом буфере. В изобретении предлагается использовать буферы предпочтительно из группы Na2HPO4 и NaH2PO4 и K2HPO4 и KH2PO4. Не имеется указания по токсичности композиций ифосфамида, описанных в этом патенте. Таким образом, остается потребность в стабильном, концентрированном растворе ифосфамида, который облегчает манипулирование во время введения. Кроме того, остается потребность в фармацевтических композициях ифосфамида, которые проявляют меньшую токсичность, чем доступные в настоящее время композиции. Основной задачей настоящего изобретения является, таким образом, разработка стабильных прозрачных водных композиций ифосфамида имеющих пониженную токсичность и предназначенных для парентерального введения людям и другим животным. Другой задачей изобретения является разработка способа получения таких композиций. Сущность изобретения В соответствии с указанным выше, настоящее изобретение предлагает стабильные, прозрачные,водные композиции ифосфамида, имеющие пониженную токсичность, предназначенные для парентерального введения и содержащие Настоящее изобретение предлагает также способ получения композиций ифосфамида, имеющих пониженную токсичность, предназначенных для парентерального введения и содержащих стадии В способе настоящего изобретения требуемые количества фармацевтически приемлемых добавок могут быть добавлены при осуществлении тесного контактирования ифосфамида, 2-гидроксипропил-циклодекстрина и воды. Тесное контактирование может быть осуществлено такими способами, как перемешивание, смешивание, обработка ультразвуком, нагревание, гомогенизация. Тесное контактирование проводят предпочтительно в асептических условиях и в атмосфере инертного газа при температуре ниже 40 С. Далее изобретение предлагает добавлять один или несколько фармацевтически приемлемых буферов, агентов тоничности, консервантов, хелатирующих агентов, антиокислителей, противокристаллизующих агентов. Настоящее изобретение рассматривает также придание композиции стерильности, предпочтительно, пропусканием через стерильный фильтр 0,2 мкм стерилизующего сорта и перенос асептически стерильной композиции в стерильные контейнеры с последующим замещением воздуха в головной части контейнера посредством продувания инертным газом, таким как азот, и герметизацию контейнеров. Подробное описание вариантов осуществления изобретения Содержание ифосфамида в композиции, описанной в данном изобретении, составляет до 1100 мг/мл, предпочтительный диапазон составляет от 1 до 200 мг/мл, более предпочтительно от 10 до 100 мг/мл, наиболее предпочтительно от 40 до 50 мг/мл. Другими предпочтительными диапазонами содержания ифосфамида в композиции, описанной в данном изобретении, являются диапазоны от 200 до 500 мг/мл и от 500 до 1000 мг/мл. В концентрированных композициях ифосфамида содержание ифосфамида составляет от 200 до 1100 мг/мл, предпочтительно от 200 до 1000 мг/мл и более предпочтительно от 500 до 1000 мг/мл.(HPBCD) является частично замещенным по 2-Гидроксипропилциклодекстрин ли(гидроксипропиловым)эфиром бета-циклодекстрина. Гидроксипропильные группы являются произвольно замещенными на гидроксильных группах циклодекстрина и количество замещения представляет собой среднюю степень замещения или число гидроксипропильных групп на циклодекстрин. В альтер-2 012368 нативном случае количество замещения указывается как молярное замещение (MS) или среднее число замещения на звено ангидроглюкозы в кольце циклодекстрина. Молярное замещение может влиять на связывание молекул гостей с HPBCD. При низкой степени замещения связывание очень похоже на связывание немодифицированного бета-циклодекстрина. Повышение молярного замещения может привести к ослабленному связыванию вследствие стерического затруднения. В данном изобретении может быть пригодным HPBCD, имеющий молярное замещение между 0,05 и приблизительно 2. Предпочтительным является HPBCD, имеющий молярное замещение между 0,3 и приблизительно 1,5, более предпочтительным является HPBCD, имеющий молярное замещение между 0,5 и приблизительно 1,2.HPBCD может присутствовать в композиции при молярном отношении ифосфамида к HPBCD от 100:0,1 до 1:300, предпочтительно от 100:0,25 до 1:100, более предпочтительно от 100:1 до 1:20. Другим предпочтительным молярным отношением ифосфамида к HPBCD является отношение от 100:3,3 до 1:2,5. При приготовлении концентрированных композиций ифосфамида потребность в HPBCD изменяется с концентрацией ифосфамида. Сначала она повышается с концентрацией ифосфамида. Но при более высокой конечной концентрации ифосфамида содержание HPBCD и воды ограничивается вследствие ограничения объема. Поэтому отношение ифосфамида к HPBCD должно быть выбрано правильно. рН композиции настоящего изобретения может быть между 3,0 и 9,0. Предпочтительным диапазоном рН настоящего изобретения является от 5,0 до 8,0. Композиции настоящего изобретения могут включать в себя также фармацевтически приемлемые добавки для целей стабилизации рН, консервации, регулирования изотоничности, стабилизации против окисления, хелатирующего действия, противокристаллизующего действия и другие подходящие добавки. Некоторые из фармацевтически приемлемых добавок могут присутствовать в водном растворе, к которому добавляют ифосфамид и HPBCD и/или некоторые из них могут быть добавлены по отдельности в виде раствора в воде перед составлением объема в конечной композиции. Для композиций настоящего изобретения могут требоваться подходящие буферы для установления или стабилизации рН. Подходящие буферные агенты для композиций настоящего изобретения включают в себя, но не ограничиваются перечисленным, фосфатный буфер, цитратный буфер, глициновый буфер,гистидиновый буфер, содержащий любое из обычно применяемых соединений или смеси соединений,таких как дигидрофосфат натрия, гидрофосфат натрия, дигидрофосфат калия, гидрофосфат калия гидрохлорид гистидина, гидроксид натрия, фосфорная кислота, цитрат натрия, лимонная кислота, глицин, цитрат калия, хлористо-водородная кислота и гидроксид калия. Предпочтительным буферным агентом является смесь дигидрофосфата натрия и гидрофосфата натрия. Из других фармацевтически приемлемых добавок подходящий агент тоничности для композиций настоящего изобретения выбран из группы таких соединений, как глицерин, хлорид натрия, мальтоза,маннит, декстроза и их смеси. Аналогично этому подходящие консерванты для композиций настоящего изобретения могут включать в себя, но не ограничиваются перечисленным, метилгидроксибензойную кислоту, пропилгидроксибензойную кислоту, фенол, бензиловый спирт и бензоат натрия. Композиция настоящего изобретения может содержать подходящие хелатирующие агенты, такие как этилендиаминтетрауксусная кислота (EDTA) и ее соли и дезфероксиминметансульфонат (дезферал). Композиция настоящего изобретения может содержать также подходящие антиокислители, такие как аскорбиновая кислота, бисульфит натрия, метабисульфит натрия, бутилированный гидроксианизол и бутилированный гидрокситолуол. Кроме того, композиция настоящего изобретения может содержать такие вещества, как глицерин, в качестве противокристаллизующих агентов. Тесное контактирование водных растворов, содержащих ифосфамид и HPBCD, осуществляют такими способами, как перемешивание, смешивание, обработка ультразвуком, нагревание, гомогенизация. Фармацевтически приемлемые добавки, такие как буферы, агенты тоничности, консерванты хелатирующие агенты, антиокислители, противокристаллизующие агенты, требуемые для парентеральной лекарственной формы, могут присутствовать в водном растворе, к которому добавляют ифосфамид и HPBCD. В альтернативном случае они могут быть добавлены отдельно в виде раствора в воде до получения нужного объема. При получении концентрированной композиции ифосфамида для включения больших количеств ифосфамида HPBCD растворяют в минимальном количестве воды и ифосфамид солюбилизируют тесным перемешиванием. Фармацевтически приемлемые добавки, если они требуются, добавляют как таковые или в виде растворов в раствор ифосфамид-HPBCD. Наконец, добавляют остальное количество воды для получения требуемого объема с последующим перемешиванием для получения гомогенного раствора и затем придания стерильности полученной таким образом композиции. Композиция может быть сделана непирогенной, если требуется, пропусканием через тангенциальную проточную систему фильтрования (TFF) перед стерилизацией. Композиции обычно делают стерильными пропусканием через фильтр стерилизующего сорта. Может быть использован предпочтительно фильтр стерилизующего сорта 0,2 мкм. Стерильные композиции настоящего изобретения могут быть помещены в асептических условиях в-3 012368 стерильные контейнеры, такие как пузырьки, ампулы, пластиковые контейнеры, с последующей заменой воздуха в головной части контейнеров продуванием инертного газа, такого как азот, и герметизацией заполненных контейнеров. Без связи с теорией авторы изобретения считают, что трехкомпонентная система ифосфамида,HPBCD и воды является стабильной водной композицией. Такие системы изучают в настоящее время в отношении различных аспектов, таких как растворимость, комплексообразование и капсулирование при разных температурах и на протяжении разных периодов времени. Кроме того, изучают также влияние других добавок на стабильность системы. Хорошо известно, что лечение ифосфамидом ассоциируется с серьезными побочными действиями,подобными геморрагическому циститу, и в противодействие этому, месну всегда вводят при инъекции ифосфамида. Однако имеются другие побочные действия, подобные миелосупрессии, сердечной аритмии, расстройству деятельности центральной нервной системы (ЦНС), нефротоксичности, гематологическим и желудочно-кишечным реакциям, которые не принимают во внимание при применении композиций ифосфамида, доступных в настоящее время. Токсичность композиций настоящего изобретения оценивали по сравнению с токсичностью обычной лекарственной формы, имеющейся в продаже (Holoxan). Композиции настоящего изобретения при исследовании на мышах swiss albino показали меньшие токсичные действия, подобные судорогам, миелосупрессии, гепатотоксичности. Обнаружено, что степень смертности является значительно меньшей у животных, которых лечили композициями настоящего изобретения, по сравнению с обычным продаваемым продуктом. Величины LD20 исследованных композиций представлены в примерах. Без связи с теорией авторы считают, что ифосфамид весь или часть его находится в виде комплекса в полости HPBCD в водном растворе. При системном введении это лекарственное средство высвобождается из полости в кровоток. Свободное лекарственное средство и комплекс лекарственное средствоHPBCD находятся в равновесии, и метаболизм свободного ифосфамида смещает равновесие, что приводит к высвобождению свободного лекарственного средства. Присутствие ифосфамида в форме комплекса и оптимальные уровни свободного лекарственного средства в крови могут предотвращать взаимодействие ифосфамида со здоровыми тканями и органами, тем самым предотвращая нежелательные побочные действия. В настоящем изобретении ифосфамид и HPBCD могут образовывать синергическую комбинацию с достижением в итоге пониженной токсичности как в присутствии, так и в отсутствие месны, как показано величинами LD50 у мышей и исследованиями геморрагического цистита у крыс. Композиции ифосфамида настоящего изобретения, имеющие пониженную токсичность, имеют преимущество при лечении различных солидных опухолей, в том числе опухолей шеи, эндометрия, легких, яичников, яичек и вилочковой железы, а также саркомы, и при лечении лимфомы Беркитта. Растворимость ифосфамида в воде составляет приблизительно 100 мг/мл. Способ настоящего изобретения делает возможным получение композиции, содержащей ифосфамид в концентрации более высокой, чем 100 мг/мл. Эти концентрированные растворы, содержащие от 100 до 1100 мг/мл, обеспечивают дополнительные преимущества, подобные безопасности, благодаря меньшей ручной манипуляции,благодаря чему происходит меньшее воздействие на клиницистов цитотоксичного ифосфамида во время введения и появляется повышенная уверенность в стерильности. Примеры Теперь изобретение будет иллюстрировано посредством примеров. Примеры представлены только для иллюстрации и никоим образом не ограничивают объем изобретения. Ифосфамид, используемый в этих примерах, был ифосфамидом парентерального сорта, соответствующим спецификациям Фармакопеи США. Используемый 2-гидроксипропилциклодекстрин(HPBCD) был изготовлен Wacker Chemie и имеет молярное замещение на звено ангидроглюкозы гидроксипропильными группами между 0,5 и 1,2. Используемое оборудование было общепринятого типа, всю обработку проводили в зоне с контролируемой внешней средой. Вода, используемая в этих примерах,была водой парентерального сорта, соответствующей спецификациям "Вода для инъекции". Все другие добавки, используемые в этих примерах, были добавками парентерального сорта. Пример I. Получение композиции 50 мг/мл ифосфамида, содержащей 20% HPBCD в воде. Процедурой, приведенной ниже, была получена следующая композиция: Взвешенное количество HPBCD растворяют в 150 мл воды. Добавляют взвешенное количество ифосфамида и систему перемешивают в течение 3 ч. Объем смеси доводят до 200 мл водой и смесь перемешивают. Образовавшийся раствор фильтруют через фильтр 0,2 мкм и заполняют в асептических условиях в стерильные стеклянные пузырьки. Стеклянные пузырьки закрывают в асептических условиях резиновыми пробками, покрытыми стерильным тефлоном, и герметизируют с применением гермети-4 012368 ков с защелкой. Композицию, полученную в данном примере, анализировали на содержание ифосфамида способом высокоэффективной жидкостной хроматографии (ВЭЖХ), было обнаружено, что она содержит 51,73 мг/мл ифосфамида. Композиция имеет рН 6,5. Пример II. Стабильность композиции примера I. Композицию, полученную в примере I, подвергали изучению стабильности в течение продолжительного времени при 2-8 С. Данные стабильности в конце 24 месяцев указаны в табл. 1. Таблица 1. Данные стабильности композиции примера I Приведенные выше данные показывают незначительное снижение содержания ифосфамида, что указывает на хорошую стабильность. Пример III. Изучение токсичности композиции примера I. Композицию, полученную в примере I, подвергали изучению на острую токсичность на мышах. Экспериментальные детали являются следующими: Оба раствора лекарственного средства подходящим образом разбавляли 5% декстрозой для инъекции и вводили внутривенно. Ифосфамид при дозах 400, 500, 600, 700 и 800 мг/кг массы тела вводили 10 группам животных, причем каждая группа состояла из 10 животных. Животных выдерживали при наблюдении в течение 14 дней и смертность регистрировали в конце 7 дней. Доза LD50, т.е. доза, которая является летальной для 50% животных, показана в табл. 2. Приведенные выше данные явно показывают, что композиция примера I является менее токсичной по сравнению с общепринятым препаратом. Пример IV. Получение композиции ифосфамида, содержащей 10% HPBCD в фосфатном буфере. Следующую композицию получали процедурой, указанной ниже: Взвешенные количества гидрофосфата натрия и дигидрофосфата натрия растворяли в 160 мл воды. Взвешенное количество HPBCD добавляли и медленно растворяли при перемешивании в этом буферном растворе. Взвешенное количество ифосфамида медленно добавляли при перемешивании к забуференному раствору HPBCD и перемешивали в течение 3 ч. Объем раствора доводили водой до 200 мл и перемешивали. Образовавшийся раствор фильтровали через фильтр 0,2 мкм и в асептических условиях заполняли в стерильные стеклянные пузырьки. Воздух в головном пространстве пузырьков продували азотом и стеклянные пузырьки закрывали в асептических условиях резиновыми пробками, покрытыми стерильным тефлоном, и герметизировали с применением герметиков с защелкой. Композицию, полученную в данном примере, анализировали на содержание ифосфамида способом высокоэффективной жидкостной хроматографии (ВЭЖХ), было обнаружено, что она содержит 50,23 мг/мл ифосфамида. Композиция имеет рН 7,2. Сравнительный пример V. Получение композиции 50 мг/мл ифосфамида в фосфатном буфере. Для установления снижающей токсичность природы HPBCD исследованием токсичности получали сравнительную композицию, содержащую ифосфамид в буфере, процедурой, указанной ниже. Взвешенные количества гидрофосфата натрия и дигидрофосфата натрия растворяли в 180 мл воды. Взвешенное количество ифосфамида медленно добавляли при перемешивании к буферному раствору и перемешивали в течение 3 ч. Объем раствора доводили водой до 200 мл и перемешивали. Образовавшийся раствор фильтровали через фильтр 0,2 мкм и в асептических условиях заполняли в стерильные стеклянные пузырьки по 10 мл. Воздух в головном пространстве пузырьков продували азотом и стеклянные пузырьки закрывали в асептических условиях резиновыми пробками, покрытыми стерильным тефлоном, и герметизировали с применением герметиков с защелкой. Композицию, полученную в данном примере, анализировали на содержание ифосфамида способом высокоэффективной жидкостной хроматографии (ВЭЖХ), было обнаружено, что она содержит 50,1 мг/мл ифосфамида. Композиция имеет рН 6,5. Пример VI. Исследование на острую токсичность композиций примера IV и примера V. Экспериментальные детали были следующими: Композиции, полученные в примере IV и примере V, подвергали изучению на острую токсичность на мышах. Общепринятый препарат, Holoxan, пересоздавали, как указано производителем, и применяли в качестве контроля. Дозы ифосфамида, выбранные для изучения, были 400, 500, 600, 700 и 800 мг/кг массы тела. Растворы ифосфамида композиций примера IV, примера V и Holoxan подходящим образом разбавляли 5% декстрозой для инъекции как таковой, а также с месной при дозе 20% ифосфамида и вводили внутривенно 25 разным группам животных, причем каждая группа состояла из восьми животных. Животных выдерживали при наблюдении в течение 14 дней и смертность регистрировали в конце 7 дней. Величины LD50 композиций примера IV, примера V и Holoxan показаны в табл. 3. Таблица 3. Величины LD20 композиций примера IV, V и Holoxan Приведенные выше данные явно показывают, что композиция примера IV менее токсична, как в присутствии, так и отсутствие месны по сравнению с общепринятым препаратом, а также ифосфамидом в буферном растворе. Пример VII. Повторные изучения токсичности доз композиции примера IV. Композицию, полученную в примере IV, вместе с общепринятым препаратом Holoxan подвергали повторному изучению для определения дозы токсичности на мышах для оценки влияния композиций ифосфамида на гематологические и биохимические параметры. Экспериментальные детали были следующими:(подробности Holoxan и Uromitexan показаны в примере VI) Животным инъецировали ифосфамид вместе с месной (в виде 20% дозы ифосфамида) при суточных дозах 80, 100 и 120 мг/кг внутривенно в течение семи дней. Необработанную группу применяли в качестве контроля. Животных обследовали на протяжении периода исследования 14 дней на смертность, гемологические и биохимические изменения. Общий подсчет WBC проводили до и после обработки композицией примера IV и Holoxan. Величины показаны в табл. 4. Таблица 4. Общий подсчет WBC животных, обработанных композицией примера IV и Holoxan Животные, обработанные препаратом примера IV и Holoxan, проявили снижение в общей величине WBC. Однако животные, обработанные Holoxan, проявили тяжелую лейкопению по сравнению с композицией примера IV. Это указывает на менее токсичную природу композиции примера IV. Для изучения влияния композиции примера IV и Holoxan на функцию печени, анализировали уровни глутаматоксалоацетаттрансаминазы (SGOT) обработанных групп и необработанной контрольной группы. Уровни SGOT обработанных групп и необработанной группы показаны в табл. 5. Таблица 5. Средние уровни SGOT животных, обработанных композицией примера IV, Holoxan и необработанного контроля Согласно приведенным выше данным, повышение уровней SGOT у животных, обработанных композицией примера IV, было незначительно выше, чем повышение контрольной группы, тогда как у животных, обработанных Holoxan, повышение в величинах SGOT было очень значительным. Это указывает на пониженную гепатотоксическую природу композиции примера IV. Пример VIII. Изучения действия композиции IV на геморрагический цистит.-8 012368 Композицию, полученную в примере IV, вместе с общепринятым препаратом Holoxan подвергали исследованию на геморрагический цистит у крыс для оценки их токсичности для мочевого пузыря. Экспериментальные детали были следующими: Схема изучения Животных делили на 9 групп и каждая группа состояла из двух животных. Ифосфамид отдельно или с месной вводили посредством внутривенного пути при дозах 400 и 500 мг/кг массы тела. Группу,обработанную инъекцией декстрозы, использовали в качестве контроля. Животных умерщвляли через 24 ч после инъекции. Мочевые пузыри всех животных собирали и фиксировали в 10% формалине в течение 48 ч. Получали гистопатологические микроскопические препараты органа и подвергали их микроскопическому изучению. Наблюдения Табл. 6 представляет результаты оценки геморрагического цистита, вызванного двумя препаратами ифосфамида. Таблица 6. Оценка в баллах геморрагического циститаN: нормальное состояние; 1+ : слабый геморрагический цистит; 2+ : умеренный геморрагический цистит с эпителиальной атипией или без нее; 3+ : тяжелый геморрагический цистит с эпителиальной атипией или без нее. Результаты Заключение Вышеуказанные открытия убедительно доказывают, что композиция примера IV является менее токсичной для мочевого пузыря, чем общепринятая композиция Holoxan.-9 012368 Пример IX. Изучение стабильности композиции примера IV. Композицию, полученную в примере IV, подвергали изучению стабильности при температуре от 2 до 8 С. Образцы в конце 6 и 12 месяцев анализировали способом ВЭЖХ. Данные показаны в табл. 7. Таблица 7. Данные стабильности композиции примера IV Приведенные выше данные показывают незначительное снижение содержания ифосфамида при 2-8 С, что указывает на хорошую стабильность при продолжении периода 12 месяцев. Другие композиции настоящего изобретения, содержащие различные концентрации ифосфамида иHPBCD, показаны в табл. 8. Таблица 8. Другие композиции настоящего изобретения Композиции, показанные в табл. 8, получали по процедуре, указанной ниже. Пример X. Ифосфамид (10 г) и HPBCD (40 г), гидрофосфат натрия (0,1 г) и дигидрофосфат натрия (0,06 г) помещали в градуированную колбу. Воду для инъекции медленно добавляли к смеси с прерывистым перемешиванием до получения 200 мл прозрачного гомогенного раствора. Образовавшийся раствор пропускали через стерильный фильтр 0,2 мкм и в асептических условиях помещали в стерильные стеклянные пузырьки на 10 мл. Воздух в головном пространстве пузырьков продували газообразным азотом и стеклянные пузырьки закрывали в асептических условиях резиновыми пробками, покрытыми стерильным тефлоном, и герметизировали с применением герметиков с защелкой. Пример XI. Ифосфамид (10 г) и HPBCD (80 г), гидрофосфат натрия (0,1 г в 10 мл воды) и дигидрофосфат натрия (0,06 г в 10 мл воды) помещали в градуированную колбу. Воду для инъекции медленно добавляли к смеси с прерывистым перемешиванием до получения 200 мл прозрачного гомогенного раствора. Образовавшийся раствор пропускали через стерильный фильтр 0,2 мкм и в асептических условиях помещали в стерильные стеклянные пузырьки на 10 мл. Воздух в головном пространстве пузырьков продували газо- 10012368 образным азотом и стеклянные пузырьки закрывали в асептических условиях резиновыми пробками,покрытыми стерильным тефлоном, и герметизировали с применением герметиков с защелкой. Пример XIIIHPBCD (20 г) растворяли в 40 мл воды. К концентрированному раствору HPBCD постепенно добавляли ифосфамид (10 г) и смесь перемешивали при умеренной скорости в течение 1 ч. Прозрачный раствор затем разбавляли до 200 мл водой. Образовавшийся раствор фильтровали через фильтр 0,2 мкм и в асептических условиях помещали в стерильные стеклянные пузырьки на 10 мл. Воздух в головном пространстве пузырьков продували газообразным азотом и стеклянные пузырьки закрывали в асептических условиях резиновыми пробками, покрытыми стерильным тефлоном, и герметизировали с применением герметиков с защелкой. Пример XIII. Композицию получали по процедуре примера IV с применением компонентов в количествах, указанных в табл. 8. Пример XIV.HPBCD (40 г) растворяли в 80 мл воды. К концентрированному раствору HPBCD постепенно добавляли ифосфамид (100 г) и растворяли перемешиванием. Объем доводили до 200 мл водой и перемешивали. Образовавшийся раствор фильтровали через фильтр 0,2 мкм и в асептических условиях помещали в стерильные стеклянные пузырьки на 10 мл. Воздух в головном пространстве пузырьков продували газообразным азотом и стеклянные пузырьки закрывали в асептических условиях резиновыми пробками, покрытыми стерильным тефлоном, и герметизировали с применением герметиков с защелкой. Композицию этого примера анализировали на содержание ифосфамида ВЭЖХ, было показано, что она содержит 500,3 мг/мл ифосфамида. Пример XV. Композицию получали по процедуре примера XIV с применением компонентов в количествах, указанных в табл. 8. Композицию этого примера анализировали на содержание ифосфамида ВЭЖХ, было показано, что она содержит 500,28 мг/мл ифосфамида. Пример XVI. Ифосфамид (200 г) и HPBCD (10 г) помещали в градуированную колбу. Воду для инъекции медленно добавляли к смеси с прерывистым перемешиванием до получения 200 мл прозрачного гомогенного раствора Образовавшийся раствор пропускали через стерильный фильтр 0,2 мкм и в асептических условиях помещали в стерильные стеклянные пузырьки на 10 мл. Воздух в головном пространстве пузырьков продували газообразным азотом и стеклянные пузырьки закрывали в асептических условиях резиновыми пробками, покрытыми стерильным тефлоном, и герметизировали с применением герметиков с защелкой. Композицию этого примера анализировали на содержание ифосфамида ВЭЖХ, было показано, что она содержит 1025,5 мг/мл ифосфамида. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Стабильные прозрачные водные композиции ифосфамида, имеющие пониженную токсичность,предназначенные для парентерального введения и содержащие ифосфамид до 1100 мг/мл композиции и 2-гидроксипропилциклодекстрин. 2. Композиции ифосфамида по п.1, где молярное замещение гидроксипропильными группами в 2 гидроксипропилциклодекстрине составляет 0,05-2. 3. Композиции ифосфамида по п.1 или 2, где молярное замещение гидроксипропильными группами в 2-гидроксипропилциклодекстрине составляет 0,3-1,5. 4. Композиции ифосфамида по любому из пп.1-3, где молярное замещение гидроксипропильными группами в 2-гидроксипропилциклодекстрине составляет 0,5-1,2. 5. Композиции ифосфамида по любому из пп.1-4, где молярное отношение ифосфамида к 2 гидроксипропилциклодекстрину находится в пределах 100:0,1-1:300. 6. Композиции ифосфамида по любому из пп.1-5, где молярное отношение ифосфамида к 2 гидроксипропилциклодекстрину находится в пределах 100:0,25-1:100. 7. Композиции ифосфамида по любому из пп.1-6, где молярное отношение ифосфамида к 2 гидроксипропилциклодекстрину находится в пределах 100:1-1:20. 8. Композиции ифосфамида по любому из пп.1-7, где молярное отношение ифосфамида к 2 гидроксипропилциклодекстрину находится в пределах 100:3,3-1:2,5. 9. Композиция ифосфамида по п.1, дополнительно содержащая фармацевтически приемлемые добавки, которые выбраны из группы веществ, таких как буферы, агенты тоничности, консерванты, хелатирующие агенты, антиокислители, антикристаллизующие агенты. 10. Композиции ифосфамида по любому из пп.1-9, где содержание ифосфамида в композиции составляет 1-200 мг/мл.- 11012368 11. Композиции ифосфамида по любому из пп.1-10, где содержание ифосфамида в композиции составляет 10-100 мг/мл. 12. Композиции ифосфамида по любому из пп.1-11, где содержание ифосфамида в композиции составляет 40-50 мг/мл. 13. Композиции ифосфамида по любому из пп.1-9, где содержание ифосфамида в композиции составляет 200-500 мг/мл. 14. Композиции ифосфамида по любому из пп.1-9, где содержание ифосфамида в композиции составляет 500-1000 мг/мл. 15. Композиции ифосфамида по любому из пп.1-14, где композиция имеет рН между 3,0 и 9,0. 16. Композиции ифосфамида по любому из пп.1-15, где композиция имеет рН между 5,0 и 8,0. 17. Композиции ифосфамида по п.9, где буферный агент выбран из группы буферных агентов, таких как дигидрофосфат натрия, гидрофосфат натрия, гидрофосфат калия, дигидрофосфат калия, фосфорная кислота, гидрохлорид гистидина, гидроксид натрия, хлористо-водородная кислота и их смеси. 18. Композиции ифосфамида по п.17, где буферным агентом является смесь дигидрофосфата натрия и гидрофосфата натрия. 19. Способ получения композиций ифосфамида по любому из пп.1-18, содержащий стадии:i) приведения в состояние тесного контакта ифосфамида, 2-гидроксипропилциклодекстрина и воды,ii) придания стерильности композиции, полученной в конце стадии (i). 20. Способ получения композиций ифосфамида по п.19, дополнительно содержащий добавление требуемых количеств фармацевтически приемлемых добавок при приведении в состояние тесного контакта ифосфамида, 2-гидроксипропилциклодекстрина и воды. 21. Способ получения композиций ифосфамида по любому из пп.19-20, где композиции придают стерильность пропусканием через стерильный 0,2 мкм фильтр стерилизующего сорта. 22. Способ получения композиций ифосфамида по любому из пп.19-21, содержащий дополнительные стадии переноса асептически стерильной композиции в стерильные контейнеры, продувания воздуха в головном пространстве контейнеров инертным газом и герметизации контейнеров. 23. Способ получения композиций ифосфамида по любому из пп.19-22, где молярное замещение гидроксипропильными группами в 2-гидроксипропилциклодекстрине составляет 0,05-2. 24. Способ получения композиций ифосфамида по любому из пп.19-23, где молярное замещение гидроксипропильными группами в 2-гидроксипропилциклодекстрине составляет 0,3-1,5. 25. Способ получения композиций ифосфамида по любому из пп.19-24, где молярное замещение гидроксипропильными группами в 2-гидроксипропилциклодекстрине составляет 0,5-1,2. 26. Способ получения композиций ифосфамида по любому из пп.19-25, где молярное отношение ифосфамида к 2-гидроксипропилциклодекстрину составляет 100:0,1-1:300. 27. Способ получения композиций ифосфамида по любому из пп.19-26, где молярное отношение ифосфамида к 2-гидроксипропилциклодекстрину составляет 100:0,25-1:100. 28. Способ получения композиций ифосфамида по любому из пп.19-27, где молярное отношение ифосфамида к 2-гидроксипропилциклодекстрину составляет 100:1-1:20. 29. Способ получения композиций ифосфамида по любому из пп.19-28, где молярное отношение ифосфамида к 2-гидроксипропилциклодекстрину составляет 100:3,3-1:2,5. 30. Способ получения композиций ифосфамида по п.20, где указанные фармацевтически приемлемые добавки выбраны из группы веществ, таких как буферы, агенты тоничности, консерванты, хелатирующие агенты, антиокислители, антикристаллизующие агенты. 31. Способ получения композиций ифосфамида по любому из пп.19-30, где содержание ифосфамида композиции составляет 1-200 мг/мл. 32. Способ получения композиций ифосфамида по любому из пп.19-31, где содержание ифосфамида композиции составляет 10-100 мг/мл. 33. Способ получения композиций ифосфамида по любому из пп.19-32, где содержание ифосфамида композиции составляет 40-50 мг/мл. 34. Способ получения композиций ифосфамида по любому из пп.19-30, где содержание ифосфамида композиции составляет 200-500 мг/мл. 35. Способ получения композиций ифосфамида по любому из пп.19-30, где содержание ифосфамида композиции составляет 500-1000 мг/мл. 36. Способ получения композиций ифосфамида по любому из пп.19-35, где рН композиции находится между 3,0-9,0. 37. Способ получения композиций ифосфамида по любому из пп.19-36, где рН композиции находится между 5,0-8,0. 38. Способ получения композиций ифосфамида по п.30, где буферный агент выбран из группы буферных агентов, таких как дигидрофосфат натрия, гидрофосфат натрия, гидрофосфат калия, дигидрофосфат калия, гидрохлорид гистидина, гидроксид натрия и их смеси.- 12012368 39. Способ получения композиций ифосфамида по п.38, где буферный агент представляет собой смесь дигидрофосфата натрия и гидрофосфата натрия. 40. Стабильная прозрачная водная композиция ифосфамида, имеющая пониженную токсичность и предназначенная для парентерального введения, по п.1, где каждый миллилитр композиции содержит 41. Стабильная прозрачная водная композиция ифосфамида, имеющая пониженную токсичность и предназначенная для парентерального введения, по п.1, где каждый миллилитр композиции содержит 42. Стабильная прозрачная водная композиция ифосфамида, имеющая пониженную токсичность и предназначенная для парентерального введения, по п.1, где каждый миллилитр композиции содержит
МПК / Метки
МПК: A61P 35/00, A61K 31/724, A61K 31/33
Метки: получения, парентерального, ифосфамида, композиции, введения, способ
Код ссылки
<a href="https://eas.patents.su/14-12368-kompozicii-ifosfamida-dlya-parenteralnogo-vvedeniya-i-sposob-ih-polucheniya.html" rel="bookmark" title="База патентов Евразийского Союза">Композиции ифосфамида для парентерального введения и способ их получения</a>
Предыдущий патент: Композиция и способ очистки поверхности тела от капсаицина, набор и способ лечения боли
Следующий патент: Новые соли тиотропия, способ их получения, а также содержащие их лекарственные композиции
Случайный патент: Производные бензотиазолона