Пиридазинилфенилгидразоны, применяемые при застойной сердечной недостаточности
Номер патента: 5574
Опубликовано: 28.04.2005
Авторы: Норе Пентти, Пюстюнен Ярмо, Луйро Анне, Левийоки Йоуко, Леннберг Кари, Кахейнен Петри, Кайвола Юха, Хайкала Хеймо, Пиппури Айно, Бякстрем Реййо
Формула / Реферат
1. Соединение формулы (I)
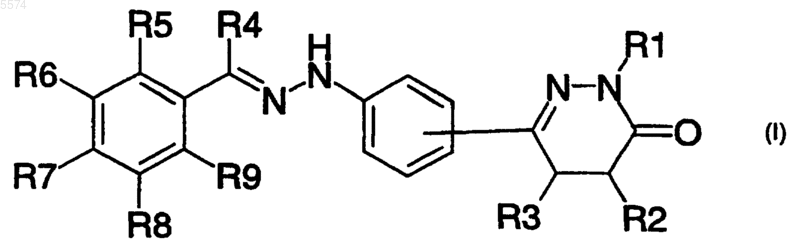
где каждый из R1-R4 независимо означают водород, C1-6алкил, C2-6алкенил, C6-10арил, C7-12арилалкил, C1-6карбоксиалкил, C1-6гидроксиалкил или C1-6галогеналкил или R2 и R3 образуют цикл из 5-7 атомов углерода и R4 означает водород, C1-6алкил, C2-6алкенил, замещенный C6-10арил, C7-12арилалкил, C1-6 карбоксиалкил, C1-6гидроксиалкил или C1-6галогеналкил, каждый из R5-R9 означает независимо водород, C1-6алкил, C2-6алкенил, C6-10арил, C7-12арилалкил, C1-6ацил, гидрокси, C1-6алкокси, C1-6алкоксикарбонил, амино, C1-6ациламино, C1-6алкиламино, C6-10арилокси, галоген, циано, нитро, карбокси, C1-6алкилсульфонил, сульфонамидо или трифторметил,
где каждый арильный остаток, определенный выше, сам по себе или как часть другой группы может быть замещён 1-3 радикалами, выбранными из группы, включающей фтор, хлор, бром, иод, гидрокси, нитро, карбокси, трифторметил, амино, C1-4алкил, C1-4алкокси, C1-6ацил, C1-6карбоксиалкил, фенил, нафтил, галогенфенил, галогеннафтил, бензил, фенетил, галогенбензил, галогенфенетил, нафтилметил, нафтилэтил, C4-7циклоалкил, C1-4алкилC4-7циклоалкил, моно-C1-4алкиламино, ди-C1-4алкиламино, C1-6алканоиламино, фенилкарбониламино, нафтилкарбониламино, циано, тиол или C1-6алкилтио,
и его фармацевтически приемлемые соли и сложные эфиры,
при условии, что a) когда R1, R2, R3, R5, R6, R8 и R9 означают водород и R4 означает метил, R7 не являются водородом, метокси, циано или метилом, и b) когда R1, R2, R3, R5, R6, R7 и R8 означают водород и R4 означает метил, R9 не является гидрокси или хлором, и c) когда R1, R2, R3, R5, R6, R7 и R9 означают водород и R4 означает метил, R8 не является трифторметилом.
2. Соединение по п.1, где R5-R9 независимо означают водород, гидрокси, C1-6алкил, C1-6алкокси, карбокси, C1-6алкоксикарбонил или нитро.
3. Соединение по п.2, где R5 означает гидрокси, C1-6алкил, C1-6алкокси, карбокси, C1-6алкоксикарбонил или нитро.
4. Соединение по п.3, где R5 означает гидрокси или нитро.
5. Соединение по любому из пп.1-4, где R2 и R3 образуют фенильный цикл.
6. Соединение по любому из пп.1-5, где R1-R3 независимо означают водород или C1-6алкил.
7. Соединение формулы (I), где R1, R2, R3, R5, R6, R8 и R9 означают водород, R4 означает метил и R7 означает водород, метокси, циано или метил, или где R1, R2, R3, R5, R6, R7 и R8 означают водород и R4 означает метил и R9 означает гидрокси или хлор, или где R1, R2, R3, R5, R6, R7 и R9 означают водород и R4 означает метил, R8 означает трифторметил, или его фармацевтически приемлемая соль с фармацевтически приемлемым носителем.
8. Фармацевтическая композиция, включающая соединение по п.1 в качестве активного ингредиента вместе с фармацевтически приемлемым носителем.
9. Способ лечения застойной сердечной недостаточности, включающий введение нуждающемуся в лечении пациенту терапевтически эффективного количества соединения по п.1 или 7.
Текст
005574 Настоящее изобретение касается соединений пиридазинилфенилгидразона и их фармацевтически приемлемых солей и сложных эфиров. Изобретение также касается фармацевтических композиций,включающих указанные соединения в качестве активных ингредиентов. Соединения по изобретению повышают чувствительность к кальцию сократительных белков миокарда и поэтому полезны в лечении застойной сердечной недостаточности. Застойная сердечная недостаточность характеризуется пониженным сердечным выбросом и повышенным давлением наполнения правого и левого желудочка. Эти гемодинамические состояния могут вызывать симптомы одышки, усталости и отка. Сокращение сердечной мышцы вызывается связыванием кальция с сократительными белками. Ряд ингибиторов изофермента фосфодиэстеразы III (PDE III) проходит клинические испытания на лечение застойной сердечной недостаточности. Указанные соединения повышают сокращаемость сердечной мышцы и вызывают расширение кровеносных сосудов. Однако известно, что длительное применение таких соединений может приводить к перегрузке сердечной мышцы кальцием и вызывать аритмию. Поэтому желательно разработать лекарственные препараты, действующие по механизму, повышающему сердечную сокращаемость, и не вызывающие при этом перегрузки кальцием. Таким механизмом будет служить повышение чувствительности к кальцию сократительных белков. Соединения пиридазинилфенилгидразона описаны ранее в европейской патентной заявке ЕР 383449. Соединения обнаруживают кальций-зависимое связывание с сократительными белками сердечной мышцы, а также активность в ингибировании PDE III. В характерных примерах описано одно производное 1-ацетил-1-фенилметилидена (Пр. 16). Хотя производное 1-ацетил-1-фенилметилидена оказывает некоторое влияние на сердечную сокращаемость, оно не повышает чувствительность к кальцию сократительных белков. Некоторые производные пиридазинилфенилгидразона выступают в роли промежуточных соединений согласно европейским патентным заявкам ЕР 223937 и ЕР 280224. Однако соединения индивидуально не охарактеризованы. В Mertens, A. et al., J. Med. Chem. 1990, 33, 2870-2875 описаны фенил-, 4 метоксифенил- и 2-гидроксифенил- производные соединений пиридазинилфенилгидразона в качестве промежуточных соединений. Найдено, что соединения формулы (I) эффективны в повышении чувствительности к кальцию сократительных белков сердечной мышцы: где каждый из R1-R4 означает водород, алкил, алкенил, арил, арилалкил, карбоксиалкил, гидроксиалкил или галогеналкил, или R2 и R3 образуют цикл из 5-7 атомов углерода,каждый из R5-R9 означает водород, алкил, алкенил, арил, арилалкил, ацил, гидрокси, алкокси, алкоксикарбонил, амино, ациламино, алкиламино, арилокси, галоген, циано, нитро, карбокси, алкилсульфонил, сульфонамидо или трифторметил,где каждый вышеуказанный арильный остаток, сам по себе или как часть другой группы, может быть замещнным,и их фармацевтически приемлемые соли и сложные эфиры,при условии, что а) когда R1, R2, R3, R5, R6, R8 и R9 означают водород и R4 означает метил, R7 не может означать водород или метокси и b) когда R1, R2, R3, R5, R6, R7 и R8 означают водород и R4 означает метил, R9 не может означать гидрокси. Изобретение также касается соединений формулы (I), где R1, R2, R3, R5, R6, R8 и R9 означают водород, R4 означает метил и R7 означает водород или метокси, или где R1, R2, R3, R5, R6, R7 и R8 означают водород, R4 означает метил и R9 означает гидрокси, и их фармацевтически приемлемых солей и сложных эфиров, применяемых в качестве лекарственного средства. К классу предпочтительных соединений и фармацевтически приемлемых солей, и сложных эфиров относятся соединения формулы (I), где R5-R9 независимо означают водород, C1-6 алкил, C1-6 алкенил, С 6-10 арил, С 7-12 арилалкил, C1-6 ацил, гидрокси, C1-6 алкокси, C1-6 алкоксикарбонил, амино, C1-6 ациламино, C1-6 алкиламино, С 6-10 арилокси, галоген, циано, нитро, карбокси, C1-6 алкилсульфонил, сульфонамидо или трифторметил. Подклассом указанного класса соединений и их фармацевтически приемлемых солей являются соединения формулы (I), где R5-R9 независимо означают водород, гидрокси, C1-6 алкил, C1-6 алкокси, карбокси, C1-6 алкоксикарбонил или нитро. Подклассом указанного класса соединений и их фармацевтически приемлемых солей являются соединения формулы (I), где R5 означает гидрокси, C1-6 алкил,C1-6 алкокси, карбокси, C1-6 алкоксикарбонил или нитро, наиболее предпочтительно, гидрокси или нитро. В другом классе предпочтительных соединений и фармацевтически приемлемых солей R1-R4 независимо означают водород, C1-6 алкил, C1-6 алкенил, С 6-10 арил, С 7-12 арилалкил, C1-6 карбоксиалкил, C1-6 гидроксиалкил или C1-6 галогеналкил, или R2 и R3 образуют фенильный цикл. Подклассом указанного-1 005574 класса соединений и их фармацевтически приемлемых солей являются соединения формулы (I), где R1R3 независимо означают водород или C1-6 алкил. Каждый арильный радикал в каждом из предпочтительных классов соединений, сам по себе или как часть другой группы, может быть замещн 1-3, желательно 1 или 2, радикалами, выбранными из группы,включающей: фтор, хлор, бром, иод, гидрокси, нитро, карбокси, трифторметил, амино, С 1-4 алкил, С 1-4 алкокси, C1-6 ацил, C1-6 карбоксиалкил, фенил, нафтил, галогенфенил, галогеннафтил, бензил, фенетил,галогенбензил, галогенфенетил, нафтилметил, нафтилэтил, С 4-7 циклоалкил, С 1-4 алкилС 4-7 циклоалкил,моно-С 1-4 алкиламино, ди-С 1-4 алкиламино, C1-6 алканоиламино, фенилкарбониламино, нафтилкарбониламино, циано, тиол или C1-6 алкилтио. Соединения формулы (I) могут содержать один или более асимметрических центров и поэтому они могут существовать как энантиомеры или диастереомеры. Изобретение включает обе смеси и отдельные индивидуальные изомеры. В особенности предпочтительные индивидуальные соединения по изобретению включают:(R)-6-4-[N'-(4-гидрокси-3-метокси-2-нитробензилиден)гидразино]фенил-5-метил-4,5-дигидро-2Hпиридазин-3-он; 6-4-[N'-(4-гидрокси-3-метокси-2-нитробензилиден)гидразино]фенил-5-метил-4,5-дигидро-2Hпиридазин-3-он; 6-(4-N'-[1-(2,5-дигидроксифенил)этилиден]гидразинофенил)-5-метил-4,5-дигидро-2H-пиридазин 3-он; 6-(4-N-[1-(2,4-дигидрокси-3-метилфенил)этилиден]гидразинофенил)-5-метил-4,5-дигидро-2Hпиридазин-3-он; 6-(4-N'-[бис-(2,4-дигидроксифенил)метилен]гидразинофенил)-5-метил-4,5-дигидро-2 Нпиридазин-3-он; 6-(4-N'-[1-(2,4-дигидроксифенил)этилиден]гидразинофенил)-5-метил-4,5-дигидро-2 Н-пиридазин 3-он; Этиловый эфир 2,6-дигидрокси-3-[4-(4-метил-6-оксо-1,4,5,6-тетрагидропиридазин-3-ил)фенил] гидразонометилбензойной кислоты и 6-4-[N'-(3-Этил-2,4-дигидроксибензилиден)гидразино]фенил-5 метил-4,5-дигидро-2 Н-пиридазин-3-он. Соединения по изобретению могут быть получены по хорошо известной реакции конденсации между карбонильным соединением и гидразином, как показано на схеме 1. Схема 1. Гидразоны и R1-R9 принимают вышеуказанные значения. Подходящим способом получения гидразинов (III) является диазотизация анилина и восстановление в одном реакторе. Схема 2 приводит указанное взаимодействие. Схема 2. Гидразины, где Аr принимает вышеуказанные значения. где Аr принимает вышеуказанные значения. Соединения формул (II) и (IV) выпускаются промышленно, либо могут быть получены применением известных в литературе способов. Общий способ 1: в случае, когда R4 означает водород, взаимодействие по схеме 1 обычно осуществляют путем нагревания с обратным холодильником смеси соединений (II) и (III) в подходящем растворителе, таком как этанол, 2-пропанол, ацетонитрил или уксусная кислота, в течение 1-24 ч. Продукт (I) отделяют фильтрованием. Общий способ 2: в случае, когда R4 не является водородом, взаимодействие по схеме 1 обычно осуществляют, нагревая чистую смесь соединений (II) и (III) при 140-170 С в инертной атмосфере. Затем смесь растирают с этилацетатом и продукт (I) фильтруют.-2 005574 Если используют соли и сложные эфиры соединений, то их можно получить известными способами. Физиологически приемлемые соли полезны в качестве активных лекарственных средств, однако,предпочтительными являются соли щелочных или щелочно-земельных металлов. Физиологически приемлемые эфиры также применяются в качестве активных лекарственных средств. Примерами служат сложные эфиры с алифатическими или ароматическими спиртами. Термин "алкил", как использован здесь, сам по себе или как часть другой группы, включает как линейные, так и разветвлнные радикалы, и циклические радикалы, содержащие до 18 атомов углерода,предпочтительно 1-8 атомов углерода, наиболее предпочтительно, 1-4 атома углерода. Термин "низший алкил", как использован здесь, сам по себе или как часть другой группы, включает как линейные, так и разветвлнные радикалы и циклические радикалы, из 1-7, предпочтительно 1-4, наиболее предпочтительно, 1 или 2 атомов углерода. Характерными примерами алкильных и низших алкильных остатков соответственно являются: метил, этил, пропил, изопропил, бутил, трет-бутил, пентил, циклопентил, гексил, циклогексил, октил, децил и додецил, включая их различные изомеры с разветвленной цепью. Термин "ацил", как использован здесь, сам по себе или как часть другой группы, означает алкилкарбонильную или алкенилкарбонильную группу, алкильные и алкенильные группы принимают вышеуказанные значения. Термин "арил", как использован здесь, сам по себе или как часть другой группы, означает моноциклическую или бициклическую группу, содержащую 6-10 атомов углерода в цикле. Характерными примерами арильных групп являются фенил, нафтил и тому подобные. "Ароил" означает соответствующую арилкарбонильную группу. Термин "алкокси", как использован здесь, сам по себе или как часть другой группы, включает вышеуказанную алкильную группу, связанную с атомом кислорода. "Арилокси" означает соответствующую арильную группу, связанную с атомом кислорода. Термин "замещнный", как использован здесь, по отношению к различным радикалам, означает галогеновые заместители, такие как фтор, хлор, бром, иод или такие заместители, как трифторметильная группа, амино, алкил, алкокси, арил, алкиларил, галогенарил, циклоалкил, алкилциклоалкил, гидрокси,алкиламино, алканоиламино, арилкарбониламино, нитро, циано, тиол или алкилтио."Замещнные" группы могут содержать 1-3, предпочтительно 1 или 2 вышеуказанных заместителя. Соединения по изобретению могут быть введены пациенту в терапевтически эффективных количествах, которые обычно находятся в пределах приблизительно от 0,1 до 500 мг в день в зависимости от возраста, массы, состояния пациента, способа введения и используемого фосфоламбанового ингибитора. Соединения по изобретению могут быть формулированы в лекарственные формы на основе известных для данной области принципов. Указанные соединения можно вводить пациенту, как таковые или в комбинации с подходящими фармацевтическими наполнителями, в форме таблеток, драже, капсул, суппозиториев, эмульсий, суспензий или растворов. Выбор подходящих ингредиентов для композиции относится к обычной практической деятельности специалиста в данной области. Очевидно, что подходящие носители, растворители, гельобразующие ингредиенты, образующие суспензии ингредиенты, антиоксиданты,красители, подсластители, смачивающие соединения и другие ингредиенты, обычно используемые в данной области технологий, также могут быть использованы. Композиции, содержащие активное соединение, могут быть введены энтерально или парентерально, пероральный способ является предпочтительным. Содержание активного ингредиента в композиции составляет приблизительно от 0,5 до 100%,предпочтительно, приблизительно от 0,5 до 20% от общей массы композиции. Полезность соединений по изобретению демонстрируется следующими экспериментальными примерами. Эксперимент 1. Влияние на повышение чувствительности к кальцию в отдельном волокне сердечной мышцы. Методика Сердце морской свинки иссекают и заливают охлажднным льдом раствором сапонина для выделения волокон (125 мг/л), состоящим из (мМ): K+-ацетата 74,7, EGTA-Na2 10, MgSO4 5,4, АТФ-Na2 4,MOPS 20, рН 7,0 (посредством 1 М КОН). Папиллярную мышцу левого желудочка иссекают и разрушают ультразвуком при 10 Вт в течение 60 с. Расстояние между ультразвуковой головкой и папиллярной мышцей равно 10 мм. Волокна ( 200 мкм в диаметре) отслаивают от поверхности разрушенных ультразвуком папиллярных мышц в том же растворе. Волокно закрепляют между платиновыми проволоками, одна из которых присоединена к изометрическому силовому датчику (тип АЕ-801/ SensoNor, Horten, Norway), а другая к микроманипулятору. Волокну позволяют уравновеситься в растворе, состоящем из (мМ): EGTA-Na2 10, MgSO4 5,4, АТФ-Na2 4,MOPS 20. РН раствора доводят до 7,0 и ионную силу до 0,16 М путм добавления KОН и K+-ацетата. Креатинкиназу и креатинфосфат в качестве АТФ-генерирующей системы не добавляют, поскольку возникшее натяжение хорошо поддерживается в течение требуемого для эксперимента времени. Расчеты ионной силы и свободного кальция (рСа 7,0-6,2) выполняют, используя подходящую программу. Волокна растягивают в релаксирующем растворе до минимально различимого натяжения покоя. Когда вызванное кальцием (рСа 6,0 или 6,2) натяжение достигнет стационарного состояния, испытуемое соединение(конечные концентрации 0,1, 0,3, 1, 3 и 10 мкМ) кумулятивно добавляют в раствор с интервалами в 6 мин. Все эксперименты выполняют со свежими волокнами при нормальной комнатной температуре. Результаты Влияние соединений на повышение чувствительности к кальцию показано в табл. 1. Максимальное влияние на повышение чувствительности к кальцию в очищенном волокне (изменение в усилии, % изменения от контроля). Стандартным соединением служит соединение по пр. 16 ЕР 383449. Таблица 1 Эксперимент 2. Влияние на производные давления в левом желудочке изолированного сердца. Морскую свинку забивают и сердце быстро иссекают и промывают насыщенным кислородом перфузионным буфером. Канюлю вводят в аорту и закрепляют лигатурой. Дегенерирующую перфузию начинают сразу после того, как сердце размещают в термостатически регулируемой влажной камере аппарата Лангендорффа (Hugo Sachs Elektronik, KG). В качестве перфузионного буфера используют модифицированный Туrode раствор (37 С), уравновешенный в термостатически регулируемом баллоновом оксигенаторе (95% O2 и 5% CO2). Состав Tyrode раствора (в мМ): NaCl 135; MgCl2 х 6H2O 1; KСl 5; CaCl2 x 2H2O 2; NaHCO3 15; Na2HPO4 x 2 Н 2 О 1; глюкоза 10; рН 7,3-7,4. Перфузионный буфер подают насосом в верхнюю часть оксигенатора и нагнетают автоматически с применением контроллера. После чего буфер доставляется в баллоны камеры оксигенатора с помощью вращающегося диска. Буфер диспергируют,получая тонкую жидкостную плнку на большой внутренней поверхности в атмосфере О 2/СО 2, что приводит к насыщению перфузата кислородом (парциальное давление 660 мм Нg при 37 С). Эксперименты проводят в условиях постоянного давления (50 мм Нg). После короткой предварительной стабилизации (10 мин) латексный баллон (номер 4) осторожно вводят в левый желудочек через левую лгочную вену и левое предсердие. Латексный баллон соединяют с канюлей из нержавеющей стали, связанной с датчиком давления. Изоволюметрическое давление в левом желудочке регистрируют датчиком давления. В начале эксперимента объм баллона регулируют до получения диастоллического давления порядка 5 мм Нg. Перед началом эксперимента сердцу дают дополнительно стабилизироваться в течение 30-50 мин. Определяют систолическое и конечное диастолическое давления для расчта положительной и отрицательной производных давления в левом желудочке. Результаты ЕС 50 значения (мкМ) для различных соединений по изобретению при максимальной положительной производной систолического давления в левом желудочке приведены в табл. 2.-4 005574 Следующие примеры приведены в целях дальнейшей иллюстрации изобретения, но не в порядке ограничения. Температуры плавления определяют на приборе для определения температуры плавления с пластиной Рейхерта и не корректируют. ЯМР-спектр регистрируют на Bruker ARX 400 спектрометре,используя ТМС в качестве внутреннего стандарта (0 м.д.). Примеры Пример 1 (промежуточное соединение). (R)-6-(4-Гидразинофенил)-5-метил-4,5-дигидро-2Hпиридазин-3-он. Использована приведенная ниже методика, слегка изменнная по сравнению с описанной в J. Med.Chem. (1990), 33(10), 2870-2875. Раствор нитрита натрия (1,7 г) в воде (12,5 мл) медленно добавляют при 0-5 С к раствору (R)-6-(4 аминофенил)-5-метил-4,5-дигидро-2H-пиридазин-3-она (5 г) в 1 М соляной кислоте (75 мл). Полученный раствор перемешивают на ледяной бане в течение пяти минут и затем медленно добавляют к раствору дигидрата хлорида олова (II) (17 г) в 1 М соляной кислоте (150 мл), поддерживая реакционную температуру ниже 5 С. Раствор перемешивают на ледяной бане в течение сорока минут и затем быстро добавляют раствор 50% NaOH (75 мл). Образовавшуюся смесь перемешивают на ледяной бане пока температура не достигнет нуля градусов Цельсия. Кристаллы фильтруют и промывают разбавленным аммиаком. Выход: 5,0 г, 93%. ВЭЖХ: энантиомерно чистый. 1H-ЯМР (400 МГц, ДМСО-d6): =1,04 (д, 3H, СН 3), 2,17 (д, 1H, J=16 Гц), 2,60 (м, 1 Н), 3,29 (м, 1 Н) ,4,04 (с, 2 Н, NH2), 6,77 (д, 2 Н, J=8 Гц), 7,09 (уш., 1 Н, NH), 7,54 (д, 2 Н, J=8 Гц), 10,66 (c, 1 Н, NHCO). Пример 2. (R)-6-4-[N'-(4-Гидрокси-3-метокси-2-нитробензилиден)гидразино]фенил-5-метил-4,5 дигидро-2H-пиридазин-3-он. Раствор 4-гидрокси-3-метокси-2-нитробензальдегида (1,6 г) в этаноле (15 мл) добавляют к суспензии (R)-6-(4-гидразинофенил)-5-метил-4,5-дигидро-2H-пиридазин-3-она (1,75 г) в этаноле (20 мл) и образовавшуюся смесь нагревают до температуры кипения с обратным холодильником в течение двух часов. Полученные кристаллы фильтруют при комнатной температуре и промывают этанолом. Выход 2,37 г. ВЭЖХ: чистота 99,4%, оптическая чистота 99,8%. 1H-ЯМР (ДМСО-d6): =1,06 (д, 3H, СН 3), 2,18-2,22 (м, 1 Н), 2,64 (м, 1 Н), 3,34 (м, 1 Н), 3,84 (с, 3H,СН 3 О), 6,98 (д, 2 Н), 7,08 (д, 1 Н), 7,37 (д, 1 Н), 7,66 (д, 2 Н), 7,67 (с, 1 Н), 10,68 (С, 1 Н, NH), 10,77 (с, 1 Н,NHCO). Дополнительные примеры Следующие соединения синтезируют по общей методике 1 (иллюстрируемой предшествующим примером) или по общей методике 2. Общая методика 1. Нагревают до температуры кипения с обратным холодильником смесь производного гидразина (II) и производного бензальдегида (III) в подходящем растворителе (этанол, 2-пропанол, ацетонитрил или уксусная кислота) в течение 1-24 ч. Фильтруют продукт. Общая методика 2. Нагревают чистую смесь производного гидразина (II) и кетона (III) при 140-170 С в инертной атмосфере. Порошкуют с этилацетатом и фильтруют продукт. Следующие соединения синтезируют по общей методике 1, если не оговорено особо. Пример 3. Этиловый эфир 2,6-дигидрокси-3-[4-(4-метил-6-оксо-1,4,5,6-тетрагидропиридазин-3 ил)фенил] гидразонометилбензойной кислоты. Выход 73%, температура плавления: 203-208 С. 1H-ЯМР (ДМСО-d6): =1,07 (д, 3H), 2,18-2,23 (м, 1 Н), 2,38 (с, 3H, ОСОСН 3), 2,62-2,67 (м, 1 Н), 3,333,38 (м, 1 Н), 3,85 (с, 3H), 7,03 (д, 2 Н), 7,46 (д, 1 Н), 7,60 (д, 1 Н), 7,72 (д, 2 Н), 7,75 (с, 1 Н), 10,79 (с, 1 Н),10,98 (с, 1 Н). Пример 13. 6-(4-N'-[1-(3,5-Дигидроксифенил)этилиден]гидразинофенил)-5-метил-4,5-дигидро 2H-пиридазин-3-он. Указанное в заглавии соединение получают по общей методике 2. Выход: 27%, температура плавления 162-166 С. 1H-ЯМР (400 МГц, ДМСО-d6): =1,07 (д, 3H), 2,17 (с, 3H) 2,18-2,22 (м, 1 Н), 2,62-2,68 (м, 1 Н), 3,353,41 (м, 1 Н), 6,17 (с, 1 Н), 6,67 (с, 2 Н), 7,23 (д, 2 Н), 7,67 (д, 2 Н), 9,21 (с, 1 Н), 9,44 (С, 1 Н), 10,75 (с, 1 Н). Пример 14. 6-(4-N'-[1-(2,4-Дигидроксифенил)-3-(3,4-диметоксифенил)пропилиден]гидразино фенил)-5-метил-4,5-дигидро-2 Н-пиридазин-3-он. Указанное в заглавии соединение получают по общей методике 2. Выход: 71%, температура плавления 135-140 С. 1(д, 1 Н), 7,03(д, 2 Н), 7,36 (д, 1 Н), 7,71 (д, 2 Н), 9,1 (с, 1 Н), 9,5 (c, 1 Н), 10,78 (с, 1 Н), 12,91 (с, 1 Н). Пример 15. 4-(4-N'-[(2,4-Дигидроксифенил)фенилметилен]гидразинофенил)-2H-фталазин-1-он. Указанное в заглавии соединение получают по общей методике 2. Выход: 95%, температура плавления 160-170 С. 1H-ЯМР (400 МГц, ДМСО-d6): =6,7 (м, 2 Н), 7,3-7,9 (м, 13 Н), 8,3 (м, 1 Н), 10,1 (с, 1 Н), 10,7 (с, 1 Н),12,1 (c, 1 Н), 12,7 (с, 1 Н). Пример 16. 4-(4-N'-[(2,4-Дигидроксифенил)-(4-гидроксифенил)метилен]гидразинофенил)-2Hфталазин-1-он. Указанное в заглавии соединение получают по общей методике 2. Выход: 95%, температура плавления 150-160 С. 1H-ЯМР (400 МГц, ДМСО-d6): =6,3 (м, 2 Н), 6,8 (м, 2 Н), 7,4-7,9 (м, 10 Н), 8,3 (м, 1 Н), 10,1 (с, 1 Н),10,2 (с, 1 Н), 10,4 (с, 1 Н), 12,1 (с, 1 Н), 12,7 (с,1 Н). Пример 17. 4-(4-N'-[Бис-(2,4-дигидроксифенил)метилен]гидразинофенил)-2 Н-фталазин-1-он. Указанное в заглавии соединение получают по общей методике 2. 1H-ЯМР (400 МГц, ДМСО-d6): =1,08 (д, 3H, СН 3), 2,22 (д, 1H, CH), 2,66 (дд, 1H, CH), 3,35 (м, 1H,CH), 7,16 (д, 2 Н, СН), 7,59 (т, 1H, СН), 7,69 (д, 2 Н, СН), 7,74 (д, 1H, СН), 7,92 (с, 1H, СН), 8,01 (д, 1H,СН), 8,10 (с, 1H, СН), 10,78 (с, 1H, NH), 10,86 (с, 1H, NH). Пример 21. 6-4-[N'-(2,4-Дигидроксибензилиден)гидразино]фенил-5-метил-2H-пиридазин-3-он. Продукт перекристаллизовывают из диметилформамида. Выход: 55%, т.пл. 303-310 С. 1H-ЯМР (400 МГц, ДМСО-d6): =2,15 (с, 3H, СН 3), 3,85 (с, 3H, ОСН 3), 6,79 (с, 1H, СН), 7,01 (д, 2 Н,СН), 7,09 (д, 1H, СН), 7,33 (д, 2 Н, СН), 7,38 (д, 1H, СН), 7,68 (с, 1H, СН), 10,62 (с, 1H, NH), 10,65 (с, 1H,ОН), 12,91 (с, 1H, NH). Пример 23. 6-4-N'-[1-(2,4-Дигидроксифенил)этилиден]гидразинофенил-5-метил-2 Н-пиридазин 3-он. Указанное в заглавии соединение получают по общей методике 2. Продукт нагревают до температуры кипения с обратным холодильником в пропионитриле, с уксусной кислотой в качестве катализатора. Выход: 32%, т.пл. 299-303 С. 1(0,55 г) в ацетонитриле (20,0 мл) нагревают до температуры кипения с обратным холодильником в течение 5 ч. Образовавшиеся при комнатной температуре кристаллы отфильтровывают. При охлаждении фильтрата в течение ночи кристаллизуется продукт. Продукт фильтруют, промывают тплым этанолом и сушат при пониженном давлении. Выход: 5,6%, т. пл. 263-268 С. 1-7 005574 Пример 27. 6-4-N'-[1-(2,4-Дигидроксифенил)пропилиден]гидразинофенил-2-метил-2 Н-пиридазин-3-он. Указанное в заглавии соединение получают по общей методике 2. Выход: 29%, т.пл. 225-233 С. 1H-ЯMP (400 МГц, ДМСО-d6): =1,08 (т, 3H, СН 3), 2,61 (кв, 2 Н, CH2), 3,71 (с, 3H, СН 3), 6,43 (д, 1 Н,СН), 6,96 (д, 2 Н, СН), 6,99 (д, 1 Н, СН), 7,01 (д, 1 Н, СН), 7,79 (д, 2 Н, СН), 7,96 (д, 1 Н, СН), 8,05 (с, 1 Н,СН), 9,67 (с, 1 Н), 10,49 (с, 1 Н), 11,30 (с, 1 Н). Пример 29. 4-(2,4-Дигидроксифенил)-4-[4-(1-метил-6-оксо-1,6-дигидропиридазин-3-ил)фенил] гидразономасляная кислота. Указанное в заглавии соединение получают по общей методике 2. Выход: 15,9%, т.пл. 138-141 С. 1H-ЯМР (400 МГц, ДМСО-d6): =2,51 (т, 2 Н, СН 2), 3,06 (т, 2 Н, СН 2), 3,72 (с, 3H, СН 3), 6,30 (с, 1 Н,СН), 6,34 (д, 1 Н, СН), 7,01 (д, 1 Н, СН), 7,10 (д, 2 Н, СН), 7,32 (д, 1 Н, СН), 7,83 (д, 2 Н, СН), 7,01 (д, 1 Н,СН), 9,72 (с, 1 Н), 9,78 (с, 1 Н), 12,31 (с, 1 Н), 12,74 (с, 1 Н). Пример 30 (промежуточное соединение). 6-(4-Гидразинофенил)-5-метил-2 Н-пиридазин-3-он. Указанное в заглавии соединение получают из 6-(4-аминофенил)-5-метил-2 Н-пиридазин-3-она подобно 6-(4-гидразинофенил)-5-метил-4,5-дигидро-2 Н-пиридазин-3-ону. 1H-ЯМР (400 МГц, ДМСО-d6): =2,13 (с, 3H, СН 3), 4,11 (с, 2 Н, NH2), 6,75 (с, 1 Н, СН), 6,81 (д, 2 Н,СН), 6,95 (с, 1 Н, NH), 7,21 (д, 2 Н, СН), 12,82 (с, 1 Н, NH). Пример 31 (промежуточное соединение). 6-(4-Гидразинофенил)-2,5-диметил-2 Н-пиридазин-3-он. Указанное в заглавии соединение получают из 6-(4-аминофенил)-2,5-диметил-2 Н-пиридазин-3-она подобно 6-(4-гидразинофенил)-5-метил-4,5-дигидро-2 Н-пиридазин-3-ону. 1H-ЯMP (400 МГц, ДМСО-d6): =2,14 (д, 3H, СН 3), 3,63 (с, 3H, СН 3), 4,12 (с, 2 Н, NH2), 6,81 (д, 2 Н,СН), 6,82 (д, 1 Н, СН), 6,98 (с, 1 Н, NH), 7,22 (д, 2 Н, СН). Пример 32 (промежуточное соединение). 6-(4-Гидразинофенил)-2-метил-2 Н-пиридазин-3-он. Указанное в заглавии соединение получают из 6-(4-аминофенил)-2-метил-2 Н-пиридазин-3-она подобно 6-(4-гидразинофенил)-5-метил-4,5-дигидро-2 Н-пиридазин-3-ону. 1H-ЯМР (400 МГц, ДМСО-d6): =3,69 (с, 3H, СН 3), 4,18 (с, 2 Н, NH2), 6,83 (д, 2 Н, СН), 6,94 (д, 1 Н,СН), 7,11 (с, 1 Н, NH), 7,65 (д, 2 Н, СН), 7,93 (д, 1 Н, СН). Пример 33. 6-(4-N'-[1-(2,4-Дигидроксифенил)этилиден]гидразинофенил)-5-метил-4,5-дигидро 2 Н-пиридазин-3-он. Указанное в заглавии соединение получают по общей методике 2. Выход: 74%, температура плавления: 259-261 С. 1H-ЯМР (ДМСО-d6): =1,07 (д, 3H), 2,21 (д, 1 Н), 2,35 (с, 3H), 2,63-2,68 (м, 1 Н), 3,30-3,36 (м, 1 Н),6,28 (д, 1 Н), 6,34 (кв, 1 Н), 7,03 (д, 2 Н), 7,37 (д, 1 Н), 7,71 (д, 2 Н), 9,57 (с, 1 Н), 9,70 (с, 1 Н), 10,78 (с, 1 Н),12,91 (с, 1 Н). Пример 34. 6-(4-N'-[Бис-(2,4-дигидроксифенил)метилен]гидразинофенил)-5-метил-4,5-дигидро 2 Н-пиридазин-3-он. Указанное в заглавии соединение получают по общей методике 2. Выход: 13%, температура плавления: 150 - 175 С. 1(уширенный, 1H), 9,72 (уширенный, 3H), 10,76 (с, 1H), 12,71 (с, 1H). Пример 35. 6-(4-N'-[1-(2,5-Дигидроксифенил)этилиден]гидразинофенил)-5-метил-4,5-дигидро 2 Н-пиридазин-3-он. Указанное в заглавии соединение получают по общей методике 2. Выход: 73%, температура плавления: 279-284 С. 1H-ЯМР (ДМСО-d6): =0,87 (т, 3H), 1,38-1,54 (м, 2 Н), 2,36 (д, 1H), 2,56-2,62 (кв, 1H), 3,12-3,38 (м,1H), 6,32 (м, 2 Н), 6,93 (д, 2 Н), 7,33 (д, 1H), 7,67 (д, 2 Н), 8,08 (с, 1H), 9,68 (с, 1H), 10,34 (с, 1H), 10,55 (с,1H), 10,71 (с, 1H). Пример 37. N-[4-(1-[4-(4-Метил-6-оксо-1,4,5,6-тетрагидропиридазин-3-ил)-фенил]гидразоноэтил) фенил]ацетамид. Указанное в заглавии соединение получают по общей методике 2. Выход: 41%, температура плавления: 145-155 С. 1H-ЯМР (ДМСО-d6): =0,91 (т, 3H), 1,07 (д, 3H), 1,29-1,38 (м, 2 Н), 1,45-1,51 (м, 2 Н), 2,21 (д, 1 Н),2,57-2,68 (м, 2 Н, 1 Н), 3,29-3,36 (м, 1 Н), 6,42 (д, 1 Н), 6,91 (д, 2 Н), 6,99 (д, 1 Н), 7,71 (д, 2 Н), 8,04 (с, 1 Н),9,62 (с, 1 Н), 10,46 (с, 1 Н), 10,76 (с, 1 Н), 11,28 (с, 1 Н). Пример 45 (промежуточное соединение). 6-(3-Гидразинофенил)-5-метил-4,5-дигидро-2 Нпиридазин-3-он. Указанное в заглавии соединение получают по методике примера 1, исходя из 1,5 г 6-(3-аминофенил)-5-метил-4,5-дигидро-2 Н-пиридазин-3-она (J. Med. Chem. 1974 17(3. Продукт выделяют (после добавления раствора гидроксида) путм экстракции тетрагидрофураном. Кристаллизация из ацетонитрила дат 1,0 г указанного в заглавии соединения. 1(с, 1 Н), 6,81 (м, 1H), 6,98 (м, 1 Н), 7,14 (т, 1H), 7,23 (т, 1 Н), 10,86 (с, 1 Н). Пример 46. 6-(3-N-[Бис(2,4-дигидроксифенил)метилен]гидразинофенил)-5-метил-4,5-дигидро 2 Н-пиридазин-3-он. Смесь 6-(3-гидразинофенил)-5-метил-4,5-дигидро-2 Н-пиридазин-3-она (0,38 г), 2,2',4,4'-тетрагидроксибензофенона (0,51 г), уксусной кислоты (0,4 мл) и ацетонитрила (7,0 мл) нагревают до температуры кипения с обратным холодильником в течение 20 ч. Растворители удаляют в вакууме и продукт выделя-9 005574 ют, используя хроматографию на колонке (силикагель; толуол, этилацетат, уксусная кислота 8:3:3). Кристаллизация из смеси этилацетата и дихлорметана дат 290 мг продукта, т.пл. 195-205 С. 1H-ЯМР (ДМСО-d6, 400 МГц): 1,08 (д, 3H), 2,23 (д, 1H), 2,68 (дд, 1H), 3,31 (м, 1H), 6,17 (дд, 1H),6,30 (д, 1H), 6,36 (дд, 1H), 6,46 (д, 1H), 6,57 (д, 1H), 6,83 (д, 1H), 7,01 (м, 1H), 7,19 (м, 1H), 7,28 (т, 1H),7,45 (т, 1H), 10,92 (с, 1H), 8-14 (уширенные синглеты, 5 Н). Пример 47. 6-4-[N-(2,4-Дигидрокси-5-нитробензилиден)гидразино]фенил-5-метил-4,5-дигидро 2H-пиридазин-3-он. 6-(4-Гидразинофенил)-5-метил-4,5-дигидро-2 Н-пиридазин-3-он (1,10 г), 2,4-дигидрокси-5-нитробензальдегид (0,92 г) и уксусную кислоту (20 мл) объединяют и образовавшуюся смесь нагревают до температуры кипения с обратным холодильником в течение 20 мин. Смесь охлаждают до комнатной температуры и продукт фильтруют, получая 1,95 г сольватированных кристаллов, содержащих 1 моль уксусной кислоты, т.пл. около 290 С, с разложением. 1(с, 1H), 13,95 (с, 1H). Пример 48. 6-4-N-[4-(Диметиламино)бензилиден]гидразинофенил-5-метил-4,5-дигидро-2Hпиридазин-3-он. 6-(4-Гидразинофенил)-5-метил-4,5-дигидро-2 Н-пиридазин-3-он (1,1 г), 4-(диметиламино)бензальдегид (0,83 г), уксусную кислоту (0,60 мл) и ацетонитрил (15 мл) объединяют и образовавшуюся смесь нагревают до кипения, охлаждают до комнатной температуры и продукт фильтруют и промывают ацетонитрилом, выход 1,50 г, т.пл. 225-232 С. 1(д, 2 Н), 7,04 (д, 2 Н), 7,49 (д, 2 Н), 7,65 (д, 2 Н), 7,81 (с, 1 Н), 10,24 (с, 1 Н), 10,73 (с, 1 Н). Пример 49. 6-(4-N-[1-(2,4-Дигидрокси-3-метилфенил)этилиден]гидразинофенил)-5-метил-4,5-дигидро-2H-пиридазин-3-он. Указанное в заглавии соединение получают по общей методике 2. Выход: 41%, т. пл. 268-271 С. 1 где каждый из R1-R4 независимо означают водород, C1-6 алкил, С 2-6 алкенил, С 6-10 арил, C7-12 арилалкил, C1-6 карбоксиалкил, C1-6 гидроксиалкил или C1-6 галогеналкил или R2 и R3 образуют цикл из 5-7 атомов углерода и R4 означает водород, C1-6 алкил, С 2-6 алкенил, замещенный С 6-10 арил, С 7-12 арилалкил, С 1-6 карбоксиалкил,С 1-6 гидроксиалкил или C1-6 галогеналкил, каждый из R5-R9 означает независимо водород, C1-6 алкил, С 2-6 алкенил, С 6-10 арил, С 7-12 арилалкил, C1-6 ацил, гидрокси, C1-6 алкокси, C1-6 алкоксикарбонил, амино, C1-6 ациламино, C1-6 алкиламино, С 6-10 арилокси, галоген, циано, нитро, карбокси, C1-6 алкилсульфонил, сульфонамидо или трифторметил,где каждый арильный остаток, определенный выше, сам по себе или как часть другой группы может быть замещн 1-3 радикалами, выбранными из группы, включающей фтор, хлор, бром, иод, гидрокси, нитро, карбокси, трифторметил, амино, С 1-4 алкил, С 1-4 алкокси, C1-6 ацил, C1-6 карбоксиалкил, фенил,нафтил, галогенфенил, галогеннафтил, бензил, фенетил, галогенбензил, галогенфенетил, нафтилметил,нафтилэтил, С 4-7 циклоалкил, C1-4 алкилС 4-7 циклоалкил, моно-С 1-4 алкиламино, ди-С 1-4 алкиламино, C1-6 алканоиламино, фенилкарбониламино, нафтилкарбониламино, циано, тиол или C1-6 алкилтио,и его фармацевтически приемлемые соли и сложные эфиры,при условии, что а) когда R1, R2, R3, R5, R6, R8 и R9 означают водород и R4 означает метил, R7 не являются водородом, метокси, циано или метилом, и b) когда R1, R2, R3, R5, R6, R7 и R8 означают водород иR4 означает метил, R9 не является гидрокси или хлором, и с) когда R1, R2, R3, R5, R6, R7 и R9 означают водород и R4 означает метил, R8 не является трифторметилом. 2. Соединение по п.1, где R5-R9 независимо означают водород, гидрокси, C1-6 алкил, C1-6 алкокси,карбокси, C1-6 алкоксикарбонил или нитро. 3. Соединение по п.2, где R5 означает гидрокси, C1-6 алкил, C1-6 алкокси, карбокси, C1-6 алкоксикарбонил или нитро. 4. Соединение по п.3, где R5 означает гидрокси или нитро. 5. Соединение по любому из пп.1-4, где R2 и R3 образуют фенильный цикл. 6. Соединение по любому из пп.1-5, где R1-R3 независимо означают водород или C1-6 алкил. 7. Соединение формулы (I), где R1, R2, R3, R5, R6, R8 и R9 означают водород, R4 означает метил и R7 означает водород, метокси, циано или метил, или где R1, R2, R3, R5, R6, R7 и R8 означают водород и R4 означает метил и R9 означает гидрокси или хлор, или где R1, R2, R3, R5, R6, R7 и R9 означают водород и R4 означает метил, R8 означает трифторметил, или его фармацевтически приемлемая соль с фармацевтически приемлемым носителем. 8. Фармацевтическая композиция, включающая соединение по п.1 в качестве активного ингредиента вместе с фармацевтически приемлемым носителем. 9. Способ лечения застойной сердечной недостаточности, включающий введение нуждающемуся в лечении пациенту терапевтически эффективного количества соединения по п.1 или 7.
МПК / Метки
МПК: A61K 31/50, A61P 9/04, C07D 237/04
Метки: применяемые, сердечной, недостаточности, застойной, пиридазинилфенилгидразоны
Код ссылки
<a href="https://eas.patents.su/13-5574-piridazinilfenilgidrazony-primenyaemye-pri-zastojjnojj-serdechnojj-nedostatochnosti.html" rel="bookmark" title="База патентов Евразийского Союза">Пиридазинилфенилгидразоны, применяемые при застойной сердечной недостаточности</a>
Предыдущий патент: Лечение т-клеточных нарушений
Следующий патент: Производные 2-аминотиазола, способ их получения, фармкомпозиция и применение указанных веществ в качестве противоопухолевых средств
Случайный патент: Мостовое сооружение