Таблетки для комбинированной терапии
Номер патента: 21313
Опубликовано: 29.05.2015
Авторы: Меннинг Марк М., Козиара Джоанна М., Олияй Реза
Формула / Реферат
1. Таблетка для комбинированной терапии, содержащая первый и второй слои, при этом:
а) первый слой содержит
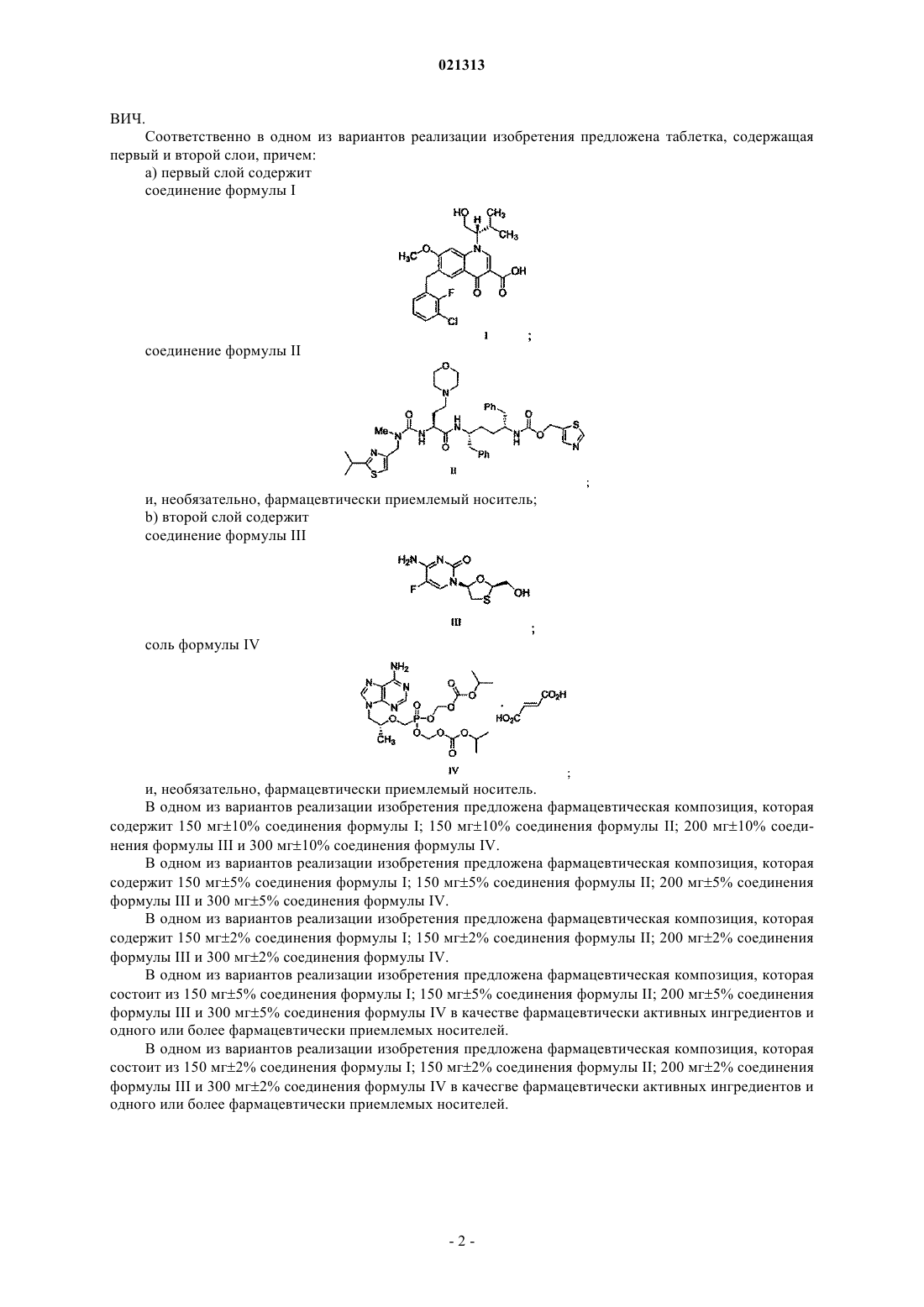
соединение формулы I
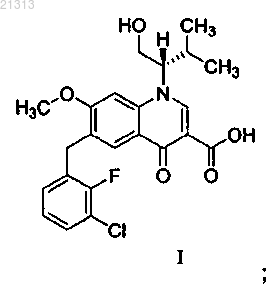
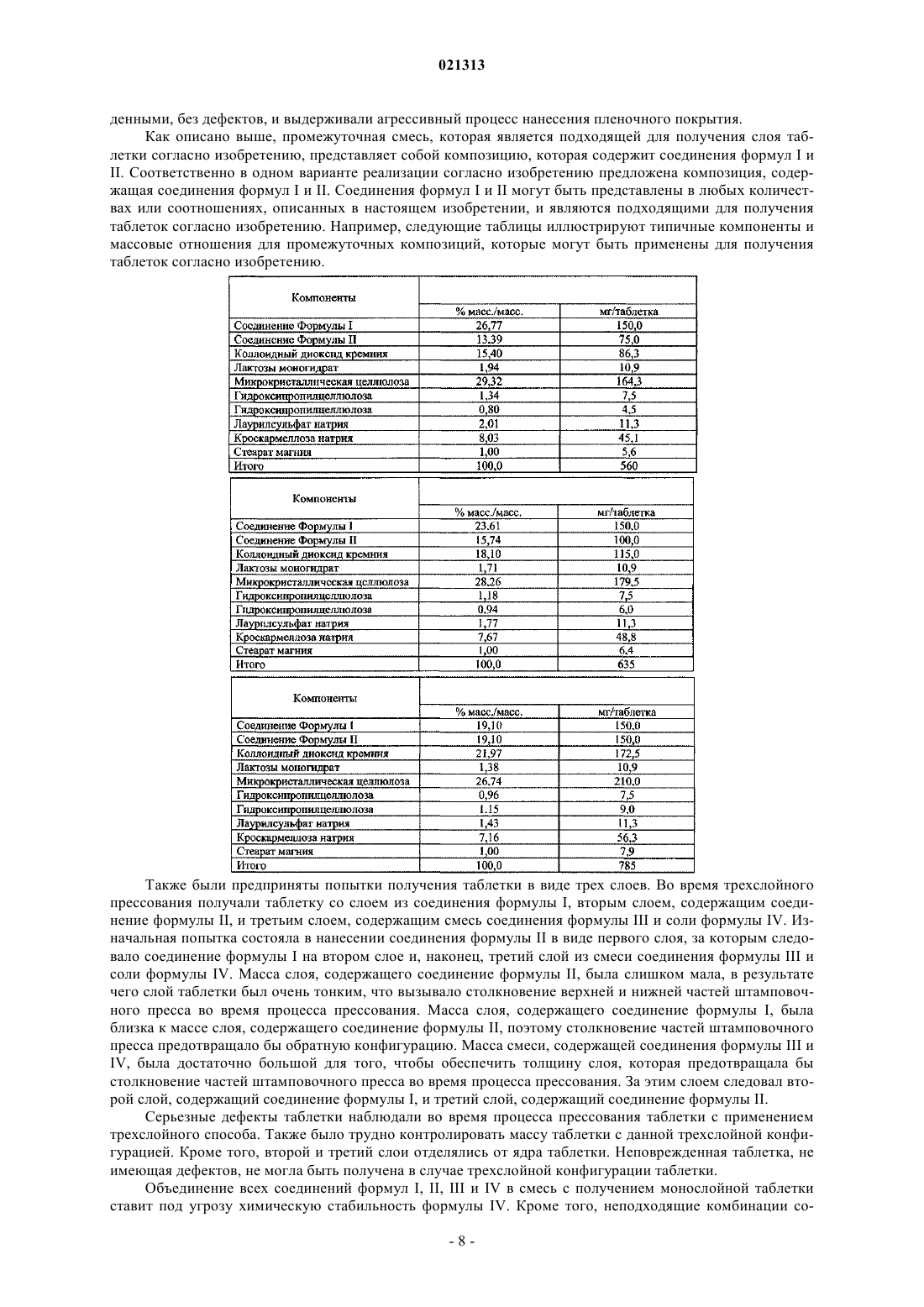
соединение формулы II
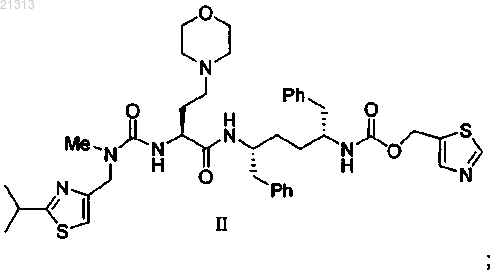
и фармацевтически приемлемый носитель;
b) второй слой содержит
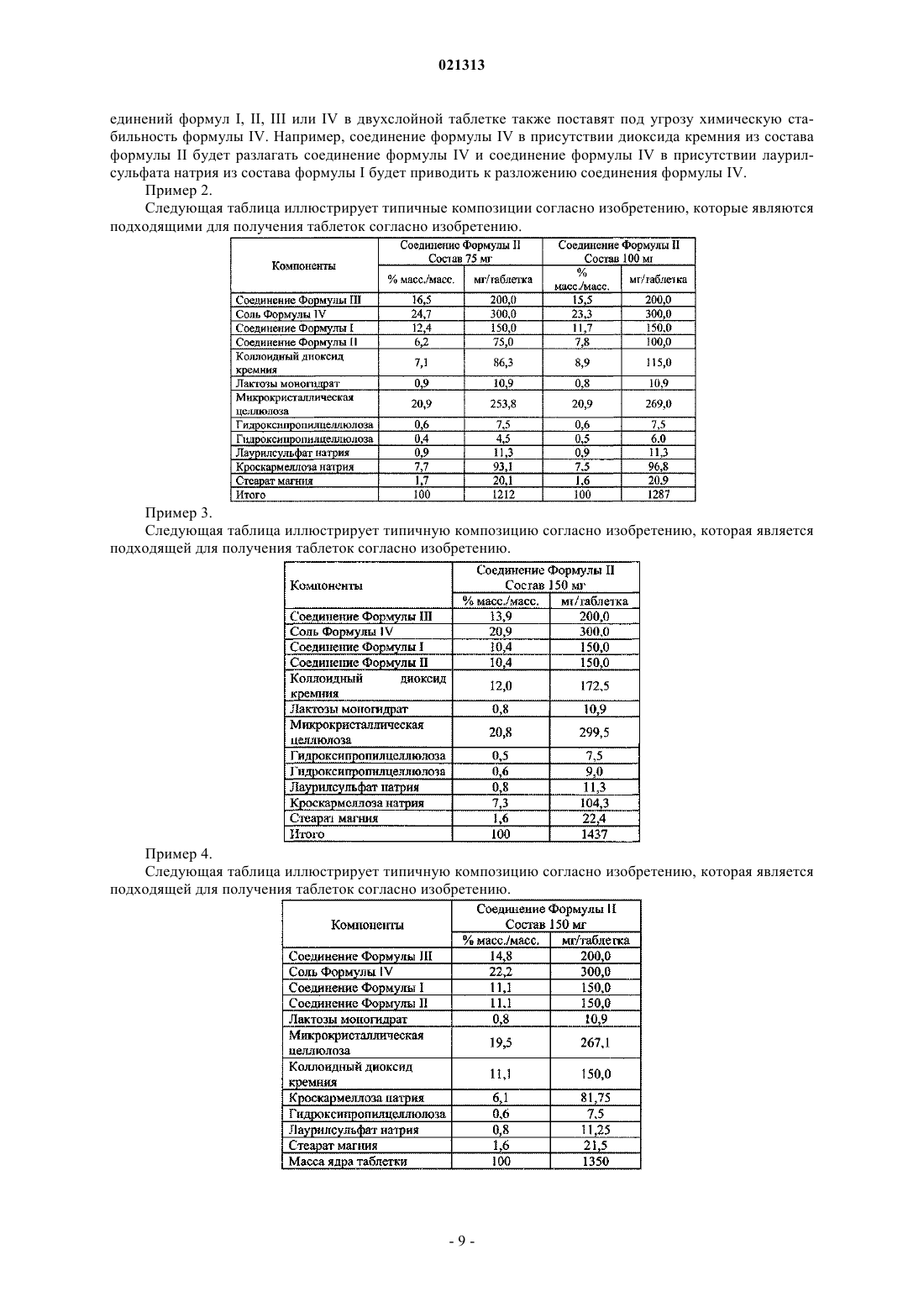
соединение формулы III
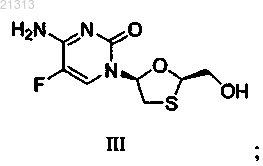
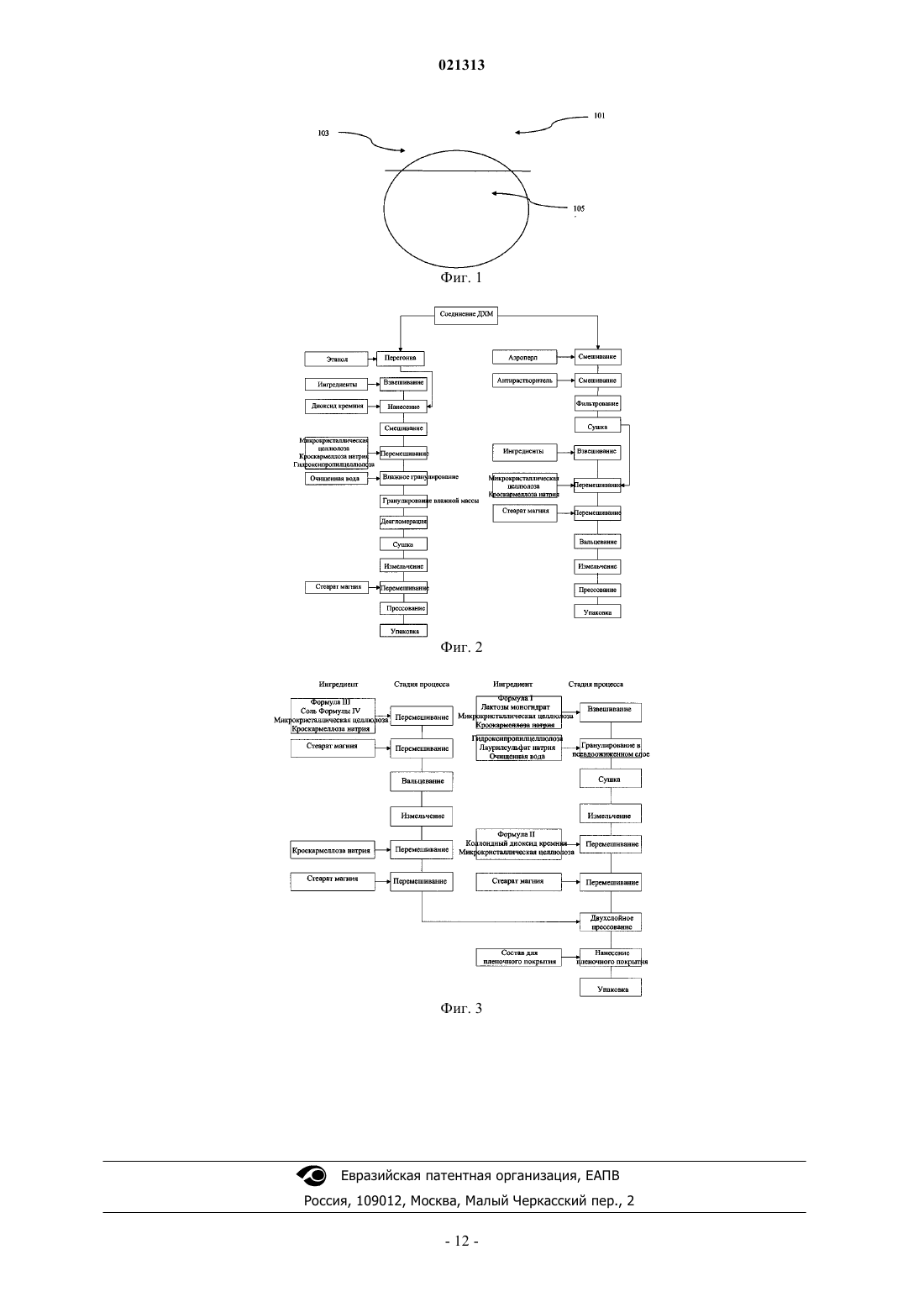
соль формулы IV
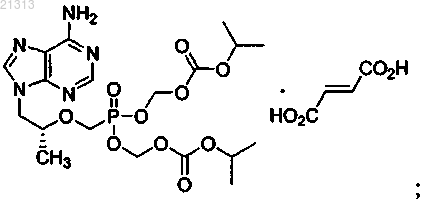
и фармацевтически приемлемый носитель.
2. Таблетка по п.1, отличающаяся тем, что первый слой находится в контакте со вторым слоем.
3. Таблетка по любому из пп.1, 2, отличающаяся тем, что массовое отношение соединения формулы I к соединению формулы II составляет 1,0±0,5.
4. Таблетка по любому из пп.1-3, отличающаяся тем, что первый слой дополнительно содержит частицы диоксида кремния.
5. Таблетка по любому из пп.1-3, отличающаяся тем, что соединение формулы II связано с частицами диоксида кремния.
6. Таблетка по любому из пп.1-5, содержащая 150 мг±10% соединения формулы I, 150 мг±10% соединения формулы II, 200 мг±10% соединения формулы III и 300 мг±10% соединения формулы IV.
7. Таблетка по п.6, содержащая 150 мг±5% соединения формулы I.
8. Таблетка по п.6, содержащая 150 мг±2% соединения формулы I.
9. Таблетка по любому из пп.6-8, содержащая 150 мг±5% соединения формулы II.
10. Таблетка по любому из пп.6-8, содержащая 150 мг±2% соединения формулы II.
11. Таблетка по любому из пп.6-10, содержащая 200 мг±5% соединения формулы III.
12. Таблетка по любому из пп.6-10, содержащая 200 мг±2% соединения формулы III.
13. Таблетка по любому из пп.6-12, содержащая 300 мг±5% соли формулы IV.
14. Таблетка по любому из пп.6-12, содержащая 300 мг±2% соли формулы IV.
15. Таблетка по любому из пп.1-14, дополнительно содержащая фармацевтически приемлемый носитель.
16. Таблетка по любому из пп.1-15, приготовленная в виде дозированной формы для однократного введения.
17. Таблетка по любому из пп.1-16, приготовленная для дозирования один раз в день.
18. Способ получения таблетки по п.1, включающий прессование композиции, содержащей соединение формулы I и соединение формулы II, с получением первого прессованного слоя; добавление соединения формулы III и соли формулы IV к первому прессованному слою и прессование с получением таблетки.
19. Таблетка по п.1, состоящая из
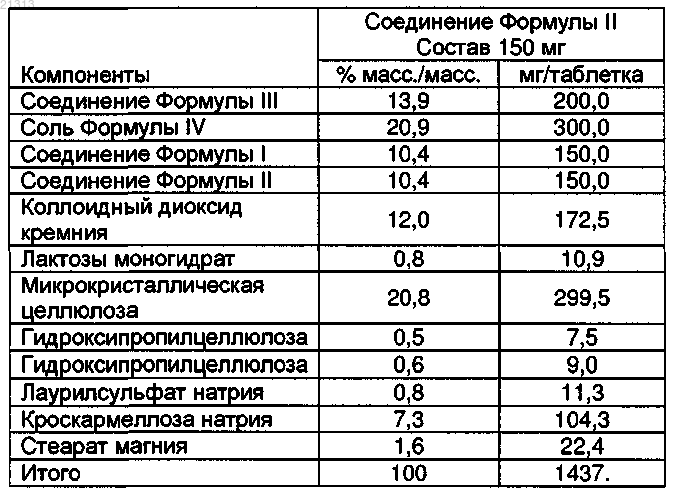
Текст
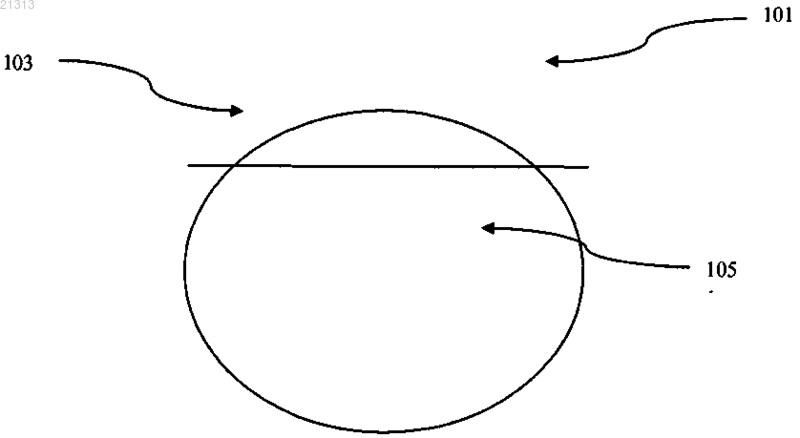
ТАБЛЕТКИ ДЛЯ КОМБИНИРОВАННОЙ ТЕРАПИИ Согласно изобретению предложены твердые дозированные формы (например, таблетки),содержащие соединения формул I-III и соль формулы IV. Приоритет изобретения Настоящая заявка испрашивает приоритет на основании предварительной заявки на патент США 61/150655, поданной 6 февраля 2009 г.; и предварительной заявки на патент США 61/150652, поданной 6 февраля 2009 г. Полное содержание каждой из указанных заявок включено в настоящее изобретение посредством ссылки. Уровень техники В патенте США 7176220 предложены соединения, которые, как сообщается, подходят для применения в качестве ингибиторов интегразы. Одно из конкретных соединений представляет собой соединение формулы I (т.е. элвитегравир). В публикации международной заявки на патент WO 2005/113508 предложены некоторые конкретные кристаллические формы соединения формулы I. Указанные конкретные кристаллические формы,как сообщается, имеют лучшую физическую и химическую стабильность по сравнению с другими физическими формами данного соединения. В публикации международной заявки на патент WO 2008/010921 описаны соединения, которые улучшают фармакокинетику вводимого совместно лекарственного средства за счет ингибировання цитохром-Р 450-зависимой монооксигеназы. Один из таких ингибиторов представляет собой соединение формулы II В WO 2008/010921 также описаны фармацевтические композиции, содержащие соединения, и предложены композиции, которые содержат по меньшей мере один дополнительный терапевтический агент. На с. 170 и 174 WO 2008/010921 также описаны комбинации предложенных соединений (например, соединения формулы II). В список различных агентов включены соединение формулы I (т.е. элвитегравир), соединение формулы III (т.е. эмтрицитабин) и соль формулы IV (т.е. тенофовир дизопроксил фумарат). Сведения, относящиеся к составам, содержащим указанные соединения, также можно найти на с. 159-168. В публикации международной заявки на патент WO 2008/103949 также предложены соединения,которые, как сообщается, подходят для модификации фармакокинетики вводимого совместно лекарственного средства посредством ингибирования цитохром-Р 450-зависимой монооксигеназы. На с. 199 WO 2008/103949 описана конкретная комбинация соединений формул I, II, III и IV. Составы обсуждаются на с. 181-190. Несмотря на эти сведения, в настоящее время существует потребность в улучшенных твердых дозированных формах (например, таблетках) для доставки композиций, содержащих несколько агентов. Также существует потребность в улучшенных твердых дозированных формах, содержащих соединения формул I, II, III и IV, которые обладают повышенной или приемлемой химической стабильностью, физической стабильностью, характеристиками высвобождения или равномерностью дозировки. Также существует потребность в улучшенных способах получения твердых дозированных форм композиций, содержащих соединения формул I, II, III и IV. Краткое описание изобретения Согласно настоящему изобретению предложены твердые дозированные формы (например, таблетки), содержащие соединения формул I, II, III и соль формулы IV и способы получения данных твердых дозированных форм. Заявитель обнаружил, что таблетки, полученные двухслойным способом, имеют лучшие свойства по сравнению с таблетками альтернативной структуры. Этот обнаруженный факт является достижением в разработке комбинированной терапии для лечения вирусных инфекций, таких как ВИЧ. Соответственно в одном из вариантов реализации изобретения предложена таблетка, содержащая первый и второй слои, причем: а) первый слой содержит соединение формулы Ib) второй слой содержит соединение формулы III и, необязательно, фармацевтически приемлемый носитель. В одном из вариантов реализации изобретения предложена фармацевтическая композиция, которая содержит 150 мг 10% соединения формулы I; 150 мг 10% соединения формулы II; 200 мг 10% соединения формулы III и 300 мг 10% соединения формулы IV. В одном из вариантов реализации изобретения предложена фармацевтическая композиция, которая содержит 150 мг 5% соединения формулы I; 150 мг 5% соединения формулы II; 200 мг 5% соединения формулы III и 300 мг 5% соединения формулы IV. В одном из вариантов реализации изобретения предложена фармацевтическая композиция, которая содержит 150 мг 2% соединения формулы I; 150 мг 2% соединения формулы II; 200 мг 2% соединения формулы III и 300 мг 2% соединения формулы IV. В одном из вариантов реализации изобретения предложена фармацевтическая композиция, которая состоит из 150 мг 5% соединения формулы I; 150 мг 5% соединения формулы II; 200 мг 5% соединения формулы III и 300 мг 5% соединения формулы IV в качестве фармацевтически активных ингредиентов и одного или более фармацевтически приемлемых носителей. В одном из вариантов реализации изобретения предложена фармацевтическая композиция, которая состоит из 150 мг 2% соединения формулы I; 150 мг 2% соединения формулы II; 200 мг 2% соединения формулы III и 300 мг 2% соединения формулы IV в качесгве фармацевтически активных ингредиентов и одного или более фармацевтически приемлемых носителей. В одном из вариантов реализации изобретения предложена таблетка, которая имеет следующий состав: Согласно изобретению также предложены способы получения таблеток согласно изобретению, которые описаны в настоящем изобретении, а также промежуточные композиции и изделия, которые подходят для получения композиций согласно изобретению. Соответственно в одном варианте реализации изобретения предложен способ получения таблетки согласно изобретению, включающий прессование композиции, которая содержит соединение формулы I и соединение формулы II, с получением первого прессованного слоя: добавление соединения формулы III и соли формулы IV к первому прессованному слою; и прессование с получением таблетки согласно изобретению. В одном варианте реализации изобретения композицию, которая содержит соединение формулы I и соединение формулы II, прессуют с получением мягкого слоя; смесь, содержащую соединение формулы III и соль формулы IV, добавляют к мягкому слою с получением конечной комбинации и конечную комбинацию прессуют с получением таблетки согласно изобретению. В одном варианте реализации способы согласно изобретению могут дополнительно включать нанесение покрытия на таблетку. Согласно изобретению также предложены способы, проиллюстрированные на фиг. 2 и 3 и в примерах в настоящем изобретении, которые подходят для получения промежуточных композиций и таблеток согласно изобретению. Краткое описание чертежей Фиг. 1 иллюстрирует таблетку согласно изобретению; фиг. 2 иллюстрирует получение композиций согласно изобретению; фиг. 3 иллюстрирует получение композиций согласно изобретению. Подробное описание Конкретные значения, приведенные ниже для диапазонов и терминов, являются лишь иллюстративными; они не исключают другие значения. Количества соединений и массовые соотношения соединений. Таблетки согласно изобретению содержат соединения формул I, II, III и соль формулы IV. Массы и отношения, описанные в настоящем изобретении, относятся к описанной комбинированной терапии. Следует понимать, что количества различных соединений могут варьироваться, не выходя за рамки изобретения. В одном варианте реализации количество соединения формулы I в таблетке согласно изобретению составляет 150 мг 10%. В другом варианте реализации количество соединения формулы I в таблетке согласно изобретению составляет 150 мг 5%. В другом варианте реализации количество соединения формулы I в таблетке согласно изобретению составляет 150 мг 2%. В одном варианте реализации количество соединения формулы II в таблетке согласно изобретению составляет 150 мг 10%. В другом варианте реализации количество соединения формулы II в таблетке согласно изобретению составляет 150 мг 5%. В другом варианте реализации количество соединения формулы II в таблетке согласно изобретению составляет 150 мг 2%. В одном варианте реализации количество соединения формулы III в таблетке согласно изобретению составляет 200 мг 10%. В другом варианте реализации количество соединения формулы III в таблетке согласно изобретению составляет 200 мг 5%. В другом варианте реализации количество соединения формулы III в таблетке согласно изобретению составляет 200 мг 2%. В одном варианте реализации количество соли формулы IV в таблетке согласно изобретению составляет 300 мг 10%. В другом варианте реализации количество соли формулы IV в таблетке согласно изобретению составляет 300 мг 5%. В другом варианте реализации количество соли формулы IV в таблетке согласно изобретению составляет 300 мг 2%. Также следует понимать, что различные массовые отношения соединений друг относительно друга в описанной комбинированной терапии могут варьироваться, не выходя за рамки изобретения. В одном из вариантов реализации массовое отношение соединения формулы I к соединению формулы II в таблетке согласно изобретению составляет 10,8. В другом варианте реализации массовое отношение соединения формулы I к соединению формулы II в таблетке согласно изобретению составляет 10,5. В другом варианте реализации массовое отношение соединения формулы I к соединению формулы II в таблетке согласно изобретению составляет 10,3. В другом варианте реализации массовое отношение соединения формулы I к соединению формулы II в таблетке согласно изобретению составляет 10,1. Фармацевтические составы. Фармацевтические композиции согласно изобретению могут быть приготовлены с применением обычных носителей. Несмотря на то что возможно введение активных ингредиентов композиции по отдельности, возможно, будет предпочтительным представить их в виде фармацевтических составов. Как описано в настоящем изобретении, фармацевтические составы согласно изобретению могут содержать соединения формул I, II, III и IV совместно с одним или более приемлемыми носителями. Носитель (носители) должен быть "приемлемым", то есть быть совместимым с другими ингредиентами состава и физиологически безвредным для реципиента. Соответственно в одном варианте реализации согласно изобретению предложены фармацевтические композиции, содержащие соединения формул I, II, III и IV и фармацевтически приемлемый носитель. В настоящем изобретении термин носитель включает вспомогательные вещества, вещества, способствующие скольжению, наполнители, связующие вещества, смазывающие вещества, разбавители, консерванты, поверхностно-активные агенты, диспергирующие агенты и т.п. Термин носитель также включает агенты, такие как подсластители, ароматизаторы, красители и консерванты. Кроме того, данные термины включают значения, как указанные в настоящем изобретении, так и значения в соответствии с обычной практикой. Таблетки, как правило, будут содержать вспомогательные вещества, вещества, способствующие скольжению, наполнители, связывающие вещества и т.п. Все составы могут необязательно содержать вспомогательные вещества, такие как указаны в руководстве Handbook of Pharmaceutical Excipients (APhA Publications, Washington, DC), полное содержание которой включено в настоящее изобретение посредством ссылки. Вспомогательные вещества включают аскорбиновую кислоту и другие антиоксиданты, хелатирующие агенты, такие как ЭДТА, углеводы, такие как декстрин, гидроксиалкилцеллюлозу, гидроксиалкилметилцеллюлозу, стеариновую кислоту и т.п. рН составов находится в диапазоне от примерно 3 до примерно 11, но обычно примерно от 7 до 10. Фармацевтические составы включают составы, которые подходят для способов введения, обсуждаемых в настоящем изобретении. Фармацевтические составы могут быть для удобства представлены в виде дозированной формы для однократного введения и могут быть получены с помощью любого из способов, хорошо известных в области фармации. Методики и составы, в общем случае, можно найти вRemington's Pharmaceutical Sciences (Mack Publishing Co., Easton, PA), полное содержание которой включено в настоящее изобретение посредством ссылки. Такие способы включают стадию связывания активного ингредиента(ов) с носителем, который составляет один или более вспомогательных ингредиентов. В общем случае, составы могут быть получены посредством равномерного и тщательного обеспечения связывания активного ингредиента(ов) с жидкими носителями или высокодисперсными твердыми носителями, или и с теми, и с другими, и затем, если необходимо, придания формы продукту (например, в виде дозированной формы для однократного введения). Конкретный носитель, который можно применять в комбинации с соединением формулы II, представляет собой частицу диоксида кремния. Как правило, частицы диоксида кремния содержат гранулярный гидрофильный высокодисперсный диоксид кремния, имеющий средний диаметр частиц от 10 до 120 мкм и удельную поверхность, определенную но методу Брунауэра-Эммета-Теллера (БЭТ), от 40 до 400 м 2/г (определенную в соответствии с DIN 66 131 с применением азота). Частицы диоксида кремния также, как правило, имеют объем пор примерно от 0,5 до 2,5 мл/г, причем менее чем примерно 5% от общего объема пор имеет диаметр пор менее чем примерно 5 нм, а остальные представляют собой ме зопоры и макропоры. Кроме того, частицы диоксида кремния, как правило, имеют рН в диапазоне от примерно 3,6 до примерно 8,5 и насыпную плотность от примерно 220 до примерно 700 г/л. Конкретный материал (частица) из диоксида кремния, особенно подходящий в композициях согласно изобретению, представляет собой AEROPERL 300 (высокодисперсный диоксид кремния), который доступен в Evonik Degussa AG, Дюссельдорф, Германия. Однако другие материалы, обладающие физическими и химическими свойствами, подобными свойствам материалов из диоксида кремния, описанных в настоящем изобретении, например силикат кальция (такой как Zeopharm) или алюминометасиликат магния (такой как Neusilin), также подходят для применения. Частицы диоксида кремния, имеющие средний диаметр от 10 до примерно 120 мкм, являются подходящими. Частицы диоксида кремния,имеющие средний диаметр 20-40 мкм, также являются подходящими. Частицы диоксида кремния, имеющие удельную поверхность по методу БЭТ примерно от 40 до 400 м 2/г, являются подходящими. Частицы диоксида кремния, имеющие удельную поверхность по методу БЭТ по меньшей мере 150 м 2/г, или по меньшей мере 200 м 2/г, или по меньшей мере 250 м 2/г, или по меньшей мере 275 м 2/г, также являются подходящими. В одном варианте реализации соединение формулы II связано (т.е. имеет покрытие в порах и на поверхности) с частицами диоксида кремния перед объединением с другими компонентами композиций согласно изобретению. В одном варианте реализации изобретения массовый процент соединения формулы II по отношению к частицам диоксида кремния составляет 2015%. В одном варианте реализации изобретения массовый процент соединения формулы II по отношению к частицам диоксида кремния составляет 5010%. В одном варианте реализации изобретения массовый процент соединения формулы II по отношению к частицам диоксида кремния составляет 4515%. В одном варианте реализации изобретения массовый процент соединения формулы II по отношению к частицам диоксида кремния составляет 10020%. В одном варианте реализации изобретения массовый процент соединения формулы II по отношению к частицам диоксида кремния составляет 8515%. Нанесение. Соединение формулы II может быть нанесено на частицы диоксида кремния с применением любого подходящего способа. Например, соединение формулы II может быть нанесено на частицы диоксида кремния посредством:a) напыления раствора соединения (например, раствора соединения в спиртовом растворителе, таком как этанол) на частицы диоксида кремния;b) объединения соединения формулы II, подходящего растворителя (например, летучего растворителя, такого как дихлорметан) и частиц диоксида кремния; испарения растворителя и выделения полученного твердого материала илиc) объединения соединения формулы I и подходящего летучего растворителя (например, галогенированного углеводорода, такого как дихлорметан) и частиц диоксида кремния; добавления антирастворителя (например, высоконеполярного растворителя, такого как гексан или гептан) и выделения получающегося в результате твердого материала (как проиллюстрировано в примере 4). Соединение формулы II может быть объединено с подходящим растворителем и множеством частиц диоксида кремния с получением смеси. Необязательно, соединение формулы II может быть объединено с подходящим растворителем с одновременным перемешиванием. Как правило, массовый процент соединения формулы II по отношению к частицам диоксида кремния перед объединением составляет примерно 5010%. В одном варианте реализации изобретения массовый процент соединения формулы II по отношению к частицам диоксида кремния перед объединением составляет примерно 2010%. В другом варианте реализации изобретения массовый процент соединения формулы II по отношению к частицам диоксида кремния перед объединением составляет примерно 3010%. Может быть применен любой растворитель, в котором растворимо соединение формулы II. Как правило, растворитель содержит летучий органический растворитель, такой как, например, (C1-C6)спирт (например, этанол). Соединение формулы II может также быть нанесено на материал из диоксида кремния путем растворения соединения в подходящем растворителе с получением раствора, содержащего соединение формулы II; добавления частиц диоксида кремния к раствору с получением смеси; необязательного взбалтывания или перемешивания смеси; добавления антирастворителя к смеси и выделения твердой смеси, которая содержит соединение формулы II на частицах диоксида кремния. Подходящие растворители включают органические растворители, такие как кетоны (например, ацетон), спирты (например, этанол) и галогенированные углеводороды (например, дихлорметан). Подходящие антирастворители включают высоконеполярные растворители (например, гексан или гептан). Конечная твердая смесь может быть выделена с помощью любого подходящего способа разделения (например, фильтрования). Одно или более фармацевтически приемлемых вспомогательных веществ может быть объединено со смесью с получением второй смеси. Данные фармацевтически приемлемые вспомогательные вещества могут включать наполнители, связующие вещества и дезинтегранты. Для облегчения переработки смеси в последующем процессе водного гранулирования может быть предпочтительно выбирать наполнители и дезинтегранты, совместимые с данным водным процессом. Например, микрокристаллическая целлюлоза (наполнитель) и кроскармеллоза натрия (дезинтегрант) являются особенно совместимыми с последующим процессом водного гранулирования. Гидроксипропилцеллюлоза (связующее вещество) также является особенно совместимой с последующим процессом гранулирования. В одном варианте реализации изобретения массовый процент микрокристаллической целлюлозы по отношению к общей массе второй смеси составляет примерно 5020%. В одном варианте реализации изобретения массовый процент гидроксипропилцеллюлозы по отношению к общей массе второй смеси составляет 21%. В одном варианте реализации изобретения массовый процент кроскармеллозы натрия составляет 52%. После добавления фармацевтически приемлемых вспомогательных веществ вторая смесь может быть перемешана, например, с помощью механической мешалки, такой как гранулятор с высокой скоростью сдвига (Niro-Fieider, модель РМА-25). Вода может быть добавлена ко второй смеси с получением влажного гранулированного материала,который впоследствии может быть подвергнут деагломерации, например, с помощью сита номер 20. Сушка, например, с помощью сушилки с псевдоожижениым слоем (Fluid Air, модель 20) приводит к получению высушенного материала, который содержит твердые частицы. В одном варианте реализации высушенный материал имеет влажность менее примерно 10,0%, определенную по потере массы при сушке (LOD). В другом варианте реализации высушенный материал имеет влажность менее примерно 5,0%, как определено по потере массы при сушке (LOD). В другом варианте реализации высушенный материал имеет влажность менее примерно 1,0%, определенную по потере массы при сушке (LOD). Раз-5 021313 мер данных частиц может быть уменьшен, например, с помощью сита номер 40 или подходящей мельницы (Quadro CoMil, модель 197/S) с получением третьей смеси. Подходящее фармацевтически приемлемое смазывающее вещество/вещество, способствующее скольжению (например, стеарат магния, стеариновая кислота, стеарат кальция, стеарат цинка или прежелатинизированный крахмал), может быть объединено с третьей смесью с получением четвертой смеси. В одном варианте реализации массовый процент стеарата магния по отношению к общей массе четвертой смеси составляет 10,5%. В одном варианте реализации согласно изобретению предложена композиция, полученная с помощью способов, описанных в настоящем изобретении. Согласно изобретению также предложен продукт,полученный с помощью любой из стадий способа, описанного в настоящем изобретении. Составы, подходящие для перорального введения, могут быть представлены в виде отдельных единиц, таких как таблетки, каждая из которых содержит заранее определенное количество активных составляющих; в виде порошка или гранул. Таблетка может быть получена путем прессования или литья в форму, возможно с применением одного или более вспомогательных веществ. Спрессованные таблетки могут быть получены посредством прессования в подходящем устройстве активного ингредиента в свободнотекучей форме, такой как порошок или гранулы, необязательно смешанного со связующим веществом, смазывающим веществом,инертным разбавителем, консервантом, поверхностно-активным агентом или диспергирующим агентом. Литые таблетки могут быть получены путем литья в форму в подходящем устройстве смеси превращенного в порошок активного ингредиента, увлажненного инертным жидким разбавителем. На таблетки может быть необязательно нанесено покрытие или насечка, при этом таблетки могут быть приготовлены с обеспечением замедленного или контролируемого высвобождения активного ингредиента. Таблетки согласно изобретению могут содержать один или более агентов, включая подсластители,ароматизаторы, красители и консерванты с целью обеспечения приятного вкуса препарата. Приемлемыми являются таблетки, содержащие активные ингредиенты в смеси с нетоксичными фармацевтически приемлемыми вспомогательными веществами, подходящими для производства таблеток. Данные вспомогательные вещества могут представлять собой, например, инертные разбавители, такие как карбонат кальция или натрия, лактоза, моногидрат лактозы, кроскармеллоза натрия, повидон, фосфат кальция или натрия; транслирующие и дезинтегрирующие агенты, такие как кукурузный крахмал или альгиновая кислота; связующие вещества, такие как целлюлоза, микрокристаллическая целлюлоза, крахмал, желатин или гуммиарабик; и смазывающие агенты, такие как стеарат магния, стеариновая кислота или тальк. Таблетки могут быть без покрытия или могут быть снабжены покрытием с помощью известных способов, включая микрокапсулирование для замедления распада и адсорбции в желудочно-кишечном тракте и, таким образом, обеспечения продолжительного действия в течение более длительного периода времени. Например, можно применять вещество, обеспечивающее замедленное действие, такое как глицерила моностеарат или глицерила дистеарат, по отдельности или совместно с воском. В публикации международной заявки на патент WO 2005/113508 предложены некоторые конкретные кристаллические формы соединения формулы I. Полное содержание публикации международной заявки на патент WO 2005/113508 включено в настоящее изобретение посредством ссылки (в частности,см. с. 12-62 в ней). Конкретные кристаллические формы в WO 2005/113508 определены как кристаллические формы II и III. Кристаллическая форма II характеризуется порошковой рентгенограммой, имеющей характеристические дифракционные пики при углах 2 6,56, 13,20, 19,86, 20,84, 21,22 и 25,22, измеренные с помощью порошкового рентгеновского дифрактометра. Кристаллическая форма III характеризуется порошковой рентгенограммой, имеющей характеристические дифракционные пики при углах 2 8,54, 14,02, 15,68, 17,06, 17,24, 24,16 и 25,74, измеренные с помощью порошкового рентгеновского дифрактометра. В одном из вариантов реализации композиции согласно изобретению включают соединение формулы I, которое находится в кристаллической форме II или III. Получение соединения формулы II и предварительное нанесение на диоксид кремния. Соединение формулы II или его соль может быть получено по реакции сочетания кислой соли формулы X, где М представляет собой противоион, с амином формулы IX с образованием соответствующего амида формулы II, как описано в публикации международной заявки на патент WO 2008/103949 (например, см. с. 254). Данная реакция, приводящая к образованию амида, может быть проведена при стандартных условиях. Например, она может быть проведена в подходящем органическом растворителе (например, тетрагидрофуране или дихлорметане) в присутствии подходящего агента для сочетания (например, EDCHCl иHOBt). Другие подходящие реагенты для проведения сочетания амида и условия известны в данной области техники. Реакция может, как правило, быть проведена при температуре от примерно -30 до примерно 20C. Конечный реакционный раствор, содержащий соединение формулы II в дихлорметане(ДХМ), можно непосредственно применять в способах, показанных на фиг. 2, с получением типичных композиций согласно изобретению, или раствор соединения в дихлорметане может быть объединен с этанолом и полученная смесь может быть подвергнута перегонке с целью удаления дихлорметана, при этом останется раствор соединения формулы II в этаноле. Этот раствор в этаноле может быть объединен с частицами диоксида кремния и испарен (как показано в левой колонке на фиг. 2) с получением композиции, содержащей соединение формулы II, нанесенное на частицы диоксида кремния. Как вариант, раствор соединения в дихлорметане может быть объединен с частицами диоксида кремния, может быть добавлен антирастворитель и полученная смесь может быть отфильтрована и высушена (как показано в правой колонке на фиг. 2) с получением композиции, содержащей нанесенное соединение формулы II. На фиг. 1 показан поперечный разрез таблетки (101) согласно изобретению. Таблетка включает первый слой (103), который содержит соединения формул I и II. Таблетка также включает второй слой(105), который содержит соединение формулы III и соль формулы IV. Фиг. 2 иллюстрирует процессы, которые можно применять для получения таблетки, содержащей соединение формулы II. Фиг. 3 иллюстрирует процесс для получения двухслойной таблетки согласно изобретению. Данный процесс дополнительно описан более детально в примере 1. Изобретение будет проиллюстрировано с помощью следующих неограничивающих примеров. Примеры Пример 1. Приготовление таблетки. Производственный процесс для комбинированной таблетки с установленной дозой, содержащей соединения формул I, II, III и IV, включает следующие стадии: 1) гранулирование и сушка в псевдоожиженном слое соединения формулы I, 2) гранулирование с высокой скоростью сдвига и сушка в псевдоожиженном слое соединений формул II или III, нанесенных на частицы диоксида кремния, 3) сухое гранулирование соединения формулы III и сухое гранулирование соли формулы IV, 4) измельчение сухого гранулированного соединения формулы III и измельчение сухой гранулированной соли формулы IV, 5) перемешивание соединения формулы III и соли формулы IV, 6) смешение соединений формул I и II, 7) прессование двухслойной структуры, при котором один слой состоит из смеси соединений формул I и II,а другой слой состоит из смеси соединений формул III и IV, с образованием таблетки, 8) нанесение покрытия на таблетку и 9) упаковка таблетки с покрытием. Внутрипроизводственный контроль массы для двухслойной таблетки был лучшего качества по сравнению с трехслойной конфигурацией таблетки. Двухслойный контроль массы для слоя, содержащего соединения формул I и II, показал значения между 100,2 и 100,8% от средней массы целевого слоя. Средние массы для всей таблетки составляли между 99,5 и 100,7% от среднего значения целевой массы таблетки. Значение относительного среднеквадратического отклонения (RSD) для слоя, содержащего соединения формул I и II, составляло между 1,4 и 2,2%, в то время как значение RSD для всей таблетки составляло между 0,7 и 1,2%. Подобные низкие значения относительного стандартного отклонения(RSD) указывают на очень низкую вариабельность массы во время процесса прессования. Хрупкость в начале и в конце процесса прессования составляла 0,0%. В процессе двухслойного прессования не были замечены таблетки с отбитыми краями, таблетки с отслоившейся верхней частью или сломанные таблетки. Значительные различия между слоями 1 и 2 в отношении свойств материала и прессуемости представляли риск разделения слоев во время процесса прессования таблетки с применением способа предварительного нанесения формулы II на твердый носитель. Однако полученные таблетки были неповреж-7 021313 денными, без дефектов, и выдерживали агрессивный процесс нанесения пленочного покрытия. Как описано выше, промежуточная смесь, которая является подходящей для получения слоя таблетки согласно изобретению, представляет собой композицию, которая содержит соединения формул I иII. Соответственно в одном варианте реализации согласно изобретению предложена композиция, содержащая соединения формул I и II. Соединения формул I и II могут быть представлены в любых количествах или соотношениях, описанных в настоящем изобретении, и являются подходящими для получения таблеток согласно изобретению. Например, следующие таблицы иллюстрируют типичные компоненты и массовые отношения для промежуточных композиций, которые могут быть применены для получения таблеток согласно изобретению. Также были предприняты попытки получения таблетки в виде трех слоев. Во время трехслойного прессования получали таблетку со слоем из соединения формулы I, вторым слоем, содержащим соединение формулы II, и третьим слоем, содержащим смесь соединения формулы III и соли формулы IV. Изначальная попытка состояла в нанесении соединения формулы II в виде первого слоя, за которым следовало соединение формулы I на втором слое и, наконец, третий слой из смеси соединения формулы III и соли формулы IV. Масса слоя, содержащего соединение формулы II, была слишком мала, в результате чего слой таблетки был очень тонким, что вызывало столкновение верхней и нижней частей штамповочного пресса во время процесса прессования. Масса слоя, содержащего соединение формулы I, была близка к массе слоя, содержащего соединение формулы II, поэтому столкновение частей штамповочного пресса предотвращало бы обратную конфигурацию. Масса смеси, содержащей соединения формулы III иIV, была достаточно большой для того, чтобы обеспечить толщину слоя, которая предотвращала бы столкновение частей штамповочного пресса во время процесса прессования. За этим слоем следовал второй слой, содержащий соединение формулы I, и третий слой, содержащий соединение формулы II. Серьезные дефекты таблетки наблюдали во время процесса прессования таблетки с применением трехслойного способа. Также было трудно контролировать массу таблетки с данной трехслойной конфигурацией. Кроме того, второй и третий слои отделялись от ядра таблетки. Неповрежденная таблетка, не имеющая дефектов, не могла быть получена в случае трехслойной конфигурации таблетки. Объединение всех соединений формул I, II, III и IV в смесь с получением монослойной таблетки ставит под угрозу химическую стабильность формулы IV. Кроме того, неподходящие комбинации со-8 021313 единений формул I, II, III или IV в двухслойной таблетке также поставят под угрозу химическую стабильность формулы IV. Например, соединение формулы IV в присутствии диоксида кремния из состава формулы II будет разлагать соединение формулы IV и соединение формулы IV в присутствии лаурилсульфата натрия из состава формулы I будет приводить к разложению соединения формулы IV. Пример 2. Следующая таблица иллюстрирует типичные композиции согласно изобретению, которые являются подходящими для получения таблеток согласно изобретению. Пример 3. Следующая таблица иллюстрирует типичную композицию согласно изобретению, которая является подходящей для получения таблеток согласно изобретению. Пример 4. Следующая таблица иллюстрирует типичную композицию согласно изобретению, которая является подходящей для получения таблеток согласно изобретению. Пример 5. Было проведено фармакокинетическое исследование с целью определения оптимальной дозы,включающей соединение формулы II. Дозы соединения формулы II для исследования с целью определения оптимальной дозы включали 50, 100 и 200 мг. Фармакокинетические данные для соединения формулы II из исследования с разными дозами для дозы 100 мг представлены в таблице ниже. Данные представлены как среднее арифметическое (% KB); T1/2 представлено как среднее значение(Q1, Q3);% KB - процент коэффициента вариации. Также было проведено фармакокинетическое исследование, включающее две комбинации с фиксированными дозами соединений формул I/II/III/IV. Дозы для комбинаций фиксированных доз соединений формул I/II/III/IV составляли 150/100/200/300 мг (доза А) и 150/150/200/300 мг (доза В) соответственно. Фармакокинетические данные для соединения формулы II из исследования, включающего две комбинации фиксированных доз (дозы А и В), представлены в следующей таблице. Общее воздействие, определенное по значению площади под кривой (AUC), было в 1,5-2 раза выше для соединения формулы II в ходе исследования комбинаций фиксированных доз (доза А) по сравнению с воздействием, определенным по значению площади под кривой (AUC) в исследовании с переменной дозой для дозы 100 мг соединения формулы II. Благодаря данному увеличенному воздействию со стороны соединения формулы II требуется либо меньшее количество соединения формулы I при обеспечении эквивалентного антивирусного эффекта, либо такое же количество соединения формулы I будет обеспечивать повышенный антивирусный эффект при введении соединения формулы I совместно с соединением формулы II. Данное неожиданное увеличение воздействия со стороны соединения формулы II также предполагает, что для эффективного воздействия соединения формулы II требуется меньшее количество соединения формулы II. Содержание всех публикаций, патентов и патентных документов включено в настоящее описание посредством ссылки, как если бы они были индивидуально включены посредством ссылки. Изобретение было описано со ссылкой на различные конкретные и предпочтительные варианты реализации и способы. Однако следует понимать, что может быть сделано много изменений и модификаций без выхода за рамки настоящего изобретения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Таблетка для комбинированной терапии, содержащая первый и второй слои, при этом: а) первый слой содержит соединение формулы Ib) второй слой содержит соединение формулы III и фармацевтически приемлемый носитель. 2. Таблетка по п.1, отличающаяся тем, что первый слой находится в контакте со вторым слоем. 3. Таблетка по любому из пп.1, 2, отличающаяся тем, что массовое отношение соединения формулыI к соединению формулы II составляет 1,00,5. 4. Таблетка по любому из пп.1-3, отличающаяся тем, что первый слой дополнительно содержит частицы диоксида кремния. 5. Таблетка по любому из пп.1-3, отличающаяся тем, что соединение формулы II связано с частицами диоксида кремния. 6. Таблетка по любому из пп.1-5, содержащая 150 мг 10% соединения формулы I, 150 мг 10% соединения формулы II, 200 мг 10% соединения формулы III и 300 мг 10% соединения формулы IV. 7. Таблетка по п.6, содержащая 150 мг 5% соединения формулы I. 8. Таблетка по п.6, содержащая 150 мг 2% соединения формулы I. 9. Таблетка по любому из пп.6-8, содержащая 150 мг 5% соединения формулы II. 10. Таблетка по любому из пп.6-8, содержащая 150 мг 2% соединения формулы II. 11. Таблетка по любому из пп.6-10, содержащая 200 мг 5% соединения формулы III. 12. Таблетка по любому из пп.6-10, содержащая 200 мг 2% соединения формулы III. 13. Таблетка по любому из пп.6-12, содержащая 300 мг 5% соли формулы IV. 14. Таблетка по любому из пп.6-12, содержащая 300 мг 2% соли формулы IV. 15. Таблетка по любому из пп.1-14, дополнительно содержащая фармацевтически приемлемый носитель. 16. Таблетка по любому из пп.1-15, приготовленная в виде дозированной формы для однократного введения. 17. Таблетка по любому из пп.1-16, приготовленная для дозирования один раз в день. 18. Способ получения таблетки по п.1, включающий прессование композиции, содержащей соединение формулы I и соединение формулы II, с получением первого прессованного слоя; добавление соединения формулы III и соли формулы IV к первому прессованному слою и прессование с получением таблетки. 19. Таблетка по п.1, состоящая из
МПК / Метки
МПК: A61K 9/20, A61P 31/18, A61K 9/50
Метки: таблетки, терапии, комбинированной
Код ссылки
<a href="https://eas.patents.su/13-21313-tabletki-dlya-kombinirovannojj-terapii.html" rel="bookmark" title="База патентов Евразийского Союза">Таблетки для комбинированной терапии</a>
Предыдущий патент: Конструкция водяного фильтра для пылесоса
Следующий патент: Комбинированная обработка потока отработанных газов, содержащих аммиак и оксиды азота, в промышленных установках
Случайный патент: Фунгицидные триазолопиримидины, способ их получения и их применение для борьбы с фитопатогенными грибами, а также содержащие их средства