Синергическое действие амлодипина и метаболита аторвастатина как основа для комбинированной терапии
Формула / Реферат
1. Фармацевтическая композиция, содержащая
(a) эффективное количество амлодипина;
(b) эффективное количество гидроксилированного метаболита аторвастатина (АТМ), имеющего формулу
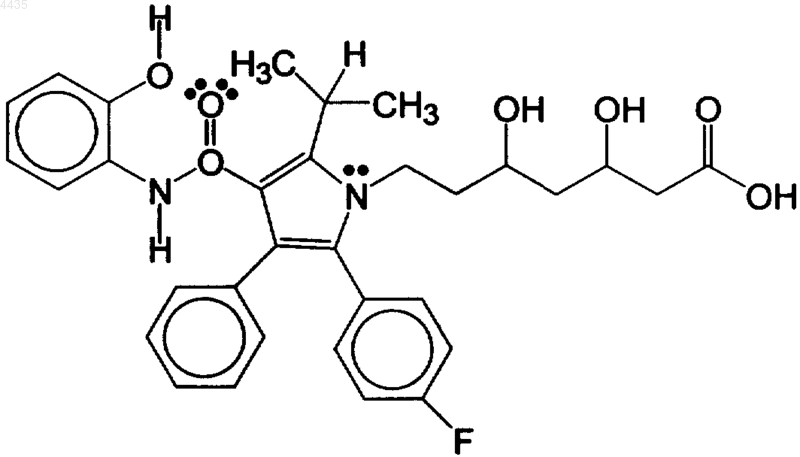
и
(c) фармацевтически приемлемые агенты, дополняющие рецептуру,
причем эффективные количества амлодипина и АТМ скоординированы так, чтобы существенно ингибировать перекисное окисление липидов в человеческом липопротеине низкой плотности или в липидной мембране для достижения терапевтического эффекта.
2. Фармацевтическая композиция по п.1, отличающаяся тем, что амлодипин представлен в виде эффективного производного амлодипина.
3. Фармацевтическая композиция по п.2, отличающаяся тем, что терапевтически эффективное производное амлодипина содержит безилат амлодипина.
4. Фармацевтическая композиция по п.1, отличающаяся тем, что указанная фармацевтическая композиция снижает риск заболевания артерий и связанного с ним сердечного заболевания.
5. Фармацевтическая композиция по п.4, отличающаяся тем, что указанное заболевание артерий и связанное с ним сердечное заболевание выбрано из группы, состоящей из гипертензии, гиперлипидемии, атеросклероза, артериосклероза, болезни коронарных артерий, инфаркта миокарда, сердечной недостаточности вследствие закупорки сосудов, инсульта и стенокардии.
6. Фармацевтическая композиция по п.1, отличающаяся тем, что указанная фармацевтическая композиция снижает кровяное давление.
7. Фармацевтическая композиция по п.6, отличающаяся тем, что указанная фармацевтическая композиция снижает кровяное давление до уровня, согласующегося с пониженным риском заболевания артерий и связанного с ним сердечного заболевания.
8. Фармацевтическая композиция по п.6, отличающаяся тем, что указанная фармацевтическая композиция снижает кровяное давление до уровня, статистически эквивалентного нормальному уровню.
9. Фармацевтическая композиция по п.1, отличающаяся тем, что указанная фармацевтическая композиция снижает концентрацию липидов в организме.
10. Фармацевтическая композиция по п.9, отличающаяся тем, что указанная фармацевтическая композиция снижает концентрацию липидов в организме до уровня, согласующегося с пониженным риском заболевания артерий и связанного с ним сердечного заболевания.
11. Фармацевтическая композиция по п.9, отличающаяся тем, что указанная фармацевтическая композиция снижает концентрацию липидов в организме до уровня, статистически эквивалентного нормальному уровню.
12. Фармацевтическая композиция по п.1, отличающаяся тем, что указанная фармацевтическая композиция снижает кровяное давление и концентрацию липидов в организме.
13. Фармацевтическая композиция по п.12, отличающаяся тем, что указанная фармацевтическая композиция снижает кровяное давление и концентрацию липидов в организме до уровня, согласующегося с пониженным риском заболевания артерий и связанного с ним сердечного заболевания.
14. Фармацевтическая композиция по п.12, отличающаяся тем, что указанная фармацевтическая композиция снижает кровяное давление и концентрацию липидов в организме до уровня, статистически эквивалентного нормальному уровню.
15. Фармацевтическая композиция по п.1, отличающаяся тем, что указанная фармацевтическая композиция сопутствующим образом снижает кровяное давление и концентрацию липидов в организме.
16. Фармацевтическая композиция по п.15, отличающаяся тем, что указанная фармацевтическая композиция сопутствующим образом снижает кровяное давление и концентрацию липидов в организме до уровня, согласующегося с пониженным риском заболевания артерий и связанного с ним сердечного заболевания.
17. Фармацевтическая композиция по п.15, отличающаяся тем, что указанная фармацевтическая композиция сопутствующим образом снижает кровяное давление и концентрацию липидов в организме до уровня, статистически эквивалентного нормальному уровню.
18. Фармацевтическая композиция по п.1, отличающаяся тем, что указанная фармацевтическая композиция синергически снижает кровяное давление и концентрацию липидов в организме.
19. Фармацевтическая композиция по п.18, отличающаяся тем, что указанная фармацевтическая композиция синергически снижает кровяное давление и концентрацию липидов в организме до уровня, согласующегося с пониженным риском заболевания артерий и связанного с ним сердечного заболевания.
20. Фармацевтическая композиция по п.18, отличающаяся тем, что указанная фармацевтическая композиция синергически снижает кровяное давление и концентрацию липидов в организме до уровня, статистически эквивалентного нормальному уровню.
21. Фармацевтическая композиция по любому из пп.15-17 и 18-20, отличающаяся тем, что снижение сопутствующим образом кровяного давления и концентрации липидов в организме является, по меньшей мере частично, результатом пониженного окисления липидов.
22. Фармацевтическая композиция, содержащая
(a) терапевтически эффективное количество сочетания амлодипина и гидроксилированного метаболита аторвастатина, имеющего формулу
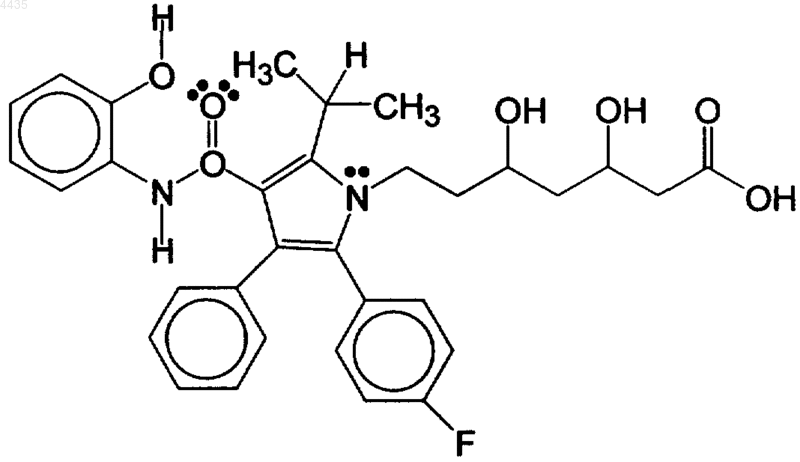
и
(b) фармацевтически приемлемые агенты, дополняющие рецептуру,
причём указанная фармацевтическая композиция снижает кровяное давление и концентрацию липидов в организме, по меньшей мере частично, в результате понижения окисления липидов.
23. Фармацевтическая композиция по п.22, отличающаяся тем, что амлодипин содержит терапевтически эффективное производное амлодипина.
24. Фармацевтическая композиция по п.23, отличающаяся тем, что терапевтически эффективное производное амлодипина содержит безилат амлодипина.
25. Фармацевтическая композиция по п.22, отличающаяся тем, что указанная фармацевтическая композиция снижает риск заболевания артерий и связанного с ним сердечного заболевания.
26. Фармацевтическая композиция по п.25, отличающаяся тем, что указанное заболевание артерий и связанное с ним сердечное заболевание выбрано из группы, состоящей из гипертензии, гиперлипидемии, атеросклероза, артериосклероза, болезни коронарных артерий, инфаркта миокарда, сердечной недостаточности вследствие закупорки сосудов, инсульта и стенокардии.
27. Фармацевтическая композиция по п.22, отличающаяся тем, что указанная фармацевтическая композиция снижает кровяное давление и концентрацию липидов в организме до уровня, согласующегося с пониженным риском заболевания артерий и связанного с ним сердечного заболевания.
28. Фармацевтическая композиция по п.22, отличающаяся тем, что указанная фармацевтическая композиция снижает кровяное давление и концентрацию липидов в организме до уровня, статистически эквивалентного нормальному уровню.
29. Способ лечения заболевания артерий и связанного с ним сердечного заболевания, включающее ингибирование образования перекисей липидов в липопротеинах низкой плотности (ЛПНП) и липидных мембранах, посредством введения терапевтически эффективного количества сочетания амлодипина и гидроксилированного метаболита аторвастатина, имеющего формулу

30. Способ п.29, отличающийся тем, что амлодипин содержит эффективное производное амлодипина.
31. Способ по п.30, отличающийся тем, что эффективное производное амлодипина содержит безилат амлодипина.
32. Способ по п.29, отличающийся тем, что указанное заболевание артерий и связанное с ним сердечное заболевание выбрано из группы, состоящей из гипертензии, гиперлипидемии, атеросклероза, артериосклероза, болезни коронарных артерий, инфаркта миокарда, сердечной недостаточности вследствие закупорки сосудов, инсульта и стенокардии.
33. Способ по п.29, отличающийся тем, что амлодипин и метаболит аторвастатина вводят в одном и том же лекарственном средстве.
34. Способ по п.29, отличающийся тем, что амлодипин и метаболит аторвастатина вводят как раздельные лекарственные средства.
35. Способ по п.29, отличающийся тем, что амлодипин и метаболит аторвастатина ввофят одновременно.
36. Способ по п.29, отличающийся тем, что амлодипин и метаболит аторвастатина вводят в различные моменты времени.
37. Способ снижения кровяного давления и концентрации липидов в организме, включающий ингибирование окисления липидов посредством введения терапевтически эффективного для этих целей количества сочетания амлодипина и гидроксилированного метаболита аторвастатина, имеющего формулу
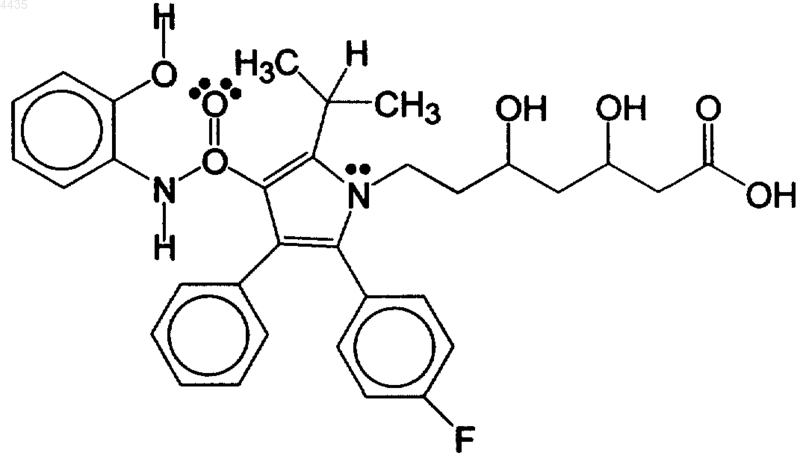
38. Способ п.37, отличающийся тем, что амлодипин содержит терапевтически эффективное производное амлодипина.
39. Способ по п.38, отличающийся тем, что терапевтически эффективное производное амлодипина содержит безилат амлодипина.
40. Способ по п.37, отличающийся тем, что амлодипин и метаболит аторвастатина вводят в одном и том же лекарственном средстве.
41. Способ по п.37, отличающийся тем, что амлодипин и метаболит аторвастатина вводят как раздельные лекарственные средства.
42. Способ по п.37, отличающийся тем, что амлодипин и метаболит аторвастатина вводят одновременно.
43. Способ по п.37, отличающийся тем, что амлодипин и метаболит аторвастатина вводят в различные моменты времени.
44. Способ по п.37, отличающийся тем, что указанная фармацевтическая композиция снижает кровяное давление и концентрацию липидов в организме до уровня, согласующегося с пониженным риском заболевания артерий и связанного с ним сердечного заболевания.
45. Способ по п.37, отличающийся тем, что указанное заболевание артерий и связанное с ним сердечное заболевание выбрано из группы, состоящей из гипертензии, гиперлипидемии, атеросклероза, артериосклероза, болезни коронарных артерий, инфаркта миокарда, сердечной недостаточности вследствие закупорки сосудов, инсульта и стенокардии.
46. Способ по п.37, отличающийся тем, что указанная фармацевтическая композиция снижает кровяное давление и концентрацию липидов в организме до уровня, статистически эквивалентного нормальному уровню.
47. Способ по любому из пп.37-46, отличающийся тем, что снижение кровяного давления и концентрации липидов в организме является, по меньшей мере частично, результатом пониженного окисления липидов.
48. Способ синергического ингибирования окисления липидов, включающий введение терапевтически эффективного количества сочетания амлодипина и гидроксилированного метаболита аторвастатина, имеющего формулу
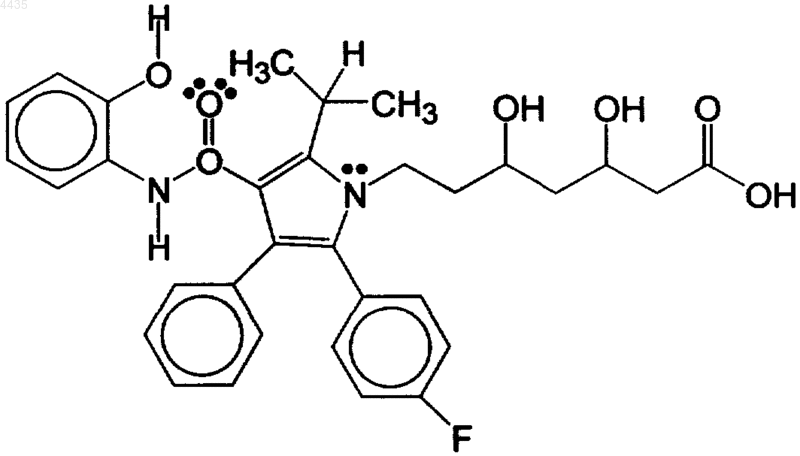
49. Способ п.48, отличающийся тем, что амлодипин содержит терапевтически эффективное производное амлодипина.
50. Способ по п.49, отличающийся тем, что терапевтически эффективное производное амлодипина содержит безилат амлодипина.
51. Способ по п.48, отличающийся тем, что амлодипин и метаболит аторвастатина вводят в одном и том же лекарственном средстве.
52. Способ по п.48, отличающийся тем, что амлодипин и метаболит аторвастатина вводят как раздельные лекарственные средства.
53. Способ по п.48, отличающийся тем, что амлодипин и метаболит аторвастатина вводят одновременно.
54. Способ по п.48, отличающийся тем, что амлодипин и метаболит аторвастатина вводят в различные моменты времени.
55. Способ по п.48, отличающийся тем, что указанная фармацевтическая композиция ингибирует окисление липидов до уровня, согласующегося с пониженным риском заболевания артерий и связанного с ним сердечного заболевания.
56. Способ по п.55, отличающийся тем, что указанное заболевание артерий и связанное с ним сердечное заболевание выбрано из группы, состоящей из гипертензии, гиперлипидемии, атеросклероза, артериосклероза, болезни коронарных артерий, инфаркта миокарда, сердечной недостаточности вследствие закупорки сосудов, инсульта и стенокардии.
57. Фармацевтическая композиция, содержащая
(a) терапевтически эффективное количество амлодипина;
(b) терапевтически эффективное количество гидроксилированного метаболита аторвастатина, имеющего формулу
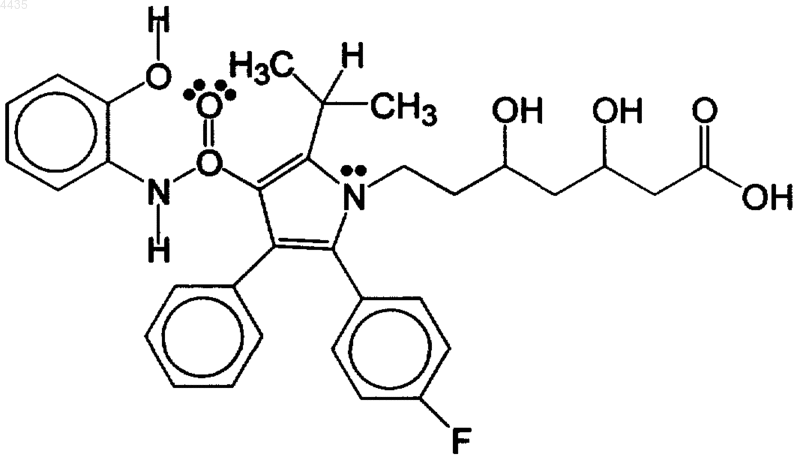
и (c) фармацевтически эффективные агенты, дополняющие рецептуру.
58. Фармацевтическая композиция по п.57, отличающаяся тем, что амлодипин содержит терапевтически эффективное производное амлодипина.
59. Фармацевтическая композиция по п.58, отличающаяся тем, что терапевтически эффективное производное амлодипина содержит безилат амлодипина.
60. Способ снижения кровяного давления и концентрации липидов в организме, включающий введение терапевтически эффективного количества сочетания амлодипина и гидроксилированного метаболита аторвастатина, имеющего формулу

61. Способ по п.60, отличающийся тем, что указанная фармацевтическая композиция синергически снижает кровяное давление и концентрацию липидов в организме до уровня, статистически эквивалентного нормальному уровню.
62. Способ по п.61, отличающийся тем, что синергическое снижение кровяного давления и концентрации липидов в организме является, по меньшей мере частично, результатом пониженного окисления липидов.
Текст
1 Область техники Настоящее изобретение относится к фармацевтическим композициям и комбинациям для лечения заболевания артерий и связанного с ним сердечного заболевания, а также родственных заболеваний. Уровень техники Болезнь коронарных артерий сердца (coronary artery disease - CAD) является главной причиной смертности в развитых странах, и вообще уровень заболеваемости для не весьма высок. Обычно пациент с CAD имеет несколько сопутствующих заболеваний, включая гипертензию,диабет и дислипидемию, что повышает общий риск неблагоприятного исхода и осложняет лечение. В одном из способов противогипертензивной терапии применяется липофильный блокатор кальциевых каналов (БКК) типа дигидропиридина - безилат амлодипина (amlodipine besylate - AML), хорошо переносимое средство с установленными рекордно низким уровнем безопасности и высокой эффективностью в лечении гипертензии и стенокардии. Возможная терапевтическая эффективность AML в лечении пациентов с CAD была недавно продемонстрирована в предварительных шифрованных испытаниях со слепым отбором действия на сосуды Норваска (AML) - Prospective Randomized(AML) Trial (PREVENT). В результате трехлетних испытаний в сравнении с плацебо было установлено действие AML на проявление и развитие атеросклеротических бляшек в коронарных и сонных артериях у пациентов с документированной CAD (Byington R.P., Miller M.E.,Herrington D. и др. Rationale, design, and baseline(PREVENT). // Am. J. Cardiol. 1997. Т. 80. С. 1087-1090). Результаты PREVENT показали впечатляющие клинические успехи терапии с помощью AML, включая общее 30%-ное снижение числа основных документированных случаев или проявлений (Byington R.P., Chen J.,Furberg C.D., Pitt В. Effect of amlodipine on cardiovascular events and procedures. // J. Am. Coll.Cardiol. 1999. Т. 33. С. 314 А). Терапия с помощью AML приводила также к значительному замедлению развития атеросклероза сонных артерий, измеренного методом УЗИ В-типаclinical events. // Circulation. 2000. Т. 102. С. 1503-1510). Клиническая эффективность, продемонстрированная для AML в случаях CAD, не была ранее отмечена для других БКК, в том 2 числе для препаратов типа дигидропиридина,которые применялись при изучении этой проблемы (Waters D., Lesperance J., Francetich M. и др. A controlled clinical trial to assess the effect ofIsradipine Diuretic Atherosclerosis Study (MIDAS). A randomized controlled trial. // JAMA. 1996. Т. 276. С. 785-791). Это наблюдение повысило интерес к возможным антиатерогенным свойствам AML, в том числе к антиокислительному действию, которое не зависит от модуляции кальциевых каналов (Mason R.P., Leedsamlodipine. // J. Mol. Cell. Cardiol. 1999. Т. 31. С. 275-281). Было также показано, что терапия с понижением содержания липидов (гиполипидемическая терапия) значительно снижает заболеваемость и смертность, связанные с CAD. Было установлено, что гидроксилированные в орто- и пара-положениях метаболиты аторвастатина(АТМ) проявляют антиокислительную активность в препаратах липопротеинов (Aviram M.,Rosenblat M., Bisgaler C.L., Newton R.S. Atorvastatin and gemfibrosil metabolites but not the(АТМ) и способы их получения описаны в патенте США 5385929. Однако в настоящее время не существует никаких фармацевтических композиций, пригодных для совместного лечения как гипертензии, так и гиперлипидемии (повышенного содержания липидов). Такая фармацевтическая композиция обладала бы несколькими преимуществами. Например, можно было бы одновременно направлять терапию сразу на несколько 3 часто присутствующих у индивидуального пациента факторов риска для заболевания сердечных артерий и связанного с ним сердечного заболевания. Кроме того, удобство введения одной комбинированной дозы могло бы значительно улучшить соблюдение пациентами лечебных схем. Таким образом, целью настоящего изобретения является разработка сочетанной (комбинированной) терапии, с помощью которой можно лечить несколько патологических процессов,участвующих в заболевании сердечных артерий и связанном с ним сердечном заболевании. Эти процессы включают (но не ограничиваются ими) гипертензию и гиперлипидемию. Целью настоящего изобретения является также разработка пригодных и удобных величин дозировок и форм таких сочетанных (комбинированных) лечебных средств. Предпочтительно,эта фармацевтическая композиция могла бы оказывать синергическое действие на эти отличительные признаки заболевания сердечных артерий и связанного с ним сердечного заболевания, так что индивидуальные воздействия компонентов этой композиции будут усилены их комбинированием. Поэтому настоящее изобретение включает терапевтическую задачу лечения CAD, влекущую за собой разработку лекарств, которые могут одновременно воздействовать на несколько основных болезненных процессов, участвующих в атеросклерозе, влияя таким путем на ход болезни. Таким образом, при применении настоящего изобретения может быть достигнуто повышение частоты положительных исходов терапии CAD, если в одной системе доставки объединить применение противогипертензивного агента и ингибитора HMG-CoA-редуктазы. Сущность изобретения При сочетании (комбинировании) AML и АТМ, что не было очевидным заранее, они обладали синергическим действием в предотвращении перекисного окисления липидов в человеческих липопротеинах низкой плотности(ЛПНП) и в липидных мембранах. Активность сочетания признана синергической, так как измеренный эффект в любом случае значительно превосходил все аддитивные эффекты обоих лекарств. Таким образом, эти вещества обладали до этого неизвестным синергическим антиокислительным действием - свойством, которое позволяет этим веществам повышать устойчивость ЛПНП и мембран клеток сосудов к окислительной модификации в ходе атерогенеза. Действительно, окислительная модификация липидов - это хорошо известная причина повреждения эпителия и подстилающих гладких мышц (Ross R. Atherosclerosis -An inflammatory 4 установлено, что липофильные вещества, защищающие липиды от перекисного окисления,уменьшали развитие поражений в различных моделях атеросклероза, а также в клинических исследованиях (Diaz M.N., Frei В., Vita J.A.,Keaney J.F. Antioxidants and atherosclerotic heartdisease. // N. Emgl. J. Med. 1997. Т. 337. С. 408416). Кроме того, полезный эффект снижающей содержание липидов терапии связывают как с еe действием на липопротеины очень низкой плотности (ЛПОНП), ЛПНП и липопротеины высокой плотности (ЛПВП) плазмы, так и со снижением (как со следствием) возможного образования атерогенных (вызывающих атеросклероз) окисленных липопротеинов. Научные исследования, на которых основано сочетанное (комбинированное) применение AML (Norvasc) и АТМ в одной системе доставки для лечения сердечно-сосудистого заболевания, описаны в настоящем изобретении. В частности, синергическое антиокислительное действие блокатора кальциевых каналов(AML) и активного гидроксилированного метаболита аторвастатина (АТМ) - ингибитораHMG-CoA-редуктазы было оценено в человеческих ЛПНП и липидных мембранах, обогащенных полиненасыщенными жирными кислотами(ПНЖК) - ключевой мишенью для окислительно-радикального поражения при атеросклерозе. Синергическое действие этих веществ было продемонстрировано в мембранах, приготовленных в присутствии холестерина. СочетаниеAML с АТМ приводило к резкому и длительному снижению повреждения липидов оксирадикалами при таких низких концентрациях, как 10,0 нМ. Зависящая от дозы антиокислительная активность, связанная с сочетанием этих лекарств в терапевтических количествах, обладала высоким синергизмом и не могла быть достигнута при применении эндогенного агента - витамина Е. Однако антиокислительная активность не наблюдалась, если AML сочетали с другими ингибиторами HMG-CoA-редуктазы, в том числе с ловастатином и мевастатином. Согласно данным рентгеновской дифракции и химического анализа, особая активность, описанная для этого сочетания лекарств, может быть объяснена сильными физико-химическими взаимодействиями с двойным слоем мембраны,не зависящими от хорошо известного действия этих лекарств на транспорт кальция и метаболизм холестерина. Этот синергический антиокислительный эффект является основой нового фармакологического механизма действия этих соединений и убедительным основанием сочетанного (комбинированного) применения активных ингредиентов в Norvasc и АТМ в лечении сердечно-сосудистого заболевания путем снижения содержания ЛПНП в плазме и усиления защиты ЛПНП и клеточных мембран от окисления. Это новое свойство дополняет из 5 вестные типы действия этих лекарств на гипертензию и дислипидемию. Другие цели, особенности и преимущества настоящего изобретения будут понятны из нижеследующего подробного описания предпочтительных примеров осуществления вместе с приведeнными рисунками. Краткое описание графических материалов Фиг. 1 показывает синергическое действиеAML и АТМ на перекисное окисление липидов при низкой, терапевтической концентрации лекарства (100,0 нМ) в мембранах, содержащих физиологические количества холестерина. По оси ординат х - обозначает процент ингибирования перекисного окисления липидов, а по оси абсцисс у - указывает обработку амлодипином(AML), метаболитом аторвастатина (АТМ) и комбинацией обоих веществ (AML+АТМ) при концентрации 100 нМ. Значения представляют собой средние величины плюс-минус стандартное отклонение для n, равного 6. Звeздочкамиобозначен доверительный интервал р меньше 0,001 относительно контроля и других обработок. На фиг. 2 показана дозовая зависимость антиокислительного действия сочетания AML и АТМ в широком интервале концентраций (от 0,001 до 10 мкМ). По оси ординат х - обозначает процент ингибирования перекисного окисления липидов, а по оси абсцисс у - указывает обработку комбинацией AML и АТМ при указанных микромолярных концентрациях. Значения представляют собой средние величины плюс-минус стандартное отклонение для n, равного 6. Звездочкамиобозначен доверительный интервал р меньше 0,001 относительно контроля и других обработок. Фиг. 3 демонстрирует зависимость от времени антиокислительной активности сочетанияAML/ATM, превосходящей активность витамина Е при одинаковых концентрациях (10,0 мкМ). По оси ординат х - обозначает процент ингибирования перекисного окисления липидов,а по оси абсцисс у - указывает обработку сочетанием амлодипина и метаболита аторвастатина(AML+АТМ) - незакрашенные столбцы или витамином Е (Е) - столбцы с косой штриховкой,обе обработки проводили при концентрации 10 мкМ. Значения представляют собой средние величины плюс-минус стандартное отклонение для n, равного 6-12. Звездочкамиобозначен доверительный интервал р меньше 0,001 относительно контроля и других обработок. На фиг. 4A-4D показаны места отделения протонов (S1, S2 и S3) в АТМ, вносящие вклад в антиокислительную активность (фиг. 4 А), вместе с результатами вычислений резонансной стабилизации (фиг. с 4 В по 4D). На фиг. 5 показано сравнение проявления антиокислительной активности AML при его сочетании с различными ингибиторами HMGCoA-редуктазы при одной и той же концентра 004435 6 ции. По оси ординат х - обозначает процент ингибирования перекисного окисления липидов, а по оси абсцисс у - указывает обработку сочетанием амлодипина и метаболита аторвастатина(AML+L) - ингибирование перекисного окисления липидов отсутствует; все обработки при концентрации 1,0 мкМ. Значения представляют собой средние величины плюс-минус стандартное отклонение для n, равного 6-12. Звездочкамиобозначен доверительный интервал р меньше 0,001 относительно контроля и других обработок. На фиг. 6 А-6 В показано синергическое антиокислительное действие AML и АТМ в образцах человеческих ЛПНП, в сравнении с тролоксом С (Trolox С - растворимый витамин Е). На фиг. 6 А: х по оси ординат обозначает образование реагирующих с тиобарбитуратами веществ (ТБРВ), измеренное по поглощению при 532 нм, а у по оси абсцисс - время в часах. Контрольным значениям соответствуют зачернeнные кружки и сплошная линия, тролоксу С(растворимый витамин Е) - зачернeнные перевeрнутые треугольники и пунктирная линия,одному AML - незаполненные ромбы и штриховая линия, одному АТМ - незаполненные кружки и штрихпунктирная линия, сочетанию AML и АТМ - зачерннные квадраты и линия с чередованием длинных и коротких штрихов. На фиг. 6 В х по оси ординат обозначает образование реагирующих с тиобарбитуратами веществ(ТБРВ), измеренное по поглощению при 532 нм,а у по оси абсцисс - указывает обработку амлодипином (AML) - незаполненный столбец, метаболитом аторвастатина (АТМ) - заштрихованный наискось столбец, или сочетанием амплодипина и метаболита аторвастатина(AML+АТМ) - зачернeнный столбец, при концентрации 3,0 мкМ. Значения представляют собой средние величины плюс-минус стандартное отклонение. Звездочкамиобозначен доверительный интервал р меньше 0,001 относительно контроля и других обработок. На фиг. 7 представлены расчетные значения энтальпии для АТМ, AML и их соответствующих радикальных форм. На фиг. 8 А-8 С показано сравнительное определение с помощью рентгеновской дифракции раздельного и комбинированного взаимодействия AML и АТМ с липидной мембраной. По оси ординат х - относительная электронная плотность, а по оси абсцисс у - среднее расстояние в ангстремах от середины липидного двойного слоя. Во всех трех рамках контроль сплошная линия. На фиг. 8 А пунктирная линия соответствует AML; на фиг. 8 В пунктирная линия соответствует АТМ; на фиг. 8 С пунктирная линия соответствует сочетанию AML и АТМ. В каждой рамке зачерненные области представ 7 ляют собой разницу в электронной плотности между профилями электронной плотности контроля и опыта. На фиг. 9 представлено сравнение раздельного и комбинированного действия AML и АТМ на размеры мембранных двойных слоев,определенные анализом с помощью рентгеновской дифракции. По оси ординат х - изменение ширины мембраны в ангстремах; по оси абсцисс у - указывает обработку AML (зачерненный столбец), АТМ (столбец с левой косой штриховкой), AT (незаполненный столбец) и сочетанием AML и АТМ (столбец с правой косой штриховкой). Значения представляют собой средние величины плюс-минус стандартное отклонение. Звездочкамиобозначен доверительный интервал р меньше 0,001 относительно контроля и других обработок. Сведения, подтверждающие возможность осуществления изобретения Синергическое антиокислительное действие амлодипина с аторвастатином или метаболитом аторвастатина на липидные мембраны Дозовую зависимость антиокислительной активности AML и АТМ при их раздельном и комбинированном применении определяли в мембранных везикулах, реконструированных из фосфолипидов, обогащенных холестерином и полиненасыщенной жирной кислотой (ПНЖК) дилинолеоил-фосфатидилхолином в мольном соотношении 0,5:1. Мембранные везикулы использовали в этих опытах по следующим соображениям: 1) эта система хорошо охарактеризована и обладает высокой воспроизводимостью; 2) линолевая кислота является первичной мишенью при окислительном повреждении и содержится как в мембранах клеток сосудов, так и в липопротеиновых частицах; 3) эта мембранная система не содержит кальциевых каналов или фермента HMG-CoAредуктазы; и 4) перекисное окисление липидов в этой системе может быть инициировано спонтанно при 37 С в отсутствие экзогенных химических инициаторов, таких как высокое содержание железа или аскорбата. В этих опытах наблюдалось постепенное нарастание со временем окисления, измеренного спектрофотометрически в течение 72-часового периода. На фиг. 1 продемонстрирована синергическая антиокислительная активность AML и АТМ в мембранных везикулах, содержащих холестерин и фосфолипид в количествах, воспроизводящих подобные физиологическим условия (Tulenko T.N., Chen M., Mason P.E., Masonwidth during atherogenesis. // J. Lipid Res. 1998. Т. 39. С. 947-956). При концентрации 100,0 нМ только один АТМ давал в этом препарате мем 004435 8 браны, обогащенные холестерином, некоторое достоверное ингибирование (на 9% по отношению к контролю) перекисного окисления липида. Однако если агенты объединяли, степень ингибирования возрастала до 33%, причем эффект достоверно (р 0,01) превышал эффект раздельного введения агентов. Антиокислительная активность сочетания была весьма значительной: препараты ингибировали образование перекиси липида (более 5 х 102 мкМ) при концентрации 100,0 нМ (уровень образования перекиси липида в контроле был 1,6 мМ). Это сочетание лекарств давало эффект с сильной зависимостью от дозы в широком интервале концентраций (фиг. 2). Достоверное ингибирование(р 0,05) наблюдалось уже при такой низкой концентрации, как 10,0 нМ, а концентрация 50% ингибирования (IC50) была равна 500,0 нМ. Ингибирование более 90% (больше, чем на 1 мМ образования перекиси липида) наблюдалось при концентрации сочетания 10,0 мкМ (фиг. 2). Тот факт, что ингибирование наблюдалось при субмикромолярных концентрациях, указывает на то, что преимущество, даваемое сочетаниемAML и АТМ, важно для терапевтического применения. Антиокислительное действие сочетания значительно более длительно во времени, чем у витамина Е, даже при повышенной концентрации последнего (10,0 мкМ) (фиг. 3). Это наблюдение согласуется с концепцией, согласно которой витамин Е, или -токоферол, постепенно расходуется в процессе перекисного окисления липидов. Наоборот, активность сочетанияAML/ATM не зависела от длительности периода инкубации, в течение которого общий уровень перекиси липида возрастал за 72 ч до 2,2 мМ. Увеличенная полярность АТМ из-за его дополнительной гидроксильной группы может обеспечивать его более сильные взаимодействия с номинально заряженным AML, что приводит к изменению взаимодействия с фосфолипидными молекулами, о чeм свидетельствует анализ методом рентгеновской дифракции. Дополнительная гидроксильная группа, связанная с АТМ,предоставляет также дополнительный удаляемый протон, который может быть передан молекулам свободных радикалов (фиг. 4). После утраты протона оставшийся неспаренным свободный электрон может быть эффективно стабилизирован в резонансных структурах метаболита, как показано на фиг. 4. На особую антиокислительную активность сочетания AML с АТМ указывают данные о том, что подобный эффект не мог быть повторен, если AML сочетали с каждым из двух других статинов (мевастатином и ловастатином), как показано на фиг. 5. Результаты изучения in vivo указали на важную роль липофильных антиоксидантов в снижении заболеваемости и смертности вследствие сердечно-сосудистых заболеваний, в частности CAD. Частицы ЛПНП, которые более 9 устойчивы к окислительным повреждениям,проявляют сниженную цитотоксичность, в меньшей степени вмешиваются в процесс продукции окиси азота эндотелиального происхождения и не участвуют в образовании пенистых клеток (Diaz M.N., Frei В., Vita J.A., Keaney J.F.Engl. J. Med. 1997. Т. 337. С. 408-416). Было установлено, что добавление антиоксиданта увеличивает устойчивость ЛПНП к окислительной модификации и снижает цитотоксичность для клеток эндотелия (Belcher J.D., Balla J., Balla G. и др. Vitamin E, LDL, and endothelium. Brief oralThromb. 1993. Т. 13. С. 1779-1789). Липофильный антиоксидант пробукол ослаблял образование атеросклеротических бляшек у приматов,получавших с пищей холестерин, этот эффект коррелировал с повышением устойчивости ЛПНП к окислительным повреждениям (Sasahara M., Raines E.W., Chait А. и др. Inhibition ofatherosclerosis related to resistance of LDL to oxidation // J. Сlin. Invest. 1994. Т. 94. С. 155-164). Этот антиоксидант ингибировал образование повреждений у кроликов Watanabe с наследуемой гиперлипидемией (Watanabe hereditary hyperlipidemic, WHHL rabbits) - в хорошо известной животной модели атеросклероза без зависимости от эффектов снижения содержания холестерина (Carew Т.Е., Schwenke D.C., SteinbergProc. Natl. Acad. Sci. USA. 1987. Т. 84. С. 77257729). Помимо этих исследований на животных,при клиническом изучении с контролем плацебо было показано, что пробукол снижал на 47% рестеноз (повторное сужение просвета сосудов),предположительно вследствие его антиокислительного действия, у пациентов, у которых развивалась CAD после ангиопластической операции на коронарных артериях (Tardif J.C., CoteGroup. // N. Engl. J. Med. 1997. Т. 337. С. 365372). В независимых исследованиях было показано с помощью внутрисосудистого УЗИ, что пробукол, в отличие от антиокислительных витаминов, положительно влиял на восстановление сосудов у пациентов, перенесших ангиопластическую операцию на сосудах (Cote G., Tardif 10 Таким образом, обзор имеющихся данных предоставляет механистическое обоснование использования липофильных антиоксидантов для воздействия на воспалительные процессы,связанные с CAD. Повышая устойчивость ЛПНП и мембран клеток сосудов к окислительным повреждениям, препараты с антиокислительной активностью могут эффективно воздействовать на патологические изменения в сосудистой стенке в ходе атерогенеза. Эти процессы включают (но не ограничиваются ими) образование пенистых клеток, дисфункцию эндотелия и токсическое действие на него, адгезию лейкоцитов и тромбоцитов и артериальный ангиоспазм, вторичный по отношению к нарушению нормальной продукции окиси азота. Эти наблюдения на клетках подкрепляют данные эпидемиологического анализа, которые указывают на обратную связь между содержанием в сыворотке некоторых антиоксидантов и неблагоприятными последствиями коронарного заболеванияClin. Nutr. 1996. Т. 64. С. 190-196). Некоторые из этих эпидемиологических исследований продемонстрировали благоприятное воздействие витамина E - антиоксиданта с ограниченной способностью к подавлению окислительной модификации. Результаты настоящего исследования предсказывают, что сочетание AML и АТМ должно быть существенно более эффективным,чем витамин E, в ослаблении повреждений сосудов, связанных с CAD. 11 Синергическое антиокислительное действие сочетания амлодипина с гидроксилированным метаболитом аторвастатина на ЛНПН человека Антиокислительное действие AML и АТМ при их раздельном и сочетанном (комбинированном) применении было также исследовано на препаратах человеческих ЛПНП. Способность этих веществ ингибировать перекисное окисление ЛПНП была оценена in vitro после добавления меди (10,0 мкМ) путeм измерения количеств реагирующих с тиобарбитуратами веществ (ТБРВ) - маркеров перекисного окисления липидов. Фиг. 6 свидетельствует, что для скорости окисления ЛПНП характерна кинетика сигмоидного типа с начальной лаг-фазой, за которой следуют область резкого подъeма, а затем конечная область плато (Esterbauer H.,Gebicki J., Puhl H., Jurgens G. The role of lipidperoxidation and antioxidants in oxidative modifications of LDL. // Free Radic. Biol. Med. 1992. Т. 13. С. 341-390). После инкубации в течение 4 ч можно было ясно видеть различные эффекты этих соединений при концентрации 3,0 мкМ. В сравнении с перекисным окислением липидов в контроле (100% образования ТБРВ), образование ТБРВ при действии AML и АТМ составляло соответственно 93,36% и 65,67%. Однако при их сочетании образование ТБРВ составляло только 29,36% - этот уровень был достоверно ниже (р 0,01), чем при действии каждого из веществ порознь. Синергическое антиокислительное действие сочетания оставалось постоянным до момента времени 6 ч. Эти наблюдения предоставили дополнительное доказательство синергической активности, согласующейся с наблюдаемой в мембранных везикулах, поскольку сочетание лекарств обеспечивало уровень ингибирования, который существенно превышал их ожидаемый аддитивный эффект. Антиокислительная активность витамина Е в этих опытах была подобна наблюдавшейся активности одного АТМ. Химические механизмы синергической активности амлодипина и метаболита аторвастатина Синергическая антиокислительная активность, наблюдавшаяся для этого сочетания лекарств в ЛПНП и реконструированных липидных мембранах, позволяет предположить, что эти соединения непосредственно взаимодействуют друг с другом, чтобы удалять липидные радикалы. На основе термодинамических соображений (фиг. 7) высказано предположение, что АТМ реагирует с липидными радикалами быстрее (уравнение реакции 1), чем AML (уравнение реакции 2). Если для этих лекарств, добавленных в систему вместе, существуют только два пути реакции, то эффект их сочетанного (комбинированного) действия будет только аддитивным. Однако сочетание обоих соединений предоставляет возможность третьего пути(уравнение реакции 3) - это альтернатива, в пользу которой говорят результаты опытов по 12 перекисному окислению как в ЛПНП, так и в липидных мембранах. Комбинация путей 1 и 3 будет давать синергический эффект, поскольку обеспечивает более быстрый процесс, чем путь 2. Действительно, на основании полуэмпирических расчетов можно предположить, что реакция 3 является предпочтительным, экзотермическим процессом (Нf=-40,7 кДж/моль). Таким образом, наличие быстрого ингибитора (АТМ) позволяет более медленному ингибитору (AML) быстрее удалять свободные радикалы, чем если бы он реагировал с липидными радикалами самостоятельно. Эти взаимодействия описываются следующими тремя путями, где LOO представляет собой липидный радикал:(3) АТМ+AMLАТМ+AML БЫСТРЫЙ В результате этого синергизма между AML и АТМ, для дополнительного удаления липидных радикалов теперь имеется возвращаемый в повторный цикл метаболит. Вообще, различия между AML и АТМ в скоростях ингибирования частично основаны на рассчитанных энтальпиях для этих соединений и их соответствующих радикалов (фиг. 7). Чем меньше (т.е. более отрицательна) величина Hf, тем предпочтительнее удаление атома водорода, связанное с образованием радикала. Образовавшись, неспаренный радикал может быть стабилизирован в резонансных структурах. Молекулярные взаимодействия с мембранами амлодипина и метаболита аторвастатина Для исследования молекулярных взаимодействий с мембранами сочетаний AML и АТМ был использован метод малоугловой рентгеновской дифракции. Этот количественный метод обеспечивает возможность получения прямой информации о структуре липидного двойного слоя мембран в отсутствии и в присутствии лекарств. Ранее было отмечено, что AML, в сравнении с другими БКК, имеет высокое сродство к липидам мембран (Kр 103) в условиях атеросклероза (Mason R.P., Moisey D.M., Shajenko L.Pharmacol. 1992. Т. 41. С. 315-321). Особая липофильность AML объясняется его бифильной химической структурой, обеспечивающей удобное расположение молекулы в мембране, где она затем может препятствовать размножению свободных радикалов с помощью как биофизических, так и биохимических механизмов, как было подробно описано ранее в работах лаборатории заявителя (Mason R.P., Leeds P.R., Jacobcharged dihydropyridine calcium antagonist amlodipine. // J. Mol. Cell. Cardiol. 1999. Т. 31. С. 275281). В мембранах, не обогащенных холестерином, амлодипин ингибировал перекисное окисление липидов способом, который не могли воспроизвести другие БКК или каптоприл - ингибитор превращающего ангиотензин ферментаcalcium antagonist amlodipine. // J. Mol. Cell. Cardiol. 1999. Т. 31. С. 275-281). Подобным же образом, химическая структура метаболита аторвастатина имеет бифильные свойства, которые,как было ранее показано в лаборатории заявителя, могут обеспечить сильное взаимодействие лекарства с двойным липидным слоем мембранCardiol. 2000. Т. 35. С. 317 А). В этих исследованиях сочетание AML и АТМ добавляли к мембранным везикулам, реконструированным из холестерина и липида в мольном соотношении 0,5:1 (фиг. 8). Анализ образцов мембран методом рентгеновской дифракции дал воспроизводимые распределения сильных дифракционных рефлексов для представительных контрольных и содержащих лекарства образцов. В отсутствие лекарств общая ширина двойного слоя мембраны, включая поверхностную гидратную оболочку, составляла 55,5 при расстоянии 44 , разделяющем головные группы внутри двойного слоя. Добавление двух лекарств вместе при отношении лекарств к фосфолипиду, равном 1:15, в отличие от добавления лекарств порознь, приводило к заметным изменениям в структуре и организации фосфолипидного двойного слоя (фиг. 8). В присутствии сочетания лекарств общая ширина двойного слоя мембраны, включая поверхностную гидратную оболочку, снижалась до 53,5 при расстоянии 41 , разделяющем головные группы внутри двойного слоя. При раздельном добавлении лекарств ширина двойного слоя мембраны для мембран, содержащих AML и АТМ поодиночке, была равна соответственно 54,8 и 58,0(фиг. 9). Эти структурные наблюдения дают прямое доказательство того, что сочетание этих агентов иначе изменяет структуру липидных молекул, чем их действие порознь. Прямое вычитание профилей электронной плотности мембран (в координатах - расстояние 14 от центра двойного слоя впо оси абсцисс и число электронов/3 по оси ординат) продемонстрировало значительные различия в структуре липидов, которые могут быть связаны с присутствием лекарств (фиг. 8). Конкретнее, добавление сочетания лекарств приводило к уширенному увеличению электронной плотности, связанной с районом мембранного двойного слоя между верхней углеводородной сердцевиной и гидратированными головными группами, на расстоянии 11-21 от середины двойного слоя. Это большое увеличение электронной плотности, распространяющееся на расстояние 10 , связано с равновесным расположением лекарств в мембране. Этому изменению сопутствовал наблюдаемый эффект разупорядочивания, связанный с центральной углеводородной сердцевинной областью мембраны на расстоянии 0-11 . Это уменьшение электронной плотности вызвано увеличением молекулярного объeма вследствие внедрения молекул лекарств в область с высокой молекулярной плотностью вблизи поверхности раздела углеводородная сердцевина мембраны/вода. Таким образом, на основании этих данных можно заключить, что внедрение внутрь двойного слоя мембраны сочетания лекарств изменяет напряжение межмолекулярной упаковки фосфолипидных молекул,что по характеру сходно с результатом либо уменьшения содержания холестерина, либо повышения температуры образца (Tulenko T.N.,Chen M., Mason P.E., Mason R.P. Physical effectsas a unifying concept. // J. Membr. Biol. 1995. Т. 143. С. 51-63). Было установлено, что такие изменения биофизических свойств препятствуют проникновению свободных радикалов сквозь матрикс липидного двойного слоя (McLean L.R.,Hagaman K.A. Effect of lipid physical state on theAML и АТМ порознь приводили, в отличие от их сочетания, к иным изменениям в структуре мембран вследствие специфических взаимодействий с составляющими их фосфолипидными молекулами (фиг. 8 и 9). В то время как сочетание лекарств приводило к уменьшению полной ширины мембраны на 2 или 4%(р 0,01), один АТМ приводил к 5%-ному увеличению (р 0,01) ширины (2,5 ), тогда как одинAML не менял существенно размеры мембраны,в том числе расстояние внутри двойного слоя между головными группами. В сравнении с введением только AML, АТМ давал большее снижение электронной плотности в углеводородной сердцевине. Это влияние на структуру мембра 15 ны может способствовать его более высокой, по сравнению с AML, антиокислительной активности. Сочетание AML и АТМ воздействовало на новый центр взаимодействия с двойным липидным слоем мембраны, в дополнение к их раздельному расположению в мембране (фиг. 8). Таким образом, настоящее изобретение направлено на фармацевтическую композицию, содержащую амлодипин и соединение аторвастатина. Эти индивидуальные фармацевтические агенты могут входить в состав лекарственного средства в сочетании или порознь, в виде солей, форм и дозировок, дающих максимальный терапевтический эффект. Эта комбинированная терапия разработана для лечения различных патофизиологических проявлений заболевания сердечных артерий и связанного с ним сердечного заболевания,включая (но не ограничиваясь ими) гипертензию,гиперлипидемию, атеросклероз, артериосклероз,болезнь коронарных артерий, инфаркт миокарда,сердечную недостаточность вследствие закупорки сосудов, инсульт и стенокардию. В частности,такая комбинированная терапия может быть создана для понижения кровяного давления и концентрации липидов в организме, а также на преодоление патофизиологических результатов отсутствия их регуляции, включая (но не ограничиваясь ими) ослабление артерий и отложение бляшек. Действие этих индивидуальных агентов на эти различные процессы и события, связанные с заболеванием сердечных артерий и связанным с ним сердечным заболеванием, при использовании их в сочетании, может быть аддитивным и/или синергическим. Для специалистов в данной области должно быть очевидно, что возможны другие варианты осуществления, усовершенствования, детали и применения, согласующиеся с буквой и духом предшествующего описания и находящиеся в пределах границ этого патента и прилагаемой формулы. Экспериментальные методы Дилинолеоил-фосфатидилхолин (DLPC), 1 пальмитоил-2-олеоил-фосфатидилхолин (РОРС) и неэтерифицированный холестерин получали от фирмы Avanti Polar Lipids Inc. (Alabaster, AL,США) и хранили при -80 С. Аликвоты ЛПНП(L-2139) из человеческой плазмы получали от фирмы Sigma Chemical Co. (St. Louis, МО,США). Колонки с сефадексом G-25 M (PD-10) поставляла фирма Pharmacia Biotech Inc. (Piscataway, NJ, США). Безилат амлодипина получали от фирмы Pfizer Central Research (Groton,CT, США), а кальциевая соль аторвастатина(atorvastatin calcium) и его гидроксилированный метаболит были продуктами фирмы Parke Davis(Trolox - аналог витамина Е), ловастатин и мевастатин были продуктами фирмы Sigma 16 Анализ перекисного окисления липидов мембран Дозовую зависимость антиокислительной активности указанных агентов при раздельном и комбинированном применении исследовали в мембранах, обогащeнных полиненасыщенными жирными кислотами, приготовленных при мольном отношении холестерина к фосфолипиду 0,5:1 (Mason R.P., Walter M.F., Trumborecalcium antagonist arnlodipine. // J. Mol. Cell. Cardiol. 1999. Т. 31. С. 275-281). Липиды (дилинолеоилфосфатидилхолин и холестерин), использованные для этих проб, растворяли в хлороформе квалификации для ВЭЖХ (25,0 мг/мл). Аликвоты липидов (1,0 мг) добавляли в отдельные стеклянные пробирки (13 х 100 мм) и хлороформ удаляли барабанной сушкой под постоянным протоком газообразного N2. Липиды сушили в отсутствии или в присутствии раствора лекарства (лекарств) в этаноле. Остаток растворителя удаляли под вакуумом, защищая образцы от попадания света. Мембранные везикулы получали быстрым смешиванием высушенных липидов при комнатной температуре с последующим добавлением 1,0 мл солевого раствора,забуференного HEPES (оксиэтилпиперазинэтансульфоновой кислотой) (0,5 мМ HEPES и 154,0 мМ NaCl, pH 7,2). Конечная концентрация фосфолипида была равна 1,0 мг на 1 мл буфера,а конечная концентрация лекарств менялась от 10,0 нМдо 10,0 мкМ. Перекисное окисление липидов проводили при 37 С в водяной бане со встряхиванием без добавления экзогенных стимуляторов, как подробно описано ранее (Mason R.P., Walter M.F.,Trumbore M.W., Olmstead Jr. E.G., Mason P.E.Mol. Cell. Cardiol. 1999. Т. 31. С. 275-281). Через различные промежутки времени (24, 48, 65, 72 ч), перед добавлением 25 мкл 5,0 мМ раствора этилендиаминтетрауксусной кислоты (EDTA),отбирали аликвоту образца липида (от 10 до 100 мкл) и к пробе немедленно добавляли 20 мкл 35,0 мМ раствора бутилированного окситолуола(ВНТ), чтобы остановить реакцию перекисного окисления. Степень перекисного окисления липидов мембраны измеряли иодидным методом(CHOD-lodide), как было подробно описано ранее (EI-Saadani М., Esterbauer Н., el-Sayed М.,Goher М., Nassar A.Y., Jurgens G. A spectrophotometric assay for lipid peroxides in serum lipoproteins using a commercially available reagent. //l2+l-l3 17 В различные моменты времени отбирали аликвоту пробы мембран и добавляли ее к 1,0 мл окрашивающего реагента CHOD (Е.М. Science,Gibbstown, NJ, США), содержащего 20,0 мкМ ВНТ, 24,0 мкМ EDTA и 0,2% Тритон-Х. Затем образец закрывали фольгой и инкубировали в течение 2 ч защищeнным от света, после чего измеряли поглощение при 365 нм (=2,4 х 104 М-1 см-1). Параллельно опытным образцам отбирали в трeх повторах контрольные образцы для определения фона, которые содержали 76,7 мкл 0,652 мМHEPES, 20 мкл 5,0 мМ EDTA и 3,3 мкл дважды дистиллированной воды. Для каждой концентрации лекарства степень перекисного окисления липидов измеряли трижды, сравнивая ее с контрольными пробами, не содержащими лекарства. Статистическую достоверность данных оценивали по неспаренному t-тесту. Различия считали достоверными при р 0,05. Определение окисления ЛПНП Кроме липидных мембран, определяли антиокислительную активность AML и АТМ в человеческих ЛПНП. EDTA, содержавшуюся в образцах ЛПНП, полученных из человеческой плазмы, удаляли гель-хроматографией на колонках PD-10 с сефадексом G25-M; элюентом служил забуференный фосфатом раствор NaCl(50 мкг белка/мл) проинкубировали вместе с лекарством (3,0 мкМ) или без него в течение 30 мин при 37 С. После этого индуцировали окисление ЛПНП добавлением 10,0 мкМ CuSO4. Окисление ЛПНП, измеряемое по образованию реагирующих с тиобарбитуратами веществBiol. Chem. 1986. Т. 261. С. 1153-1157). Окисление ЛПНП, определeнное методами ТБРВ, имело кинетику типа сигмоидной кривой с начальной лаг-фазой, за которой следовали быстрое нарастание и завершающая фаза плато (Esterbauer H., Gebicki J., Puhl H., Jurgens G. The rolemodifications of LDL // Free Radic. Biol. Med. 1992. Т. 13. С. 341-390). Содержание белка в ЛПНП определяли по окрашиванию Кумасси с помощью наборов Coomassie Protein Plus фирмыquantities of protein utilizing the principle of protein-dye binding. // Anal. Biochem. 1976. Т. 72. С. 248-254). Анализ методом малоугловой рентгеновской дифракции Для прямого изучения молекулярных взаимодействий с мембранами AML, AT и АТМ был использован метод малоугловой рентгеновской дифракции. Использованные для этих проб липиды (1-пальмитоил-2-олеоил-фосфатидилхолин и холестерин) растворяли (10,0 мг/мл) в 18 хлороформе квалификации для ВЭЖХ. Из этих липидов получали мембранные везикулы таким же методом, как описано в опытах с перекисным окислением. Конечная концентрация фосфолипида составляла 5,0 мг в 1 мл буфера, а мольное отношение лекарства к фосфолипиду составляло 1:15. Для дифракционного анализа образцы мембран ориентировали, подвергая их центрифугированию, как описано ранее (ChesterD.W., Hetrbette L.G., Mason R.P., Joslyn A.F.,Triggle D.J., Koppel D.E. Diffusion of dihidropyridine calcium channel antagonists in cardiac sarcolemmal lipid multibilayers. // Biophys. J. 1987. Т. 52. С. 1021-1030). Вкратце, везикулы помещали в седиментационные ячейки, содержавшие подложку из алюминиевой фольги. Везикулы седиментировали в роторе SW-28 (Beckman Instruments, Fullerton, CA) при 35000 g в течение 1,5 ч при 5 С. После центрифугирования надосадочную жидкость сливали с осадка, затем пробы наносили на стеклянные подложки типа часовых стeкол. Пробы помещали в закупоренные контейнеры для поддержания в течение опытов постоянными относительной влажности и температуры, как было ранее подробно описаноA.F., Triggle D.J., Koppel D.E. Diffusion of dihidropyridine calcium channel antagonists in cardiac sarcolemmal lipid multibilayers. // Biophys. J. 1987. Т. 52. С. 1021-1030). Опыты по рентгеновской дифракции проводили, ориентируя образцы под косым углом к направлению падения коллимированного,фильтрованного через никель монохроматического пучка рентгеновских лучей (СuK=1,54), испускаемых микрофокусирующим генератором с вращающимся анодом высокой светимости (Rigaku Rotaflex RU-200, Danvers, MA,США). Линию пучка с фиксированной геометрией задавали одиночным покрытым никелем зеркалом Франка, определяя такое положение линии, где K1 и К 2 не разрешаются. Регистрацию рефлексов осуществляли с помощью одномерного детектора электронов с изменяемым положением (Innovative Technologies, Newburyport, MA, США), помещeнного на расстоянии 150 мм от образца. Для каждого меридионального дифракционного пика вводили поправку по Лоренцу и поправку на фон, как описано ранееand biological membranes. // Biophys. J. 1989. Т. 55. С. 769-778). Фазы для данных четвeртого порядка определяли по анализу выпуклости профиля (Moody M.F. X-ray diffraction pattern of// Science. 1963. Т. 142. С. 1173-1179). Преобразование Фурье для дифракционных данных проводили с помощью программы Origin (Microcal(b) эффективное количество гидроксилированного метаболита аторвастатина (АТМ),имеющего формулу(с) фармацевтически приемлемые агенты,дополняющие рецептуру, причeм эффективные количества амлодипина и АТМ скоординированы так, чтобы существенно ингибировать перекисное окисление липидов в человеческом липопротеине низкой плотности или в липидной мембране для достижения терапевтического эффекта. 2. Фармацевтическая композиция по п.1,отличающаяся тем, что амлодипин представлен в виде эффективного производного амлодипина. 3. Фармацевтическая композиция по п.2,отличающаяся тем, что терапевтически эффективное производное амлодипина содержит безилат амлодипина. 4. Фармацевтическая композиция по п.1,отличающаяся тем, что указанная фармацевтическая композиция снижает риск заболевания артерий и связанного с ним сердечного заболевания. 5. Фармацевтическая композиция по п.4,отличающаяся тем, что указанное заболевание артерий и связанное с ним сердечное заболевание выбрано из группы, состоящей из гипертензии, гиперлипидемии, атеросклероза, артериосклероза, болезни коронарных артерий, инфаркта миокарда, сердечной недостаточности вследствие закупорки сосудов, инсульта и стенокардии. 6. Фармацевтическая композиция по п.1,отличающаяся тем, что указанная фармацевтическая композиция снижает кровяное давление. 7. Фармацевтическая композиция по п.6,отличающаяся тем, что указанная фармацевтическая композиция снижает кровяное давление до уровня, согласующегося с пониженным риском заболевания артерий и связанного с ним сердечного заболевания. 8. Фармацевтическая композиция по п.6,отличающаяся тем, что указанная фармацевтическая композиция снижает кровяное давление до уровня, статистически эквивалентного нормальному уровню. 9. Фармацевтическая композиция по п.1,отличающаяся тем, что указанная фармацевти 004435 20 ческая композиция снижает концентрацию липидов в организме. 10. Фармацевтическая композиция по п.9,отличающаяся тем, что указанная фармацевтическая композиция снижает концентрацию липидов в организме до уровня, согласующегося с пониженным риском заболевания артерий и связанного с ним сердечного заболевания. 11. Фармацевтическая композиция по п.9,отличающаяся тем, что указанная фармацевтическая композиция снижает концентрацию липидов в организме до уровня, статистически эквивалентного нормальному уровню. 12. Фармацевтическая композиция по п.1,отличающаяся тем, что указанная фармацевтическая композиция снижает кровяное давление и концентрацию липидов в организме. 13. Фармацевтическая композиция по п.12,отличающаяся тем, что указанная фармацевтическая композиция снижает кровяное давление и концентрацию липидов в организме до уровня, согласующегося с пониженным риском заболевания артерий и связанного с ним сердечного заболевания. 14. Фармацевтическая композиция по п.12,отличающаяся тем, что указанная фармацевтическая композиция снижает кровяное давление и концентрацию липидов в организме до уровня, статистически эквивалентного нормальному уровню. 15. Фармацевтическая композиция по п.1,отличающаяся тем, что указанная фармацевтическая композиция сопутствующим образом снижает кровяное давление и концентрацию липидов в организме. 16. Фармацевтическая композиция по п.15,отличающаяся тем, что указанная фармацевтическая композиция сопутствующим образом снижает кровяное давление и концентрацию липидов в организме до уровня, согласующегося с пониженным риском заболевания артерий и связанного с ним сердечного заболевания. 17. Фармацевтическая композиция по п.15,отличающаяся тем, что указанная фармацевтическая композиция сопутствующим образом снижает кровяное давление и концентрацию липидов в организме до уровня, статистически эквивалентного нормальному уровню. 18. Фармацевтическая композиция по п.1,отличающаяся тем, что указанная фармацевтическая композиция синергически снижает кровяное давление и концентрацию липидов в организме. 19. Фармацевтическая композиция по п.18,отличающаяся тем, что указанная фармацевтическая композиция синергически снижает кровяное давление и концентрацию липидов в организме до уровня, согласующегося с пониженным риском заболевания артерий и связанного с ним сердечного заболевания. 20. Фармацевтическая композиция по п.18,отличающаяся тем, что указанная фармацевти 21 ческая композиция синергически снижает кровяное давление и концентрацию липидов в организме до уровня, статистически эквивалентного нормальному уровню. 21. Фармацевтическая композиция по любому из пп.15-17 и 18-20, отличающаяся тем,что снижение сопутствующим образом кровяного давления и концентрации липидов в организме является, по меньшей мере частично, результатом пониженного окисления липидов. 22. Фармацевтическая композиция, содержащая(а) терапевтически эффективное количество сочетания амлодипина и гидроксилированного метаболита аторвастатина, имеющего формулу(b) фармацевтически приемлемые агенты,дополняющие рецептуру,причм указанная фармацевтическая композиция снижает кровяное давление и концентрацию липидов в организме, по меньшей мере частично, в результате понижения окисления липидов. 23. Фармацевтическая композиция по п.22,отличающаяся тем, что амлодипин содержит терапевтически эффективное производное амлодипина. 24. Фармацевтическая композиция по п.23,отличающаяся тем, что терапевтически эффективное производное амлодипина содержит безилат амлодипина. 25. Фармацевтическая композиция по п.22,отличающаяся тем, что указанная фармацевтическая композиция снижает риск заболевания артерий и связанного с ним сердечного заболевания. 26. Фармацевтическая композиция по п.25,отличающаяся тем, что указанное заболевание артерий и связанное с ним сердечное заболевание выбрано из группы, состоящей из гипертензии, гиперлипидемии, атеросклероза, артериосклероза, болезни коронарных артерий, инфаркта миокарда, сердечной недостаточности вследствие закупорки сосудов, инсульта и стенокардии. 27. Фармацевтическая композиция по п.22,отличающаяся тем, что указанная фармацевтическая композиция снижает кровяное давление и концентрацию липидов в организме до уровня, согласующегося с пониженным риском заболевания артерий и связанного с ним сердечного заболевания. 22 28. Фармацевтическая композиция по п.22,отличающаяся тем, что указанная фармацевтическая композиция снижает кровяное давление и концентрацию липидов в организме до уровня, статистически эквивалентного нормальному уровню. 29. Способ лечения заболевания артерий и связанного с ним сердечного заболевания,включающее ингибирование образования перекисей липидов в липопротеинах низкой плотности (ЛПНП) и липидных мембранах, посредством введения терапевтически эффективного количества сочетания амлодипина и гидроксилированного метаболита аторвастатина, имеющего формулу 30. Способ п.29, отличающийся тем, что амлодипин содержит эффективное производное амлодипина. 31. Способ по п.30, отличающийся тем, что эффективное производное амлодипина содержит безилат амлодипина. 32. Способ по п.29, отличающийся тем, что указанное заболевание артерий и связанное с ним сердечное заболевание выбрано из группы,состоящей из гипертензии, гиперлипидемии,атеросклероза, артериосклероза, болезни коронарных артерий, инфаркта миокарда, сердечной недостаточности вследствие закупорки сосудов,инсульта и стенокардии. 33. Способ по п.29, отличающийся тем, что амлодипин и метаболит аторвастатина вводят в одном и том же лекарственном средстве. 34. Способ по п.29, отличающийся тем, что амлодипин и метаболит аторвастатина вводят как раздельные лекарственные средства. 35. Способ по п.29, отличающийся тем, что амлодипин и метаболит аторвастатина вводят одновременно. 36. Способ по п.29, отличающийся тем, что амлодипин и метаболит аторвастатина вводят в различные моменты времени. 37. Способ снижения кровяного давления и концентрации липидов в организме, включающий ингибирование окисления липидов посредством введения терапевтически эффективного для этих целей количества сочетания амлодипина и гидроксилированного метаболита аторвастатина, имеющего формулу 38. Способ п.37, отличающийся тем, что амлодипин содержит терапевтически эффективное производное амлодипина. 39. Способ по п.38, отличающийся тем, что терапевтически эффективное производное амлодипина содержит безилат амлодипина. 40. Способ по п.37, отличающийся тем, что амлодипин и метаболит аторвастатина вводят в одном и том же лекарственном средстве. 41. Способ по п.37, отличающийся тем, что амлодипин и метаболит аторвастатина вводят как раздельные лекарственные средства. 42. Способ по п.37, отличающийся тем, что амлодипин и метаболит аторвастатина вводят одновременно. 43. Способ по п.37, отличающийся тем, что амлодипин и метаболит аторвастатина вводят в различные моменты времени. 44. Способ по п.37, отличающийся тем, что указанная фармацевтическая композиция снижает кровяное давление и концентрацию липидов в организме до уровня, согласующегося с пониженным риском заболевания артерий и связанного с ним сердечного заболевания. 45. Способ по п.37, отличающийся тем, что указанное заболевание артерий и связанное с ним сердечное заболевание выбрано из группы,состоящей из гипертензии, гиперлипидемии,атеросклероза, артериосклероза, болезни коронарных артерий, инфаркта миокарда, сердечной недостаточности вследствие закупорки сосудов,инсульта и стенокардии. 46. Способ по п.37, отличающийся тем, что указанная фармацевтическая композиция снижает кровяное давление и концентрацию липидов в организме до уровня, статистически эквивалентного нормальному уровню. 47. Способ по любому из пп.37-46, отличающийся тем, что снижение кровяного давления и концентрации липидов в организме является, по меньшей мере частично, результатом пониженного окисления липидов. 48. Способ синергического ингибирования окисления липидов, включающий введение терапевтически эффективного количества сочетания амлодипина и гидроксилированного метаболита аторвастатина, имеющего формулу 49. Способ п.48, отличающийся тем, что амлодипин содержит терапевтически эффективное производное амлодипина. 50. Способ по п.49, отличающийся тем, что терапевтически эффективное производное амлодипина содержит безилат амлодипина. 51. Способ по п.48, отличающийся тем, что амлодипин и метаболит аторвастатина вводят в одном и том же лекарственном средстве. 52. Способ по п.48, отличающийся тем, что амлодипин и метаболит аторвастатина вводят как раздельные лекарственные средства. 53. Способ по п.48, отличающийся тем, что амлодипин и метаболит аторвастатина вводят одновременно. 54. Способ по п.48, отличающийся тем, что амлодипин и метаболит аторвастатина вводят в различные моменты времени. 55. Способ по п.48, отличающийся тем, что указанная фармацевтическая композиция ингибирует окисление липидов до уровня, согласующегося с пониженным риском заболевания артерий и связанного с ним сердечного заболевания. 56. Способ по п.55, отличающийся тем, что указанное заболевание артерий и связанное с ним сердечное заболевание выбрано из группы,состоящей из гипертензии, гиперлипидемии,атеросклероза, артериосклероза, болезни коронарных артерий, инфаркта миокарда, сердечной недостаточности вследствие закупорки сосудов,инсульта и стенокардии. 57. Фармацевтическая композиция, содержащая(a) терапевтически эффективное количество амлодипина;(b) терапевтически эффективное количество гидроксилированного метаболита аторвастатина, имеющего формулу(с) фармацевтически эффективные агенты,дополняющие рецептуру. 58. Фармацевтическая композиция по п.57,отличающаяся тем, что амлодипин содержит 25 терапевтически эффективное производное амлодипина. 59. Фармацевтическая композиция по п.58,отличающаяся тем, что терапевтически эффективное производное амлодипина содержит безилат амлодипина. 60. Способ снижения кровяного давления и концентрации липидов в организме, включающий введение терапевтически эффективного количества сочетания амлодипина и гидроксилированного метаболита аторвастатина, имеющего формулу 61. Способ по п.60, отличающийся тем, что указанная фармацевтическая композиция синергически снижает кровяное давление и концентрацию липидов в организме до уровня, статистически эквивалентного нормальному уровню. 62. Способ по п.61, отличающийся тем, что синергическое снижение кровяного давления и концентрации липидов в организме является, по меньшей мере частично, результатом пониженного окисления липидов.
МПК / Метки
МПК: A61P 9/00, A61K 31/40
Метки: комбинированной, метаболита, аторвастатина, амлодипина, терапии, синергическое, основа, действие
Код ссылки
<a href="https://eas.patents.su/16-4435-sinergicheskoe-dejjstvie-amlodipina-i-metabolita-atorvastatina-kak-osnova-dlya-kombinirovannojj-terapii.html" rel="bookmark" title="База патентов Евразийского Союза">Синергическое действие амлодипина и метаболита аторвастатина как основа для комбинированной терапии</a>
Предыдущий патент: Кристаллическая форма ii линезолида
Следующий патент: Замещенные 3-цианохинолины в качестве ингибиторов протеинтирозинкиназ
Случайный патент: Способ разупрочнения материалов кристаллической структуры и устройство для его осуществления












