Ингибиторы mpo для лечения множественной системной атрофии
Формула / Реферат
1. Применение 1-(2-изопропоксиэтил)-2-тиоксо-1,2,3,5-тетрагидропирроло[3,2-d]пиримидин-4-она или его фармацевтически приемлемой соли для изготовления лекарственного средства для лечения множественной системной атрофии.
2. Применение по п.1, где суточная доза 1-(2-изопропоксиэтил)-2-тиоксо-1,2,3,5-тетрагидропирроло[3,2-d]пиримидин-4-она или его фармацевтически приемлемой соли находится в диапазоне от 1 до 1000 мг.
Текст
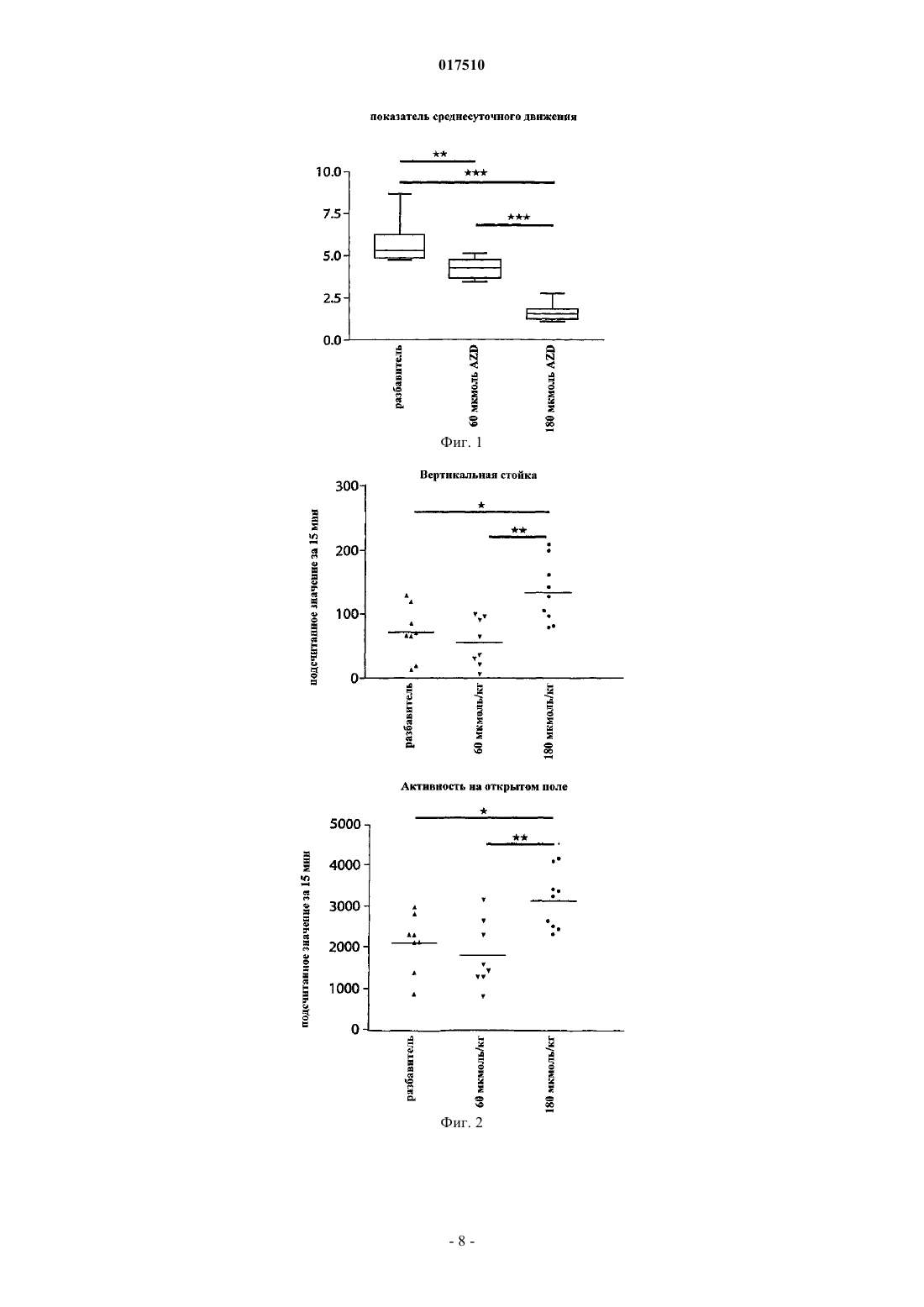
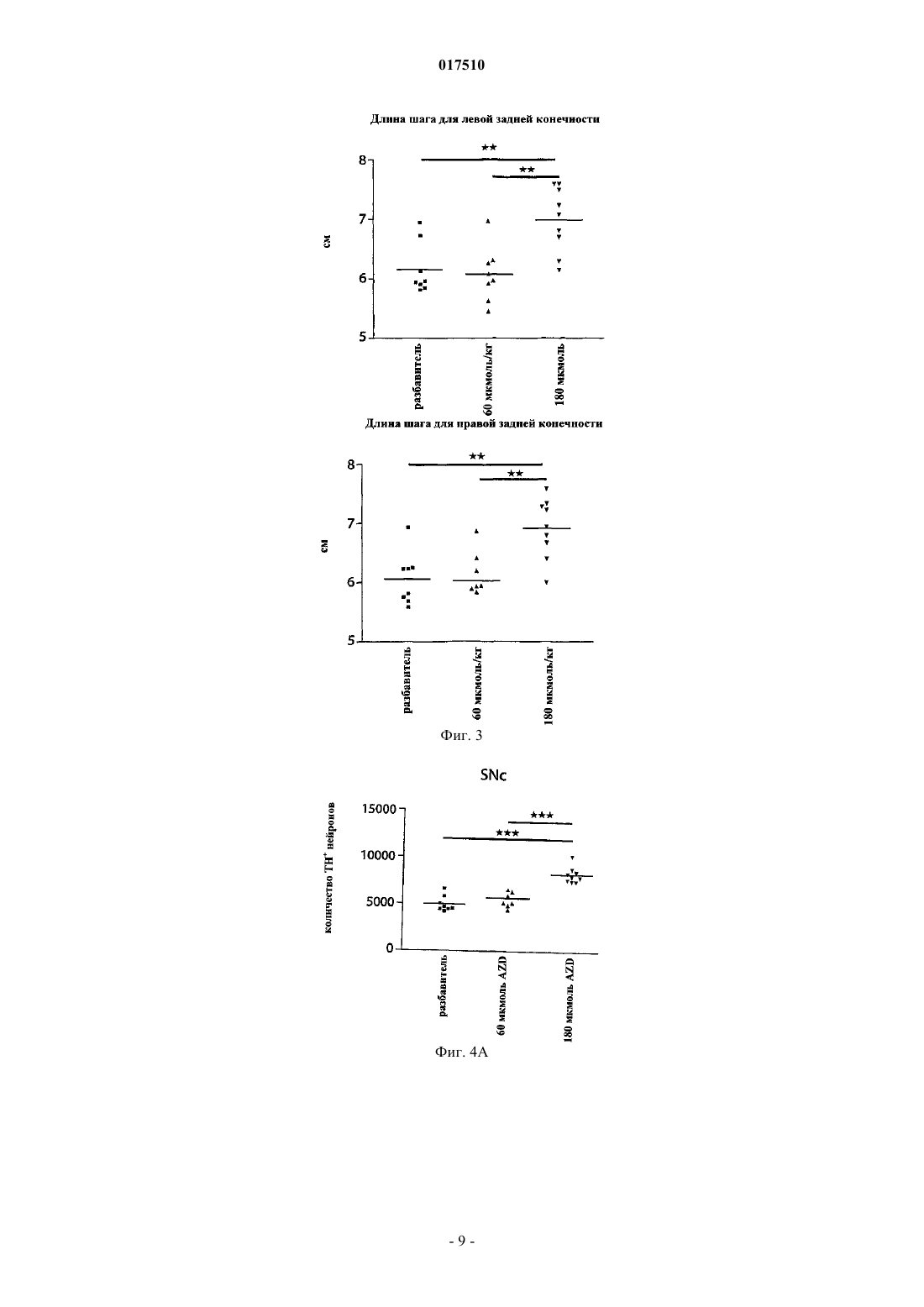
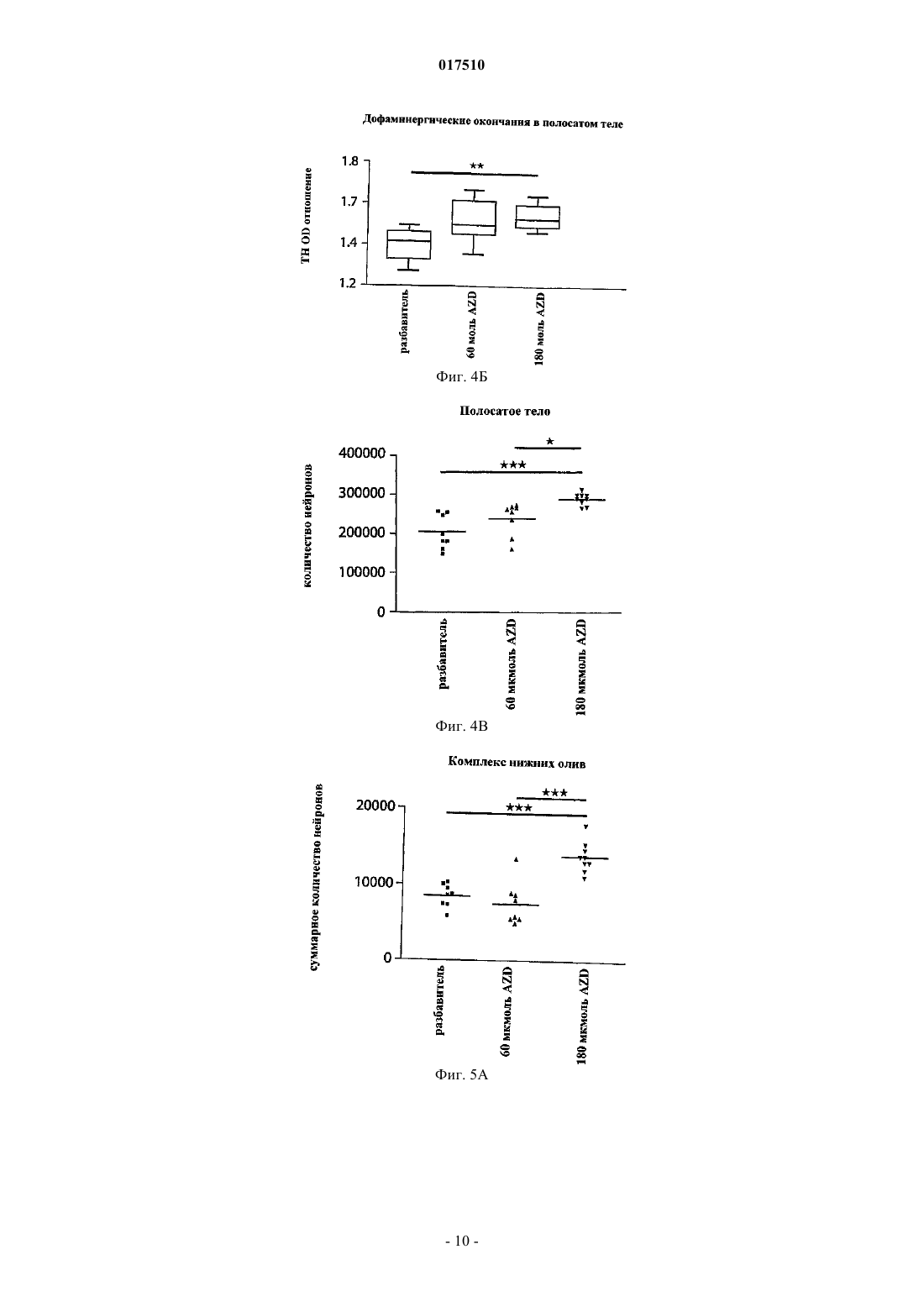
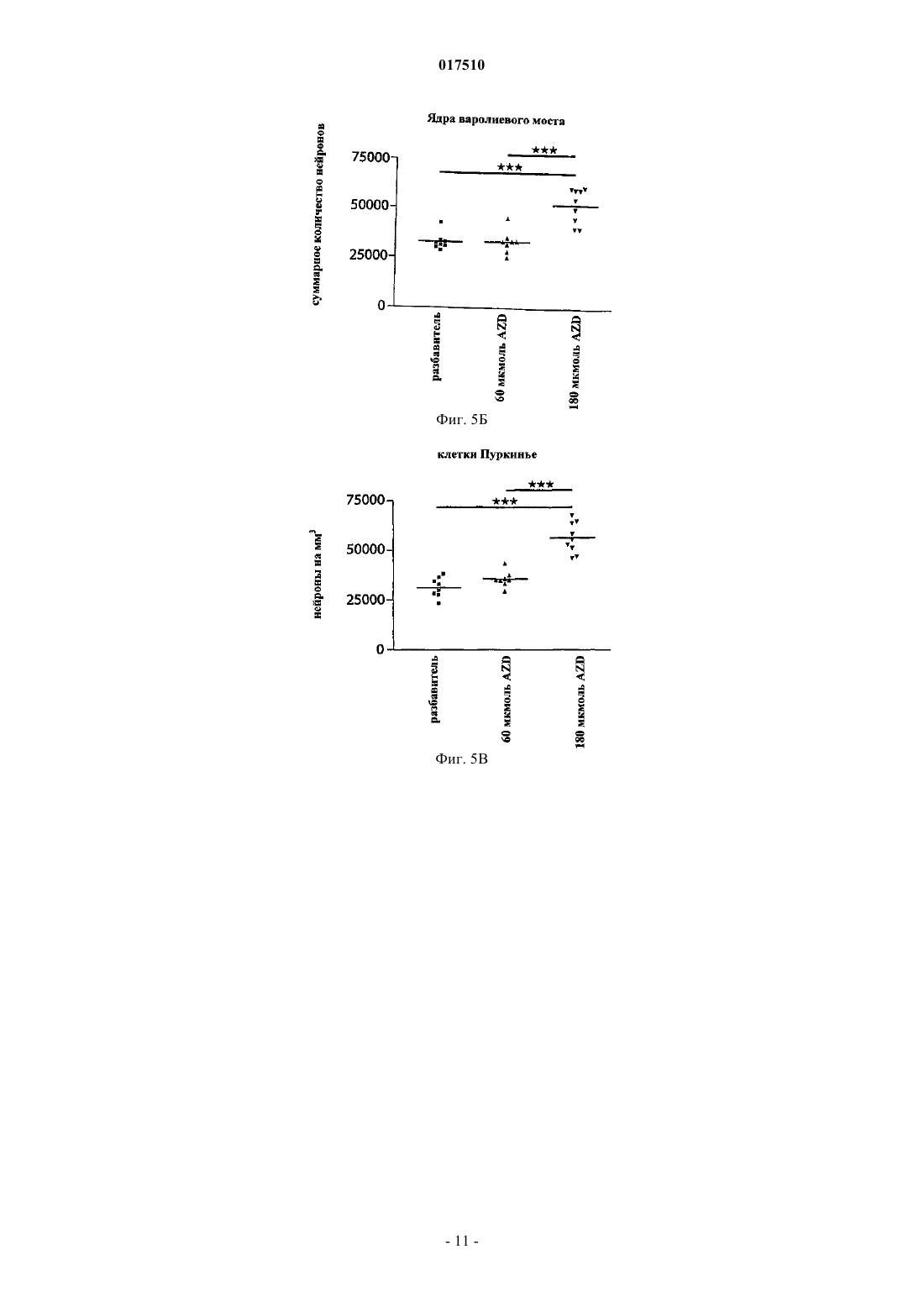
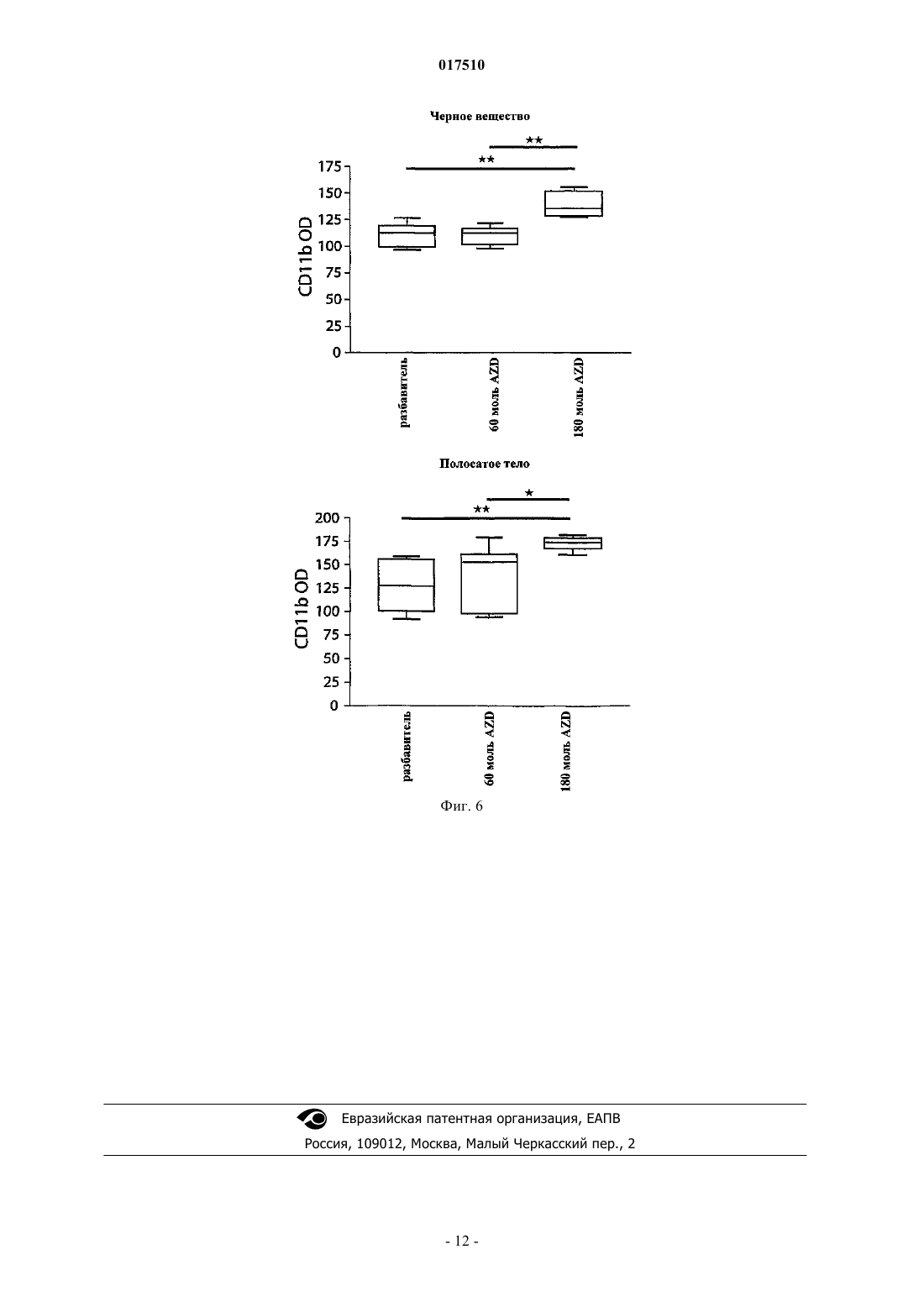
ИНГИБИТОРЫ MPO ДЛЯ ЛЕЧЕНИЯ МНОЖЕСТВЕННОЙ СИСТЕМНОЙ АТРОФИИ[3,2-d]пиримидин-4-она в качестве ингибитора миелопероксидазы для лечения множественной системной атрофии. 017510 Область изобретения Настоящее изобретение относится к применению ингибитора миелопероксидазы (MPO) или его фармацевтически приемлемых солей для лечения множественной системной атрофии (MSA). Предшествующий уровень техники Миелопероксидаза (MPO) представляет собой гемсодержащий фермент, обнаруживаемый преимущественно в полиморфно-ядерных лейкоцитах (PMN). MPO является одним из членов многообразного белкового семейства пероксидаз млекопитающих, которое также включает эозинофильную пероксидазу,тиреоидную пероксидазу, слюнную пероксидазу, лактопероксидазу, простагландин-Н-синтазу и др. Зрелый фермент представляет собой димер, состоящий из идентичных половинок. Каждая половина молекулы содержит присоединенный ковалентной связью гем, который проявляет необычные спектральные свойства, ответственные за характерный зеленый цвет MPO. В результате расщепления дисульфидного мостика, связывающего две половинки MPO, получается полуфермент, проявляющий спектральные и каталитические свойства, не отличающиеся от свойств целого фермента. Фермент использует пероксид водорода для окисления хлорида до хлорноватистой кислоты. Другие галогениды и псевдогалогениды(типа тиоцианата) также являются физиологическими субстратами для MPO.PMN особенно важны для борьбы с инфекциями. Эти клетки содержат MPO, обладающую документально подтвержденным бактерицидным действием. PMN действуют неспецифично посредством фагоцитоза с целью поглощения микроорганизмов, заключают их в вакуоли, называемые фагосомами,которые сливаются с гранулами, содержащими миелопероксидазу, с образованием фаголизосом. В фаголизосомах ферментативная активность миелопероксидазы приводит к образованию хлорноватистой кислоты, мощного бактерицидного соединения. Сама по себе хлорноватистая кислота является окислителем и наиболее "жадно" взаимодействует с тиолами и простыми тиоэфирами, а также превращает амины в хлорамины и хлорирует ароматические аминокислоты. Макрофаги представляют собой большие фагоцитарные клетки, которые подобно PMN способны к фагоцитозу микроорганизмов. Макрофаги могут генерировать пероксид водорода и в результате активации также продуцировать миелопероксидазу. MPO и пероксид водорода также могут высвобождаться наружу из клеток, где в результате взаимодействия с хлоридом может индуцироваться повреждение соседней ткани. Связь миелопероксидазной активности с заболеванием подразумевалась для неврологических заболеваний с нейровоспалительным ответом, включая рассеянный склероз, болезнь Альцгеймера и болезнь Паркинсона.MPO-позитивные клетки в большой степени присутствуют в кровотоке и в ткани, подвергающейся воспалению. Более конкретно, MPO-содержащие макрофаги, микроглия, астроциты и/или нейроны были документально подтверждены в ЦНС (центральной нервной системе) во время заболевания: рассеянного склероза (Nagra R.M. et al., Journal of Neuroimmunology. 1997, 78(1-2): 97-107; Marik C., et al., Brain. 2007; 130: 2800-15; Gray E., et al., Brain Pathology; 18: 86-95), болезни Паркинсона (Choi D.-K. et al., J. Neurosci. 2005, 25(28): 6594-600) и болезни Альцгеймера (Reynolds W.F., et al., Experimental Neurology. 1999; 155:31-41; Green P.S. et al., Journal of Neurochemistry. 2004, 90(3): 724-33). Предполагается, что некоторые аспекты хроническим образом продолжающегося воспаления приводят к огромной деструкции, при которой важную роль играют агенты реакций с участием MPO. Фермент высвобождается как во внеклеточную область, так и в фаголизосомы в нейтрофилах(Hampton M.B., Kettle A.J., Winterbourn C.C., Blood. 1998, 92(9): 3007-17). Необходимым условием для проявления активности MPO является наличие пероксида водорода, генерируемого под действиемNADPH (никотинамидадениндинуклеотидфосфат, восстановленная форма)-оксидазы и последующей супероксид-дисмутации. Окисленный фермент способен использовать большой избыток разных субстратов, из которых наиболее признанным является хлорид. В результате этой реакции образуется сильный нерадикальный окислитель - хлорноватистая кислота (HOCl). HOCl очень эффективно окисляет серосодержащие аминокислоты типа цистеина и метионина (Peskin A.V., Winterbourn C.C., Free Radical Biologyand Medicine. 2001, 30(5): 572-9). Кроме того, с аминогруппами она образует хлорамины как в белках, так и в других биомолекулах (Peskin A.V. et al., Free Radical Biology and Medicine. 2004, 37(10): 1622-30). Она хлорирует фенолы (типа тирозина) (Hazen S.L. et al., Mass Free Radical Biology and Medicine. 1997, 23(6): 909-16) и ненасыщенные связи в липидах (Albert C.J. et al., J. Biol. Chem. 2001, 276(26): 23733-41), окисляет железные центры (Rosen H., Klebanoff S.J., Journal of Biological Chemistry 1982, 257(22): 13731-354) и перекрестно сшивает белки (Fu X., Mueller D.M., Heinecke J.W., Biochemistry. 2002, 41(4): 1293-301). Различные соединения, представляющие собой ингибиторы MPO, раскрыты в WO 01/85146, J. Heterocyclic Chemistry, 1992, 29, 343-354, J. Chem. Soc., 1962, 1863, WO 03/089430 и WO 2006/062465. Множественная системная атрофия (MSA). Множественная системная атрофия (MSA) представляет собой нейродегенеративное расстройство,проявляющееся с вегетативным нарушением и двигательной недостаточностью в результате нечувствительного к L-dopa паркинсонизма, мозжечковой атаксии и пирамидальных симптомов. Гистологически,существует потеря нейронов в полосатом теле, компактной части черного вещества, мозжечке, мосте,нижних оливах и интермедиолатеральном столбе спинного мозга. Глиальная патология включает астроглиоз, микроглиальную активацию и -синуклеин, содержащий олигодендроглиальные цитоплаз-1 017510 мические включения. Явно выраженное нейровоспаление, которому содействует активированная микроглия, так же как и цитоплазматические включения - тельца, содержащие агрегированные и окислительномодифицированные белки, делает интересным рассмотрение значительного вклада MPO-активности в прогрессирующую нейродегенерацию, которая характеризует MSA-патологию. Подтверждение в пользу ингибирования MPO при патологии MSA-типа можно получить путем использования преклинических моделей заболевания для MSA, подобных трансгенным мышам с олигодендроглиальной сверхпродукцией -синуклеина человека с добавлением токсина, подобного 3-нитропропионовой кислоте, или без него. Болезнь Гентингтона (HD). Болезнь Гентингтона (HD) представляет собой наследственное прогрессирующее нейродегенеративное расстройство, клинически характеризуемое двигательными и психическими нарушениями, а патологически - нейронной потерей и глиозом (реактивным астроцитозом), в частности в полосатом теле и коре головного мозга. HD представляет собой нейродегенеративное расстройство, вызываемое экспансией повтора CAG в гене HD, кодирующего полиглутамин в белке гентингтине. Объяснения для механизмов патологии включают стресс, нарушенный энергетический метаболизм и взаимодействия аномальный белок-белок. Такие механизмы возможны для связывания с активностью MPO, что можно было бы подтвердить через ее сверхпродукцию, наблюдаемую в патологической HD-ткани (Choi D.-K. et al., J.Neurosci. 2005; 25(28): 6594-600). Подтверждение в пользу ингибирования MPO при патологии HD-типа можно получить путем использования преклинических моделей заболевания для HD. Такими моделями могут быть мыши или крысы, обработанные митохондриальными токсинами, подобными 3-нитропропионовой кислоте или малонату (Matthews R.T. et al., J. Neurosci. 1998; 18:156-63). Полезными моделями также могли бы быть трансгенные мыши, экспрессирующие белки-мутанты гентингтина с добавлением токсина, подобного 3-нитропропионовой кислоте, или без него (Bogdanov M.B. et al., J. Neurochem. 1998; 71:2642-44). Существует большая неудовлетворенная потребность в лекарственных средствах, которые можно применять для лечения болезни Гентингтона, для лечения множественной системной атрофии и/или для нейропротекции. Краткое изложение сущности изобретения Обнаружено, что ингибиторы MPO можно применять для лечения множественной системной атрофии (MSA). Поэтому настоящее изобретение направлено на применение ингибитораMPO 1-(2-изопропоксиэтил)-2-тиоксо-1,2,3,5-тетрагидропирроло[3,2-d]пиримидин-4-она или его фармацевтически приемлемой соли для изготовления лекарственного средства для лечения множественной системной атрофии (MSA). В одном воплощении суточная доза 1-(2-изопропоксиэтил)-2-тиоксо-1,2,3,5-тетрагидропирроло[3,2d]пиримидин-4-она или его фармацевтически приемлемой соли находится в диапазоне от 1 до 1000 мг. Формулировка "множественная системная атрофия", используемая в данном описании, означает вызывающее смерть прогрессирующее нейродегенеративное расстройство. Она определена как спорадическая альфа-синуклеинопатия с вегетативной дистонией и паркинсоновской и/или мозжечковой двигательной недостаточностью. Термин "проведение лечения", используемый в данном описании, относится к реверсированию, облегчению, замедлению или ингибированию прогрессирования или предотвращению расстройства или состояния, в отношении которых такой термин используют, или одного или более чем одного симптома такого расстройства или состояния. Термин "лечение", используемый в данном описании, относится к акту "проведения лечения", как оно определено в данном описании. Фармацевтически приемлемые соли могут быть полезны при получении соединений по настоящему изобретению вследствие их применения в медицине. Подходящие фармацевтически приемлемые соли описанных здесь соединений включают соли присоединения кислоты, которые могут, например, быть образованы путем смешения раствора соединения по настоящему изобретению с раствором фармацевтически приемлемой кислоты, такой как соляная кислота, серная кислота, метансульфоновая кислота и фумаровая кислота. Кроме того, в тех случаях, когда соединения имеют кислотную группировку, их подходящие фармацевтически приемлемые соли могут включать соли щелочных металлов, например соли натрия или калия; соли щелочно-земельных металлов, например соли кальция или магния; и соли, образованные с подходящими органическими лигандами, например соли четвертичного аммония. Выражение "фармацевтически приемлемые соли" включает как фармацевтически приемлемые соли присоединения кислоты, так и фармацевтически приемлемые катионные соли. Выражение "фармацевтически приемлемые катионные соли" предназначено для определения таких солей, как соли щелочных металлов (например, натрия и калия), соли щелочно-земельных металлов (например, кальция и магния),соли алюминия, соли аммония и соли с органическими аминами, такими как бензатин(N,N'-дибензилэтилендиамин) и холин, но не ограничивается ими. Выражение "фармацевтически приемлемые соли присоединения кислоты" предназначено для определения таких солей, как гидрохлорид, гидробромид и сульфат, но не ограничивается ими.-2 017510 Фармацевтически приемлемые катионные соли, содержащие свободные карбоновые кислоты, могут быть легко получены путем взаимодействия формы свободной кислоты с подходящим основанием. Типичные основания представляют собой гидроксид натрия, метоксид натрия и этоксид натрия. Фармацевтически приемлемые соли присоединения кислоты, содержащие свободные аминные группы, могут быть легко получены путем взаимодействия формы свободного основания с подходящей кислотой. Применение оптических изомеров ингибиторов MPO также находится в объеме настоящего изобретения. Ингибиторы MPO, имеющие асимметрический атом углерода, представляют собой хиральные соединения, и такие ингибиторы MPO в зависимости от присутствия асимметрических атомов могут существовать в виде смесей изомеров, в частности рацематов, или в виде чистых изомеров, таких как конкретные энантиомеры. Фармацевтические композиции. Описанные здесь ингибиторы MPO или их фармацевтически приемлемые соли можно вводить обычным способом, например перорально, парентерально, трансмукозально (например, подъязычно или посредством трансбуккального введения), местно, трансдермально, ректально, путем ингаляции (например, назальной ингаляции или ингаляции глубоко в легкие). Парентеральное введение включает внутривенное, внутриартериальное, внутрибрюшинное, подкожное, внутримышечное, интратекальное введение или путем технических приемов при высоком давлении, но не ограничивается ими. Ингибиторы MPO или их фармацевтически приемлемые соли для трансбуккального введения могут быть в форме таблеток или лепешек, приготовленных традиционным способом. Например, таблетки и капсулы для перорального введения могут содержать традиционные эксципиенты, такие как связывающие агенты (например, сироп, гуммиарабик, желатин, сорбит, трагакант, клейкое вещество крахмала или поливинилпирролидон), наполнители (например, лактозу, сахар, микрокристаллическую целлюлозу,маисовый крахмал, фосфат кальция или сорбит), смазывающие вещества (например, стеарат магния,стеариновую кислоту, тальк, полиэтиленгликоль или диоксид кремния), разрыхлители (например, картофельный крахмал или натрия крахмала гликолят) или увлажняющие агенты (например, лаурилсульфат натрия). Таблетки могут быть покрыты в соответствии со способами, хорошо известными в данной области. Такие препараты также могут быть приготовлены в виде суппозиториев для ректального введения,например, содержащих традиционные суппозиторные основы, такие как масло какао или другие глицериды. Обычно композиции для ингаляции, содержащие ингибиторы MPO или их фармацевтически приемлемые соли, могут быть предоставлены в форме раствора, суспензии или эмульсии, которые можно вводить в виде сухого порошка или в виде аэрозоля с использованием традиционного пропеллента, такого как дихлордифторметан или трихлорфторметан. Типичные местные и трансдермальные препараты содержат традиционные водные или неводные разбавители, например глазные капли, крема, мази, лосьоны и пасты, или существуют в форме содержащих лекарственное средство пластыря, повязки или мембраны. Кроме того, описанные здесь ингибиторы MPO или их фармацевтически приемлемые соли могут быть приготовлены для парентерального введения путем инъекции или длительной инфузии. Композиции для инъекции могут быть в форме суспензий, растворов или эмульсий в масляных или водных разбавителях и могут содержать такие агенты, используемые для приготовления композиций, как суспендирующие, стабилизирующие и/или диспергирующие агенты. Альтернативно, активный ингредиент может быть в форме порошка для восстановления стабильным разбавителем (например, стерильной, апирогенной водой) перед применением. Ингибиторы MPO или их фармацевтически приемлемые соли по настоящему изобретению также могут быть приготовлены в виде препарата депо. Такие композиции длительного действия можно вводить путем имплантации (например, подкожно или внутримышечно) или путем внутримышечной инъекции. Соответственно, соединения по настоящему изобретению могут быть приготовлены с подходящими полимерными или гидрофобными материалами (например, эмульсия в подходящем масле), ионообменными смолами или в виде труднорастворимых производных (например, в виде труднорастворимой соли). Фармацевтическая композиция для перорального введения, содержащая ингибиторы MPO или их фармацевтически приемлемые соли по настоящему изобретению, может принимать форму растворов,суспензий, таблеток, пилюль, капсул, порошков и т.п. Таблетки, содержащие различные эксципиенты,такие как цитрат натрия, карбонат кальция и фосфат кальция, применяют наряду с различными разрыхлителями, такими как крахмал, предпочтительно картофельный крахмал или крахмал из тапиоки, и некоторые комплексные силикаты, вместе со связывающими агентами, такими как поливинилпирролидон,сахароза, желатин и гуммиарабик. Дополнительно, для формирования таблеток можно использовать смазывающие агенты, такие как стеарат магния, лаурилсульфат натрия и тальк. Твердые композиции подобного типа также используют в качестве наполнителей в мягких и твердых заполненных желатиновых капсулах; предпочтительные материалы в таком контексте также включают лактозу или молочный сахар,а также полиэтиленгликоли с высокой молекулярной массой.-3 017510 Альтернативно, описанные здесь ингибиторы MPO или их фармацевтически приемлемые соли можно включать в пероральные жидкие препараты, такие как водные или масляные суспензии, растворы,эмульсии, сиропы или эликсиры, например. Более того, композиции, содержащие эти соединения, могут быть представлены в виде сухого продукта для восстановления водой или другим подходящим разбавителем перед применением. Такие жидкие препараты могут содержать традиционные добавки, такие как суспендирующие агенты, такие как сорбитовый сироп, синтетические и природные смолы, такие как трагакант, гуммиарабик, альгинат, декстран, натрия карбоксиметилцеллюлоза, метилцеллюлоза, поливинилпирролидон или желатин, глюкозный/сахарный сироп, желатин, гидроксиэтилцеллюлоза, гидроксипропилметилцеллюлоза, гель стеарата алюминия, эмульгаторы, такие как лецитин, сорбит-моноолеат или гуммиарабик; неводные разбавители (которые могут включать пищевые масла), такие как миндальное масло, фракционированное кокосовое масло, масляные сложные эфиры, пропиленгликоль и этиловый спирт; и консерванты, такие как метил- или пропил-н-гидроксибензоат и сорбиновая кислота. Жидкие формы, в которые можно включать описанные здесь композиции для перорального введения или введения путем инъекции, включают водные растворы, подходящим образом ароматизированные сиропы,водные или масляные суспензии и ароматизированные эмульсии с пищевыми маслами, такими как хлопковое масло, кунжутное масло, кокосовое масло или арахисовое масло, а также эликсиры и подобные фармацевтические разбавители. В тех случаях, когда для перорального введения желательны водные суспензии и/или эликсиры,описанные здесь соединения можно объединять с различными подсластителями, корригентами, красящими агентами, эмульгирующими агентами и/или суспендирующими агентами, а также с такими разбавителями, как вода, этанол, пропиленгликоль, глицерин и их различные комбинации. Подходящие диспергирующие или суспендирующие агенты для водных суспензий включают синтетические и природные смолы, такие как трагакант, гуммиарабик, альгинат, декстран, натрия карбоксиметилцеллюлоза, метилцеллюлоза, поливинилпирролидон или желатин. Описанные здесь ингибиторы MPO или их фармацевтически приемлемые соли также можно вводить в композиции контролируемого высвобождения (определение), такой как композиция медленного высвобождения или быстрого высвобождения. Такие композиции контролируемого высвобождения из описанных здесь комбинаций могут быть приготовлены с использованием способов, хорошо известных специалистам в данной области. Способ введения будет определен лечащим врачом или другим квалифицированным персоналом в данной области после оценки состояния и потребностей пациента. Таким образом, эффективная доза ингибитора MPO или его фармацевтически приемлемых солей по настоящему изобретению может варьироваться в зависимости от таких факторов, как состояние пациента, тяжесть симптомов расстройства, а также эффективности выбранного конкретного соединения, способа введения, возраста и массы пациента и т.п. Определение дозы находится в компетенции обычного специалиста. Точная композиция, путь введения и дозировка могут быть выбраны индивидуальным врачом с учетом состояния пациента. Величина и интервал дозирования могут быть скорректированы в индивидуальном порядке для обеспечения уровней активной группировки в плазме, которые достаточны для поддержания терапевтических эффектов. В типичных случаях эффективная доза ингибиторов MPO или их фармацевтически приемлемых солей обычно требует введения соединения в диапазоне от включительно 1 до 1000 мг. Согласно одному из аспектов настоящего изобретения указанный диапазон представляет собой от включительно 2 до 800 мг или от включительно 2 до 400 мг. В альтернативном воплощении настоящего изобретения количество ингибитора MPO выбрано примерно из 5, 10, 50, 100, 150, 200, 250, 300, 350, 400, 500, 550, 600, 700 и 800 мг. Описание методов Обработка трансгенных (tg) мышей или мышей дикого типа с использованием 3NP также вносит вклад в наиболее признанные модели HD (Brouillet E. et al., Prog. Neurobiol. 1999; 59:427-68). Она основана на подострой системной инъекции этого митохондриального комплекса II токсина. Этот токсин создает у мышей HD-подобные стриарные поражения и повторяет метаболическое нарушение, имеющее место при HD. За время его широкого использования была продемонстрирована корреляция(Fernagut Р.О. et al., Neuroscience. 2002; 114: 1005-17) между периодом времени и интенсивностью двигательного расстройства с использованием полуколичественной шкалы (оценка брадикинезии, дистонии туловища, дистонии и сдавливании задней конечности и ослабленного постурального контроля) и тяжести стриарного повреждения (нейронная потеря и астроцитарная реакция). Ухудшение сенсомоторной интеграции также было продемонстрировано с использованием количественных тестов, про которые известно, что они чувствительны к дисфункции полосатого тела - черного вещества: общей активности,полюсного теста и теста пересечения пучка. Соответственно, некоторые важные поведенческие и гистопатологические конечные точки, имеющие отношение к HD, являются такими же, как в используемой модели MSA. Таким образом, стриарная патология, включая нейронную потерю и компоненты двигательного поведения в упомянутой ниже модели MSA, также отражает HD-патологию.-4 017510 Разработана новая мышиная модель MSA путем индуцирования окислительного стресса у трансгенных мышей с олигодендроглиальной экспрессией -синуклеина (описано здесь). Эта модель воспроизводит кардинальные нейропатологические признаки заболевания, в том числе дегенерацию полосатого тела - черного вещества (SND), оливомостомозжечковую атрофию (ОРСА), астроглиоз и микроглиоз,объединенный с олигодендроглиальными нерастворимыми включениями -синуклеина. Митохондриальное ингибирование посредством 3NP в присутствии глиальных цитоплазматических включений у трансгенных мышей индуцирует селективную картину гибели нейронных клеток, типичную для MSA у этих животных (Stefanova N. et al., Am. J. Pathol. 2005; 166: 869-76). Таким образом, в настоящем изобретении ингибиторы MPO применяли для подавления активностиMPO на мышиной модели MSA, состоящей из олигодендроглиальной сверхпродукции -SYN у трансгенных мышей, подвергаемых митохондриальному ингибированию посредством 3-нитропропионовой кислоты (3NP). Эффекты появлялись после использования установленных иммуногистологических и поведенческих методов для оценки участия MPO в патогенезе MSA и возможных нейрозащитных эффектов на модели MSA. Трансгенная компактная часть черного вещества (SNc) сначала подвергается нейронной потере, ассоциируемой с олигодендроглиальной -синуклеинопатией в течение временного окна между 2 и 4 месяцами жизни. Эта ранняя нейронная потеря коррелируется с активацией микроглии в SNc. Установлено,что подавление микроглиоза в период времени между 2 и 4 месяцами жизни является нейропротективным для нейронов черного вещества. Результаты исследования наводят на мысль, что объединенная трансгенная и нейротоксическая мышиная модель MSA сама могла бы быть пригодной в качестве преклинического теста для новых терапевтических кандидатов в отношении MSA как для образца с ранним"минимальным изменением", так и образца поздней прогрессирующей "развившейся" MSA. Активация микроглии отчетливо обнаруживается в MSA-мозгах. Для трансгенных мышей, сверхэкспрессирующих человеческий -синуклеин дикого типа под контролем протеолипидного белкового(PLP) промотора, было показано, что такие мыши имели интенсивную активацию микроглии в особенности в белом веществе, которая не имеет место у мышей дикого типа C57Bl/6 (Stefanova N. et al., Am. J.Pathol. 2005; 166:869-76). Кроме того, активация микроглии в значительной степени усиливается после подвергания воздействию 3NP и сопровождается MSA-подобной дегенерацией нейронов. Корреляция активации микроглии с потерей нейронных клеток наводит на мысль, что микроглиальные факторы могли бы, по меньшей мере частично, опосредовать нейродегенерацию путем высвобождения реакционноспособных кислородных частиц, оксида азота (NO), цитокинов или хемокинов. Животные. Всего использовали 30 (PLP)синуклеин-трансгенных мышей. Животных содержали в условиях цикла темнота/свет (12/12 ч) со свободным доступом к пище и воде в виварии медицинского университета Инсбрука. Все эксперименты выполняли в соответствии с австрийским законодательством и после разрешения на проведение экспериментов на животных, полученного от Федерального Министерства по образованию, науке и культуре Австрии. Группы. Контрольная группа мышей с MSA (tg+3NP) (n=10), обработанная разбавителем (циклодекстрином,полученным от AstraZeneca) p.o. (пероральное введение). Группа мышей с MSA (tg+3NP), получающая низкую дозу, (n=10) обработанная 1-(2 изопропоксиэтил)-2-тиоксо-1,2,3,5-тетрагидропирроло[3,2-d]пиримидин-4-оном (соединением I; полученным от AstraZeneca), 260 мкмоль/кг р.о. Группа мышей с MSA (tg+3NP), получающая высокую дозу, (n=10) обработанная соединением I(обработку соединением I) начинали за одну неделю до первой интоксикации 3NP и останавливали через три недели после первой интоксикации 3NP (см. протокол интоксикации 3NP ниже). Животных подвергали поведенческим тестам в течение 3-4 недель после начала эксперимента. На 28-е сутки животных подвергали перфузии под глубоким тиопенталовым наркозом и для гистологического анализа потери нейронов и глиоза собирали мозги. Интоксикация 3NP. Мышей постоянно подвергали интоксикации 3NP с медленным увеличением доз токсина в соответствии с ранее используемой схемой (т.е. внутрибрюшинные инъекции 410 мг/кг, 420 мг/кг, 440 мг/кг,450 мг/кг каждый 12-й час в течение периода времени 8 суток) для модели MSA (Stefanova N. et al., Am.J. Pathol. 2005; 166:869-76). Обработка соединением I. Лекарственное средство и разбавитель (0,1 моль/л меглумина с 20% мас./об. гидроксипропил-циклодекстрина, рН 10,8) хранили при 4 С. Мыши получали необходимую дозу лекарственного средства/разбавителя (10 мл/кг) два раза в сутки путем перорального введения через желудочный зонд в течение указанного периода.-5 017510 Поведение. Поведенческие тесты проводили "вслепую" по отношению к обработке в соответствии с утвержденными процедурами: оценкой клинической шкалы, полюсным тестом и тестом на длину шага при спонтанной локомоторной активности (Stefanova N. et al., Am. J. Pathol. 2005; 166:869-76). Оценка моторной клинической шкалы. Ранее описанная оценочная шкала для определения сдавливания задней конечности, общей локомоторной активности, дистонии задней конечности, дистонии туловища и постуральной реакции на введение разрешающей дозы (0 - норма; 1 - незначительное беспокойство, 2 - заметное поражение)(Fernagut P.O. et al., Neuroscience. 2002; 114:1005-17). Активность на "открытом поле". Для тестирования локомоторной активности мышей использовали систему гибкого открытого поляFlex Field Activity System (San Diego Instruments, CA, USA), которая позволяла наблюдать и подсчитывать в режиме реального времени горизонтальную и вертикальную локомоторную активность с помощью 544 каналов пучка света. Мышей помещали в центр открытого поля (40,540,536,5 см) и тестировали в течение 15-минутного периода времени всегда в одно и то же время суток (17.00 ч). Тестирование проводили в темной комнате, которая была полностью изолирована от внешних шумов и света на протяжении периода тестирования. Длина шага. Длину шага для передних и задних конечностей мышей измеряли после привыкания мышей к тестированию в течение 3 суток до осуществления измерения в соответствии с Fernagut et al. (Femagut P.O.et al., Neuroscience. 2002; 114:1005-17) с незначительной модификацией. Конечности каждого животного смачивали нетоксичным пищевым красителем и каждой мыши разрешали бегать по полоске бумаги(длина 42 см, ширина 4,5 см) по яркому коридору в направлении темной камеры - месту назначения. После трех пробегов измеряли длину шага для задних конечностей с каждой стороны, исключая начало(7 см) и окончание (7 см) забега. Определяли среднюю длину шага для каждой конечности. Тканевый препарат. Животных подвергали перфузии под действием избыточной тиопенталовой дозы с 4% параформальдегида (PFA), рН 7,4. Мозги быстро удаляли и хранили в течение 24 ч в 4% PFA при 4 С. После криопротекции в растворе 20% сахароза/0,1 M PBS (фосфатно-солевой буферный раствор), рН 7,4 мозги замораживали и хранили при -80 С. Серийные срезы (всего 7 серий) делали в криостате (Leica) и собирали для гистологических окрашиваний (одна серия на предметных стеклах) и иммуногистохимии (6 серий свободноплавающих срезов). Окрашивание по методу Ниссля: коронарные срезы через весь головной мозг помещали на предметные стекла и проводили стандартное окрашивание крезиловым фиолетовым. В соответствии со стандартными протоколами (Stefanova N. et al., Am. J. Pathol. 2005; 166:869-76) проводили иммуноцитохимию свободноплавающих срезов (40 мкм) для анализа нейронной и глиальной патологии на модели мышей с MSA. Использовали следующие первичные антитела: антитело анти-ТН(тирозингидроксилаза, Sigma); антитело анти-DARPP-32 (допамин и циклический аденозин-3',5'монофосфат-регулируемый фосфопротеин 32); антитело анти-GFAP (глиальный фибриллярный кислотный протеин, Roche Diagnostics GmbH); антитело анти-CD11b: (Serotec). Вторичные антитела представляли собой биотинилированные антимышиные или антикрысиные IgG, по необходимости. Кратко, после промывки в фосфатно-солевом буферном растворе (PBS) срезы инкубировали в 0,3% H2O2, снова ополаскивали и блокировали в течение 1 ч в 10%-ной нормальной сыворотке козла в PBS с 0,3% Triton-X100(PBS-T) с последующим инкубированием в течение ночи в первичном антителе при 4 С. После промывки в PBS-T срезы инкубировали в течение 1 ч во вторичном антителе, снова промывали и инкубировали в течение еще 1 ч в комплексе авидин-биотин (Elite Kit, Vector). В конце реакцию визуализировали с помощью 3,3'-диаминобензидина. Для стереологии использовали компьютеризованную систему анализа изображений (микроскопNikon E-800, CCD (камера с зарядовой связью) видеокамера, Optronics MicroFire, Goleta, USA; программное обеспечение Stereo Investigator Software, MicroBrightField Europe e.K., Магдебург, Германия). Для подсчета нейронов в полосатом теле, компактной части черного вещества, ядрах варолиевого моста и нижних оливах использовали оптический фракционатор. Клетки Пуркинье подсчитывали в области,намеченной для включения только слоя клеток Пуркинье, как описано ранее (German D.C. et al.,Neuroscience. 2001; 105: 999-1005). Все данные выражали в виде среднего значенияSEM (стандартная погрешность среднего). Глиальную активацию в черном веществе и полосатом теле измеряли путем определения оптической плотности в целевой области посредством схематического изображения этой области в серийных срезах. Степень вероятности 5% (р 0,05) для всех выполненных статистических тестов рассматривали как значимую.-6 017510 Результаты. Эффекты обработки соединением I на двигательное поведение мышей с MSA. Показатель среднесуточного движения значительно улучшился у мышей с MSA, обработанных соединением I, по сравнению с мышами, обработанными разбавителем (фиг. 1). Также было значительное улучшение при функционировании гибкого поля после обработки высокой дозой соединения I(180 мкмоль/кг). Затрагивалась как вертикальная стойка, так и активность на открытом поле (фиг. 2). Аналогично, было значительное улучшение при тестировании длины шага после обработки высокой дозой соединения I (180 мкмоль/кг); в равной степени затрагивались как левая, так и правая задние конечности (фиг. 3). Эффекты обработки соединением I на нейропатологию мышей с MSA. Соединение I при высокой дозе (180 мкмоль/кг) является нейрозащитным в отношении дегенерации полосатого тела - черного вещества у мышей с MSA (фиг. 4). Очевидно для ТН иммуноположительных клеток в черном веществе, дофаминергических окончаний в полосатом теле, а также стриарных DARPP32 иммунореактивных нейронов. Соединение I при высокой дозе (180 мкмоль/кг) является нейрозащитным в отношении оливомостомозжечковой атрофии у мышей с MSA. Защита комплекса нижних олив, ядер варолиевого моста и клеток Пуркинье в мозжечке (фиг. 5). Высокая доза соединения I (180 мкмоль/кг) ассоциировалась с подавлением активации микроглии,другим маркером нейровоспаления, у мышей с MSA. Это было видно как в черном веществе, так и в полосатом теле (фиг. 6). Это означает, что авторы имеют фармакологически подтвержденную предполагаемой ранее (Stefanova N. et al., Am. J. Pathol. 2005; 166: 869-76) связь между активацией микроглии и нейро дегенерацией. Краткое изложение результатов исследований Значительная нейропротекция была продемонстрирована при обработке соединением I. Нейроны последовательно сохранялись на уровне компактной части черного вещества, полосатого тела, коры мозжечка, ядер варолиевого моста и комплекса нижних олив. Эта нейропротекция сопровождалась функциональным улучшением, измеренным с использованием разных поведенческих тестов. Эффекты соединения I также были связаны с подавлением активации микроглии. Данные подтверждают, что ингибиторы MPO обладают потенциалом, чтобы быть нейрозащитными в условиях, сопровождаемых нейровоспалением, включая MSA, PD и HD. Широкая нейропротекция, не ограниченная только подмножеством нейронов, вследствие уменьшенной потери нейронных клеток и/или уменьшенной потери нейронных окончаний при обработке ингибитором MPO на модели такого типа дополнительно будет свидетельствовать в пользу того, что ингибиторы MPO обладают потенциалом, чтобы быть также нейрозащитными при нейродегенеративных расстройствах человека. Нейропротекция ингибиторами MPO всех пораженных фенотипов нейронов, без какого-либо исключения, на описанной здесь модели предоставляет не вызывающие сомнений аргументы, что ингибиторы MPO являются нейрозащитными и не только обязательно ограничены MSA, PD и болезнью Гентингтона. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Применение 1-(2-изопропоксиэтил)-2-тиоксо-1,2,3,5-тетрагидропирроло[3,2-d]пиримидин-4-она или его фармацевтически приемлемой соли для изготовления лекарственного средства для лечения множественной системной атрофии. 2. Применение по п.1, где суточная доза 1-(2-изопропоксиэтил)-2-тиоксо-1,2,3,5 тетрагидропирроло[3,2-d]пиримидин-4-она или его фармацевтически приемлемой соли находится в диапазоне от 1 до 1000 мг.
МПК / Метки
МПК: A61P 25/28, A61K 31/519, A61K 31/522
Метки: лечения, ингибиторы, системной, атрофии, множественной
Код ссылки
<a href="https://eas.patents.su/13-17510-ingibitory-mpo-dlya-lecheniya-mnozhestvennojj-sistemnojj-atrofii.html" rel="bookmark" title="База патентов Евразийского Союза">Ингибиторы mpo для лечения множественной системной атрофии</a>
Предыдущий патент: Защитное укрытие
Следующий патент: Переработка ценных руд с помощью магнитных частиц
Случайный патент: Устройство для приготовления гомеопатических продуктов