Способы получения соединений на основе имидазола
Формула / Реферат
1. Способ получения изомерной смеси соединения формулы I, обогащенной изомером Е
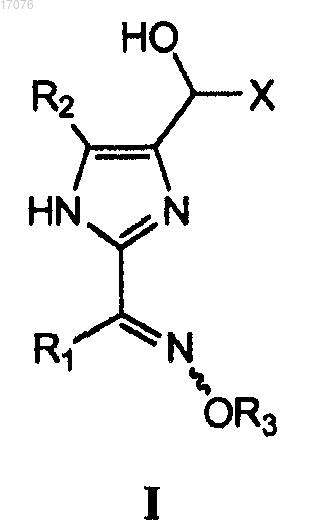
где X представляет собой С2-10алкил, необязательно замещенный одним или более заместителем, таким как гидроксил, ацетил или галоген; R1 представляет С2-6алкил; R2 представляет собой водород, галоген, цианогруппу или С2-6алкил и R3 представляет собой водород или С2-6алкил, необязательно замещенный одним или более заместителем, таким как гидроксил, ацетил или галоген; который включает
взаимодействие соединения формулы II

с соединением формулы III
с образованием первой смеси Е- и Z-изомеров соединения формулы I; и
взаимодействие этой первой смеси с сильной кислотой с образованием второй смеси Е- и Z-изомеров соединения формулы I, где отношение E:Z изомеров первой смеси является меньшим, чем отношение E:Z изомеров второй смеси.
2. Способ по п.1, в котором R2 представляет собой водород.
3. Способ по п.1, в котором R3 представляет собой водород.
4. Способ по п.1, в котором соединение формулы I представляет собой соединение формулы I(a)
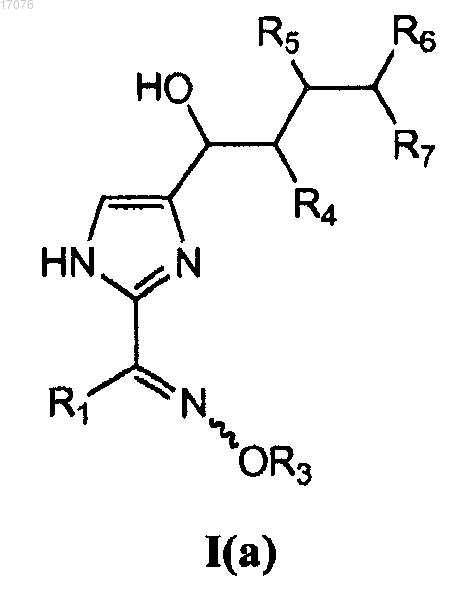
где каждый из R4, R5, R6 и R7 независимо представляет собой гидроксил, ацетил или галоген.
5. Способ по п.4, в котором соединение формулы I(a) представляет собой стереомерно чистое соединение формулы I(b)
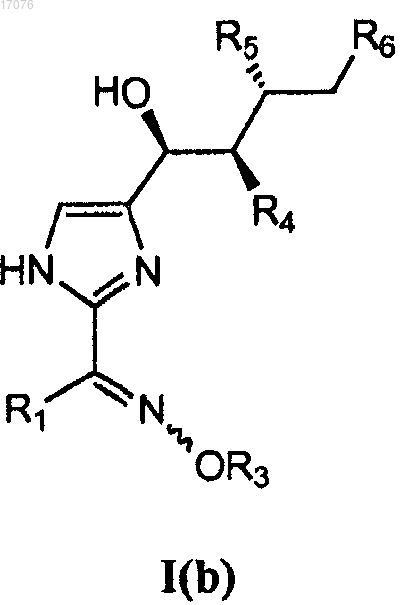
6. Способ по п.5, в котором один или несколько из R4, R5 и R6 представляют собой гидрокси или галоген.
7. Способ по п.5, в котором все R4, R5 и R6 представляют собой гидроксил или ацетил.
8. Способ по п.1, в котором сильная кислота представляет собой йодисто-водородную, бромисто-водородную, хлористо-водородную, серную, азотную, фосфорную, алкансульфоновую или аренсульфоновую кислоту.
9. Способ по п.1, в котором отношение E:Z изомеров увеличивается от менее чем примерно 5:1 до более чем примерно 8:1.
10. Способ по п.9, в котором отношение E:Z изомеров увеличивается от менее чем примерно 4:1 до более чем примерно 10:1.
11. Способ по п.10, в котором отношение E:Z изомеров увеличивается от примерно 3:1 до более чем примерно 13:1.
12. Способ увеличения отношения E:Z изомеров в смеси (Е)-1-(4-((1R,2S,3R)-1,2,3,4-тетрагидроксибутил)-1Н-имидазол-2-ил)этаноноксима и (Z)-1-(4-((1R,2S,3R)-1,2,3,4-тетрагидроксибутил)-1Н-имидазол-2-ил)этаноноксима, который включает взаимодействие раствора, содержащего первую смесь (Е)-1-(4-((1R,2S,3R)-1,2,3,4-тетрагидроксибутил)-1Н-имидазол-2-ил)этаноноксима и (Z)-1-(4-((1R,2S,3R)-1,2,3,4-тетрагидроксибутил)-1Н-имидазол-2-ил)этанон оксима, с сильной кислотой с образованием второй смеси (Е)-1-(4-((1R,2S,3R)-1,2,3,4-тетрагидроксибутил)-1Н-имидазол-2-ил)этаноноксима и (Z)-1-(4-((1R,2S,3R)-1,2,3,4-тетрагидроксибутил)-1Н-имидазол-2-ил)этаноноксима; где отношение E:Z изомеров первой смеси является меньшим, чем отношение изомеров E:Z второй смеси.
13. Способ по п.12, в котором первую смесь получают путем взаимодействия 1-(4-((1R,2S,3R)-1,2,3,4-тетрагидроксибутил)-1Н-имидазол-2-ил)этанона с гидроксиламином с образованием 1-(4-((1R,2S,3R)-1,2,3,4-тетрагидроксибутил)-1Н-имидазол-2-ил)этаноноксима.
14. Способ по п.12, в котором 1-(4-((1R,2S,3R)-1,2,3,4-тетрагидроксибутил)-1Н-имидазол-2-ил)этанон получают путем взаимодействия 1-амино-1-дезокси-D-фруктозы с 2-этоксиакрилонитрилом.
15. Способ по п.12, в котором раствор содержит спирт.
16. Способ по п.15, в котором спирт представляет собой метанол, этанол, пропанол или изопропанол.
17. Способ по п.12, в котором сильная кислота представляет собой йодисто-водородную, бромисто-водородную, хлористо-водородную, серную, азотную, фосфорную, алкансульфоновую или аренсульфоновую кислоту.
18. Способ получения 1-(4-((1R,2S,3R)-1,2,3,4-тетрагидроксибутил)-1Н-имидазол-2-ил)этанона, который включает
добавление первой части метоксида натрия к раствору, содержащему 2-этоксиакрилонитрил, с получением первой смеси;
взаимодействие первой смеси с 1-амино-1-дезокси-D-фруктозой с получением второй смеси;
добавление второй части метоксида натрия к второй смеси с получением третьей смеси;
добавление уксусной кислоты к третьей смеси с получением четвертой смеси и
перемешивание четвертой смеси с образованием 1-(4-((1R,2S,3R)-1,2,3,4-тетрагидроксибутил)-1Н-имидазол-2-ил)этанона;
где вторую смесь поддерживают при температуре более чем примерно 5°С.
19. Способ по п.18, в котором первую смесь поддерживают при температуре более чем примерно 5°С.
20. Способ по п.18, в котором первую часть метоксида натрия добавляют в виде раствора метоксида натрия в метаноле в количестве более чем примерно 15 мас.%.
21. Способ по п.18, в котором вторую часть метоксида натрия добавляют в виде раствора метоксида натрия в метаноле в количестве более чем примерно 15 мас.%.
22. Способ по п.18, в котором 1-амино-1-дезокси-D-фруктозу получают в суспензии, дополнительно содержащей ее соль с уксусной кислотой.
23. Способ по п.18, в котором третью смесь разбавляют водой перед добавлением к ней уксусной кислоты.
24. Способ по п.18, в котором четвертую смесь нагревают до температуры более чем примерно 30°С.
25. Способ по п.24, в котором четвертую смесь нагревают в течение менее чем примерно 5 ч.
26. Способ по п.18, в котором 1-(4-((1R,2S,3R)-1,2,3,4-тетрагидроксибутил)-1Н-имидазол-2-ил)этанон выделяют с выходом более чем примерно 50%.
Текст
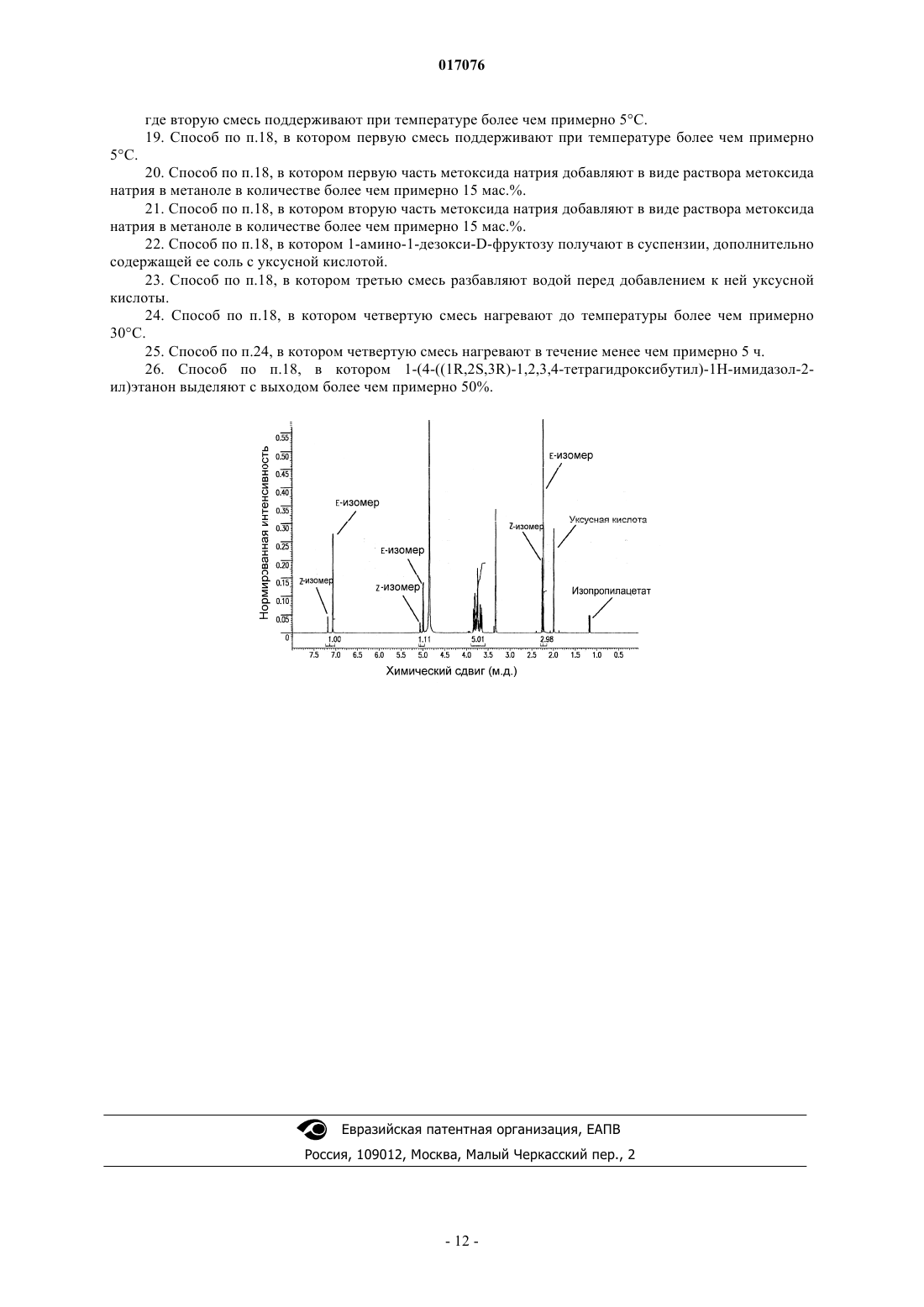
СПОСОБЫ ПОЛУЧЕНИЯ СОЕДИНЕНИЙ НА ОСНОВЕ ИМИДАЗОЛА Описываются способы получения соединения на основе имидазола. Конкретные соединения представляют собой соединения формулы (I) 017076 По настоящей заявке испрашивается приоритет на основании временной заявки на патент США 60/923029, зарегистрированной 12 апреля 2007 г., которая включена в описание в качестве ссылки во всей ее полноте. Область техники, к которой относится изобретение Настоящее изобретение относится к способам синтеза соединений на основе имидазола. Уровень техники Соединение 1-(4-1R,2S,3R)-1,2,3,4-тетрагидроксибутил)-1 Н-имидазол-2-ил)этанон (THI) представляет собой второстепенный компонент Carmel Color III и, как сообщают, понижает количество отсчетов лимфоцитов, циркулирующих в крови у крыс. Способы получения THI известны. См., например,Krplien, U. and Rosdorfer, J. J. Org. Chem. 50: 1131-1133 (1985); патент США 4567194, Krplien et al.;and Bchi, G., J. Org. Chem. 50: 1134-1136, 1135 (1985). В последнее время сообщают, что определенные соединения на основе имидазола представляют собой сильнодействующие ингибиторы иммунной реакции и могут быть пригодны для лечения таких заболеваний, как ревматоидный артрит и диабет I типа. См. заявку на патент США 11/698253, Augeri et al.,зарегистрированную 25 января 2007 г. Для облегчения их исследования и использования являются желательными дополнительные способы их синтеза. Сущность изобретения Настоящее изобретение относится к способу получения изомерной смеси соединения формулы I,обогащенной изомером Е где X представляет собой С 2-10 алкил, необязательно замещенный одним или более заместителем, таким как гидроксил, ацетил или галоген; R1 представляет С 2-5 алкил; R2 представляет собой водород, галоген,цианогруппу или С 2-6 алкил; и R3 представляет собой водород или С 2-6 алкил, необязательно замещенный одним или более заместителем, таким как гидроксил, ацетил или галоген; который включает взаимодействие соединения формулы II с образованием первой смеси Е- и Z-изомеров соединения формулы I; и взаимодействие этой первой смеси с сильной кислотой с образованием второй смеси Е- и Zизомеров соединения формулы I, где отношение E:Z изомеров первой смеси является меньшим, чем отношение E:Z изомеров второй смеси. Предпочтительно R2 представляет собой водород и R3 представляет собой водород. В предпочтительном варианте осуществления способа соединение формулы I представляет собой соединение формулы I(a) где каждый из R4, R5, R6 и R7 независимо представляет собой гидроксил, ацетил или галоген. Ещ более предпочтительно, когда соединение формулы I(а) представляет собой стереомерно чистое соединение формулы I(b) В предпочтительном варианте один или несколько из R4, R5 и R6 представляют собой гидрокси или галоген или все R4, R5 и R6 представляют собой гидроксил или ацетил. Согласно настоящему изобретению сильная кислота представляет собой йодисто-водородную, бромисто-водородную, хлористо-водородную, серную, азотную, фосфорную, алкансульфоновую или аренсульфоновую кислоту. В предпочтительном варианте отношение E:Z изомеров увеличивается от менее чем примерно 5:1 до более чем примерно 8:1, более предпочтительно, если отношение E:Z изомеров увеличивается от менее чем примерно 4:1 до более чем примерно 10:1, и ещ более предпочтительно, если отношение E:Z изомеров увеличивается от примерно 3:1 до более чем примерно 13:1. Другим объектом настоящего изобретения является способ увеличения отношения E:Z изомеров в смеси (Е)-1-(4-1R,2S,3R)-1,2,3,4-тетрагидроксибутил)-1 Н-имидазол-2-ил)этаноноксима и (Z)-1-(41R,2S,3R)-1,2,3,4-тетрагидроксибутил)-1 Н-имидазол-2-ил)этаноноксима, который включает взаимодействие раствора, содержащего первую смесь (Е)-1-(4-1R,2S,3R)-1,2,3,4-тетрагидроксибутил)-1 Нимидазол-2-ил)этаноноксима и(Z)-1-(4-1R,2S,3R)-1,2,3,4-тетрагидроксибутил)-1 Н-имидазол-2 ил)этаноноксима, с сильной кислотой с образованием второй смеси (Е)-1-(4-1R,2S,3R)-1,2,3,4 тетрагидроксибутил)-1 Н-имидазол-2-ил)этаноноксима и (Z)-1-(4-1R,2S,3R)-1,2,3,4-тетрагидроксибутил)-1 Н-имидазол-2-ил)этаноноксима; где отношение E:Z изомеров первой смеси является меньшим, чем отношение изомеров E:Z второй смеси. В предпочтительном варианте первую смесь получают путем взаимодействия 1-(4-1R,2S,3R)1,2,3,4-тетрагидроксибутил)-1 Н-имидазол-2-ил)этанона с гидроксиламином с образованием 1-(41R,2S,3R)-1,2,3,4-тетрагидроксибутил)-1 Н-имидазол-2-ил)этаноноксима. В ещ одном предпочтительном варианте 1-(4-1R,2S,3R)-1,2,3,4-тетрагидроксибутил)-1 Нимидазол-2-ил)этанон получают путем взаимодействия 1-амино-1-дезокси-D-фруктозы с 2 этоксиакрилонитрилом. Предпочтительно, когда раствор содержит спирт, например такой как метанол, этанол, пропанол или изопропанол. Предпочтительно, когда сильная кислота представляет собой йодисто-водородную, бромистоводородную, хлористо-водородную, серную, азотную, фосфорную, алкансульфоновую или аренсульфоновую кислоту. В ещ одном варианте настоящее изобретение относится к способу получения 1-(4-1R,2S,3R)1,2,3,4-тетрагидроксибутил)-1 Н-имидазол-2-ил)этанона, который включает добавление первой части метоксида натрия к раствору, содержащему 2-этоксиакрилонитрил, с получением первой смеси; взаимодействие первой смеси с 1-амино-1-дезокси-D-фруктозой с получением второй смеси; добавление второй части метоксида натрия ко второй смеси с получением третьей смеси; добавление уксусной кислоты к третьей смеси с получением четвертой смеси и перемешивание четвертой смеси с образованием 1-(4-1R,2S,3R)-1,2,3,4-тетрагидроксибутил)-1 Н-2 017076 имидазол-2-ил)этанона; где вторую смесь поддерживают при температуре более чем примерно 5 С. В предпочтительном варианте первую смесь поддерживают при температуре более чем примерно 5 С; первую часть метоксида натрия добавляют в виде раствора метоксида натрия в метаноле в количестве более чем примерно 15 мас.%; вторую часть метоксида натрия добавляют в виде раствора метоксида натрия в метаноле в количестве более чем примерно 15 мас.%. В других предпочтительных вариантах 1-амино-1-дезокси-D-фруктозу получают в суспензии, дополнительно содержащей ее соль с уксусной кислотой; третью смесь разбавляют водой перед добавлением к ней уксусной кислоты; четвертую смесь нагревают до температуры более чем примерно 30 С, предпочтительно четвертую смесь нагревают в течение менее чем примерно 5 ч. В предпочтительном варианте 1-(4-1R,2S,3R)-1,2,3,4-тетрагидроксибутил)-1 Н-имидазол-2 ил)этанон выделяют с выходом более чем примерно 50%. Краткое описание фигур Аспекты настоящего изобретения могут быть поняты со ссылкой на фиг. 1, которая показывает спектр 1 Н ЯМР смеси (Е)-1-(4-1R,2S,3R)-1,2,3,4-тетрагидроксибутил)-1 Н-имидазол-2-ил)этаноноксима и (Z)-1-(4-1R,2S,3R)-1,2,3,4-тетрагидроксибутил)-1 Н-имидазол-2-ил)этаноноксима. Подробное описание Настоящее изобретение частично основывается на обнаружении новых способов получения соединений формулы I. Конкретные способы являются хорошо приспособленными для получения соединений в большом масштабе (например, в масштабе килограммов). Настоящее изобретение также основывается на обнаружении новых способов получения 1-(41R,2S,3R)-1,2,3,4-тетрагидроксибутил)-1 Н-имидазол-2-ил)этанона. Конкретные способы дают соединение с высоким выходом. Определения Если не указано иное, термин "алкенил" означает углеводород с прямой цепью, разветвленный и/или циклический, имеющий от 2 до 20 (например, 2-10 или 2-6) атомов углерода и содержащий по меньшей мере одну двойную связь углерод-углерод. Репрезентативные алкенильные остатки включают винил, аллил, 1-бутенил, 2-бутенил, изобутиленил, 1-пентенил, 2-пентенил, 3-метил-1-бутенил, 2-метил 2-бутенил, 2,3-диметил-2-бутенил, 1-гексенил, 2-гексенил, 3-гексенил, 1-гептенил, 2-гептенил, 3 гептенил, 1-октенил, 2-октенил, 3-октенил, 1-ноненил, 2-ноненил, 3-ноненил, 1-деценил, 2-деценил и 3 деценил. Если не указано иное, термин "алкокси" означает -O-алкильную группу. Примеры алкоксигрупп включают, но без ограничения, -ОСН 3, -ОСН 2 СН 3, -O(СН 2)2 СН 3, -O(СН 2)3 СН 3, -O(СН 2)4 СН 3 и-O(СН 2)5 СН 3. Термин "низший алкокси" относится к -O-(низшему алкилу). Если не указано иное, термин "алкил" означает углеводород с прямой цепью, разветвленный и/или циклический ("циклоалкил"), имеющий от 1 до 20 (например, 1-10 или 1-4) атомов углерода. Алкильные остатки, имеющие от 1 до 4 атомов углерода, упоминаются как "низший алкил". Примеры алкильных групп включают метил, этил, пропил, изопропил, н-бутил, трет-бутил, изобутил, пентил, гексил, изогексил, гептил, 4,4-диметилпентил, октил, 2,2,4-триметилпентил, нонил, децил, ундецил и додецил. Циклоалкильные остатки могут быть моноциклическими или мультициклическими, и их примеры включают циклопропил, циклобутил, циклопентил, циклогексил и адамантил. Дополнительные примеры алкильных остатков имеют линейные, разветвленные и/или циклические части (например, 1-этил-4-метилциклогексил). Термин "алкил" включает насыщенные углеводороды, а также алкенильные и алкинильные остатки. Если не указано иное, термин "алкиларил" или "алкил-арил" означает алкильный остаток, связанный с арильным остатком. Если не указано иное, термин "алкилгетероарил" или "алкил-гетероарил" означает алкильный остаток, связанный с гетероарильным остатком. Если не указано иное, термин "алкилгетероцикл" или "алкил-гетероциклил" означает алкильный остаток, связанный с гетероциклическим остатком. Если не указано иное, термин "алкинил" означает углеводород с прямой цепью, разветвленный или циклический, имеющий от 2 до 20 (например, 2-20 или 2-6) атомов углерода и содержащий по меньшей мере одну тройную связь углерод-углерод. Репрезентативные алкинильные остатки включают ацетиленил, пропинил, 1-бутинил, 2-бутинил, 1-пентинил, 2-пентинил, 3-метил-1-бутинил, 4-пентинил, 1 гексинил, 2-гексинил, 5-гексинил, 1-гептинил, 2-гептинил, 6-гептинил, 1-октинил, 2-октинил, 7-октинил,1-нонинил, 2-нонинил, 8-нонинил, 1-децинил, 2-децинил и 9-децинил. Если не указано иное, термин "арил" означает ароматическое кольцо или ароматическую или частично ароматическую кольцевую систему, состоящую из атомов углерода и водорода. Арильный остаток может содержать множество колец, связанных или конденсированных вместе. Примеры арильных остатков включают антраценил, азуленил, бифенил, флуоренил, индан, инденил, нафтил, фенантренил, фенил,1,2,3,4-тетрагидронафталин и толил. Если не указано иное, термин "арилалкил" или "арил-алкил" означает арильный остаток, связанный-3 017076 с алкильным остатком. Если не указано иное, термин "отношение изомеров E:Z", когда он относится к смеси Е-изомера соединения и соответствующего его Z-изомера, означает отношение этих изомеров. Такие отношения могут определяться с помощью различных способов, известных в данной области, включая хроматографические (например, ВЭЖХ) и спектроскопические способы (например, ЯМР, Рамановское рассеяние и инфракрасное поглощение). Если не указано иное, термин "галоген" охватывает фтор, хлор, бром и йод. Если не указано иное, термин "гетероалкил" относится к алкильному остатку (например, линейному, разветвленному или циклическому), в котором по меньшей мере один из его атомов углерода заменяется гетероатомом (например, N, О или S). Если не указано иное, термин "гетероарил" означает арильный остаток, где по меньшей мере один из его атомов углерода заменяется гетероатомом (например, N, О или S). Примеры включают акридинил,бензимидазолил, бензофуранил, бензоизотиазолил, бензоизоксазолил, бензохиназолинил, бензотиазолил,бензоксазолил, фурил, имидазолил, индолил, изотиазолил, изоксазолил, оксадиазолил, оксазолил, фталазинил, пиразинил, пиразолил, пиридазинил, пиридил, пиримидинил, пиримидил, пирролил, хиназолинил,хинолинил, тетразолил, тиазолил и триазинил. Если не указано иное, термин "гетероарилалкил" или "гетероарилалкил" означает гетероарильный остаток, связанный с алкильным остатком. Если не указано иное, термин гетероцикл" относится к ароматическому, частично ароматическому или неароматическому моноциклическому или полициклическому кольцу или кольцевой системе, состоящей из углерода, водорода и по меньшей мере одного гетероатома (например, N, О или S). Гетероцикл может содержать множество (т.е. два или более) колец, конденсированных или связанных вместе. Гетероциклы включают гетероарилы. Примеры включают бензо[1,3]диоксолил, 2,3-дигидробензо[1,4] диоксинил, циннолинил, фуранил, гидантоинил, морфолинил, оксетанил, оксиранил, пиперазинил, пиперидинил, пирролидинонил, пирролидинил, тетрагидрофуранил, тетрагидропиранил, тетрагидропиридинил, тетрагидропиримидинил, тетрагидротиофенил, тетрагидротиопиранил и валеролактамил. Если не указано иное, термин "гетероциклоалкил" или "гетероцикл-алкил" относится к гетероциклическому остатку, связанному с алкильным остатком. Если не указано иное, термин "гетероциклоалкил" относится к неароматическому гетероциклу. Если не указано иное, термин "гетероциклоалкилалкил" или "гетероциклоалкил-алкил" относится к гетероциклоалкильному остатку, связанному с алкильным остатком. Если не указано иное, термин "отношение главный изомер:второстепенный изомер", когда относится к смеси двух изомеров соединения - главного изомера (т.е. изомера, присутствующего в более чем 50 мас.%) и соответствующего ему второстепенного изомера (т.е. изомера, присутствующего в менее чем 50 мас.%) - означает отношение этих изомеров. Такие отношения могут определяться с помощью различных способов, известных в данной области, включая хроматографические (например, ВЭЖХ) и спектроскопические способы (например, ЯМР, Рамановское рассеяние и инфракрасное поглощение). Когда они используются для упоминания соединения, содержащего остаток оксима, термин "отношение главный изомер:второстепенный изомер" относится к геометрии оксима. Таким образом, если соединение, содержащее остаток оксима, имеет дополнительные стереоцентры, термин относится к отношению диастереомеров, содержащих оксим в одной конфигурации, к диастереомерам, содержащим оксим в другой. Если не указано иное, термин "стереомерно обогащенная композиция" соединения относится к смеси названного соединения и его стереоизомера(ов), которая содержит больше соединения, чем его стереоизомера(ов). Например, стереоизомерно обогащенная композиция (S)-бутан-2-ола охватывает смеси(S)-бутан-2-ола и (R)-бутан-2-ола в отношениях, например, примерно 60/40, 70/30, 80/20, 90/10, 95/5 и 98/2. Если не указано иное, термин "стереоизомерная смесь" охватывает рацемические смеси, а также стереомерно обогащенные смеси (например, R/S=30/70, 35/65, 40/60, 45/55, 55/45, 60/40, 65/35 и 70/30). Если не указано иное, термин "стереомерно чистая" означает композицию, которая содержит один стереоизомер соединения и, по существу, не содержит других стереоизомеров этого соединения. Например, стереомерно чистая композиция соединения, имеющего один стереоцентр, по существу, не будет содержать противоположного стереоизомера соединения. Стереомерно чистая композиция соединения,имеющего два стереоцентра, не будет, по существу, содержать другие диастереомеры соединения. Стереомерно чистая композиция соединения, которое имеет множество стереоцентров, но которое изображается или именуется таким образом, что определена стереохимия не всех его стереоцентров, по существу, не содержит изомеры соединения, которые имеют иную стереохимию стереоцентров, для которых определена стереохимия. Например, "стереомерно чистый 1R)-1,2-дихлорпропил)бензол" относится к 1R)-1,2-дихлорпропил)бензолу, который, по существу, не содержит 1S)-1,2-дихлорпропил) бензола. Типичное стереомерно чистое соединение содержит более чем примерно 80 мас.% одного стереоизомерного соединения и менее чем примерно 20 мас.% другого стереоизомерного соединения, более чем примерно 90 мас.% одного стереоизомерного соединения и менее чем примерно 10 мас.% другого стереоизомерного соединения, более чем примерно 95 мас.% одного стереоизомерного соединения и-4 017076 менее чем примерно 5 мас.% другого стереоизомерного соединения, более чем примерно 97 мас.% одного стереоизомерного соединения и менее чем примерно 3 мас.% другого стереоизомерного соединения или более чем примерно 99 мас.% одного стереоизомерного соединения и менее чем примерно 1 мас.% другого стереоизомерного соединения. Если не указано иное, термин "замещенный", когда используется для описания химической структуры или остатка, относится к производному этой структуры или остатка, где один или несколько из его атомов водорода замещаются атомом, химическим остатком или функциональной группой, такой как, но без ограничения, спирт, альдегид, алкокси, алканоилокси, алкоксикарбонил, алкенил, алкил (например,метил, этил, пропил, трет-бутил), алкинил, алкилкарбонилокси (-ОС(О)алкил), амид (-С(О)NH-алкилили -алкилNHC(О)алкил), амидинил (-C(NH)NH-алкил- или -C(NR)NH2), амин (первичный, вторичный и третичный, такой как алкиламино, ариламино, арилалкиламино), ароил, арил, арилокси, азо, карбамоил(включая алкилсульфонил, арилсульфонил и арилалкилсульфонил), сульфоксид, тиол (например, сульфгидрил, простой тиоэфир) и мочевина (-NHCONH-алкил-). Если не указано иное, "терапевтически эффективное количество" соединения представляет собой количество, достаточное для обеспечения терапевтического выигрыша при лечении или в тактике лечения заболевания или состояния, или для замедления или сведения к минимуму одного или нескольких симптомов, связанных с заболеванием или состоянием. Терапевтически эффективное количество соединения представляет собой количество терапевтического агента самого по себе или в сочетании с другими терапевтическим агентами, которое обеспечивает терапевтический выигрыш при лечении или в тактике лечения заболевания или состояния. Термин "терапевтически эффективное количество" может охватывать количество, которое улучшает общее терапевтическое состояние, уменьшает или устраняет симптомы или причины возникновения заболевания или состояния или улучшает терапевтическую эффективность другого терапевтического агента. Если не указано иное, термины "лечение", "леченый" и "лечить" предполагают действие, которое происходит тогда, когда пациент страдает от конкретного заболевания или расстройства, и которое понижает тяжесть заболевания или расстройства или один или несколько из его симптомов, или задерживает или замедляет развитие заболевания или расстройства. Если не указано иное, фраза "более чем X", где X представляет собой число, имеет такое же значение, как "X или более чем X". Подобным же образом фраза "более чем примерно X", где X представляет собой число, имеет такое же значение, как "примерно X или более чем примерно X". Если не указано иное, фраза "менее чем X", где X представляет собой число, имеет такое же значение, как "X или менее чем X". Подобным же образом фраза "менее чем примерно X", где X представляет собой число, имеет такое же значение, как "примерно X или менее чем примерно X". Если не указано иное, термин "включают" имеет такое же значение, как "включает", и термин"включает" имеет такое же значение, как "включает, но без ограничения". Подобным же образом термин"такие как" имеет такое же значение, как термин "такие как, но без ограничения". Если не указано иное, одно или несколько прилагательных, непосредственно предшествующих ряду существительных, должны рассматриваться как применяемые к каждому из существительных. Например, фраза "необязательно замещенный алкил, арил или гетероарил" имеет такое же значение, как"необязательно замещенный алкил, необязательно замещенный арил или необязательно замещенный гетероарил". Необходимо отметить, что химический остаток, который формирует часть большего соединения,может быть описан здесь с использованием наименования, обычно охватывающего его, когда он существует как отдельная молекула, или наименования, обычно охватывающего его радикал. Например, термины "пиридин" и "пиридил" соответствуют одному и тому же значению, когда используются для описания остатка, связанного с другими химическими остатками. Таким образом, две фразы "ХОН, где X представляет собой пиридил" и "ХОН, где X представляет собой пиридин", соответствуют одному и тому же значению и охватывают соединения пиридин-2-ол, пиридин-3-ол и пиридин-4-ол. Необходимо также отметить, что, если стереохимия структуры или части структуры не указывается, например, с помощью толстой или прерывистой линии, структура или часть структуры должна интерпретироваться как охватывающая все ее стереоизомеры. Подобным же образом наименования соединений, имеющих один или несколько хиральных центров, которые не описывают стереохимию этих центров, охватывают чистые стереоизомеры и их смеси. Кроме того, любой атом, показанный на изображении с ненасыщенной валентностью, как предполагается, должен быть связан с достаточным количеством атомов водорода, чтобы насытить валентности. В дополнение к этому химические связи, изображенные одной сплошной линией, параллельной одной прерывистой линии, охватывают как одинарные, так и-5 017076 двойные (например, ароматические) связи, если валентность позволяет. 5.2. Способы синтеза Настоящее изобретение охватывает способ получения соединения формулы I где X представляет собой необязательно замещенный алкил; R1 представляет собой необязательно замещенный алкил; R2 представляет собой водород, галоген, нитрил или необязательно замещенный алкил,арил, алкиларил, арилалкил, гетероалкил, гетероцикл, алкилгетероцикл или гетероциклоалкил и R3 представляет собой водород или необязательно замещенный алкил, арил, алкиларил, арилалкил, гетероалкил,гетероцикл, алкилгетероцикл или гетероциклоалкил; который включает взаимодействие соединения формулы II при условиях, достаточных для образования смеси Е- и Z-изомеров соединения формулы I; и взаимодействие смеси Е- и Z-изомеров с сильной кислотой. Другой вариант осуществления охватывает способ увеличения отношения главный изомер:второстепенный изомер в смеси соединений формулы I который включает взаимодействие раствора, содержащего первую смесь соединений формулы I, с сильной кислотой при условиях, достаточных для получения второй смеси соединений формулы I, где отношение главный изомер:второстепенный изомер для первой смеси является меньшим, чем отношение главный изомер:второстепенный изомер для второй смеси; X представляет собой необязательно замещенный алкил; R1 представляет собой необязательно замещенный алкил; R2 представляет собой водород,галоген, нитрил, или необязательно замещенный алкил, арил, алкиларил, арилалкил, гетероалкил, гетероцикл, алкилгетероцикл или гетероциклоалкил и R3 представляет собой водород или необязательно замещенный алкил, арил, алкиларил, арилалкил, гетероалкил, гетероцикл, алкилгетероцикл или гетероциклоалкил. В различных способах и вариантах осуществления, описанных здесь, соединения (например, соединения формулы I, II и/или III) могут существовать или быть получены как сольваты и/или соли. В конкретном варианте осуществления раствор содержит спирт (например, метанол, этанол, пропанол или изопропанол). В другом варианте осуществления раствор нагревают до температуры более чем примерно 30 С(например, более чем примерно 40, 50 или 60 С). В другом варианте осуществления отношение главный изомер:второстепенный изомер увеличивается от менее чем примерно 5:1 до более чем примерно 8:1. В другом варианте осуществления отноше-6 017076 ние главный изомер:второстепенный изомер увеличивается от менее чем примерно 4:1 до более чем примерно 10:1. В другом варианте осуществления отношение главный:второстепенный изомер увеличивается от примерно 3:1 до более чем примерно 13:1. В другом варианте осуществления рН раствора, содержащего вторую смесь, повышают. В конкретных способах рН повышают до более чем примерно 6,0 (например, до более чем примерно 7,0 или 8,0). Со ссылками на различные способы, описанные здесь, по возможности, конкретные варианты осуществления являются такими, что X представляет собой алкил, необязательно замещенный одним или несколькими гидроксильными, ацетатными или галогеновыми остатками. В других вариантах осуществления R2 представляет собой водород. В других вариантах осуществления R3 представляет собой водород. В других вариантах осуществления соединение формулы I представляет собой соединение формулы I(a) где R4 представляет собой OR4A, OC(O)R4A, N(R4B)2, NHC(O)R4B, водород или галоген; R5 представляет собой OR5A, OC(O)R5A, N(R5B)2, NHC(O)R5B, водород или галоген; R6 представляет собой OR6A,OC(O)R6A, N(R6B)2, NHC(O)R6B, водород или галоген; R7 представляет собой алкил, CH2OR7A,CH2OC(O)R7A, CH2N(R7B)2, CH2NHC(O) R7B, водород или галоген и каждый из R4A, R5A, R6A, R7A, R4B, R5B,R6B и R7B независимо представляет собой водород или необязательно замещенный алкил, арил, алкиларил, арилалкил, гетероалкил, гетероцикл, алкилгетероцикл или гетероциклоалкил. В других вариантах осуществления соединение формулы I(a) представляет собой стереомерно чистое соединение формулы I(b) Обращаясь к структурам I(a) и (b), здесь конкретные варианты осуществления настоящего изобретения представляют собой такие, в которых один или несколько из R4, R5 и R6 представляют собой гидрокси или галоген. В других все R4, R5 и R6 представляют собой гидроксил или ацетат. Примеры сильных кислот включают йодисто-водородную, бромисто-водородную, хлористоводородную, серную, азотную, фосфорную, алкансульфоновую и аренсульфоновую кислоту. Конкретный вариант осуществления настоящего изобретения представлен ниже на схеме 1 В этом способе увеличивается отношение изомеров E:Z в смеси (Е)-1-(4-1R,2S,3R)-1,2,3,4 тетрагидроксибутил)-1 Н-имидазол-2-ил)этаноноксима и (Z)-1-(4-1R,2S,3R)-1,2,3,4-тетрагидроксибутил)-1 Н-имидазол-2-ил)этаноноксима. Способ включает контактирование раствора, содержащего первую смесь (Е)-1-(4-1R,2S,3R)1,2,3,4-тетрагидроксибутил)-1 Н-имидазол-2-ил)этаноноксима и (Z)-1-(4-1R,2S,3R)-1,2,3,4-тетрагидроксибутил)-1 Н-имидазол-2-ил)этаноноксима, с сильной кислотой при условиях, достаточных для получения второй смеси (Е)-1-(4-1R,2S,3R)-1,2,3,4-тетрагидроксибутил)-1 Н-имидазол-2-ил)этаноноксима и(Z)-1-(4-1R,2S,3R)-1,2,3,4-тетрагидроксибутил)-1 Н-имидазол-2-ил)этаноноксима; где отношение изо-7 017076 меров E:Z для первой смеси является меньшим, чем отношение изомеров E:Z для второй смеси. В конкретном варианте осуществления первую смесь получают путем взаимодействия 1-(41R,2S,3R)-1,2,3,4-тетрагидроксибутил)-1 Н-имидазол-2-ил)этанона с гидроксиламином при условиях,достаточных для образования 1-(4-1R,2S,3R)-1,2,3,4-тетрагидроксибутил)-1 Н-имидазол-2 ил)этаноноксима. 1-(4-1R,2S,3R)-1,2,3,4-тетрагидроксибутил)-1 Н-имидазол-2-ил)этанон может быть получен путем взаимодействия 1-амино-1-дезокси-D-фруктозы с 2-этоксиакрилонитрилом при условиях,достаточных для образования 1-(4-1R,2S,3R)-1,2,3,4-тетрагидроксибутил)-1 Н-имидазол-2-ил)этанона,как показано ниже на схеме 2 Как преимущество, настоящее изобретение предусматривает новые способы получения 1-(41R,2S,3R)-1,2,3,4-тетрагидроксибутил)-1 Н-имидазол-2-ил)этанона. Один из вариантов осуществления охватывает способ получения 1-(4-1R,2S,3R)-1,2,3,4 тетрагидроксибутил)-1 Н-имидазол-2-ил)этанона, который включает добавление первой части метоксида натрия к раствору, содержащему 2-этоксиакрилонитрил, для получения первой смеси; взаимодействия первой смеси с 1-амино-1-дезокси-D-фруктозой для получения второй смеси; добавление второй части метоксида натрия ко второй смеси для получения третьей смеси; добавление уксусной кислоты к третьей смеси для получения четвертой смеси и смешивание четвертой смеси в течение времени и при температуре, достаточных для образования 1-(4-1R,2S,3R)-1,2,3,4-тетрагидроксибутил)-1 Н-имидазол-2 ил)этанона. В конкретном способе вторую смесь поддерживают при температуре более чем примерно 5 С (например, более чем примерно 10, 15 или 20 С). В другом варианте осуществления первую смесь поддерживают при температуре более чем примерно 5 С (например, более чем примерно 10, 15 или 20 С). В другом варианте осуществления первую часть метоксида натрия добавляют в виде раствора метоксида натрия в метаноле в количестве более чем примерно 15 мас.% (например, более чем примерно 20 или 25 мас.%). В другом варианте осуществления вторую часть метоксида натрия добавляют в виде раствора метоксида натрия в метаноле в количестве более чем примерно 15 мас.% (например, более чем примерно 20 или 25 мас.%). В другом варианте осуществления 1-амино-1-дезокси-D-фруктозу получают в суспензии, дополнительно содержащей ее соль с уксусной кислотой. В другом варианте осуществления третью смесь разбавляют водой перед добавлением к ней уксусной кислоты. В другом варианте осуществления четвертую смесь нагревают до температуры более чем примерно 30 С (например, более чем примерно 35, 40, 45, 50, 55 или 60 С). В другом варианте осуществления четвертую смесь нагревают в течение менее чем примерно 5 ч(например, менее чем примерно 4, 3 или 2 ч). В другом варианте осуществления 1-(4-1R,2S,3R)-1,2,3,4-тетрагидроксибутил)-1 Н-имидазол-2 ил)этанон выделяют с выходом более чем примерно 50% (например, более чем примерно 55, 60, 65, 70,75 или 80%). 6. Примеры Аспекты настоящего изобретения могут быть поняты из следующих далее примеров, которые не ограничивают его рамок. 6.1. Пример 1. Получение этоксиакрилонитрила. В 250-мл снабженную кожухом 3-горлую круглодонную колбу с бруском магнитной мешалки, каучуковой перегородкой с датчиком температур, пластиковой пробкой и уравновешенной по давлению наполнительной воронкой с устройством для барботирования загружают бромацетальдегид диэтилацеталь (35,33 г/179,28 ммоль) и хлорид олова(II) (167,1 мг/0,88 ммоль/0,5 мол.%). Суспензию охлаждают до 3 С. Затем добавляют триметилсилилцианид (17,69 г/178,31 ммоль) в течение 11 мин при температуре ниже 15 С. Смесь поддерживают примерно при 10 С в течение 35 мин, а затем примерно при 20 С в течение по меньшей мере 1,75 ч или до тех пор, пока GC (газохроматографический) анализ не покажет из-8 017076 расходование бромацетальдегида диэтилацеталя. Указанный выше светло-желтый раствор разбавляют 85 мл МТВЕ. Диэтиламин (19,61 г, 268,11 ммоль/1,50 экв.) добавляют в течение 6 мин при температуре ниже 35 С. Полученную густую суспензию разбавляют с помощью дополнительных 25 мл МТВЕ. Реакционную смесь перемешивают при примерно 25 С в течение по меньшей мере 1,75 ч или до тех пор, пока реакция не завершится согласно GC анализу. Смесь фильтруют и собранный твердый продукт промывают МТВЕ (230 мл). Объединенный фильтрат концентрируют в вакууме (конечный вакуум: примерно 95 Торр). Полученный сырой этоксиакрилонитрил (17,46 г) подвергают тонкому фильтрованию и вакуумной отгонке с получением прозрачной жидкости (11,2 г, 67% выход). Т.пл.: 46-49 С/31 мм Hg. 1 Н ЯМР (CDCl3)4,85 (д, J=3,54 Гц, 1 Н), 4,75 (д, J=3,28 Гц, 1 Н), 3,73 (кв, J=6,99 Гц, 2 Н), 1,24 (т,J=6,95 Гц, 3 Н). 13 С ЯМР (CDCl3)136,58, 115,23, 101,11, 65,54, 14,40. 6.2. Пример 2. Получение 1-(4-(1R,2S,3R)-1,2,3,4-тетрагидроксибутил)-1 Н-имидазол-2-ил)этанона. В 3-горлую 12-л круглодонную колбу, снабженную механической мешалкой, контроллером температуры, добавляют этоксиакрилонитрил (100,0 г, 1,03 моль) и метанол (качество для ВЭЖХ, 1,0 л, 10). К указанному выше перемешиваемому раствору в течение 15 мин добавляют метоксид натрия в метаноле (25 мас.% 140,6 мл, 0,60 экв.). Смесь перемешивают при 20 С в течение по меньшей мере 3 ч или до тех пор, пока 1 Н ЯМР не покажет по меньшей мере 95% преобразование этоксиакрилонитрила в соответствующий имидат). Указанный выше раствор переносят в течение 15 мин в суспензию соли фруктозамина и уксусной кислоты (246,9 г, 1,0 экв., получают в соответствии с Hodge, J.E.; Fisher, B.E., Methods inCarbohydrate Chemistry 11: 99-103 (1963 в метаноле (1,0 л, 10) и смесь перемешивают при 20 С в течение 6 ч. Другую часть метоксида натрия в метаноле (25 мас.% 117,3 мл, 0,50 экв.) добавляют к смеси в течение 10 мин и смесь перемешивают при 20 С в течение дополнительных 16 ч. Затем смесь разбавляют водой (2,0 л, 20) и обрабатывают уксусной кислотой (118 мл, 2,0 экв.). После перемешивания при 60 С в течение 1 ч раствор концентрируют (50 С, 200-70 мбар) до получения общего объема 1,2 л. Смесь в виде суспензии охлаждают до 0 С и перемешивают в течение 1 ч, затем фильтруют и твердые вещества промывают водой (100 мл, 2). Твердые вещества собирают и сушат в вакууме при 50 С с получением 196,8 г сырого продукта в виде бледно-желтого твердого вещества, который затем обрабатывают водой (980 мл, 5) и полученную суспензию нагревают до кипения в течение 15 мин, затем повторно охлаждают до 0 С и перемешивают в течение дополнительного 1 ч. Смесь опять фильтруют и твердые вещества промывают водой (100 мл, 2) и сушат до постоянной массы в вакуумной печи при 50 С с получением 194,8 г (82%) указанного в заголовке продукта (THI) в виде бледно-желтого твердого вещества (KF=0,4%). 1 Н ЯМР (вода D2O/капля DCl в D2O) 7,48 (д, J=2,0 Гц, 0,9H), 7,19 (д, J=2,0 Гц, 0,1 Н), 5,09 (с, 0,9 Н),4,98 (с, 0,1 Н), 3,40-3,70 (м, 4 Н), 2,53 (д, J=2,4 Гц, 3 Н); 13 С ЯМР (вода D2O/капля DCl в D2O) 185,0, 139,4, 138,0, 119,5, 73,0, 70,9, 65,0, 63,2, 26,7; МН+ = 231,2. 6.3. Пример 3. Получение дигидрата (E)-1-(4-1R,2S,3R)-1,2,3,4-тетрагидроксибутил)-1 Н-имидазол 2-ил)этаноноксима. В 3-горлую 3-л круглодонную колбу, снабженную механической мешалкой, контроллером температуры и холодильником, загружают 1-(4-1R,2S,3R)-1,2,3,4-тетрагидроксибутил)-1 Н-имидазол-2 ил)этанон (100,0 г, 434,4 ммоль), соль гидроксиламина и хлористо-водородной кислоты (45,2 г, 1,5 экв.),ацетат натрия (53,4 г, 1,5 экв.) и метанол (качество для ВЭЖХ, 1,0 л, 10). Указанный выше раствор нагревают при 65 С при перемешивании в течение 2 ч. Затем к смеси добавляют в течение 15 мин раствор HCl в изопропаноле (только что приготовленный посредством медленного добавления 92,7 мл ацетилхлорида к 200 мл изопропанола при 0 С, 3,0 экв.) и полученную смесь перемешивают при 65 С в течение 3 ч. Смесь разбавляют МеОН (1,0 л, 10),охлаждают до комнатной температуры и осажденный хлорид натрия удаляют с помощью фильтрования. Твердые вещества промывают МеОН (100 мл, 1) и раствор концентрируют при 40 С в вакууме до тех пор, пока не начнут образовываться твердые вещества (примерно 200 мл). Затем добавляют воду (1,0 л,10) и остатки органических растворителей удаляют при 40 С в вакууме. Осуществляют тонкое фильтрование с получением прозрачного желтого раствора. К этому раствору медленно добавляют 50% водный раствор NaOH при комнатной температуре таким образом, чтобы температура смеси не превышала 40 С, до тех пор, пока не будет достигнут рН 7,2 (7,0-7,5). Затем полученный раствор нагревают до 65 С с образованием гомогенного раствора и концентрируют в вакууме при 65 С (60-70 С) до тех пор, пока раствор не достигнет общего объема примерно 500 мл (5). Затем смесь медленно охлаждают до комнатной температуры, дополнительно охлаждают до 0 С и перемешивают при 0 С в течение 1 ч. Твердые продукты собирают с помощью фильтрования и промывают водой (0 С, 100 мл, 1, 2) с получением белого кристаллического твердого вещества. К полученному выше влажному твердому веществу добавляют воду (400 мл) и полученную смесь нагревают до 70-80 С до полного растворения. Раствор охлаждают до комнатной температуры, а затем-9 017076 перемешивают при 0 С в течение 1 ч. Твердые вещества собирают с помощью фильтрования и промывают водой (0 С, 100 мл, 1, 2), а затем сушки в вакууме при 30 С в течение ночи с получением 99,4 г указанного в заголовке соединения. Анализ ЯМР показывает, что материал содержит примерно 3% Zизомера. 6.4. Пример 4. Получение безводного (Е)-1-(4-(1R,2S,3R)-1,2,3,4-тетрагидроксибутил)-1 Нимидазол-2-ил)этанона оксима. Твердое вещество из примера 3 суспендируют с помощью EtOH (800 мл, 8) и нагревают при 75 С в течение 1 ч. Полученную смесь охлаждают до 0 С и перемешивают при 0 С в течение 1 ч. Белое твердое вещество собирают с помощью фильтрования и промывают EtOH (0C, 100 мл, 1, 2) и сушат при 50 С в вакууме до постоянной массы с получением указанного в заголовке соединения. Анализ ЯМР показывает примерно 2% Z-изомера. 1 Н ЯМР (D2O) 7,05 (с, 1 Н), 4,83 (д, J=3,6 Гц, 1 Н), 3,60-3,80 (м, 3 Н), 3,50 (дд, J=11,6, 6,8 Гц, 1 Н), 2,11(д, J=4,0 Гц, 3 Н); 1 Н ЯМР (вода D2O/капля DCl в D2O) 7,30 (с, 1H), 5,04 (с, 1 Н), 3,45-3,75 (м, 4 Н), 2,13 (с, 3 Н); 13 С ЯМР (вода D2O/капля DCl в D2O) 143,8, 140,9, 135,0, 116,9, 72,5, 70,6, 64,4, 62,7, 10,5; МН+ = 246,1. 6.5. Пример 5. Определение отношений изомеров Е:Z. Относительные количества изомеров Е и Z соединений формулы I могут определяться с помощью различных методик, известных в данной области. Например, относительные количества (Е)-1-(41R,2S,3R)-1,2,3,4-тетрагидроксибутил)-1 Н-имидазол-2-ил)этаноноксима и (Z)-1-(4-1R,2S,3R)-1,2,3,4 тетрагидроксибутил)-1 Н-имидазол-2-ил)этаноноксима в смеси их обоих могут быстро определяться с помощью ЯМР, как показано на чертеже. Все цитируемые публикации, патенты и заявки на патенты включены в настоящее описание посредством ссылок во всей полноте. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения изомерной смеси соединения формулы I, обогащенной изомером Е где X представляет собой С 2-10 алкил, необязательно замещенный одним или более заместителем, таким как гидроксил, ацетил или галоген; R1 представляет С 2-6 алкил; R2 представляет собой водород, галоген,цианогруппу или С 2-6 алкил и R3 представляет собой водород или С 2-6 алкил, необязательно замещенный одним или более заместителем, таким как гидроксил, ацетил или галоген; который включает взаимодействие соединения формулы II с образованием первой смеси Е- и Z-изомеров соединения формулы I; и взаимодействие этой первой смеси с сильной кислотой с образованием второй смеси Е- и Zизомеров соединения формулы I, где отношение E:Z изомеров первой смеси является меньшим, чем отношение E:Z изомеров второй смеси. 2. Способ по п.1, в котором R2 представляет собой водород. 3. Способ по п.1, в котором R3 представляет собой водород. 4. Способ по п.1, в котором соединение формулы I представляет собой соединение формулы I(a) где каждый из R4, R5, R6 и R7 независимо представляет собой гидроксил, ацетил или галоген. 5. Способ по п.4, в котором соединение формулы I(a) представляет собой стереомерно чистое соединение формулы I(b) 6. Способ по п.5, в котором один или несколько из R4, R5 и R6 представляют собой гидрокси или галоген. 7. Способ по п.5, в котором все R4, R5 и R6 представляют собой гидроксил или ацетил. 8. Способ по п.1, в котором сильная кислота представляет собой йодисто-водородную, бромистоводородную, хлористо-водородную, серную, азотную, фосфорную, алкансульфоновую или аренсульфоновую кислоту. 9. Способ по п.1, в котором отношение E:Z изомеров увеличивается от менее чем примерно 5:1 до более чем примерно 8:1. 10. Способ по п.9, в котором отношение E:Z изомеров увеличивается от менее чем примерно 4:1 до более чем примерно 10:1. 11. Способ по п.10, в котором отношение E:Z изомеров увеличивается от примерно 3:1 до более чем примерно 13:1. 12. Способ увеличения отношения E:Z изомеров в смеси (Е)-1-(4-1R,2S,3R)-1,2,3,4 тетрагидроксибутил)-1 Н-имидазол-2-ил)этаноноксима и (Z)-1-(4-1R,2S,3R)-1,2,3,4-тетрагидроксибутил)-1 Н-имидазол-2-ил)этаноноксима, который включает взаимодействие раствора, содержащего первую смесь (Е)-1-(4-1R,2S,3R)-1,2,3,4-тетрагидроксибутил)-1 Н-имидазол-2-ил)этаноноксима и (Z)-1-(41R,2S,3R)-1,2,3,4-тетрагидроксибутил)-1 Н-имидазол-2-ил)этанон оксима, с сильной кислотой с образованием второй смеси (Е)-1-(4-1R,2S,3R)-1,2,3,4-тетрагидроксибутил)-1 Н-имидазол-2-ил)этаноноксима и(Z)-1-(4-1R,2S,3R)-1,2,3,4-тетрагидроксибутил)-1 Н-имидазол-2-ил)этаноноксима; где отношение E:Z изомеров первой смеси является меньшим, чем отношение изомеров E:Z второй смеси. 13. Способ по п.12, в котором первую смесь получают путем взаимодействия 1-(4-1R,2S,3R)1,2,3,4-тетрагидроксибутил)-1 Н-имидазол-2-ил)этанона с гидроксиламином с образованием 1-(41R,2S,3R)-1,2,3,4-тетрагидроксибутил)-1 Н-имидазол-2-ил)этаноноксима. 14. Способ по п.12, в котором 1-(4-1R,2S,3R)-1,2,3,4-тетрагидроксибутил)-1 Н-имидазол-2 ил)этанон получают путем взаимодействия 1-амино-1-дезокси-D-фруктозы с 2-этоксиакрилонитрилом. 15. Способ по п.12, в котором раствор содержит спирт. 16. Способ по п.15, в котором спирт представляет собой метанол, этанол, пропанол или изопропанол. 17. Способ по п.12, в котором сильная кислота представляет собой йодисто-водородную, бромистоводородную, хлористо-водородную, серную, азотную, фосфорную, алкансульфоновую или аренсульфоновую кислоту. 18. Способ получения 1-(4-1R,2S,3R)-1,2,3,4-тетрагидроксибутил)-1 Н-имидазол-2-ил)этанона, который включает добавление первой части метоксида натрия к раствору, содержащему 2-этоксиакрилонитрил, с получением первой смеси; взаимодействие первой смеси с 1-амино-1-дезокси-D-фруктозой с получением второй смеси; добавление второй части метоксида натрия к второй смеси с получением третьей смеси; добавление уксусной кислоты к третьей смеси с получением четвертой смеси и перемешивание четвертой смеси с образованием 1-(4-1R,2S,3R)-1,2,3,4-тетрагидроксибутил)-1 Нимидазол-2-ил)этанона;- 11017076 где вторую смесь поддерживают при температуре более чем примерно 5 С. 19. Способ по п.18, в котором первую смесь поддерживают при температуре более чем примерно 5 С. 20. Способ по п.18, в котором первую часть метоксида натрия добавляют в виде раствора метоксида натрия в метаноле в количестве более чем примерно 15 мас.%. 21. Способ по п.18, в котором вторую часть метоксида натрия добавляют в виде раствора метоксида натрия в метаноле в количестве более чем примерно 15 мас.%. 22. Способ по п.18, в котором 1-амино-1-дезокси-D-фруктозу получают в суспензии, дополнительно содержащей ее соль с уксусной кислотой. 23. Способ по п.18, в котором третью смесь разбавляют водой перед добавлением к ней уксусной кислоты. 24. Способ по п.18, в котором четвертую смесь нагревают до температуры более чем примерно 30 С. 25. Способ по п.24, в котором четвертую смесь нагревают в течение менее чем примерно 5 ч. 26. Способ по п.18, в котором 1-(4-1R,2S,3R)-1,2,3,4-тетрагидроксибутил)-1 Н-имидазол-2 ил)этанон выделяют с выходом более чем примерно 50%.
МПК / Метки
МПК: C07D 233/64
Метки: получения, имидазола, основе, способы, соединений
Код ссылки
<a href="https://eas.patents.su/13-17076-sposoby-polucheniya-soedinenijj-na-osnove-imidazola.html" rel="bookmark" title="База патентов Евразийского Союза">Способы получения соединений на основе имидазола</a>
Следующий патент: Фунгицидная композиция
Случайный патент: Гербицидная комбинация