Улучшенные димеры sgp130fc
Формула / Реферат
1. Полипептидный димер, способный ингибировать активность агонистического комплекса IL-6/sIL-6R и содержащий два мономера, где каждый из указанных мономеров содержит внеклеточную часть молекулы gp130, или ее вариант, или фрагмент, слитые с доменом Fc белка IgG1, и где, по меньшей мере, аминокислотный остаток Leu235 шарнирной области домена Fc заменен по меньшей мере одним гидрофильным аминокислотным остатком.
2. Полипептидный димер по п.1, где гидрофильный аминокислотный остаток представляет собой Glu или Asp.
3. Полипептидный димер по п.1 или 2, где, кроме того, аминокислотный остаток Leu234 шарнирной области заменен на Phe или Ala.
4. Полипептидный димер по п.3, где аминокислотные остатки Leu234 и/или Gly237 шарнирной области заменены аминокислотным остатком Ala.
5. Полипептидный димер по любому из пп.1-4, где шарнирная область содержит мотив аминокислотной последовательности Ala234-Glu235-Gly236-Ala237 вместо Leu234-Leu235-Gly236-Gly237.
6. Полипептидный димер по п.5, где шарнирная область содержит аминокислотную последовательность Asp221-Lys222-Thr223-His224-Thr225-Cys226-Pro227-Pro228-Cys229-Pro230-Ala231-Pro232-Glu233-Ala234-Glu235-Gly236-Ala237-Pro238-Ser239-Val240.
7. Полипептидный димер по любому из пп.1-6, где растворимая молекула gp130, или ее вариант, или фрагмент слиты с шарнирной областью домена Fc белка IgG1 непосредственно или посредством гибкого полипептидного линкера.
8. Полипептидный димер по п.7, где линкер представляет собой линкер, содержащий 2-50 аминокислотных остатка, независимо выбранных из группы, состоящей из глицина, серина, аспарагина, треонина и аланина.
9. Полипептидный димер по любому из пп.1-8, где между растворимой молекулой gp130, или ее вариантом, или фрагментом и доменом Fc вставлен один или более сайтов N-гликозилирования.
10. Полипептидный димер по любому из пп.1-9, где мономеры соединены друг с другом посредством простой ковалентной связи, гибкого пептидного линкера либо одного или более дисульфидных мостиков.
11. Полипептидный димер по любому из пп.1-10, где по меньшей мере один мономер указанного димера является ПЭГилированным.
12. Полинуклеотид, кодирующий мономер полипептидного димера по любому из пп.1-10.
13. Вектор экспрессии, содержащий полинуклеотид по п.12.
14. Клетка-хозяин, содержащая вектор экспрессии по п.13.
15. Способ получения полипептидного димера по любому из пп.1-10, включающий культивирование клетки-хозяина по п.14 и выделение мономера или димера из указанной клетки-хозяина или культуры.
16. Фармацевтическая композиция, содержащая полипептидный димер по любому из пп.1-11.
17. Применение полипептидного димера по любому из пп.1-11 для изготовления фармацевтической композиции для лечения и/или предупреждения заболевания или расстройства, при которых благоприятно блокирование агонистического комплекса IL-6/sIL-6R.
18. Применение по п.17, где указанное заболевание представляет собой резорбцию кости, гиперкальцемию, кахексию, опухоль или другой тип рака, аутоиммунное заболевание, воспалительное или атопическое заболевание, инфекцию, эндокринное расстройство либо метаболическое или катаболическое заболевание.

Текст
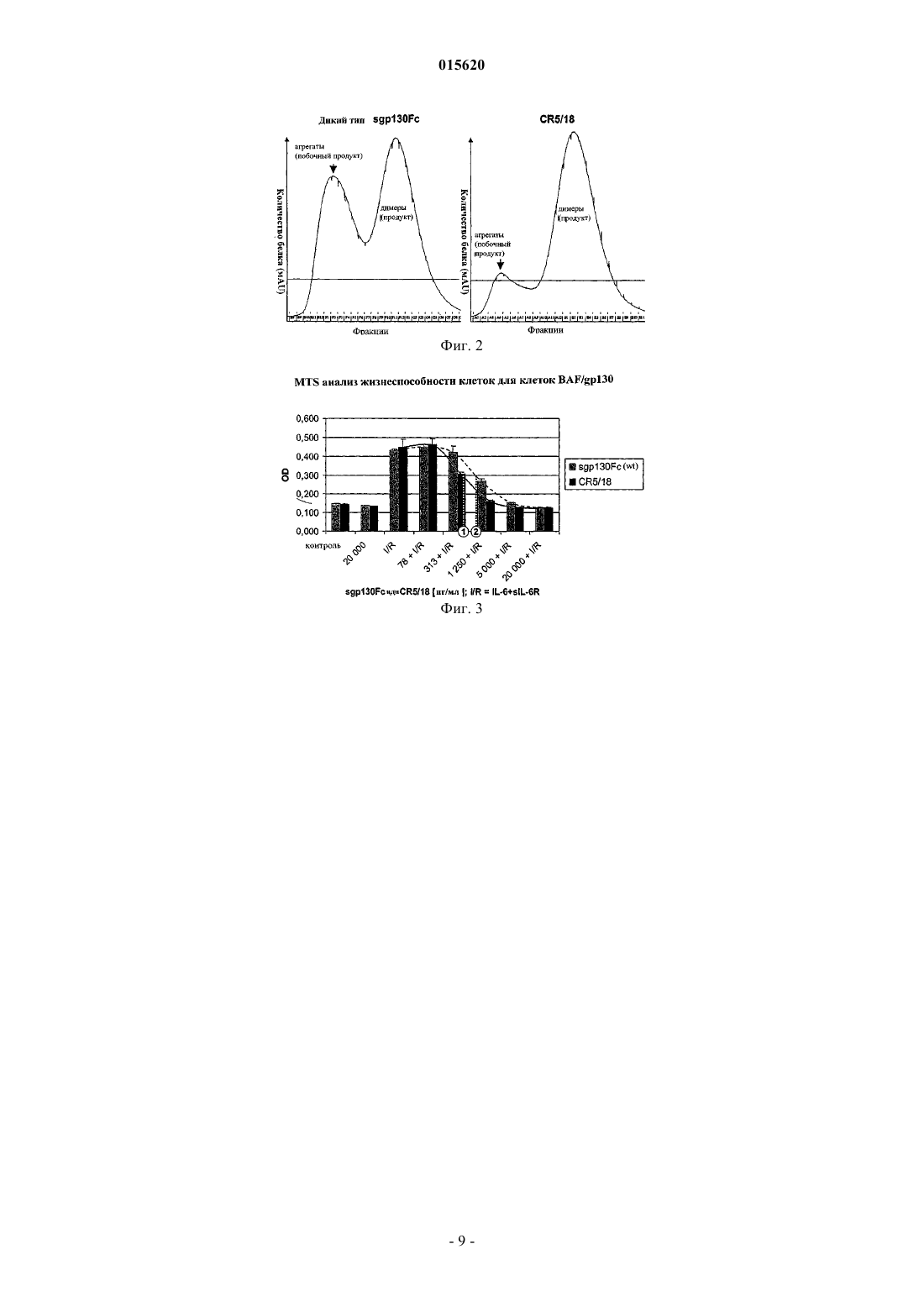
ОПИСАНИЕ ИЗОБРЕТЕНИЯ К ЕВРАЗИЙСКОМУ ПАТЕНТУ Дата публикации и выдачи патента Описаны полипептидные димеры, содержащие две растворимые молекулы gp130, где каждая из указанных молекул слита с Fc доменом белка IgG1 и где шарнирная область доменаFc модифицирована таким образом, чтобы придавать димеру благоприятные свойства. В особенно предпочтительном воплощении шарнирная область содержит мотив аминокислотной последовательности Ala234-Glu235-Gly236-Ala237. Кроме того, описаны фармацевтическая композиция,содержащая указанный димер, и различные медицинские применения.(71)(73) Заявитель и патентовладелец: КОНАРИС РИСЕРЧ ИНСТИТЬЮТ АГ (DE) 015620 Настоящее изобретение относится к полипептидному димеру, содержащему две растворимые молекулы gp130, каждая из которых слита с доменом Fc белка IgG1, где шарнирная область домена Fc модифицирована таким образом, чтобы придавать димеру полезные свойства. Настоящее изобретение также относится к фармацевтической композиции, содержащей указанный димер, и к различным медицинским применениям. Плейотропный цитокин интерлейкин 6 (IL-6) демонстрирует широкий спектр биологических функций, среди которых наиболее значительными являются стимуляция В-клеток и индукция синтеза белков острой фазы в печени. IL-6 осуществляет свою активность в отношении клеток-мишеней посредством связывания со специфичным поверхностным рецептором IL-6 (IL-6R). Этот комплекс рецептор/лиганд содействует гомодимеризации gp130, второй субъединицы IL-6 рецепторного комплекса. Димеризацияgp130 имеет результатом трансдукцию сигнала IL-6. Растворимые формы IL-6R (sIL-6R), которые генерируются посредством двух механизмов (альтернативный сплайсинг и шеддинг), также способны запускать димеризацию gp130 и передачу сигнала при образовании комплекса с IL-6. Поскольку цитоплазматическая часть IL-6R не вносит вклада в трансдукцию сигнала, передача сигнала гомодимером gp130 может быть индуцирована IL-6 в комплексе с мембраносвязанным или растворимым IL-6R. Однако присутствие SIL-6R ведет к сенсибилизации IL-6-отвечающих клеток в отношении лиганда. Кроме того, строго IL-6-зависимые клетки гибридомы не пролиферируют в ответ на очень низкие количества IL-6, когда присутствующий в культуральных средах SIL-6R постоянно удаляется. Первоначально описанный как трансдуктор сигнала интерлейкина-6, gp130 является участником трансдукторной системы, в которой участвуют многие цитокины, такие как IL-6, IL-11, ингибирующий лейкемию фактор (LIF), онкостатин М (OSM) и цилиарный нейротрофический фактор (CNTF). Все эти цитокины действуют через состоящий из двух или трех компонентов рецепторный комплекс, в котором передача сигнала запускается гомодимеризацией (для IL-6) или гетеродимеризацией gp130 с LIF-R (дляLIF, CT-1, OSM, CLC и CNTF) или OSM-R (для OSM). Эти цитокины могут, таким образом, опосредовать сходные биологические активности в различных тканях. В то время как gp130 может быть обнаружен почти во всех типах клеток, IL-6R демонстрирует намного более ограниченную экспрессию. Высвобождение SIL-6R одним типом клеток делает другие клетки, которые экспрессируют только gp130, отвечающими на IL-6. Этот сценарий называют транссигналинг. Действительно, было описано несколько клеточных активностей, для которых необходим комплексSIL-6R и IL-6, и которые не обнаруживаются в присутствии только одного IL-6. Растворимый белокgp130 найден в высоких концентрациях в человеческой плазме. Недавно был описан сконструированный цитокин гипер-L-6 (H-IL-6), в котором С-конец SIL-6R ковалентно соединен с N-концом зрелого IL-6 гибким пептидным линкером. Как и в случае комплекса IL-6/sIL-6R, H-IL-6 также действует на клетки,которые экспрессируют только gp130. В отличие от отдельных компонентов IL-6 и sIL-6R, в 100-1000 раз более низкие концентрации этой слитой молекулы являются достаточными для того, чтобы индуцировать сравнимые биологические сигналы. Для лечения различных заболеваний или расстройств может быть желательным специфичное блокирование IL-6 ответов, зависящих от растворимого IL-6R. Такие заболевания включают резорбцию кости, гиперкальцемию, кахексию, опухоли или другие типы рака (например рак ободочной кишки, множественную миелому, лимфому, лейкемию, болезнь Ходжкина), аутоиммунные заболевания (например рассеянный склероз (PC) или диабет типа 1), воспалительные или атопические заболевания (например болезнь Крона, язвенный колит, ревматоидный артрит, ювенильный ревматоидный артрит, астму, псориаз,саркоидоз, красную системную волчанку или увеит), инфекции (например бактериями, вирусами, грибами или другими патогенами), а также эндокринные расстройства и метаболические или катаболические заболевания (например диабет типа 2, ожирение, гипергликемию или гиперхолистеринемию). Было обнаружено, что, например, димеры sgp130 или димеры sgp130Fc пригодны для терапевтических применений. Техническая задача, лежащая в основе настоящего изобретения, заключается в создании улучшенных димеров sgp130Fc. Указанная техническая задача решена посредством предложения воплощений изобретения, охарактеризованных в формуле изобретения. Во время осуществления экспериментов, приведших к созданию настоящего изобретения, было обнаружено, что биологическая активность, способность к очистке и стабильность слитых белков sgp130Fc в значительной степени зависят от аминокислотного состава шарнирной области между sgp130 и Fc участком. Аминокислоты 234, 235 и 237 человеческого IgG1-Fc (согласно нумерации EU) были подвергнуты мутации для того, чтобы снизить связывание рецептора Fc с этим мотивом (Duncan et al., Nature (1988), 332: 563-564; Canfield and Morrison, J. Exp. Med. (1991), 173: 14831491; Wines et al., J. Immunol. (2000), 164: 5313-5318; Sondermann et al., Nature (2000), 406: 267). Неожиданно было установлено, что посредством замены Leu235 в последовательности дикого типа Leu234-Leu235Gly236-Gly237 глутаматом (Glu, E) или аспартатом (Asp, D) и тем самым нарушения гидрофобного мотива высокогидрофильной (заряженной) аминокислотой, биологическая активность и стабильность слитых белков sgp130Fc могут быть улучшены. Мутации в положениях 234 и 237 усиливают этот эффект. Самый мощный мутант имеет последовательность Ala234-Glu235-Gly236-Ala237.-1 015620 Краткое описание графических материалов Фиг. 1. Шарнирная область мутеинов sgp130Fc Нижняя шарнирная область человеческого IgG1-Fc была модифицирована посредством сайтнаправленного мутагенеза. Идеальная последовательность, определенная в экспериментах, представляет собой "AEGA" (как она включена в соединение CR5/18). Сокращения и символы: аа - аминокислота(ы); С - цистеины, формирующие два дисульфидных мостика, необходимых для димеризации слитого белка Fc; X - аланин (Ala, А) или фенилаланин (Phe, F);CR5/18 показывает значительно меньшее количество агрегатов (побочных продуктов) по сравнению с sgp130Fc дикого типа и, таким образом, более высокий выход незагрязненного продукта. Фиг. 3. Ингибирование IL-6/sIL-6R-индуцированной пролиферации клеток BAF3/gp130 посредством CR5/18 или sgp130Fc дикого типа, как определено MTS анализами жизнеспособности клетокCR5/18 является значительно более биологически активным, чем sgp130Fc дикого типа (wt) в плане блокирования пролиферации, запускаемой 100 нг/мл IL-6 и 50 нг/мл SIL-6R. Это отображается величиной IC50 дляCR5/18 (1), которая составляет приблизительно половину от IC50 для sgp130Fc (2). Сокращения и символы: IC50 концентрация с 50%-ой эффективностью ингибирования; IL-6 - интерлейкин-6; I/R - IL-6 плюс sIL-6R; MTS субстрат, который преобразуется метаболически активными клетками в растворимый продукт формазан, поглощающий при 490 нм; OD - оптическая плотность при 490 нм; SIL-6R - растворимый рецептор интерлейкина 6. Таким образом, настоящее изобретение относится к полипептидным димерам, способным ингибировать активность агонистического комплекса IL-6/sIL-6R и содержащим два мономера, где каждый мономер содержит растворимую молекулу gp130 либо ее вариант или фрагмент, слитые с доменом Fc белкаIgG, и где по меньшей мере аминокислотный остаток Leu235 шарнирной области домена Fc заменен по меньшей мере одним гидрофильным аминокислотным остатком. Предпочтительные гидрофильные аминокислотные остатки представляют собой Glu и Asp. Термин "растворимая", как он используется здесь, относится к молекуле gp130 без внутриклеточного домена и предпочтительно без трансмембранного домена. Димеры по настоящему изобретению могут быть сконструированы с использованием известных способов. Используемые домены могут состоять из целого внеклеточного домена gp130 либо они могут состоять из его мутантов или фрагментов, которые обладают способностью ингибировать активность агонистического комплекса IL-6/sIL-6R. Предпочтительные фрагменты представляют собой фрагменты,состоящие, по меньшей мере, из внеклеточных доменов D1-D3. Выражение "слитый с доменом Fc белка IgG" означает, что предпочтительно партнер слияния димера состоит только из домена Fc белка IgG1. Однако этот участок Fc может содержать последовательности из более чем одного изотипа IgG, и выбор конкретных мотивов последовательности для оптимизации желательных эффекторных функций находится в пределах навыков специалиста в данной области техники. В предпочтительном воплощении полипептидного димера по настоящему изобретению аминокислотный остаток шарнирной области Leu234 заменен на Phe или Ala. В более предпочтительном воплощении полипептидного димера по настоящему изобретению аминокислотные остатки Leu234 и/или Gly237 шарнирной области заменены аминокислотным остатком Ala. В еще более предпочтительном воплощении полипептидного димера по настоящему изобретению шарнирная область содержит мотив аминокислотной последовательности Ala234-Glu235-Gly236-Ala237 вместо Leu234-Leu235-Gly236-Gly237. Особенно предпочтительным является полипептидный димер, где шарнирная область содержит аминокислотную последовательность Asp221-Lys222-Thr223-His224-Thr225-Cys226-Pro227-Pro228-Cys229-Pro230Ala231-Pro232-Glu233-Ala234-Glu235-Gly236-Ala237-Pro238-Ser239-Val240. Слияние внеклеточного домена gp130 (sgp130), предпочтительно по С-концу, или его варианта, или фрагмента с шарнирной областью участка Fc может быть непосредственным, либо для него могут быть использованы гибкие полипептидные линкерные домены разной длины и аминокислотного состава. Эти линкеры могут быть либо полностью искусственными (например содержащими 2-50 аминокислотных остатков, независимо выбранных из группы, состоящей из глицина, серина, аспарагина, треонина и аланина), либо полученными из встречающихся в природе белков. Такие линкеры могут усиливать гибкость и связывающие свойства димера. Кроме того, слитые белки sgp130Fc по изобретению могут быть дополнительно слиты с метками,таким как поли(His), Мус, Strep, полиаргинин, Flag, зеленый флуоресцентный белок (GFP), ТАР, глутатион-S-трансфераза (GST), НА, кальмомодулин-связывающий пептид (СВР), мальтоза-связывающий белок (MBP), V5, HSV (вирус простого герпеса), S, вирус везикулярного стоматита (VSV), белок С, люцифераза, Glu-Glu, Е, бета-GAL, Т 7 или другие эпитопы, к которым доступны антитела или другие связывающие молекулы для обеспечения быстрой очистки, обнаружения в вестерн-блоттинге или ELISA(твердофазный иммуноферментный анализ), иммунопреципитации или снижения/блокирования актив-2 015620 ности в биоанализах. В еще одном предпочтительном воплощении полипептидного димера по настоящему изобретению один или более сайтов N-гликозилирования вставлены между растворимой молекулой gp130, или ее вариантом, или фрагментом и доменом Fc. Аминокислотные мотивы сайтов N-гликозилирования с коровой последовательностью Asn-X-Ser или Asn-X-Thr зависят от контекста мотива в белке и могут быть предсказаны и сконструированы специалистом в данной области техники, например, посредством использования бесплатного программного обеспечения, такого как NetNGIyc (Центр Анализа Биологических Последовательностей, Технический университет Дании (Center for Biological Sequence Analysis, TechnicalUniversity of Denmark. Предпочтительным элементом линкера N-гликозилирования для димеровsgp130Fc по изобретению является His-Asn-Leu-Ser-Val-Ile. Другим объектом настоящего изобретения являются ПЭГилированные или другие химически модифицированные формы димеров. ПЭГилирование молекул sgp130 может быть осуществлено, например,согласно способам, описанным для человеческих IFN-, IFN-, IFN-, IL-15 или IL-2 (Youngster et al.,Curr Pharm Des (2002), 8:2139; Grace et al., J. Interferon Cytokine Res (2001), 21:1103; Pepinsky et al., J.Pharmacol Exp Ther (2001), 297:1059; Pettitet al., J. Biol Chem (1997), 272:2312; Goodson et al. Biotechnology NY (1990), 8:343; Katre; J. Immunol (1990), 144:209). Для настоящего изобретения подходит любой вид полиэтиленгликоля (ПЭГ) при условии, что ПЭГполипептид-димер сохранит способность блокировать IL-6 ответы, зависящие от SIL-6R, что может быть проанализировано способами, известными в данной области техники. Предпочтительно полиэтиленгликоль в полипептидном димере по настоящему изобретению представляет собой ПЭГ 1000, 2000, 3000, 5000, 10000, 15000, 20000 или 40000, причем особо предпочтителен полиэтиленгликоль 20000 или 40000. Для образования димера две растворимые gp130 молекулы соединяют друг с другом простой ковалентной связью, гибким пептидным линкером или предпочтительно посредством одного или более дисульфидных мостиков. Пептидные линкеры могут быть полностью искусственными (например содержащими 2-20 аминокислотных остатков, независимо выбранных из группы, состоящей из глицина, серина, аспарагина, треонина и аланина) или полученными из встречающихся в природе белков. Образование дисульфидных мостиков может быть осуществлено, например, посредством рекомбинантной экспрессии, где нуклеиновокислотная последовательность, кодирующая мономер sgp130Fc, содержит один или более кодонов,кодирующих цистеин, предпочтительно в шарнирной области шарнира домена Fc. Димеры по настоящему изобретению предпочтительно продуцируют рекомбинантным образом путем использования полинуклеотида, кодирующего мономер димера, и векторов, предпочтительно векторов экспрессии, содержащих указанные полинуклеотиды. Для получения димеров по изобретению полинуклеотиды получают из существующих клонов, то есть они предпочтительно кодируют встречающийся в природе полипептид или его часть (для человеческого gp130/IL6ST: последовательность GenBankNM002184 и поддерживающие клоны; для константной области человеческого IgG1/IGHG1: например,последовательность GenBank AK057754). Полипептиды, кодируемые любым полинуклеотидом, который гибридизуется с комплеменом нативной ДНК или РНК в условиях высокой строгости или умеренной строгости (определения см. в Sambrook, Molecular Cloning A Laboratory Manual, Cold Spring Harbor Laboratory (1989) N.Y.) до тех пор, пока этот полипептид сохраняет биологическую активность нативной последовательности, также полезны для получения димеров по настоящему изобретению. Рекомбинантные векторы могут быть созданы способами, хорошо известными специалисту в данной области техники; см., например, Sambrook, Molecular Cloning A Laboratory Manual, Cold Spring Harbor Laboratory (1989) N.Y. Для поддержания и экспрессии последовательностей, кодирующих димеры по настоящему изобретению, могут быть использованы разнообразные системы вектор экспрессии/хозяин. Они включают, без ограничения ими, микроорганизмы, такие как бактерии, трансформированные рекомбинантным бактериофагом, плазмидой или космидными ДНК-векторами экспрессии; дрожжи, трасформированные дрожжевыми векторами экспрессии; системы на основе клеток насекомых, инфицированных вирусными векторами экспрессии (например бакуловирусом); системы на основе растительных клеток, трансформированных вирусными векторами экспрессии (например вирусом мозаики цветной капусты, CaMV; вирусом мозаики табака, TMV) или бактериальными векторами экспрессии (например плазмидами Ti или pBR322); или системы на основе животных клеток. В бактериальных системах может быть выбран целый ряд векторов экспрессии в зависимости от применения, предназначенного для полипептидного димера по настоящему изобретению. Векторы, пригодные для использования в настоящем изобретении, включают, без ограничения ими, pSKK экспрессирующий вектор для экспрессии в бактериях. В разновидностях дрожжей дикого типа или модифицированных (например подвергнутых гликоинжинирингу), таких как Saccharomyces cerevisiae, Schizosaccharomyces pombe или Pichia pastoris, может быть использован ряд векторов, содержащих конституитивные или индуцибельные промоторы или системы промоторов, такие как альфа-фактор, алкогольоксидаза, PGH (фосфоглицераткиназа), тетрациклинглюкоза и т.д.; обзор см. в Grant et al. (1987) Methods Enzymol. 153:516-544; Siam et al. (2004) Methods-3 015620 33:189-198; Macauley-Patrick et al. (2005) Yeast 22:249-270, Gellissen et al. (2005) FEMS Yeast Res. 5:10791096; Wildt and Gerngross (2005) Nat.Rev.Microbiol. 3:119-128. В случаях, когда используются растительные системы экспрессии из уровня техники (обзор см. в,например, Stoger et al. (2005) Curr.Opin.Biotechnol.16:167-173; Gomord et al. (2005) Trends Biotechnol. 23:559-565), экспрессия последовательностей, кодирующих димер (или его мономеры) по настоящему изобретению, может находиться под контролем любого из множества промоторов. Например, могут использоваться вирусные промоторы, такие как промоторы 35S и 19S CaMV, по-отдельности или в комбинации с омега-лидерной последовательностью из TMV (Takamatsu (1987) EMBO J. 6:307-311). Альтернативно могут использоваться растительные промоторы, такие как промоторы малой субъединицыRUBISCO или белков теплового шока, (Coruzzi et al. (1984) EMBO J. 3:1671-1680; Broglie et al. (1984)Science 224:838-843; и Winter et al. (1991) Results Probl. Cell Differ. 17:85-105). Эти конструкты могут быть введены в растительные клетки непосредственной ДНК-трансформацией или патогенопосредованной трансфекцией. Такие методики описаны во многих общедоступных обзорах (см., например, Hobbs and Murry in McGraw Hill Yearbook of Science and Technology (1992) McGraw Hill, New York,NY.; pp. 191-196). Для экспрессии димеров (или их мономеров) по настоящему изобретению также может быть использована система насекомых. Например, в одной такой системе в качестве вектора для экспрессии чужеродных генов в клетках Spodoptera frugiperda или в личинках Trichoplusia используется вирус ядерного полигедрозиса Autographa californica (AcNPV). Последовательности могут быть клонированы в несущественную область вируса, такую как ген полигедрина, и помещены под контроль промотора полигедрина. Успешная вставка ДНК-последовательности, кодирующей мономеры sgp130Fc или их фрагменты или варианты, сделает ген полигедрина неактивным и приведет к продуцированию рекомбинантного вируса без белка оболочки. Затем эти рекомбинантные вирусы могут использоваться для инфицирования, например, клеток S. frugiperda или личинок Trichoplusia, в которых может быть экспрессирован sgp130Fc по настоящему изобретению (Engelhard et al. (1994) Proc. Nat. Acad. Sci. 91:3224-3227). В клетках-хозяевах млекопитающих может быть использовано большое количество систем экспрессии на основе, например, липидной трансфекции или вирусной трансдукции клеток. В тех случаях, когда в качестве вектора экспресии используется аденовирус, последовательности, кодирующие полипептид(ы) по настоящему изобретению, могут быть лигированы в комплекс транскрипции/трансляции аденовируса, состоящий из позднего промотора и тройчатой лидерной последовательности. Вставка в несущественную область Е 1 или ЕЗ вирусного генома может использоваться для получения жизнеспособного вируса, который способен экспрессировать полипептиды по настоящему изобретению в инфицированных клетках-хозяевах (Logan, J and Shenk, Т. (1984) Proc. Natl. Acad. Sci. 81:3655-3659). Кроме того, для усиления экспрессии в клетках-хозяевах млекопитающего могут быть использованы транскрипционные энхансеры, такие как энхансер вируса саркомы Рауса (RSV). После введения рекомбинантного вектора(ов) клетки-хозяева выращивают в селективной среде, которая позволяет осуществлять селекцию на рост клеток, содержащих вектор. Для выделения трансформированных клеточных линий может быть использовано любое количество систем селекции. Они включают, без ограничения ими, тимидинкиназу вируса простого герпеса (Wigler, M. et al. (1977) Cell 11:22332) и аденинфосфорибозилтрансферазу (Lowy, I. et al. (1980) Cell 22:817-23), гены, которые могут использоваться в tk.sup.- или aprt.sup.- клетках, соответственно. Кроме того, в качестве основы для селекции может использоваться устойчивость к антиметаболиту, антибиотику или гербициду; например, генdhfr (кодирует дигидрофолатредуктазу), который придает устойчивость к метотрексату (Wigler, М. et al.(1980) Proc. Natl. Acad. Sci.77:3567-70); ген npt (кодирует неомицинфосфотрансферазу), который придает устойчивость к аминогликозидам неомицину и G-418 (Colbere Colbere-Garapin, F. et al (1981) J. Mol. Biol. 150:1-14) и ген als (кодирует ацетолактатсинтазу) или ген pat (кодирует фосфинотрицинацетилтрансферазу), которые придают устойчивость к хлорсульфурону и фосфинотрицинацетилтрансферазе, соответственно. Были описаны дополнительные гены для селекции, например, ген trpB (кодирует триптофансинтазу В), который позволяет клеткам утилизировать индол вместо триптофана, или ген hisD (кодирует гистидинолдегидрогеназу), который позволяет клеткам утилизировать гистинол вместо гистидина (Hartman, S. С. and R. С. Mulligan (1988) Proc. Natl. Acad. Sci. 85:8047-51). Использование видимых маркеров приобрело популярность благодаря таким маркерам, как антоцианины, бета-глюкуронидаза и ее субстратGUS, и люцифераза и ее субстрат люциферин, которые широко применяются не только для идентификации трансформантов, но также и для определения величины временной или стабильной экспрессии белка, относящегося к конкретной векторной системе (Rhodes, С. A. et al. (1995) Methods Mol. Biol. 55:121131). Очистку рекомбинантных полипептидов осуществляют любыми из способов, известных в уровне техники для этой цели, то есть посредством любой общеизвестной методики, включая экстракцию, осаждение, хроматографию, электрофорез или тому подобное. Дополнительная процедура очистки, которая может быть использована, представляет собой афинную хроматографию с использованием, например,белка А, белка G или моноклональных антител, которые связывают целевой полипептид и которые продуцируются и иммобилизуются на гелевой матрице, содержащейся в колонке. Неочищенные препараты,-4 015620 содержащие рекомбинантный полипептид, пропускают через колонку. Полипептид связывается с колонкой посредством специфического взаимодействия с аффинной гелевой матрицей, тогда как примеси проходят, не связываясь. После промывания полипептид элюируют из геля, изменяя рН или ионную силу, а затем, если он получен в виде мономера, димеризуют и, если желательно, ПЭГилируют. Соответственно, настоящее изобретение также относится к способу получения полипептидного димера по настоящему изобретению, включающему культивирование клетки-хозяина, трасформированной ДНК-последовательностью, кодирующей мономер указанного полипептида, и выделение полипептидамономера или димера из указанной клетки-хозяина или культуры. Полипептидные димеры по настоящему изобретению полезны для лечения и/или предупреждения всех патологий, при которых должна быть ингибирована активность агонистического комплекса IL6/slL6R. Таким образом, настоящее изобретение также относится к фармацевтической композиции, содержащей эффективное количество полипептидного димера по настоящему изобретению, предпочтительно в сочетании с фармацевтически приемлемым носителем. "Фармацевтически приемлемый" охватывает любой носитель, который не влияет негативно на уровень биологической активности активного ингредиента и который не токсичен для хозяина, которому он вводится. Примеры пригодных фармацевтических носителей хорошо известны в уровне техники и включают забуференные фосфатом физиологические растворы, воду, эмульсии, такие как эмульсии масло/вода, различные типы увлажнителей, стерильные растворы и т.д. Такие носители могут быть получены общеизвестными способами и могут быть введены субъекту в эффективной дозе."Эффективное количество" относится к количеству активного ингредиента, которое является достаточным для того, чтобы воздействовать на течение и тяжесть заболевания, приводя к снижению или ремиссии такой патологии."Эффективная доза", полезная для лечения и/или предупреждения этих заболеваний или расстройств, может быть определена с помощью способов, известных специалисту в данной области техники (см., например, Fingl et al., The Pharmocological Basis of Therapeutics, Goodman and Gilman, eds. Macmillan Publishing Co., New York, pp. 1-46 1975. Введение композиций может быть осуществлено различными путями, например внутривенным,внутрибрюшинным, подкожным, внутримышечным, местным или внутрикожным. Режим дозирования будет определен лечащим врачом и другими клиническими факторами. Как известно в медицине, дозы для каждого конкретного пациента зависят от многих факторов, включая размер пациента, площадь поверхности тела, возраст, пол, конкретное соединение, подлежащее введению, время и путь введения, вид терапии, общее состояние здоровья и другие лекарственные средства, вводимые одновременно. Настоящее изобретение также относится к применению полипептидного димера, как он определен выше, для изготовления фармацевтической композиции для лечения и/или предупреждения заболевания или расстройства, при которых благоприятным является блокирование агонистического комплекса IL6/sIL-6R. Предпочтительным медицинским применением полипептидных димеров по настоящему изобретению является лечение/предупреждение резорбции кости, гиперкальцемии, кахексии, опухолей или других типов рака (например рака ободочной кишки, множественной миеломы, лимфомы, лейкемии или болезни Ходжкина), аутоиммунных заболеваний (например рассеянного склероза или диабета типа 1),воспалительных или атопических заболеваний (например болезни Крона, язвенного колита, ревматоидного артрита, ювенильного ревматоидного артрита, астмы, псориаза, саркоидоза, красной системной волчанки или увеита), инфекций (например бактериями, вирусами, грибами или другими патогенами), а также эндокринных расстройств и метаболических или катаболических заболеваний (например диабета типа 2, ожирения, гипергликемии или гиперхолистеринемии). Примеры ниже объясняют изобретение более подробно. Пример 1. Конструирование и продуцирование sgp130Fc мутеина CR5/18(А) Материалы Компонентны системы клонирования Gateway (AccuPrime Pfx ДНК полимераза, донорный векторpDONR221, вектор экспрессии pcDNA-DEST40 с CMV промотором, ВР и LR рекомбиназа для переноса вставки и компетентные клетки Е. coli) были получены от Invitrogen (Карлсруэ, Германия). Набор для сайт-направленного мутагенеза QuikChange II был получен от Stratagene (Амстердам, Нидерланды). Очищенные ПААГ праймеры для мутагенеза получали от Microsynth (Бальгах, Швейцария). Клетки СНО-K1 были получены из немецкой коллекции микроорганизмов и клеточных культур (Брауншвейг,Германия). Компоненты культуральных сред были получены следующим образом: среда Хама F12, FBS(фетальная телячья сыворотка) с низким содержанием IgG и PBS (PAA Laboratories; Клбе, Германия),FBS (Biochrom; Берлин, Германия), раствор трипсин/ЭДТА (этилендиаминтетрауксусная кислота, Invitrogen) и раствор G418 (Sigma-Aldrich; Тауфкирхен, Германия). Реагент для трансфекции, Lipofectamine 2000, получали от Invitrogen. Santa Cruz (Гейдельберг, Германия) поставил белок A/G плюс агароза для иммунопреципитации. Как для иммунопреципитации, так и для первичного обнаружения в вестернблоттингах использовали мышиное моноклональное антитело против человека IgG (Fc) (CBL102; Chemicon; Хофхайм, Германия). Вторичное обнаружение в вестерн-блоттинге проводили с помощью антителаHiperfilm ECL (все от GE Healthcare; Мюнхен, Германия). Роллерные флаконы (2,1 л, 2,5 Х поверхность) получали от Greiner Bio-One (Фриккенхаузен, Германия). Фильтры из ацетата целлюлозы (0,45 мкм) для вакуум-фильтра получали от Sartorius (Геттинген,Германия). Материалы для аффинной и гель-хроматографии (SEC) были получены от GE Healthcare(Мюнхен, Германия): материал MabSelect (код продукта 17-5199-01) в колонке XK16/20, PD-10 обессоливающие колонки и HiLoad 26/60 Superdex 200 пг колонки для SEC. Мембранные блоки для концентрирования Amicon Ultra-15 Ultracel-PL на 50 кДа были получены от Millipore (Эшборн, Германия). Готовый раствор бис-акриламида (19:1, 30%) для ПААГ (полиакриламидный гель) был получен от Bio-Rad (Мюнхен, Германия).(Б) Конструирование CR5/18 кДНК для полноразмерного sgp130Fc, содежащую полный внеклеточный домен gp130 и человеческий IgG1 Fc дикого типа (источники: для человеческого gp130/IL6ST: последовательность GenBankNM002184 и поддерживающие клоны; для константной области человеческого IgG1/IGHG1: например,последовательность GenBank AK057754), оптимизировали по кодонам для экспрессии в клетках СНО-К 1 и субклонировали в pDONR221, используя праймеры Gateway, AccuPrime Pfx ДНК полимеразу и ВР рекомбиназу в стандартной процедуре клонирования Gateway. Последовательность субклонированной вставки полностью проверяли, используя стэкированные прямой и обратный праймеры для секвенирования, каждый 250-300 п.о. Посредством сайт-направленного мутагенеза с помощью набора QuikChange II нижнюю шарнирную область IgG1-Fc (аминокислоты 234, 235 и 237 согласно нумерации EU) мутировали из последовательности дикого типа, "LLGG", в "AEGA". Мутантные клоны проверяли полным секвенированием, как описано выше. Затем вставку переносили в вектор экспрессии pcDNA-DEST40 путемLR Gateway рекомбинации. Поскольку вставка кодирует два стоп-кодона после участка Fc, метки, закодированные в pcDNA-DEST40 (V5 и 6xHis эпитопы), не присутствуют в CR5/18. Положительные клоны идентифицировали рестрикционным анализом с помощью AlwNI и снова секвенированием.(В) Клеточная культура и трансфекция Клетки СНО-K1 выращивали в среде Хама F12 с добавлением 10% FBS при 37 С и 5% СО 2 в насыщенной водными парами атмосфере. Поддерживающие культуры делили каждые 3-4 дня и использовали только вплоть до 20 пассажей. Клетки трансфицировали экспрессионным конструктом pcDNADEST40CR5/18, используя Lipofectamine 2000 и стандартные условия для СНО-K1, поставляемые Invitrogen. Для первого теста временной экспрессии клетки СНО-K1 трансфицировали в 6-луночных планшетах, и клетки и супернатанты собрали через 24 ч после трансфекции. CR5/18 подвергали иммунопреципитации из супернатантов, используя белок A/G плюс агароза и антитело IgG (Fc) против человека согласно инструкциям изготовителя. Весь клеточный белок экстрагировали и проводили вестернблоттинги с антителом IgG (Fc) против человека с лизатами клеток и иммунопреципитатами, как описано в Waetzig et al., J. Immunol. 168: 5342 (2002).(Г) Продуцирование CR5/18 в клетках CHQ-K1 После успешной временной экспрессии клетки СНО-К 1 трансфицировали и отбирали положительные клоны, используя 400 мкг/мл G418, в чашках диаметром 10 см. Для определения качества и свойств продукта предварительно отобранный поликлональный пул СНО-K1 переносили в роллерные флаконы и культивировали в FBS с низким содержанием IgG. Супернатанты конфлюентных клеток собирали 2-3 раза в неделю, центрифугировали дважды при 3500 g и 4 С в течение 15 мин, чтобы удалить клеточные остатки и либо обрабатывали немедленно, либо замораживали при -80 С. Параллельно стабильные клеточные клоны отбирали из предварительно отобранного пула, используя метод ограниченного разведения, и характеризовали анализом экспрессии в вестерн-блоттинге, как описано выше. Клон с самой высокой и самой стабильной экспрессией переносили в роллерные флаконы и использовали для постоянной продукции.CR5/18-содержащие супернатанты из культур в роллерных флаконах очищали при 4 С с использованием перистальтического насоса Р-1 и системы АКТА Purifier 100 (оба от GE Healthcare; Мюнхен,Германия). Протокол был основан на рекомендациях изготовителя для очистки моноклональных антител. После центрифугирования рН свежего или оттаявшего (на льду) супернатанта доводили до 6,7-7,0. После двух раундов вакуумного фильтрования (0,45 мкм) супернатант дегазировали и, в случае необходимости, рН снова доводили до значения 6,7-7,0. Затем в колонку для аффинной хроматографии, уравновешенную PBS (6-25 мл MabSelect в колонке XK16/20), загружали 2-4 л супернатанта при скорости потока 3-10 мл/минут, используя насос Р-1. После промывания PBS колонку переносили в AKTA Purifier и снова промывали PBS до тех пор, пока А 280 не стабилизировался после количественного удаления несвязанного белка. Для элюции в систему AKTA вводили два 50 мМ буфера на основе цитрата натрия с рН 3,25 и 5,5, соответственно, которые смешивали, чтобы получить желательные условия рН. После одной стадии промывания при рН 5,1 следовала элюция при рН 3,7. Фракции по 10 мл собирали в пробирки объемом 15 мл, содержащие 2 мл 1 М трис-HCl (рН 11). Пиковые фракции объединяли и измеряли рН и доводили до 7,5 в случае необходимости. Концентрацию белка в пуле измеряли при А 280 и пул осторож-6 015620 но концентрировали максимум до 1,5 мг/мл, используя мембранные блоки для концентрирования Amicon Ultra-15 Ultracel-PL на 50 кДа. Использовали PD-10 обессоливающие колонки, уравновешенные PBS,для замены цитратного буфера на PBS, после чего проводили еще одно измерение концентрации белка при 280 нм. Для гель-хроматографии (SEC) рекомендована максимальная концентрация белка 1,2 мг/мл в PBS.SEC выполняли с системой АКТА в HiLoad 26/60 Superdex колонке на 200 пк, уравновешенной PBS, при скорости потока 0,8 мл/мин. В отличие от дикого типа sgp130Fc, CR5/18 элюировался в единственном пике после низкого пика агрегатов более высокой молекулярной массы (фиг. 2). В первых прогонах были получены образцы всех фракций для анализа посредством электрофореза в полиакриламидном геле. Пиковые фракции объединяли, измеряли в них концентрацию белка и доводили до 400-500 мкг/мл в PBS, а аликвоты для одноразового использования замораживали при -80 С для длительного хранения. Фракции и объединенные образцы анализировали с помощью анализа посредством нативного электрофореза в полиакриламидном геле (7,5%) с последующим окрашиванием серебром или Кумасси. Как показано на фиг. 2, количество побочных продуктов (агрегатов) CR5/18 значительно уменьшено по сравнению с исходным соединением sgp130Fc, которое очищали в параллельном эксперименте. Кроме того, элюция желаемого продукта (димер CR5/18) четко отделена от фракций примесей (агрегатов), что не имеет места при sgp130Fc дикого типа. Таким образом, как выход (благодаря более высокой доле желаемого продукта), так и качество препаратов CR5/18 лучше, чем таковые для обычногоsgp130Fc, что приводит к более низким затратам для промышленного производства. Эти результаты указывают на явное усовершенствование CR5/18 по сравнению с исходной молекулой sgp130Fc. Пример 2. Биоактивность CR5/18 в стандартизированном анализе клеточной пролиферации(A) Материалы Использовали стабильно трансфицированную клеточную линию BAF3/gp130, являющуюся предшественником В клеток, и сконструированный цитокин гипер-IL-6. Компоненты культуральной среды были получены следующим образом: DMEM (модифицированная по Дульбекко среда Игла) и PBS (РААLaboratories; Кольбе, Германия), FBS (Biochrom; Берлин, Германия) и раствор трипсин/ЭДТА (Invitrogen; Карлсруэ, Германия). Интерлейкин-6 (IL-6) и растворимый рецептор интерлейкина-6 (slL-6R) были получены у BioSource (Золинген, Германия) и RD Systems (Висбаден, Германия), соответственно. Набор для водного нерадиоактивного анализа пролиферации клеток (MTS) The Cell Titer 96 был получен отsqp130Fc или CR5/18 Пролиферация и жизнеспособность клеток BAF3/gp130 зависят от присутствия комплекса IL-6/sIL-6R в культуральной среде. Для поддержания клетки BAF3/gp130 культивировали при плотности меньше чем 5 105 клеток/мл в DMEM с 10% FBS и 10 нг/мл гипер-IL-6 (сконструированный цитокин, состоящий из соединенных ковалентной связью IL-6 и SIL-6R; Fischer et al. 1997, Nat. Biotechnol. 15: 142-145). 10 нг/мл гиперIL-6 можно заменить на 100 нг/мл IL-6 и 50 нг/мл SIL-6R. Два раза в неделю проводили клеточные пассажи. Для анализов клетки промывали дважды в среде без гипер-IL-6 (или IL-6/sIL-6R) и затем засевали с плотностью 5000 клеток/лунку в 96-луночных планшетах. CR5/18 или исходное соединение sgp130Fc добавляли в различных концентрациях, варьирующих от 20 мкг/мл до 78 нг/мл (серии разведений 1:4; фиг. 3). Затем клетки культивировали в течение 3 дней в присутствии 100 нг/мл IL-6 и 50 нг/мл SIL-6R. Контроли включали нестимулированные клетки без CR5/18 или sgp130Fc и с их максимальной концентрацией, а также клетки, инкубировавшиеся только со стимуляторами IL-6 и slL-6R (фиг. 3).(B) Результаты Биологическую активность CR5/18 или sgp130Fc дикого типа в клеточной культуре измеряли по снижению числа жизнеспособных клеток BAF3/gpl30 (как определено превращением субстрата MTS) после 3 дней. CR5/18 является более биологически активным, чем sgp130Fc дикого типа, достигая своейIC50 при концентрации примерно 400 нг/мл, где sgp130Fc (с IC50 примерно 800 нг/мл) не показывает никакого значительного эффекта (фиг. 3). Это указывает на то, что CR5/18 может использоваться в концентрации, составляющей приблизительно половину терапевтической концентрации соединения дикого типа. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Полипептидный димер, способный ингибировать активность агонистического комплекса IL6/sIL-6R и содержащий два мономера, где каждый из указанных мономеров содержит внеклеточную часть молекулы gp130, или ее вариант, или фрагмент, слитые с доменом Fc белка IgG1, и где, по меньшей мере, аминокислотный остаток Leu235 шарнирной области домена Fc заменен по меньшей мере одним гидрофильным аминокислотным остатком. 2. Полипептидный димер по п.1, где гидрофильный аминокислотный остаток представляет собойGlu или Asp. 3. Полипептидный димер по п.1 или 2, где, кроме того, аминокислотный остаток Leu234 шарнирной-7 015620 области заменен на Phe или Ala. 4. Полипептидный димер по п.3, где аминокислотные остатки Leu234 и/или Gly237 шарнирной области заменены аминокислотным остатком Ala. 5. Полипептидный димер по любому из пп.1-4, где шарнирная область содержит мотив аминокислотной последовательности Ala234-Glu235-Gly236-Ala237 вместо Leu234-Leu235-Gly236-Gly237. 6. Полипептидный димер по п.5, где шарнирная область содержит аминокислотную последовательность Asp221-Lys222-Thr223-His224-Thr225-Cys226-Pro227-Pro228-Cys229-Pro230-Ala231-Pro232-Glu233-Ala234-Glu235Gly236-Ala237-Pro238-Ser239-Val240. 7. Полипептидный димер по любому из пп.1-6, где растворимая молекула gp130, или ее вариант,или фрагмент слиты с шарнирной областью домена Fc белка IgG1 непосредственно или посредством гибкого полипептидного линкера. 8. Полипептидный димер по п.7, где линкер представляет собой линкер, содержащий 2-50 аминокислотных остатка, независимо выбранных из группы, состоящей из глицина, серина, аспарагина, треонина и аланина. 9. Полипептидный димер по любому из пп.1-8, где между растворимой молекулой gp130, или ее вариантом, или фрагментом и доменом Fc вставлен один или более сайтов N-гликозилирования. 10. Полипептидный димер по любому из пп.1-9, где мономеры соединены друг с другом посредством простой ковалентной связи, гибкого пептидного линкера либо одного или более дисульфидных мостиков. 11. Полипептидный димер по любому из пп.1-10, где по меньшей мере один мономер указанного димера является ПЭГилированным. 12. Полинуклеотид, кодирующий мономер полипептидного димера по любому из пп.1-10. 13. Вектор экспрессии, содержащий полинуклеотид по п.12. 14. Клетка-хозяин, содержащая вектор экспрессии по п.13. 15. Способ получения полипептидного димера по любому из пп.1-10, включающий культивирование клетки-хозяина по п.14 и выделение мономера или димера из указанной клетки-хозяина или культуры. 16. Фармацевтическая композиция, содержащая полипептидный димер по любому из пп.1-11. 17. Применение полипептидного димера по любому из пп.1-11 для изготовления фармацевтической композиции для лечения и/или предупреждения заболевания или расстройства, при которых благоприятно блокирование агонистического комплекса IL-6/sIL-6R. 18. Применение по п.17, где указанное заболевание представляет собой резорбцию кости, гиперкальцемию, кахексию, опухоль или другой тип рака, аутоиммунное заболевание, воспалительное или атопическое заболевание, инфекцию, эндокринное расстройство либо метаболическое или катаболическое заболевание.
МПК / Метки
МПК: C07K 19/00, C07K 14/705
Метки: sgp130fc, димеры, улучшенные
Код ссылки
<a href="https://eas.patents.su/13-15620-uluchshennye-dimery-sgp130fc.html" rel="bookmark" title="База патентов Евразийского Союза">Улучшенные димеры sgp130fc</a>