Композиция тразодона для введения один раз в день
Номер патента: 14739
Опубликовано: 28.02.2011
Авторы: Жервэ Соня, Рахмуни Милу, Феррада Анджела, Контамен Полин, Смит Дэймон, Ма Ми Линх, Сули Фузия, Узеруру Рашид
Формула / Реферат
1. Фармацевтическая композиция замедленного высвобождения для перорального введения один раз в день, где композиция содержит приблизительно от 15 до приблизительно 60 мас.% тразодона или его фармацевтически приемлемой соли или эфира и приблизительно от 15 до приблизительно 85 мас.% наполнителя для контролируемого высвобождения и, необязательно, фармацевтическую добавку, где указанный наполнитель для контролируемого высвобождения характеризуется тем, что при введении композиции млекопитающему позволяет тразодону или его фармацевтически приемлемой соли или эфиру поддерживать эффективную концентрацию в плазме по меньшей мере от приблизительно 1 по меньшей мере до 24 ч после первоначального введения.
2. Фармацевтическая композиция замедленного высвобождения по п.1, где концентрация в плазме является эффективной при лечении депрессии у млекопитающего.
3. Фармацевтическая композиция замедленного высвобождения по п.1 или 2, где концентрация в плазме является эффективной при лечении расстройства сна у млекопитающего.
4. Фармацевтическая композиция замедленного высвобождения по любому из пп.1-3, где композиция содержит гидрохлорид тразодона.
5. Фармацевтическая композиция замедленного высвобождения по любому из пп.1-4, где наполнитель для контролируемого высвобождения обеспечивает концентрацию тразодона в плазме между приблизительно 50 и приблизительно 3000 нг/мл, которая остается фактически постоянной в течение периода, который длится от около 1 ч после введения до около 24 ч.
6. Фармацевтическая композиция замедленного высвобождения по п.1, где композиция содержит 150 мг гидрохлорида тразодона.
7. Фармацевтическая композиция замедленного высвобождения по п.6, где концентрация тразодона в плазме, достигнутая за 1 ч после приема внутрь, составляет между приблизительно 150 и приблизительно 500 нг/мл.
8. Фармацевтическая композиция замедленного высвобождения по п.1, где композиция содержит 300 мг гидрохлорида тразодона.
9. Фармацевтическая композиция замедленного высвобождения по п.8, где концентрация тразодона в плазме через 1 ч после приема внутрь составляет от приблизительно 300 до приблизительно 1000 нг/мл.
10. Фармацевтическая композиция замедленного высвобождения по любому из пп.1-9, где композиция содержит от приблизительно 20 до приблизительно 50 мас.% тразодона или производного тразодона и от приблизительно 20 до приблизительно 50 мас.% наполнителя для контролируемого высвобождения.
11. Фармацевтическая композиция замедленного высвобождения по п.10, где композиция содержит от приблизительно 35 до 50 мас.% тразодона или производного тразодона и от приблизительно 15 до 50 мас.% наполнителя для контролируемого высвобождения.
12. Фармацевтическая композиция замедленного высвобождения по любому из пп.1-11, где наполнитель для контролируемого высвобождения содержит поперечно-сшитый высокоамилозный крахмал.
13. Фармацевтическая композиция замедленного высвобождения по п.12, где поперечно-сшитый высокоамилозный крахмал содержит между приблизительно 65 и 75 мас.% амилозы и поперечно сшит оксихлоридом фосфора.
14. Фармацевтическая композиция замедленного высвобождения по п.13, где поперечно-сшитый высокоамилозный крахмал содержит боковые цепи гидроксипропила.
15. Фармацевтическая композиция замедленного высвобождения по п.14, где поперечно-сшитый высокоамилозный крахмал желатинирован.
16. Фармацевтическая композиция замедленного высвобождения по любому из пп.1-14, где композиция содержит фармацевтическую добавку.
17. Фармацевтическая композиция замедленного высвобождения по п.16, где фармацевтическая добавка выбрана из связывающего вещества, солюбилизирующего компонента, подкислителя, порообразующего вещества, смягчающего компонента и вещества, способствующего скольжению.
18. Фармацевтическая композиция замедленного высвобождения по п.17, где связывающее вещество представляет собой гидроксипропилметилцеллюлозу.
19. Фармацевтическая композиция замедленного высвобождения по п.17, где солюбилизирующий компонент выбран из повидона или цетилпиридиумхлорида.
20. Фармацевтическая композиция замедленного высвобождения по п.17, где подкислитель представляет собой альгиновую кислоту.
21. Фармацевтическая композиция замедленного высвобождения по п.17, где порообразующее вещество представляет собой сахарозу.
22. Фармацевтическая композиция замедленного высвобождения по п.17, где смягчающий компонент представляет собой стеарилфумарат натрия.
23. Фармацевтическая композиция замедленного высвобождения по п.17, где вещество, способствующее скольжению, представляет собой коллоидный диоксид кремния.
24. Фармацевтическая композиция замедленного высвобождения для перорального введения один раз в день, содержащая по меньшей мере 150 мг гидрохлорида тразодона, приблизительно от 20 до приблизительно 50 мас.% поперечно-сшитого высокоамилозного крахмала, приблизительно от 10 до приблизительно 25 мас.% гидроксипропилметилцеллюлозы, приблизительно от 0 до приблизительно 5 мас.% цетилпиридиумхлорида, приблизительно от 0 до приблизительно 20 мас.% альгиновой кислоты, приблизительно от 1 до приблизительно 5 мас.% стеарилфумарата натрия и до приблизительно 1 мас.% коллоидного диоксида кремния.
25. Фармацевтическая композиция замедленного высвобождения по любому из пп.1-24, где композиция представляет собой композицию в форме таблетки.
26. Фармацевтическая композиция замедленного высвобождения по п.25, где таблетка сформирована в виде капсулы.
27. Фармацевтическая композиция замедленного высвобождения по п.26, где таблетка в форме капсулы содержит приблизительно 300 мг тразодона.
28. Фармацевтическая композиция замедленного высвобождения по пп.1-27, где композиция обеспечивает отсутствие сонливости у субъекта приблизительно 8 ч после перорального введения по сравнению с повторными введениями композиции быстрого высвобождения тразодона.
29. Единичная доза фармацевтической композиции замедленного высвобождения для перорального введения один раз в день 300 мг гидрохлорида тразодона, содержащая приблизительно от 20 до приблизительно 40 мас.% наполнителя для контролируемого высвобождения, где при пероральном приеме внутрь композиция обеспечивает площадь под кривой концентрация-время, по существу, эквивалентную суточной дозе трех таблеток с концентрацией 100 мг гидрохлорида тразодона, где три таблетки вводят в течение 24 ч.
30. Единичная доза фармацевтической композиции замедленного высвобождения для перорального введения один раз в день 150 мг гидрохлорида тразодона, содержащая приблизительно от 30 до приблизительно 50 мас.% наполнителя для контролируемого высвобождения, где при пероральном приеме внутрь композиция обеспечивает площадь под кривой концентрация-время, по существу, эквивалентную суточной дозе трех таблеток с концентрацией 50 мг гидрохлорида тразодона, где три таблетки вводят в течение 24 ч.
31. Способ лечения расстройства сна, включающий введение субъекту с расстройством сна фармацевтической композиции замедленного высвобождения, содержащей тразодон или производное тразодона в наполнителе для контролируемого высвобождения, где указанный наполнитель для контролируемого высвобождения характеризуется тем, что при введении композиции млекопитающему, обеспечивает поддержание эффективной концентрации в плазме тразодона или его фармацевтически приемлемой соли или эфира по меньшей мере от приблизительно 1 ч по меньшей мере до приблизительно 24 ч после первоначального введения.
32. Способ лечения расстройства сна, включающий введение субъекту с расстройством сна фармацевтической композиции замедленного высвобождения по любому из пп.1-30.
33. Способ по любому из пп.31 или 32, где композицию вводят перед сном.
34. Способ лечения депрессии, включающий введение один раз в день субъекту с депрессией фармацевтической композиции замедленного высвобождения по любому из пп.1-30.
35. Способ по п.34, где композицию вводят перед сном.
36. Применение фармацевтической композиции замедленного высвобождения по любому из пп.1-30 для лечения депрессии.
37. Применение по п.36, где композицию вводят перед сном.
38. Применение фармацевтической композиции замедленного высвобождения по любому из пп.1-30 для получения лекарственного средства, пригодного для лечения депрессии.
39. Применение фармацевтической композиции замедленного высвобождения по любому из пп.1-30 для лечения расстройства сна.
40. Применение фармацевтической композиции замедленного высвобождения по любому из пп.1-30 для получения лекарственного средства, пригодного для лечения расстройства сна.
41. Применение по любому из пп.39 или 40, где композицию вводят перед сном.
Текст
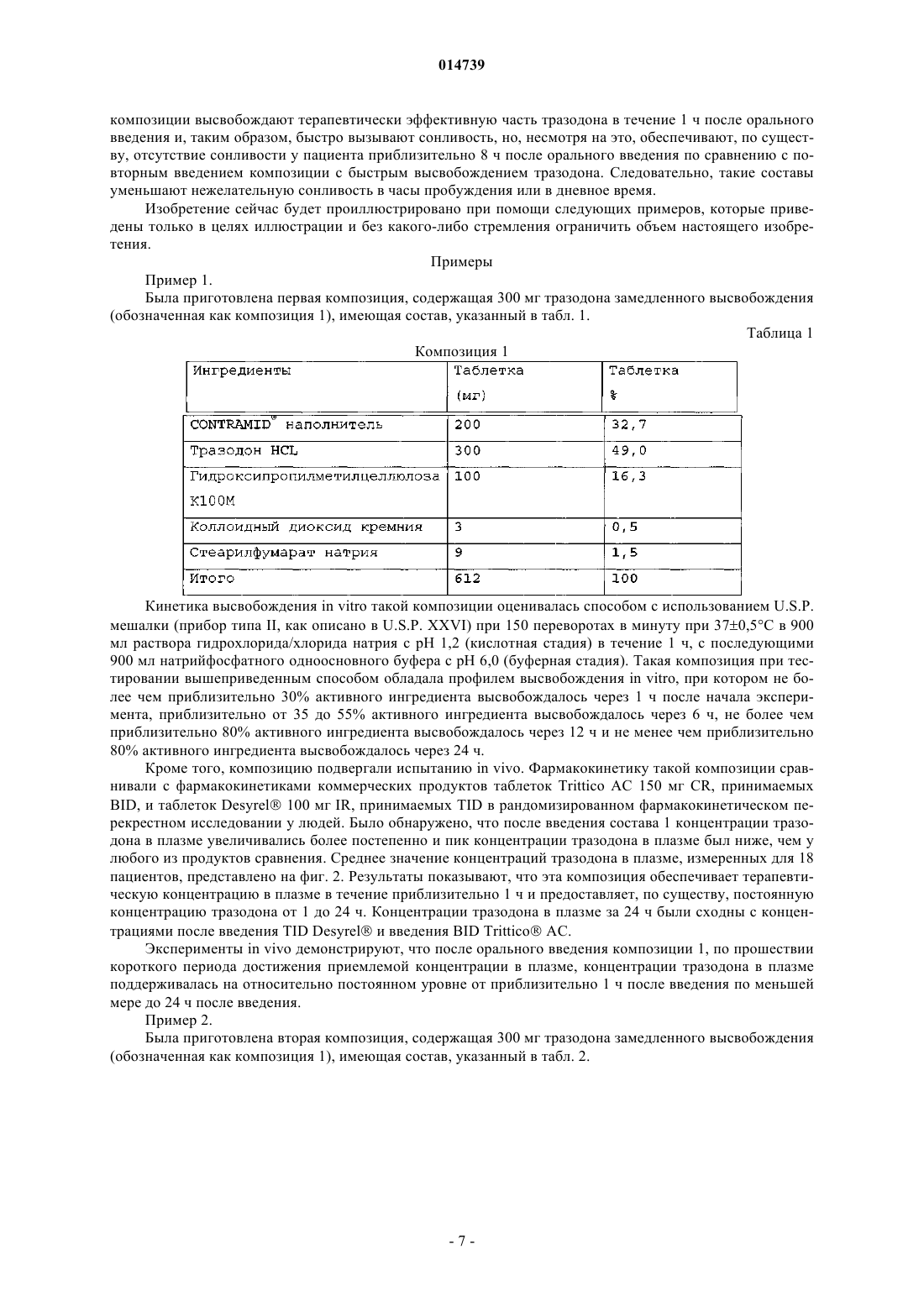
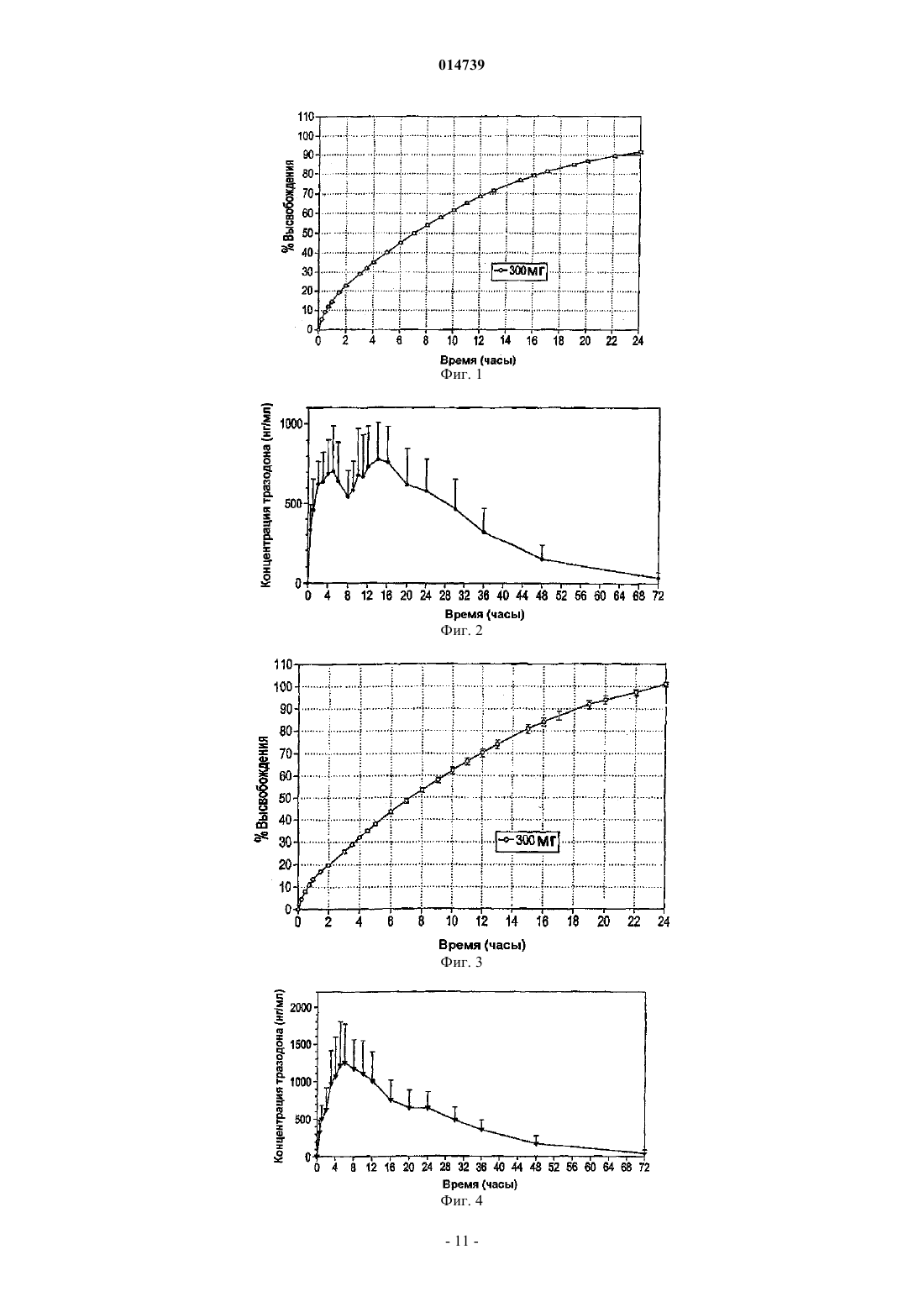
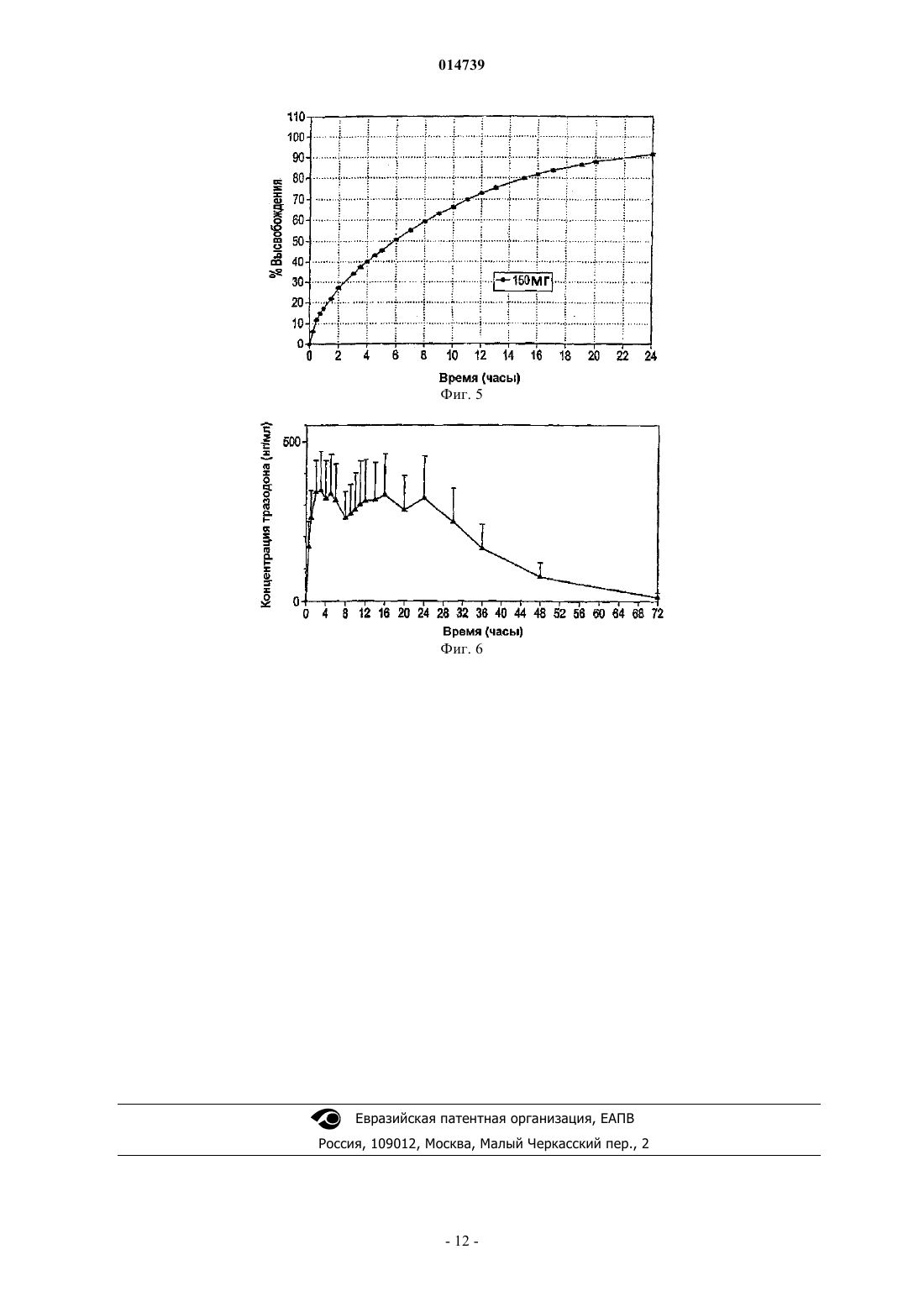
КОМПОЗИЦИЯ ТРАЗОДОНА ДЛЯ ВВЕДЕНИЯ ОДИН РАЗ В ДЕНЬ Изобретение относится к композиции для введения один раз в день тразодона или производного тразодона. Композиция содержит тразодон или производное тразодона и наполнитель для контролируемого высвобождения с тем, чтобы после введения один раз перорально тразодон или производное тразодона поддерживались в терапевтической концентрации в плазме по меньшей мере от 1 по меньшей мере до 24 ч после первоначального введения. Этот терапевтический эффект сохраняется относительно и в значительной степени стабильным в течение оставшегося периода 24 ч. Композиции могут применяться для лечения депрессии и/или нарушений сна.(71)(73) Заявитель и патентовладелец: ЛАБОФАРМ ИНК. (CA); ЛАБОФАРМ ЮРОП ЛИМИТЕД (IE); ЛАБОФАРМ 014739 Область техники, к которой относится изобретение Настоящее изобретение относится к антидепрессанту тразодону и, в частности, к составу тразодона для введения один раз в день, и к его применению для лечения депрессии и определенных расстройств сна. Предпосылки изобретения Тразодон является антагонистом/ингибитором обратного захвата рецептора серотонина-2, который также приводит к уменьшению уровней внеклеточной -аминомасляной кислоты (GABA) в коре головного мозга, из-за блокады рецепторов 5-гидрокситриптамина 2A (5-HT2A). Это уменьшение сопровождается усилением высвобождения 5-НТ. Увеличенные дозы тразодона ингибируют транспорт 5-НТ, и это ингибирование поглощения приводит к дополнительному увеличению уровней 5-НТ. Полагают, что этот двойной механизм может быть ответственен за антидепрессантные свойства тразодона. Более того, взаимодействие между GABA-эргической и серотонинэргической системами может объяснить его седативные, анксиолитические свойства. Тразодон представляет собой, таким образом, психотропное соединение с седативным и антидепрессантным свойствами. Он быстро всасывается из верхнего отдела желудочно-кишечного тракта и экстенсивно метаболизируется после орального введения. Обычно его применяют для уменьшения симптомов депрессии, таких как ощущения уныния, негодности или вины; потеря интереса к повседневной деятельности; изменение в аппетите; усталость; мысли о смерти или самоубийстве; и бессонница. Тразодон также можно применять для других назначений, которые подробно описаны в рассматриваемой области. Тразодон представляет собой производное триазолпиридина с формулой, которая показана в его обычно используемой форме гидрохлорида. Приготовление этого соединения было впервые раскрыто вU.S. Patent No. 3381009, выданном G. Palazzo et al. в 1968 г. Растворимость тразодона зависит от рН и имеет pKa=6,74 в воде. Как результат, тразодон хорошо растворим в кислой среде (которая обнаруживается в желудке и верхнем отделе кишечника), т.е. существенно ниже его pKa. Наоборот, когда рН превышает его pKa, то его растворимость является очень низкой, например, при нейтральных и щелочных условиях нижних отделов кишечника. Такая нерастворимость, безусловно, влияет на его растворение и,таким образом, на пригодность лекарственного средства для всасывания в нижнем отделе кишечника. Полагают, что эти свойства могут препятствовать разработке форм тразодона длительного действия (например, более 8 ч), для которых требуется фактически равномерное всасывание по всей длине желудочно-кишечного тракта, в частности всасывание при прохождении через верхний и нижний отделы кишечника. Как и в случае многих лекарственных средств, тразодон обычно назначают в форме быстрого высвобождения для применения два (BID) или три раза (TID) в день, со всеми неудобствами и недостатками, которые это вызывает. Например, BID или TID дозирование в форме быстрого высвобождения тразодона приводит к концентрации лекарственного средства в крови, которая не остается внутри так называемого терапевтического окна и которая, таким образом, может быть связана с увеличенными рисками зависящих от дозы отрицательных эффектов при достижении высоких уровней, или уменьшением степени эффективности при достижении низких уровней. Кроме того, многократные ежедневные дозы могут приводить к некоторым периодам сонливости в течение дня, связанным с пиковыми концентрациями тразодона, имеющими место сразу после введения. В результате, существует потребность в композиции тразодона для применения один раз в день(OAD), чтобы от единственной таблетки быстро достигалась и поддерживалась стабильная, эффективная концентрация в течение 24 часов и более, профиль высвобождения которой не зависит от рН, с тем, чтобы тразодон мог равномерно всасываться фактически по всей длине верхнего и нижнего отделов желудочно-кишечного тракта, тем самым уменьшая частоту возникновения и тяжесть побочных эффектов,таких как сонливость, в течение дня. Раскрытие изобретения Изобретение описывает фармацевтическую композицию замедленного высвобождения для орального введения один раз в день тразодона или его производного. Композиция содержит от приблизительно 15 до приблизительно 60 мас.% тразодона или его производного и от приблизительно 15 до приблизительно 85 мас.% наполнителя для контролируемого высвобождения. Наполнитель для контролируемого высвобождения при оральном введении млекопитающему, например субъекту, позволяет тразодону или его производному достигать эффективной концентрации в плазме по меньшей мере от приблизительно 1 до приблизительно 24 ч после первоначального введения. При определенных условиях наполнитель для контролируемого высвобождения обеспечивает, по существу, рН-независимое контролируемое высвобождение тразодона или его производного, так что тразодон или производное тразодона может всасываться при прохождении через верхний и нижний отделы желудочно-кишечного тракта. Составы замедленного высвобождения обеспечивают концентрации тразодона или производных тразодона в плазме в течение по меньшей мере 24 ч, которые эффективны при лечении, а именно облегчении, одного или более симптомов депрессии. В другом варианте осуществления составы замедленного высвобождения обеспечивают эффективные количества тразодона или производного тразодона для ле-1 014739 чения нарушений сна, например, улучшая структуру сна. Наполнитель замедленного высвобождения может обеспечивать терапевтически эффективную концентрацию тразодона или производного тразодона в плазме, которая остается, по существу, постоянной между приблизительно 50 и приблизительно 3000 нг/мл в течение периода, составляющего приблизительно от 1 ч после приема внутрь до по меньшей мере приблизительно 24 ч. Концентрации в плазме, как правило, зависят от введенной дозы. Например, в одном варианте осуществления фармацевтическая композиция замедленного высвобождения, предложенная здесь, содержит 150 мг гидрохлорида тразодона. Такой состав обеспечивает эффективную концентрацию тразодона в плазме по меньшей мере от приблизительно 1 до приблизительно 24 ч после первоначального введения приблизительно от 150 до приблизительно 500 нг/мл. В другом варианте осуществления фармацевтическая композиция замедленного высвобождения содержит 300 мг гидрохлорида тразодона. Такой состав обеспечивает эффективную концентрацию тразодона в плазме по меньшей мере от приблизительно 1 до приблизительно 24 ч после первоначального введения от приблизительно 300 до приблизительно 1000 нг/мл. В некоторых вариантах осуществления фармацевтическая композиция замедленного высвобождения содержит от около 15 до около 60 мас.% тразодона или его производного и от около 15 до около 85 мас.% наполнителя для контролируемого высвобождения. В других вариантах осуществления композиция содержит от приблизительно 20 до приблизительно 50 мас.% тразодона и от приблизительно 20 до приблизительно 50 мас.% наполнителя для контролируемого высвобождения. Например, композиция может содержать от приблизительно 35 до приблизительно 50 мас.% тразодона и от приблизительно 15 до приблизительно 50 мас.% наполнителя для контролируемого высвобождения. Полагают, что в лечебной практике изобретения может быть пригоден ряд различных наполнителей. В одном варианте осуществления наполнитель для контролируемого высвобождения содержит поперечно-сшитый высокоамилозный крахмал. В определенных вариантах осуществления поперечносшитый высокоамилозный крахмал поперечно сшит оксихлоридом фосфора и/или содержит боковые цепи гидроксипропила. В определенных вариантах осуществления поперечно-сшитый высокоамилозный крахмал содержит приблизительно от 65 до 75 мас.% амилозы и поперечно сшит оксихлоридом фосфора. Один предпочтительный поперечно-сшитый высокоамилозный крахмал, пригодный в практике, по изобретению известен как поперечно-сшитый высокоамилозный крахмал CONTRAMID, коммерчески доступный от Labopharm, Inc., Laval, Canada. Кроме того, фармацевтическая композиция замедленного высвобождения может необязательно включать те или иные фармацевтические добавки. Типичные фармацевтические добавки включают связывающие вещества (например, гидроксипропилметилцеллюлоза), солюбилизирующие компоненты (например, повидон или цетилпиридиниумхлорид), подкислители (например, альгиновая кислота), порообразующие вещества (например, сахароза), смягчающие компоненты (например, стеарилфумарат натрия) и вещества, способствующие скольжению (например, коллоидный диоксид кремния). В одном варианте осуществления изобретение предоставляет фармацевтическую композицию замедленного высвобождения, содержащую приблизительно от 20 до приблизительно 50 мас.% гидрохлорида тразодона, приблизительно от 20 до приблизительно 50 мас.% поперечно-сшитого высокоамилозного крахмала, приблизительно от 10 до приблизительно 20 мас.% гидроксипропилметилцеллюлозы, приблизительно от 0 до приблизительно 5 мас.% цетилпиридиумхлорида, приблизительно от 0 до приблизительно 20 мас.% альгиновой кислоты, приблизительно от 1 до приблизительно 5 мас.% стеарилфумарата натрия и до приблизительно 1 мас.% коллоидного диоксида кремния. Фармацевтическая композиция замедленного высвобождения может быть получена во множестве видов и форм, таких как таблетки и таблетки в форме капсул, пригодных для орального введения. В одном варианте осуществления изобретение предоставляет таблетки в форме капсул, содержащих 300 мг тразодона. Такие таблетки в форме капсул могут быть приспособлены для введения перед сном. Такой состав вызывает быструю сонливость после орального введения, но зато обеспечивает, по существу, отсутствие сонливости у пациента приблизительно 8 ч после орального введения по сравнению с повторным введением композиции быстрого высвобождения тразодона. Изобретение предоставляет однократную дозу фармацевтической композиции замедленного высвобождения для орального введения один раз в день 300 мг гидрохлорида тразодона, содержащего от приблизительно 20 до приблизительно 40 мас.% наполнителя для контролируемого высвобождения, где при оральном приеме внутрь композиция предоставляет область под концентрационно-временной кривой,фактически эквивалентной коммерчески доступной ежедневной дозе трех таблеток с концентрацией 100 мг гидрохлорида тразодона, где три таблетки вводятся в течение 24 ч. Также здесь предоставлена единица дозы фармацевтической композиции замедленного высвобождения для орального введения один раз в день 150 мг гидрохлорида тразодона, содержащей от приблизительно 30 до приблизительно 50 мас.% наполнителя для контролируемого высвобождения, где при оральном приеме внутрь композиция предоставляет область под концентрационно-временной кривой, фактически эквивалентной коммерчески доступной ежедневной дозе трех таблеток с концентрацией 50 мг гидрохлорида тразодона, где три таблетки вводятся в течение 24 ч. Кроме того, изобретение предоставляет способ лечения депрессии путем введения один раз в день-2 014739 субъекту, нуждающемуся в антидепрессанте, одной из описанных выше фармацевтических композиций замедленного высвобождения. Композицию можно вводить перед сном. Кроме того, изобретение относится к способу улучшения структуры сна у субъекта, нуждающегося в таком лечении, способ включает введение такому субъекту один раз в день одной из описанных выше фармацевтических композиций замедленного высвобождения. Композиция предпочтительно вводится перед сном. Краткое описание чертежей Изобретение иллюстрируется, но не ограничивается приложенными чертежами, на которых фиг. 1 представляет собой график, иллюстрирующий профиль растворения in vitro первых 300 мг тразодона композиции для приема один раз в день; фиг. 2 - график, который иллюстрирует концентрацию тразодона в плазме, полученную от одной таблетки первых 300 мг тразодона композиции для приема один раз в день, как функцию от времени с момента введения в организм человека; фиг. 3 - график, иллюстрирующий профиль растворения in vitro вторых 300 мг тразодона композиции для приема один раз в день; фиг. 4 - график, который иллюстрирует концентрацию тразодона в плазме, полученную от одной таблетки вторых 300 мг тразодона композиции для приема один раз в день, как функцию от времени с момента введения в организм человека; фиг. 5 - график, иллюстрирующий профиль растворения in vitro 150 мг тразодона композиции для приема один раз в день; и фиг. 6 - график, который иллюстрирует концентрацию тразодона в плазме, полученную от одной таблетки со 150 мг тразодона композиции для приема один раз в день, как функцию от времени с момента введения в организм человека. Подробное описание изобретения Изобретение частично основано на открытии, что возможно получение композиции тразодона или производного тразодона для введения один раз в день, которая обеспечивает концентрацию активного ингредиента в плазме, которая в значительной степени стабильна от 1 до 24 ч и эффективна для лечения,а именно улучшения одной или более систем депрессии. Это открытие было удивительным, поскольку,хотя растворимость тразодона зависит от рН и быстро падает при увеличенных рН, обнаруживаемых в нижнем отделе желудочно-кишечного тракта, выяснилось, что можно обеспечить терапевтические, стабильные и/или эффективные концентрации тразодона в кровотоке по меньшей мере 24 ч независимо от изменений рН вдоль верхнего и нижнего отделов кишечника. В связи с этим изобретение предоставляет фармацевтическую композицию замедленного высвобождения для перорального введения один раз в день тразодона или его производного. Композиция содержит от приблизительно 15 до приблизительно 60 мас.% тразодона или его производного и от приблизительно 15 до приблизительно 85 мас.% наполнителя для контролируемого высвобождения. Наполнитель для контролируемого высвобождения при оральном введении млекопитающему, например субъекту,позволяет тразодону или его производному достигать и/или поддерживать эффективную концентрацию в плазме, например терапевтически эффективную концентрацию в плазме по меньшей мере от приблизительно 1 до приблизительно 24 ч после первоначального введения для лечения депрессии. Кроме того, возможно применение тех же или похожих составов для лечения глубоких расстройств,например улучшения структуры сна. Наполнитель для контролируемого высвобождения при оральном введении млекопитающему, например субъекту, позволяет тразодону или его производному достигать эффективной концентрации в плазме для лечения глубоких расстройств. Такой состав вызывает быструю(например, в течение 1 ч) сонливость после орального введения, но зато обеспечивает, по существу, отсутствие сонливости у пациента около 8 ч после орального введения по сравнению с повторным введением композиции быстрого высвобождения тразодона. Описанные здесь композиции обеспечивают быстрое увеличение концентрации активного ингредиента в плазме, которая после этого остается относительно и в значительной степени стабильной в течение по меньшей мере 24 ч или более. Концентрация в плазме в течение от 1 до 24 ч остается в пределах приблизительно 45% от средней концентрации в плазме, более предпочтительно в пределах приблизительно 30% от средней концентрации в плазме и наиболее предпочтительно в пределах приблизительно 15% от средней концентрации в плазме. В определенных композициях после начального быстрого высвобождения тразодона или производного тразодона в течение 1 ч после приема внутрь тразодон или производное тразодона высвобождается in vivo приблизительно с кинетикой нулевого порядка в течение по меньшей мере приблизительно 24 ч, приводя к выходу концентрации в плазме на плато. В этих составах эффективная концентрация в плазме состава тразодона остается постоянной, как правило, приблизительно 1 ч после приема внутрь, и может составлять приблизительно от 60 до 3000 нг/мл, приблизительно от 150 до 1500 нг/мл, приблизительно от 600 до 1300 нг/мл, приблизительно от 500 до 1200 нг/мл или приблизительно от 300 до 650 нг/мл по меньшей мере в течение приблизительно 24 ч после орального введения. Рассматриваемые здесь композиции могут достигать установившегося состояния, например, в-3 014739 среднем, внутри обычной популяции, после приблизительно четырех введений. Соотношение пиквпадина, образуемое такими композициями в установившемся состоянии, может составлять приблизительно от 60 до 100%. Рассматриваемые здесь композиции замедленного высвобождения тразодона могут обладать эффективными концентрациями в плазме, которые, например, биоэквивалентны в плане AUC (площадь под кривой) композиции с быстрым высвобождением, которая вводится, например, два или три раза в день.AUC представляет собой математический расчет для оценки общего воздействия на организм в течение времени данного лекарственного средства и относится к области под кривой на кривой концентрации лекарственного средства от времени, AUC используют в качестве ориентира для планирования дозирования и для сравнения биологической доступности композиций различных лекарственных средств в организме. Описанные здесь композиции пригодны, в частности, для доставки тразодона и производных тразодона. Производные включают фармацевтически приемлемые пролекарства, метаболиты, соли и эфиры или подобные тразодона. Например, термин фармацевтически приемлемые соли применяется в рассматриваемой области и относится к относительно нетоксичным, неорганическим и органическим,образуемым присоединением остатков кислот солям соединений, например, включая соединения, входящие в композиции по настоящему изобретению. В предпочтительном варианте осуществления активным ингредиентом в композиции является гидрохлорид тразодона. Композиция по изобретению может включать тразодон или его производные и наполнитель для контролируемого высвобождения. В некоторых вариантах осуществления раскрываемые здесь композиции включают более чем приблизительно 15 мас.% тразодона или его производных, например приблизительно от 15 до 60%, или приблизительно от 20 до 60%, или приблизительно от 20 до 55 мас.%. В других вариантах осуществления рассматриваемые здесь композиции могут включать более чем около 15 мас.% наполнителя для контролируемого высвобождения, например, приблизительно от 15 до 85%, или приблизительно от 20 до 85%, или приблизительно от 20 до 60%, приблизительно от 20 до 50%, или приблизительно от 30 до 50 мас.%. Композиция по изобретению предпочтительно содержит приблизительно от 20 до 50 мас.%, более предпочтительно приблизительно от 25 до 50% тразодона или производного тразодона и приблизительно от 20 до 50 мас.%, более предпочтительно приблизительно от 25 до 50 мас.% наполнителя для контролируемого высвобождения. В конкретном варианте осуществления это изобретение направлено на композицию, содержащую приблизительно от 25 до 50 мас.% гидрохлорида тразодона и приблизительно от 30 до 50% поперечно-сшитого высокоамилозного крахмала, такого как раскрыт здесь. Практический пример фармацевтической композиции замедленного высвобождения по изобретению представляет собой композиция, содержащая 150 мг гидрохлорида тразодона. Такая композиция может обеспечивать эффективную концентрацию в плазме предпочтительно в диапазоне приблизительно от 150 до 500 нг/мл приблизительно от 1 до 24 ч после первого введения. Другим практическим примером является композиция, содержащая 300 мг гидрохлорида тразодона. Такая композиция может обеспечивать концентрацию тразодона в плазме предпочтительно в диапазоне от приблизительно 300 до 1000 нг/мл. Разумеется, другие композиции по изобретению могут быть приготовлены с различными количествами тразодона или его производных с соответствующим изменением концентраций в плазме, которые могут составлять, например, приблизительно от 50 до 3000 нг/мл. Рассматриваемые здесь наполнители для контролируемого высвобождения можно менять в широких пределах, как хорошо известно специалистам в данной области, при условии, что композиция, включающая наполнитель, обладает раскрытым терапевтическим действием и/или обеспечивает независимую от рН доставку тразодона или производного тразодона. Наполнители для контролируемого высвобождения могут включать поперечно-сшитые крахмалы, гидрогели, целлюлозы и/или полимеры и другие наполнители для контролируемого высвобождения, известные специалистам в данной области. В одном варианте осуществления наполнитель для контролируемого высвобождения предпочтительно содержит поперечно-сшитый высокоамилозный крахмал, например, где поперечно-сшитый высокоамилозный крахмал поперечно сшит оксихлоридом фосфора и/или содержит боковые цепи гидроксипропила. В конкретных вариантах осуществления поперечно-сшитый высокоамилозный крахмал содержит от приблизительно 65 до 75 мас.% амилозы и поперечно сшит оксихлоридом фосфора. Подходящий наполнитель был разработан и коммерчески доступен от Labopharm, Inc., Laval, Canada под торговой маркой CONTRAMID. Синтез наполнителя CONTRAMID описан, например, в U.S. Patent No. 6607748, включенном здесь в качестве ссылки во всей полноте для всех целей. Рассматриваемые здесь композиции могут включать поперечно-сшитый высокоамилозный крахмал вместе с одним или более дополнительных наполнителей для контролируемого высвобождения. Поперечное сшивание крахмала представляет собой эффективный способ модификации крахмала. Как правило, гранулы крахмала поперечно сшивают для увеличения устойчивости композиции к расщеплению или повышенной температуре. Такие химически поперечно-сшитые крахмалы обеспечивают необходимую плавную стуктуру, стабильную вязкость при всех производственных операциях и нормальный срок годности. В некоторых вариантах осуществления поперечно-сшитый высокоамилозный крахмал, как рассматривается здесь, может быть желатинирован после поперечного сшивания. В пред-4 014739 почтительном варианте осуществления поперечно-сшитый высокоамилозный крахмал может содержать дополнительные химические модификации (например, присоединенный гидроксипропил) перед желатинированием. Поперечно-сшитый высокоамилозный крахмал можно получить по методикам, описанным в предыдущем уровне техники. Например, поперечное сшивание амилозы можно проводить способом, описанным в Mateescu [BIOCHEMIE 60: 535-537 (1978)], путем реакции амилозы с эпихлоргидрином в щелочных условиях. Тем же способом крахмал можно поперечно прошить реагентом, выбранным из группы, состоящей из эпихлоргидрина, ангидрида адипиновой кислоты, триметафосфата натрия и оксихлорида фосфора или других сшивающих веществ, включая в качестве неограничивающих примеров 2,3 дибромпропанол, нормально смешанные ангидриды уксусной и ди- или трехосновных карбоновых кислот, сульфонвинил, диэпоксиды, циануровый хлористый, гексагидро-1,3,5-трисакрилоил-s-триазин, гексаметилендиизоцианат, толуол 2,4-диизоцианат, N,N-метиленбисакриламид, N,N'-бис(гидроксиметил) этиленмочевина, смешанные ангидриды карбонил-карбоновой кислоты, имидазолиды карбоновой и многоосновной карбоксильной кислот, имидазольные соли многоосновных карбоновых кислот и гуанидиновые производные поликарбоновых кислот. Используемые условия реакции следует варьировать в зависимости от типа и количества сшивающего агента, который применяется, а также базовой концентрации,количества и типа крахмала. Предполагают, что крахмалы, содержащие более чем приблизительно 40% мас./мас. амилозы, могут быть использованы для образования поперечно-сшитого высокоамилозного крахмала, например крахмал гороха и мозгового гороха, бобовый крахмал, крахмал гибридов или генетически модифицированных маниока или картофеля, или любой другой крахмал из корней, клубней или зерна. Предпочтительно высокоамилозный крахмал, содержащий приблизительно 70% мас./мас. амилозы, применяется в качестве основы. Например, можно применять высокоамилозный крахмал Cerestar AmyloGel 03003 (CerestarU.S.A. Inc.). Было обнаружено, что при сочетании тразодона или производного тразодона с наполнителем для контролируемого высвобождения, например, поперечно-сшитым высокоамилозным крахмалом (например, поперечно-сшитый высокоамилозный крахмал CONTRAMID), тразодон, который чувствителен к рН с pKa приблизительно=6,74, может высвобождаться и поглощаться не только в верхнем отделе желудочно-кишечного тракта, где рН ниже pKa тразодона (где тразодон растворим), но также в нижнем отделе желудочно-кишечного тракта, где рН выше pKa тразодона (где тразодон слабо растворим), что поддерживает стабильные концентрации в плазме при прохождении через желудочно-кишечный тракт. На сегодняшний день, по нашим сведениям, не был предложен тразодон для введения один раз в день,включая рН-зависимое активное вещество, или запланирован для композиции, обладающей описанным здесь фармакокинетическим профилем. Фармацевтическая композиция по изобретению может также содержать фармацевтически приемлемые добавки. Такие добавки могут включать, например, сахара, такие как лактоза, глюкоза и сахароза; другие крахмалы, такие как зерновой крахмал и картофельный крахмал; целлюлозу и ее производные,такие как натрийкарбоксиметилцеллюлоза, этилцеллюлоза и целлюлозоацетат; порошкообразный трагакант; солод; желатин; тальк; гликоли, такие как пропиленгликоль; полиолы, такие как глицерин, сорбитол, мармитол и полиэтиленгликоль; сложные эфиры, такие как этилолеат и этиллаурат; агар; буферные вещества, такие как гидроксид магния и гидроксид алюминия; альгиновую кислоту и другие нетоксичные совместимые вещества, применяемые в фармацевтических составах. Такие добавки также могут включать окрашивающие вещества. Например, раскрытые здесь композиции могут включать любые смеси связывающих веществ, солюбилизирующих компонентов, подкислителей, порообразующих веществ, смягчающих компонентов и веществ, способствующих скольжению, и подобных, хорошо известных специалистам в данной области. Предпочтительные фармацевтические добавки, которые применяют при предоставлении композиции по изобретению, могут включать, например, связывающие вещества, которые включают, например, гидроксипропилметилцеллюлозу, гидроксипропилцеллюлозу, гидроксиэтилцеллюлозу, метилцеллюлозу, дикальцийфосфат, фосфат кальция, микрокристаллическую целлюлозу или подобные, солюбилизирующие компоненты, которые включают, например, повидон, цетилпиридиумхлорид или подобные, подкислители, которые включают, например, альгиновую кислоту, лимонную кислоту, янтарную кислоту, желчную кислоту или подобные, порообраующие вещества, которые включают, например, сахарозу, лактозу, маннит или подобные, смазывающие вещества, которые включают, например, стеарилфумарат натрия, стеарат магния, стеарат кальция, стеариновую кислоту, гидрогенизированные растительные масла или подобные и/или вещества, способствующие скольжению, которые включают, например, коллоидный диоксид кремния, тальк или подобные. Другие добавки, которые хорошо известны специалистам в данной области, можно, разумеется, включать в композицию по изобретению, не выходя за рамки и сущность настоящего изобретения. Например, композиция по изобретению может содержать приблизительно от 20 до 50 мас.% гидрохлорида тразодона, приблизительно от 20 до 50 мас.% поперечно-сшитого высокоамилозного крахмала(например, поперечно-сшитый высокоамилозный крахмал CONTRAMID), приблизительно от 10 до 25 мас.% гидроксипропилметилцеллюлозы, приблизительно от 0 до 10 мас.% цетилпиридиумхлорида, приблизительно от 0 до 20 мас.% альгиновой кислоты, приблизительно от 1 до 5 мас.% стеарилфумарата натрия и до около 1 мас.% коллоидного диоксида кремния. Композиция по изобретению обычно изготовляется в виде таблетки. Хотя таблетка может принимать широкое разнообразие форм, как хорошо известно специалистам в данной области, предпочтительной формой является таблетка в форме капсулы. Такие таблетки в виде капсулы можно формировать при помощи, например, верхнего и нижнего штампов, как известно в данной области. В некоторых вариантах осуществления таблетки могут включать оболочку, такую как, например, оболочку с окрашивающим веществом. Пригодные покрытия включают, например, водные пленочные покрывающие полимеры, такие как поливиниловый спирт, тальк, макрогол и подобные и их смеси. Пригодные окрашивающие вещества включают, например, оксид железа, лаки, натуральные окрашивающие вещества и другие окрашивающие вещества, известные специалистам в данной области. В типичном протоколе для тразодона для приготовления партии из 5 кг типичного состава замедленного высвобождения наполнитель CONTRAMID, гидроксипропилметилцеллюлоза, тразодон-HCl и стеарилфумарат натрия индивидуально взвешивают и просеивают через фильтр размером меш 30. Коллоидный диоксид кремния взвешивают и предварительно смешивают с CONTRAMID, просеивают через фильтр размером 30 меш и смешивают 10-30 с, например 15 с, для получения предварительной смеси. Гидроксипропилметилцеллюлозу, тразодон и предварительную смесь CONTRAMID-коллоидный диоксид кремния объединяют и смешивают в течение 5-10 мин, например 7 мин, для получения массы смеси. Небольшую часть получившейся массы смеси объединяют со стеарилфумаратом натрия и перемешивают в течение 20-60 с, например 30 с. Образующуюся смесь со стеарилфумаратом натрия объединяют с оставшейся массой смеси и получившуюся смесь перемешивают в течение приблизительно 2-6 мин, например 4 мин. Окончательную смесь прессуют в таблетки при давлении сжатия 27 kN. Таблетки в виде капсулы формируют при помощи стандартного штамповального пресса со впадинами для таблеток в виде капсул. Дозировка для введения один раз в день может составлять от 25 до 600 мг тразодона или производного тразодона. Типичная доза для введения один раз в день содержит 150 или 300 мг тразодона или производного тразодона, хотя это количество может в значительной степени меняться в зависимости от необходимых потребностей и специфических требований лечащего врача. Например, дозировку любой композиции по настоящему изобретению следует менять в зависимости от симптомов, возраста и массы тела пациента, природы и тяжести подвергаемого лечению или профилактике расстройства, курса введения и формы представленной композиции. Дозировки для композиций по настоящему изобретению можно легко определить по методикам, известным специалистам в данной области, или как рекомендовано здесь. Точное время введения и количество любой конкретной представленной композиции, которая должна произвести наиболее эффективное лечение у данного пациента, будет зависеть от активности, фармакокинетики и биологической доступности конкретной представленной композиции, физиологических особенностей, пациента (включая возраст, пол, тип и степень заболевания, общие физиологические условия, чувствительность к данной дозировке и типу лечения), курса введения и подобных. Приведенные здесь рекомендации могут применяться для оптимизации лечения, например, определения оптимального времени и/или количества введения, для чего потребуется не более чем рутинное исследование,состоящее из наблюдения за субъектом и приведения в соответствие дозировки и/или временного режима. Полученные составы обладают профилями in vitro, предпочтительно, как описано ниже в примерах 1 и 3. Профили высвобождения in vitro определялись следующим образом. Вкратце, скорость высвобождения оценивалась способом с использованием U.S.Р. лопастей (прибор типа II, как описано в U.S.Р.XXVI) при 150 переворотах в минуту при 370,5 С в 900 мл раствор гидрохлорида/хлорида натрия с рН 1,2 (кислотная стадия) в течение 1 ч, с последующими 900 мл натрийфосфатного одноосновного буфера с рН 6,0 (буферная стадия). В некоторых вариантах осуществления составы могут обладать кинетикой высвобождения, в результате чего при тестировании вышеприведенным способом не более чем приблизительно 30% активного ингредиента высвобождается в течение 1 ч после начала эксперимента, приблизительно от 35 до 60% активного ингредиента высвобождается через 6 ч, не более чем приблизительно 80% активного ингредиента высвобождается через 12 ч и/или не менее чем приблизительно 80% активного ингредиента высвобождается через 24 ч. Описанные здесь композиции, в частности, пригодны для лечения депрессий, связанных с депрессией расстройств и нарушений сна. Соответственно, млекопитающему, страдающему депрессией, можно вводить один раз в день (например, перед сном) состав тразодона, как определено выше. Под млекопитающим, подвергаемым лечению рассматриваемым способом, можно подразумевать либо человека, либо не относящееся к человеку млекопитающее. Описанные здесь композиции также можно применять для лечения пациентов, у которых существуют затруднения со сном и/или нарушение структуры сна, т.е. нарушение медленной /парадоксальной стадии и циклической инфраструктуры сна. В некоторых вариантах осуществления раскрытые здесь-6 014739 композиции высвобождают терапевтически эффективную часть тразодона в течение 1 ч после орального введения и, таким образом, быстро вызывают сонливость, но, несмотря на это, обеспечивают, по существу, отсутствие сонливости у пациента приблизительно 8 ч после орального введения по сравнению с повторным введением композиции с быстрым высвобождением тразодона. Следовательно, такие составы уменьшают нежелательную сонливость в часы пробуждения или в дневное время. Изобретение сейчас будет проиллюстрировано при помощи следующих примеров, которые приведены только в целях иллюстрации и без какого-либо стремления ограничить объем настоящего изобретения. Примеры Пример 1. Была приготовлена первая композиция, содержащая 300 мг тразодона замедленного высвобождения Кинетика высвобождения in vitro такой композиции оценивалась способом с использованием U.S.Р. мешалки (прибор типа II, как описано в U.S.Р. XXVI) при 150 переворотах в минуту при 370,5 С в 900 мл раствора гидрохлорида/хлорида натрия с рН 1,2 (кислотная стадия) в течение 1 ч, с последующими 900 мл натрийфосфатного одноосновного буфера с рН 6,0 (буферная стадия). Такая композиция при тестировании вышеприведенным способом обладала профилем высвобождения in vitro, при котором не более чем приблизительно 30% активного ингредиента высвобождалось через 1 ч после начала эксперимента, приблизительно от 35 до 55% активного ингредиента высвобождалось через 6 ч, не более чем приблизительно 80% активного ингредиента высвобождалось через 12 ч и не менее чем приблизительно 80% активного ингредиента высвобождалось через 24 ч. Кроме того, композицию подвергали испытанию in vivo. Фармакокинетику такой композиции сравнивали с фармакокинетиками коммерческих продуктов таблеток Trittico AC 150 мг CR, принимаемыхBID, и таблеток Desyrel 100 мг IR, принимаемых TID в рандомизированном фармакокинетическом перекрестном исследовании у людей. Было обнаружено, что после введения состава 1 концентрации тразодона в плазме увеличивались более постепенно и пик концентрации тразодона в плазме был ниже, чем у любого из продуктов сравнения. Среднее значение концентраций тразодона в плазме, измеренных для 18 пациентов, представлено на фиг. 2. Результаты показывают, что эта композиция обеспечивает терапевтическую концентрацию в плазме в течение приблизительно 1 ч и предоставляет, по существу, постоянную концентрацию тразодона от 1 до 24 ч. Концентрации тразодона в плазме за 24 ч были сходны с концентрациями после введения TID Desyrel и введения BID Trittico AC. Эксперименты in vivo демонстрируют, что после орального введения композиции 1, по прошествии короткого периода достижения приемлемой концентрации в плазме, концентрации тразодона в плазме поддерживалась на относительно постоянном уровне от приблизительно 1 ч после введения по меньшей мере до 24 ч после введения. Пример 2. Была приготовлена вторая композиция, содержащая 300 мг тразодона замедленного высвобождения Кинетика высвобождения in vitro композиции 2 оценивалась способом с использованием U.S.Р. мешалки, описанного в примере 1. Профиль высвобождения in vitro (фиг. 3) показывает, что в этой композиции не более чем приблизительно 30% активного ингредиента высвобождалось через 1 ч после начала эксперимента, приблизительно от 35 до 55% активного ингредиента высвобождалось через 6 ч, не более чем приблизительно 80% активного ингредиента высвобождалось через 12 ч и не менее чем приблизительно 80% активного ингредиента высвобождалось через 24 ч. Композицию 2 также оценивали in vivo. Полученные результаты были фактически теми же, когда композицию 2 сравнивали с Trittico и Desyrel. Среднее значение концентрации тразодона в плазме,измеренных для 19 пациентов, представлено в фиг. 4. Было обнаружено, что после введения композиции 2 концентрации тразодона в плазме увеличивается для достижения терапевтической концентрация в течение приблизительно 1 ч. Концентрации в плазме возрастали вплоть до приблизительно 6 ч после орального введения, а затем постепенно снижались. Концентрация тразодона в плазме, достигаемая композицией 1, была более стабильна между 1 и 24 ч, чем таковая, предоставляемая составом 2. Пример 3. Была приготовлена первая композиция, содержащая 150 мг тразодона замедленного высвобождения Кинетика высвобождения in vitro композиции 3 оценивалась способом с использованием U.S.Р. мешалки, описанным в примере 1. Профиль высвобождения in vitro (фиг. 5) показывает, что в этой композиции не более чем приблизительно 30% активного ингредиента высвобождалось через 1 ч после начала эксперимента, приблизительно от 40 до 60% активного ингредиента высвобождалось через 6 ч, не более чем приблизительно 80% активного ингредиента высвобождалось через 12 ч и не менее чем приблизительно 80% активного ингредиента через 24 ч. Композицию 2 также оценивали in vivo. Среднее значение концентраций тразодона в плазме, измеренных у 18 пациентов, представлено в фиг. 6. Было обнаружено, что после введения композиции 3 концентрации тразодона в плазме быстро увеличиваются с достижением терапевтической концентрации в течение приблизительно 1 ч. Результаты свидетельствуют о фактически постоянной концентрации тразодона от 1 до 24 ч. Как и в случае композиции 1, она демонстрирует нулевой порядок кинетики высвобождения между 1 и 24 ч после перорального введения. Хотя настоящее изобретение было проиллюстрировано при помощи его предпочтительных вариантов осуществления, понятно, что настоящее изобретение предполагает охватить иные аспекты без отступления от сущности и объема, как определено в прилагаемой формуле изобретения.-8 014739 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Фармацевтическая композиция замедленного высвобождения для перорального введения один раз в день, где композиция содержит приблизительно от 15 до приблизительно 60 мас.% тразодона или его фармацевтически приемлемой соли или эфира и приблизительно от 15 до приблизительно 85 мас.% наполнителя для контролируемого высвобождения и, необязательно, фармацевтическую добавку, где указанный наполнитель для контролируемого высвобождения характеризуется тем, что при введении композиции млекопитающему позволяет тразодону или его фармацевтически приемлемой соли или эфиру поддерживать эффективную концентрацию в плазме по меньшей мере от приблизительно 1 по меньшей мере до 24 ч после первоначального введения. 2. Фармацевтическая композиция замедленного высвобождения по п.1, где концентрация в плазме является эффективной при лечении депрессии у млекопитающего. 3. Фармацевтическая композиция замедленного высвобождения по п.1 или 2, где концентрация в плазме является эффективной при лечении расстройства сна у млекопитающего. 4. Фармацевтическая композиция замедленного высвобождения по любому из пп.1-3, где композиция содержит гидрохлорид тразодона. 5. Фармацевтическая композиция замедленного высвобождения по любому из пп.1-4, где наполнитель для контролируемого высвобождения обеспечивает концентрацию тразодона в плазме между приблизительно 50 и приблизительно 3000 нг/мл, которая остается фактически постоянной в течение периода, который длится от около 1 ч после введения до около 24 ч. 6. Фармацевтическая композиция замедленного высвобождения по п.1, где композиция содержит 150 мг гидрохлорида тразодона. 7. Фармацевтическая композиция замедленного высвобождения по п.6, где концентрация тразодона в плазме, достигнутая за 1 ч после приема внутрь, составляет между приблизительно 150 и приблизительно 500 нг/мл. 8. Фармацевтическая композиция замедленного высвобождения по п.1, где композиция содержит 300 мг гидрохлорида тразодона. 9. Фармацевтическая композиция замедленного высвобождения по п.8, где концентрация тразодона в плазме через 1 ч после приема внутрь составляет от приблизительно 300 до приблизительно 1000 нг/мл. 10. Фармацевтическая композиция замедленного высвобождения по любому из пп.1-9, где композиция содержит от приблизительно 20 до приблизительно 50 мас.% тразодона или производного тразодона и от приблизительно 20 до приблизительно 50 мас.% наполнителя для контролируемого высвобождения. 11. Фармацевтическая композиция замедленного высвобождения по п.10, где композиция содержит от приблизительно 35 до 50 мас.% тразодона или производного тразодона и от приблизительно 15 до 50 мас.% наполнителя для контролируемого высвобождения. 12. Фармацевтическая композиция замедленного высвобождения по любому из пп.1-11, где наполнитель для контролируемого высвобождения содержит поперечно-сшитый высокоамилозный крахмал. 13. Фармацевтическая композиция замедленного высвобождения по п.12, где поперечно-сшитый высокоамилозный крахмал содержит между приблизительно 65 и 75 мас.% амилозы и поперечно сшит оксихлоридом фосфора. 14. Фармацевтическая композиция замедленного высвобождения по п.13, где поперечно-сшитый высокоамилозный крахмал содержит боковые цепи гидроксипропила. 15. Фармацевтическая композиция замедленного высвобождения по п.14, где поперечно-сшитый высокоамилозный крахмал желатинирован. 16. Фармацевтическая композиция замедленного высвобождения по любому из пп.1-14, где композиция содержит фармацевтическую добавку. 17. Фармацевтическая композиция замедленного высвобождения по п.16, где фармацевтическая добавка выбрана из связывающего вещества, солюбилизирующего компонента, подкислителя, порообразующего вещества, смягчающего компонента и вещества, способствующего скольжению. 18. Фармацевтическая композиция замедленного высвобождения по п.17, где связывающее вещество представляет собой гидроксипропилметилцеллюлозу. 19. Фармацевтическая композиция замедленного высвобождения по п.17, где солюбилизирующий компонент выбран из повидона или цетилпиридиумхлорида. 20. Фармацевтическая композиция замедленного высвобождения по п.17, где подкислитель представляет собой альгиновую кислоту. 21. Фармацевтическая композиция замедленного высвобождения по п.17, где порообразующее вещество представляет собой сахарозу. 22. Фармацевтическая композиция замедленного высвобождения по п.17, где смягчающий компонент представляет собой стеарилфумарат натрия. 23. Фармацевтическая композиция замедленного высвобождения поп.17, где вещество, способствующее скольжению, представляет собой коллоидный диоксид кремния.-9 014739 24. Фармацевтическая композиция замедленного высвобождения для перорального введения один раз в день, содержащая по меньшей мере 150 мг гидрохлорида тразодона, приблизительно от 20 до приблизительно 50 мас.% поперечно-сшитого высокоамилозного крахмала, приблизительно от 10 до приблизительно 25 мас.% гидроксипропилметилцеллюлозы, приблизительно от 0 до приблизительно 5 мас.% цетилпиридиумхлорида, приблизительно от 0 до приблизительно 20 мас.% альгиновой кислоты,приблизительно от 1 до приблизительно 5 мас.% стеарилфумарата натрия и до приблизительно 1 мас.% коллоидного диоксида кремния. 25. Фармацевтическая композиция замедленного высвобождения по любому из пп.1-24, где композиция представляет собой композицию в форме таблетки. 26. Фармацевтическая композиция замедленного высвобождения по п.25, где таблетка сформирована в виде капсулы. 27. Фармацевтическая композиция замедленного высвобождения по п.26, где таблетка в форме капсулы содержит приблизительно 300 мг тразодона. 28. Фармацевтическая композиция замедленного высвобождения по пп.1-27, где композиция обеспечивает отсутствие сонливости у субъекта приблизительно 8 ч после перорального введения по сравнению с повторными введениями композиции быстрого высвобождения тразодона. 29. Единичная доза фармацевтической композиции замедленного высвобождения для перорального введения один раз в день 300 мг гидрохлорида тразодона, содержащая приблизительно от 20 до приблизительно 40 мас.% наполнителя для контролируемого высвобождения, где при пероральном приеме внутрь композиция обеспечивает площадь под кривой концентрация-время, по существу, эквивалентную суточной дозе трех таблеток с концентрацией 100 мг гидрохлорида тразодона, где три таблетки вводят в течение 24 ч. 30. Единичная доза фармацевтической композиции замедленного высвобождения для перорального введения один раз в день 150 мг гидрохлорида тразодона, содержащая приблизительно от 30 до приблизительно 50 мас.% наполнителя для контролируемого высвобождения, где при пероральном приеме внутрь композиция обеспечивает площадь под кривой концентрация-время, по существу, эквивалентную суточной дозе трех таблеток с концентрацией 50 мг гидрохлорида тразодона, где три таблетки вводят в течение 24 ч. 31. Способ лечения расстройства сна, включающий введение субъекту с расстройством сна фармацевтической композиции замедленного высвобождения, содержащей тразодон или производное тразодона в наполнителе для контролируемого высвобождения, где указанный наполнитель для контролируемого высвобождения характеризуется тем, что при введении композиции млекопитающему, обеспечивает поддержание эффективной концентрации в плазме тразодона или его фармацевтически приемлемой соли или эфира по меньшей мере от приблизительно 1 ч по меньшей мере до приблизительно 24 ч после первоначального введения. 32. Способ лечения расстройства сна, включающий введение субъекту с расстройством сна фармацевтической композиции замедленного высвобождения по любому из пп.1-30. 33. Способ по любому из пп.31 или 32, где композицию вводят перед сном. 34. Способ лечения депрессии, включающий введение один раз в день субъекту с депрессией фармацевтической композиции замедленного высвобождения по любому из пп.1-30. 35. Способ по п.34, где композицию вводят перед сном. 36. Применение фармацевтической композиции замедленного высвобождения по любому из пп.130 для лечения депрессии. 37. Применение по п.36, где композицию вводят перед сном. 38. Применение фармацевтической композиции замедленного высвобождения по любому из пп.130 для получения лекарственного средства, пригодного для лечения депрессии. 39. Применение фармацевтической композиции замедленного высвобождения по любому из пп.130 для лечения расстройства сна. 40. Применение фармацевтической композиции замедленного высвобождения по любому из пп.130 для получения лекарственного средства, пригодного для лечения расстройства сна. 41. Применение по любому из пп.39 или 40, где композицию вводят перед сном.
МПК / Метки
МПК: A61K 9/22, A61P 25/20, A61K 47/36, A61P 25/24, A61K 31/496
Метки: введения, композиция, один, день, тразодона
Код ссылки
<a href="https://eas.patents.su/13-14739-kompoziciya-trazodona-dlya-vvedeniya-odin-raz-v-den.html" rel="bookmark" title="База патентов Евразийского Союза">Композиция тразодона для введения один раз в день</a>
Предыдущий патент: Гетероарил-замещенные диазатрициклоалканы, способы их получения и их применение
Следующий патент: Картридж для обработки газа
Случайный патент: Этикетка и ее применение