Мутантный il-6 человека и его внутренний фрагмент, кодирующие их последовательности днк, способы их получения, содержащие их фармацевтические композиции, содержащие их векторы, линии клеток- хозяев испособ лечения il-6 опосредованных заболеваний
Формула / Реферат
1. Мутантный интерлейкин-6 (IL-6) человека, имеющий аминокислотную последовательность

содержащую следующие точечные мутации по сравнению с природным IL-6 человека: Pro 54, Glu 159, Pro 162, Leu 170 и Аrg 176.
2. Внутренний фрагмент мутантного IL-6 человека по п.1 формулы, обладающий аналогичной биологической активностью.
3. Последовательность ДНК, кодирующая мутантный IL-6 человека по п.1 формулы.
4. Последовательность ДНК, кодирующая внутренний фрагмент мутантного IL-6 человека по п.2 формулы.
5. Вектор, используемый для экспрессии мутантного IL-6 по п.1 формулы или его внутреннего фрагмента по п.2 формулы, содержащий последовательность ДНК по любому из пп.3-4 формулы.
6. Линия клеток-хозяев, трансформированная вектором экспрессии по п.5 формулы или последовательностью ДНК по любому из пп.3-4 формулы.
7. Способ получения мутантного IL-6 по п.1 формулы, заключающийся в том, что культивируют линию клеток-хозяев по п.6 формулы в условиях, обеспечивающих экспрессию IL-6, и выделяют целевой продукт из культуральной среды.
8. Способ получения внутреннего фрагмента мутантного IL-6 по п.2 формулы, заключающийся в том, что культивируют линию клеток-хозяев по п.6 формулы в условиях, обеспечивающих экспрессию фрагмента, и выделяют целевой продукт из культуральной среды.
9. Фармацевтическая композиция, содержащая в качестве активного ингредиента мутантный IL-6 по п.1 формулы или его внутренний фрагмент по п.2 формулы и один или более фармацевтически приемлемый носитель и/или наполнитель.
10. Применение мутантного IL-6 по п.1 формулы в качестве активного ингредиента фармацевтической композиции по п.9 формулы.
11. Применение внутреннего фрагмента мутантного IL-6 по п.1 формулы в качестве активного ингредиента фармацевтической композиции по п.9 формулы.
12. Способ лечения заболеваний, опосредованных патогенным действием IL-6, включающий введение пациенту эффективного количества фармацевтической композиции по п.9 формулы.
Текст
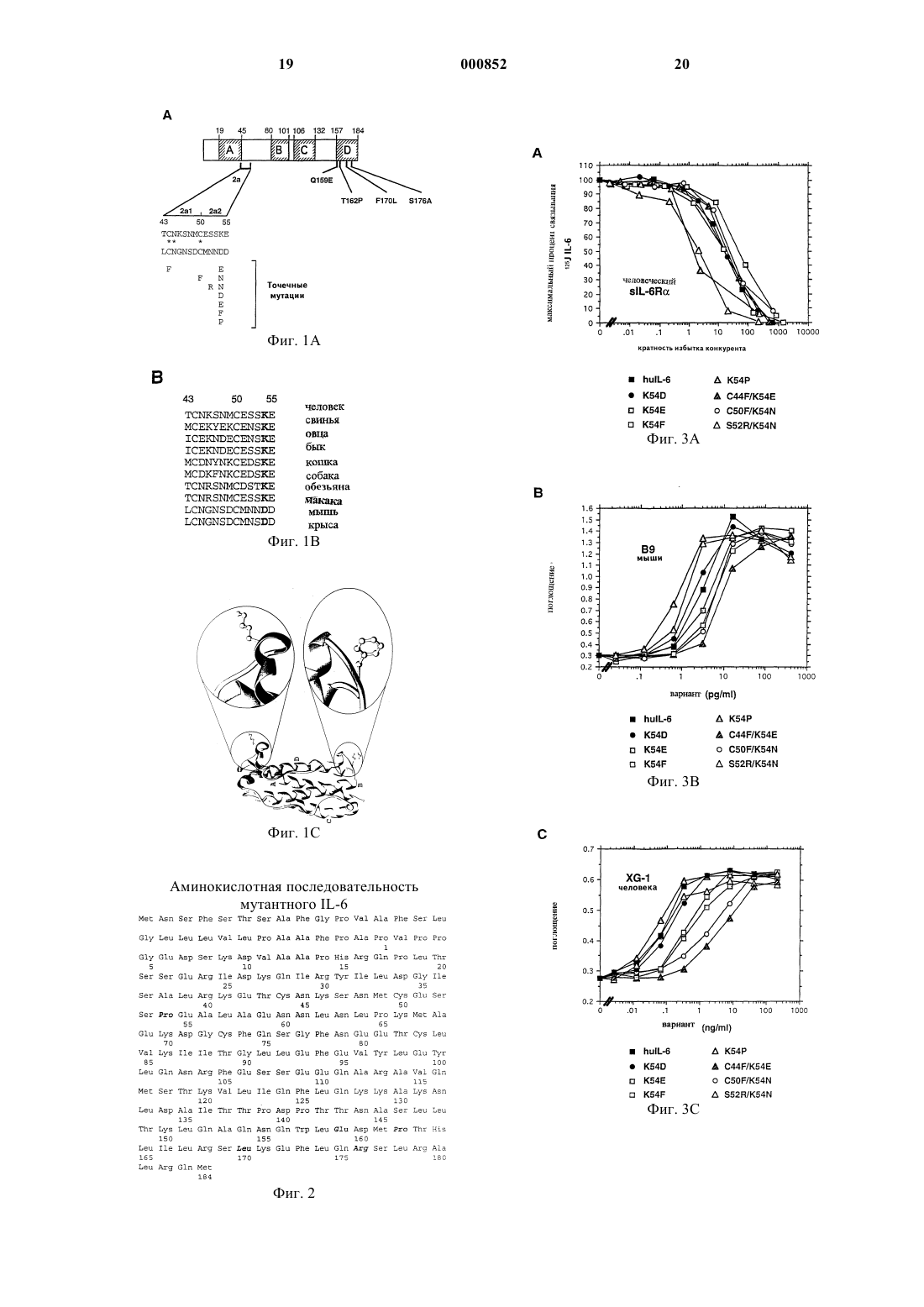
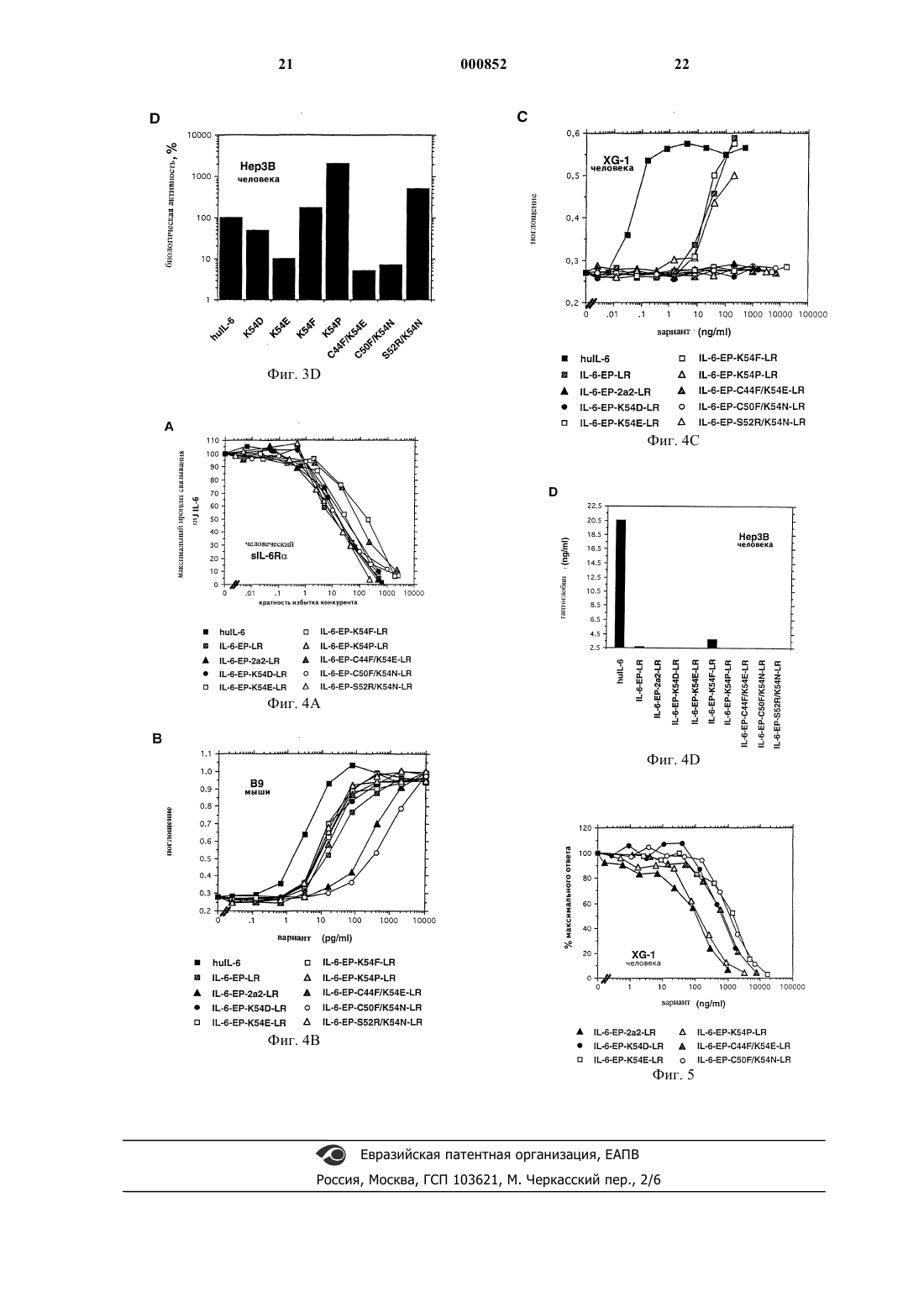
1 Область техники, к которой относится изобретение Настоящее изобретение относится к новому мутантному IL-6, кодирующей его последовательности ДНК и его применению в терапии,в том числе и в составе композиций. Предпосылки изобретения Интерлейкин-6 выделяется в плазму при повреждении или инфекции различными типами клеток. Он вовлечен в ряд процессов, таких как иммунная защита, гемопоэз, созревание мегакариоцитов, образование тромбоцитов и реакции острой фазы (Akira, S. et al., Adv. Immunol. 54:1,1993). Играя ключевую роль в защите организмахозяина, IL-6 вовлечен в патогенез многих заболеваний, таких как плазмоцитома/миелома, остеопороз, неопластические и аутоиммунные заболевания (Akira, S. et al., Adv. Immunol. 54:1,1993). Рецепторный комплекс IL-6 на клеткахмишенях состоит из двух различных субъединиц: специфической лиганд связывающей субъединицы массой 80 кДа (IL-6Ra) и передающего сигнал белка массой 130 кДа (gр 130) (Yamasaki К. et al., Science 241:825, 1988; Таgа T.et al., Cell 58:573, 1989; Hibi, M. et al., Cell 63:1149, 1990).IL-6 связывается с IL-6R, и комплекс IL-6/IL6R ассоциируется с димером gp130, инициируя сигнал IL-6. Сам по себе IL-6 не обнаруживает доступного измерению сродства к gp130Murakami, M et al., Science 260:1808, 1993). Интерлейкин 6 является белком, характеризующимся вариабельностью N-концевого участка. Ранее было показано (Hirano, Т. et al.Nature 324:73, 1986), что он состоит из 184 аминокислот. (Эта нумерация аминокислот далее будет применена в заявке). Предсказания вторичной структуры и моделирование белка показали, что IL-6 является членом семейства гемопоэтических цитокинов, характеризующимся четырьмя антипараллельными -спиралями (A,В, С и D) (Bazan, J.F., Immunol. Today 11:350,1990; Ehlers, M., J.Immunol. 153:1744, 1994). LIF фактор ингибирования лейкоза, CNTF (цилиарный нейротрофный фактор), IL-11, СТ-1 (кардиотропин-1) и OSM (онкостатин M) также принадлежат к этому семейству. Все они используют белок gp130 в своем рецепторном комплексе, что объясняет их перекрывающиеся биологические активности (Akira, S. et al., Adv.Acad. Sci. U.S.A. 92:1141, 1995; Pennica, D. et al.,J.Biol. Chem. 270:10915, 1995). Делеционным анализом IL-6 было показано, что 28 N-концевых аминокислотных остатков являются несущественными для биологической активности данной молекулы. Удаление более чем 28 аминокислот инактивирует белок 2 1989). Дальнейшие исследования позволяют предсказать, что С-конец и конец А-В петли/начало В-спирали (участок 2 с, остатки G77E95) вовлечены во взаимодействие с IL-6Ral., FEBS Lett. 273:95, 1990; Ltticken, С. et al.,FEBS Lett. 282:265, 1991; Leebeck, F.W.G. et al.,J.Biol. Chem. 267:14832, 1992). Данный результат был подтвержден недавней публикацией модели IL-6 человека (Ehlers, M.,J. Immunol. 153:1744, 1994), где данные два участка располагались вблизи друг друга. К настоящему времени идентифицированы два сайта взаимодействия IL-6 с gp130. 1. Эпитопным картированием белка IL-6 с помощью нейтрализующих MAT предоставлены доказательства, что остатки Q152-Т 162 (начало D-спирали) вовлечены во взаимодействие сPub.Raven Press. 88:33, 1992; Brakenhoff, J.P.J.,J.Biol. Chem. 269:86, 1994). Анализом химерных человеческих/мышиных белков IL-6 показано наличие эпитопа в пределах начала А-B петлиIL-6, вовлеченной в контактирование и активацию gp130 (Ehlers, M.,J. Immunol. 153:1744,1994; Ehlers, M. et al., J.Biol.Chem. 270:8158,1995). Недавно этот результат был подтвержден посредством демонстрации того, что лейцин 57 вовлечен в это взаимодействие (De Hon, F.D. etal., FEBS Lett. 369:187, 1995). Этот район находится в непосредственной близости к началу Dспирали, что позволяет предположить, что эти два участка вместе формируют один общий сайт взаимодействия с одним gp130 (Ehlers, M.,J.Immunol. 153:1744, 1994; Ehlers, M. et al.,J.Biol.Chem. 270:8158, 1995; De Hon, F.D. et al.,J.Exp.Med. 180:2395, 1994). 2. Второй сайт взаимодействия с gp130 был определен по аналогии с комплексом GH(гормоном роста)/GHR2, структура которого была определена с использованием рентгеноструктурного анализа. (De Vos, A.M. et al., Science 255:306, 1992). Было высказано предположение,что части GH, важные для взаимодействия со вторым GHR (рецептором) являются аналогичными таковым IL-6 для взаимодействия с одним из gp130 (Savino, R. et аl., ЕМВО J. 13:281, 1994;Savino, R. et al., EMBO J. 13:5863, 1994). В действительности замена двух аминокислот в Аспирали (Y31D/G35F) и двух аминокислот в Сспирали (S118R/V121D) также приводит к образованию мутантного белка IL-6 с почти нормальным связыванием IL-6R, но не обладающего биологической активностью. Эти четыре аминокислоты вероятно важны для взаимодействия со вторым белком gp130 (Savino, R. et al.,ЕМВО J. 13:5863, 1994; Paonessa, G. et al.,EMBO J.14:1942, 1995). 3. Принимая во внимание обсуждавшееся ранее участие IL-6 в патогенезе некоторых за 3 болеваний, разработка ингибиторов активностиIL-6 является объектом активного изучения. Для достижения этой цели были применимы различные подходы, включая применение антител против IL-6, gp130, или gр 80; применение растворимого gр 130; или мутеинов IL-6 или рецептора IL-6. Заявитель исследовал возможность синтеза новых мутантных IL-6, которые способны действовать как антагонисты рецептора IL-6. С этой целью одним из научных подходов являлся синтез мутантных белков, сохраняющих способность связывания с IL-6R, но утерявших способность взаимодействовать с gp130. Таким образом оптимальной молекулой является такая,которая не проявляет активности IL-6, но имеет более высокое сродство к рецептору IL-6R,чем IL-6, и содержит как можно меньше мутаций по сравнению с IL-6 в целях уменьшения риска антигенности. Подробное описание изобретения Заявителем было обнаружено, что, сочетая точечные мутации в положении 54 с двумя мутациями F170L/S176R, увеличивающими сродство к IL-6R, и двумя мутациямиIL-6Rзависимое взаимодействие с gp130, можно было получить мутантные белки человеческого IL-6,сохраняющие сродство к рецепторам, но не способные активировать gp130. В частности, основным объектом данного изобретения является мутантный IL-6 человека, имеющий аминокислотную последовательность, представленную на фиг. 2 и обозначенную SEQ ID NO:1, так же, как его фрагменты. Полученный белок проявляет себя как эффективный антагонист IL-6 в эксперименте на человеческой IL-6R-зависимой миеломной клеточной линии XG-1 и обладает всеми преимуществами, описанными выше. Другим объектом изобретения является молекула ДНК, включающая последовательность ДНК, кодирующую полипептид SEQ IDNO:1, так же как и ее варианты, имеющие место в результате вырожденности генетического кода, или в результате точечных мутаций, кодирующая полипептид, имеющий одинаковую активность с полипептидом SEQ ID NO:1. Следующим объектом настоящего изобретения является плазмидный вектор, содержащий нуклеотидную последовательность по настоящему изобретению. Следующим аспектом настоящего изобретения является применение данного белка в качестве лекарственного средства. В частности,оно относится к применению заявленного белка в производстве лекарственного средства для лечения заболеваний, при которых IL-6 является звеном патогенеза, таких как, например, плазмоцитома/миелома, остеопороз и неопластические и аутоиммунные заболевания. 4 Лекарственное средство предпочтительно находится в форме фармацевтической композиции, содержащей белок по настоящему изобретению вместе с одним или несколькими фармацевтически приемлемыми носителями и/или наполнителями. Такие фармацевтические композиции являются еще одним аспектом настоящего изобретения. Одним из способов получения заявленного мутантного белка является применение технологии ПЦР и синтетических олигонуклеотидов,содержащих несовпадение по основанию, подлежащих мутированию, в качестве праймеров. Экспрессия любых рекомбинантных белков по изобретению, описанных здесь, может происходить в эукариотических клетках (таких как клетки дрожжей, насекомых или млекопитающих) или в прокариотических клетках при применении соответствующих экспрессирующих векторов. Может быть использован любой из известных в данной области методов. Например, молекула ДНК, кодирующая полипептид по настоящему изобретению вставляется в сконструированные надлежащим образом экспрессирующие векторы в соответствии с методиками, хорошо известными из предшествующего уровня техники (см. Sambrook et al,1989). Двухцепочечная кДНК присоединяется к плазмидным векторам гомополимерным наращиванием или рестрикционной сшивкой, включающей использование синтетических ДНКлинкеров, или в соответствии с методикой лигирования по тупым концам: для лигирования молекул ДНК применяют ДНК-лигазы, а нежелательное объединение избегается обработкой щелочной фосфатазой. Для того чтобы быть способным экспрессировать желаемый белок, экспрессирующий вектор должен включать также особые нуклеотидные последовательности, содержащие транскрипционную и трансляционную регуляторную информацию, связанные с ДНК, кодирующей желаемый белок, таким образом, чтобы обеспечить возможность экспрессии гена и продукции белка. В первую очередь, для того, чтобы ген транскрибировался, ему должен предшествовать промотор, узнаваемый РНК-полимеразой, с которым полимераза связывается и таким образом инициирует процесс транскрипции. Применяется множество таких промоторов, которые работают с различной эффективностью (сильные и слабые промоторы). В случае эукариотических хозяев могут быть применены различные транскрипционные и трансляционные регуляторные последовательности в зависимости от природы хозяина. Они могут быть получены из вирусных источников, таких как аденовирус, вирус папиломы крупного рогатого скота, вакуолизирующий обезьяний вирус или сходные вирусы, где регуляторные сигналы ассоциированы с определенным геном, имеющим высокий уровень экс 5 прессии. Примерами являются ТК-промотор вируса герпеса, ранний промотор SV40, дрожжевой промотор гена gа 14 и т.д. Регуляторные сигналы инициации транскрипции, которые обеспечивают возможность репрессии и активации, могут быть подобраны так, что может быть изменена экспрессия генов. Молекулу ДНК, включающую нуклеотидную последовательность, кодирующую полипептид по изобретению, встраивают в вектор(ы), содержащие оперативно связанные регуляторные сигналы транскрипции и трансляции, способные к интеграции желаемых генных последовательностей в клетки-хозяева. Клетки,которые были стабильно трансформированы введенной ДНК, могут отбираться введением также одного или более маркеров, которые позволяют проводить селекцию клеток-хозяев,содержащих экспрессирующий вектор. Маркер может также сообщать фототрофность ауксотрофному хозяину, толерантность к токсичным агентам, например к антибиотикам или тяжелым металлам, таким как медь, и т.п. Селективный маркерный ген может быть либо напрямую связан с последовательностью ДНК гена, подлежащего экспрессии, или введен в ту же клетку котрансфицированием. Дополнительные элементы могут также быть нужны для оптимального синтеза белков по настоящему изобретению. Факторы, имеющие значение при выборе конкретной плазмиды или вирусного вектора,включают: легкость, с которой реципиентные клетки, которые содержат вектор, могут быть распознаны и отобраны среди тех реципиентных клеток, которые не содержат вектор; количество копий вектора, которое желательно в конкретном хозяине; и желательна ли способность вектора трансформировать клетки-хозяева различных видов. По получении вектор(ы) или последовательность ДНК, содержащие конструкцию(и),пригодные для экспрессии, могут быть введены в подходящую клетку-хозяин различными методами: трансформацией, трансфекцией, конъюгацией, слиянием протопластов, электропорацией, осаждением с помощью фосфата кальция,прямой микроинъекцией и так далее. Клетки-хозяева могут быть как прокариотическими, так и эукариотическими. Предпочтительными являются эукариотические хозяева,например клетки млекопитающих, таких как человек, обезьяна, мышь, клетки яичников китайского хомячка (СНО), поскольку они обеспечивают посттрансляционную модификацию белковых молекул, включая правильное свертывание или гликозилирование в нужных сайтах. Дрожжевые клетки также могут обеспечивать посттрансляционную модификацию пептидов,включая гликозилирование. Существует ряд методик рекомбинантных ДНК с использованием сильных промоторных последовательностей 6 и многокопийных векторов, которые могут быть использованы для получения желаемого белка в дрожжах. Дрожжи узнают лидерные последовательности клонируемых генных продуктов млекопитающих и секретируют пептид вместе с лидерной последовательностью (т.е. препептид). После введения вектора(ов) клетки-хозяева выращивают на селективной среде, на которой отбираются только векторсодержащие клетки. Экспрессия клонируемых генных последовательностей приводит к продукции желаемого белка. Очистка рекомбинантных белков проводится любым из известных для этой цели методов, т.е. в соответствии с любой традиционной методикой, включая экстракцию, осаждение,хроматографию, электрофорез и т.д. Преимущественным методом очистки заявленного белка является аффинная хроматография с использованием иммобилизованных на гелевой матрице колонки моноклональных антител, связывающихся с белком-мишенью. Неочищенные препараты, содержащие рекомбинантный белок пропускают через колонку. Белок задерживается на колонке, специфически связываясь с антителами, в то время как примеси проходят сквозь нее. После отмывки белок элюируют с колонки при контролировании рН или ионной силы. Изобретение далее будет проиллюстрировано нижеследующими примерами, которые никоим образом не предназначены для ограничения объема притязаний. В примерах даны ссылки на описанные ниже фигуры. Краткое описание Фиг. 1 - точечные мутанты белка IL-6 человека. (А) - белок IL-6 человека с четырьмя предсказанными -спиралями показано заштрихованными прямоугольниками. Цифрами показаны первые и последние остатки -спирали. Представлена аминокислотная последовательность участков 2 с и 2 с его подразделением на 21 и 22 для человеческого (наверху) и мышиного (внизу) IL-6. Присутствуют полученные точечные мутации в участке 2. (В) - представлено сравнение "выровненных" участков 2 молекул IL-6. (С) - ленточная модель человеческого IL-6. Изображение F78 (внизу) важно для понимания связывания с рецептором IL-6R, aK54 (наверху) важно для понимания IL-6Rзависимого взаимодействия с gp130. N-конец соответствует остатку 17 человеческого IL-6(Ehlers et al. 1994); фиг. 2 - нуклеотидная последовательность мутантного человеческого IL-6 по настоящему изобретению. Она содержит пять точечных мутаций по сравнению с человеческим IL-6 в положениях 54, 159, 162, 170, 176. Эти положения выделены жирным шрифтом; фиг. 3 - связывание и биологическая активность точечных мутантов K54 человеческогоIL-6. (А) - связывание мутеинов IL-6 (мутантного интерлейкина 6) с растворимым человеческим IL-6R. Представлены средние значения из двух экспериментов. (В) - пролиферация клеток мыши линии В 9 и (С) - человеческих клеток линии XG-1 как реакция на мутанты IL-6. Представлен один из трех экспериментов. (D) - индукция экспрессии гаптоглобина мутантным IL6 в клетках гепатомы человека. Количество требуемого для 50% экспрессии гаптоглобина человеческого IL-6 принято за 100%. Представлены средние значения из двух экспериментов; фиг. 4 - связывание и биологическая активность точечных мутантов K54 в комбинации с EP-LR. (А) - связывание мутантных IL-6 с растворимым человеческим IL-6R. Представлены средние значения из двух экспериментов. (В) пролиферация клеток мыши линии В 9 и (С) человеческой линии XG-1 как реакция на мутанты IL-6. Представлен один из трех экспериментов. (D) - индукция экспрессии гаптоглобина мутантными lL-6 в клетках гепатомы человека. Показан уровень экспрессии гаптоглобина в присутствии 1 мкг/мл мутантного белка. Представлены средние значения из двух экспериментов; фиг. 5 - эффект антагонизма точечной мутации К 54 в комбинации с EP-LR на индуцированную IL-6 человека пролиферацию клеток линии XG-1. Указанные концентрации мутантовIL-6 добавляли к клеткам XG-1 в присутствии 100 пг/мл человеческого IL-6 и оценивали клеточную пролиферацию. Представлены средние значения из двух экспериментов. Примеры Материалы и методы Реактивы Рестриктазы AccI, EcoNI, HindIII, NcoI,NheI и XbaI были получены от компании AGS(Heidelberg, Germany), полинуклеотидкиназа,щелочная фосфатаза кишечника теленка и Т 4 ДНК-лигаза получены от компании BoehringerBspEI и Vent ДНК-полимераза поставлены компанией NEN Biolabs (Schwalbach, Germany) и среды для культур клеток получены от Gibco(74 ТБк/ммоль) и метка tran[S35] получены от фирмы Amersham International (Amersham,United Kingdom). Олигонуклеотиды были получены от фирмы Pharmacia (Freiburg, Germany). Козьи и кроличьи поликлональные антитела против человеческого гаптоглобина были предоставлены компанией Sigma (Deisenhofen,Germany), а конъюгированные с щелочной фосфатазой ослиные поликлональные антитела против кроличьего IgG - компанией Pierce 8 кДНК человеческого IL-6 была любезно предоставлена докторамиpRSET 5d и бактерия хозяин BL21 (DЕ 3) были описаны Shpfer et al. (Schoepfer, R. et al., Neuron 5:393, 1990). После замены сигнальных последовательностей на кодон начала трансляции кДНК, кодирующую IL-6 человека, клонировали в вектор pRSET 5d по сайтам рестрикцииNcoI и HindIII (Van Dam, M. et al., J. Biol. Chem. 268:15285, 1992). Человеческая миеломная клеточная линияXG-1 была предоставлена доктором Б.Клейном(Nantes, France). Растворимый белок IL-6R был экспрессирован в E.coli, ренатурирован и очищен (Stoyan, Т., Eur. J. Biochem. 216:239, 1993). Поликлональные моноспецифические антитела против IL-6R были получены введением части внеклеточного домена растворимого белка IL-6R кроликам (Stoyan, Т., Eur. J. Biochem. 216:239, 1993). Конструкция экспрессирующих векторов Для введения точечных мутаций по аминокислоте 54 в IL-6 человека (pRSET 5d-huIL-6K54X), четыре олигонуклеотида были сшиты и лигированы в EcoNI-NheI-рестрикт pRSET5dмутанта 2 (Ehlers, M.,J. Immunol. 153:1744,1994). Олигонуклеотиды представляли собой: Чтобы объединить точечные мутации по аминокислоте 54 с двумя точечными мутациямиF170L/S176R (кратко обозначаемыми LR) и двумя точечными мутациями Q159E/T162P(кратко обозначаемыми ЕР), были сконструированы векторы pRSET 6d-huIL-6-EP-K54X-LR лигированием фрагментов NcoI-XbaI кДНК изNcoI-XbaIрасщепленный вектор pRSET 6d-huIL-6Q159E/T162P-22-F170L/S176R (кратко обозначаемый pRSET 6d-huIL-6-EP-22-LR) ( Ehlers,M. et al., J.Biol.Chem. 270:8158, 1995). Целостность всех конструкций была подтверждена анализом фрагментов рестрикции и секвенированием ДНК (Sanger, F. et al., Proc. Natl. Acad.Sci. U.S.A. 74:5463, 1977). Получение белков Бактерии BL21 (DE3) были трансформированы вектором экспрессии pRSET. Генная экспрессия и ренатурация белков, переведенных в 9 растворенное состояние из телец включения,были произведены, как описано (Van Dam, M. etal., Eur.J.Biochem. 198:541, 1991). Ренатурированные белки были очищены до 90% гомогенности. Чистота рекомбинантных белков была проверена 12,5% SDS-PAGE и окрашиванием серебром. Связывание IL-6 с растворимым IL-6R человека Очищенные мутантные белки IL-6 были последовательно разведены в PBS, содержащим 0,02% TWEEN 20/0,2% BSA и добавлены к 1 нг 125 человеческого(60.000-90.000 имп/миннг) и 1,7 нг растворимого человеческого IL-6R, экспрессированного в E.coli (Stoyan,Т., Eur. J. Biochem. 216:239, 1993), до конечного объема 500 мкл. После инкубации в течение ночи при 4 С IL-6/sIL-6R комплексы были иммунопреципитированны с использованиемIL-6R (рецептор-6R) антисыворотки и протеин А-Сефарозы, радиоактивность была подсчитана счетчиком Гейгера. Биологические анализы Для анализа пролиферации мышиных клеток В 9 и человеческих клеток XG-1, мутантные белки IL-6 последовательно разводили до концентраций, указанных на фигурах. Анализы выполнялись, как описано (Aarden, L.A et al., Eur.J. Immunol. 17:1411, 1987; Zhang, X.-G. et al.,Blood. 76:2599, 1990). Одна единица В 9, соответствующая приблизительно 1 пг человеческого IL-6 на мл, приводила к половине от максимальной пролиферации клеток В 9. С человеческими клетками XG-1 половина максимальной пролиферации была получена после стимуляции с 50 пг/мл человеческого IL-6. Для анализа секреции белка острой фазы, клетки гепатомы человека (Нер 3 В) культивировали на модифицированной Дульбекко среде Игла (DMEM) с 10% околоплодной сыворотки теленка, распределяли в 96-луночные культуральные планшеты и оставляли до образования монослоя. Клетки отмывали PBS, выдерживали в течение 1 ч вDMEM без околоплодной сыворотки теленка и потом обрабатывали в течение 20 ч в 100 мл несодержащей сыворотки DMEM с возрастающими количествами мутантных белков IL-6. Количество гаптоглобина, секретированного в культуральную среду, определяли ферментсвязывающим иммуносорбентным анализом (Salvati, A.L. et al., J. Biol. Chem. 270:12242, 1995). Результаты Аминокислота К 54 IL-6 вовлечена в IL-6R зависимое взаимодействие с gp130 Исследования с человеческими/мышиными химерными белками IL-6 показали, что область 22 (остатки 50-55) белка IL-6 необходима для IL-6R-зависимого взаимодействия с 10 1995) (фиг. 1 А). Замена этих остатков по соответствующим аминокислотам в мышином белке приводила к уменьшению связывания с gp130 и 30-кратному снижению биоактивности человеческих XG-1 клеток. Сравнение с десятью молекулами IL-6 показало, что внутри области 2 а 2 положительно заряженная К 54 сохраняется в 8 молекулах, но меняется на отрицательно заряженную аспарагиновую кислоту в мышиной и крысиной аминокислотной последовательностиNorthemann, W. et al., J. Biol. Chem. 264:16072,1989) (фиг. 1 В). Поэтому произведена замена К 54 (фиг. 1 С) на аминокислоты, показанные на фиг. 1 А. Процедура клонирования привела также к трем двухточечным мутациям IL-6:C44F/K54E, C50F/K54N и S52R/K54N, которые были также проанализированы (фиг. 1 А). Для исследования влияния точечных мутаций К 54 на IL-6R-зависимое взаимодействие сgp130 проводили в первую очередь измерение связывания IL-6R путем замещения связывания человеческого 125I-IL-6 с растворимой формой белка IL-6R путем использования точечных мутантов. Как показано на фиг. 3 А, немеченный человеческий вариант IL-6 дикого типа замещает связывание человеческого 125I-IL-6 на 50% при использовании в 10-20-кратном молярном избытке. Точечный мутант К 54 Р и двойной мутант S52R/K54N проявлял в 10 раз большее сродство, чем человеческий IL-6, тогда как мутант К 54 Е имел в три раза меньшее сродство, чем huIL-6, к IL-6R. Другие исследованные мутанты показали сходное сродство с человеческим IL-6. Кроме того, мутанты стимулировали пролиферацию IL-6-зависимых В 9 клеток в той же мере, что и человеческий IL-6, что демонстрирует интактность их структуры (фиг. 3 В). В клетках миеломы XG-1 и клетках человеческой гепатомы характер биологической активности IL-6 мутеина был следующим: К 54 РS52R/K54N, имевшие наивысшее сродство к IL6Ra, также проявляли наивысшую биологическую активность на человеческих клетках. Замена положительно заряженного лизина 54 на отрицательно заряженную аспарагиновую кислоту имела результатом только слегка ослабленную биологическую активность в человеческих клетках, тогда как замена на Glu имела результатом существенное снижение (10 кратное) биологической активности. Разработка новых антагонистов рецепторов человеческого IL-6 Недавно было показано на мышах, что введение остатков 50-55 (область 22) и двух точечных мутаций F170L/S176R (обозначениеLR), которые повышают сродство к IL-6R, в двойной мутант Q159E/T162P (обозначение IL 11 6-EP), который обнаруживает пониженное взаимодействие с gp130, приводит в результате к получению мутантного IL-6 с отсутствием биологической активности в человеческих клетках (Ehlers, M. et al., J.Biol.Chem. 270:8158,1995). Сродство этого IL-6 мутанта (IL-6-EP22-LR) к человеческому IL-6R было схожим с таковым к человеческому IL-6. Этот IL-6 мутант был эффективным антагонистом рецептораIL-6 в высоко чувствительных человеческих IL6-зависимых клетках линии миеломы человекаXG-1. Мутации К 54 были введены в мутантные белки IL-6-EP-LR. Полученные в результате мутантные белки IL-6 были названы IL-6-EPK54X-LR, где Х обозначает все мутации, введенные в позицию 54 (фиг. 1 А). Мутант IL-6EP-C44F/K54E-LR и мутант IL-6-EP-K54E-LR обнаруживали пониженное сродство к человеческому IL-6R, тогда как все другие мутанты вели себя как человеческий IL-6 (фиг. 4 А). Пролиферация мышиных клеток В 9 была сильно снижена для мутантов IL-6-EP-22-LR и IL-6EP-S52R/K54N-LR. Все другие мутанты были приблизительно в 5-10 раз менее активны, чем человеческий IL-6 (фиг. 4 В). В противоположность этому, величина пролиферации клеток человеческой миеломы XG-1 снижается на три порядка в случае мутантов IL-6-EP-LR, IL-6-EPK54F-LR и IL-6-EP-S52R/K54N-LR (фиг. 4 С). Все другие мутанты не обнаруживали регистрируемой биологической активности. В человеческих Нер 3 В клетках только мутанты IL-6-EP-LR и IL-6-EP-K54F-LR обнаруживали остаточную активность (фиг. 4D). Когда мутанты без биологической активности были добавлены в возрастающих количествах к человеческим клеткам миеломы (XG-1),стимулированным 100 пг/мл человеческого IL-6,было обнаружено ингибирование пролиферации. Фиг. 5 показывает, что прибавление мутантов IL-6-EP-22-LR и IL-6-EP-K54P-LR приводит к 50% ингибированию пролиферации при приблизительно 100 нг/мл, тогда как все другие мутанты были приблизительно в 5-10 раз менее эффективны. Обсуждение Аминокислота К 54 является частью gp130 связывающего эпитопа Все мутантные IL-6 с К 54, замененной различными аминокислотными остатками, эффективно связывались с человеческим IL-6Ra. Интересно, что введение Р 54 и двойной мутацииS52R/R54N приводило к образованию IL-6 с более высоким сродством к человеческому IL6R. Поскольку область 22, которая включает остаток 54, была идентифицирована как участвующая во взаимодействии с gp130 (Ehlers, M.et al., J.Biol.Chem. 270:8158, 1995), это указывает скорее всего на непрямой эффект. Сделано предположение, что присутствие Р 54 или заря 000852 12 женной аминокислоты аргинина в положении 52 приводит к перемещению петли между спиралью А и спиралью В, посредством изменения местоположения области 2 С, которая напрямую вовлечена во взаимодействие IL-6R. Замена консервативного для восьми видов лизина 54 на аспарагиновую кислоту, являющуюся консервативной для мыши и крысы, ведет к слабому снижению активности, тогда как замена на глутаминовую кислоту приводит к существенному снижению (в 10 раз) биологической активности. Хотя глутаминовая кислота несет боковую цепь на одну метильную группу длиннее, чем аспарагиновая кислота, похоже, что расстояние между заряженной группой и человеческим IL6R существенно. Исходя из этих данных, возможно предсказать, что мутация по положению К 54 взаимодействует с отрицательно заряженными остатками в положении 54 человеческогоIL-6, приводя к восстановлению узнавания между gp130 и IL-6/IL-6R комплексом. Мутация в цистеиновых остатках положения 44 или 50 в мутантном IL-6 приводит к слабой потере биологической активности, что подтверждается недавними результатами Rock с соавторами(Salvati, A.L. et al., J.Biol.Chem. 270:12242,1995), сумевшим продемонстрировать, что замена цистеиновых (остатков) в положениях 44 и 50 не приводит к инактивации мутантного IL-6. Взаимодействие лиганда с рецептором Структура комплекса гормона роста человека с его рецептором (GH/GHR2) была показана в работе (De Vos, A.M. et al., Science 255:306,1992). Сайт взаимодействия гормона роста с его рецептором многократно подвергался мутагенезу (Cunningham, В. С. et al., Science 244:1081,1989; Cunningham, B.C. et al., J. Mol. Biol. 234:554, 1993; Bass, S. H. et al., Proc. Natl. Acad.Sci. U.S.A. 88:4498, 1991) и оценен вклад каждого аминокислотного остатка в энергию связывания (Clackson Т., et al., Science 267:383, 1995). Поскольку комплекс гормон роста/его рецептор являются единственной парой из семейства гемопоэтических цитокинов, чья структура известна на атомном уровне, она является парадигмой для других членов семейства. Для комплекса гормон роста/рецептор известно, что эпитоп взаимодействия для обоих состоит примерно из 30 аминокислотных остатков (Clackson Т., et al., Science 267:383, 1995). Однако вклад этих аминокислотных остатков не одинаков. Основной вклад в энергию связывания производят два гидрофобных взаимодействия. Это ядро связывания окружено менее важными для контакта остатками, которые в основном гидрофильны и частично гидратированы, они дают примерно треть вклада в энергию связывания. Существует теория, что такое определение сайтов связывания применимо и к другим взаимодействиям типа лиганд/рецептор (Clackson Т., et 13 Однако, как считается, К 54 является одним из остатков окружения центрального района взаимодействия IL-6/gp130, имеющего слабый вклад в энергию взаимодействия. Относительно сильный эффект замены К 54 Р в мутантном антагонисте IL-6 является следствием структурных изменений в петле АВ. Антагонисты рецептора IL-6 Как известно, были идентифицированы два района, вероятно контактирующие с gp130, 1) участок 22 (остатки 50-55) и лейцин 57, комплементарные вершине спирали D IL-6 и 2) эпитоп, сформированный частями спиралей А и Сal., J. Exp. Med 180:2395, 1994; Savino, R. et al.,EMBO J. 13:281, 1994; Savino, R. et al., EMBO J. 13:5863, 1994). Для связывания IL-6 с IL-6R необходим конец А-В петли (остаток 78), так же как и С-конец белка (Ehlers, M.,J. Immunol. 153:1744, 1994; Krttgen, A. et al., FEBS Lett. 262:323, 1990; Krttgen, A. et al., FEBS Lett. 273:95, 1990; Ltticken, C. et al., FEBS Lett. 282:265, 1991; Leebeck, F.W.G. et al., J. Biol.gp130 необходимы для инициации сигнала и весьма вероятно, что роль двух сайтов взаимодействия с gp130 на IL-6 заключается во взаимодействии с двумя белками gp130. Перестройки вблизи обоих сайтов взаимодействия с gp130 приводили к образованию молекул, способных связываться с рецептором, но не способных инициировать сигнал. Было показано, что такие молекулы могут быть использованы в качестве антагонистов рецептора для IL-6 (Ehlers, M. etal., J.Exp. Med. 180:2395, 1994; Savino, R. et al.,EMBO J. 13:281, 1994; Savino, R. et al., EMBO J. 13:5863, 1994). Факт одновременного увеличения связывающей активности мутантного IL-6 по отношению к IL-6R привел к так называемым суперантагонистам (Ehlers, M. et al.,J.Biol.Chem. 270:8158, 1995; De Hon, F.D. et al.,J.Exp. Med. 180:2395, 1994; Savino, R. et al.,EMBO J. 13:5863, 1994), что предполагает возможность изменения связывающих свойств различных субъединиц рецептора по какому-либо независимому варианту. Новый антагонист рецептора IL-6, представленный в данной заявке на патент, содержит единственную замену К 54 Р в участке 22 и, тем не менее, является столь же эффективным, как и недавно сконструированный мутантный IL-6 с пятью аминокислотными заменами в участке 22 (Ehlers, M. et al., J.Biol.Chem. 270:8158,1995). Интересно, что мутантный К 54 Р белок показал большее связывание с IL-6R, чем IL-6, в 14 то время как комбинация мутантов ЕР и LR показала нормальное связывание. Говоря о терапевтическом потенциале антагонистов цитокиновых рецепторов, понятно,что чем меньше аминокислот изменяется, тем меньше шанс, что антагонист будет антигеном. Исходя из этой точки зрения, мутантный IL-6 иIL-6-EP-K54P-LR являются улучшенными вариантами антагонистов рецептора IL-6, доступных ранее. Перечень последовательностей(2) Информация для идентификации последовательности SEQ ID NO: 2:(2) Информация для идентификации последовательности SEQ ID NO: 7:(2) Информация для идентификации последовательности SEQ ID NO: 3:(2) Информация для идентификации последовательности SEQ ID NO: 8:(2) Информация для идентификации последовательности SEQ ID NO: 4:(2) Информация для идентификации последовательности SEQ ID NO: 9:(2) Информация для идентификации последовательности SEQ ID NO: 5:(2) Информация для идентификации последовательности SEQ ID NO: 10:(2) Информация для идентификации последовательности SEQ ID NO: 6:(2) Информация для идентификации последовательности SEQ ID NO: 11:(2) Информация для идентификации последовательности SEQ ID NO: 12:(2) Информация для идентификации последовательности SEQ ID NO: 13:(ii) Тип молекула геномная ДНК 18 содержащую следующие точечные мутации по сравнению с природным IL-6 человека: Pro 54,Glu 159, Pro 162, Leu 170 и Аrg 176. 2. Внутренний фрагмент мутантного IL-6 человека по п.1 формулы, обладающий аналогичной биологической активностью. 3. Последовательность ДНК, кодирующая мутантный IL-6 человека по п.1 формулы. 4. Последовательность ДНК, кодирующая внутренний фрагмент мутантного IL-6 человека по п.2 формулы. 5. Вектор, используемый для экспрессии мутантного IL-6 по п.1 формулы или его внутреннего фрагмента по п.2 формулы, содержащий последовательность ДНК по любому из пп.3-4 формулы. 6. Линия клеток-хозяев, трансформированная вектором экспрессии по п.5 формулы или последовательностью ДНК по любому из пп.3-4 формулы. 7. Способ получения мутантного IL-6 по п.1 формулы, заключающийся в том, что культивируют линию клеток-хозяев по п.6 формулы в условиях, обеспечивающих экспрессию IL-6, и выделяют целевой продукт из культуральной среды. 8. Способ получения внутреннего фрагмента мутантного IL-6 по п.2 формулы, заключающийся в том, что культивируют линию клеток-хозяев по п.6 формулы в условиях, обеспечивающих экспрессию фрагмента, и выделяют целевой продукт из культуральной среды. 9. Фармацевтическая композиция, содержащая в качестве активного ингредиента мутантный IL-6 по п.1 формулы или его внутренний фрагмент по п.2 формулы и один или более фармацевтически приемлемый носитель и/или наполнитель. 10. Применение мутантного IL-6 по п.1 формулы в качестве активного ингредиента фармацевтической композиции по п.9 формулы. 11. Применение внутреннего фрагмента мутантного IL-6 по п.1 формулы в качестве активного ингредиента фармацевтической композиции по п.9 формулы. 12. Способ лечения заболеваний, опосредованных патогенным действием IL-6, включающий введение пациенту эффективного количества фармацевтической композиции по п.9 формулы. Фиг. 3 В Фиг. 1 С Аминокислотная последовательность мутантного IL-6
МПК / Метки
МПК: A61P 19/10, C07K 14/54, C12N 1/21, A61K 38/20, A61P 35/00, C12N 15/24, A61P 37/00
Метки: лечения, получения, линии, способы, композиции, опосредованных, кодирующие, заболеваний, векторы, хозяев, днк, испособ, фармацевтические, последовательности, человека, фрагмент, клеток, содержащие, внутренний, мутантный
Код ссылки
<a href="https://eas.patents.su/12-852-mutantnyjj-il-6-cheloveka-i-ego-vnutrennijj-fragment-kodiruyushhie-ih-posledovatelnosti-dnk-sposoby-ih-polucheniya-soderzhashhie-ih-farmacevticheskie-kompozicii-soderzhashhie-ih-ve.html" rel="bookmark" title="База патентов Евразийского Союза">Мутантный il-6 человека и его внутренний фрагмент, кодирующие их последовательности днк, способы их получения, содержащие их фармацевтические композиции, содержащие их векторы, линии клеток- хозяев испособ лечения il-6 опосредованных заболеваний</a>
Следующий патент: Грануляты гидролизованной целлюлозы для фармацевтических препаратов.
Случайный патент: Пневматическая шина, содержащая опору для электронного устройства