Противоопухолевый, противовирусный, антибактериальный, противопаразитарный, противовоспалительный, иммуномодулирующий и противогрибковый лекарственный препарат, способ его изготовления и лекарственныеформы
Номер патента: 5929
Опубликовано: 25.08.2005
Авторы: Яковлева Елена Владимировна, Травкин Олег Викторович
Формула / Реферат
1. Противоопухолевый, противовирусный, антибактериальный, противопаразитарный, противовоспалительный, иммуномодулирующий и противогрибковый лекарственный препарат, включающий биологически активную часть и фармацевтически приемлемый носитель, отличающийся тем, что биологически активная часть содержит смесь акридонуксусной кислоты или ее производных общей формулы (1)
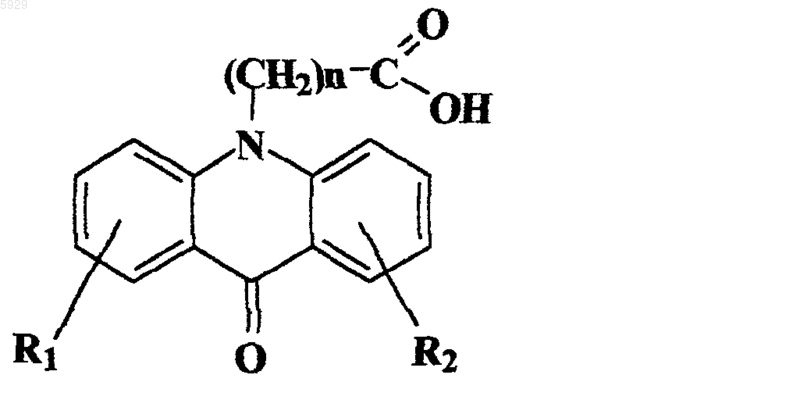
где R1, R2 выбраны из группы H, OH, галоген, алкил, оксиалкил, арил, оксиарил, карбоксигруппа, n=1-4,
с монозамещенными эфирами моносахаридов общей формулы (2)
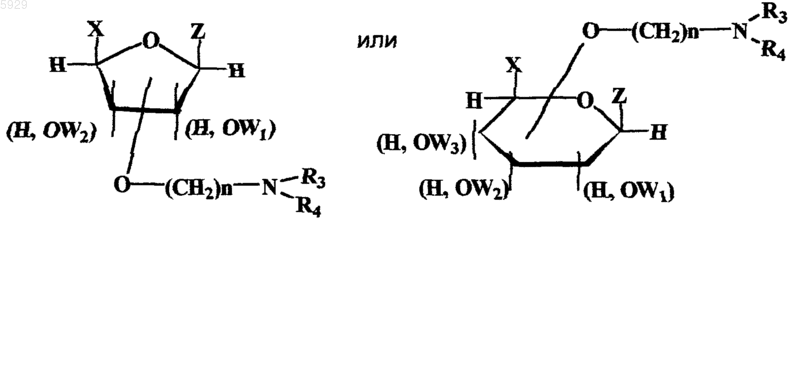
где группа  может быть в форме гемиацеталя или гемикеталя, в a или b конфигурациях,
может быть в форме гемиацеталя или гемикеталя, в a или b конфигурациях,
(H, OW1), (H, OW2), (H, OW3) обозначают различные изомеры, отличающиеся положением групп H и OW относительно плоскости кольца моносахарида,
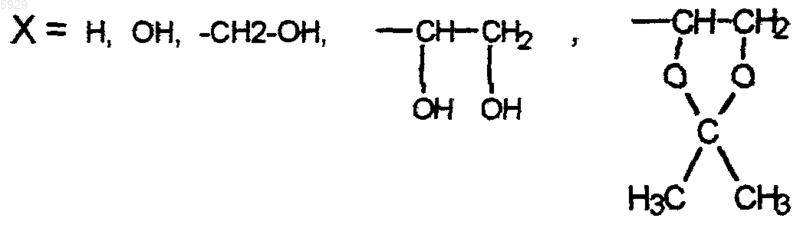
X, Z выбраны из группы: H, OH, алкил, гидроксиалкил, алкоксил, алкоксиалкил,
W1, W2, W3 выбраны из группы H, алкил, арил, алкенил,
OW1 и Z, OW2 и Z, OW3 и Z, OW1 и X, OW2 и X, OW3 и X, OW1 и OW2, OW1 и OW3, OW2 и OW3 попарно выбраны из группы: алкил, арил, бензил, алкенил,
R3, R4 выбраны из группы H, алкил, арил, или R3 и R4 вместе с атомом азота образуют морфолиновый, пиперидиновый или пиридиновый гетероцикл, n = 1-6,
термически обработанные совместно с носителем при температурах 80-120шC, причем весовые соотношения ингредиентов биологически активной части препарата выбраны в пределах от 1:10 до 10:1, а весовые соотношения активной части и носителя выбраны в пределах, мас.%: биологически активная часть 0,05-80, носитель 20-99,95.
2. Способ изготовления лекарственного препарата по п.1, отличающийся тем, что, смесь ингредиентов биологически активной части (акридонуксусной кислоты или ее производных и монозамещенных эфиров моносахаридов) смешивают с фармацевтически приемлемым носителем с одновременным или последующим нагреванием или смешиванием при нагревании или смешиванием с нагретым носителем непосредственно перед или во время их смешивания.
3. Лекарственный препарат по п.1, отличающийся тем, что в качестве биологически активной части препарат содержит анандин, представляющий собой смесь N-акридонуксусной кислоты (глюкоаминопропилкарбакридона) и 3-O(N,N-диметиламино-н-пропил)-1,2:5,6-ди-O-изопропилиден-a,D-глюкофура-нозы (диметиламинопропилглюкофуранозы).
4. Лекарственный препарат в лекарственной форме мази, или крема, или пасты, или геля, или линимента по п.1 или 3, отличающийся тем, что, в качестве фармацевтически приемлемого носителя препарат содержит липофильную, или жировую, или гидрофильную основу при соотношении, мас.%: биологически активная часть 0,1-50, носитель 50-99,9.
5. Лекарственный препарат в лекарственной форме глазных капель, или интраназальных капель, или ушных капель по п.1 или 3, отличающийся тем, что в качестве фармацевтически приемлемого носителя содержит стерильный водный, или спиртовой, или масляный, или гидрофобный растворитель, стабилизатор и/или консервант при соотношении, мас.%: биологически активная часть 0,1-50, носитель 50-99,9.
6. Лекарственный препарат в лекарственной форме раствора для парентерального или перорального использования по п.1 или 3, отличающийся тем, что в качестве фармацевтически приемлемого носителя препарат содержит растворитель, консервант, и/или антиоксидант, и/или стабилизатор при соотношении, мас.%: биологически активная часть 0,05-60, носитель 40-99,95.
7. Лекарственный препарат в лекарственной форме спрея по п.1 или 3, отличающийся тем, что в качестве фармацевтически приемлемого носителя содержит растворитель, консервант и/или корригент при соотношении, мас.%: биологически активная часть 0,1-50, носитель 50-99,9.
8. Лекарственный препарат в лекарственной форме аэрозоля по п.1 или 3, отличающийся тем, что в качестве фармацевтически приемлемого носителя содержит газ-вытеснитель, растворитель и корригент при соотношении, мас.%: биологически активная часть 0,1-50, носитель 50-99,9.
9. Лекарственный препарат в лекарственной форме таблеток, или таблеток с кишечнорастворимым покрытием, или порошка в капсулах по п.1 или 3, отличающийся тем, что в качестве фармацевтически приемлемого носителя содержит связующее вещество и кишечнорастворимую оболочку или капсулупри соотношении, мас.%: биологически активная часть 1,0-80, носитель 20-99,0.
10. Лекарственный препарат в лекарственной форме суппозиториев по любому из пп.1 или 3, отличающийся тем, что в качестве фармацевтически приемлемого носителя препарат содержит плавящуюся при 36,5-37шC основу суппозиториев и консервант при соотношении, мас.%: биологически активная часть 0,5-40, носитель 60-99,5.
Текст
005929 Область техники Изобретение относится к медицине, ветеринарии, фармакологии и химико-фармацевтической промышленности, более конкретно к иммуномодулирующим, противопаразитарным, противосклеротическим, противовирусным, противобактериальным, противогрибковым, противовоспалительным и противоопухолевым препаратам, промышленному способу их изготовления и лекарственным формам препарата. Уровень техники Известны лекарственные препараты противоинфекционного (противомикробного, противогрибкового и противовирусного), антипаразитарного, иммуномодулирующего, противовоспалительного и противоопухолевого действия [1-3]. Современными высокоэффективными противомикробными препаратами являются средства, включающие в свой состав: антибиотики, сульфаниламиды, производные нитрофурана или 8-оксихинолина.[4, 5] К противогрибковым лекарственным препаратам относят антибиотики (физеофульвин, микосептин,нистатин и др.) и препараты на основе имидазола (клотримазол, миконазол и др.) [3, 4, 6]. В настоящее время широко используются противовирусные лекарственные препараты двух основных групп: препараты на основе аномальных нуклеозодов (например, ацикловир, виразол), а также интерфероны или их индукторы [5-9]. Группа противовоспалительных фармакологических средств представлена препаратами салициловой (аспирин), фенилпропионовой (ибупрофен) кислот, глюкокортикостероидами (кортизон) [4, 8-10]. Противоопухолевые медицинские препараты это, в первую очередь, химио-терапевтические средства (циклофосфан, фотрин, цитозар и др.) и противоопухолевые антибиотики (брунеомицин, адриомицин) [3-5, 8]. К антипаразитарным препаратам относят эффективные в отношении простейших и гельминтов лекарственные средства, такие как хинин, акрихин, перметрины, азинокс и др. (1-5). Отдельную, все более важную и наиболее значимую в настоящее время для практической медицины и ветеринарии, группу лекарственных препаратов составляют препараты широкого спектра действия- иммуномодуляторы, изменяющие иммунный ответ организма человека или животного [3; 6; 9]. Особое значение для практической медицины имеют препараты-иммуностимуляторы, например,левамизол, тималин, амиксин, а также терафектин (амиприлоз), созданный на основе монозамещенного эфира моносахарида - иммуномодулятор, обладающий выраженным противовоспалительным действием[11-13]. Эти препараты увеличивают сопротивляемость пациентов различным инфекциям за счет усиления гуморального или клеточного иммунитета [1-5; 9]. Такие препараты, как правило, обладают относительно широким спектром фармакологического действия, но недостаточно эффективны при лечении комплексных заболеваний и поэтому они чаще всего используются в качестве вспомогательных лекарственных средств при лечении отдельных заболеваний различной этиологии. Известны такие индукторы эндогенного интерферона, как неовир и циклоферон [14-17]. Эти препараты применяются в медицине в качестве эффективных противовирусных средств. Известен иммуномодулирующий лекарственный препарат в виде гидрофобных производных Nакридонуксусной кислоты [19], однако он имеет ограниченное лечебное действие и не эффективен при лечении комплексных заболеваний. Известна ранее полученная авторами-заявителями группа химических соединений и способ их получения - соли акридонуксусных кислот и монозамещенных эфиров моносахаридов и их противоинфекционное, противовоспалительное и противоопухлевое действие [20]. По данному способу эти соли перед их применением предварительно синтезируют в твердом виде путем смешивания эквимолекулярных количеств акридонуксусной кислоты или ее производных и монозамещенных эфиров моносахаридов в безводном ацетоне, кипячения с обратным холодильником в течение 20-40 мин с предохранением от попадания влаги, упаривания полученного раствора в вакууме до объема, необходимого для выпадения осадка соли, отделения выпавшего осадка фильтрацией, высушивания и перекристаллизовывания из безводного метанола, высушивания перекристаллизованного осадка в вакууме с получением кристаллической соли акридонуксусных кислот и монозамещенных эфиров моносахаридов и использования этой соли в качестве лекарственного средства противоинфекционного, противовоспалительного и противоопухлевого действия. Получаемые таким образом соли очень гигроскопичны, интенсивно впитывают влагу из воздуха и не пригодны для длительного хранения в обычных для медицинских и ветеринарных препаратов условиях. Наиболее близким по технической сущности и достигаемому при использованию результату (прототипом), является разработанный ранее при участии авторов-заявителей иммуномодулирующий лекарственный препарат, содержащий в качестве лекарственного вещества производное акридона и моносахариды различного строения, включенные в фармацевтически приемлемую основу [18]. Основным действующим началом этих препаратов являются водорастворимые соли N-акридонуксусной кислоты. При-1 005929 значительной, по сравнению с другими известными препаратами, эффективности противовирусного действия данные лекарственные препараты гидрофильны, что затрудняет проникновение их через липидный слой клеточных мембран. Это, в свою очередь, существенно ослабляет действие данного лекарственного вещества на внутриклеточных паразитов. Кроме этого данные препараты обладают ограниченной сферой лечебного действия. Вышеприведенные аналоги и прототип лекарственного препарата и способы их получения имеют ряд общих существенных недостатков:- недостаточно широкий спектр фармакологической активности (специфическое противовирусное или противоопухолевое действие);- принципиальная невозможность получения ряда лекарственных форм на основе данных лекарственны веществ;- нестабильность при длительном хранении (разрушение липосом или выпадение осадков из растворов).- высокая стоимость, трудоемкость и технологическая сложность изготовления лекарственного вещества. Задачи изобретения Задачами изобретений являются разработка нового лекарственного препарата, обладающего высокой активностью и широким спектром неспецифического фармакологического действия - иммуномодулирующего, противопаразитарного, противовирусного, противобактериального, противогрибкового,противовоспалительного и противоопухолевого, а также технологически простого способа промышленного изготовления пригодных к использованию всех известных в настоящее время лекарственных форм,причем лекарственные формы должны иметь длительные сроки хранения. Сущность изобретения Поставленные задачи решаются тем, что в известный лекарственный препарат, включающий биологически активную часть, содержащую акридонуксусную кислоту или ее производные и фармацевтически приемлемый носитель, согласно изобретению внесены существенные изменения и дополнения, а именно: А) биологически активная часть препарата содержит смесь акридонуксусной кислоты или ее производных общей формулы (1) где R1, R2 выбраны из группы: Н, ОН, галоген, алкил, оксиалкил, арил, оксиарил, карбоксигруппа, n=1-4 с монозамещенными эфирами моносахаридов общей формулы (2) Группа может быть в форме гемиацеталя или гемикеталя, виликонфигурациях.(Н, OW1), (H, OW2), (Н, OW3) обозначают различные изомеры, отличающиеся положением групп Н и OW относительно плоскости кольца моносахарида.OW1 и Z, OW2 и Z, OW3 и Z, OW1 и X, OW2 и X, OW3 и X, OW1 и OW2, OW1 и OW3, OW2 и OW3 попарно выбраны из группы: H, алкил, арил, бензил, алкенил.R3, R4 - выбраны из группы: Н, алкил, арил, или R3 и R4 вместе с атомом азота образуют морфолиновый, пиперидиновый или пиридиновый гетероцикл, n=1-6. Б) весовые соотношения составляющих указанной смеси (ингредиентов биологически активной части) выбраны в пределах от 1:10 до 10:1; В) биологически активная часть термически обработана совместно с фармацевтически приемлемым носителем при температурах 80-120C; Г) Соотношение масс препарата выбрано в пределах, %,биологически активная часть 0,05 - 80 фармацевтически приемлемый носитель 20 - 99,95. При этом лекарственный препарат изготовляют путем смешивания и нагревания акридонуксусной кислоты или ее производных с монозамещенными эфирами моносахаридов или смешивания и последующего нагревания или смешивания при нагревании или смешивания с нагретым носителем непосредственно перед или во время их смешивания с носителем. При этом лекарственный препарат изготовляют в лекарственной форме мази или крема, или пасты,или геля, или линимента, или глазных капель, или интраназальных капель, или капель для ушей, или спрея или аэрозоля, или раствора для парентерального или перорального введения, или таблеток, или таблеток с кишечно-растворимым покрытием или порошка в капсулах или суппозиториев. Одним из наиболее эффективных является лекарственный препарат, содержащий анандин, представляющий собой смесь N-акридонуксусной кислоты (глюкоаминопропилкарбакридона) и 3-0(N,Nдиметиламино-н-пропил)-1,2:5,6-ди-O-изопропилиден-,D-глюкофуранозы (диметиламинопропилглюкофуранозы). Лекарственный препарат в лекарственной форме мази или крема или пасты или геля или линимента в качестве фармацевтически приемлемого носителя содержит липофильную или жировую или гидрофильную основу мази, при соотношении, мас.%: Биологически активная часть 0,1-50 Основа мази 50-99,9 Лекарственный препарат в лекарственной форме глазных капель или интраназальных капель или капель для ушей в качестве фармацевтически приемлемого носителя содержит стерильный водный или спиртовый, или масляный, или гидрофобный растворитель, стабилизатор и/или консервант, при соотношении, мас. %: Биологически активная часть 0,1-50 Растворитель, стабилизатор и/или консервант 50-99,9 Лекарственный препарат в лекарственной форме раствора для парентерального или перорального введения в качестве фармацевтически приемлемого носителя содержит растворитель, консервант и/или антиоксидант и/или стабилизатор, при соотношении, мас.%: Биологически активная часть 0,05-60 Растворитель, консервант и/или антиоксидант и/или стабилизатор 40-99,95 Лекарственный препарат в лекарственной форме спрея в качестве фармацевтически приемлемого носителя содержит растворитель, консервант и/или корригент, при соотношении, мас.%: Биологически активная часть 0,1-50 Растворитель, консервант и/или корригент 50-99.9 Лекарственный препарат в лекарственной форме аэрозоля в качестве фармацевтически приемлемого носителя содержит газ-вытеснитель, растворитель и корригент, при соотношении, мас. %: Биологически активная часть 0,1-50 Газ-вытеснитель, растворитель и корригент 50-99,9 Лекарственный препарат в лекарственной форме таблеток или таблеток с кишечно-растворимым покрытием или порошка в капсулах в качестве фармацевтически приемлемого носителя содержит связующее вещество и кишечнорастворимую оболочку или капсулу, при соотношении, мас.%: Биологически активная часть 1,0-80 Связующее вещество и кишечнорастворимая оболочка 20-99,0 Лекарственный препарат в лекарственной форме суппозитория в качестве фармацевтически приемлемого носителя содержит плавящуюся при 36,5-37 С основу суппозитория и консервант, при соотношении, мас.%: Биологически активная часть 0,5-40 Плавящаяся при 36,5-37 С основа суппозитория и консервант 60-99,5 При этом смесь акридонуксусной кислоты или ее производных с монозамещенными эфирами моносахаридов для ее смешивания с фармацевтически приемлемым носителем приготавливают в жидком или расплавленном состоянии путем смешивания или смешивания и последующего нагревания или смеши-3 005929 вания при нагревании или смешивания с нагретым фармацевтически приемлемым носителем непосредственно перед или во время смешивания с носителем. При этом смесь биологически активной части с фармацевтически приемлемым носителем дополнительно нагревают или стерилизуют или подвергают иной антибактериальной или антимикробной или антивирусной или антипаразитарной или антигрибковой обработке. В результате серии испытаний и исследований экспериментально установлено, что новые лекарственные формы заявляемого лекарственного препарата обладают выраженным иммуномодулирующим,противопаразитарным, противовирусным, противобактериальным, противогрибковым, противовоспалительным и противоопухолевым действием, низкой токсичностью, высоким индексом терапевтического действия, длительным сроком годности и высокой стабильностью при хранении. Экспериментально доказано, что биологически активная часть в силу ряда особенностей строения и физико-химических свойств обладает уникальной способностью растворяться как в гидрофильных, так и в гидрофобных средах при совместном их нагревании до 80-120C. Смеси акридонуксусных кислот или ее производных с монозамещенными эфирами моносахаридов являются сложными физико-химическими структурами, образованными слабыми донорами и слабыми акцепторами подвижных атомов водорода, очень мало диссоциированными в водных растворах и образующих устойчивые пары в спиртах и малополярных растворителях. Между компонентами при нагревании происходит дополнительное образование нескольких водородных связей, что в свою очередь стабилизирует структуру. Частичные электростатические заряды и гидрофильные группы данных веществ в значительной степени экранированы гидрофобными группами. Все эти факторы, по видимому, способствуют растворению данных соединений в различных по своей полярности растворителях [22]. Авторам удалось решить эти технологические, химические и фармацевтические сложности и практически получить весь набор необходимых в практической медицине лекарственных форм [2; 23]. Новым является создание лекарственного препарата с очень широкой сферой фармацевтической активности, а также разработка новых технологически простых, но эффективных методов получения лекарственных форм лекарственного препарата, предусматривающих смешивание ингредиентов биологически активной части (т.е. акридонуксусных кислот или их производных с монозамещенными эфирами моносахаридов) и фармацевтически приемлемого носителя с нагреванием смеси непосредственно перед или во время приготовления лекарственного препарата описанным выше способом. Как следует из приведенного выше обзора уровня техники, заявляемые способы и препараты являются новыми, они неизвестны из доступных источников информации, не вытекают явным образом из известного уровня техники, т.е. предложенные решения изобретательской задачи неочевидны для среднего специалиста. По сравнению с прототипом изобретения группы содержат новую, не известную ранее совокупность существенных признаков. Некоторые существенные признаки группы изобретений известны, однако совокупности общих и частных отличительных существенных признаков изобретений среди известных в науке и технике решений нами не обнаружено. Кроме этого отличительные признаки изобретений выполняют новые, не известные ранее функции, то есть обеспечивают возможность получения требуемого нового технического результата. Действительно, как будет показано ниже, на примерах конкретной реализации изобретений, заявляемые изобретения позволяют не только получить практически все пригодные к использованию в медицине и ветеринарии лекарственные формы высокоэффективного с широким спектром фармакологического действия лекарственного препарата иммуномодулирующего, противопаразитарного, противовирусного, противобактериального, противогрибкового, противовоспалительного и противоопухолевого действия, но и разработать новый, технологически простой и экономически выгодный промышленный способ приготовления разнообразных лекарственных форм лекарственного препарата с длительным сроком хранения (до 5 лет). Раскрытие изобретения Сущность изобретения поясняется нижеприведенными примерами практического апробирования и промышленной реализации изобретения в Научно-исследовательском обществе МЕДИТЭР в СанктПетербурге. Пример 1. 5 г акридонуксусной кислоты и 45 г 3-O-(N,N-диметиламино-н-бутил)-1,2:5,6-ди-Oизопропилиден-,D-аллофуранозы растворяют при нагревании до 90-95C в 100 мл 50% этанола. Полученный раствор смешивают с 700 мл расплавленного безводного ланолина, 200 мл касторового масла, 10 мл 10% водного раствора салицилата калия. Смесь нагревают до 90C доводят вес до 1 кг касторовым маслом и медленно охлаждают при интенсивном перемешивании. Полученную гомогенную 5% мазь расфасовывают в тубы и бушоны. Выход 98%. Мазь эффективна для лечения герпетических поражений кожных покровов, кандидозов половых органов, ран, кожных поражений, вызванных аутоиммунными заболеваниями.-4 005929 Аналогичным образом готовят кремы, пасты, гели, линименты с различным процентным содержанием биологически активной части и использованием различных фармакологических носителей. Пример 2. 4,5 г 3-хлор-10-метиленкарбокси-9-акридона и 5,5 г 1,2;3,4-ди-O-изопропилиден 6O(N,N-диметиламиноэтил)-,D-галактопиранозы растворяют при нагревании до 90-100 С в 0,4 л апирогенной воды. Полученный раствор охлаждают, доводят до 500 мл глицерином, и фильтруют через бактериальный фильтр. Разливают во флаконы по 5 мл, закрывают резиновыми пробками, обжимают жестяными колпачками, стерилизуют. Выход 97%. Получают 2% глазные капли, высокоэффективные при лечении конъюнктивитов различной этиологии. Эти же капли, после введения в раствор 0,1% метилпарабена и розлива в спреи или аэрозольные упаковки, используют в качестве интраназальных при острых респираторных заболеваниях и гриппе А и В для лечения ринитов и воспаления придаточных пазух носа. Пример 3. 270 г 3,7-диэтокси 10-метиленкарбокси-9-акридона и 230 г 3-O-(N,N-диметиламиноэтил)1,2-O-изопропилиден-,D-глюкофуранозы растворяют при нагревании до 95-100 С в 1,7 л апирогенной воды. Полученный раствор охлаждают и фильтруют через бактериальные фильтры, объем доводят до 2 л, разливают в ампулы по 1 мл, запаивают и стерилизуют. Получают 25% стерильный раствор, предназначенный для парентерального или перорального использования. Выход 97%. Лекарственная форма предназначена для лечения тяжелых иммунных, вирусных и бактериальных заболеваний, а также в качестве эффективного противоопухолевого средства. Пример 4. 42 г акридонуксусной кислоты и 58 г 3-O-(N,N-диметиламино-н-пропил)-1,2:5,6-ди-Oизопропилиден-,D-глюкофуранозы смешивают в 500 мл апирогенной воды. Смесь нагревают при перемешивании до кипения и выдерживают при кипячении 30-40 мин. При этом происходит растворение обоих компонентов. Полученный раствор охлаждают, доводят объем апирогенной водой до 1 л, фильтруют через бактериальные фильтры и разливают в ампулы по 2 мл. Ампулы запаивают и стерилизуют. Получают 10% стерильный раствор в ампулах для парентерального введения. Выход 95,6%. Полученное лекарственное средство анандин в настоящее время имеет разрешение Минздрава РФ 269/2000 на применение в медицине в качестве парентерального средства. Утверждена ВФС 42-368600 на 10% стерильный раствор для инъекций. Высокоэффективно в отношении практически всех классов как ДНК-, так и РНК-геномных вирусов (герпес, опоясывающий лишай, вирусные гепатиты, ОРЗ, грипп,энцефаломиелиты, полиэнцефалиты, геморрагические лихорадки), а также стафилококковых инфекций и ряда грибковых поражений. Пример 5. 44 г 3-O-(1'-этил-2'-(N-морфолинил)-1,2-O-изопропилиден-,D-глюкофуранозы, представляющей собой прозрачную вязкую жидкость смешивают с 39 г 3-хлор-6-метил-N-акридонуксусной кислоты в 250 мл этанола. Смесь нагревают до кипения и кипятят с обратным холодильником в течение 30 мин. Полученный раствор смешивают с 83 г крахмала водорастворимого и перетирают на шаровой мельнице и высушивают в вакууме 5 мм рт.ст. при температуре 110-120 С. Получают 160 г порошка светло-желтого цвета, из которого по известным технологиям изготавливают таблетки весом 400 мг, с содержанием активного препарата 200 мг, которые затем покрывают кишечно-растворимой оболочкой. Выход 93%. Таблетки эффективны в качестве как профилактического, так и лечебного средства при различных хронических заболеваниях. Пример 6. 45 г 2-карбокси-N-метиленкарбокси-9'-акридона и 5 г 3-O-(N,N,-диэтиламино-(2'изобутил)-1,2-O-изопропилиден-,D-аллофуранозы носят в 950 г расплава масла какао с парафином и гидрогенизированными жирами, нагретыми до 95-105 С, при интенсивном перемешивании. Полученный гомогенный расплав выливают в формы для получения суппозиториев весом 4 г, охлаждают до 10-15 С,покрывают тонким слоем талька. Выход около 90%. Получают суппозитории, содержащие 200 мг активного вещества, используемые для введения в полости тела, в качестве ректальных (свечи) и вагинальных. Лекарственное средство эффективно для лечения герпетических и кандидозных поражений половых органов, а также в качестве противовоспалительного и ранозаживляющего средства анального канала при геморрое. Промышленная применимость Оценка иммуномодулирующего действия заявленного препарата. Иммуномодулирующая активность лекарственного препарата оценена на 33 больных геморрагической лихорадкой с почечным синдромом (ГЛПС). Больным, с первичным диагнозом ГЛПС, вводили внутримышечно 2 мл. 10% стерильного раствора анандина (способ получения в примере 4) в течение пяти дней (200 мг препарата в день). Изучены типы иммунного реагирования пациентов на основную патологию ГЛПС на фоне анандина и без него. Результаты анализов приведены в табл. 1. Оценка иммунитета у больных ГЛПС на фоне анандина и без него. Из табл. 1 следует, что на фоне анандина основные показатели функциональной активности звеньев иммунитета возрастают. Это свидетельствует о стимуляции системы иммунитета и формировании активного иммуноответа на глубокий воспалительный процесс, при этом также упорядочиваются межклеточные взаимодействия (иммунорегуляторный индекс ИРИ). Т.е. установлено, что анандин имеет выраженное иммуностимулирующее и иммунокоррегирующее действие. Оценка противогрибковой активности заявленного препарата Для оценки противогрибковой активности заявляемого лекарственного средства в сравнении с прототипом были использованы 140 белых мышей с массой тела 18-20 г. Для получения модели генерализованного кандидоза мышам вводили внутривенно взвесь Candida albicans в дозе 15 млн клеток гриба на мышь (минимум 5 LD 50). Препараты вводили внутримышечно и перорально в течение 5 дней с момента заражения. Полученные данные представлены в табл. 2. Противогрибковая активность (на модели генерализованного кандидоза) заявляемого лекарственного препарата. Таблица 2 В табл. 2-7, приводятся усредненные результаты изучения 3-5 разных составов биологически активной части заявляемого лекарственного препарата. Как следует из полученных данных табл. 2, заявляемый лекарственный препарат как при внутримышечной, так и при пероральной формах введения проявил выраженный противогрибковый эффект, в то время как прототип не обладал данным видом активности. Оценка противовоспалительной активности заявленного препарата Для сравнительной оценки противовоспалительной активности заявляемого лекарственного препарата и прототипа использована модель асептического экссудативного воспаления лапок крыс. Эксперименты проводились на белых крысах массой 80-90 г, у которых вызывали отек задних лапок подкожным-6 005929 введением яичного белка по методике Селье через 1 ч после введения испытуемых лекарственных форм. Степень подавления отека учитывали по уменьшению прироста в массе отечной лапки крыс, получавшей испытуемые лекарственные препараты по сравнению с животными контрольной группы, которым вводили физиологический раствор. Результаты - в табл. 3. Противовоспалительная активность (на модели овальбуминового отека) заявляемого лекарственного препарата. Таблица 3 Результаты, представленные в табл. 3, свидетельствуют о наличии противовоспалительной активности у заявляемой лекарственной формы и отсутствии ее у прототипа. Оценка противобактериальной активности заявленного препарата Противобактериальную активность заявляемого лекарственного препарата в сравнении с прототипом оценивали на модели псевдотуберкулеза (Versinia pseudotuberculosis). Морских свинок, массой 300350 г заражали введением подкожно 0,1 мл взвеси, содержащей 1,5 х 10 6 клеток штамма псевдотуберкулеза первого серовара, LD-12,6. Препараты вводили через сутки после заражения, в течение 5 дней подряд в дозе 100 мг/кг, внутривенно. Результаты эксперимента - в табл. 4. Протибактериальная активность (на модели псевдотуберкулеза) заявляемого лекарственного препарата Таблица 4 Из данных табл. 4 следует, что заявляемый лекарственный препарат, в отличие от прототипа, обладает выраженной противобактериальной активностью. Следует отметить, что использование прототипа приводило лишь к незначительному увеличению средней продолжительности жизни зараженных животных, по сравнению с контролем. Оценка противовирусной активности заявленного препарата Оценку противовирусной активности заявляемого препарата в сравнении с прототипом провели на модели РНК-содержащего вируса (Picornaviridae) Энцефалита Менго (энцефаломиелита мышей), вызывающего заболевание энцефаломиокардит грызунов. Белые мыши весом 18-22 г были заражены дозой вируса 10 LD50, через 1 ч после заражения вводили лекарственные препараты, однократно в дозах 100 мг/кг, внутривенно и перорально. Противовирусная активность (на модели энцефалита Менго) заявляемого лекарственного препарата Таблица 5 Из данных табл. 5 следует, что как заявляемый препарат, так и прототип, обладают выраженной противовирусной активностью. Оценка противоопухолевой активности заявленного препарата Оценку противоопухолевой активности заявляемого лекарственного препарата и прототипа осуществили на модели лейкоза Р-388. Лейкоз Р-388 перевивали внутрибрюшинно мышам-самцам, линии ДВА, в количестве 106 клеток. Начиная со 2 дня после перевивания, мышам контрольной группы вводили 0,1 мл физраствора, а животным опытных групп вводили лекарственные средства 16 по 100 мг/кг, ежедневно в течение 7 дней.-7 005929 Противоопухолевая активность (на модели лейкоза Р-388) заявляемого лекарственного препарата Таблица 6 Оба испытанных препарата обладают достоверным противоопухолевым действием, однако заявляемый препарат увеличивал продолжительность жизни в 1,5 раза по сравнению с контролем, в то время как в опыте с использованием прототипа наблюдалось увеличение продолжительности жизни в 1,3 раза. Оценка антипаразитарной активности заявленного препарата Оценку антипаразитарной активности проводили на нескольких моделях: токсоплазмоз крыс, криптоспороидоз белых мышей, ихтиофтириоз рыб. Во всех случаях получен выраженный лечебный эффект,значительно превосходящий эффект прототипа. Ниже приведены данные по испытанию лекарственного препарата при лечении ихтиофтириоза рыб. В опытах использовали высоковирулентный штамм равнореснитчатой инфузории Ichthyophthius multifiliis. Заражению подвергались беспородные самки Poecilia reticulata Peters в возрасте двух месяцев. На пятый день после заражения появились выраженные признаки заболевания. Для изучения сравнительной эффективности заявляемого лекарственного препарата, в стерильные сосуды с отстоявшейся водой, температуры 22-24C, помещали больных рыб:-в первом случае в сосуд вносили гидрофильную лекарственную форму лекарственного препарата из расчета, чтобы общая концентрация его была 0,01%.-во втором случае - вносили водорастворимую лекарственную форму прототипа в той же концентрации-0,01%.-в третьем случае - вносили стерильный раствор натрия хлорида до концентрации 0,01%. В сосудах больных рыб выдерживали 5 ч, затем каждую группу переносили в отдельный сосуд с чистой водой. Лечение проводили в течение 3 дней по той же схеме. Антипаразитарная активность заявленного лекарственного препарата на модели ихтиофтириоза Таблица 7 Из данных табл. 7 следует, что заявляемый лекарственный препарат обладает выраженным лечебным эффектом, в 2,2 раза превосходящим эффективность прототипа. Кроме того, экспериментально установлено, что предлагаемый лекарственный препарат имеет не только показанную выше уникальную совокупность полезных свойств, но и не обладает раздражающим и сенсибилизирующим действием, не токсичен даже при высоких дозах. Тесты in vitro и in vivo не обнаруживают мутагенной активности. Представленные экспериментальные результаты показали: заявляемый лекарственный препарат обладает иммуномодулирующим, противопаразитарным, противовирусным, противобактериальным, противогрибковым, противовоспалительным и противоопухолевым действием, что убедительно подтверждает - поставленная цель достигнута - получен новый лекарственный препарат, обладающий высокой активностью и широким спектром фармакологического действия. Высокая активность заявленного препарата, ее широкий спектр и практически неограниченная растворимость являются совершенно неочевидными для специалиста. Действительно, используемые для получения биологически активной части препарата ингредиенты: а) акридонуксусная кислота и ее производные имеют значительно меньшую активность, значительно меньший терапевтический индекс и имеет только противовирусную, и иммуномодулирующую активности, мало растворимы в гидрофобных растворителях, причем часто гигроскопичны и поэтому плохо хранятся. б) монозамещенные эфиры моносахаридов имеют незначительную активность только против аутоиммунных и воспалительных заболеваний, например, Амиприлоз, причем слабо растворимы в гидрофильных фармацевтически приемлемых носителях таких как водные спирты.-8 005929 А композиция, созданная их смешиванием с любым фармацевтически приемлемым носителем при нагревании показала активность, несопоставимо большую и широкую, чем сумма активностей ингредиентов и прекрасную растворимость практически во всех типах основ, используемых в готовых лекарственных средствах. Экспериментально установлено также, что явно выраженное лечебное действие заявляемый лекарственный препарат проявляет во всех заявленных лекарственных формах и во всех пределах заявленных значений содержания отдельных компонентов или ингредиентов. Выявленные экспериментально и предлагаемые по изобретению предельные значения отдельных ингредиентов лекарственного препарата обусловлены его уникальными физико-химическими и терапевтическими свойствами - растворимостью биологически активной части во всех фармацевтически приемлемых носителях при кратковременном нагревании в течение 20-40 мин до температуры 80-120C, позволяющим применять в медицине любые лекарственные формы лекарственного препарата, отсутствием осмотического повреждающего давления на ткани лекарственных форм, изотоничностью для глазных,интраназальных, инъекционных лекарственных форм, технологическими особенностями изготовления форм в виде таблеток, суппозиториев, порошка и мазей. Кроме этого экспериментально установлено, что эффективные терапевтические дозы лекарственного препарата составляют 1-250 мг/кг, терапевтический индекс 100 и более. Низкая токсичность соединений, отсутствие побочного действия и высокая эффективность в низких концентрациях позволяют использовать препарат в широком диапазоне заявленных концентраций и доз. Исследования и клинические испытания лекарственного препарата для выявления детального биохимического механизма действия и отработки наиболее оптимальных для частных случаев соотношений ингредиентов лекарственных форм продолжаются. Конкретные параметры и особенности проведения технологических операций могут выбираться в пределах заявленных диапазонов в совокупности с другими известными и широко применяемыми в фармакологической практике технологическими приемами и способами. Соответствие критериям охраноспособности Изложенные выше подробные описания практической реализации лекарственного препарата в промышленных условиях доказали их промышленную осуществимость - составные части и все элементы технологических приемов изготовления лекарственных препаратов давно известны и хорошо освоены современной фармакологией [24]. Приведенные выше примеры получения лекарственных форм показали, что они легко изготавливаются в промышленных масштабах, не требует дорогого сырья и специального оборудования. В целом, учитывая новизну и неочевидность изобретений, существенность всех общих и частных признаков изобретений (показанную в разделе Раскрытие изобретения), а также промышленную применимость изобретения, уверенное решение поставленных изобретением задач, достижение требуемого технического результата, по нашему мнению, заявленная группа изобретений удовлетворяет всем требованиям, предъявляемым к изобретениям. Источники информации 1. Государственная фармакопея СССР, Х изд., М.: "Медицина", 1968. 2. Государственная фармакопея СССР, XI изд., М.: "Медицина", 1990. 2. Государственный реестр лекарственных средств (официальное издание), М., 2000 г. 3. Машковский М.Д., Лекарственные средства., 14-е изд., ч 1, 2., М.: "Новая волна", 2000 г. 4. X. Винтер Гриффит, Новейшие лекарственные средства., М.: "Крон-пресс", 1998 г. 5. Харкевич Д.А., Фармакология., М.: "ГЭОТАР Медицина", 1999 г. 6. Кленова И.Ф., Яременко И.А., Ветеринарные препараты в России, Справочник., М.: "Сельхозиздат", 2000 г. 7. Лекарственные средства (свойства, применение, противопоказания)., Справочник., ред. М.А. Клюев, М.: "Русская книга", 1993 г. 8. Chemotherapy and Immunity. Ed. G. Pulverer, J. Jeljaszewicz, Gustav Fisher Verlag, 1985, 245 с. 9. Регистр лекарственных средств России (РЛС), под ред. Крылова Ю.Ф., Москва "Инфармхим",1993, 1006 с. 10. Schneiden H, Levamisole - a general pharmacological perspective. Int. J. Immunopharmacological,1981, v.3, p. 9-13. 11. Gordon G., Minks M.A. The interferone renaissance: molecular aspects of induction and action. Microbiol. Rev., 1981, v. 45, p. 244. 12. Патент США N 4017608, МКИ А 61 K 31/70, НКИ 424/80, 536/129, опубл. 12.04. 1977. 13. Taylor J.L, Grossberg S.E. Тех. Rep. Biol. Med. 1981 82. Vol. 41 p. 158-163; 14. Szulc В., Piasecki E. Arch. Immun. Ther. Exp., 1988, 36, N 5 p. 537-545. 15. PCT WO 94/22837, опубл. 13.10.1994. 16. Патент США 5.658.886, опубл. 19.08.1997. 17. Патент РФ 2080108. О.Травкин, E. Яковлева, E. Буянова, Иммуно-модулирующее лекарственное средство, опубл. 27.05.1997 - Прототип.-9 005929 18. Патент РФ 2103006. О.Травкин , Д.Генкин, Иммуномодулирующее лекарственное средство,опубл. 27.01.1998 г. 19. Патент РФ 2118532. О.Травкин, Е.Яковлева, Противоинфекционное, противовоспалительное и противоопухолевое средство, опубл. 10.09.1998. 20. Патент ЕА 000632. Травкин О.В., Яковлева Е.В., Средство противоинфекционного, противовоспалительного и противоопухолевого действия, опубл. 27.10.1999 г. 21. Новые пути органического синтеза, Ред. Колхаун Х.М., М.:"Химия", 1989. 22. Грецкий В.М., Хоменок B.C., Руководство к практическим занятиям по технологии лекарственных форм, М.: "Медицина", 2000 г. 23. И. Муравьев. Технология лекарств, М.: Медицина, 1971 г. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Противоопухолевый, противовирусный, антибактериальный, противопаразитарный, противовоспалительный, иммуномодулирующий и противогрибковый лекарственный препарат, включающий биологически активную часть и фармацевтически приемлемый носитель, отличающийся тем, что биологически активная часть содержит смесь акридонуксусной кислоты или ее производных общей формулы (1) где R1, R2 выбраны из группы Н, ОН, галоген, алкил, оксиалкил, арил, оксиарил, карбоксигруппа, n=1-4,с монозамещенными эфирами моносахаридов общей формулы (2) где группа может быть в форме гемиацеталя или гемикеталя, виликонфигурациях,(Н, OW1), (H, OW2), (Н, OW3) обозначают различные изомеры, отличающиеся положением групп Н и OW относительно плоскости кольца моносахарида,X, Z выбраны из группы: Н, ОН, алкил, гидроксиалкил, алкоксил, алкоксиалкил,W1, W2, W3 выбраны из группы Н, алкил, арил, алкенил,OW1 и Z, OW2 и Z, OW3 и Z, OW1 и X, OW2 и X, OW3 и X, OW1 и OW2, OW1 и OW3, OW2 и OW3 попарно выбраны из группы: алкил, арил, бензил, алкенил,R3, R4 выбраны из группы Н, алкил, арил, или R3 и R4 вместе с атомом азота образуют морфолиновый, пиперидиновый или пиридиновый гетероцикл, n = 1-6,термически обработанные совместно с носителем при температурах 80-120C, причем весовые соотношения ингредиентов биологически активной части препарата выбраны в пределах от 1:10 до 10:1, а весовые соотношения активной части и носителя выбраны в пределах, мас.%: биологически активная часть 0,05-80, носитель 20-99,95. 2. Способ изготовления лекарственного препарата по п.1, отличающийся тем, что, смесь ингредиентов биологически активной части (акридонуксусной кислоты или ее производных и монозамещенных эфиров моносахаридов) смешивают с фармацевтически приемлемым носителем с одновременным или последующим нагреванием или смешиванием при нагревании или смешиванием с нагретым носителем непосредственно перед или во время их смешивания. 3. Лекарственный препарат по п.1, отличающийся тем, что в качестве биологически активной части препарат содержит анандин, представляющий собой смесь N-акридонуксусной кислоты (глюкоамино- 10005929 пропилкарбакридона) и 3-O(N,N-диметиламино-н-пропил)-1,2:5,6-ди-O-изопропилиден-,D-глюкофуранозы (диметиламинопропилглюкофуранозы). 4. Лекарственный препарат в лекарственной форме мази, или крема, или пасты, или геля, или линимента по п.1 или 3, отличающийся тем, что, в качестве фармацевтически приемлемого носителя препарат содержит липофильную, или жировую, или гидрофильную основу при соотношении, мас.%: биологически активная часть 0,1-50, носитель 50-99,9. 5. Лекарственный препарат в лекарственной форме глазных капель, или интраназальных капель, или ушных капель по п.1 или 3, отличающийся тем, что в качестве фармацевтически приемлемого носителя содержит стерильный водный, или спиртовой, или масляный, или гидрофобный растворитель, стабилизатор и/или консервант при соотношении, мас.%: биологически активная часть 0,1-50, носитель 50-99,9. 6. Лекарственный препарат в лекарственной форме раствора для парентерального или перорального использования по п.1 или 3, отличающийся тем, что в качестве фармацевтически приемлемого носителя препарат содержит растворитель, консервант, и/или антиоксидант, и/или стабилизатор при соотношении,мас.%: биологически активная часть 0,05-60, носитель 40-99,95. 7. Лекарственный препарат в лекарственной форме спрея по п.1 или 3, отличающийся тем, что в качестве фармацевтически приемлемого носителя содержит растворитель, консервант и/или корригент при соотношении, мас.%: биологически активная часть 0,1-50, носитель 50-99,9. 8. Лекарственный препарат в лекарственной форме аэрозоля по п.1 или 3, отличающийся тем, что в качестве фармацевтически приемлемого носителя содержит газ-вытеснитель, растворитель и корригент при соотношении, мас.%: биологически активная часть 0,1-50, носитель 50-99,9. 9. Лекарственный препарат в лекарственной форме таблеток, или таблеток с кишечнорастворимым покрытием, или порошка в капсулах по п.1 или 3, отличающийся тем, что в качестве фармацевтически приемлемого носителя содержит связующее вещество и кишечнорастворимую оболочку или капсулу при соотношении, мас.%: биологически активная часть 1,0-80, носитель 20-99,0. 10. Лекарственный препарат в лекарственной форме суппозиториев по любому из пп.1 или 3,отличающийся тем, что в качестве фармацевтически приемлемого носителя препарат содержит плавящуюся при 36,5-37 С основу суппозиториев и консервант при соотношении, мас.%: биологически активная часть 0,5-40, носитель 60-99,5.
МПК / Метки
МПК: A61K 31/473, A61P 37/00
Метки: препарат, способ, противоопухолевый, лекарственный, изготовления, противовирусный, антибактериальный, противопаразитарный, противовоспалительный, лекарственныеформы, противогрибковый, иммуномодулирующий
Код ссылки
<a href="https://eas.patents.su/12-5929-protivoopuholevyjj-protivovirusnyjj-antibakterialnyjj-protivoparazitarnyjj-protivovospalitelnyjj-immunomoduliruyushhijj-i-protivogribkovyjj-lekarstvennyjj-preparat-sposob-ego-izgot.html" rel="bookmark" title="База патентов Евразийского Союза">Противоопухолевый, противовирусный, антибактериальный, противопаразитарный, противовоспалительный, иммуномодулирующий и противогрибковый лекарственный препарат, способ его изготовления и лекарственныеформы</a>
Предыдущий патент: Способ получения кристаллической формы i каберголина
Следующий патент: Фармацевтические комбинации на основе производных пиридоиндолона и противораковых агентов
Случайный патент: Упругий элемент (варианты), упругодемпфирующий узел












