Способ получения циталопрама
Формула / Реферат
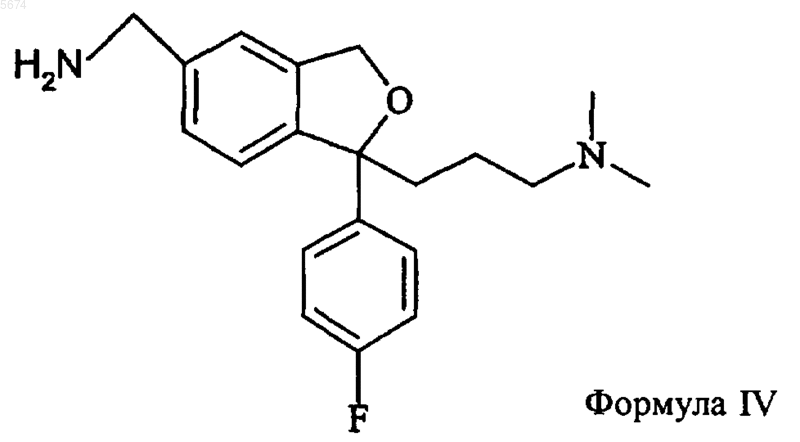
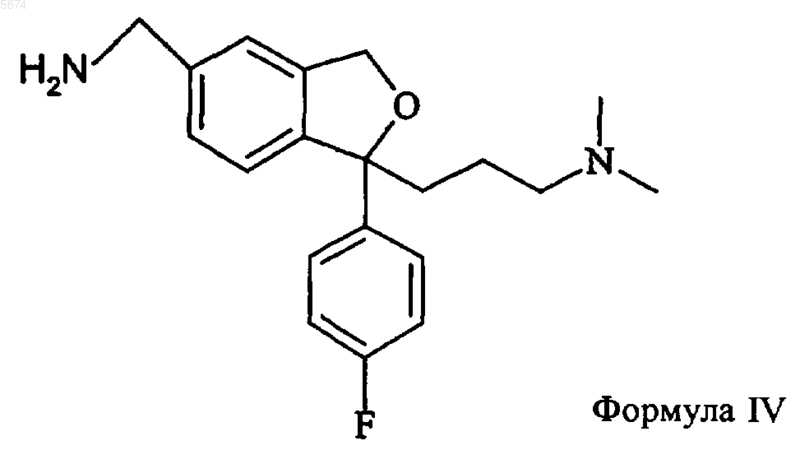
1. Способ получения циталопрама, включающий взаимодействие соединения формулы IV
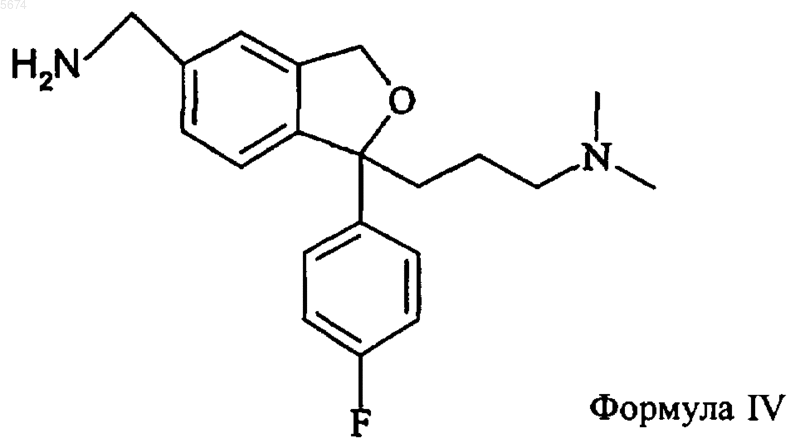
с окисляющим агентом с образованием циталопрама

который выделяют в виде основания или его фармацевтически приемлемой соли.
2. Способ по п.1, отличающийся тем, что промежуточный продукт формулы IV получают активацией спирта формулы VIII
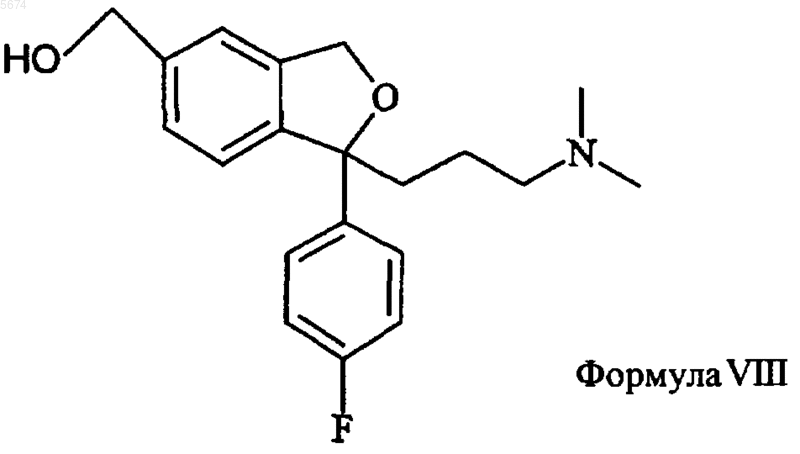
замещенным сульфонатом или превращением спирта в бензилгалогенид или другое активированное производное с последующим аминолизом с образованием соединения формулы IV
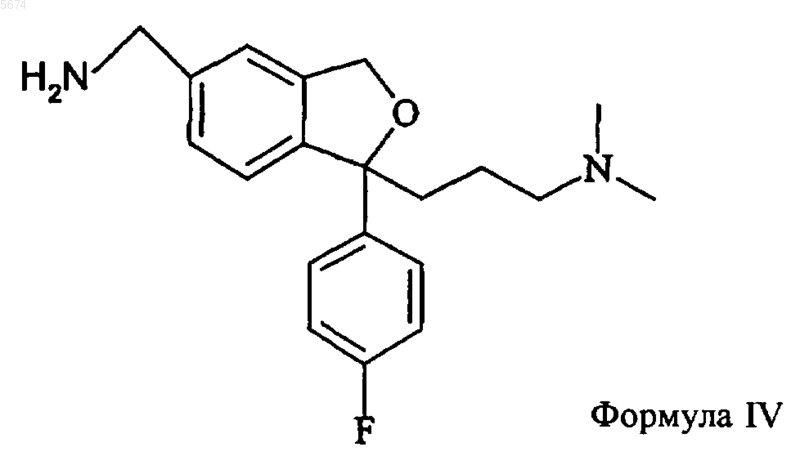
3. Способ по п.2, отличающийся тем, что промежуточное соединение формулы VIII получают взаимодействием соединения формулы VII
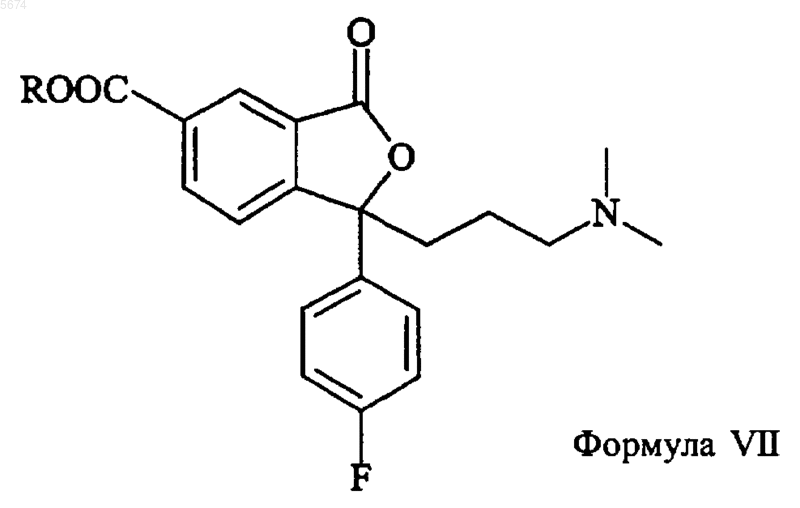
с восстанавливающим агентом.
4. Способ по п.3, отличающийся тем, что промежуточное соединение формулы VII получают алкилированием соединения формулы VI
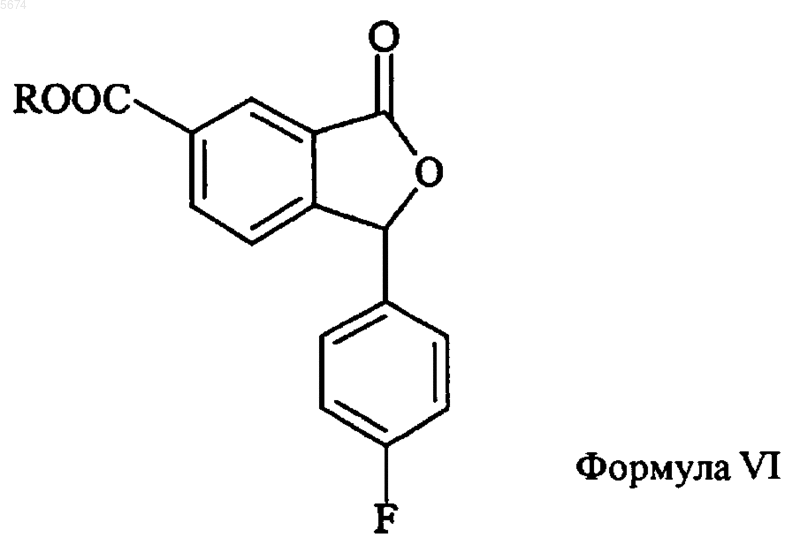
необязательно, ступенчатым алкилированием.
5. Способ по п.4, отличающийся тем, что промежуточное соединение формулы VI получают взаимодействием соединения формулы V
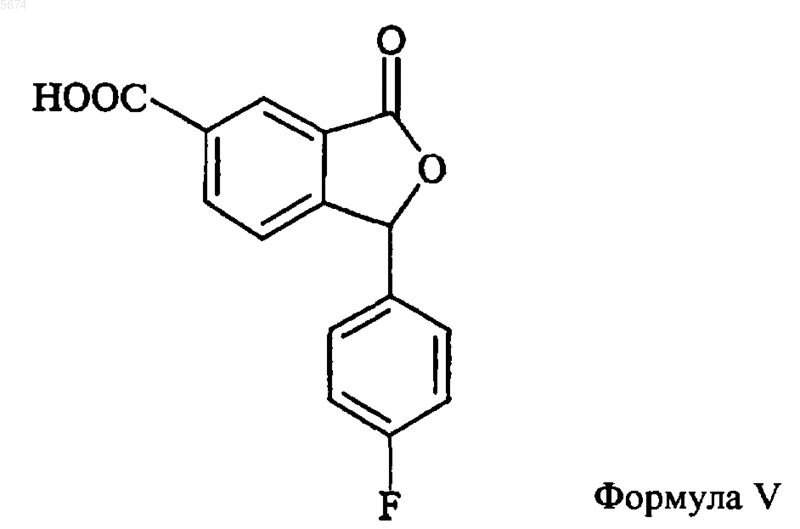
со спиртом R-OH в присутствии дегидратирующего агента.
6. Способ по п.1, отличающийся тем, что промежуточное соединение формулы IV получают взаимодействием соединения формулы X
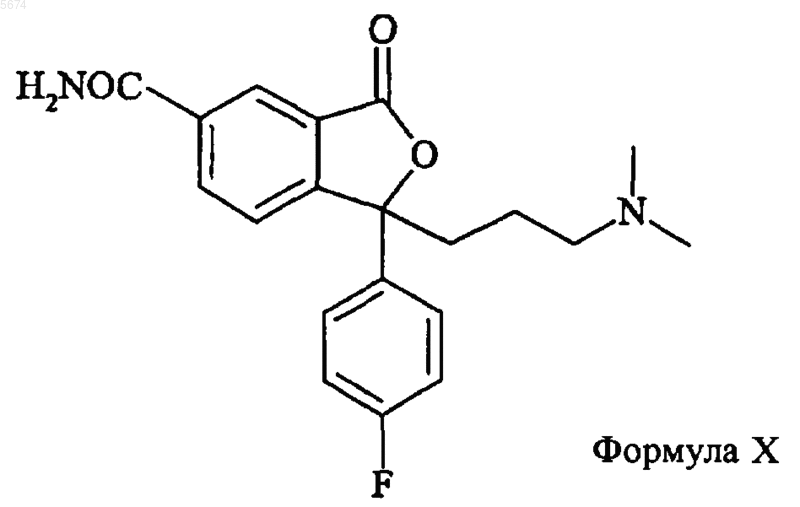
с восстанавливающим агентом с последующей циклизацией с образованием соединения формулы IV

7. Способ по п.6, отличающийся тем, что промежуточное соединение формулы X получают алкилированием соединения формулы IX

необязательно, ступенчатым алкилированием.
8. Способ по п.7, отличающийся тем, что промежуточное соединение формулы IX получают взаимодействием соединения формулы V
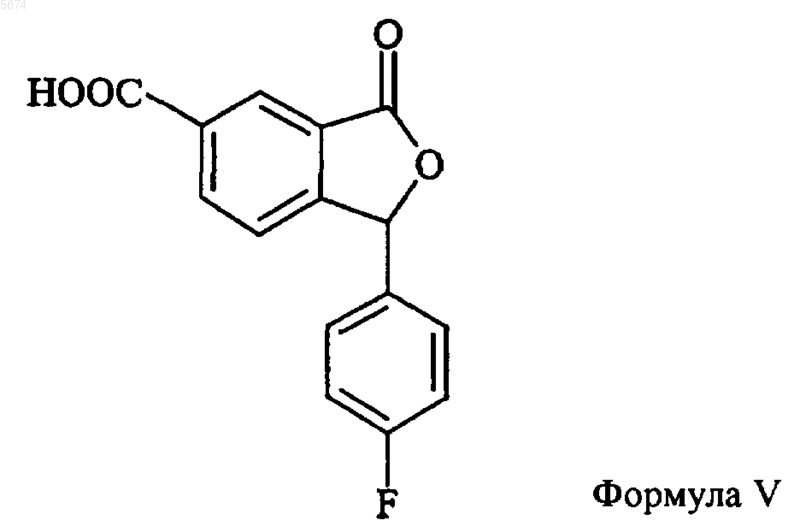
с дегидратирующим агентом, таким как тионилхлорид, с последующим аминолизом образовавшегося активированного производного кислоты.
9. Способ по п.1, отличающийся тем, что промежуточное соединение формулы IV получают взаимодействием соединения формулы XII
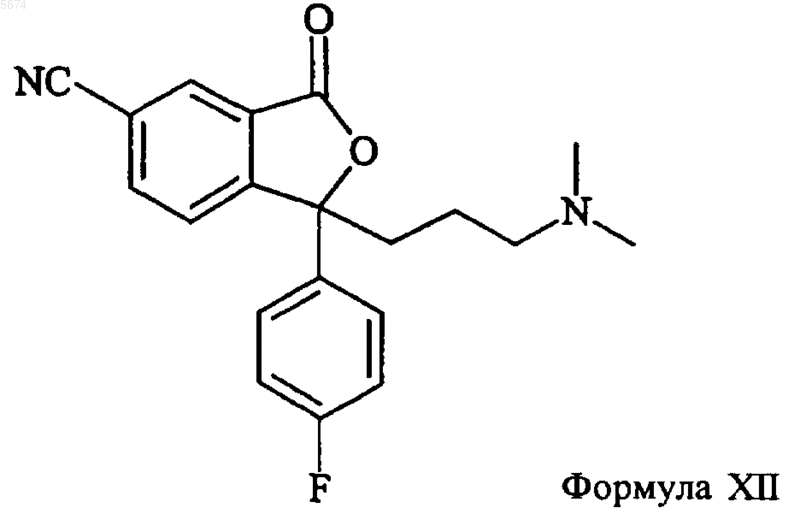
с восстанавливающим агентом с последующей циклизацией с образованием соединения формулы IV
10. Способ по п.9, отличающийся тем, что промежуточное соединение формулы XII получают алкилированием соединения формулы XI
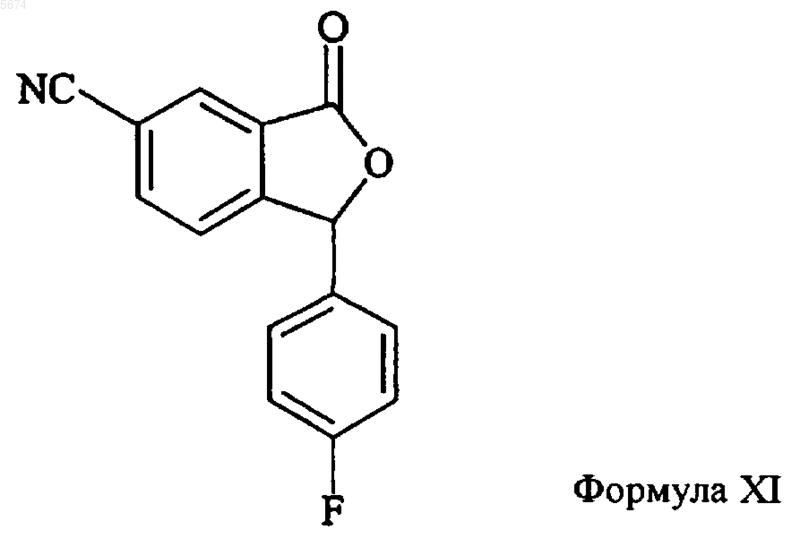
необязательно, ступенчатым алкилированием.
11. Способ по п.10, отличающийся тем, что промежуточное соединение формулы XI получают превращением соединения формулы V
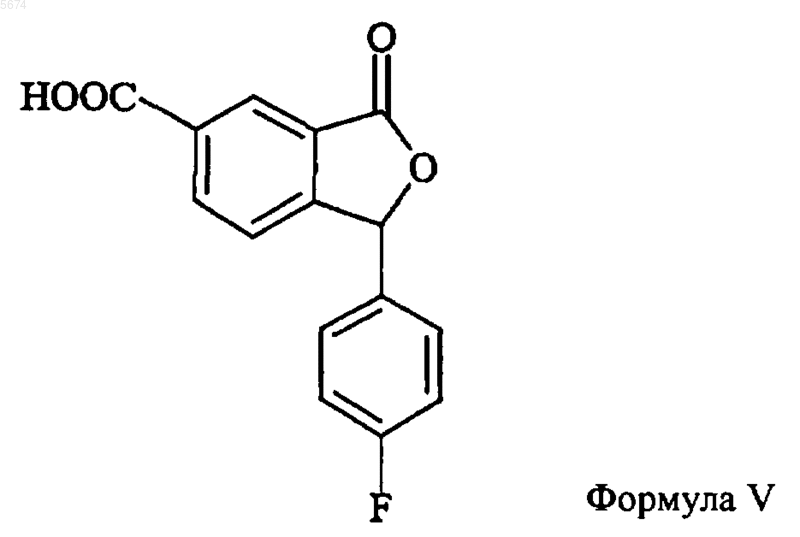
в соответствующее цианозамещенное соединение.
12. Соединение формулы V

13. Способ получения промежуточного продукта по п.12, включающий реакцию циклизации соединения формулы XIII
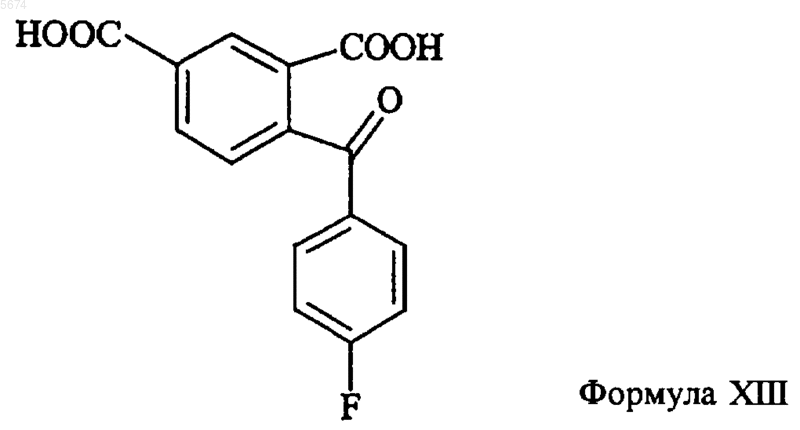
с подходящим восстанавливающим агентом.
14. Способ по п.13, где восстанавливающим агентом является Zn в кислоте, предпочтительно уксусной кислоте.
15. Способ по п.1, отличающийся тем, что промежуточное соединение формулы IV получают алкилированием соединения формулы XVII
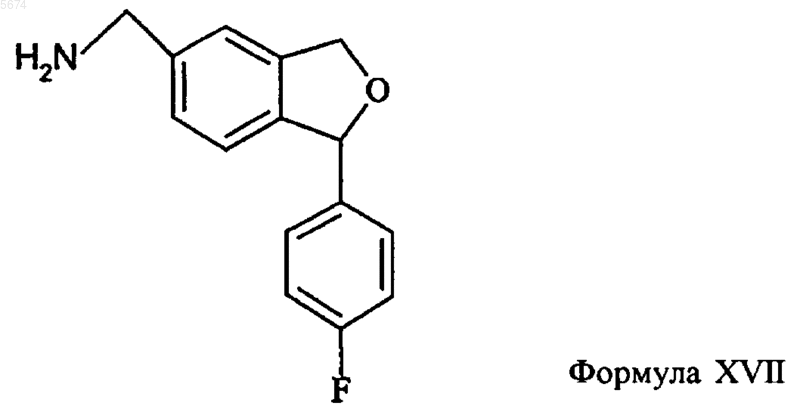
необязательно, ступенчатым алкилированием с образованием соединения формулы IV
16. Способ по п.15, отличающийся тем, что промежуточное соединение формулы XVII получают аминолизом соединения формулы XVI
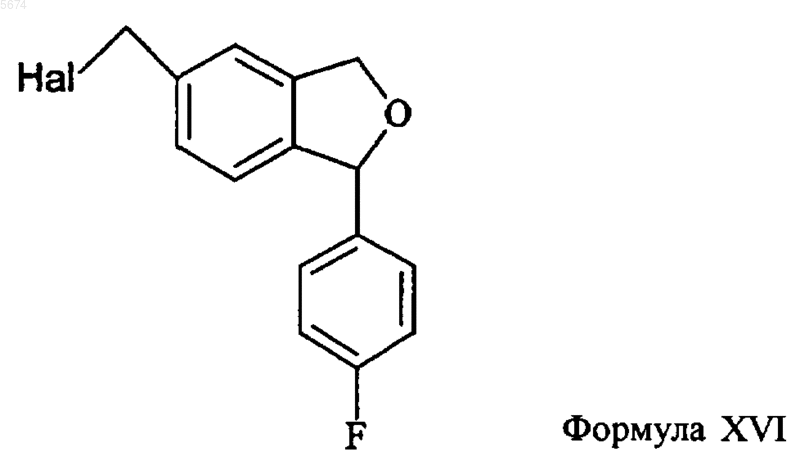
17. Способ по п. 16, отличающийся тем, что промежуточное соединение формулы XVI получают активацией спирта формулы XV
замещенным сульфонатом или превращением спирта в бензилгалогенид или другое активированное производное.
18. Способ по п.17, отличающийся тем, что промежуточное соединение формулы XV получают взаимодействием кетона формулы XIII
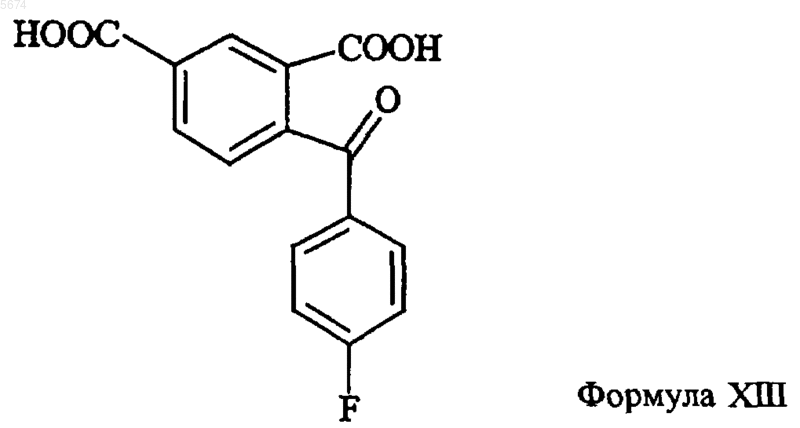
с восстанавливающим агентом с последующей циклизацией с образованием соединения формулы XV.
Текст
005674 Настоящее изобретение относится к способу получения хорошо известного антидепрессантного лекарственного средства циталопрама, 1-[3-(диметиламино)пропил]-1-(4-фторфенил)-1,3-дигидро-5 изобензофуранкарбонитрила. Циталопрам является хорошо известным антидепрессантным лекарственным средством, которое продается на рынке в течение нескольких лет и имеет следующую структуру: Он является селективным ингибитором повторного поглощения серотонина(5 гидрокситриптамина; 5-НТ), действующим в центральной нервной системе, соответственно обладающим антидепрессивной активностью. Антидепрессивная активность данного соединения описана в нескольких публикациях, например, J. Hyttel Prog. Neuro-PsychopharmacolBiol. Psychiat, 1982, 6, 277-295 и A.Gravem, Acta Psychiatr. Scand. 1987, 75, 478-486. Соединение далее описано как проявляющее действия при лечении деменции и цереброваскулярных нарушений, ЕР-А 474580. Циталопрам впервые описан в патенте Германии 2657013, соответствующем патенту США 4136193. Эта патентная публикация описывает получение циталопрама одним способом и характеризует другой способ, который можно использовать для получения циталопрама. В соответствии с описанным способом, соответствующий 1-(4-фторфенил)-1,3-дигидро-5 изобензофуранкарбонитрил подвергают взаимодействию с 3-(N,N-диметиламино)пропилхлоридом в присутствии метилсульфинилметида в качестве конденсирующего агента. Исходный материал получают из соответствующего 5-бромпроизводного путем взаимодействия с цианидом меди. В соответствии со способом, который только охарактеризован в общих чертах, циталопрам можно получить циклизацией соединения: в присутствии дегидратирующего агента и последующим обменом группы 5-бром с цианидом меди (I). Исходный материал формулы II получают из 5-бромфталида двумя последовательными реакциями Гриньяра, т.е. с 4-фторфенилмагнийхлоридом и N,N-диметиламинопропилмагнийхлоридом, соответственно. Новый и неожиданный способ и промежуточный продукт получения циталопрама описаны в патенте США 4650884, в соответствии с которым промежуточный продукт формулы подвергают реакции циклизации дегидратацией сильной серной кислотой для получения циталопрама. Промежуточный продукт формулы III получают из 5-цианофталида двумя последовательными реакциями Гриньяра, т.е. с 4-хлорфенилмагнийгалогенидом и N,N-диметиламинопропилмагнийгалогенидом,соответственно. Следующие способы описаны в Международных патентных публикацияхWO 98019511, WO 98019512 и WO 98019513. WO 980195512 и WO 98019513 и относятся к способам, в которых 5-амино-, 5 карбокси- или 5-(фтораминокарбонил)фталид подвергают двум последовательным реакциям Гриньяра,циклизации и превращению образовавшегося в результате производного 1,3-дигидроизобензофурана в соответствующее 5-цианосоединение, т.е. циталопрам. В Международной патентной публикацииWO 98019511 описан способ получения циталопрама, в котором соединение (4-замещенный-2 гидроксиметилфенил-(4-фторфенил)метанол подвергают циклизации и образовавшийся 5-замещенный 1(4-фторфенил)-1,3-дигидроизобензофуран превращают в соответствующее 5-цианопроизводное, которое алкилируют (3-диметиламино)пропилгалогенидом для получения циталопрама. Наконец, способы получения индивидуальных энантиомеров циталопрама описаны в патенте США 4943590, из которого также следует, что циклизацию промежуточного продукта формулы III можно проводить через лабильный сложный эфир основанием. В настоящее время неожиданно обнаружено, что циталопрам можно изготовить новым удобным и безопасным способом с использованием общепринятых исходных материалов. В соответствии с этим, настоящее изобретение относится к новому способу получения циталопрама, включающему взаимодействие соединения формулы IV который выделяют в виде основания или его фармацевтически приемлемой соли. В другом аспекте изобретение относится к способам получения промежуточных продуктов формулы IV. Еще в одном аспекте настоящее изобретение относится к антидепрессантной фармацевтической композиции, включающей циталопрам в виде основания или его любой пригодной соли, полученной способом изобретения. Кроме того, в соответствии с изобретением, соединения формулы IV можно получить различными способами. Один из этих способов включает следующие стадии: 6-карбокси-3-(4-фторфенил)фталид подвергают взаимодействию со спиртом R-OH, где R представляет предпочтительно низший алкил, наиболее предпочтительно Me, в присутствии дегидратирующего агента, предпочтительно SOCl2. Образовавшееся в результате соединение формулы VI алкилируют где X представляет удаляемую группу, в присутствии подходящего основания. X, предпочтительно,представляет галоген или сульфонат. Реакция алкилирования необязательно является ступенчатым алкилированием. В этом случае образовавшееся соединение формулы VI алкилируют соединением, имеющим формулу-2 005674 где X' представляет подходящую удаляемую группу и R' представляет-СН 2-O-Рg, -CH2-NPg1Pg2, -СОN(СН 3)2, -СН(OR1)(OR2), -С(OR4)(OR5)(OR6) или COOR3, где Pg представляет защитную группу для спиртовой группы, Pg1 и Рg2 являются защитными группами для аминогруппы, R1 и R2 представляют алкильные группы или R1 и R2 вместе образуют цепь из 2-4 атомов углерода, и R3, R4, R5 и R6 представляют алкил, алкенил, алкинил, арил или аралкил; с образованием соединения формулы XVIII где R' имеет указанные выше значения с последующим превращением группы R' в диметиламинометильную группу. Образовавшееся соединение формулы VII подвергают взаимодействию с восстанавливающим агентом, таким как LiAlH4, красный-Al, АlН 3 или активированные формы NaBH4, например, NaBH4, Me2SO4;NaBH4, I2; NaBH4, ВF3, Et2O или В 2 Н 6, с последующей обработкой кислотой или другим дегидратирующим агентом для проведения циклизации с образованием соединения формулы VIII. Спирт формулы VIII подходящим способом активируют тозилхлоридом или мезилхлоридом с образованием соответствующего замещенного сульфоната; или спирт превращают в соответствующий бензилгалогенид. Превращение, предпочтительно, проводят с SOBr2 или SOCl2. Соответствующий сульфонат или галогенид либо превращают непосредственно в соединение формулы IV путем взаимодействия с жидким аммиаком; или путем взаимодействия с солью металла фталимида, предпочтительно фталимидом калия, с последующей обработкой NH2NH2 или обработкой амином в спирте, т.е. R8NH2/R9-ОН, где R8 и R9 представляют низший алкил, предпочтительно метил или этил,например, метиламином в этаноле; или взаимодействием с азидом металла, MN3, причем М предпочтительно представляет Na или K; с последующей обработкой восстанавливающим агентом, таким как Pd/C и Н 2 или гидридным источником, таким как LiAlH4 или NaBH4 или его активированная форма. Другой способ получения соединения формулы IV включает следующие стадии: 6-карбокси-3-(4-фторфенил)фталид подходящим образом подвергают взаимодействию с дегидратирующим агентом, таким как тионилхлорид, с последующим аминолизом образовавшегося активированного производного кислоты. Образовавшееся соединение формулы IX алкилируют где Х представляет удаляемую группу, в присутствии подходящего основания. X предпочтительно представляет галоген или сульфонат. Реакция алкилирования, необязательно, является ступенчатым алкилированием, аналогичным описанному выше ступенчатому алкилированию. Образовавшееся соединение Х подвергают взаимодействию с восстанавливающим агентом, таким как LiAlH4, красный-Al, АlН 3 или активированные формы NaBH4, например, NaBH4, Me2SO4; NaBH4, I2;NaBH4, BF3.Et2O или В 2 Н 6; с последующей обработкой кислотой или другим дегидратирующим агентом для проведения циклизации с образованием соединения формулы IV. В соответствии с третьим способом получения соединения формулы IV, получают соответствующее 6-цианозамещенное производное 6-карбокси-3-(4-фторфенил)фталида.-3 005674 Карбоксипроизводное либо подвергают взаимодействию с SOCl2 с последующей обработкой аммиаком, и, наконец, дегидратирующим агентом, таким как SOCl2, с получением цианопроизводного формулы XI; либо подвергают взаимодействию со спиртом R-OH в присутствии кислоты с последующей обработкой аммиаком и, наконец, подвергают взаимодействию с SOCl2; или подвергают взаимодействию в одном резервуаре, например, с SO2(NH2)2, SOCl2 и сульфоланом или с трет-бутиламином, дегидратирующим агентом, таким как РОСl3, и подходящим растворителем, таким как толуол. Образовавшееся соединение формулы XI алкилируют где Х представляет удаляемую группу, в присутствии подходящего основания. X предпочтительно представляет галоген или сульфонат. Реакция алкилирования, необязательно, является ступенчатым алкилированием, аналогичным описанному выше ступенчатому алкилированию. Образовавшееся соединение формулы XII подвергают взаимодействию с восстанавливающим агентом, таким как LiAlH4, красный-Al, АlН 3 или активированные формы NaBH4, например, NaBH4, Ме 2SO4;NaBH4, I2; NaBH4, ВF3. Et2O или В 2 Н 6; с последующей обработкой кислотой для проведения циклизации с образованием соединения формулы IV. Другие условия взаимодействия, растворители и т.д. для описанных выше реакций являются общепринятыми условиями для таких взаимодействий, их может легко определить специалист в данной области. В другом аспекте настоящее изобретение относится к новому промежуточному соединению формулы V. В следующем аспекте изобретение относится к способам получения промежуточного соединения формулы V. Один ступенчатый способ получения промежуточного соединения формулы V иллюстрируется ниже м-ксилол и п-фторбензоилхлорид, которые являются коммерчески доступными соединениями, подвергают взаимодействию в присутствии АlСl3, получая при этом соединение формулы XIV. Это соединение окисляют перманганатом, предпочтительно, KМnO4 или NaMnO4, получая при этом образовавшееся соединение формулы XIII, которое, наконец, подвергают взаимодействию подходящим способом с Zn в кислоте, предпочтительно в уксусной кислоте. В альтернативном случае соединение формулы IV получают из соединения формулы XIII следующим ступенчатым способом:LiAlH4, красный-Al, АlН 3 или активированные формы NaBH4, например, NaBH4, Me2SO4; NaBH4, I2;NaBH4, BF3.Et2O или В 2 Н 6; с последующей обработкой кислотой для проведения циклизации с образованием соединения формулы XV. Спирт формулы XV общепринятым способом активируют тозилхлоридом или мезилхлоридом с образованием соответственно замещенного сульфоната; или спирт превращают в соответствующий бензилхлорид. Это превращение, предпочтительно, проводят с SOВr2 или SOCl2.-4 005674 Соответствующий сульфонат или галогенид либо превращают непосредственно в соединение формулы XVII взаимодействием с жидким аммиаком; или взаимодействием с солью металла фталимида,предпочтительно, фталимидом калия, с последующей обработкой NH2NH2 или обработкой амином в спирте, например, R8NH2/R9-OH, где R8 и R9 представляют низший алкил, предпочтительно метил или этил, предпочтительно, метиламином в этаноле; или взаимодействием с азидом металла MN3, причем М предпочтительно представляет Na или К; с последующей обработкой восстанавливающим агентом, таким как Pd/C и Н 2 или гидридный источник, такой как LiAlH4 или NaBH4 или его активированная форма. Образовавшееся соединение формулы XVII алкилируют где X представляет удаляемую группу, в присутствии подходящего основания. X предпочтительно представляет галоген или сульфонат. Реакция алкилирования необязательно является ступенчатым алкилированием, аналогичным описанному выше ступенчатому алкилированию. Стадии алкилирования и превращения в цианопроизводное необязательно проводят в обратном порядке, так что превращение в цианопроизводное проводят до алкилирования. Повсеместно в описании и формуле изобретения термин алкил или C1-6-алкил относится к разветвленной или неразветвленной алкильной группе, имеющей от одного до шести атомов углерода, включительно, такой как метил, этил, 1-пропил, 2-пропил, 1-бутил, 2-бутил, 2-метил-2-пропил, 2,2-диметил-1 этил и 2-метил-1-пропил. Аналогично этому алкенил и алкинил, соответственно, обозначают такие группы, имеющие от двух до шести атомов углерода, включающие одну двойную связь и тройную связь, соответственно, такие как этенил, пропенил, бутенил, этинил, пропинил и бутинил. Термин арил относится к моно- или бициклической карбоциклической ароматической группе, такой как фенил и нафтил, в частности, фенил. Термин аралкил относится к арилалкильной группе, где арил и алкил имеют указанные выше значения. Галоген означает хлор, бром или иод. Соединение общей формулы I можно использовать в виде свободного основания или его фармацевтически приемлемой кислотно-аддитивной соли. В качестве кислотно-аддитивных солей можно использовать соли, образованные с органическими или неорганическими кислотами. Примерами таких органических солей являются соли с малеиновой, фумаровой, бензойной, аскорбиновой, янтарной, щавелевой,бисметиленсалициловой, метансульфоновой, этандисульфоновой, уксусной, пропионовой, винной, салициловой, лимонной, глюконовой, молочной, яблочной, миндальной, коричной, цитраконовой, аспарагиновой, стеариновой, пальмитиновой, итаконовой, гликолевой, п-аминобензойной, глутаминовой, бензолсульфоновой и теофиллинуксусной кислотами, а также 8-галогентеофиллином, например, 8 бромтеофиллином. Примерами таких неорганических солей являются соли с хлористо-водородной, бромисто-водородной, серной, сульфаминовой, фосфорной и азотной кислотами. Кислотно-аддитивные соли соединений можно получить способами, известными в данной области. Основание подвергают взаимодействию либо с вычисленным количеством кислоты в смешиваемом с водой растворителе, таком как ацетон или этанол, с последующим выделением соли концентрированием и охлаждением, либо с избытком кислоты в несмешиваемом с водой растворителе, таком как этиловый эфир, этилацетат или дихлорметан, с самопроизвольным выделением соли. Фармацевтические композиции изобретения можно вводить любым подходящим путем и в любой подходящей форме, например, перорально в форме таблеток, капсул, порошков или сиропов, или парентерально в форме обычных стерильных растворов для инъекций. Фармацевтические готовые препаративные формы изобретения можно получить общепринятыми способами в данной области. Таблетки можно получить, например, смешиванием активного ингредиента с обычными адъювантами и/или разбавителями и последующим прессованием смеси в обычной машине для таблетирования. Примеры адъювантов или разбавителей включают кукурузный крахмал, картофельный крахмал, тальк, стеарат магния, желатин, лактозу, камеди и тому подобное. Можно использовать любой другой адъювант или добавку, краситель, ароматизатор, консервант и тому подобное, при условии, что они являются совместимыми с активными ингредиентами. Растворы для инъекций можно получить растворением активного ингредиента и возможных добавок в части растворителя для инъекции, предпочтительно стерильной воде, регулированием раствора до нужного объема, стерилизацией раствора и наполнением его в подходящие ампулы или склянки. Можно добавить любую подходящую добавку, обычно используемую в данной области, такую как агенты тоничности, консерванты, антиоксиданты и т.д.-5 005674 Примеры Изобретение далее иллюстрируется следующими примерами. Пример 1. 5-Аминометил-1-(3-диметиламинопропил)-1-(4-фторфенил)-1,3-дигидроизобензофуран. 1-(3-Диметиламинопропил)-1-(4-фторфенил)-3-оксо-1,3-дигидроизобензофуран-5-карбонитрил (5,4 г, 16,2 ммоль) растворяют в сухом ТГФ (5 мл) и разбавляют сухим эфиром (50 мл). Этот раствор добавляют по каплям к кипящей с обратным холодильником суспензии литийалюминийгидрида (2,5 г, 65 ммоль) в сухом эфире (150 мл) на протяжении 10-15 мин, после чего образовавшуюся суспензию нагревают при кипячении с обратным холодильником в течение дополнительных 4 ч. Раствор оставляют для охлаждения до комнатной температуры и перемешивают при комнатной температуре в течение ночи. Реакционную смесь гасят минимальным количеством воды и образовавшийся раствор/суспензию сушат над безводным сульфатом магния. Смесь фильтруют и твердую лепешку промывают ТГФ. Объединенные фильтраты выпаривают, получая при этом масло. Масло растворяют в толуоле (200 мл) и перемешивают с водным раствором серной кислоты (10 мл, 70 об./об.%) в течение 3 ч. Смесь разбавляют водой и рН регулируют до 9 добавлением водного раствора аммиака (25 мас./об.%). Толуол отделяют и водную фазу экстрагируют следующей порцией толуола. Объединенные экстракты толуола сушат над безводным сульфатом магния, фильтруют и упаривают, получая при этом указанное в заголовке соединение в виде желтого масла (4,4 г, 84%). 1(дд, 2 Н). Пример 2. Циталопрам, НВr. Смесь 5-аминометил-1-(3-диметиламинопропил)-1-(4-фторфенил)-1,3-дигидроизобензофурана (10 г, 30 ммоль) и молекулярных сит 5 А (24 г) в пиридине (150 мл) перемешивают при 60 С в атмосфере кислорода. Добавляют хлорид меди (1) (1,8 г, 1,8 ммоль) и смесь перемешивают в течение 3 ч. Добавляют следующую порцию хлорида меди(1) (1,8 г, 1,8 ммоль) и смесь перемешивают в течение ночи. Смесь выливают на лед и рН смеси регулируют до 9 добавлением водного раствора аммиака (25 мас./об.%). Раствор разбавляют толуолом и фильтруют. Органическую фазу отделяют и водную фазу промывают дополнительным толуолом. Объединенные органические экстракты промывают водой, сушат над безводным сульфатом натрия и упаривают. Остаток обрабатывают гептаном и упаривают, получая при этом масло (11,1 г). Это масло растворяют в ацетоне и обрабатывают водной бромисто-водородной кислотой(7 мл, 47 мас./об.%). Раствор упаривают и остаток растворяют в изопропаноле (100 мл). Раствор перемешивают течение ночи. Образовавшийся осадок фильтруют и сушат, получая при этом соль с НВr циталопрама в виде белого порошка (8,2 г, 66%). Фильтрат упаривают и маслянистый остаток встряхивают с эфиром и оставляют на ночь. Фильтрование раствора дает дополнительную соль с НВr циталопрама в виде коричневого твердого вещества (1,7 г, 14%). 1H ЯМР (d6-DMSO):1,35-1,50 (м, 1 Н), 1,50-1,60 (м, 1 Н), 2,25 (т, 2 Н), 2,69 (с, 3 Н), 3,00-3,10 (м, 2 Н),5,17 (д, 1 Н), 5,25 (д, 1 Н), 7,18 (т, 2 Н), 7,61 (дд, 2 Н), 7,77 (д, 1 Н), 7,82 (д, 1 Н), 7,83 (с, 1 Н), 9,27 (уш.с, 1 Н). Пример 3. Метиловый эфир 1-(4-фторфенил)-3-оксо-1,3-дигидроизобензофуран-5-карбоновой кислоты Перемешиваемую суспензию 1-(4-фторфенил)-3-оксо-1,3-дигидроизобензофуран-5-карбоновой кислоты (1 г, 3,7 ммоль) в тионилхлориде (25 мл) нагревают при кипячении с обратным холодильником в течение 25 мин, во время такого кипячения твердое вещество растворяется. Тионилхлорид затем выпаривают и остаток растворяют с толуоле и снова выпаривают. Остаток перемешивают в метаноле (25 мл) в течение ночи, во время перемешивания образуется тяжелый осадок. Растворитель выпаривают и остаток распределяют между водным раствором аммиака (25 мас./об.%) и толуолом. Органическую фазу отделяют, сушат над сульфатом магния и упаривают, получая при этом указанное в заголовке соединение в виде белого твердого вещества (0,97 г, 92%). 1H ЯМР (d6-DMSO):3,92 (с, 3 Н), 6,85 (с, 1 Н), 7,26 (т, 2 Н), 7,42 (дд, 2 Н), 7,61 (д, 1 Н), 8,31 (дд, 1 Н),8,36 (с, 1 Н). Пример 4. Амид 1-(4-фторфенил)-3-оксо-1,3-дигидроизобензофуран-5-карбоновой кислоты. Перемешиваемую суспензию 1-(4-фторфенил)-3-оксо-1,3-дигидроизобензофуран-5-карбоновой кислоты (1 г, 3,7 ммоль) в тионилхлориде (25 мл) нагревают при кипячении с обратным холодильником в течение 25 мин, во время кипячения твердое вещество растворяется. Тионилхлорид затем выпаривают и остаток растворяют в толуоле и снова выпаривают. Остаток растворяют в толуоле (15 мл) и обрабатывают раствором аммиака в эфире, в результате чего образуется тяжелый осадок. Смесь перемешивают в течение ночи, разбавляют толуолом и водным раствором аммиака и фильтруют. Осадок сушат, получая при этом указанное в заголовке соединение в виде белого твердого вещества (0,80 г, 80%). 1-6 005674 Пример 5. 1-(4-Фторфенил)-3-оксо-1,3-дигидроизобензофуран-5-карбонитрил. Суспензию амида 1-(4-фторфенил)-3-оксо-1,3-дигидроизобензофуран-5-карбоновой кислоты (13,6 г, 0,05 моль) в тионилхлориде (40 мл) и ДМФ (0,25 мл) нагревают при кипячении с обратным холодильником в течение 2 ч. Тионилхлорид затем выпаривают и остаток растворяют в горячем IPA (100 мл). После охлаждения образуются кристаллы указанного в заголовке соединения. Выход: 7,8 г (62%). 1H ЯМР (d6-DMSO):6,87 (с, 1 Н), 7,26 (т, 2 Н), 7,42 (дд, 2 Н), 7,58 (д, 1 Н), 8,18 (дд, 1 Н), 8,48 (с, 1 Н). Пример 6. 5-Бромметил-1-(4-фторфенил)-1,3-дигидроизобензофуран. Суспензию 5-гидроксиметил-1-(4-фторфенил)-1,3-дигидроизобензофурана (2 г, 8,2 ммоль) в толуоле (20 мл) нагревают до растворения твердого вещества. Нагревание затем прекращают. Добавляют тионилбромид (2,2 г, 10,6 ммоль) и смесь перемешивают в течение часа. Добавляют диоксид кремния (25 г) и смесь фильтруют и остаток промывают раствором 1:1 (об./об.) этилацетата и гептана. Фильтрат выпаривают, получая при этом указанное в заголовке соединение в виде красно-оранжевого масла. (2,6 г,90%). 1H ЯМР (d6-DMSO):4,72 (с, 2 Н), 5,11 (д, 1 Н), 5,28 (д, 1 Н), 6,17 (с, 1 Н), 7,04 (д, 1 Н), 7,17 (т, 2 Н),7,33 (д, 1 Н), 7,38 (дд, 2 Н), 7,45 (с, 1 Н). Пример 7. 5-Аминометил-1-(4-фторфенил)-1,3-дигидроизобензофуран. Суспензию 5-бромметил-1-(4-фторфенил)-1,3-дигидроизобензофурана (1,96 г, 6,4 ммоль) перемешивают в жидком, повторно перегнанном аммиаке (200 мл) в атмосфере азот/аммиак при -33 С в течение 2,5 дней. Аммиаку дают возможность испариться и остаток перемешивают со смесью этилацетата и водной серной кислоты (2 М). Водную фазу отделяют и промывают эфиром. Водную фазу затем подщелачивают до рН 9 с использованием водного раствора гидроксида аммония (25 мас./об.%) и экстрагируют толуолом. Экстракты в толуоле сушат над безводным сульфатом магния и упаривают, получая при этом указанное в заголовке соединение в виде желто-оранжевого масла (0,63 г, 40%). 1H ЯМР (d6-DMSO):3,72 (с, 2 Н), 5,09 (д, 1 Н), 5,25 (дд, 1 Н), 6,14 (с, 1 Н), 6,96 (д, 1 Н), 7,17 (т, 2 Н),7,20 (д, 1 Н), 7,32 (с, 1 Н), 7,36 (дд, 2 Н). Пример 8. Циталопрам. К перемешиваемому раствору 5-аминометил-1-(3-диметиламинопропил)-1-(4-фторфенил)-1,3 дигидроизобензофурана (0,5 г, 1,5 ммоль) в дихлорметане (10 мл) добавляют водный раствор бисульфата калия и гидроксида натрия (19 мл, 0,2 М в K2S2O8, 3,8 ммоль; 0,4 М в NaOH, 7,6 ммоль) с последующим добавлением водного раствора сульфата никеля (1,5 мл, 40 мМ, 61 мкмоль). Смесь энергично перемешивают в течение 4 дней и затем фильтруют через целит. Фильтрат распределяют между водной серной кислотой (2 М) и толуолом. Водный слой отделяют и рН смеси регулируют до 9 добавлением водного раствора аммиака (25 мас./об.%). Раствор экстрагируют толуолом и этот последний экстракт в толуоле сушат над сульфатом магния и упаривают, получая при этом свободное основание циталопрама в виде очень бледно-желтого масла (0,35 г, 70%). Пример 9. 1-(4-Фторфенил)-3-оксо-1,3-дигидроизобензофуран-5-карбоновая кислота. Цинк (38 г, 0,58 моль) суспендируют в уксусной кислоте (400 мл). Смесь нагревают до 60 С, порциями по 5 г добавляют 2,4-дикарбокси-4'-фторбензофенон (21 г, 0,075 моль). После добавления реакционную смесь нагревают при температуре флегмы в течение двух часов. Суспензию фильтруют, пока она остается еще горячей. Фильтрат добавляют к смеси лед-вода (1 кг) и указанное в заголовке соединение выделяют фильтрованием. Выход 17,8 г (90%). 1H ЯМР (d6-DMSO):6,84 (с, 1 Н), 7,17 (т, 2 Н), 7,43 (дд, 2 Н), 7,59 (д, 1 Н), 8,31 (д, 1 Н), 8,35 (с, 1 Н). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения циталопрама, включающий взаимодействие соединения формулы IV-7 005674 который выделяют в виде основания или его фармацевтически приемлемой соли. 2. Способ по п.1, отличающийся тем, что промежуточный продукт формулы IV получают активацией спирта формулы VIII замещенным сульфонатом или превращением спирта в бензилгалогенид или другое активированное производное с последующим аминолизом с образованием соединения формулы IV 3. Способ по п.2, отличающийся тем, что промежуточное соединение формулы VIII получают взаимодействием соединения формулы VII с восстанавливающим агентом. 4. Способ по п.3, отличающийся тем, что промежуточное соединение формулы VII получают алкилированием соединения формулы VI необязательно, ступенчатым алкилированием. 5. Способ по п.4, отличающийся тем, что промежуточное соединение формулы VI получают взаимодействием соединения формулы V со спиртом R-OH в присутствии дегидратирующего агента. 6. Способ по п.1, отличающийся тем, что промежуточное соединение формулы IV получают взаимодействием соединения формулы Х с восстанавливающим агентом с последующей циклизацией с образованием соединения формулы IV 7. Способ по п.6, отличающийся тем, что промежуточное соединение формулы Х получают алкилированием соединения формулы IX необязательно, ступенчатым алкилированием. 8. Способ по п.7, отличающийся тем, что промежуточное соединение формулы IX получают взаимодействием соединения формулы V с дегидратирующим агентом, таким как тионилхлорид, с последующим аминолизом образовавшегося активированного производного кислоты. 9. Способ по п.1, отличающийся тем, что промежуточное соединение формулы IV получают взаимодействием соединения формулы XII с восстанавливающим агентом с последующей циклизацией с образованием соединения формулы IV-9 005674 10. Способ по п.9, отличающийся тем, что промежуточное соединение формулы XII получают алкилированием соединения формулы XI необязательно, ступенчатым алкилированием. 11. Способ по п.10, отличающийся тем, что промежуточное соединение формулы XI получают превращением соединения формулы V 13. Способ получения промежуточного продукта по п.12, включающий реакцию циклизации соединения формулы XIII с подходящим восстанавливающим агентом. 14. Способ по п.13, где восстанавливающим агентом является Zn в кислоте, предпочтительно уксусной кислоте. 15. Способ по п.1, отличающийся тем, что промежуточное соединение формулы IV получают алкилированием соединения формулы XVII необязательно, ступенчатым алкилированием с образованием соединения формулы IV- 10005674 16. Способ по п.15, отличающийся тем, что промежуточное соединение формулы XVII получают аминолизом соединения формулы XVI 17. Способ по п. 16, отличающийся тем, что промежуточное соединение формулы XVI получают активацией спирта формулы XV замещенным сульфонатом или превращением спирта в бензилгалогенид или другое активированное производное. 18. Способ по п.17, отличающийся тем, что промежуточное соединение формулы XV получают взаимодействием кетона формулы XIII с восстанавливающим агентом с последующей циклизацией с образованием соединения формулы XV.
МПК / Метки
МПК: C07D 307/87
Метки: получения, циталопрама, способ
Код ссылки
<a href="https://eas.patents.su/12-5674-sposob-polucheniya-citaloprama.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения циталопрама</a>
Предыдущий патент: Новые неочищенные и кристаллические формы гидрохлорида лерканидипина
Следующий патент: Способ извлечения металлов из халькопиритсодержащих руд
Случайный патент: Машина для приготовления горячих напитков, в частности, супов












