Способ получения полиакриламидных гранул, полиакриламидные гранулы и их применение
Формула / Реферат
1. Способ получения полиакриламидных гранул, содержащих инкапсулированные клетки и характеризующихся прочностью по меньшей мере 200 мН, включающий следующие стадии:
(1) получение водного раствора смеси акриловых мономеров,
(2) получение суспензии клеток в водном растворе персульфата,
(3) получение эмульсии водного раствора третичного амина в несмешивающейся с водой жидкости,
(4) смешивание раствора, полученного на стадии (1), и суспензии, полученной на стадии (2),
(5) добавление смеси, полученной на стадии (4), в перемешиваемую эмульсию, полученную на стадии (3),
(6) полимеризация смеси акриловых мономеров и одновременное инкапсулирование клеток с образованием полиакриламидных гранул, содержащих инкапсулированные клетки,
(7) выделение полученных полиакриламидных гранул.
2. Способ по п.1, в котором размер полиакриламидных гранул составляет от 0,05 до 3 мм.
3. Способ по п.2, в котором размер полиакриламидных гранул составляет от 0,1 до 1,5 мм, а механическая прочность по крайней мере 300 мН.
4. Способ по любому из пп.1-3, в котором массовое соотношение сухие клетки/смесь акриловых мономеров составляет от 0,001:1 до 1:1.
5. Способ по любому из пп.1-4, в котором массовое соотношение сухие клетки/смесь акриловых мономеров составляет от 0,2:1 до 0,9:1.
6. Способ по любому из пп.1-5, в котором клеткой является бактериальная клетка.
7. Способ по п.6, в котором клеткой является бактериальная клетка группы нокардиоформы актиномицетов или семейства Enterobacteriacea.
8. Способ по любому из пп.1-7, в котором третичным амином является N,N,N',N'-тетраметилэтилендиамин или 3-(диметиламино)пропионитрил.
9. Способ по любому из пп.1-8, в котором несмешивающейся с водой жидкостью является минеральное масло.
10. Способ по любому из пп.1-9, в котором используется поверхностно-активное вещество.
11. Полиакриламидные гранулы, содержащие инкапсулированные клетки, полученные способом по любому из пп.1-10, причем механическая прочность полиакриламидных гранул составляет по крайней мере 200 мН.
12. Полиакриламидные гранулы по п.11, в которых инкапсулированными клетками являются клетки штамма рода Rhodococcus, включающие нитрилгидратазу.
13. Применение полиакриламидных гранул по п.11 или 12 в качестве биокатализатора для превращения нитрильного субстрата в соответствующий амид.
Текст
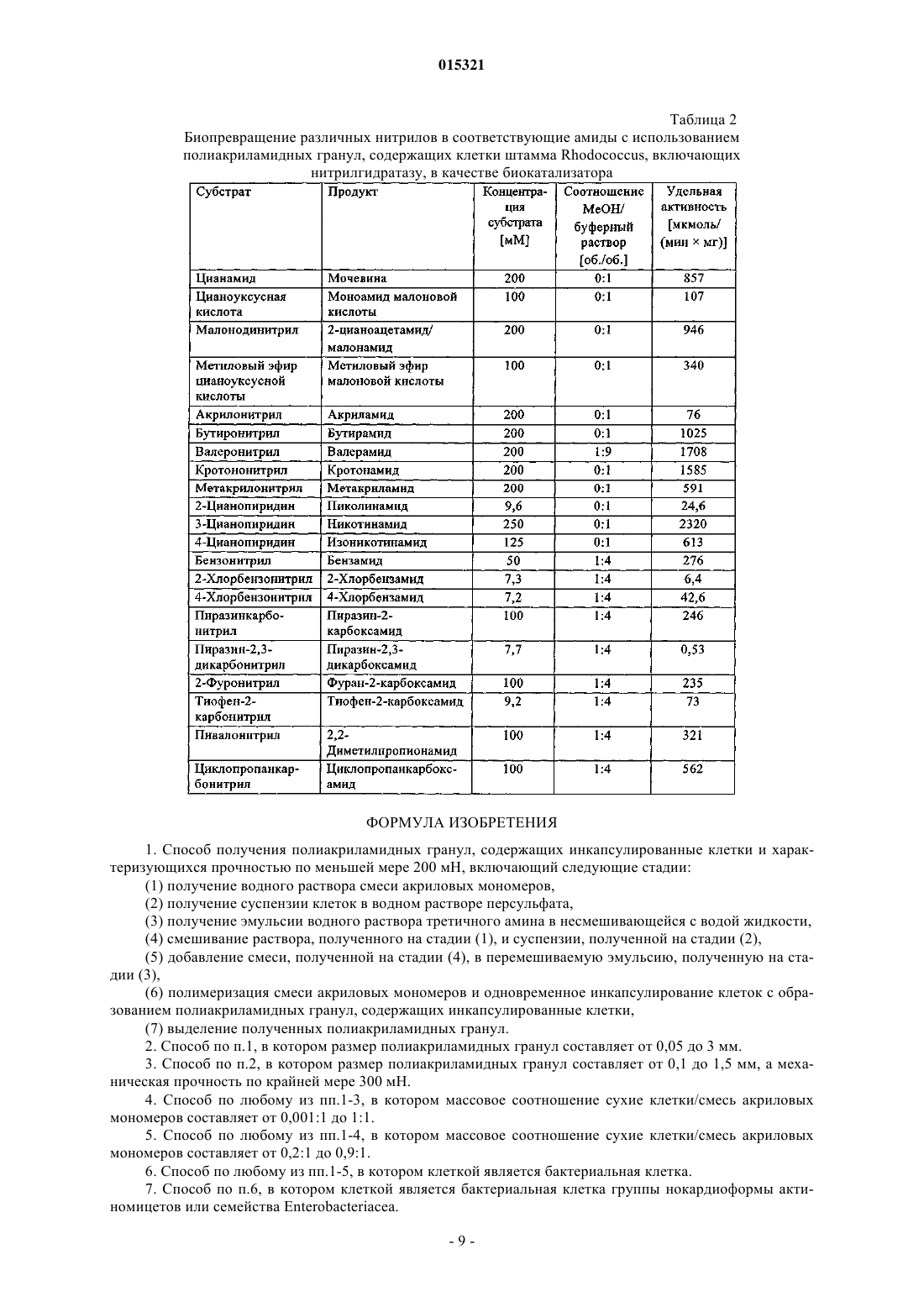
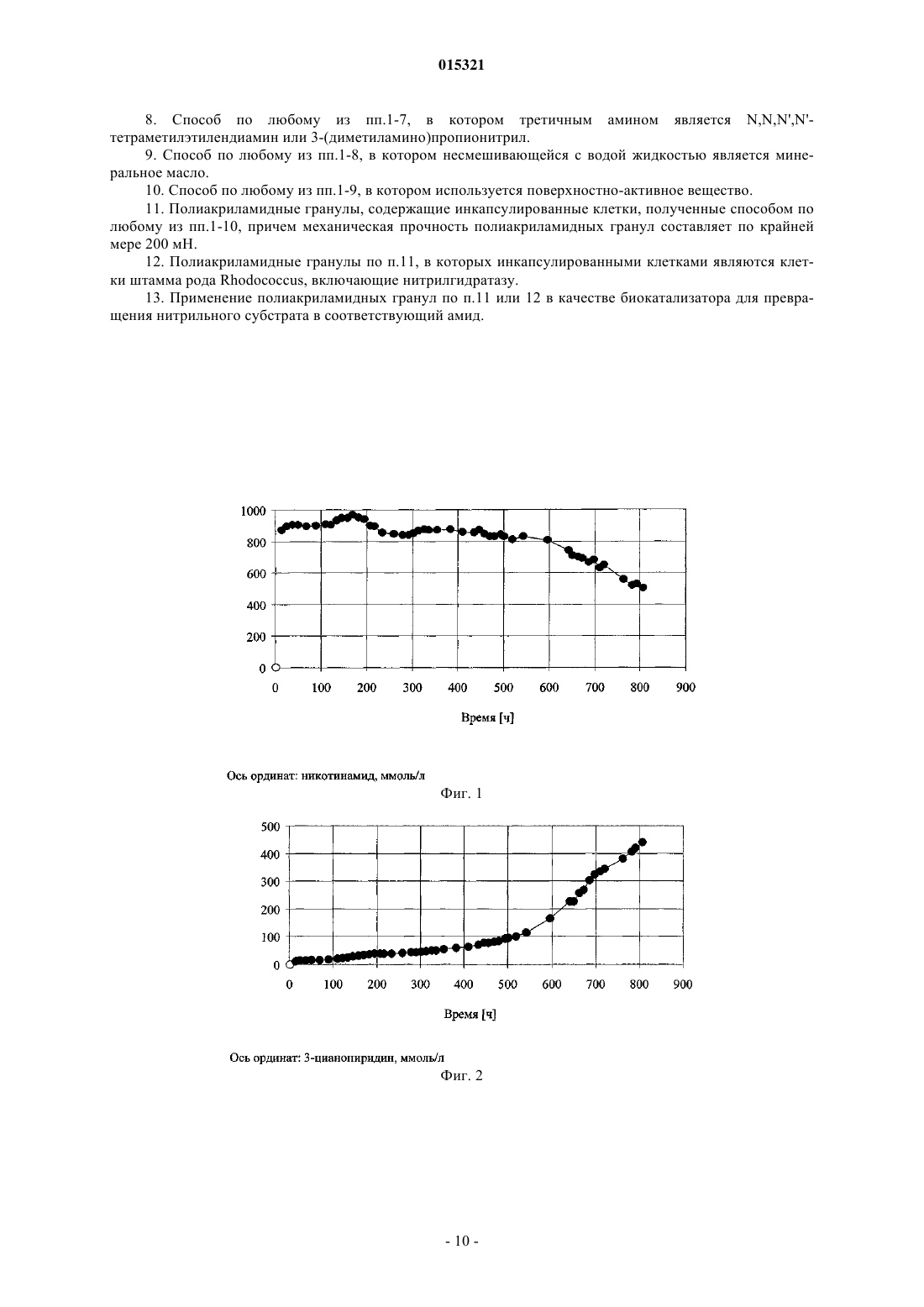
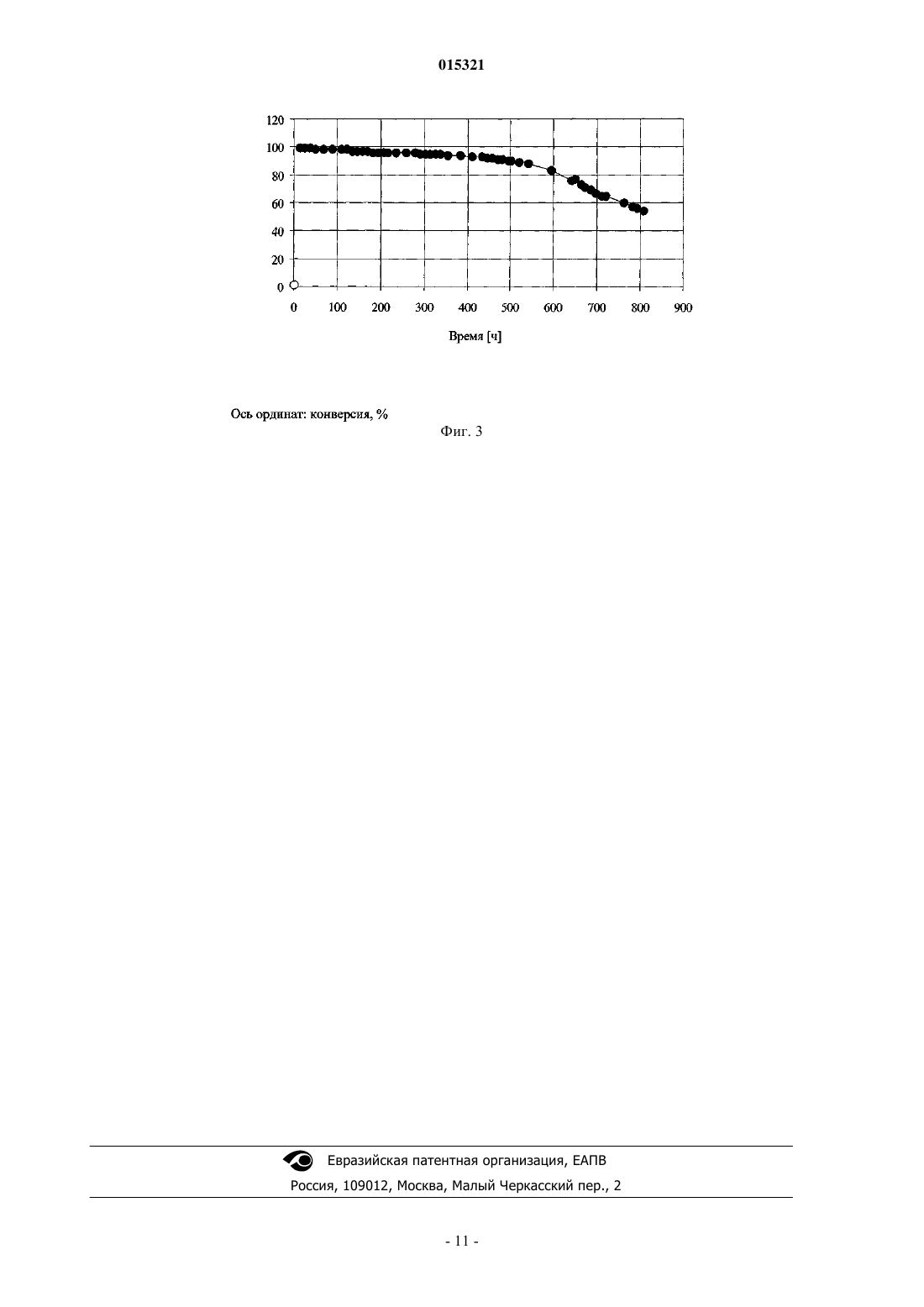
СПОСОБ ПОЛУЧЕНИЯ ПОЛИАКРИЛАМИДНЫХ ГРАНУЛ, ПОЛИАКРИЛАМИДНЫЕ ГРАНУЛЫ И ИХ ПРИМЕНЕНИЕ Полиакриламидные гранулы, содержащие инкапсулированные клетки, получают способом,включающим следующие стадии: (1) получение водного раствора смеси акриловых мономеров,(2) получение суспензии клеток в водном растворе персульфата, (3) получение эмульсии водного раствора третичного амина в несмешивающейся с водой жидкости, которая необязательно содержит поверхностно-активное вещество (ПАВ), (4) смешивание раствора, полученного на стадии (1), и суспензии, полученной на стадии (2), (5) добавление смеси, полученной на стадии (4), в перемешиваемую эмульсию, полученную на стадии (3), и (6) полимеризация смеси акриловых мономеров и одновременное инкапсулирование клеток с образованием полиакриламидных гранул, содержащих инкапсулированные клетки. 015321 Настоящее изобретение относится к полиакриламидным гранулам, содержащим инкапсулированные клетки, к способу их получения и применения в качестве биокатализатора. Полиакриламидные гранулы, содержащие инкапсулированные клетки, можно использовать в качестве биокатализатора для различных биопревращений в зависимости от ферментов, содержащихся в клетках. Например, полиакриламидные гранулы, содержащие инкапсулированные бактериальные клетки штамма Rhodococcus, включающие нитрилгидратазу, можно использовать для превращения нитрилов в амиды. В статье Nilsson и др. (Biochim. Biophys. Acta, 268, 253-256 (1972 описаны полиакриламидные гранулы, содержащие ферменты. Раствор персульфата аммония (0,25 г, 1,1 ммоль) в буферном растворе триэтаноламин-HCl (0,05 М, рН 7,0, 0,5 мл) и N,N,N',N'-тетраметилэтилендиамин (0,5 мл, 0,385 мг,3,3 ммоль) добавляли в раствор (60 мл) трипсина (60 мг), акриламида (8,55 г, 120 ммоль) иN,N'-метилен-бис-акриламида (0,45 г, 2,9 ммоль) в буферном растворе триэтаноламин-HCl (0,05 М,рН 7,0). Раствор выливали в перемешиваемую смесь органических растворителей (толуол/хлороформ,290:110, 400 мл), содержащую сесквиолеат сорбита (1 мл). Полимеризацию проводили при 4 С в течение 30 мин. В статье Nilsson и др. (Biochim. Biophys. Acta, 268, 253-256 (1972 не описано инкапсулирование клеток в полиакриламидные гранулы. В патенте Mosbach и др. (US 4647536 А) описан способ получения различных полимерных гранул,содержащих инкапсулированные клетки, причем в качестве водно-нерастворимой фазы использовали животные масла, растительные масла, трибутилфосфат, силиконовое масло, парафиновое масло или дибутиловый эфир фталевой кислоты. Полиакриламидные гранулы, содержащие дрожжевые клетки или ферменты, получали при растворении акриламида (17,6 г, 248 ммоль) и N,N'-метилен-бис-акриламида(1,2 г, 8 ммоль) в трис-буферном растворе (100 мл, 0,05 М, рН 7), затем перемешивали полученный раствор (8 мл) в смеси с дрожжевыми клетками или ферментами (например, перокисдазой, 10 мг/мл, 2 мл) и персульфатом аммония (0,4 г/мл, 20 мкл, 8 мг, 0,03 ммоль) и диспергировали смесь в соевом масле(40 мл). Затем добавляли N,N,N',N'-тетраметилэтилендиамин (100 мкл, 77,0 мг, 0,66 ммоль) и получали гранулы пригодного размера. Объектом настоящего изобретения является получение полиакриламидных гранул, содержащих клетки, и способ их получения. Указанная цель достигается при получении полиакриламидных гранул по п.12 с использованием способа по п.1. Способ по настоящему изобретению для получения полиакриламидных гранул, содержащих инкапсулированные клетки, включает следующие стадии:(1) получение водного раствора смеси акриловых мономеров,(2) получение суспензии клеток в водном растворе персульфата,(3) получение эмульсии водного раствора третичного амина в несмешивающейся с водой жидкости,которая необязательно содержит поверхностно-активное вещество (ПАВ),(4) смешивание раствора, полученного на стадии (1), и суспензии, полученной на стадии (2),(5) добавление смеси, полученной на стадии (4), в перемешиваемую эмульсию, полученную на стадии (3), и(6) полимеризация смеси акриловых мономеров и одновременное инкапсулирование клеток с образованием полиакриламидных гранул, содержащих инкапсулированные клетки. Преимущество способа по настоящему изобретению заключается в том, что перед добавлением акриловых мономеров, клеток и персульфата в несмешивающуюся с водой жидкость уже добавлен третичный амин. Полиакриламидные гранулы, полученные способом по настоящему изобретению, имеют сферическую или практически сферическую форму. Размер полиакриламидных гранул составляет от 0,01 до 5 мм, а механическая прочность по крайней мере 10 мН. Размер полиакриламидных гранул предпочтительно составляет от 0,05 до 3 мм, а механическая прочность по крайней мере 200 мН, более предпочтительно размер составляет от 0,1 до 1.5 мм, а механическая прочность по крайней мере 300 мН. Механическую прочность измеряют, оказывая давление на гранулу, расположенную между пластинами, до разрыва гранулы. В качестве клеток можно использовать бактериальные клетки, грибковые клетки, дрожжевые клетки, растительные клетки или клетки млекопитающих. Клетками предпочтительно являются бактериальные клетки, более предпочтительно бактериальные клетки актиномицетов группы нокардиоформа или бактерии семейства Enterobacteriaceae. Еще более предпочтительными клетками являются бактерии родаRhodococcus или Escherichia и наиболее предпочтительными клетками являются бактерии родаRhodococcus. Примеры бактерий включают грамположительные бактерии, такие как род Bacillus, Acetobacterium,Actinomyces, Arthrobacter, Corynebacterium, Gordona, Nocardia, Rhodococcus или Amycolatopsis, и грамотрицательные бактерии рода Acetobacter, Agrobacterium, Alcaligenes, Comamonas, Gluconobacter, Pseudomonas, Rhizobium, Citrobacter, Enterobacter, Escherichia или Klebsiella.-1 015321 Примеры бактерий группы актиномицетов группы нокардиоформа включают Gordona, Nocardia,Rhodococcus и Amycolatopsis. Примеры бактерий семейства Enterobacteriaceae включают бактерии родаCitrobacter, Enterobacter, Escherichia и Klebsiella. Клетки культивируют известными методами. Бактериальные клетки могут содержать ген, кодирующий исследуемый фермент в хромосоме, или их можно встраивать в плазмиду, содержащую ген, кодирующий исследуемый фермент. Если бактериальные клетки содержат ген, кодирующий исследуемый фермент в хромосоме, и этот фермент является катаболическим ферментом, то бактериальные клетки культивируют в присутствии пригодного индуктора фермента. Например, клетки штамма рода Rhodococcus культивируют в присутствии индуктора нитрилгидратазы, который индуцирует экспрессию нитрилгидратазы. Примеры пригодных индукторов нитрилгидратазы штамма рода Rhodococcus включат метакриламид, кротонамид и пропионамид. Если бактериальные клетки трансформированы плазмидой, содержащей ген, кодирующий исследуемый фермент, и этот ген регулируется индуцибельным промотером, то транскрипцию гена, кодирующего исследуемый фермент, можно индуцировать в определенный момент времени в процессе культивирования. Примеры индуцибельных промотеров включают trp, lac, tac, чувствительные к арабинозе и рамнозе промотеры. Индукция зависит от используемого промотера. Например, чувствительный к рамнозе промотер индуцируют при добавлении L-рамнозы. После культивирования клетки, содержащие исследуемый фермент, можно отделить от ферментационной среды. Предпочтительно клетки хранят в соответствующем буферном растворе при температуре ниже 5 С. Смесь акриловых мономеров содержит по крайней мере один монофункциональный и по крайней мере один бифункциональный акриловый мономер. Монофункциональным акриловым мономером является мономер формулы где R1 означает Н или метил,R2 выбирают из группы, включающей NH2, NHR3, N(R3)2, NH-(CH2)n-N(R3)2 и O-(CH2)n-N(R3)2,R1 в каждом случае означает С 1-С 4 алкил, аn равно целому числу от 1 до 4. Примеры монофункциональных акриловых мономеров включают акриламид (R1 означает Н, R2 означает NH2), метакриламид (R1 означает метил, R2 означает NH2), N-алкилакриламиды (R1 означает Н, R2 означает NHR3, R3 означает C1-С 4-алкил), такой как N-этилакриламид (R3 означает этил),N-изопропилакриламид (R3 означает изопропил) или N-трет-бутилакриламид (R3 означает трет-бутил),N-алкилметакриламиды (R1 означает метил, R2 означает NHR3, R3 означает C1-С 4-алкил), такие какN-Алкилакриламиды, N-алкилметакриламиды, N,N-диалкилакриламиды, N,N-диалкилметакриламиды, N-[(диалкиламино)алкил]акриламиды, N-[(диалкиламино)алкил]метакриламиды, (диалкиламино)аклилакрилаты и (диалкиламино)алкилакрилаты можно получить известными методами, например при взаимодействии акрилоилхлорида, метилакрилата, метакрилоилхлорида или метилметакрилата с соответствующим алкиламином, диалкиламином или (диалкиламино)алкиламином или (диалкиламино)спиртом.-2 015321 Бифункциональными акриловыми мономерами являются мономеры формулыn равно целому числу от 1 до 4. Примеры бифункциональных акриловых мономеров включают N,N'-метилен-бис-акриламид (R1 означает Н, -Х- означает -(СН 2)n-, n равно 1), N,N'-метилен-бис-метакриламид (R1 означает метил, -Х- означает (CH2)n, n равно 1), N,N'-этилен-бис-акриламид (R1 означает Н, -Х- означает -(CH2)n-, n равно 2), N,N'этилен-бис-метакриламид (R1 означает метил, -Х- означает -(CH2)n-, n равно 2), N,N'-пропиленбисакриламид (R1 означает Н, -Х- означает -(CH2)n-, n равно 3) и N,N'-(1,2-дигидроксиэтилен)-бисакриламид (R1 означает Н, -Х- означает -(СН-ОН)n-, n равно 2). Бифункциональные акриловые мономеры можно получить известными методами, например бифункциональные акриловые мономеры, в которых -X-означает -(CH2)n-, получают при взаимодействии акрилоилхлорида, метилакрилата, метакрилоилхлорида или метилметакрилата с соответствующим диамином. Предпочтительный бифункциональный акриловый мономер выбирают из группы, включающейN,N'-метилен-бис-акриламид, N,N'-метилен-бис-метакриламид и N,N'-(1,2-дигидроксиэтилен)-бисакриламид, а монофункциональный мономер выбирают из группы, включающей акриламид, метакриламид, N,N-диалкилакриламиды, N-[(диалкиламино)алкил]метакриламиды, (диалкиламино)алкилакрилаты и (диалкиламино)алкилметакрилаты. Более предпочтительно в качестве бифункционального мономера используют N,N'-метиленбисакриламид, а монофункциональный мономер выбирают из группы, включающей акриламид, N,N-диметилакриламид, N-[3-(диметиламино)пропил]метакриламид и 2-(диметиламино)этилметакрилат. Персульфатом является любой водорастворимый персульфат. Примеры водорастворимых персульфатов включают персульфат аммония и персульфаты щелочных металлов. Примеры щелочных металлов включают литий, натрий и калий. Предпочтительно используют персульфат аммония или персульфат калия, более предпочтительно персульфат аммония. Третичным амином является любой водорастворимый третичный амин. Предпочтительным третичным амином является N,N,N',N'-тетраметилэтилендиамин или 3-(диметиламино)пропионитрил, более предпочтительно N,N,N',N'-тетраметилэтилендиамин. Несмешивающейся с водой жидкостью является любой несмешивающийся с водой материал, который является жидкостью при температуре полимеризации. Примеры несмешивающихся с водой жидкостей включают минеральные масла, растительные масла и синтетические масла. Примеры минеральных масел включают толуол, ксилол, деароматизированные смеси углеводородов, такие как продукт ExxsolD100, и изопарафиновые смеси, такие как продукт Isopar M. Примеры растительных масел включают подсолнечное масло, оливковое масло, арахисовое масло, миндальное масло, сафлоровое масло, соевое масло и кукурузное масло. Пример синтетического масла включает силиконовое масло. Предпочтительной несмешивающейся с водой жидкостью является минеральное масло, более предпочтительно насыщенный углеводород или их смесь, наиболее предпочтительно смесь деароматизированных углеводородов или изопарафиновая смесь. Несмешивающаяся с водой жидкость необязательно содержит ПАВ, которым является любое пригодное ПАВ. Примеры пригодных ПАВ включают неионные ПАВ, такие как сложные эфиры жирных кислот и сорбита, эфиры жирных кислот и полиэтиленгликоля, эфиры жирных кислот и этиленгликоля или эфиры жирных кислот и глицерина, а также катионные ПАВ, такие как соли тетраалкиламмония, в которых по крайней мере одна алкильная группа содержит по крайней мере 8 атомов углерода. Примеры жирных кислот включают олеиновую кислоту и стеариновую кислоту. Примеры алкильных групп включают этил, пропил и бутил. Примеры алкильных групп, содержащих по крайней мере 8 атомов углерода,включают октил, нонил и децил. Соотношение ПАВ/масло составляет вплоть до 0,10:1 (мас./мас.). В предпочтительных вариантах ПАВ не используется. Водный раствор смеси акриловых мономеров можно получить при растворении акриловых мономеров в воде или буферном растворе. Суспензию клеток в водном растворе персульфата получают при смешивании раствора персульфата в воде или буферном растворе с суспензией клеток в воде или буферном растворе. Предпочтительно сначала растворяют акриловые мономеры в буферном растворе и клетки суспендируют, затем рН суспензии доводят до величины в диапазоне от 5 до 10, то есть до рН, оптимального для исследуемого фермента. Например, оптимальная величина рН для нитрилгидратазы из штамма Rhodococcus составляет диапазон от 6 до 8. Эмульсию водного раствора третичного амина в несмешивающейся в воде жидкости получают при-3 015321 эмульгировании раствора третичного амина в воде или буферном растворе в несмешивающейся с водой жидкости. В предпочтительном варианте водный раствор акриловых мономеров, суспензию клеток в водном растворе персульфата и эмульсию водного раствора третичного амина в несмешивающейся с водой жидкости, которая необязательно содержит ПАВ, дегазируют (удаляют кислород), например продувают азотом. Водный раствор смеси акриловых мономеров смешивают с суспензией клеток в водном растворе персульфата, затем немедленно добавляют по каплям в перемешиваемую эмульсию водного раствора третичного амина в несмешивающейся с водой жидкости. Примеры пригодных смесителей включают трех- или четырехшаговые лопастные турбинные мешалки, пропеллерные мешалки или струйные смесители Visco-jet, причем предпочтительным является смеситель Visco-jet. Полимеризацию предпочтительно проводят при температуре от 5 до 35, более предпочтительно от 15 до 25 и наиболее предпочтительно от 18 до 22 С. При полимеризации используют следующие предпочтительные соотношения. Предпочтительное соотношение смеси акриловые мономеры/вода составляет от 0,05:1 до 0,5:1 (мас./мас.), более предпочтительно от 0,1:1 до 0,3:1 (мас./мас.), наиболее предпочтительно от 0,2:1 до 0,28:1 (мас./мас.). Предпочтительное соотношение смеси бифункциональные акриловые мономеры/монофункциональные акриловые мономеры составляет от 0,001:1 до 0,8:1 (мол./мол.), более предпочтительно от 0,01:1 до 0,08:1 (мол./мол.), наиболее предпочтительно от 0,03:1 до 0,06:1 (мол./мол.). Предпочтительное соотношение сухие клетки/смесь акриловых мономеров составляет от 0,001:1 до 1:1 (мас./мас.), более предпочтительно от 0,2:1 до 0,9:1 (мас./мас.), еще более предпочтительно от 0,4 до 0,8:1 (мас./мас.), наиболее предпочтительно от 0,5:1 до 0,7:1 (мас./мас.). Предпочтительное соотношение персульфат/смесь акриловых мономеров составляет от 0,0001:1 до 0,1:1 (мол./мол.), более предпочтительно от 0,001:1 до 0,05:1 (мол./мол.), наиболее предпочтительно от 0,002:1 до 0,03:1 (мол./мол.). Предпочтительное соотношение третичный амин/персульфат составляет от 0,2:1 до 50:1 (мол./мол.), более предпочтительно от 0,8:1 до 10:1 (мол./мол.), наиболее предпочтительно от 1:1 до 5:1 (мол./мол.). Предпочтительное соотношение масло/вода составляет от 1,2:1 до 10:1 (мас./мас.), более предпочтительно от 1,3:1 до 7:1 (мас./мас.), еще более предпочтительно от 1,4:1 до 5:1 (мас./мас.), наиболее предпочтительно от 1,5:1 до 4:1 (мас./мас.). Полиакриламидные гранулы, полученные после полимеризации, предпочтительно отделяют, например, декантацией или фильтрованием. Отделенные гранулы можно промыть водой или водным раствором для удаления следов несмешивающейся с водой жидкости, и их можно хранить в соответствующем буферном растворе. Другим объектом осуществления настоящего изобретения являются полиакриламидные гранулы,содержащие инкапсулированные клетки, полученные способом по настоящему изобретению. Инкапсулированными клетками предпочтительно являются клетки штамма Rhodococcus, содержащие нитрилгидратазу. Еще одним объектом настоящего изобретения является применение описанных выше полиакриламидных гранул, содержащих инкапсулированные клетки, в качестве биокатализатора для превращения субстрата в продукт. Предпочтительным субстратом является нитрил, а продуктом - соответствующий амид. Более предпочтительным субстратом является 3-цианопиридин, а продуктом никотинамид. Примеры нитрилов включают цианамид, цианоуксусную кислоту, малонодинитрил, метиловый эфир цианоуксусной кислоты, акрилонитрил, бутиронитрил, валеронитрил, кротононитрил, метакрилонитрил, 2-цианопиридин, 3-цианопиридин, 4-цианопиридин, бензонитрил, 2-хлорбензонитрил, 4 хлорбензонитрил, пиразинкарбонитрил, пиразин-2,3-дикарбонитрил, 2-фуронитрил, тиофен-2 карбонитрил, пивалонитрил и циклопропанкарбонитрил. Превращение проводят в статистическом режиме или в непрерывном режиме. Реакцию предпочтительно проводят в пригодном буферном растворе при температуре от 10 до 35 С. На фиг. 1 показана зависимость концентрации никотинамида в реакционной смеси от времени в процессе превращения 3-цианопиридина в никотинамид в непрерывном режиме; на фиг. 2 показана зависимость концентрации 3-цианопиридина в реакционной смеси от времени в процессе превращения 3-цианопиридина в никотинамид в непрерывном режиме; на фиг. 3 показана зависимость конверсии 3-цианопиридина в никотинамид от времени в процессе превращения 3-цианопиридина в никотинамид в непрерывном режиме. Пример 1. Культивирование штамма Rhodococcus. 1.1. Получение прекультуры. В стерильную среду (200 мл, рН 7,0), содержащую 1,25 мас.% дрожжевого экстракта, 0,05 мас.%KH2PO4, высеивали культуру штамма Rhodococcus из слоя агара с культурой. Прекультуру культивиро-4 015321 вали в колбе Эрленмейера (500 мл) при 28 С и 120 об/мин в течение 48 ч. 1.2. Получение культуры. В стерильную среду (12 л, рН 7,0), содержащую 1,25 мас.% дрожжевого экстракта, 0,05 мас.%KH2PO4, высеивали прекультуру (200 мл) штамма Rhodococcus, полученную, как описано в примере 1.1. Клетки культивировали в ферментере (12 л) при 28 С, рН 7,0, при концентрации растворенного кислорода 40% (в расчете на концентрацию растворенного кислорода в 1 об. воздуха/(объем ферментационной средымин), 28 С) и при 300-400 об/мин в течение 48 ч. Клетки собирали центрифугированием, промывали фосфатным буферным раствором (50 мМ, рН 7,0), концентрировали до 15-20 мас.% сухих клеток и хранили при -40 С. Пример 2. Определение активности нитрилгидратазы в культуре штамма Rhodococcus. Полиакриламидные гранулы, содержащие инкапсулированные клетки штамма Rhodococcus (0,2 г влажного материала), добавляли в раствор 3-цианопиридина (1,59 г) в фосфатном буферном растворе(0,05 М, рН 7,0, 30 мл) при 25 С. Образцы на анализ (1000 мкл) отбирали через 5 и 15 мин. Указанные образцы немедленно смешивали с 20 мкл H2SO4 (48 мас.%), разбавляли в 100 раз по объему смесью метанол/вода, 40:60 (об./об.), фильтровали (диаметр пор 0,2 мкм) и анализировали методом ЖХВР (колонка С 8 для обращенно-фазовой хроматографии, скорость потока 1 мл/мин, элюент: метанол/вода,40:60 (об./об.), детектирование при 210 нм, 25 С). После высушивания влажного биокатализатора при 55 С и 20 мбар в течение 4 ч получали сухие полиакриламидные гранулы. Пример 3. Инкапсулирование клеток штамма Rhodococcus в полиакриламидные гранулы. Акриламид (42,25 г, 594 ммоль), N,N'-метилен-бис-акриламид (3,75 г, 24 ммоль) и 2-(диметиламино)этилметакрилат (1,5 г, 9 ммоль) растворяли в фосфатном буферном растворе (37,5 г, 50 мМ,рН 7,0) и рН раствора доводили до 7,0. Раствор персульфата аммония (0,465 г, 2 ммоль) в дистиллированной воде (5 г) добавляли в суспензию клеток штамма Rhodococcus (20 мас.% сухих клеток, 165 г),полученную, как описано в примере 1. Раствор N,N,N',N'-тетраметилэтилендиамина (0,232 г, 2 ммоль) в дистиллированной воде (5 г) диспергировали в минеральном масле (Exxsol D100, 350 г) в реакторе объемом 1 л при 350 об/мин. Раствор мономеров, суспензию клеток и масло (каждый компонент в отдельности) продували азотом в течение 15 мин. Раствор мономеров (скорость потока 2,5 г/мин) и суспензию клеток (скорость потока 5 г/мин), каждый в отдельности, загружали с помощью насоса в колбу для смешивания объемом 2,5 л. Полученную смесь немедленно по каплям при 20 С добавляли в перемешиваемое масло (350 об/мин, струйный смеситель Visco-jet). После завершения добавления реагентов реакционную смесь перемешивали в течение еще 3,5 ч при 20 С. Полученные полиакриламидные гранулы, содержащие инкапсулированные клетки штамма Rhodococcus, отделяли фильтрованием, промывали дистиллированной водой и оставляли набухать в воде. Полиакриламидные гранулы хранили в двух объемах буферного раствора для хранения (3,55 г/л сульфата натрия, 0,25 мас.% натриевой соли дегидрацетовой кислоты, 0,05 мас.% никотинамида, рН 7,0) при 4 С. Набухшие гранулы характеризуются правильной сферической формой размером от 200 до 1200 мкм и механической прочностью 300 мН. Соотношение сухие полиакриламидные гранулы/влажные полиакриламидные гранулы составляет 0,11:1 (мас./мас.). Удельная активность составляет 9,5 мкмоль никотинамида/(минмг сухих полиакриламидных гранул). Пример 4. Конверсия 3-цианопиридина в никотинамид в статистическом режиме. Полиакриламидные гранулы, содержащие инкапсулированные клетки штамма Rhodococcus (100 г влажных гранул), полученные, как описано в примере 3, добавляли в медленно перемешиваемый раствор 3-цианопиридина (40 г, 3,8 моль) в фосфатном буферном растворе (0,05 М, рН 7,0, 400 мл) при 25 С. Через 15 мин конверсия 3-цианопиридина в никотинамид составляла 99%, через 30 мин - 99%. Пример 5. Конверсия 3-цианопиридина в никотинамид в непрерывном режиме. Полиакриламидные гранулы, содержащие инкапсулированные клетки штамма Rhodococcus (100 г влажных гранул), полученные, как описано в примере 3, добавляли в раствор 3-цианопиридина (40 г,3,8 моль) в фосфатном буферном растворе (0,05 М, рН 7,0, 400 мл) при 25 С. Раствор 3-цианопиридина(10 мас.%) в фосфатном буферном растворе (0,05 М, рН 7,0) непрерывно добавляли в медленно перемешиваемую реакционную смесь и реакционную смесь (не содержащую полиакриламидные гранулы) непрерывно удаляли. Непрерывную конверсию проводили в течение 5 недель при 25 С, время выдерживания составляло 3,1 ч. При этом в течение 5 недель разрушения гранул не наблюдалось. В ходе реакции определяли концентрацию 3-цианопиридина и никотинамида (см. фиг. 1 и 2) и рассчитывали конверсию(см. фиг. 3). Пример 6. Инкапсулирование клеток штамма Rhodococcus в полиакриламидные гранулы. Акриламид (422,5 г, 5940 ммоль), N,N'-метилен-бис-акриламид (37,5 г, 240 ммоль) и 2-(диметиламино)этилметакрилат (15 г, 90 ммоль) растворяли в фосфатном буферном растворе (375 г, 50 мМ,рН 7,0) и рН раствора доводили до 7,0. Раствор персульфата аммония (4,65 г, 20 ммоль) в дистиллированной воде (25 г) добавляли в суспензию клеток штамма Rhodococcus (16 мас.% сухих клеток, 1650 г),полученную, как описано в примере 1. Раствор N,N,N',N'-тетраметилэтилендиамина (2,32 г, 20 ммоль) в дистиллированной воде (25 г) диспергировали в минеральном масле (Exxsol D100, 3500 г) в реакторе-5 015321 объемом 10 л. Раствор мономеров, суспензию клеток и масло (каждый компонент в отдельности) продували азотом в течение 15 мин. Раствор мономеров (скорость потока 13,5 г/мин) и суспензию клеток (скорость потока 27 г/мин), каждый в отдельности, загружали с помощью насоса в общий шланг для подачи растворов. Полученную смесь добавляли с помощью наноса при 20 С в перемешиваемое масло(215 об/мин, струйный смеситель Visco-jet). После завершения добавления реагентов реакционную смесь перемешивали в течение еще 3,5 ч при 20 С. Полученные полиакриламидные гранулы, содержащие инкапсулированные клетки штамма Rhodococcus, отделяли фильтрованием, промывали и хранили, как описано в примере 3. Набухшие гранулы характеризуются правильной сферической формой размером от 200 до 1200 мкм и механической прочностью 400 мН. Соотношение сухие полиакриламидные гранулы/влажные полиакриламидные гранулы составляет 0,09:1 (мас./мас.). Удельная активность составляет 7,3 мкмоль никотинамида/(минмг сухих полиакриламидных гранул). Пример 7. Стабильность при хранении полиакриламидных гранул, содержащих инкапсулированные клетки штамма Rhodococcus. Полиакриламидные гранулы, содержащие инкапсулированные клетки штамма Rhodococcus, полученные, как описано в примере 5, хранили в водном растворе для хранения (3,55 г/л сульфата натрия,0,25 мас.% натриевой соли дегидрацетовой кислоты, 0,05 мас.% никотинамида, рН 7,0). Через каждые 5 недель отбирали образцы. Полиакриламидные гранулы отделяли, промывали дистиллированной водой и суспендировали в свежем буферном растворе для хранения (3,55 г/л сульфата натрия, 0,25 мас.% натриевой соли дегидрацетовой кислоты, 0,05 мас.% никотинамида, рН 7,0) при 25 С в течение 1 ч. Активность нитрилгидратазы определяли, как описано в примере 2. Определяли соотношение сухие полиакриламидные гранулы/влажные полиакриламидные гранулы. Сухие полиакриламидные гранулы получали при высушивании влажных полиакриламидных гранул при 55 С и 20 мбар в течение 4 ч. Таблица 1 Стабильность при хранении полиакриламидных гранул, содержащих клетки штамма Rhodococcus Пример 8. Инкапсулирование клеток штамма Rhodococcus в полиакриламидные гранулы. Инкапсулирование проводили аналогично тому, как описано в примере 3, но при этом использовали раствор персульфата аммония (1,86 г, 8 ммоль) в дистиллированной воде (7,0 г) и раствор N,N,N',N'тетраметилэтилендиамина (0,928 г, 8 ммоль) в дистиллированной воде (5 г). Полученные полиакриламидные гранулы, содержащие инкапсулированные клетки штамма Rhodococcus, отделяли, промывали и хранили, как описано в примере 3. Набухшие гранулы характеризуются правильной сферической формой размером от 250 до 1300 мкм и механической прочностью 400 мН. Соотношение сухие полиакриламидные гранулы/влажные полиакриламидные гранулы составляет 0,12:1 (мас./мас.). Удельная активность составляет 7,8 мкмоль никотинамида/(минмг сухих полиакриламидных гранул). Пример 9. Инкапсулирование клеток штамма Rhodococcus в полиакриламидные гранулы. Инкапсулирование проводили аналогично тому, как описано в примере 3, но при этом использовали суспензию клеток штамма Rhodococcus (16 мас.% сухих клеток), а полимеризацию проводили при 10 С в течение 9 ч. Полученные полиакриламидные гранулы, содержащие инкапсулированные клетки штамма Rhodococcus, отделяли, промывали и хранили, как описано в примере 3. Набухшие гранулы характеризуются правильной сферической формой размером от 250 до 1300 мкм и механической прочностью 400 мН. Соотношение сухие полиакриламидные гранулы/влажные полиакриламидные гранулы составляет 0,09:1,00 (мас./мас.). Удельная активность составляет 7,3 мкмоль никотинамида/(минмг сухих полиакриламидных гранул). Пример 10. Инкапсулирование клеток штамма Rhodococcus в полиакриламидные гранулы.N,N-Диметилакриламид (42,25 г, 426 ммоль), N,N'-метилен-бис-акриламид (3,75 г, 24 ммоль) и 2-(диметиламино)этилметакрилат (1,5 г, 9 ммоль) растворяли в фосфатном буферном растворе (37,5 г,50 мМ, рН 7,0) и рН раствора доводили до 7,0. Раствор персульфата аммония (1,86 г, 8 ммоль) в дистиллированной воде (7 г) добавляли в суспензию клеток штамма Rhodococcus (18 мас.% сухих клеток,166 г), полученную, как описано в примере 1. Раствор N,N,N',N'-тетраметилэтилендиамина (0,928 г,8 ммоль) в дистиллированной воде (7 г) диспергировали в минеральном масле (Exxsol D100, 350 г) в реакторе объемом 1 л. Раствор мономеров, суспензию клеток и масло (каждый компонент в отдельности) продували азотом в течение 15 мин. Раствор мономеров (скорость потока 2,5 г/мин) и суспензию клеток-6 015321 смешивания объемом 2,5 л. Полученную смесь немедленно добавляли по каплям при 20 С в перемешиваемое масло (350 об/мин, струйный смеситель Visco-jet). После завершения добавления реагентов реакционную смесь перемешивали в течение еще 3,5 ч при 20 С. Полученные полиакриламидные гранулы,содержащие инкапсулированные клетки штамма Rhodococcus, отделяли фильтрованием, промывали и хранили, как описано в примере 3. Набухшие гранулы характеризуются правильной сферической формой размером от 200 до 700 мкм и механической прочностью 400 мН. Соотношение сухие полиакриламидные гранулы/влажные полиакриламидные гранулы составляет 0,21:1 (мас./мас.). Удельная активность составляет 5,4 мкмоль никотинамида/(минмг сухих полиакриламидных гранул). Пример 11. Инкапсулирование клеток штамма Rhodococcus в полиакриламидные гранулы. Инкапсулирование проводили аналогично тому, как описано в примере 10, но вместоN,N-диметилакриламида (42,25 г, 426 ммоль) использовали акриламид (42,25 г, 594 ммоль), а вместо 2-(диметиламино)этилметакрилата (1,5 г, 9 ммоль) использовали N-[3-(диметиламино)пропил]метакриламид (1,5 г, 9 ммоль). Полученные полиакриламидные гранулы, содержащие инкапсулированные клетки штамма Rhodococcus, отделяли, промывали и хранили, как описано в примере 3. Набухшие гранулы характеризуются правильной сферической формой размером от 150 до 1200 мкм и механической прочностью 400 мН. Соотношение сухие полиакриламидные гранулы/влажные полиакриламидные гранулы составляет 0,13:1 (мас./мас.). Удельная активность составляет 5,9 мкмоль никотинамида/(минмг сухих полиакриламидных гранул). Пример 12. Культивирование штамма Escherichia coli, содержащего плазмиду, включающую кодирующий амидазу ген, транскрипция которого регулируется промотером-рамнозой. 12.1. Получение пре-прекультуры. В стерильную среду (5 мл, рН 7,0), содержащую 1,6 мас.% триптона, 1,0 мас.% дрожжевого экстракта, 0,5 мас.% NaCl и 0,01 мас.% ампицилина, высеивали культуру штамма Escherichia coli из слоя агара с культурой, причем культура содержит плазмиду, включающую кодирующий амидазу ген, транскрипция которого регулируется промотером-рамнозой. Пре-прекультуру культивировали при 37 С в течение 12 ч на качалке. 12.2. Получение прекультуры. В стерильную среду, описанную в примере 12.1 (100 мл), высеивали 5 мл пре-прекультуры штаммаEscherichia coli, полученной в примере 12.1. Прекультуру культивировали при 37 С на качалке. При поглощении 0,25 при длине волны 600 нм в культуру добавляли 0,2 мас.% L-рамнозу. При поглощении 5 при 600 нм клетки собирали центрифугированием, дважды промывали буферным раствором (1,80 г/л этилендиаминтетрауксусной кислоты, 2,65 г/л динатриевой соли/натрий ацетатного буферного раствора,рН 7,0) и ресуспендировали в указанном буферном растворе до концентрации сухих клеток 15-20 мас.%. Суспензию клеток хранили при -40 С. Пример 13. Определение амидазной активности. Полиакриламидные гранулы, содержащие инкапсулированные клетки штамма Escherichia coli, содержащие амидазу (0,4 г влажных клеток), добавляли в перемешиваемый раствор 2-гидрокси-2-метил 3,3,3-трифторпропионамида (1,0 г) в фосфатном буферном растворе (0,1 М, рН 8,0, 9 мл) при 37 С. Образцы (200 мкл) отбирали через 0, 30 и 60 мин. Затем измеряли молярное количество образующегося аммиака, которое равно молярному количеству образующейся 2-гидрокси-2-метил-3,3,3-трифторпропионовой кислоты. Пример 14. Инкапсулирование в полиакриламидные гранулы штамма Escherichia coli, содержащего плазмиду, включающую кодирующий амидазу ген, транскрипция которого регулируется промотеромрамнозой. Инкапсулирование проводили аналогично тому, как описано в примере 3, но при этом использовали суспензию клеток штамма Escherichia coli (19 мас.% сухих клеток), полученную, как описано в примере 12, раствор персульфата аммония (1,86 г, 8 ммоль) в дистиллированной воде (7,0 г) и растворN,N,N',N'-тетраметилэтилендиамина (0,928 г, 8 ммоль) в дистиллированной воде (5 г), а полимеризацию проводили при 400 об/мин (струйный смеситель Visco-jet). Полученные полиакриламидные гранулы,содержащие инкапсулированные клетки штамма Escherichia coli, отделяли и промывали, как описано в примере 3, хранили в фосфатном буферном растворе (0,1 М, рН 7,0). Набухшие гранулы характеризуются неправильной сферической формой размером от 200 до 2000 мкм и механической прочностью 200 мН. Соотношение сухие полиакриламидные гранулы/влажные полиакриламидные гранулы составляет 0,21:1 (мас./мас.). Удельная активность составляет 0,029 мкмоль 2-гидрокси-2-метил-3,3,3-трифторпропионамида/(минмг сухих полиакриламидных гранул). Пример 15. Конверсия 2-гидрокси-2-метил-3,3,3-трифторпропионамида в 2-гидрокси-2-метил-3,3,3 трифторпропионовую кислоту в статическом режиме. Полиакриламидные гранулы, содержащие клетки штамма Escherichia coli, содержащие плазмиду,включающую кодирующий амидазу ген, и полученные, как описано в примере 14 (0,4 г влажных гранул),добавляли в раствор 2-гидрокси-2-метил-3,3,3-трифторпропионамида (1,0 г, 6,366 ммоль) в фосфатном буферном растворе (0,1 М, рН 8,0, 10 мл) при 37 С в течение 1 ч. При этом образуется 2-гидрокси-2-7 015321 метил-3,3,3-трифторпропионовая кислота (2%). Пример 16. Инкапсулирование в полиакриламидные гранулы штамма Escherichia coli, содержащего плазмиду, включающую кодирующий амидазу ген, транскрипция которого регулируется промотеромрамнозой. Акриламид (21,13 г, 297 ммоль), N,N'-метилен-бис-акриламид (1,88 г, 12 ммоль) и 2-(диметиламино)этилметакрилат (0,75 г, 4,8 ммоль) растворяли в фосфатном буферном растворе (18,75 г, 50 мМ,рН 7,0) и рН раствора доводили до 7,0. Раствор персульфата аммония (0,93 г, 4 ммоль) в дистиллированной воде (2,5 г) добавляли в суспензию клеток штамма Escherichia coli (19 мас.% сухих клеток, 82,5 г),полученную, как описано в примере 12. Раствор N,N,N',N'-тетраметилэтилендиамина (0,928 г, 8 ммоль) в дистиллированной воде (5 г) диспергировали в минеральном масле (Isopar M, 350 г) в реакторе объемом 1 л при 450 об/мин. Раствор мономеров, суспензию клеток и масло (каждый компонент в отдельности) продували азотом в течение 15 мин. Раствор мономеров (скорость потока 2,5 г/мин) и суспензию клеток(скорость потока 5 г/мин) (каждый компонент в отдельности) загружали с помощью насоса в колбу для смешивания объемом 2,5 л. Полученную смесь немедленно добавляли по каплям при 20 С в перемешиваемое масло (450 об/мин, струйный смеситель Visco-jet). После завершения добавления реагентов реакционную смесь перемешивали в течение еще 3,75 ч при 20 С. Полученные полиакриламидные гранулы,содержащие инкапсулированные клетки штамма Escherichia coli, отделяли и промывали, как описано в примере 3, хранили в фосфатном буферном растворе (0,1 М, рН 7,0) при 4 С. Набухшие гранулы характеризуются неправильной сферической формой размером от 1000 до 1200 мкм и механической прочностью 200 мН. Соотношение сухие полиакриламидные гранулы/влажные полиакриламидные гранулы составляет 0,25:1,00 (мас./мас.). Удельная активность составляет 0,016 мкмоль никотинамида/(минмг сухих полиакриламидных гранул). Пример 17. Применение полиакриламидных гранул, содержащих инкапсулированные клетки штамма Rhodococcus, содержащие нитрилгидратазу, в качестве биокатализатора для превращения нитрилов в амиды. Полиакриламидные гранулы, содержащие инкапсулированные клетки штамма Rhodococcus и полученные, как описано в примере 7 (25 г влажных гранул), добавляли в медленно перемешиваемый раствор нитрила в фосфатном буферном растворе (0,05 М, рН 7, 100 мл) или в смеси фосфатного буферного раствора (0,05 М, рН 7, 100 мл) и метанола при 25 С. Через 5, 15 и 60 мин отбирали образцы (3 мл) и их немедленно смешивали с H2SO4 (48 мас.%, 0,03 мл). Реакционную смесь анализировали методом ЖХВР или ГХ и определяли удельную активность. Полученные результаты приведены в табл. 2.-8 015321 Таблица 2 Биопревращение различных нитрилов в соответствующие амиды с использованием полиакриламидных гранул, содержащих клетки штамма Rhodococcus, включающих нитрилгидратазу, в качестве биокатализатора ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения полиакриламидных гранул, содержащих инкапсулированные клетки и характеризующихся прочностью по меньшей мере 200 мН, включающий следующие стадии:(1) получение водного раствора смеси акриловых мономеров,(2) получение суспензии клеток в водном растворе персульфата,(3) получение эмульсии водного раствора третичного амина в несмешивающейся с водой жидкости,(4) смешивание раствора, полученного на стадии (1), и суспензии, полученной на стадии (2),(5) добавление смеси, полученной на стадии (4), в перемешиваемую эмульсию, полученную на стадии (3),(6) полимеризация смеси акриловых мономеров и одновременное инкапсулирование клеток с образованием полиакриламидных гранул, содержащих инкапсулированные клетки,(7) выделение полученных полиакриламидных гранул. 2. Способ по п.1, в котором размер полиакриламидных гранул составляет от 0,05 до 3 мм. 3. Способ по п.2, в котором размер полиакриламидных гранул составляет от 0,1 до 1,5 мм, а механическая прочность по крайней мере 300 мН. 4. Способ по любому из пп.1-3, в котором массовое соотношение сухие клетки/смесь акриловых мономеров составляет от 0,001:1 до 1:1. 5. Способ по любому из пп.1-4, в котором массовое соотношение сухие клетки/смесь акриловых мономеров составляет от 0,2:1 до 0,9:1. 6. Способ по любому из пп.1-5, в котором клеткой является бактериальная клетка. 7. Способ по п.6, в котором клеткой является бактериальная клетка группы нокардиоформы актиномицетов или семейства Enterobacteriacea.-9 015321 8. Способ по любому из пп.1-7, в котором третичным амином является N,N,N',N'тетраметилэтилендиамин или 3-(диметиламино)пропионитрил. 9. Способ по любому из пп.1-8, в котором несмешивающейся с водой жидкостью является минеральное масло. 10. Способ по любому из пп.1-9, в котором используется поверхностно-активное вещество. 11. Полиакриламидные гранулы, содержащие инкапсулированные клетки, полученные способом по любому из пп.1-10, причем механическая прочность полиакриламидных гранул составляет по крайней мере 200 мН. 12. Полиакриламидные гранулы по п.11, в которых инкапсулированными клетками являются клетки штамма рода Rhodococcus, включающие нитрилгидратазу. 13. Применение полиакриламидных гранул по п.11 или 12 в качестве биокатализатора для превращения нитрильного субстрата в соответствующий амид.
МПК / Метки
МПК: C12P 17/12, C12N 11/08, C12P 13/02, C12N 11/04
Метки: полиакриламидные, гранулы, получения, гранул, полиакриламидных, применение, способ
Код ссылки
<a href="https://eas.patents.su/12-15321-sposob-polucheniya-poliakrilamidnyh-granul-poliakrilamidnye-granuly-i-ih-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения полиакриламидных гранул, полиакриламидные гранулы и их применение</a>
Предыдущий патент: Способ снижения вязкости вязких текучих сред (варианты)
Следующий патент: Полимерная композиция для производства труб и способ ее получения
Случайный патент: Замещенные производные бензамида