Фармацевтические композиции, содержащие циклодекстрины и таксоиды
Формула / Реферат
1. Способ получения быстрорастворимых твердых препаратов для фармацевтического применения и их водных растворов, включающий
а) растворение в этаноле таксоида, паклитакселя или доцетакселя, или их соли, или гидрата, или сольвата, а затем проведение любой из следующих стадий:
i) добавление твердого ацетил-g-циклодекстрина или гидроксипропил-b-циклодекстрина и, при необходимости, других растворимых вспомогательных материалов, обычных в фармацевтических препаратах для парентерального применения, растворение этой смеси в водном растворителе и лиофилизация до получения твердого вещества; или
ii) добавление лиофилизированного твердого ацетил-g-циклодекстрина или гидроксипропил-b-циклодекстрина и, при необходимости, других растворимых вспомогательных материалов, обычных в фармацевтических препаратах для парентерального применения, выпаривание растворителя и высушивание до получения твердого вещества; или
iii) смешивание раствора с твердым, обладающим большой площадью поверхности, предпочтительно лиофилизированным твердым ацетил-g-циклодекстрином или гидроксипропил-b-циклодекстрином и, при необходимости, с другими растворимыми вспомогательными материалами, обычными в фармацевтических препаратах для парентерального применения, и затем растворение в водном растворителе возможно в присутствии добавки для поддержания изотоничности до получения раствора, содержащего:
А) в качестве активного ингредиента указанный таксоид,
В) указанное производное циклодекстрина,
С) при необходимости другие растворимые вспомогательные материалы, обычные в фармацевтических препаратах для парентерального применения,
где весовое соотношение таксоид:циклодекстрин находится в интервале от 1:25 до 1:400;
при условии, что гидроксипропил-b-циклодекстрин используют в сочетании только с доцетакселем в весовом соотношении таксоид:циклодекстрин от 1:25 до 1:100,
а также, возможно:
b) когда стадии i) или ii) используются при растворении твердого вещества в водном растворителе, получают раствор для прямого медицинского применения.
2. Способ по п.1, в котором в качестве водного растворителя или разбавителя используют воду для инъекций или водный раствор добавки для поддержания изотоничности, такой как хлористый натрий, глюкоза или декстроза, содержащий эти ингредиенты в количестве, достаточном для поддержания изотоничности водного раствора.
3. Способ по любому из пп.1 и 2, в котором в качестве циклодекстринового компонента используют ацетил-g-циклодекстрин со степенью ацетилирования примерно от 2 до 12 ацетильных групп в одном кольце циклодекстрина или ацетил-g-циклодекстрин со степенью ацетилирования около 8 ацетильных групп в одном кольце циклодекстрина.
4. Способ по любому из пп.1-3, в котором паклитаксель используют в гидратированном полиморфном виде или в сольватированном виде, таком как этанольный сольват.
5. Способ по любому из пп.1 и 2, в котором в качестве циклодекстринового компонента используют гидроксипропил-b-циклодекстрин, предпочтительно гидроксипропил-b-циклодекстрин со степенью замещения примерно от 2 до 10 гидроксипропильных групп в одном кольце циклодекстрина или гидроксипропил-b-циклодекстрин со степенью замещения примерно от 4 до 6 гидроксипропильных групп в одном кольце циклодекстрина.
6. Быстрорастворимые твердые препараты для фармацевтического применения и их водные растворы, если указанные композиции содержат
a) в качестве активного ингредиента мелкодисперсный, с большой площадью поверхности, аморфный, предпочтительно лиофилизированный таксоид, предпочтительно паклитаксель или доцетаксель, их соли или полиморфные гидраты или сольваты типа сольватов с этанолом и
b) мелкодисперсный, с большой, площадью поверхности, твердый, аморфный, предпочтительно лиофилизированный ацетил-g-циклодекстрин или гидроксипропил-b-циклодекстрин, где весовое соотношение указанного таксоида к циклодекстрину находится в интервале от 1:25 до 1:400,
при условии, что гидроксипропил-b-циклодекстрин используют в сочетании только с доцетакселем с весовым соотношением таксоид:циклодекстрин от 1:25 до 1:100;
с) при необходимости другие растворимые вспомогательные материалы, обычные в фармацевтических препаратах для парентерального применения.
7. Препарат по п.6, в котором весовое соотношение паклитакселя и ацетил-g-циклодекстрина составляет от 1:100 до 1:250.
8. Быстрорастворимые твердые препараты для фармацевтического применения и их водные растворы, содержащие любой из продуктов, полученных в соответствии со способом по любому из пп.1-5.
9. Способ предупреждения самоаггрегации и преждевременного выпадения осадка любого таксоида из группы паклитакселя и доцетакселя и их солей, сольватов и гидратов в водных растворах и продления перенасыщенного состояния растворенного препарата, путем использования таксоидов в виде препаратов по любому из пп.6-8.
10. Способ лечения нежелательной пролиферации клеток эффективными количествами фармацевтических композиций по любому из пп.6-8, включающий введение пациенту, нуждающемуся в таком лечении, дозовой формы, содержащей фармацевтическую композицию по любому из пп.6-9, содержащую эффективное количество паклитакселя или доцетакселя и их солей, сольватов и гидратов.
11. Способ по п.10, включающий введение пациенту, нуждающемуся в таком лечении, дозовой формы, содержащей паклитаксель, его соли, сольваты или гидраты и ацетил-g-циклодекстрин в весовом соотношении от 1:100 до 1:250.
12. Способ по п.10, включающий введение пациенту, нуждающемуся в таком лечении, дозовой формы, содержащей доцетаксель, его соли, сольваты или гидраты и гидроксипропил-b-циклодекстрин в весовом соотношении от 1:25 до 1:100.
Текст
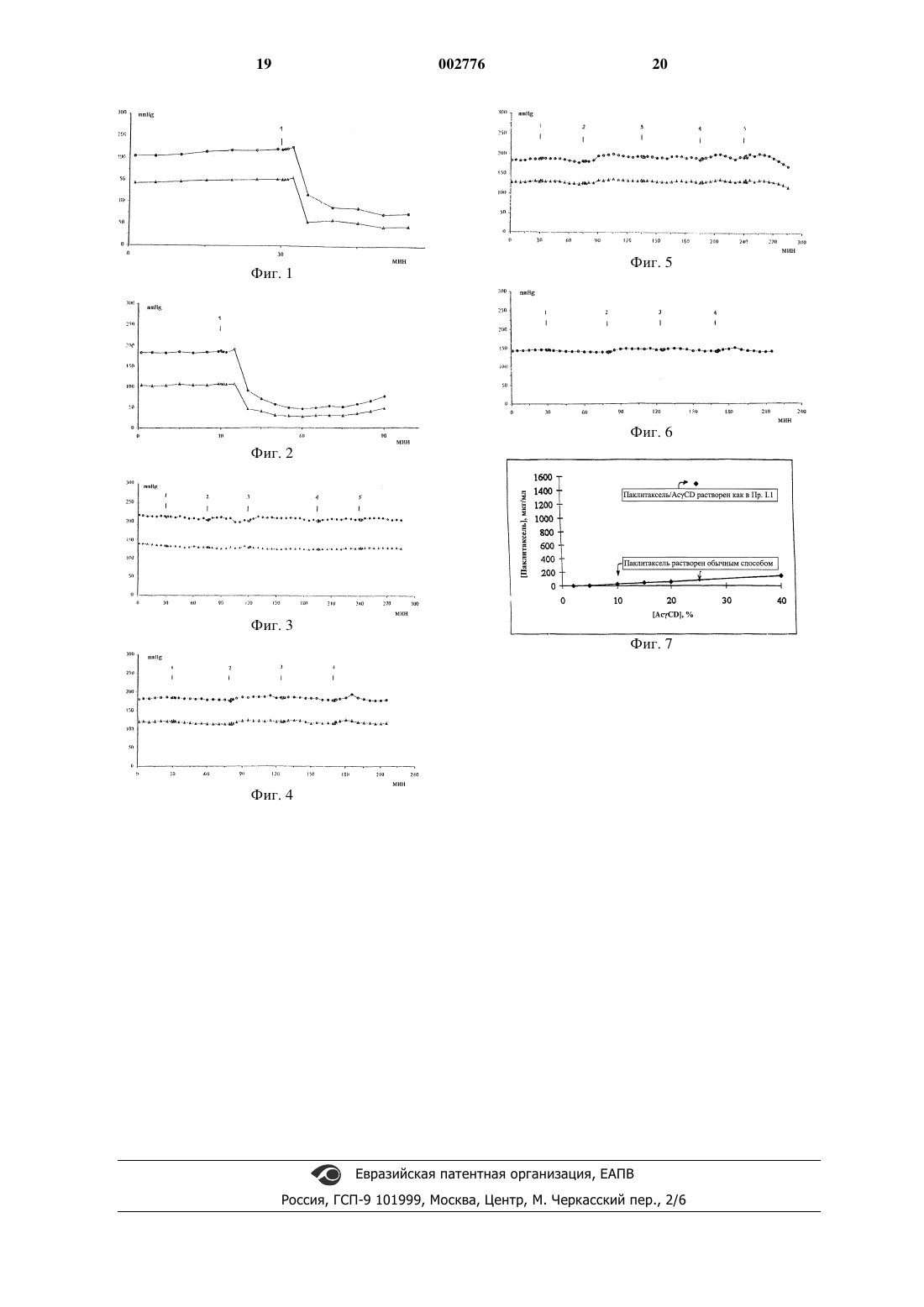
1 Настоящее изобретение касается новых водорастворимых твердых фармацевтических композиций и их водных растворов для парентерального применения, содержащих таксоиды и определенные циклодекстрины без вредных растворителей и/или детергентов. Более конкретно, изобретение касается новых водорастворимых твердых фармацевтических композиций и их водных растворов, причем указанные композиции содержатa) в качестве активного ингредиента таксоид, такой как паклитаксель и доцетаксель,или, но необязательно, их соли или полиморфные гидраты или сольваты, напр., сольваты, образованные с этанолом; иb) ацетилциклодекстрин или гидроксипропилциклодекстрин с большой площадью поверхности (в дальнейшем - циклодекстрин),где весовое соотношение указанного таксоида к указанному циклодекстрину составляет от 1:25 до 1:250;c) а также, но необязательно, другие водорастворимые вспомогательные материалы, которые обычно используются в фармацевтических препаратах для парентерального применения. Изобретение также касается приготовления и применения указанных фармацевтических композиций для инъекций. В описании и формуле изобретения применяются следующие обозначения: паклитаксель - таксол А; доцетаксель"водные растворители" - вода, пригодная для инъекций, или водные растворы, содержащие растворенный изотонизатор в количестве и концентрации, достаточной для поддержания изотоничности указанных водных растворов,напр., хлористый натрий, глюкоза;"аморфизированный" проявляющий аморфную структуру в рентгеновских лучах;HPCD - гидроксипропилциклодекстрин (примерно от 2 до 8 гидроксипропильных групп на единицу CD);DIME - гептакис-2,6-ди-O-метилциклодекстрин. Таксоид - это общее название для паклитакселя и родственных ему по структуре соединений. Паклитаксель известен как соединение,обладающее значительной противораковой активностью, которое действует в качестве митотического яда на веретено деления, и является потенциальным ингибитором клеточной репликации. Также известно, что он плохо растворяется в воде, примерно до 0,0005 мг/мл при комнатной температуре, и сообщалось, что он не 002776 2 стабилен в растворе при хранении вследствие сольволиза его эфирной связи, что приводит к потере цитотоксической активности. Он продается растворенным в смеси этанола и Кремофора EL (полигидроксилированное касторовое масло) в соотношении 1:1. Кремофор EL связывали с некоторыми неблагоприятными реакциями (гиперчувствительность, выброс гистамина) во время внутривенной терапии, поэтому в последнее десятилетие предпринимались многочисленные попытки разработать новые системы доставки лекарства. Когда паклитаксель составлен в виде раствора в органических растворителях - этаноле и полиэтоксилированном касторовом масле, его вводят в виде перенасыщенной эмульсии масло в воде, при этом он быстро растворяется в крови, т.е. в водной среде, богатой гидрофобными доменами, представленными липидами и белками. Паклитаксель проходит через гидрофобную среду плазматических мембран при проникновении в клетки и выходе из них путем диффузии. Склонность паклитакселя к самоаггрегации в зависимости от растворителя и концентрации затрудняла попытки составить этот плохо растворимый препарат с фармацевтически приемлемыми наполнителями для клинического введения. Известно также, что доцетаксель, полусинтетический таксоид, сильно липофилен и лучше растворим в воде, чем паклитаксель (USP 4814470). Коммерчески доступный концентрированный доцетаксель для инъекций является стерильным раствором препарата в полисорбате 80, в сопровождении растворителя, 13%(вес/вес) этанола в воде для инъекций. Максимальная концентрация препарата, которая могла быть использована, составляла от 0,3 до 0,9 мг/мл. Концентраций выше 0,9 мг/мл следовало избегать вследствие проблем преципитации. Реакции гиперчувствительности, связанные с полисорбатом 80, могут вызывать осложнения с коммерчески доступными составами. Для разработки композиции был предпринят широкий диапазон подходов, включая использование носителей с гидрофобными характеристиками. В большинстве носителей таксоид используется в миллимолярном диапазоне концентраций, который сравним с концентрациями,при которых наблюдалась самоаггрегация таксоида, приводящая к преципитации. На основании взаимодействия между таксоидом и циклодекстринами были сделаны некоторые дальнейшие предположения. Исследуя подвижность таксоида методом тонкослойной хроматографии в присутствии циклодекстринов(Int. J. Pharm. 1994. 108. 64-75), сначала пришли к заключению, что взаимодействие между таксоидом и циклодекстрином очень слабое. Затем(AU-P-35544/93; 645.927) обнаружили умеренное увеличение растворимости таксоида, ис 3 пользуя незамещенные циклодекстрины и модифицированные ферментами разветвленные циклодекстрины. Было предположено, что при сочетании водных парентеральных растворов плохо растворимых в воде препаратов с циклодекстринами можно свести к минимуму преципитацию в местах инъекции или в органах после парентерального применения (USP 5 024 998). При этом наблюдалось увеличение растворимости при высоких (около 50% вес/об) концентрациях CD и были получены твердые комплексы с некоторыми концентрированными препаратами, подтверждая, что при концентрации CD менее 20% вес/об может происходить преципитация. Среди огромного количества препаратов, перечисленных в этом описании, не содержится упоминания ни о таксоидах, ни об ацетилCD. Дальнейшее улучшение состояло в использовании водного раствора метилированных циклодекстринов в качестве эффективных усилителей растворимости паклитакселя (РСТ WO 94/62728) и сочетании метилированного циклодекстрина вместе с этанолом для получения растворов паклитакселя от 1 до 4 мг/мл (ЕР 788373). Такие концентрированные растворы таксоида не выпадали в осадок при разбавлении до определенного предела и позволяли избежать применения токсических детергентов. Также предлагалось использовать 2,6-ди-О-метил-циклодекстрин в качестве более эффективного солюбилизатора паклитакселя (ЕРА 0639380) и были опубликованы подробные результаты его солюбилизирующей способности (J. Pharm. Sci. 84. 10. 1223-1230; 1995). Однако, высказывалась некоторая озабоченность относительно применения метилированных -циклодекстринов в препаратах для инъекций ввиду их поверхностно-активных свойств, сродства к холестерину и другим липидным компонентам клеточных мембран даже при низких концентрациях и дозах. В печати появилось несколько исследований по применению циклодекстринов вместе с водорастворимыми препаратами с целью уменьшения изъязвления по сравнению с тем же составом цитотоксических соединений при выходе из сосуда в ткань (WO 95/06485). Хотя паклитаксель не растворим в воде, в этом описании также приводится пример "таксола" в 50% растворе этанола для иллюстрации этого эффекта с добавлением "HPCD". Результаты показывают, что HPCD оказывал защитное действие на кожу при введении таксола в подкожный участок, приводя к уменьшению размера повреждения. Были выявлены тиоразветвленные циклодекстрины для растворения противораковых таксоидов (напр., доцетакселя и паклитакселя,см. РСТ WO 95/19994), без описания деталей об улучшении растворимости, стабильности и ток 002776 4 сичности. Такие композиции обеспечивают значительное увеличение растворимости в воде для паклитакселя. Однако, при разведении для парентерального введения (от 0,3 до 1,2 мг/мл) происходила преципитация препарата. Целью настоящего изобретения являлось дальнейшее улучшение растворимости таксоидов в композициях для инъекций и улучшение стабильности лекарственных систем на основе таксоидов для парентерального введения, наряду с возможным снижением токсичности сопровождающих материалов, применяемых для приготовления композиций. Основой настоящего изобретения является признание того, что и ацетилированный декстрин, и гидроксипропилциклодекстрин обладают положительным действием по продлению перенасыщенного состояния растворенного паклитакселя и доцетакселя, предотвращая преждевременную преципитацию без применения этанола в качестве сорастворителя. Это было неожиданным, поскольку было известно, что-циклодекстрин и его гидроксипропилированные производные, которые, как известно, обладают наибольшими полостями среди CD, ранее признавались наименее подходящими для солюбилизации паклитакселя и образования комплексов (Int. J. Pharm. 133. 191-201. 1996). Это подтверждалось и нашими исследованиями по равновесной растворимости паклитакселя в зависимости от концентрации водных растворов химически модифицированных-циклодекстринов, в которых не было обнаружено практически никакого солюбилизирующего эффекта, хотя использовались высокие концентрации циклодекстрина (см. табл. 1). Таблица 1. Растворимость паклитакселя в зависимости от концентрации ацетилциклодекстрина Растворенный паклитаксель Ацетилциклодекстрин Растворимость паклитакселя в воде при комнатной температуре составляет примерно 0,5 мкг/мл, таким образом, концентрация растворенного паклитакселя 170 мкг/мл в 40% растворе ацетилциклодекстрина уже означает примерно 340-кратное увеличение растворимости. Приведенные выше данные, однако, хуже по сравнению с известными результатами, согласно которым в водном растворе 40% вес/обDIME растворялось примерно 800-1000 мкг/мл паклитакселя. Такие же плохие результаты были получены при использовании DIME в качестве солюбилизатора. Это значение далеко отстоит от желаемого значения, соответствующего терапевтической дозе паклитакселя, и применение такой дозовой формы потребовало бы введения 5 более 70 г циклодекстрина вместе с единицей дозы паклитакселя в 30 мг. Предметом настоящего изобретения является способ получения фармацевтических композиций для парентерального применения в твердом состоянии, быстрорастворимых в воде,а также их водных растворов, содержащих ацетилциклодекстрин или гидроксипропил-циклодекстрин (в дальнейшем именуемых циклодекстрином), включающий а) растворение таксоида, предпочтительно паклитакселя или доцетакселя, или их солей или гидратов в этаноле, а затем проведение любой из следующих стадий:i) добавление твердого циклодекстрина, а также, но необязательно, других водорастворимых вспомогательных материалов, обычных в фармацевтических препаратах для парентерального применения, растворение этой смеси в водном растворителе и лиофилизация до получения твердого вещества, илиii) добавление твердого, с большой площадью поверхности, аморфного (предпочтительно лиофилизированного) циклодекстрина, а также,но необязательно, других водорастворимых вспомогательных материалов, обычных в фармацевтических препаратах для парентерального применения, выпаривание растворителя и высушивание до получения твердого вещества,или(предпочтительно лиофилизированным) циклодекстрином (а также, но необязательно, с другими водорастворимыми вспомогательными материалами, обычными в фармацевтических препаратах для парентерального применения),затем растворение в водном растворителе, а также, но необязательно, в присутствии достаточного количества добавки для поддержания изотоничности, и получение раствора, включающегоa) таксоид в качестве активного ингредиента,b) циклодекстрин,с) необязательно, другие водорастворимые вспомогательные материалы, обычные в фармацевтических препаратах для парентерального применения,где весовое соотношение таксоид:циклодекстрин находится в интервале от 1:25 до 1:400;b) необязательно, когда стадии i) или ii) используются при растворении твердого вещества в водном растворителе для получения парентерального раствора, готового к прямому медицинскому применению. Согласно изобретению, таксоид паклитаксель используется в его гидратированной полиморфной форме или в его сольватированной форме, такой как сольват в этаноле. Предпочтительным применением изобретения является использование ативного ингре 002776 диента паклитакселя вместе с ацетил-циклодекстрином в весовом соотношении от 1:100 до 1:250. Другим предпочтительным применением изобретения является использование доцетакселя вместе с HPCD в области весовых соотношений от 1:25 до 1:100. При проведении процесса согласно изобретению в качестве водного растворителя или разбавителя можно использовать любое из следующих веществ: вода для инъекций, водный раствор в изотоническом наполнителе, таком как хлористый натрий, глюкоза, маннитол, декстроза. Последние растворы должны содержать указанные ингредиенты в количестве, достаточном для поддержания изотоничности водного раствора в применяемых условиях. Так, концентрации,подходящие для изотонизаторов в фармацевтических растворах, могут быть слегка изменены в присутствии используемых циклодекстринов и таксоидов. Так, концентрации порядка примерно 0,9% вес/об хлорида натрия или ок. 5% вес/об глюкозы должны быть оптимизированы для конкретной композиции в зависимости от применяемого таксоида и от количества и качества применяемого CD. Другими предметами настоящего изобретения являются фармацевтические композиции,содержащие в качестве активного ингредиента любой препарат, если таковой приготовлен согласно способам изобретения. Еще одним предметом настоящего изобретения являются водорастворимые твердые фармацевтические композиции и их водные растворы, если указанные композиции содержатa) в качестве активного ингредиента мелкодисперсный таксоид с большой площадью поверхности, такой как паклитаксель или доцетаксель, или, но необязательно, в виде их солей или полиморфных гидратов или сольватов,напр., с этанолом иb) мелкодисперсный, с большой площадью поверхности ацетилциклодекстрин или гидроксипропилциклодекстрин (циклодекстрин),причем весовое соотношение указанного таксоида и указанного циклодекстрина находится в интервале от 1:25 до 1:250;c) необязательно, другие водорастворимые вспомогательные вещества, обычные в фармацевтических препаратах для парентерального применения. Предпочтительные композиции, согласно изобретению, содержат в качестве активного ингредиента паклитаксель и в качестве циклодекстрина ацетилциклодекстрин в весовом соотношении от 1:100 до 1:250. Другими предпочтительными композициями являются комбинации доцетакселя и гидроксипропил-циклодекстрина в весовом соотношении от 1:25 до 1:100. 7 Дальнейшими предметами настоящего изобретения являются методы предотвращения самоаггрегации и преждевременой преципитации таксоида, подобного паклитакселю и доцетакселю, а также их солей, сольватов и гидратов в водных растворах, и продления перенасыщенного растворенного состояния препаратов путем использования таксоидов в виде фармацевтических композиций согласно настоящему изобретению, как подробно описано выше. Еще одним предметом настоящего изобретения является метод лечения нежелательной пролиферации клеток путем применения эффективных количеств фармацевтических композиций согласно изобретению, как подробно описано выше. Готовые к употреблению растворы паклитакселя остаются физически стабильными в течение разумного периода времени. Для внутривенного введения обычно требуется, чтобы используемые растворы были физически стабильными не менее 6 ч. При растворении соединений в водных растворах согласно настоящему изобретению реконституированные таким образом растворы стабильны, по меньшей мере, от 6 до 8 ч. В случае растворов, состоящих из комбинаций паклитаксель/AcCD,а также доцетаксель/AcCD или HPCD, физическая стабильность наблюдалась в течение 24 ч. В соответствии с методом пациенту, нуждающемуся в таком лечении, обеспечивается введение парентеральной дозовой формы, содержащей фармацевтическую композицию. Единичные дозы по 100 мг таксоида можно приготовить в лиофилизированном виде. Их растворяют, получая готовые к употреблению дозовые растворы, пригодные,напр., для внутривенного введения. В зависимости от требуемого лечения, применимого к конкретным нуждам пациента, можно применять несколько единичных доз по 100 мг, чтобы достичь эффективной дозы, соответствующей желаемому количеству, которое обычно выражают в мг/м 2 поверхности тела. Таким образом, напр., можно достичь рекомендуемой дозы паклитакселя в диапазоне от 135 до 250 мг/м 2 поверхности тела. Препарат можно эффективно применять, напр., путем внутривенного, внутрибрюшинного, внутримышечного введения, в зависимости от типа рака, подлежащего лечению, и таксоида и циклодекстрина, выбранных для применения. Можно достичь улучшения результатов лечения по сравнению с известными методами терапии благодаря значительному снижению токсичности дозовой формы по сравнению с токсичностью носителей, содержащихся в известных композициях, применяемых в настоящее время. К тому же, больше не требуется подвергать пациента премедикации против гиперчувствительности и других нежелательных побочных эффектов с помощью стероидов, антигистаминов и антагонистов Н 2-рецепторов перед введением паклитакселя или доцетакселя для предупреждения тяжелых реакций гиперчувствительности. 8 Изобретение подробно иллюстрируется примерами без намерения ограничить ими пределы защиты.I. Приготовление композиций Пример I.1. Получение реконституируемых,твердых смесей паклитаксель/ацетил-циклодекстрин путем высушивания. 3 мг паклитакселя (растворенного в этаноле) добавляли к 500 мг порошка ацетил-циклодекстрина (лиофилизированного из водного раствора). Эту смесь выдерживали 18 ч под вакуумом над пятиокисью фосфора для удаления этанола. Порции этой порошковой смеси, свободной от этанола, растворяли в 5, 4, 3 и 2 мл 5% водного раствора глюкозы, соответственно. Физическая стабильность этих реконституированных растворов показана в табл. 2. Таблица 2 Добавлено 5% раствора глюкозы: 5 мл 4 мл 3 мл 2 мл Паклитаксель, конечная конц. (мг/мл)(мг/мл) Стабильность по визуальной оценке (ч) Паклитаксель в растворе,HPLC (мг/мл) Этот эксперимент повторяли с меньшими количествами ацетилциклодекстрина. 3 мг паклитакселя (растворенного в 0,3 мл этанола) добавляли к 450 мг, 400 мг или 350 мг лиофилизированных образцов ацетилциклодек-стрина, после чего смеси выдерживали 18 ч под вакуумом над пятиокисью фосфора для удаления этанола. Каждую смесь растворяли в 5, 4, 3 и 2 мл 5% водного раствора глюкозы. В табл. 3, 4, 5 суммированы данные по составу, а также физической стабильности этих реконституированных растворов паклитакселя, полученных согласно примеру I.1 с использованием различных количеств ацетил-циклодекстрина. Таблица 3 Добавлено 5% раствора глюкозы 5 мл 4 мл 3 мл 2 мл Паклитаксель, конечная 0,6 0,75 конц. (мг/мл) Ацетилциклодекстрин,90 112,5 конечная конц. Стабильность по визуаль- опалесц. 48 ной оценке (ч) раствор Таблица 4 Добавлено 5% раствора глюкозы 5 мл 4 мл 3 мл 2 мл Паклитаксель, конечная конц. (мг/мл) Ацетил-CD, конечная конц. (мг/мл) Стабильность по визуальной оценке (ч)(мг/мл): сразу после приготовления через 22 чAc-CD, конечная конц. Стабильность по визуальной оценке (ч) Паклитаксель в р-ре,HPLC (мг/мл): сразу после приготовления через 22 ч Пример I.2. Приготовление композиций паклитакселя с номинальной концентрацией паклитакселя 6 мг/мл. К 6,5 г аморфизированного ацетил-циклодекстрина добавляли 3 мл раствора паклитакселя с концентрацией паклитакселя 10 мг/мл(что соответствует 30 мг паклитакселя). К влажной смеси сразу же добавляли 50 мл 5% раствора декстрозы и композицию втряхивали до получения прозрачного раствора. Концентрация растворенного паклитакселя в растворе составляла 0,550,05 мг/мл, что определяли методомHPLC после фильтрования раствора через мембранный фильтр 0,2 мкм. Раствор может храниться в стеклянной посуде при комнатной температуре при нормальном освещении не менее 6 ч без появления заметной опалесценпии и/или образования частиц. Повторный анализ растворенного паклитакселя после 6 ч хранения методом HPLC показал, что уменьшения концентрации растворенного паклитакселя не происходило. Пример I.3. Приготовление композиций паклитакселя с номинальной концентрацией паклитакселя в 0,3 мг/мл. К 6,5 г предварительно аморфизированного ацетилциклодекстрина добавляли 3 мл раствора паклитакселя с концентрацией паклитакселя 10 мг/мл (что соответствует 30 мг паклитакселя). К влажной смеси сразу же добавляли 100 мл 5% раствора декстрозы и встряхивали смесь до получения прозрачного раствора. Концентрация растворенного паклитакселя в растворе составляла 0,270,03 мг/мл, что определяли методом HPLC после фильтрования раствора через мембранный фильтр 0,2 мкм. Раствор может храниться в стеклянной посуде при комнатной температуре при нормальном освещении не менее 12 ч без появления заметной опалесценции и/или образования частиц. Повторный анализ растворенного паклитакселя после 12 ч хранения методом HPLC показал, что за 12 ч уменьшения концентрации растворенного паклитакселя не происходит. Пример I.4. Приготовление композиций доцетакселя с номинальной концентрацией доцетакселя в 0,5 и 1 мг/мл. К 100 мг аморфизированного ацетил-циклодекстрина добавляли 0,1 мл раствора доцетакселя с концентрацией доцетакселя 20 10 мг/мл (это соответствует 2 мг доцетакселя). К влажной твердой смеси сразу же добавляли 1 или 2 мл 5% вес./об. водного раствора декстрозы и смеси встряхивали до получения прозрачного раствора. Концентрация растворенного доцетакселя в растворе согласно примеру I.4 составляла 1 и 0,5 мг/мл, соответственно. Растворы могут храниться в стеклянной посуде при комнатной температуре при нормальном освещении не менее 24 ч без появления заметной опалесценции и/или образования частиц. Оба раствора имели следующий состав в пересчете на единичную дозу доцетакселя в 20 мг:- 20 мл или 40 мл 5% декстрозы. Пример I.5. Приготовление композиций доцетакселя с номинальной концентрацией доцетакселя в 0,75 мг/мл с помощью гидроксипропилциклодекстрина (HPCD). К 200 мг HPCD добавляли 0,15 мл раствора доцетакселя с концентрацией доцетакселя 10 мг/мл (это соответствует 1,5 мг доцетакселя). К влажной смеси сразу же добавляли 2 мл 5% вес./об. раствора декстрозы и смесь встряхивали до получения прозрачного раствора. Концентрация растворенного доцетакселя в растворе согласно примеру I.5 составляла 0,75 мг/мл. Раствор может храниться в стеклянной посуде при комнатной температуре при нормальном освещении не менее 24 ч без появления заметной опалесценции и/или образования паклитакселя. Растворы имели следующий состав в пересчете на единичную дозу доцетакселя в 20 мг:- 27 мл 5 % декстрозы. Пример I.6. Приготовление двойного лиофилизата паклитаксель/ацетилциклодекстрин. 30 мг паклитакселя, растворенного в 3 мл этанола, добавляли к 5,0 г аморфизированного ацетилциклодекстрина. К влажному порошку добавляли еще 2 мл этанола и порошок растворяли в 50 мл дистиллированной воды, получая прозрачный раствор с номинальной концентрацией паклитакселя 0,6 мг/мл. Этот раствор быстро замораживали в сухом льду и лиофилизировали, получая белый лиофилизат с содержанием паклитакселя, равным 0,60,05% по весу. Этот лиофилизат можно легко реконституировать в первоначальном объеме раствора путем добавления 50 мл 5% водного раствора глюкозы. В результате получали прозрачный раствор с концентрацией паклитакселя 0,6 мг/мл. Реконституированный раствор хранится в стеклянной посуде при комнатной температуре в нормальных условиях. Концентрацию паклитакселя определяли методом HPLC после 11 фильтрования исследуемых растворов через мембрану 0,2 мкм. Содержание паклитакселя составляло сразу после приготовления 5130,07 мг/мл через 25 ч хранения: 0,5560,01 мг/мл( Разница между номинальной и измеренной концентрацией паклитакселя обусловлена увеличением общего объема лиофилизата). Пример I.7. Приготовление двойного лиофилизата доцетаксель/ацетилциклодекстрин. 10 мг доцетакселя, растворенного в 0,5 мл этанола, добавляли к 400 мг аморфизированного ацетилциклодекстрина. Влажный порошок растворяли в 8 мл дистиллированной воды, получая прозрачный раствор с номинальной концентрацией доцетакселя 1,25 мг/мл. Этот раствор быстро замораживали в сухом льду и лиофилизировали, получая белый лиофилизат с содержанием доцетакселя, равным 2,250,1%. 50 мг лиофилизата можно легко растворить в 1 мл 5% водного раствора глюкозы, получая прозрачный раствор с концентрацией доцетакселя в 1,13 мг/мл (определяли методомHPLC). Реконституированный раствор может храниться в стеклянной посуде при комнатной температуре при нормальном освещении. После 21 ч хранения концентрация доцетакселя, измеренная методом HPLC, составляла 1,150,02 мг/мл. Даже после 72 ч хранения в растворе не отмечалось визуально заметной опалесценции или образования твердых частиц. Пример I.8. Приготовление лиофилизата паклитаксель/ацетилциклодекстрин/глюкоза. 30 мг паклитакселя растворяли в 3 мл этанола и этот раствор добавляли к 5,0 г аморфизированного ацетилциклодекстрина. К влажному порошку добавляли еще 2 мл этанола и порошок затем растворяли в 50 мл 5% водного раствора глюкозы. Этот раствор замораживали в сухом льду и лиофилизировали, получая белый лиофилизат с содержанием паклитакселя, равным 0,420,1%. Этот лиофилизат можно легко реконституировать в первоначальном объеме при добавлении 50 мл дистиллированной воды. В результате получается прозрачный раствор с номинальной концентрацией паклитакселя в 0,6 мг/мл. Реконституированные растворы хранятся в закрытой стеклянной посуде при комнатной температуре при нормальном освещении. Концентрацию паклитакселя во время хранения измеряют методом HPLC после фильтрования исследуемых растворов. Содержание паклитакселя составляло сразу после приготовления 0,5300,06 мг/мл через 25 ч хранения 0,5410,05 мг/мл(Разница между номинальной и измеренной концентрацией паклитакселя обусловлена увеличением общего объема лиофилизата). 12 Пример I.9. Приготовление лиофилизата доцетаксель/ацетилциклодекстрин/глюкоза. 8 мг доцетакселя растворяли в 0,4 мл этанола и добавляли к 400 мг аморфизированного ацетилциклодекстрина. Влажный порошок затем растворяли в 8 мл 5% вес./об. водного раствора глюкозы. Это приводило к получению прозрачного раствора с номинальной концентрацией доцетакселя в 1 мг/мл, который замораживали в сухом льду и лиофилизировали, получая белый лиофилизат с содержанием доцетакселя в 1%. 100 мг свободного от этанола лиофилизата можно легко реконституировать в 1, 2 или 4 мл дистиллированной воды, получая прозрачные растворы с номинальной концентрацией доцетакселя 1, 0,5 или 0,25 мг/мл, соответственно. В табл. 6 суммированы данные по физической стабильности растворов доцетакселя при хранении в закрытой стеклянной посуде в течение 21 ч при комнатной температуре, полученные путем определения концентрации растворенного доцетакселя методом HPLC при различных номинальных концентрациях. Доцетаксель в растворе,HPLC (мг/мл) сразу через 21 ч Таблица 6 Номинальная концентрация доцетакселя в растворе 1 мг/мл 0,5 мг/мл 0,25 мг/мл 0,93 0,49 0,24 0,89 0,48 0,24 Пример I.10. Приготовление двойного лиофилизата доцетаксель/гидроксипропилциклодекстрин (HPCD). 6 мг доцетакселя, растворенного в 0,3 мл этанола, добавляли к 300 мг HPCD. Влажный порошок растворяли в 6 мл дистиллированной воды,получая прозрачный раствор с номинальной концентрацией доцетакселя в 1 мг/мл. Этот раствор быстро замораживали в сухом льду и лиофилизировали, получая белый лиофилизат с содержанием доцетакселя 2% по весу. 50 мг твердого лиофилизата можно легко растворить в 1 или 2 мл 5% вес./об. водного раствора глюкозы, при этом получали прозрачный раствор с содержанием доцетакселя в 0,97 и 0,59 мг/мл, соответственно, как показал анализ методом HPLC. Реконституированные растворы хранятся в стеклянной посуде при комнатной температуре в нормальных условиях. После 21 ч хранения концентрация доцетакселя составила 0,950,05 и 0,490,005 мг/мл, как показал анализ HPLC. Пример I.11. Продление перенасыщенного состояния растворов паклитакселя путем выпаривания. 30 мг паклитакселя растворяли в 6 мл этанола и раствор тщательно смешивали с 5 г ацетил-циклодекстрина. Дополнительно добавляли 3 мл этанола и смесь перемешивали 5 мин при комнатной температуре. Содержащийся в смеси этанол затем удаляли под струй азота с помощью роторного испарителя в вакууме. Получали белый твер 13 дый остаток, который затем растворяли в 5 мл деионизированной воды, получая слегка опалесцирующий раствор, который немедленно замораживали в сухом льду и лиофилизировали. Полученный лиофилизат представляет собой быстрорастворимый аморфный порошок. Его обычно реконституируют до прозрачного раствора добавлением воды для инъекций или 5% водного раствора глюкозы. Реконституированный раствор с концентрацией растворенного паклитакселя в 0,3-0,6 мг/мл остается стабильным не менее 24 ч при комнатной температуре. Пример I.12. Парентеральная композиция для внутривенного применения. 100 мг паклитакселя, растворенного в 10 мл этанола, добавляли к 15,0 г аморфизированного ацетилциклодекстрина с большой площадью поверхности. К влажному порошку добавляли еще 10 мл этанола и порошок растворяли в 80 мл дистиллированной воды, получая прозрачный раствор с номинальной концентрацией паклитакселя в 1,25 мг/мл. Этот раствор быстро замораживали в сухом льду и лиофилизировали, получая белый лиофилизат, содержащий 0,70,05% паклитакселя по весу. Этот лиофилизат можно легко реконституировать до объема 100 мл с помощью 5% вес./об. водного раствора декстрозы. Получается прозрачный раствор с концентрацией паклитакселя в 1,0 мг/мл, готовый к употреблению для внутривенного введения.II. Биологические исследования Целью этих исследований являлась оценка некоторых специфических побочных эффектов внутривенного введения паклитакселя. Оценивали сердечно-сосудистые и респираторные эффекты паклитакселя после внутривенного введения 7 беспородным собакам, находящимся под наркозом,вызваннымII.1. Исследуемые вещества. А. Паклитаксель, жидкость по 1 мл (30 мг/мл в этаноле), поставляется во флаконах. Растворяли в носителе Кремофор ЕLР:этанол в соотношении 1:1 по ходу исследования. В. Паклитаксель/AcCD, белый кристаллический порошок; приготовлен согласно примеру 1.6 настоящего изобретения. Растворяли в носителе из 2,5% вес./об. водного раствора декстрозы по ходу исследования.II.2. Методы. Записывали или выводили следующие параметры, служившие в качестве индикаторов функционального состояния различных элементов сердечно-сосудистой и респираторной систем. Единицы измерения указаны в скобках. Систолическое, диастолическое Общее состояние гемодии среднее кровяное давление (мм намики рт.ст.) Частота сердцебиений (раз/мин) Систолическое давление в левом Состояние сократительжелудочке (мм рт.ст.) ного аппарата миокарда Макс. dp/dt левого желудочка(мл/мин) Сопротивление в бедренной артерии (мм рт.ст./мл/мин) Частота дыхания (раз/мин) Минутный объем дыхания (мл) Объем вдоха (мл) Состояние проводящей системы миокарда Состояние и сопротивление периферических сосудов Общее состояние системы дыхания Наркоз проводили путем внутривенной инъекции тиопентала натрия и поддерживали внутривенной инъекцией смеси -хлоралозы и пентобарбитала натрия, по мере необходимости. Поддерживали температуру тела. Вставляли канюлю в трахею и подсоединяли ее к экрану пневмометра для измерения объема вдоха (мл) и вычисления параметров частоты дыхания (раз/мин) и минутного объема (мл). Вводили катетеры в правую бедренную артерию и головную вену для обеспечения измерений кровяного давления и введения носителя, исследуемых веществ и анестетиков, соответственно. Бедренную артерию соединяли с датчиком давления, заполненным гепарином/физраствором, и подсоединяли его к полиграфу Grass 7E. Частоту сердцебиений выводили автоматически по сигналу кровяного давления. Помещали ультразвуковой зонд на левую бедренную артерию и подсоединяли его к измерителю кровотока, соединенному с полиграфом Grass для записи кровотока в бедренной артерии(мл/мин). Вводили катетер в левую сонную артерию и продвигали его в левый желудочек для обеспечения измерений систолического давления в левом желудочке (СДЛЖ). Катетер соединяли с датчиком давления, заполненным гепарином/физраствором, и сигнал СДЛЖ выводили на экран полиграфа Grass. Подкожные иглы-электроды вставляли в соответствующие конечности для регистрации электрокардиограммы, которую выводили на экран полиграфа Grass. Различные сигналы из полиграфаGrass передавали на компьютер, где полученные данные подвергались анализу с выводом на экран. После периода стабилизации в 30 мин вводили внутривенно дозу носителя в объеме 7,0 мл/кг на протяжении 15 мин. Через 45 мин и с интервалами в 45 мин после этого вводили внутривенно дозы препаратов в объеме 7,0 мл/кг на протяжении 15 мин для каждой. Регистрировали показатели не менее 45 мин с момента начала инфузии. Все дозы вводили с помощью инфузионного насоса KdS модель 200. Исследовали следующие образцы:Животное 1 2 3 4 Носитель Препарат Доза препа 7 мл/кг в/в, 15 мин рата мг/м 2 Кремофор паклитаксель 6 и 60 ЕLP:этанол Кремофор паклитаксель 6 и 60 ЕLР:этанол Кремофор нет 2901 АК ЕLР:этанол Кремофор 2841 АК нетAcCDПриготовлен согласно примеру I.6. Все параметры, включая записи ЭКГ с высоким разрешением (50 мм/с), измеряли с интервалом в 5 мин во время периода стабилизации и с интервалами в 0,5, 1, 2 и 5 мин после введения дозы носителя и препаратов. В конце полного периода наблюдения животных забивали введением в/в высокой дозы пентобарбитала натрия.II.3. Результаты. Животные (результаты) 1 и 2: Введение 6 и 60 мг/м 2 паклитакселя в смеси Кремофор ЕLР:этанол в соотношении 1:1 пришлось прекратить по причине смерти животных. 3 и 4: Внутривенное введение смеси Кремофор ЕLР:этанол при обеих дозах (эквивалентных дозам, применяющимся при 6 и 60 мг/м 2 паклитакселя, соответственно) вызывало реакцию анафилактического типа: немедленное понижение артериального кровяного давления,частоты сердцебиений, систолического давления в левом желудочке и максимального dp/dt левого желудочка в одинаковой степени у обоих животных. Наблюдалось слабое или вовсе никакого восстановления по всем сердечнососудистым параметрам после дозы. Обе дозы вызывали желудочковую эктопию, уменьшали общую амплитуду записи ЭКГ, вызывали сбои и снижение амплитуды Т-волны. У животного 2841 АК носитель также вызывал увеличение сегмента S-T. Из полученных результатов можно сделать вывод, что эта смесь растворителей токсична сама по себе и следует избегать ее введения в/в. 5, 6 и 7: Введение дозы 2,5% вес./об. декстрозы в объеме 7 мл/кг в целом не оказывало явного влияния на какие-нибудь сердечнососудистые или респираторные параметры у 3 исследованных животных. Введение паклитакселя/AcCD в дозах до 240 мг/м 2 в общем вызывало лишь небольшие изменения измеряемых сердечно-сосудистых и респираторных параметров. Небольшие эффекты заключались в некотором повышении артериального кровяного давления и систолического давления в левом желудочке, что сопровождалось уменьшением частоты сердцебиений и максимального dp/dt левого желудочка. Другие непостоянные изменения заключались в повышении кровотока в бедренной артерии, объема вдоха и частоты дыхания. Эти результаты были обратимыми.II.4. Иллюстрации. Для иллюстрации результатов по одному из важных параметров после в/в введения на фиг. 1-6 приводятся изменения артериального"Артериальное кровяное давление (мм рт.ст.) относительно времени (минуты)": систолическое диастолическое График Животное Носитель Фиг. 1 2901 АК Кремофор:этанол Фиг. 2 2841 АК Кремофор:этанол 2,5% декстроза в Фиг. 3II.5. Выводы. Внутривенное введение носителя - смеси Кремофор ЕLР:этанол в соотношении 1:1, а также паклитакселя вместе с этим носителем,вызывало реакцию анафилактического типа и поэтому не является адекватным для введения. Введение паклитакселя/ацетилCD (от 20 мг до 240 мг/м 2) в водном растворе декстрозы в качестве носителя не оказывало заметного и стойкого, явного сердечно-сосудистого действия ни на один из параметров ни в одном из исследованных животных. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения быстрорастворимых твердых препаратов для фармацевтического применения и их водных растворов, включающий а) растворение в этаноле таксоида, паклитакселя или доцетакселя, или их соли, или гидрата, или сольвата, а затем проведение любой из следующих стадий:i) добавление твердого ацетил-циклодекстрина или гидроксипропил-циклодекстрина и, при необходимости, других растворимых вспомогательных материалов,обычных в фармацевтических препаратах для парентерального применения, растворение этой смеси в водном растворителе и лиофилизация до получения твердого вещества; илиii) добавление лиофилизированного твердого ацетилциклодекстрина или гидроксипропилциклодекстрина и, при необходимости, других растворимых вспомогательных материалов, обычных в фармацевтических препаратах для парентерального применения, выпаривание растворителя и высушивание до получения твердого вещества; илиiii) смешивание раствора с твердым, обладающим большой площадью поверхности,предпочтительно лиофилизированным твердым ацетилциклодекстрином или гидроксипропилциклодекстрином и, при необходимости, 17 с другими растворимыми вспомогательными материалами, обычными в фармацевтических препаратах для парентерального применения, и затем растворение в водном растворителе возможно в присутствии добавки для поддержания изотоничности до получения раствора, содержащего: А) в качестве активного ингредиента указанный таксоид,В) указанное производное циклодекстрина,С) при необходимости другие растворимые вспомогательные материалы, обычные в фармацевтических препаратах для парентерального применения,где весовое соотношение таксоид:циклодекстрин находится в интервале от 1:25 до 1:400; при условии, что гидроксипропил-циклодекстрин используют в сочетании только с доцетакселем в весовом соотношении таксоид:циклодекстрин от 1:25 до 1:100,а также, возможно:b) когда стадии i) или ii) используются при растворении твердого вещества в водном растворителе, получают раствор для прямого медицинского применения. 2. Способ по п.1, в котором в качестве водного растворителя или разбавителя используют воду для инъекций или водный раствор добавки для поддержания изотоничности, такой как хлористый натрий, глюкоза или декстроза,содержащий эти ингредиенты в количестве,достаточном для поддержания изотоничности водного раствора. 3. Способ по любому из пп.1 и 2, в котором в качестве циклодекстринового компонента используют ацетилциклодекстрин со степенью ацетилирования примерно от 2 до 12 ацетильных групп в одном кольце циклодекстрина или ацетилциклодекстрин со степенью ацетилирования около 8 ацетильных групп в одном кольце циклодекстрина. 4. Способ по любому из пп.1-3, в котором паклитаксель используют в гидратированном полиморфном виде или в сольватированном виде, таком как этанольный сольват. 5. Способ по любому из пп.1 и 2, в котором в качестве циклодекстринового компонента используют гидроксипропилциклодекстрин,предпочтительно гидроксипропилциклодекстрин со степенью замещения примерно от 2 до 10 гидроксипропильных групп в одном кольце циклодекстрина или гидроксипропилциклодекстрин со степенью замещения примерно от 4 до 6 гидроксипропильных групп в одном кольце циклодекстрина. 6. Быстрорастворимые твердые препараты для фармацевтического применения и их водные растворы, если указанные композиции содержатa) в качестве активного ингредиента мелкодисперсный, с большой площадью поверхности, аморфный, предпочтительно лиофилизированный таксоид, предпочтительно паклитаксель или доцетаксель, их соли или полиморфные гидраты или сольваты типа сольватов с этанолом иb) мелкодисперсный, с большой площадью поверхности, твердый, аморфный, предпочтительно лиофилизированный ацетилциклодекстрин или гидроксипропилциклодекстрин, где весовое соотношение указанного таксоида к циклодекстрину находится в интервале от 1:25 до 1:400,при условии, что гидроксипропил-циклодекстрин используют в сочетании только с доцетакселем с весовым соотношением таксоид:циклодекстрин от 1:25 до 1:100; с) при необходимости другие растворимые вспомогательные материалы, обычные в фармацевтических препаратах для парентерального применения. 7. Препарат по п.6, в котором весовое соотношение паклитакселя и ацетилциклодекстрина составляет от 1:100 до 1:250. 8. Быстрорастворимые твердые препараты для фармацевтического применения и их водные растворы, содержащие любой из продуктов,полученных в соответствии со способом по любому из пп.1-5. 9. Способ предупреждения самоаггрегации и преждевременного выпадения осадка любого таксоида из группы паклитакселя и доцетакселя и их солей, сольватов и гидратов в водных растворах и продления перенасыщенного состояния растворенного препарата, путем использования таксоидов в виде препаратов по любому из пп.6-8. 10. Способ лечения нежелательной пролиферации клеток эффективными количествами фармацевтических композиций по любому из пп.6-8, включающий введение пациенту, нуждающемуся в таком лечении, дозовой формы,содержащей фармацевтическую композицию по любому из пп.6-9, содержащую эффективное количество паклитакселя или доцетакселя и их солей, сольватов и гидратов. 11. Способ по п.10, включающий введение пациенту, нуждающемуся в таком лечении, дозовой формы, содержащей паклитаксель, его соли, сольваты или гидраты и ацетил-циклодекстрин в весовом соотношении от 1:100 до 1:250. 12. Способ по п.10, включающий введение пациенту, нуждающемуся в таком лечении, дозовой формы, содержащей доцетаксель, его соли, сольваты или гидраты и гидроксипропил-циклодекстрин в весовом соотношении от 1:25 до 1:100.
МПК / Метки
МПК: A61K 47/40
Метки: таксоиды, содержащие, циклодекстрины, композиции, фармацевтические
Код ссылки
<a href="https://eas.patents.su/11-2776-farmacevticheskie-kompozicii-soderzhashhie-ciklodekstriny-i-taksoidy.html" rel="bookmark" title="База патентов Евразийского Союза">Фармацевтические композиции, содержащие циклодекстрины и таксоиды</a>
Предыдущий патент: Производные 2,3-диарил-пиразоло[1,5-b]пиридазинов, их получение и их применение в качестве ингибиторов циклооксигеназы 2 (цог-2)
Следующий патент: Способ получения гидроксамовых кислот
Случайный патент: Привод попеременного действия для велосипедов и транспортных средств, приводимых в движение аналогичным велосипедам образом