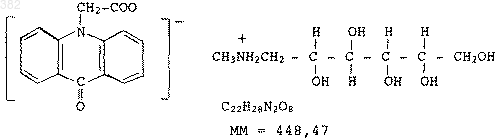Фармацевтическая лекарственная форма, включающая 2-[[(2-пиридинил) метил] сульфинил] бензимидазол, обладающий противоязвенной активностью, и способ изготовления такой лекарственной формы
Номер патента: 2502
Опубликовано: 27.06.2002
Авторы: Педерсен Серен Болс, Канн Хелле, Серенсен Карен Айхстетт, Хенриксен Кристиан Лунд
Формула / Реферат
1. Пероральная фармацевтическая лекарственная форма, включающая 2-[[(2-пиридинил)метил]сульфинил]бензимидазол, обладающий противоязвенной активностью, в качестве активного ингредиента, причем указанная лекарственная форма состоит из гранул, имеющих, по существу, инертное ядро, покрытое i) внутренним покрывающим слоем, состоящим из бензимидазола, дезинтегранта и поверхностно-активного вещества в матрице из расплавляемого покрывающего вещества, по существу, состоящего из одного или более сложных эфиров глицерина и жирных кислот, ii) наружным покрывающим слоем, являющимся энтеросолюбильным покрытием, и iii) промежуточным покрывающим слоем, разделяющим слой энтеросолюбильного покрытия и слой внутреннего покрытия.
2. Лекарственная форма по п.1, в которой расплавляемое покрывающее вещество имеет температуру плавления в интервале от 30 до 60шС, в частности в интервале от 30 до 50шС и более конкретно в интервале от 35 до 45шС.
3. Лекарственная форма по п.1 или 2, в которой расплавляемое покрывающее вещество, по существу, состоит из смеси твердого жира и глицерилмоностеарата 40-50.
4. Лекарственная форма по п.3, в которой весовое соотношение твердого жира и глицерилмоностеарата 40-50 находится в интервале от 100:1 до 1:2 и предпочтительно в интервале от 20:1 до 5:2.
5. Лекарственная форма по любому из предшествующих пунктов, в которой дезинтегрант является супердезинтегрантом, в частности кросповидоном.
6. Лекарственная форма по любому из предшествующих пунктов, в которой бензимидазол является микронизированным.
7. Лекарственная форма по любому из предшествующих пунктов, в которой поверхностно-активное вещество является анионным или неионным поверхностно-активным веществом, в частности лаурилсульфатом натрия.
8. Лекарственная форма по любому из предшествующих пунктов, в которой инертные ядра, по существу, представляют собой нонпарели, полученные из сахарозы и крахмала и имеют размер в интервале от 200 до 1500 мкм, в частности в интервале от 850 до 1000 мкм.
9. Лекарственная форма по любому из предшествующих пунктов, в которой слой энтеросолюбильного покрытия включает сополимер метакриловой кислоты и метилметакрилата, необязательно в сочетании с пластификатором, в частности триэтилцитратом, и/или другими возможными вспомогательными веществами, в частности микронизированным тальком.
10. Лекарственная форма по любому из предшествующих пунктов, в которой промежуточный покрывающий слой включает гидроксипропилметилцеллюлозу, необязательно в сочетании с двуокисью титана, микронизированным тальком и/или другими возможными вспомогательными веществами.
11. Лекарственная форма по любому из предшествующих пунктов, в которой промежуточный покрывающий слой включает слой из расплавляемого покрывающего вещества, по существу, состоящего из одного или более сложных эфиров глицерина и жирных кислот, необязательно включающий вспомогательные вещества, такие как дезинтегрант и/или поверхностно-активное вещество, но без бензимидазола.
12. Лекарственная форма по любому из предшествующих пунктов, в которой бензимидазол является омепразолом, пантопразолом или лансопразолом.
13. Лекарственная форма по любому из предшествующих пунктов, которая представлена в виде разовой дозы в желатиновой капсуле, в частности в виде разовой дозы, равной 10, 20 или 40 мг омепразола, 40 мг пантопразола или 15 или 30 мг лансопразола.
14. Способ получения пероральной фармацевтической лекарственной формы по любому из предшествующих пунктов, отличающийся тем, что включает стадию получения, по существу, инертных ядер с покрывающим слоем, содержащим бензимидазол, дезинтегрант и поверхностно-активное вещество в матрице из расплавляемого покрывающего вещества, по существу, состоящего из одного или более сложных эфиров глицерина и жирных кислот, методом покрытия расплавом.
15. Способ по п.14, отличающийся тем, что включает стадии
i) смешивания бензимидазола c поверхностно-активным веществом и дезинтегрантом,
ii) перемешивания смеси, полученной на стадии i), по существу, с инертными ядрами при нагревании до температуры выше температуры плавления расплавляемого покрывающего вещества,
iii) добавления расплавляемого покрывающего вещества к смеси, полученной на стадии ii), при перемешивании и нагревании до температуры выше температуры плавления расплавляемого покрывающего вещества,
iv) продолжения перемешивания и нагревания до температуры выше температуры плавления расплавляемого покрывающего вещества до тех пор, пока не будет получено достаточное покрытие ядер, и
v) охлаждения покрытых ядер, полученных на стадии iv), до комнатной температуры.
16. Способ по п.15, в котором, по существу, инертные ядра нагревают до температуры выше температуры плавления расплавляемого покрывающего вещества перед перемешиванием на стадии ii).
17. Способ по п.15 или 16, в котором расплавляемое покрывающее вещество добавляют в виде расплава на стадии iii).
18. Способ по п.15 или 16, в котором расплавляемое покрывающее вещество добавляют в виде тонкоизмельченного твердого вещества на стадии iii).
19. Способ по любому из пп.15-18, в котором охлаждение до комнатной температуры на стадии v) осуществляют в два этапа, первый этап проводится при непрерывном перемешивании до тех пор, пока не будет достигнута температура слегка выше температуры плавления расплавляемого покрывающего вещества, а второй этап осуществляется охлаждением в лотке.
20. Способ по любому из пп.14-19, включающий дополнительные стадии покрытия полученных, по существу, инертных ядер, покрытых покрывающим слоем, включающим бензимидазол, дезинтегрант и поверхностно-активное вещество в матрице из расплавляемого покрывающего вещества, промежуточным покрывающим слоем и наружным покрывающим слоем, причем наружный покрывающий слой является энтеросолюбильным покрытием.
Текст
1 Данное изобретение относится к пероральной фармацевтической лекарственной форме,включающей 2-(2-пиридинил)метил]сульфинил]бензимидазол, обладающий противоязвенной активностью, в качестве активного ингредиента, и способу изготовления такой лекарственной формы. 2-(2-Пиридинил)метил]сульфинил]бензимидазолы, обладающие противоязвенной активностью, являются хорошо известной группой соединений, которые всесторонне описаны в литературе, и большое количество патентов и патентных заявок было посвящено таким соединениям, способам их получения и лекарственным формам, содержащим их в качестве активного ингредиента. Соединения, получаемые в соответствии с нашей международной патентной заявкойPCT/DK 98/00058, являются примерами таких соединений, а именно производные 2-(2-пиридинил)метил]сульфинил]-1H-бензимидазола общей формулы IR5 представляет собой Н, СН 3 или ОСН 3, и их соли. Конкретными примерами являются соединения: 5-метокси-2-(4-метокси-3,5-диметил-2-пиридинил)метил]сульфинил-1 Н-бензимидазол (омепразол), 2-4-(2,2,2-трифторэтокси)-3-метил-2-пиридинил]метил]сульфинил]1H-бензимидазол (лансопразол), 2-(2-пиридинил)метил]сульфинил]-1H-бензимидазол (тимопразол) и 5-дифторметокси-2-(3,4-диметокси-2-пиридинил)метил]сульфинил]-1H-бензимидазол (пантопразол), среди которых омепразол, ланзопрозол и пантопразол в настоящее время продаются в Дании как средства, подавляющие секрецию кислоты в желудке, например, при лечении и профилактике язвы желудка и язвы двенадцатиперстной кишки, гастроэзофагеального рефлюкса и синдрома ЗоллингераЭллисона. В нижеследующем изобретение объясняется конкретными ссылками на омепразол, однако должно быть понятно, что изобретение не ограничивается лекарственной формой, содержащей омепразол. Как известно специалистам, омепразол чувствителен к действию кислот, но очень хорошо растворим в щелочных растворах, и только слабо растворим в воде. Кроме того, омепразол, как известно, чувствителен к влажности, 002502 2 нагреванию, свету и органическим растворителям. Как следствие, пероральным лекарственным формам омепразола и других 2-(2 пиридинил)метил]сульфинил]бензимидазолов обеспечивалось покрытие, растворимое в кишечнике, для защиты активного ингредиента от разрушения кислотой в желудке и для того, чтобы активный ингредиент выделялся в проксимальной части тонкого кишечника. Пероральная лекарственная форма омепразола на основе таблеток с энтеросолюбильным покрытием и результаты испытаний биодоступности, проведенных с такой таблеточной лекарственной формой, описаны в Scand. J. Gastroenterol., 1985, 20 (suppl. 108), pp. 113-120, PilbrandtA. and Cederberg C., "Development of an oral formulation of omeprasole". Однако стабильность этого типа лекарственной формы неудовлетворительна, и наблюдается разрушение омепразола, среди прочего, из-за кислотной природы энтеросолюбильного покрытия. При попытке улучшить стабильность омепразола были получены некоторые щелочные соли омепразола, сравн. ЕР 0124495 А. Подобным же образом в ЕР 0237200 В 1, ЕР 0423748 В 1 и ЕР 0446961 В 1, два последних на основе выделенных заявок из первого, использованы неорганические соли оснований магния и/или кальция для улучшения стабильности 2(2-пиридинил)метил]сульфинил]бензимидазолов, обладающих противоязвенной активностью. Однако было также описано, что когда такие щелочные ядра покрывались энтеросолюбильным покрытием - обычным полимером для создания энтеросолюбильной оболочки, таким как, например, ацетофталат целлюлозы, вода из желудочного сока может диффундировать через покрытие, в то время, когда дозированная лекарственная форма находится в желудке и частично растворять ядро в тесной близости от энтеросолюбильного покрытия. Здесь будет образовываться щелочной раствор, который разрушает энтеросолюбильное покрытие изнутри и, в конце концов, растворяет его. Чтобы решить эту проблему в ЕР 0247983 В 1 и ЕР 0496437 В 1, последний основан на заявке, выделенной из первого, сделано предложение создания небольших ядер с щелочной реакцией, покрытых энтеросолюбильной оболочкой, которые содержат в качестве активного компонента омепразол вместе с соединением с щелочной реакцией или щелочную соль омепразола, необязательно, вместе с соединением с щелочной реакцией, с подпокрытием, состоящим из одного или более слоев подпокрытия с инертной реакцией, включающих таблеточные наполнители, которые растворимы или быстро распадаются в воде, или полимерные водорастворимые образующие пленку соединения, необязательно содержащие рН-буферные щелоч 3 ные соединения. Подпокрытие отделяет ядра с щелочной реакцией от энтеросолюбильного покрытия. В качестве примеров материалов для подпокрытия называют гидроксипропилметилцеллюлозу, гидроксипропилцеллюлозу и поливинилпирролидон. Соответствующие лекарственные формы на основе других кислотолабильных бензимидазолов раскрыты в ЕР 0244380 В 1. По WO 96/24338 водорастворимый отделяющий слой, содержащий водорастворимую соль полимера для энтеросолюбильного покрытия образуется in situ между материалом ядра со щелочной реакцией, содержащим ингибитор протонного насоса, таким как омепразол, лансопразол или пантопразол, и энтеросолюбильным покрытием. Ядро со щелочной реакцией может быть изготовлено различными путями,такими как получение гранул или таблеток,включающих активное вещество и соединение(я) с щелочной реакцией или нанесением слоя, включающего активное вещество и соединение(я) с щелочной реакцией на предварительно сформированные затравочные зерна. В WO 94/02140 описывается фармацевтическая композиция для всасывания в кишечнике, состоящая из ядра, содержащего противоязвенное средство, такое как омепразол или лансопразол, подпокрытия из одного или двух слоев и энтеросолюбильного покрытия, причем ядро и/или подпокрытие включает гидроксид алюминия, бикарбонат натрия, соосажденные необязательно в смеси с буфером, или смесь одного из последующих с буфером: глицината алюминия, аминокислоты, кислотной соли аминокислоты и щелочной соли аминокислоты в качестве стабилизатора, причем используемые буферы способны регулировать рН смесей до 8 - 9. В ES 2024993 описывается пероральная фармацевтическая композиция, состоящая из ядра, включающего омепразол или его щелочную соль в сочетании с основным соединением,причем первое покрытие делается из инертного водорастворимого наполнителя и второго основного вещества, а второе покрытие является энтеросолюбильным покрытием. В качестве примеров основных соединений, которые могут быть включены в композицию, названы натриевые, калиевые, магниевые, кальциевые, алюминиевые и гидроксиалюминиевые соли аминокислот или пиридинкарбоновая кислота. Кроме того, в качестве примеров основных соединений, которые могут быть добавлены в ядро, названы известные противоязвенные средства ранитидин и фамотидин. В ЕР 0277741 описан способ получения сферических гранул, имеющих ядро, которое покрывается путем распыления порошка, содержащего лекарственное вещество и низкозамещенную гидроксипропилцеллюлозу при распылении с связывающим воду веществом, таким 4 как 1% (весообъемный) раствор гидроксипропилцеллюлозы. Говорится, что по этому способу получаются сферические гранулы, имеющие превосходную твердость и распадаемость. Покрытые ядра могут покрываться дополнительными покрытиями; в качестве примеров упоминаются покрытия, обеспечивающие длительное стабильное выделение, растворимые в желудке покрытия и энтеросолюбильные покрытия. В качестве примеров лекарственного вещества названы бензимидазолы, обладающие противоязвенной активностью, а в примерах 1 и 10 в качестве лекарственного вещества используется лансопразол. Однако отмечено, что в обоих примерах лансопразол используется в сочетании с очень существенным количеством щелочного стабилизатора, карбоната магния. В WO 96/23500 описывается пероральная фармацевтическая лекарственная форма, содержащая бензимидазольное соединение, лабильное в кислой среде, например, омепразол и лансопразол, которую получают путем покрытия инертных ядер первым слоем, содержащим бензимидазольное соединение, водорастворимый инертный полимер, такой как гидроксипропилметилцеллюлоза или гидроксипропилцеллюлоза, и фармацевтически приемлемые наполнители, имеющие не щелочную реакцию, такие как тальк, с последующим покрытием вторым слоем, состоящим из инертного водорастворимого полимера, такого как гидроксипропилметилцеллюлоза или гидроксипропилцеллюлоза, талька и пигмента, такого как двуокись титана, и, наконец, третьим энтеросолюбильным слоем, состоящим из полимера, который устойчив к желудочному соку, такого как сополимеризованные метакриловая кислота/ метилметакрилат, пластификатора, такого как триэтилцитрат или тому подобное, и талька. Слои наносят,используя водные растворы или дисперсии. Так же в WO 97/12580 и WO 97/12581 широко описываются композиции, свободные от соединений с щелочной реакцией, которые состоят из ядра, содержащего кислотолабильные бензимидазольные основные действующие лекарственные вещества, причем указанное ядро образуется из зародыша ядра и активного ингредиента, смешанных и затем вместе спрессованных, причем основное действующее вещество находится не в виде щелочной соли; промежуточного слоя и энтеросолюбильного слоя. В формуле изобретения WO 97/12581 бензимидазол ограничивается омепразолом, тогда как омепразол отклонен в WO 97/12580. Конкретными зародышами ядер, использованными в примерах, являются лактозные зародыши ядра, которые получают путем нанесения суспензии бензимидазола в водном растворе гидроксиметилцеллюлозы на зародыши ядер путем напыления с последующей сушкой. К суспензии может добавляться поверхностноактивное вещество, подобное полисорбату 80 5 или лакрилсульфату натрия. Высушенные зародыши ядер смешивают с кросповидоном и веществом, повышающим скольжение, а затем полученную смесь прессуют в микротаблетки,которые покрывают промежуточным слоем и энтеросолюбильным слоем. В ЕР 0589981 В 1 описана пероральная лекарственная форма пантопразола, устойчивая к желудочному соку в виде гранул или таблеток,состоящих из ядра, содержащего пантопразол или его соль, поливинилпирролидон и/или гидроксипропилметилцеллюлозу в качестве связывающего вещества, необязательно, маннит в качестве наполнителя, необязательно, другие вспомогательные вещества и одно или более основных неорганических соединений; водорастворимых промежуточных покрытий и устойчивого к желудочному соку наружного покрытия. Основные неорганические соединения добавляют для обеспечение ядру щелочной реакции, если она уже не обеспечена через использование соли пантопразола. Воду или смесь воды и изопропанола используют в качестве среды во время изготовления содержащего пантопразол ядра. В ЕР 0519144 А 1 описывается процесс изготовления препарата, содержащего омепразол,в соответствии с которым инертные ядра покрывают тремя слоями. Первый слой получают,используя водную дисперсию омепразола, гидроксипропилметилцеллюлозу, лактозу, L-гидроксипропилцеллюлозу, лаурилсульфат натрия и щелочное вещество, дигидрат двузамещенного фосфата натрия. Для второго слоя используется водная дисперсия гидроксипропилметилцеллюлозы. И под конец для энтеросолюбильного покрытия используется раствор фталата гидроксипропилметилцеллюлозы и диэтилфталата в ацетоне и этиловом спирте, которое наносится в качестве третьего покрытия. В этом случае омепразол также подвергается воздействию водной среды во время изготовления лекарственной формы. Дополнительное число примеров прототипов, в которых омепразол подвергается воздействию водной среды во время изготовления лекарственной формы дано в нижеследующем. В соответствии с WO 93/25204 сухую смесь омепразола, маннита, лаурилсульфата натрия и карбоксиметилкрахмала наносят на нейтральные ядра из сахара и крахмала с помощью связывающего раствора гидроксипропилметилцеллюлозы в смеси воды и этанола, причем за каждым нанесением следует стадия сушки. Также создаются защитные слои маннита,наносимые с использованием того же связывающего водного раствора гидроксипропилметилцеллюлозы, что и выше, сахарного сиропа и энтеросолюбильного покрытия из фталата гидроксипропилметилцеллюлозы. В соответствии с ES 2087823 устойчивые в желудке лекарственные формы из микрогранул 6 омепразола получают с помощью покрытия нейтральных инертных гранул смесью омепразола, разбавителя, такого как лактоза, сахароза,маннит или сорбит, и поверхностно-активного вещества, такого как лаурилсульфат натрия, при использовании водноспиртового раствора поливинилпирролидона (ПВП), сахарозы и полиэтиленгликоля (ПЭГ) в качестве связывающего вещества. Затем наносятся защитные покрытия,устойчивые в желудке. В РТ 101826 описывается процесс изготовления содержащей микрогранулы лекарственной формы омепразола, при котором инертные зародыши ядер из крахмала и сахарозы покрываются активным слоем, содержащим микронизированный омепразол и щелочные соли натрия. Активный слой наносят в виде водной суспензии, необязательно содержащей другие компоненты, как поверхностно-активные вещества,связывающие вещества и дезинтегрирующие вещества. Активный слой в свою очередь покрывают водорастворимым изолирующим слоем и устойчивым в желудке энтеросолюбильным покрытием. В WO 95/37195 описывается лекарственная форма омепразола, содержащая TiO2 для стабилизации. Сформулированная цель состоит в получении стабильной фармацевтической лекарственной формы, имеющей ядро, содержащее омепразол и только одно покрытие. TiO2 добавляют к содержащему омепразол ядру и,необязательно, также и к энтеросолюбильному покрытию. Лекарственную форму получают путем нанесения водной суспензии, содержащейTiO2 и различные вспомогательные вещества,такие как связывающие вещества, предотвращающие осаждение вещества и вещества, корректирующие рН, а также снижающееся количество омепразола по отношению к исходному ядру, так что смесь, которая должна наноситься в конце, практически не содержит омепразола. После сушки наносится энтеросолюбильное покрытие. Отмечено, что лекарственная форма, использованная в испытании на стабильность,включает существенное количество щелочного вещества, двузамещенного фосфата натрия, который, как известно, является стабилизатором омепразола в дополнение к TiO2. И наконец, в ЕР 0630235 В 1 описывается процесс получения гранул с длительным постоянным выделением, в соответствии с которым смесь, содержащую лекарственное вещество в тонко измельченном виде и воскоподобное вещество с температурой плавления выше 40 С,механически гранулируют, обрабатывая смесь в миксере высоким усилием сдвига при подводе достаточного количества энергии для того, чтобы связывающее вещество плавилось, и происходило гранулирование. Говорится, что процесс потенциально может использоваться для любого лекарственного 7 вещества, которое должно вводиться перорально, чтобы поддерживать определенные уровни концентрации в крови на протяжении суток. Как возможный кандидат упоминается омепразол,но ни один из рабочих примеров не относится к изготовлению содержащей омепразол лекарственной формы. Как проиллюстрировано вышеприведенным списком прототипов, было сделано много предложений в отношении изготовления лекарственных форм, содержащих омепразол и другие кислотолабильные бензимидазолы для перорального приема. Тем не менее данное изобретение представляет новый подход к изготовлению пероральных фармацевтических лекарственных форм, содержащих 2-(2-пиридинил)метил] сульфинил]бензимидазол, обладающий противоязвенной активностью, при котором бензимидазол может быть введен в лекарственную форму без использования воды и органических растворителей, которые, как известно, оказывают отрицательное действие на стабильность бензимидазола, особенно омепразола, при сохранении адекватного растворения, что дает возможность достаточного всасывания в пределах узкого окна абсорбции для бензимидазола в кишечнике. Эта цель достигается с помощью способа покрытия расплавом с получением предварительно формируемых ядер, таких как нонпарель,изготовленная из сахарозы и крахмала, с покрывающим слоем, содержащим бензимидазол, дезинтегрант и поверхностно-активное вещество в матрице из расплавленного покрывающего вещества, по существу состоящего из одного или более сложных эфиров глицерина и жирных кислот. Кроме того, создается слой энтеросолюбильного покрытия в качестве наружного покрытия и обеспечивается слой промежуточного покрытия для защиты бензимидазола от разрушения ингредиентами энтеросолюбильного покрытия. Когда этот способ используется в соответствии с этим изобретением, нет необходимости использовать какие-либо щелочные соединения или соли для дополнительной стабилизации бензимидазола. Таким образом исключается риск агрессивного действия энтеросолюбильного покрытия изнутри из-за выщелачивания щелочных соединений из ядра. Соответственно, данное изобретение представляет перораль-ную фармацевтическую лекарственную форму, содержащую 2-(2-пиридинил)метил]сульфинил]бензимидазол,обладающий противоязвенной активностью, в качестве активного ингредиента, причем указанная лекарственная форма содержит гранулы, имеющие по существу инертное ядро, покрытое i) внутренним покрывающим слоем, состоящим из бензимидазола, дезинтегранта и поверхностноактивного вещества в матрице из расплавленно 002502 8 го покрывающего вещества, по существу состоящего из одного или более сложных эфиров глицерина и жирных кислот, ii) наружным покрывающим слоем, являющимся энтеросолюбильным покрытием и iii) промежуточным покрывающим слоем, разделяющим энтеросолюбильный покрывающий слой и внутренний покрывающий слой для защиты бензимидазола от разрушения ингредиентами энтеросолюбильного покрытия. От первоначальных экспериментов, нацеленных на получение лекарственных форм для перорального приема, содержащих омепразол, с использованием методики гранулирования расплавом, подобной описанной в ЕР 0630235 В 1 для получения ядер, содержащих омепразол,отказались из-за свойств недостаточного растворения получающейся лекарственной формы. Однако в настоящее время открыто, что,принимая за основу лекарственной формы гранулы, имеющие по существу инертное ядро,покрытое внутренним покрывающим слоем,включающим бензимидазол, дезинтегрант и поверхностно-активное вещество в матрице из расплавленного покрывающего вещества, по существу состоящего из одного или более сложных эфиров глицерина и жирных кислот,может быть получена лекарственная форма омепразола, проявляющая удовлетворяющие требованиям фармакологические свойства, которые сравнимы со свойствами коммерческого препарата омепразола, который продается под торговой маркой лосек. (Лосек представлен в виде желатиновых капсул, которые в соответствии с информацией, находящейся в упаковке, содержат покрытые энтеросолюбильным покрытием гранулы, содержащие омепразол,маннит, гидроксипропилцеллюлозу, микрокристаллическую целлюлозу, безводную лактозу,лаурилсульфат натрия, дигидрат двузамещенного фосфата натрия, гидроксипропилметилцеллюлозу, сополимер метакриловой кислоты, макрогол 400 (полиэтиленгликоль 400), стеарат магния, двуокись титана и окись железа). Сложные эфиры глицерина и жирных кислот, использованные в качестве расплавленного покрывающего вещества, образующего матрицу для слоя, содержащего бензимидазол, в лекарственной форме, в соответствии с этим изобретением являются природными или синтетическими веществами, которые способны разлагаться системой нормального метаболизма жиров в организме. Матрица имеет функцию удерживания ингредиентов внутреннего покрывающего слоя вместе в едином, но не обязательно компактном слое. Жировая природа расплавленного покрывающего вещества означает, что в дополнение к обладанию эффектом связывания частиц других ингредиентов вместе в слой расплавленное покрывающее вещество будет иметь эффект покрытия частиц тонким слоем, защищающим их 9 от увлажнения до тех пор, пока он не разрушится в желудочно-кишечном тракте. Предпочтительным ингредиентом для расплавляемого покрывающего вещества является жир типа, называемого твердым жиром илиadeps solidus, который в соответствии с Европейской фармакопеей 1997 состоит из смеси триглицеридов, диглицеридов и моноглицеридов, которые могут быть получены или путем эстерификации жирных кислот природного происхождения с глицерином или путем трансэстерификации природных жиров и имеет температуру плавления, равную 30-45 С. Обычно твердый жир используется в качестве основы для суппозиториев. Дополнительным предпочтительным ингредиентом для расплавляемого покрывающего вещества является глицерилмоностеарат, и в частности, глицерилмоностеарат 40-50, который предпочтительно используется в сочетании с твердым жиром. По вышеназванной фармакопее глицерилмоностеарат 40-50 является смесью моноацилглицерола, главным образом стеароили пальмитоилглицерол, вместе с различными количествами ди- и триацилглицеролов. Он имеет температуру плавления, равную 54 - 64 С,и содержит не менее 40,0 процентов и не более 50,0 процентов моноацилглицеролов, рассчитанных на дигидроксипропилмоностеарат. Весовое отношение между твердым жиром и глицерилмоностеаратом 40-50, когда они используются в лекарственной форме по этому изобретению, обычно находится в интервале от 100:1 до 1:2, предпочтительно в интервале от 20:1 до 5:2. Ввиду термочувствительной природы, например, омепразола, использование расплавляемых покрывающих веществ с более высокими температурами плавления, предпочтительно,должно быть исключено. С другой стороны,температура плавления расплавляемого покрывающего вещества не должна быть настолько низкой, чтобы представлять затруднения во время манипуляций с лекарственной формой. Соответственно, температура плавления расплавляемого покрывающего вещества будет обычно находиться в интервале от 30 до 60 С,конкретно, в интервале от 30 до 50 С, и более конкретно, в интервале от 35 до 45 С. Расплавляемые покрывающие вещества,имеющие температуру плавления, близкую к температуре тела, примерно равную 37 С, особенно предпочтительны с той точки зрения, что они очень легко абсорбируются в кишечнике. Бензимидазол включается в лекарственную форму в тонко измельченной форме, а предпочтительно, в микронизированной форме. Размер частиц обычно составляет 50 мкм, а предпочтительно, 25 мкм, такой как 20 мкм,или даже 10 мкм. Дезинтегрант включается в матрицу так,чтобы дать возможность создания содержащего 10 бензимидазол слоя соответствующей толщины с сохранением в то же время достаточной скорости растворения активного ингредиента, когда энтеросолюбильное покрытие растворяется в тонком кишечнике. Кроме того, добавляется поверхностно-активное вещество. Дезинтегрант, используемый в матрице,предпочтительно представляет собой так называемый тип супердезинтегрантов,дезинтегранты этого типа хорошо известны опытному специалисту. В качестве примеров этих дезинтегрантов могут быть названы следующие: структурированные поливинилпирролидоны, в частности, кросповидон, модифицированные крахмалы, в частности, гликолят крахмала натрия, модифицированные целлюлозы, в частности, натрийкроскармеллоза (структурированная натрийкарбоксиметилцеллюлоза) и НГПЦ (низкозамещенная гидроксипропилцеллюлоза). Натрийкроскармеллоза, например, выпускается под торговым названием Ac-Di-Sol, а натрийкрахмалгликолят - под торговыми названиями примоджель (Primojel) и эксплотаб (Explotab). Коллидон CL и полипласдон XL являются коммерческими продуктами кросповидона. В предпочтительном в настоящее время варианте в качестве дезинтегранта используется кросповидон. Поверхностно-активное вещество, используемое в матрице, обычно является неионного или анионного типа, таким как полисорбат 80 или лаурилсульфат натрия, причем последний является особенно предпочтительным поверхностно-активным веществом для указанного применения. По существу инертные ядра, используемые в лекарственной форме по этому изобретению,будут по существу сферической формы и по существу одного размера с тем, чтобы обеспечить хорошо сформированную поверхность для покрывающего слоя, включающего активный ингредиент, хотя могут использоваться ядра других форм и смеси ядер разных размеров,если они дают лекарственную форму с соответствующими свойствами. Ядра должны быть изготовлены по существу из инертных материалов, таких как материалы, выбираемые из сахаров, крахмалов, модифицированных крахмалов,полимеров и их комбинаций. При предпочтительном воплощении используются ядра на основе сахарозы и крахмала по существу сферической формы, выпускаемые под названием нонпарель. Такие продукты можно, например, получить под торговой маркой ню-парель (Nu-Pareil). Эти продукты предлагаются в различных размерах, обычно с указанием настандартного сита США. Размеры обычно находятся в интервале от 200 до 1500 мкм, размеры сит 14/18, 16/20, 18/20, 20/25,25/30 и 30/35, соответствующие частицам с размерами в интервалах 1400 - 1000, 1180 - 850,1000 - 850, 850 - 710, 710 - 610 и 600 - 500, соот 11 ветственно. В предпочтительном в настоящее время воплощении используются ядра, имеющие размер в интервале от 850 до 1000 мкм. Как в основном известно специалистам,наружное энтеросолюбильное покрытие создается для защиты лекарственной формы от разрушения в желудке. Не ограничивающими примерами материалов, которые могут быть использованы с этой целью, являются ацетофталат целлюлозы,гидроксипропилметилцеллюлозы фталат, гидроксипропилметилцеллюлозы ацетофталат, ацетотримеллитат целлюлозы, карбоксиметилэтилцеллюлоза, различные сополимеры метакриловой кислоты, такие как метакриловая кислота/метакрилатные сополимеры и шеллак. Если желательно, могут быть добавлены различные вспомогательные вещества, такие как пластификаторы, пигменты, вещества, увеличивающие скольжение, и т.д. Не ограничивающими примерами веществ,которые могут использоваться с этой целью,являются триэтилцитрат и другие сложные эфиры лимонной кислоты, сложные эфиры фталевой кислоты, дибутилсебакат, триацетин, цетиловый спирт, полиэтиленгликоли и полисорбаты. В качестве не ограничивающих примеров пригодных пигментов могут быть упомянуты двуокись титана и окись железа, и тальк и двуокись кремния - в качестве не ограничивающих примеров подходящих веществ, улучшающих скольжение, для использования в энтеросолюбильном покрытии. В предпочтительном в настоящее время воплощении слой энтеросолюбильного покрытия состоит из сополимера метакриловой кислоты и метакрилата в сочетании с триэтилцитратом и микронизированным тальком. Промежуточный покрывающий слой создается для защиты омепразола от разрушения ингредиентами энтеросолюбильного покрытия. В качестве не ограничивающих примеров материалов, которые могут использоваться с этой целью, можно назвать гидроксипропилметилцеллюлозу, гидроксипропилцеллюлозу и поливинилпирролидон. Если желательно, могут быть добавлены различные вспомогательные вещества, такие как пластификаторы, пигменты, улучшающие скольжение вещества и т.д., как упомянуто выше. В предпочтительном в настоящее время варианте промежуточный покрывающий слой состоит из гидроксипропилметилцеллюлозы в сочетании с двуокисью титана и микронизированным тальком. Однако промежуточный покрывающий слой может также включать слой расплавляемого покрывающего вещества, по существу состоящего из одного или более сложных эфиров глицерина и жирных кислот, необязательно включающий вспомогательные вещества, такие как дезинтегрант и/или поверхностно-активное 12 вещество, но без бензимидазола, причем указанный слой создается или в виде единственного промежуточного покровного слоя или в качестве дополнительного слоя. Относительные количества, по весу, ингредиентов в лекарственной форме по данному изобретению будут обычно такими, которые показаны в таблице 1, ниже, в которой указаны также предпочтительные количества, общее количество ингредиентов, названных в таблице и других ингредиентов, которые могут присутствовать в гранулах, равно 100%. Таблица 1 ПредпочтиИнгредиент Обычное тельное Бензимидазол 3-20% 10-15% Поверхностно 0,5-10% 1,5-5,0% активное вещество Дезинтегрант 0,5-15% 2,5-10,0% Инертные ядра 60-90% 70-80% Сложный эфир гли 2-15% 3-10% церина При предпочтительном варианте лекарственная форма по этому изобретению помещается в желатиновые капсулы, причем каждая капсула обычно содержит одну дозу, такую, как 10,20 или 40 мг омепразола, 40 мг пантопразола или 15 или 30 мг лансопразола. Конкретно названные дозы соответствуют дозам, содержащимся в капсуле препаратов, которые продаются в настоящее время. Изобретение также относится к процессу изготовления пероральной фармацевтической лекарственной формы, которой дано определение выше, причем указанный процесс включает этап получения по существу инертных ядер с покрывающим слоем, состоящим из бензимидазола, дезинтегранта и поверхностно-активного вещества в матрице из расплавляемого покрывающего вещества, по существу состоящего из одного или более сложных эфиров глицерина и жирных кислот, с помощью способа покрытия расплавом. В частности, данное изобретение относится к способу, включающему стадии:i) смешивания бензимидазола с поверхностно-активным веществом и дезинтегрантом,ii) перемешивания смеси, полученной на стадии i) с по существу инертными ядрами при нагревании до температуры выше температуры плавления расплавляемого покрывающего вещества,iii) добавления расплавляемого покрывающего вещества к смеси, полученной на стадии ii) при перемешивании и нагревании до температуры выше температуры плавления расплавляемого покрывающего вещества,iv) продолжения перемешивания и нагревания до температуры выше температуры плавления расплавляемого покрывающего вещества до тех пор, пока не получится достаточное покрытие ядер, иv) охлаждения покрытых ядер, полученных на стадии iv) до комнатной температуры. По существу инертные ядра, предпочтительно, перед перемешиванием на стадии ii) нагревают до температуры выше температуры плавления расплавляемого покрывающего вещества, тем самым облегчается процесс покрытия. Обычно будет достаточна температура на 0- 20 С, и конкретно на 5 - 15 С выше температуры плавления расплавляемого покрывающего вещества. Расплавляемое покрывающее вещество можно добавлять в виде расплава на стадии iii) или его можно добавлять в твердом виде, например, как тонко измельченное твердое вещество, или в виде тонких хлопьев. В предпочтительном в настоящее время варианте его добавляют в виде расплава. Когда получено достаточное покрытие ядер, покрытые ядра охлаждают до комнатной температуры. Охлаждение может выполняться в одну стадию или более. В предпочтительном в настоящее время варианте охлаждение выполняется в две стадии, причем первая стадия осуществляется при непрерывном перемешивании до тех пор, пока не будет достигнута температура слегка выше температуры плавления расплавляемого покрывающего вещества, а вторая стадия выполняется путем охлаждения в лотке. При конкретном воплощении способ включает дополнительные стадии покрытия полученных по существу инертных ядер покрывающим слоем, содержащим бензимидазол, дезинтегрант и поверхностно-активное вещество в матрице из расплавляемого покрывающего вещества, промежуточным покрывающим слоем и наружным покрывающим слоем, причем наружный покрывающий слой является энтеросолюбильным покрытием, а промежуточный покрывающий слой применяется для защиты омепразола от разрушения ингредиентами энтеросолюбильного покрытия. И наконец полученные покрытые гранулы могут распределяться по желатиновым капсулам, причем каждая капсула предпочтительно содержит разовую дозу, такую как доза в 10, 20 или 40 мг омепразола, доза в 40 мг пантопразола или доза 15 или 30 мг лансопразола. Данное изобретение будет теперь далее описано в следующих не ограничивающих примерах. Пример 1. А. Покрытие инертных ядер слоем, содержащим омепразол.II Лаурилсульфат натрия 60,0 III Коллидон CL (кросповидон) 100,0 IV Ню-Парель PG 18/20 1400,0 V Вайтепсол Н 15) 94,1 VI Глицерилмоностеарат 40-50 6,114 Смесь V и VI 75,0 Смесь V и VI 12,0 ) Твердый жир, имеющий температуру плавления 35 С.I, II и III интенсивно перемешивают и нагревают до температуры 40 С, после чего IV перемешивают с I+II+III в смесителе, предварительно нагретом до 40 С в течение 30 с. В смеситель добавляют 75,0 г тонко измельченной смеси V и VI и перемешивают сI+II+III+IV в течение 2 мин. Температура продукта после перемешивания: 43 С. Затем далее добавляют 12,0 г тонко измельченной смеси V и VI и перемешивание продолжают в течение примерно 3 мин, до тех пор, пока температура продукта не достигнет 45 С. После дополнительного перемешивания в течение 2 мин при температуре в кожухе, равной 35 С, продукт удаляют из смесителя и переносят на лотки для дальнейшего охлаждения до комнатной температуры. В. Покрытие промежуточным слоем. 250 г гранул, изготовленных, как описано в А, переносят в комбинированный аппарат для нанесения покрытия, где их покрывают 144,5 г покрывающей жидкости, полученной путем смешивания 15 частей ГПМЦ 5, 6 частей микронизированного талька, 6 частей двуокиси титана и 285 частей очищенной воды, все части являются весовыми. После сушки при 30 С в течение 30 мин продукт охлаждают до комнатной температуры и взвешивают. С. Покрытие энтеросолюбильным покрытием. Гранулы с покрытием, полученные в В,покрывают 250 г свежеприготовленной покрывающей жидкости, полученной перемешиванием смеси 22,5 частей микронизированного талька, 0,5 части противопенной эмульсии, 4,5 частей цитрофлекса 2 (Citroflex) (триэтилцитрата) и 78 частей очищенной воды и смеси из 135 частей эудраджита L 30 D - 55 (Eudragit) (водная дисперсия метакриловой кислоты - метилметакрилатного сополимера) и 60 частей очищенной воды, все части являются весовыми частями. Пример 2. А. Покрытие инертных ядер слоем, содержащим омепразол.VI Глицерилмоностеарат 40-50 72,0 Смесь I+II и III, полученную перемешиванием в смесителе, добавляют в смеситель, содержащий IV, предварительно нагретый до температуры примерно 40 С при перемешивании 15 при 140 об/мин, после чего перемешивание продолжают в течение 30 с при нагревании кожуха до температуры 40-45 С. При перемешивании при 140 об/мин, добавляют жидкую смесь V+VI, нагретую до 45 50 С. Оставляют примерно 10% смеси V+VI. Перемешивают в течение 2 мин. После соскабливания со стенок, если необходимо, перемешивание продолжают в течение 30 с. Добавляют оставшиеся 10% V + VI и перемешивание продолжают в течение 2 мин. Затем температуру кожуха снижают примерно до 38 С, и перемешивание продолжают в течение 2 мин при 140 об/мин. Продукт переносят в лотки для охлаждения при комнатной температуре. Фракцию гранул от 0,8 до 1,25 мм получают просеиванием. На полученных гранулах может быть создан промежуточный и энтеросолюбильный покрывающие слои таким же образом, который описан в примере 1. Предварительное изучение биоэквивалентности Желатиновые капсулы размера 1, содержащие 220 мг гранул, полученных, как описано в примере 1 (содержание омепразола 20 мг), 002502 16 сравнивали с коммерческими капсулами Лосека, содержащими 20 мг омепразола в перекрестном исследовании по единственной дозе со случайной выборкой, проведенном на 8 здоровых мужчинах. Результаты представлены в таблице 2, показывающей максимальные концентрации в плазме Смах, время достижения максимальной концентрации в плазме, Тмах, и площадь под кривой концентраций в плазме, ППК 0(AUC0-), для обоих продуктов, а также Fотн,отношение между ППК 0- для продукта по данному изобретению и ППК 0- для известного продукта. Определяли значения среднего арифметического, СО, СКО и KB, %КВ, показывающий стандартное отклонение, СО, как процент от среднего значения. Как будет видно, биодоступность продукта по этому изобретению сравнима с биодоступностью известного продукта. Однако также, повидимому, колебания биодоступности от субъекта к субъекту для продукта по данному изобретению меньше, чем для известного продукта,как показано более низкими значениями %КВ для Смах И ППК 0-. Таблица 2 Тесты на растворение Определение количественного содержания омепразола в гранулах, полученных по примеру 1. Осуществляли 6 определений. Образцы анализировали ВЭЖХ. Среднее значение составляло 8,6 мг омепразола на 100 мг гранул с относительным стандартным отклонением 3,8%. Определение количественного содержания омепразола в гранулах, полученных по примеру 1, после перемешивания в 0,1N НСl при 37 С в течение 120 мин. Осуществляли 6 определений после перемешивания в 0,1N НСl при 37 С в течение 120 мин. Образцы анализировали ВЭЖХ. Разложение омепразола кислотой не было обнаружено. Среднее значение омепразола составляло 8,6 мг омепразола на 100 мг гранул с относительным стандартным отклонением 4,3%. Растворение омепразола из гранул, полученных по примеру 1, после перемешивания в 0,1N НСl при 37 С в течение 120 мин. Осуществляли 6 определений в аппарате для расстворения при рН 7,2 после перемеши 17 вания гранул в 0,1N НСl при 37 в течение 120 мин. Образцы анализировали ВЭЖХ. После 60 мин более чем 89% омепразола,содержащегося в гранулах, было растворено с относительным стандартным отклонением. Процент растворения после 15, 30 и 120 мин составлял 90%, 87% и 85% соответственно. Растворение омепразола из гранул, полученных по примеру 2, после перемешивания в 0,1N НСl при 37 С в течение 120 мин. Четыре партии имеющих энтеросолюбильное покрытие гранул, полученных по примеру 2,были испытаны на растворение после перемешивания в 0,1N НСl при 37 С в течение 120 мин, как описано выше. Результаты показаны в табл.3. Партия 805302 806001 807001 807601 В предшествующем изобретение было описано посредством конкретных примеров предпочтительных воплощений. Однако будет понятно, что квалифицированным специалистом могут быть произведены различные модификации без выхода из сущности и объема данного изобретения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Пероральная фармацевтическая лекарственная форма, включающая 2-(2-пиридинил)метил]сульфинил]бензимидазол, обладающий противоязвенной активностью, в качестве активного ингредиента, причем указанная лекарственная форма состоит из гранул,имеющих, по существу, инертное ядро, покрытое i) внутренним покрывающим слоем, состоящим из бензимидазола, дезинтегранта и поверхностно-активного вещества в матрице из расплавляемого покрывающего вещества, по существу, состоящего из одного или более сложных эфиров глицерина и жирных кислот, ii) наружным покрывающим слоем, являющимся энтеросолюбильным покрытием, и iii) промежуточным покрывающим слоем, разделяющим слой энтеросолюбильного покрытия и слой внутреннего покрытия. 2. Лекарственная форма по п.1, в которой расплавляемое покрывающее вещество имеет температуру плавления в интервале от 30 до 60 С, в частности в интервале от 30 до 50 С и более конкретно в интервале от 35 до 45 С. 3. Лекарственная форма по п.1 или 2, в которой расплавляемое покрывающее вещество,по существу, состоит из смеси твердого жира и глицерилмоностеарата 40-50. 4. Лекарственная форма по п.3, в которой весовое соотношение твердого жира и глицерилмоностеарата 40-50 находится в интервале 18 от 100:1 до 1:2 и предпочтительно в интервале от 20:1 до 5:2. 5. Лекарственная форма по любому из предшествующих пунктов, в которой дезинтегрант является супердезинтегрантом, в частности кросповидоном. 6. Лекарственная форма по любому из предшествующих пунктов, в которой бензимидазол является микронизированным. 7. Лекарственная форма по любому из предшествующих пунктов, в которой поверхностно-активное вещество является анионным или неионным поверхностно-активным веществом,в частности лаурилсульфатом натрия. 8. Лекарственная форма по любому из предшествующих пунктов, в которой инертные ядра, по существу, представляют собой нонпарели, полученные из сахарозы и крахмала и имеют размер в интервале от 200 до 1500 мкм, в частности в интервале от 850 до 1000 мкм. 9. Лекарственная форма по любому из предшествующих пунктов, в которой слой энтеросолюбильного покрытия включает сополимер метакриловой кислоты и метилметакрилата,необязательно в сочетании с пластификатором,в частности триэтилцитратом, и/или другими возможными вспомогательными веществами, в частности микронизированным тальком. 10. Лекарственная форма по любому из предшествующих пунктов, в которой промежуточный покрывающий слой включает гидроксипропилметилцеллюлозу, необязательно в сочетании с двуокисью титана, микронизированным тальком и/или другими возможными вспомогательными веществами. 11. Лекарственная форма по любому из предшествующих пунктов, в которой промежуточный покрывающий слой включает слой из расплавляемого покрывающего вещества, по существу, состоящего из одного или более сложных эфиров глицерина и жирных кислот,необязательно включающий вспомогательные вещества, такие как дезинтегрант и/или поверхностно-активное вещество, но без бензимидазола. 12. Лекарственная форма по любому из предшествующих пунктов, в которой бензимидазол является омепразолом, пантопразолом или лансопразолом. 13. Лекарственная форма по любому из предшествующих пунктов, которая представлена в виде разовой дозы в желатиновой капсуле,в частности в виде разовой дозы, равной 10, 20 или 40 мг омепразола, 40 мг пантопразола или 15 или 30 мг лансопразола. 14. Способ получения пероральной фармацевтической лекарственной формы по любому из предшествующих пунктов, отличающийся тем, что включает стадию получения, по существу, инертных ядер с покрывающим слоем,содержащим бензимидазол, дезинтегрант и поверхностно-активное вещество в матрице из расплавляемого покрывающего вещества, по существу, состоящего из одного или более сложных эфиров глицерина и жирных кислот,методом покрытия расплавом. 15. Способ по п.14, отличающийся тем, что включает стадииi) смешивания бензимидазола c поверхностно-активным веществом и дезинтегрантом,ii) перемешивания смеси, полученной на стадии i), по существу, с инертными ядрами при нагревании до температуры выше температуры плавления расплавляемого покрывающего вещества,iii) добавления расплавляемого покрывающего вещества к смеси, полученной на стадии ii), при перемешивании и нагревании до температуры выше температуры плавления расплавляемого покрывающего вещества,iv) продолжения перемешивания и нагревания до температуры выше температуры плавления расплавляемого покрывающего вещества до тех пор, пока не будет получено достаточное покрытие ядер, иv) охлаждения покрытых ядер, полученных на стадии iv), до комнатной температуры. 16. Способ по п.15, в котором, по существу, инертные ядра нагревают до температуры выше температуры плавления расплавляемого 20 покрывающего вещества перед перемешиванием на стадии ii). 17. Способ по п.15 или 16, в котором расплавляемое покрывающее вещество добавляют в виде расплава на стадии iii). 18. Способ по п.15 или 16, в котором расплавляемое покрывающее вещество добавляют в виде тонкоизмельченного твердого вещества на стадии iii). 19. Способ по любому из пп.15-18, в котором охлаждение до комнатной температуры на стадии v) осуществляют в два этапа, первый этап проводится при непрерывном перемешивании до тех пор, пока не будет достигнута температура слегка выше температуры плавления расплавляемого покрывающего вещества, а второй этап осуществляется охлаждением в лотке. 20. Способ по любому из пп.14-19, включающий дополнительные стадии покрытия полученных, по существу, инертных ядер, покрытых покрывающим слоем, включающим бензимидазол, дезинтегрант и поверхностно-активное вещество в матрице из расплавляемого покрывающего вещества, промежуточным покрывающим слоем и наружным покрывающим слоем, причем наружный покрывающий слой является энтеросолюбильным покрытием.
МПК / Метки
МПК: A61K 31/44, A61P 1/04
Метки: способ, лекарственной, включающая, активностью, лекарственная, сульфинил, метил, фармацевтическая, изготовления, формы, противоязвенной, 2-[[(2-пиридинил, обладающий, бензимидазол, форма
Код ссылки
<a href="https://eas.patents.su/11-2502-farmacevticheskaya-lekarstvennaya-forma-vklyuchayushhaya-2-2-piridinil-metil-sulfinil-benzimidazol-obladayushhijj-protivoyazvennojj-aktivnostyu-i-sposob-izgotovleniya-takojj-lekars.html" rel="bookmark" title="База патентов Евразийского Союза">Фармацевтическая лекарственная форма, включающая 2-[[(2-пиридинил) метил] сульфинил] бензимидазол, обладающий противоязвенной активностью, и способ изготовления такой лекарственной формы</a>
Предыдущий патент: Анальгетическое средство “тетралгин” и способ его получения
Следующий патент: Способ противоточной регенерации ионитов
Случайный патент: Тетрагидропиримидоазепины и их применение в качестве модуляторов trpv1