Способ производства промежуточных продуктов артемизинина
Формула / Реферат
1. Способ получения соединения формулы I
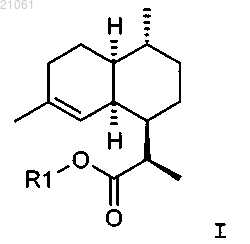
где R1 представляет собой водород, или линейный или разветвленный алкил, имеющий 1, 2, 3, 4, 5 или 6 атомов углерода, или циклоалкил, имеющий 3, 4, 5, 6 или 7 атомов углерода,
включающий введение в реакцию соединения формулы III
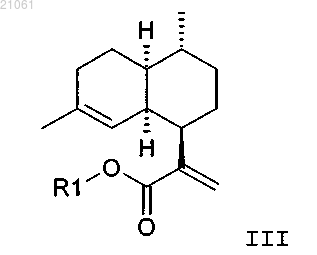
с диимином, где диимин получают in situ.
2. Способ по п.1, где диимин образуется из гидроксиамина и гидроксиамин О-сульфоновой кислоты в присутствии основания.
3. Способ по п.1, где диимин образуется из гидроксиамин-О-сульфоновой кислоты в присутствии основания.
4. Способ по п.1, где диимин образуется из гидроксиамина и сложного эфира уксусной кислоты.
5. Способ по п.1, где диимин образуется из гидразина и окислителя.
6. Способ по п.1, где диимин образуется из катализируемого кислотой декарбоксилирования азодикарбоксилата.
7. Способ по любому из пп.1-6, дополнительно включающий окисление соединения формулы I до артемизинина II
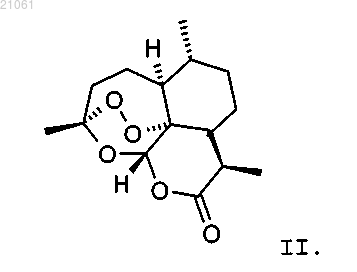
Текст
СПОСОБ ПРОИЗВОДСТВА ПРОМЕЖУТОЧНЫХ ПРОДУКТОВ АРТЕМИЗИНИНА Данное изобретение относится к способу получения (2R)-дигидроартемизининовой кислоты или сложных эфиров (2R)-дигидроартемизининовой кислоты из артемизининовой кислоты или сложных эфиров артемизининовой кислоты, соответственно, дииминовой гидрогенизацией экзоциклической СС-двойной связи и применению указанного способа в производстве противомалярийного лекарственного средства артемизинина. Заявка на данный патент заявляет приоритет по 35 U.S.С.119 предварительной заявки США 61/241744, поданной 11 сентября 2009 г., которая включена ссылкой во всей полноте. Малярия представляет собой тропическое заболевание и широко распространена в Африке, ЮгоВосточной Азии и Южной Америке. Приблизительно 300-500 млн людей инфицированы малярией, что делает ее одним из основных инфекционных заболеваний в мире. В 2006 году было зарегистрировано приблизительно 1,5-2,7 млн смертей от малярии и большая часть смертей имела место среди детей в возрасте до пяти лет. Контролю заболевания препятствует возникновение штаммов паразита Plasmodiumfalciparum с мультиустойчивостью к лекарственным средствам. Следовательно, важной задачей для здоровья населения планеты является разработка новых противомалярийных препаратов и альтернативных способов производства противомалярийных лекарственных средств. Одним из таких противомалярийных лекарственных средств является артемизинин формулы II сесквитерпен лактон эндопероксид, который представляет собой компонент лекарственного растения традиционной китайской медицины Artemisia annua. В Китае его применяют для контроля симптомов лихорадки более 1000 лет. В научной литературе артемизинин также иногда называют по его китайскому наименованию Цинхаосу. Недавно были сделаны успехи в понимании свойств и структуры данной молекулы. Соединение впервые выделили в 1972 году. Его противомалярийная активность была обнаружена в 1979 году. Первый полный синтез молекулы был осуществлен химиками в Hoffmann-La Roche в 1983 г. (G. Schmidt, W. Hofheinz, J. Am. Chem. Soc., 105, 624 (1983. Артемизинин высокоэффективен против мультиустойчивого к лекарственным средствам Plasmodium spp., однако находится в ограниченных запасах и является дорогим для большинства страдающих от малярии. Производство артемизинина можно осуществлять несколькими путями. Один способ включает экстракцию артемизинина из Artemisiaannua. Недостатком данного способа являются низкие и непостоянные выходы (0,001-0,8%) артемизинина из растения (Wallaart и соавт., Planta Med; 66, 57 (2000); Abdin и соавт., Planta Med; 69, 289 (2003. Альтернативная процедура получения артемизинина включает экстракцию биосинтетической молекулы-предшественника - артемизининовой кислоты формулы IIIa из Artemisia annua и затем синтетическое преобразование данной молекулы за несколько этапов синтеза в артемизинин. Поскольку кислота формулы IIIa может присутствовать в Artemisia annua на уровнях приблизительно в 10 раз более высоких, чем артемизинин, преобразование предыдущей в противомалярийное лекарственное средство привлекло много внимания. Однако выходы соединения IIIa изArtemisia annua являются непостоянными и, несмотря на быстрый рост Artemisia annua, в настоящее время приблизительно оценено, что мировой запас растения удовлетворит менее 10% мировых потребностей в артемизининовой кислоте и артемизинине (WO 2006/128126). Другая альтернативная процедура производства представляет собой полный синтез артемизинина. Однако такой полный синтез предполагает большое количество этапов синтеза и не является эффективным и экономичным в целях обеспечения больших количеств желаемого лекарственного средства. С другой стороны, этот полусинтез из дорогостоящего биосинтетического предшественника, такого как артемизининовая кислота формулы IIIa, полученного ферментацией созданного методами генетической инженерии микроорганизма, может быть экономичным, не оказывающим отрицательного воздействия на окружающую среду, высококачественным и надежным источником артемизинина. В связи с этим, большого прорыва в 2006 году достигли химики из компании "Amyris Inc." и Калифорнийского университета,Беркели, которые разработали ферментативный способ со сконструированными дрожжами, продуцирующими высокие титры артемизининовой кислоты формулы IIIa, используя сконструированный мевалонатный путь, аморфадиен синтазу и новую цитохром монооксигеназу Р 450 из Artemisia annua, который представляет собой трехэтапное окисление аморфа-4,11-диена в промежуточный продукт формулы IIIa(J.D. Keasling и соавт., Nature, 440, 940 (2006. Два года спустя титры увеличили до еще более высоких и еще более экономичных уровней (R. Regentin и соавт., Biotechnol. Prog.; 24, 1026 (2008. Регио- и стереоселективное восстановление артемизининовой кислоты или сложных эфиров арте-1 021061 мизининовой кислоты можно выполнить, используя следующие способы. а) Восстановление с боргидридом лития (LiBH4) и хлоридом никеля (NiCl2), комбинацией реагентов, часто называемой никель борид, образовывает смесь желаемой диастереомерной дигидроартемизиновой кислоты или (2R)-изомера I и нежелательного (2S)-изомера IV сложного эфира дигидроартемизиновой кислоты в соотношении 85:15, что представляет собой недостаточную стереоселективность (X. Xu и соавт.,Tetrahedron; 42, 819 (1986. К тому же необходим достаточно большой избыток реагента гидрида, что делает процедуры выполнения и обработки сложными в большом масштабе. Кроме того, способ восстановления запрещен для соединений формулы III, где R1 представляет собой не Н, и не описан как восприимчивый к действию свободной кислоты формулы IIIa (см. WO 2006/128126). В ранней работе говорилось о полной стереоселективности для данного превращения (М. Jung и соавт.; Synlett; 74 (1990,однако высокая диастереоселективность не может быть воспроизведена и подтверждена позже другими(см. WO 2006/128126). На самом деле, соотношение продукта не превысило результатов восстановления боридом никеля. Также описаны некоторые изменения данной процедуры, проявляющие те же недостатки, как описано выше (например, by R.J. Roth и соавт., US 4992561). б) Регио- и диастереоселективная гомогенная каталитическая гидрогенизация, которая была разработана Knowles и Noyori (W.S. Knowles и соавт., J. Am. Chem. Soc., 99, 5946 (1977); R. Noyori и соавт., J.Am. Chem. Soc., 102, 7932 (1980, использует переход металла-катализатора, который может быть хиральным, для достижения диастеро- или энантиоселективной гидрогенизации алкена соответственно. Например, K. Reiling и соавт. (WO 2006/128126) выполнили желаемое превращение кислоты формулыIIIa в кислоту формулы Ia (т.е. соединение формулы I, где R1 представляет собой водород), используя ахиральный катализатор Уилкинсона на основе родия для получения смеси (2R)/(2S)-стереоизомеров с соотношением 85:15. Однородная каталитическая гидрогенизация, использующая комплексы переходных металлов, которые являются, однако, очень дорогими из-за драгоценных металлов (например, родия или рутения) и комплекса органических лигандов, сложного восстановления металла и лиганда, зачастую низких загрузок субстрата к катализатору и скоростям обмена, восприимчивости реакционной смеси к отравляющим веществам катализатора и потребности в дорогом оборудовании реактора высокого давления, например работающем при давлении водорода до 60 бар в больших масштабах. Обеспечен способ получения соединения формулы I или из коммерчески доступных материалов,или из соединений, уже описанных в литературе, которые, в свою очередь, легко получаемы из коммерчески доступных материалов. Можно применять простые и экологически безопасные реагенты и растворители для достижения высоких общих выходов и высокой чистоты продуктов, которые могут быть выполнены в промышленном масштабе. Соединение формулы I можно получить гидрогенизацией (восстановлением) соединения формулыIII, используя диимин в качестве гидрирующего (восстанавливающего) средства. Способ приводит к высокому выходу и хорошей регио- и диастереоселективности. Также предусмотрен способ получения соединения формулы I где R1 представляет собой водород, или линейный или разветвленный алкил, имеющий 1, 2, 3, 4, 5 или 6 атомов углерода, или циклоалкил, имеющий 3, 4, 5, 6 или 7 атомов углерода,предусматривающий введение в реакцию соединения формулы III с диимином. В некоторых вариантах осуществления R1 представляет собой водород. Также предусмотрен способ получения соединения формулы I где R1 представляет собой линейный или разветвленный алкил, имеющий 1, 2, 3, 4, 5 или 6 атомов углерода, или циклоалкил, имеющий 3, 4, 5, 6 или 7 атомов углерода,предусматривающий этерификацию соединения формулы IIIa для получения соединения формулы III где R1 представляет собой линейный или разветвленный алкил, имеющий 1, 2, 3, 4, 5 или 6 атомов углерода, или циклоалкил, имеющий 3, 4, 5, 6 или 7 атомов углерода,и впоследствии введение в реакцию соединения формулы III с диимином. Диимин представляет собой реакционноспособный реагент, который также называют диимид или диазен и который имеет химическую формулу HN=NH. В некоторых вариантах формирования диимин образуется in situ. Некоторые способы получения диимина включают (i) окисление гидразина окислителем, таким как пероксид водорода или кислород,необязательно в присутствии катализатора Cu(I), (ii) катализируемое кислотой декарбоксилирование азодикарбоксилата, например декарбоксилирование двунатриевого или дикалиевого азодикарбоксилата уксусной кислотой, пропионовой кислотой, муравьиной кислотой, винной кислотой, лимонной кислотой или щавелевой кислотой, (iii) обработку гидроксиламина сложным эфиром уксусной кислоты, например метилацетатом или этилацетатом, (iv) обработку гидроксиламин-О-сульфоновый кислоты основанием,или (v) обработку гидроксиламин-О-сульфоновой кислоты и гидроксиламина основанием, например гироксидом щелочного или щелочно-земельного металла, таким как гидроксид натрия, или гидроксид калия, или метилат натрия, этаноат натрия, метаноат калия, этаноат калия, трет-бутилат натрия, третбутилат калия или аминоподобный триэтиламин, трибутиламин или N-метиланилин. Доступны различные способы образования диимина и они описаны, например, авторами D.J. Pasto, R.T. Taylor в работе"Organic Reactions", 40, 91-155, 1991. Альтернативно, соединение формулы I можно выделить способами, известными в данной области техники, например хроматографией или кристаллизацией, которые в некоторых вариантах осуществления могут дополнительно увеличивать диастереомерную чистоту продукта. Этерификацию соединения формулы IIIa можно выполнить способом, известным в данной области техники, например, как описано W. Greene и соавт.; Protective Groups in Organic Synthesis, Wileylnterscience 3-е издание, глава 5 (1999). Например, реакции этерификации можно выполнить следующими способами: или I, и в некоторых вариантах осуществления X представляет собой Cl или Br; или(ii) введением в реакцию соединения IIIa с диазоалканом (например, с диазометаном для обеспечения сложного метилового эфира); или(iii) получением хлорангидрида кислоты формулы IIIb из соединения IIIa способами, известными в данной области техники, и последовательным введением в реакцию хлорангидрида кислоты со спиртом формулы R1-OH; или (iv) конденсированием соединения формулы IIIa с соответствующим спиртом формулы R1-OH в присутствии карбонилдиимидазола, карбодиимида или хлорформиата. Обнаружено, что артемизининовая кислота IIIa или ее сложноэфирные производные общей формулы III могут быть гидрогенизированы (восстановлены) при умеренных условиях и с высоким выходом с хорошей регио- и диастереоселективностью, без дорогостоящих драгоценных металлов и лигандов, используя полученный диимин in situ. Достаточные количества артемизининовой кислоты IIIa доступны из нескольких источников, например из растительной экстракции из Artemisia annua (R.J. Roth и соавт., Planta Med; 53, 501 (1987, или из способа дрожжевого брожения, как описано J. D. Keasling и соавт. (Nature, 440, 940 (2006. Соединения формулы III, где R1 представляет собой линейный или разветвленный алкил, имеющий 1, 2, 3, 4, 5 или 6 атомов углерода, или циклоалкил, имеющий 3, 4, 5, 6 или 7 атомов углерода, могут быть получены этерификацией артемизининовой кислоты IIIa с помощью способов, как правило, известных специалистам в данной области техники. Например, X. Xu и соавт., Tetrahedron 42, 819 (1986), описывает синтез сложного метилового эфира артемизининовой кислоты (соединение формулы III, где R1 представляет собой метил) введением в реакцию артемизининовой кислоты с CH2N2, например, в эфире при 0 С. Zhou и соавт. (Huaxue Xuebao 43(9), 845-851, 1985) описывает синтез сложного трет-бутилового эфира артемизининовой кислоты образованием смеси ангидрида артемизининовой кислоты с хлорангидридом триметилуксусной кислоты и обработку продукта трет-бутаноатом натрия. Дополнительные примеры процедур преобразования кислот в сложные эфиры предусмотрены, например, в работе W. Greene и соавт.;Protective Groups in Organic Synthesis Синтез, Wiley-lnterscience 3-е издание, глава 5 (1999). Соединение формулы I можно окислить до артемизинина формулы II способами, известными в данной области техники, например как описано X. Xu и соавт. (Tetrahedron; 42, 819 (1986, R.J. Roth и соавт. (US 4992561) и K. Reiling и соавт. (WO 2006/128126), т.е. окислением соединения формулы I пероксидом водорода и двуводным молибдатом натрия с последующим вторым окислением кислородом в присутствии трифторметансульфоната меди (II) для выхода артемизинина формулы II. В соединении формулы I, где R1 представляет собой линейный или разветвленный алкил, имеющий 1, 2, 3, 4, 5 или 6 атомов углерода, или циклоалкил, имеющий 3, 4, 5, 6 или 7 атомов углерода, соединение сложного эфира может быть предварительно расщеплено до соединения формулы I, где R1 представляет собой Н посредством способов, известных в данной области техники, как это описано W.Greene и соавт., Protective Groups in Organic Synthesis, Wiley-lnterscience 3-е издание, например введением в реакцию указанного соединения с основанием. Также предусмотрен способ получения артемизинина формулы II, где соединение формулы IIIa вводят в реакцию с диимином для выхода соединения формулы Ia, и затем соединение Ia окисляют до артемизинина формулы II, как описано выше. Следующие варианты осуществления настоящего изобретения содержат процедуры образования диимина in situ, которые, как оказалось, пригодны для способа гидрогенизации (восстановления), описанного в данном документе. Они предусмотрены с целью иллюстрации, а не с целью ограничения, поскольку специалисты в данной области с легкостью установят, что другие экспериментальные процедуры также применимы для образования диимина in situ и дадут такие же результаты; подробные условия реакции будут зависеть от способа, выбранного для осуществления образования диимина. Диапазоны должны пониматься как такие, которые включают все значения между указанными конечными точками. Например, диапазон температуры от приблизительно 15 до 25 С включает все без исключения температуры между приблизительно 15 и приблизительно 25 С. Подобным образом диапазон времени 1-3 ч включает все без исключения значения времени между 1 и 3 ч. В некоторых вариантах осуществления соединение формулы III растворяют в воде. В некоторых вариантах осуществления, когда R1 в соединении формулы III представляет собой водород, соединение формулы III представляет собой артемизининовую кислоту, соединение формулы IIIa. Альтернативно,можно добавить органический вспомогательный растворитель, выбранный из смешиваемого с водой рас-4 021061 творителя, такого как метанол, этанол, n-пропанол, изопропанол, диоксан, тетрагидрофуран и диметилформамид. В некоторых вариантах осуществления добавляют спирт с низкой точкой кипения, такой как метанол, этанол или изопропанол. В некоторых вариантах осуществления добавляют метанол или этанол. В некоторых вариантах осуществления можно добавить основание для регулирования значения рН между 4 и 14, такого как между 8 и 10. Примеры основания представляют собой гидроксид натрия, гидроксид калия, гидроксиды других щелочных или щелочно-земельных металлов, метилат натрия, этаноат натрия, метаноат калия, этаноат калия, трет-бутилат натрия, трет-бутилат калия или аминоподобный триэтиламин, трибутиламин или N-метиланилин. В качестве примера способов, пригодных для образования диимина, добавляют гидроксиламин и гидроксиламин-О-сульфоновую кислоту (H2N-OSO3H,HOSA) к реакционной среде при поддержании постоянного рН в диапазоне между 6 и 14, добавлением по меньшей мере одного основания из перечисленных выше. В некоторых вариантах осуществления рН поддерживают на неизменном уровне в диапазоне между 8 и 10. В некоторых вариантах осуществления по меньшей мере 1 экв. или избыток, например 1,0-7,0, экв., каждого гидроксиламина и HOSA применяют для выполнения способа. В некоторых вариантах осуществления диапазон температуры реакции составляет от -60 до 120 С. В некоторых вариантах осуществления диапазон температуры реакции составляет от -20 до 60 С. Время реакции является изменчивым и зависит от масштаба реакции, основания,растворителя и температуры, выбранных для данного способа. Время реакции может составлять от 0,5 до 24 ч, в то время как температура реакции составляет от 60 до -20 С. Выход реакции можно регулировать контролем реакции, например, используя технику обращено-фазовой высокоэффективной жидкостной хроматографии (RP-HPLC), перед подачей смеси на процедуру выделения. После полного расходования субстрата соединение формулы I, полученное способом, можно выделить способами, известными специалистам данной области техники. Данные процедуры могут включать водное выделение реакционной смеси или хроматографию реакционной смеси. Пример общепринятой процедуры выделения включает подкисление реакционной смеси, например соляной кислотой, и затем экстракцию желаемого продукта формулы I, например стандартной экстракцией с растворителем, не смешивающимся с водой, таким как 2-метилтетрагидрофуран, дихлорметан, метил-трет-бутиловый эфир (МТВЕ), толуол, этилацетат, гептан,циклогексан, метилизобутилкетон, бензол или изобутил ацетат. В некоторых вариантах осуществления несмешиваемый с водой растворитель представляет собой дихлорметан или МТВЕ. Стандартные водные процедуры выделения обеспечивают выделение соединения формулы I. Альтернативно, желаемый продукт можно получить хроматографической очисткой или кристаллизацией. Диастереомерное соотношение сырых продуктов формулы I:IV, которое можно достичь данной процедурой без кристаллизации, как правило, лучше, чем 90:10%, при этом можно добиться соотношения 99:1%. К тому же диастереомерную чистоту продукта можно повысить до 100% кристаллизацией. В некоторых вариантах осуществления HOSA добавляют порционно или непрерывно к реакционной среде, содержащей соединение формулы III и основание в растворителе, как описано ниже. В некоторых вариантах осуществления реакционная среда содержит артемизининовую кислоту IIIa. По меньшей мере 1 экв. или избыток, например 1,0-7,0 экв., HOSA применяют для выполнения способа. Основание для выполнения реакции может включать, но не ограничивается гидроксидом натрия, гидроксидом калия, гидроксидами других щелочных или щелочно-земельных металлов, метилатом натрия, этаноатом натрия, метаноатом калия, этаноатом калия, трет-бутилатом натрия, трет-бутилатом калия или аминоподобным триэтиламином, трибутиламином или N-метиланилином. В некоторых вариантах осуществления растворитель представляет собой воду необязательно с добавлением смешивающегося с водой растворителя, такого как метанол, этанол, n-пропанол, изопропанол, диоксан, тетрагидрофуран или диметилформамид. В некоторых вариантах осуществления добавляют спирт с низкой точкой кипения, такой как метанол, этанол или изопропанол. В некоторых вариантах осуществления добавляют метанол или этанол. Температура реакции находится между 10 и 120 С в зависимости от температуры кипения растворителя. В некоторых вариантах осуществления температура реакции находится между 20 С и температурой кипения растворителя, такого как водный метанол или этанол соответственно. Время реакции может находиться между 1 и 24 ч, в то время как температура реакции составляет от 65 С в метаноле до 30 С в том же растворителе. Выход реакции можно регулировать контролем реакции перед подачей смеси на процедуру выделения. После полного расходования субстрата, как определено, например, техникой обращенофазовой высокоэффективной жидкостной хроматографии (RP-HPLC), продукт формулы I, полученный данным способом, можно выделить способами, описанными выше. Диастереомерное соотношение сырых продуктов формулы I:IV, которого можно достичь данной процедурой, как правило, лучше, чем 90:10% для желаемого диастереомера, при этом можно достигнуть соотношения 99:1% или более. В некоторых вариантах осуществления соединение формулы III растворяют в воде необязательно с добавлением изменяющихся количеств смешивающегося с водой спиртового растворителя, такого как метанол, этанол, n-пропанол или изопропанол. В некоторых вариантах осуществления, когда R1 в соединении формулы III представляет собой водород, соединение формулы III представляет собой артемизининовую кислоту, например соединение формулы IIIa. В некоторых вариантах осуществления водный раствор пероксида водорода, например 10-70% раствор в воде, и водный раствор гидразингидрата, например 64% раствор в воде, добавляют одновременно, сохраняя температуру реакции между -40 и 80 С. В некоторых вариантах осуществления температура реакции находится между -20 и 40 С. В некоторых вариантах осуществления по меньшей мере 1 экв. или избыток, например от 1,0 до 7,0 экв., каждого гидразингидрата и пероксида водорода использовали для выполнения данного способа. Выход реакции регулируют с помощью контроля реакции, например, с использованием техник обращено-фазовой высокоэффективной жидкостной хроматографии (RP-HPLC) перед подачей смеси на процедуру выделения. Диастереомерное соотношение сырых продуктов формулы I:IV, которое может быть получено данным способом, как правило, лучше, чем 90:10% для желаемого диастереомера, при этом можно достигнуть соотношения 99:1% или больше, в зависимости от условий реакции. Скорость реакции зависит от температуры реакции, растворителей и условий смешивания, примененных к реактивным составляющим в реакционной среде. Техники микросмешивания могут быть пригодны для достижения благоприятных выходов субстратов. После полного превращения соответствующего субстрата реакционную смесь разбавляли водой и не смешивающимся с водой растворителем, например МТВЕ, циклогексаном, метилциклогексаном, толуолом или любым другим, не смешивающимся с водой органическим растворителем, который не образовывает пероксиды с потенциально остающимся избытком пероксида водорода. Если некоторый избыток пероксида водорода присутствует в органической фазе, он может быть разрушен способами, известными специалистам в данной области техники,например с помощью каталазы или промыванием водным раствором сернокислого железа. Затем продукт выделяют из органического раствора хроматографией или непосредственно кристаллизацией из растворителей или смесей растворителей, таких как МТВЕ, гептан, толуол, диизопропиловый эфир, этилацетат, метанол, этанол, пропанол и вода. В некоторых вариантах осуществления соединение формулы III добавляют к суспензии двунатриевой или дикалиевой соли азодикарбоновой кислоты в растворителе, таком как тетрагидрофуран, 2 метилтетрагидрофуран, толуол, диоксан, изопропанол, трет-бутанол, метанол, этанол, монометиловый эфир этиленгликоля или диметиловый эфир этиленгликоля. В некоторых вариантах осуществления, когда R1 в соединении формулы III представляет собой водород, соединение формулы III представляет собой артемизининовую кислоту, например соединение формулы IIIa. В некоторых вариантах осуществления растворитель представляет собой этанол, метанол или изопропанол. В некоторых вариантах осуществления диимин получают in situ в реакционной смеси разрушением натриевой или калиевой соли азодикарбоновой кислоты слабой кислотой, такой как лимонная кислота, уксусная кислота, пропионовая кислота, винная кислота, щавелевая кислота или муравьиная кислота, при температуре реакции от приблизительно -10 до 100 С, в зависимости от используемого растворителя. Время реакции изменяется от нескольких минут до нескольких часов, в зависимости от масштаба проведения реакции и температуры реакции. В некоторых вариантах осуществления по меньшей мере 1 экв. или избыток, например от 1,0 до 7,0 экв., натриевой или калиевой соли азодикарбоновой кислоты применяют для выполнения данного способа. Контроль реакции и процедуры выделения такие же, как и те, которые изложены выше. В некоторых вариантах осуществления артемизининовую кислоту IIIa растворяют в диметилформамиде (DMF), N-метилпирролидине (NMP) или N,N-диметилацетамиде (DMA) и вводят в реакцию с раствором, содержащим гидроксиламин и этилацетат или метилацетат в DMF, NMP или DMA. В некоторых вариантах осуществления артемизининовую кислоту IIIa растворяют в DMF и вводят в реакцию с раствором, содержащим гидроксиламин и этилацетат или метилацетат в DMF. В некоторых вариантах осуществления реакцию поддерживают между 20 и 120 С. В некоторых вариантах осуществления реакцию поддерживают между 50 и 100 С. В некоторых вариантах осуществления по меньшей мере 1 экв. или избыток, например от 1,0 до 20 экв., каждого гидроксиламина и ацетатного сложного эфира применяют для выполнения данного способа. Выход реакции регулируют с помощью контроля реакции, например, с использованием техник обращено-фазовой высокоэффективной жидкостной хроматографии(RP-HPLC) перед подачей смеси на процедуру выделения. Диастереомерное соотношение сырых продуктов формул Ia:IVa (т.е. соединения формулы I и IV соответственно, где R1 представляет собой водород), которое может быть достигнуто с помощью данной методики, как правило, лучше, чем 90:10%. Скорость реакции зависит от температуры реакции, растворителей и условий смешивания, примененных к реактивным составляющим в реакционной среде. В некоторых вариантах осуществления после полного превращения реакционную смесь подкисляют, например, разбавленной соляной кислотой и продукт экстрагируют несмешивающимся с водой растворителем, например МТВЕ, циклогексаном, метилциклогексаном или толуолом. Затем продукт обычно выделяют из органического раствора хроматографией или кристаллизацией. Сокращения:TMS -тетраметилсилан Примеры. Следующие примеры предоставлены только с целью иллюстрирования, а не с целью ограничения. Специалисты в данной области без труда определят разнообразие характеристик, которые могут быть изменены или модифицированы для получения подобных результатов.NMR распределения приводятся только для иллюстрирования на основе анализа линейных 1H-NMR 13 и С NMR спектров, как выполнено специалистом в данной области техники. Более подробный анализ спектров может привести к незначительному перераспределению некоторых NMR пиков, что не меняет общего распределения. Все 1H-NMR спектры записывают на 500 MHz приборе, сдвиги являются подобными таковым у TMS в [ppm], и растворитель представляет собой DMSO-d6. Дополнительно к NMR анализу применяли способ HPLC/MS анализа для определения диастереомерного соотношения соединений формул I и IV. Экспериментальные условия HPLC анализа: Колонка Atlantis Т 3 длина 150 мм 4,6 мм; пористость: 3 мкм Элюент А вода с 0,04% объем/объем муравьиной кислоты Элюент В ацетонитрил с 0,05% объем/объем муравьиной кислоты Впрыскивание 10 мкл Обнаружение 205 нм Температура 35 С Градиент Время после 5 мин Пример 1. Синтез дигидроартемизининовой кислоты Ia с помощью образования диимина из HOSA и метилата натрия при 65 С в метаноле. 0,248 г (0,001 моль) артемизининовой кислоты IIIa растворяли в 10 мл МеОН. Затем добавляли 0,432 г (0,008 моль) метилата натрия. Реакционную смесь нагревали до кипячения (65 С) и по частям добавляли 0,628 г (0,005 моль) гидроксиламин-О-сульфоновой кислоты (HOSA). После полного добавления реакционную смесь перемешивали в течение дополнительного 1 ч при такой же температуре, покаRP-HPLC анализ не показывал полный расход исходного материала. Реакционную смесь окисляли разбавленной водной соляной кислотой до рН 2. Продукт экстрагировали МТВЕ, сушили над сернокислым магнием и растворитель выпаривали для получения 0,22 г (93%) указанного в заголовке соединения, которое кристаллизовалось при отстаивании. Диастереомерное соотношение в неочищенном продукте, как определено 1H-NMR анализом и HPLC/MS анализом, составляло 96:4 в пользу желаемого стереоизомера Ia.H NMR (DMSO-d6): 12,0 (s, 1H, OH), 5,33 (s, 1H, H-11). Пример 2. Синтез дигидроартемизининовой кислоты Ia с помощью образования диимина из гидроксиламина и HOSA в метаноле при 40-50 С. 5,3 г (0,08 моль) гидроксиламина (50% в воде) и 15,1 г (0,12 моль) HOSA (растворенный в 25 мл воды) добавляли непрерывно к раствору 4,69 г (0,02 моль) артемизининовой кислоты IIIa в 10 мл МеОН,сохраняя значение рН постоянным при рН 9 с помощью 5N водного раствора NaOH. Температура находилась между 40 и 50 С. После полного добавления реакционную смесь перемешивали в течение одного дополнительного часа, пока изменение рН не было обнаруживаемым. Полный расход артемизининовой кислоты Ia подтверждали RP-HPLC анализом. Затем реакционную смесь окисляли разбавленной водной соляной кислотой до рН 2. Продукт экстрагировали МТВЕ, сушили над сернокислым магнием и растворитель выпаривали для получения 4,8 г (100%) указанного в заголовке соединения, которое кристаллизовалось при отстаивании. Диастереомерное соотношение в неочищенном продукте, как определено 1HNMR анализом и LC/MS анализом, составляло 96:4 в пользу указанного в заголовке соединения. Пример 3. Синтез дигидроартемизининовой кислоты Ia с помощью образования диимина из гидроксиламина и HOSA/NaOH в метаноле при -5-0 С. 2,34 г (0,01 моль) артемизининовой кислоты IIIa растворяли в 20 мл МеОН. Затем непрерывно добавляли 1,98 г (0,03 моль) гидроксиламина (50% в воде) и 5,65 г (0,045 моль) HOSA (растворенный в 10 мл воды), в то же время рН 9 поддерживали на постоянном уровне 32% водным раствором NaOH. Температуру регулировали между -5 и 0 С. После полного добавления реакционную смесь перемешивали в течение одного дополнительного часа, пока рН изменение не было обнаруживаемым. Полный расход артемизининовой кислоты подтверждали RP-HPLC анализом. Затем реакционную смесь окисляли разбавленной водной соляной кислотой до рН 2. Продукт экстрагировали МТВЕ, сушили над сернокислым магнием и растворитель выпаривали для получения 2,25 г (95%) указанного в заголовке соединения, которое кристаллизовалось при отстаивании. Диастереомерное соотношение в неочищенном продукте, как определено 1H-NMR анализом и LC/MS анализом, составляло 98:2 в пользу желаемого стереоизомера Ia. Пример 4. Синтез дигидроартемизининовой кислоты Ia с помощью образования диимина из гидроксиламина и этилацетата. 6,95 г (0,1 моль) гидроксиламин гидрохлорида суспендировали в 10 мл DMF и добавляли 6,60 г порошкообразного KOH. После 10 мин при 30 С суспензию отфильтровали и фильтрат, содержащий гидроксиламин, собирали. При охлаждении с помощью ванны со льдом 3,19 г (0,044 моль) этилацетат добавляли к раствору гидроксиламина. Данный раствор затем добавляли по каплям к раствору 0,47 г (0,002 моль) артемизининовой кислоты IIIa, растворенной в 10 мл DMF при 90 С. После полного добавления реакционную смесь перемешивали в течение одного дополнительного часа до тех пор, пока полный расход артемизининовой кислоты не подтверждали RP-HPLC анализом. Затем реакционную смесь окисляли разбавленной водной соляной кислотой до рН 2. Продукт экстрагировали МТВЕ, сушили над сернокислым магнием и растворитель выпаривали для получения 0,36 г (76%) сырого продукта, который кристаллизовался после колоночной хроматографии (силикагель, 1:2 этилацетат:гептан в качестве элюента) для получения 0,26 г (55%) очищенного указанного в заголовке соединения. Диастереомерное соотношение в неочищенном сыром продукте реакции, как определено 1 Н-NMR анализом и LC/MS анализом, составляло 95:5 в пользу желаемого стереоизомера Ia. Пример 5. Синтез дигидроартемизининовой кислоты Ia с помощью образования диимина из гидроксиламина и HOSA/KOH. 0,248 г (0,001 моль) артемизининовой кислоты IIIa растворяли в 5 мл МеОН. Затем добавляли 2,24 г(0,02 моль) KOH (50% в воде). Реакционную смесь нагревали до 40 С и одновременно по частям добавляли 0,264 г (0,004 моль) гидроксиламина и 0,754 г (0,006 моль) HOSA кислоты. После полного добавления реакционную смесь перемешивали в течение одного дополнительного часа при такой же температуре до тех пор, пока RP-HPLC анализ не подтверждал полный расход исходного материала. Затем реакционную смесь окисляли разбавленной водной соляной кислотой до рН 2. Диастереомерное соотношение в неочищенном сыром продукте реакции, как определено 1H-NMR анализом и LC/MS анализом, составля-8 021061 ло 95:5 в пользу желаемого стереоизомера. Пример 6. Синтез дигидроартемизининовой кислоты Ia с помощью образования диимина из гидразина и пероксида водорода. К охлажденному льдом раствору 0,248 г (0,001 моль) артемизининовой кислоты IIIa в 2 мл абсолютного EtOH и 0,821 г (0,0105 моль) гидразингидрата (64 % в воде) добавляли 0,641 мл (0,0063 моль) 30% водного раствора пероксида водорода в течение 1 ч. После полного добавления реакционную смесь нагревали до комнатной температуры и перемешивали в течение дополнительных 4 ч до тех пор, покаRP-HPLC анализ не подтверждал полный расход исходного материала. Затем смесь окисляли разбавленной водной соляной кислотой до рН 2, продукт экстрагировали МТВЕ, промывали единожды растворомFeSO4 и соляным раствором и высушивали над сернокислым магнием. Растворитель выпаривали для получения 0,222 г (93%) кристаллического указанного в заголовке соединения. Диастереомерное соотношение в неочищенном продукте как определено 1H-NMR анализом и LC/MS анализом, составляло 95:5 в пользу желаемого стереоизомера Ia. Пример 7. Крупномасштабный синтез дигидроартемизининовой кислоты Ia с помощью образования диимина из гидроксиламина и HOSA. 11,72 г (0,05 моль) артемизининовой кислоты IIIa растворяли в 25 мл горячего (приблизительно 50 С) МеОН. рН приводили к значению 9 при помощи 32% раствора NaOH в воде. 13,2 г (0,2 моль) гидроксиламина (50% раствор в воде) и 25,1 г (0,2 моль) HOSA (растворенный в 30 мл воды) добавляли одновременно, пока рН 9 поддерживали 32% раствором NaOH в воде. Внутреннюю температуру поддерживали между -5 и 5 С охлаждением. После полного добавления реакционную смесь перемешивали в течение одного дополнительного часа до тех пор, пока рН не оставался постоянным. Полный расход артемизининовой кислоты IIIa подтверждали RP-HPLC анализом. Общий объем приблизительно 30 млNaOH (6,5 экв.) расходовали. Затем реакционную смесь окисляли разбавленной водной соляной кислотой до рН 2. Продукт экстрагировали 100 мл МТВЕ, промывали единожды 25 мл воды и сушили над сернокислым магнием. Растворитель выпаривали для получения 11,1 г (93%) кристаллического титульного соединения. NMR анализ показывал МТВЕ в качестве примеси. Диастереомерное соотношение, как оценивали 1H-NMR анализом, составило 97:3 в пользу желаемого, указанного в заголовке, соединения. Данный материал затем очищали следующим образом: 11 г неочищенного продукта растворяли в 12 мл кипящего этанола и добавляли 6 мл воды в горячем состоянии. Медленное охлаждение образовывало кристаллы, которые отфильтровали после перемешивания в течение 30 мин в охлажденной льдом ванне. Осадок на фильтре промывали единожды охлажденными льдом 20 мл этанола/воды (1/1) с последующими 30 мл воды. Высушивание образовывало 9,0 г (76%) желаемого продукта Ia, тогда как не желаемый диастереомер был ниже предела определения применяемых NMR и HPLC способов. Пример 8. Синтез дигидроартемизининовой кислоты Ia с помощью образования диимина из дикалиевого азодикарбоксилата. К перемешанному раствору 4,22 г (0,035 моль) KOH (40% в воде) при 5 С добавляли 0,500 г (0,0043 моль) азодикарбамида по маленьким частям. После перемешивания в течение дополнительного часа ярко желтое твердое вещество, которое выпало в осадок, отфильтровывали и промывали несколько раз холодным метанолом для получения 0,683 г (80%) дикалиевого азодикарбоксилата. Данную соль и 0,234 г(0,001 моль) артемизининовой кислоты IIIa суспендировали в 5 мл абсолютного метанола. При перемешивании и охлаждении ледяной ванной раствор 0,36 г (0,006 моль) уксусной кислоты в 1 мл абсолютного метанола добавляли по каплям в течение 30 мин. После перемешивания в течение 4 ч при комнатной температуре добавляли воду и МТВЕ, органическую фазу промывали единожды 10 мл 1 М водной HCl и сушили над сернокислым магнием. Выпаривание растворителя дало 0,23 (97%) кристаллического, указанного в заголовке, соединения. Диастереомерное соотношение в неочищенном продукте, как определено 1H-NMR анализом и LC/MS анализом, составляло 97:3 в пользу желаемого стереоизомера Ia. Пример 9. Синтез сложного метилового эфира дигидроартемизининовой кислоты (соединение I, гдеR1 = метил) с помощью образования диимина из гидразина и пероксида водорода. К охлажденному льдом раствору 0,248 г (0,001 моль) сложного метилового эфира артемизининовой кислоты (соединение III, где R1 = метил), полученного с помощью описанного в литературе способа (X.Xu и соавт., Tetrahedron 42, 819, 1986), в 2 мл абсолютного этанола и 0,821 г (0,0105 моль) гидразингидрата (64 % раствор в воде) добавляли 0,641 мл (0,0063 моль) 30% водного раствора пероксида водорода в течение 1 ч. После полного добавления реакционную смесь нагревали до комнатной температуры и перемешивали в течение дополнительных 4 ч до тех пор, пока RP-HPLC анализ не показывал полный расход исходного соединения. Реакционную смесь окисляли разбавленной водной соляной кислотой до рН 2, продукт экстрагировали МТВЕ, промывали единожды раствором FeSO4 и соляным раствором, высушивали над сернокислым магнием и выпаривали для получения 0,222 г (93%) указанного в заголовке соединения. Диастереомерное соотношение, как определено 1H-NMR анализом и LC/MS анализом, составляло 97:3 в пользу желаемого соединения. 1 Н NMR (DMSO-d6): 5,15 (s, 1H, Н-11), 3,60 (s, 3H, ОМе), 1,62 (s, 3H, 10-Ме), 1,05 (d, 2H, 2-Ме), 0,84(d, 3H, 6-Ме); соответствующие признаки второстепенного изомера появляются при 5,25 (s, 1H, Н-11),3,59 (s, 3H, ОМе). Пример 10. Синтез сложного трет-бутилового эфира дигидроартемизининовой кислоты (соединение I, где R1 = трет-бутил) с помощью образования диимина с применением гидразина и пероксида водорода. К охлажденному льдом раствору 0,290 г (0.001 моль) сложного трет-бутилового эфира артемизининовой кислоты (соединение III, где R1 = трет-бутил), полученного с помощью описанного в литературе способа (W. Zhou и соавт., Huaxue Xuebao 43(9), 845-851, 1985), в 2 мл абсолютного этанола и 0,821 г(0,0105 моль) гидразингидрата (64% раствор в воде) добавляли 0,641 мл (0,0063 моль) 30% водного раствора пероксида водорода в течение 1 ч. После полного добавления реакционную смесь нагревали до комнатной температуры и перемешивали в течение дополнительных 4 ч до тех пор, пока RP-HPLC анализ не показывал полный расход исходного соединения. Реакционную смесь окисляли разбавленной водной соляной кислотой до рН 2, продукт экстрагировали МТВЕ, промывали единожды растворомFeSO4 и соляным раствором, сушили над сернокислым магнием и выпаривали для получения 0,290 г(d, 3H, 6-Ме). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения соединения формулы I где R1 представляет собой водород, или линейный или разветвленный алкил, имеющий 1, 2, 3, 4, 5 или 6 атомов углерода, или циклоалкил, имеющий 3, 4, 5, 6 или 7 атомов углерода,включающий введение в реакцию соединения формулы III с диимином, где диимин получают in situ. 2. Способ по п.1, где диимин образуется из гидроксиамина и гидроксиамин О-сульфоновой кислоты в присутствии основания. 3. Способ по п.1, где диимин образуется из гидроксиамин-О-сульфоновой кислоты в присутствии основания. 4. Способ по п.1, где диимин образуется из гидроксиамина и сложного эфира уксусной кислоты. 5. Способ по п.1, где диимин образуется из гидразина и окислителя. 6. Способ по п.1, где диимин образуется из катализируемого кислотой декарбоксилирования азодикарбоксилата. 7. Способ по любому из пп.1-6, дополнительно включающий окисление соединения формулы I до артемизинина II
МПК / Метки
МПК: C07C 67/303, C07D 493/18, C07C 57/26, C07C 69/608, C07C 51/36
Метки: производства, способ, артемизинина, промежуточных, продуктов
Код ссылки
<a href="https://eas.patents.su/11-21061-sposob-proizvodstva-promezhutochnyh-produktov-artemizinina.html" rel="bookmark" title="База патентов Евразийского Союза">Способ производства промежуточных продуктов артемизинина</a>
Предыдущий патент: Вытяжной колпак, сборочный комплект для вытяжного колпака и способ сборки вытяжного колпака
Следующий патент: Способ гидрирования фракции нафты и способ получения минерального масла
Случайный патент: Биосинтетические нерегулярные спиральные полипептиды пролина/аланина и их применения












