Способ повышения оптической чистоты 2r-[1-гидрокси-1-трифторметил-3-циклопропилпропин-2-ил]-4-хлоранилина
Номер патента: 2039
Опубликовано: 24.12.2001
Авторы: Чен Ченг Йи, Рейдер Пол Дж., Тан Луши, Грабовски Эдвард Дж.Дж., Тилльер Ричард Д.
Формула / Реферат
1. Способ повышения оптической чистоты R-аминоспирта формулы
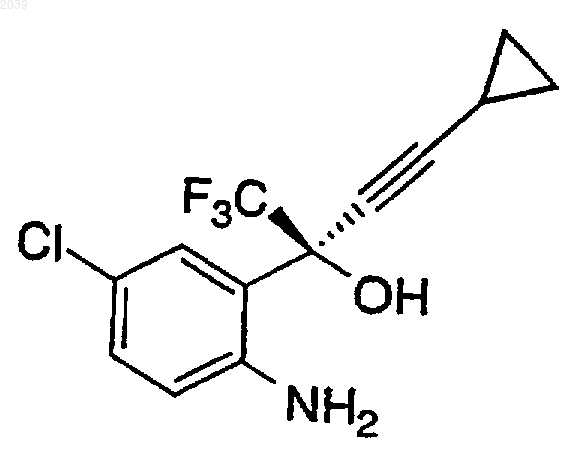
включающий стадии:
(a) медленного добавления раствора кислоты или газообразной кислоты к раствору аминоспирта в органическом растворителе с образованием суспензии кислотно-аддитивной соли аминоспирта;
(b) концентрирования суспензии кислотно-аддитивной соли аминоспирта;
(c) промывания концентрированной суспензии кислотно-аддитивной соли аминоспирта органическим растворителем для регулирования состава растворителя;
(d) выдерживания суспензии кислотно-аддитивной соли аминоспирта при температуре окружающей среды в течение приблизительно от 2 до 24 ч;
(e) фильтрования выдержанной суспензии кислотно-аддитивной соли аминоспирта для выделения влажного осадка кислотно-аддитивной соли аминоспирта;
(f) промывания влажного осадка кислотно-аддитивной соли аминоспирта холодным органическим растворителем и
(g) сушки влажного осадка кислотно-аддитивной соли аминоспирта для выделения кислотно-аддитивной соли аминоспирта в виде твердого продукта с повышенной оптической чистотой.
2. Способ по п.1, где кислота имеет рКа меньше чем 3 или равный 3.
3. Способ по п.2, где органический растворитель выбирают из группы, состоящей из изопропилацетата, этилацетата, толуола, метил-трет-бутилового простого эфира, ацетонитрила, тетрагидрофурана, метанола, этанола, изопропанола, углеводородных растворителей и их смесей.
4. Способ по п.3, где кислота имеет рКа меньше чем 1 или равный 1.
5. Способ по п.4, где органический растворитель выбирают из группы, состоящей из изопропилацетата, этилацетата, толуола, метил-трет-бутилового простого эфира, ацетонитрила, тетрагидрофурана, метанола, этанола, изопропанола, углеводородного растворителя и их смесей.
6. Способ по п.5, где кислоту выбирают из группы, состоящей из НХ, где Х определяют как галогенид (Сl, Вr, I или F), H2SO4, трифторуксусной кислоты, трихлоруксусной кислоты, RSО3Н, где R представляет (С1-С6)-алкил, (С2-С6)-алкенил, (С2-С6)-алкинил, арил, который определяют как фенил или нафтил, и гетероарил, который определяют как 5- или 6-членное кольцо, замещенное одним или двумя гетероатомами, выбранными из О, S, N, и (С1-С6)-алкил, (С2-С6)-алкенил, (С2-С6)-алкинил, арил или гетероарил может быть не замещен или замещен одним, двумя или тремя заместителями, выбранными из группы, состоящей из Br, Cl, F, I, (С1-С6)-алкила, (С2-С6)-алкенила, (С2-С6)-алкинила, (С1-С6)-алкокси, циано, нитро, гидрокси, СНО, СO2Н, SО3Н, CO-С1-С6-алкил, CO2-С1-С6-алкил, CONR1R2, NR1R2, NR1CО-С1-С6-алкил, где R1 и R2 независимо определяют как галоген (Cl, Br, F, I), СF3, CN, NO2, NH2, NH(С1-С6-алкил), N(С1-С6-алкил)2, CONH2, CONH(С1-С6-алкил), CON(С1-С6-алкил)2, NHCONH2, NHCONH(С1-С6-алкил), NHCON(С1-С6-алкил)2, CO2-C1-С6-алкил, (С1-С6)-алкил, (С2-С6)-алкенил, (С2-С6)-алкинил, С3-С7-циклоалкил или (С1-С6)-алкокси, так что С1-С6-алкил не замещен или замещен арилом, арил определяют как фенил или нафтил, незамещенный или замещенный С1-С6-алкилом, С1-С6-алкокси, NO2 или галогеном (Cl, Br, F, I).
7. Способ по п.6, где органический растворитель выбирают из группы, состоящей из изопропилацетата, этилацетата, толуола, метил-трет-бутилового простого эфира, ацетонитрила, тетрагидрофурана, метанола, этанола, изопропанола и углеводородных растворителей и их смесей.
8. Способ по п.7, где раствор кислоты или газообразную кислоту выбирают из группы, состоящей из 1,5-нафталиндисульфоновой кислоты, п-толуолсульфоновой кислоты, СН3SО3Н, трифторметансульфоновой кислоты и камфорасульфоновой кислоты, НСl, НВr и Н2SO4.
9. Способ по п.8, где раствор кислоты или газообразная кислота и органический растворитель представляют собой НСl и изопропилацетат, НВr и изопропилацетат или НВr и смесь толуолтетрагидрофуран.
Текст
1 Предпосылки создания изобретения Ключевой стадией в синтезе ингибитора обратной транскриптазы, (-)-6-хлор-4-циклопропилэтинил-4-трифторметил-1,4-дигидро-2 Н-3,1 бензоксазин-2-она, известного также как DMP266, является хиральное присоединение 2 трифторметилкарбонил-4-хлоранилина для получения целевого этантиомера аминоспирта в оптически чистой форме. Синтез DMP-266 и структурно подобных ингибиторов обратной транскриптазы описывается в патенте США 5519021 и соответствующей заявке на Международный патент РСТ WO 95/20389, которая опубликована 3 августа 1995. Кроме того, асимметрический синтез энантиомерного бензоксазинона путем присоединения ацетилида с высокой энантиоселективностью и последующей циклизацией был описан Thompson, et al., Tetrahedron Letters 1995, 36, 89378940, а также в публикации РСТ WO 96/37457,которая опубликована 28 ноября 1996. Кроме того, были зарегистрированы несколько заявок, в которых описываются различные аспекты синтеза (-)-6-хлор-4-циклопропилэтинил-4-трифторметил-1,4-дигидро-2 Н-3,1 бензоксазин-2-она, включающие: 1) способ получения хирального спирта,заявка на патент США, peг.60/035462, зарегистрирована 14 января 1997; 2) хиральную добавку, заявка на патент США, peг.60/034926, зарегистрирована 10 января 1997, заявка на патент США, peг.60/042021, зарегистрирована 17 апреля 1997,заявка на патент США, peг.60/045167, зарегистрирована 30 апреля 1997; 3) реакцию циклизации, заявка на патент США, peг.60/037059, зарегистрирована 12 февраля 1997; 4) методику кристаллизации с применением антирастворителя, заявка на патент США,peг.60/037385, зарегистрирована 5 февраля 1997 и заявка на патент США, peг.60/042807,зарегистрирована 8 апреля 1997; 5) катализируемое цинком энантиоселективное присоединение, заявка на патент США,peг.60/046713, зарегистрирована 16 мая 1997; и 6) способ получения циклопропилацетилена, заявка на патент США, peг.60/047692,зарегистрирована 23 мая 1997. В данном изобретении описывается эффективный способ повышения оптической чистоты аминоспирта Данный способ позволяет повысить оптическую чистоту аминоспирта, независимо от синтетического пути, использованного для получения этого аминоспирта. В предыдущих спо 002039 2 собах защиту аминогруппы использовали в качестве средства для повышения энантиомерного избытка целевого R-аминоспирта. В самой последней разработке способа была исключена последовательность защита-снятие защиты, что делало необходимым применение средства, при помощи которого можно было повысить энантиомерный избыток аминоспирта. Краткое изложение сущности изобретения Данное изобретение относится к способу повышения энантиомерного избыткаRаминоспирта, включающему образование кислотно-аддитивной соли с кислотой, имеющей рКа ниже, чем 3, или равное 3, и селективную кристаллизацию кислотно-аддитивной соли Rаминокислоты из рацемической смеси с использованием подходящего органического растворителя, чтобы повысить оптическую чистоту. Подробное описание изобретения Данное изобретение относится к способу повышения оптической чистоты R-аминоспирта формулы(a) медленного добавления раствора кислоты или газообразной кислоты к раствору аминоспирта в органическом растворителе с образованием суспензии кислотно-аддитивной соли аминоспирта;(b) концентрирования суспензии кислотноаддитивной соли аминоспирта;(c) промывания концентрированной суспензии кислотно-аддитивной соли аминоспирта органическим растворителем для регулирования состава растворителя;(d) выдерживания суспензии кислотноаддитивной соли аминоспирта при температуре окружающей среды в течение приблизительно от 2 до 24 ч;(e) фильтрования выдержанной суспензии кислотно-аддитивной соли аминоспирта для выделения влажного осадка кислотноаддитивной соли аминоспирта;(f) промывания влажного осадка кислотноаддитивной соли аминоспирта холодным органическим растворителем и(g) сушки влажного осадка кислотноаддитивной соли аминоспирта для выделения кислотно-аддитивной соли аминоспирта в виде твердого продукта с повышенной оптической чистотой. Раствор кислоты или газообразную кислоту определяют как кислоту, имеющую рКа меньше чем 3, или равный 3, предпочтительно рКа меньше чем 1 или равный 1. Примерами кислот, которые можно использовать в данном способе, являются НХ, где Х представляет галогенид (Сl, Вr, I или F), H2SO4, трифторуксусная 3 кислота (ТФК), трихлоруксусная кислота,RSО 3 Н, где R представляет (C1-С 6)-алкил, (С 2 С 6)-алкенил, (С 2-С 6)-алкинил, арил, который определяют как фенил или нафтил, и гетероарил, который определяют как 5- или 6-членное кольцо, замещенное одним или двумя гетероатомами, выбранными из О, S, N и (С 1-С 6)-алкил,(С 2-С 6)-алкенил, (С 2-С 6)-алкинил, арил или гетероарил может быть незамещен или замещен одним, двумя или тремя заместителями, выбранными из группы, состоящей из: Br, Cl, F, I,(С 1-С 6)-алкила,(С 2-С 6)-алкенила,(С 2-С 6)алкинила, (С 1-С 6)-алкокси, циано, нитро, гидрокси, СНО, СО 2 Н, SО 3 Н, CO-С 1-С 6-алкил, СO2 С 1-С 6-алкил, CONR1R2, NR1R2, NR1CO-С 1-С 6 алкил, где R1 и R2 независимо определяют как: галоген (Cl, Br, F, I), СF3, CN, NO2, NH2, NH(С 1 С 6-алкил), N(С 1-С 6-алкил)2, CONH2, СОNН(С 1 С 6-алкил),СОN(С 1-С 6-алкил)2,NHCONH2,NHCONH(С 1-С 6-алкил), NНСОN(С 1 С 6-алкил)2,СО 2-С 1-С 6-алкил,(С 1-С 6)-алкил,(С 2-С 6)алкенил, (С 2-С 6)-алкинил, С 3-С 7-циклоалкил или(С 1-С 6)-алкокси, так что С 1-С 6-алкил незамещен или замещен арилом, арил определяют как фенил или нафтил, незамещенный или замещенный С 1-С 6-алкилом, С 1-С 6-алкокси, NO2 или галогеном (Cl, Br, F, I). Примеры RSО 3 Н включают, но не ограничиваются ими, 1,5 нафталиндисульфоновую кислоту, п-толуолсульфоновую кислоту (п-TsOH), СН 3SО 3 Н,трифторметансульфоновую кислоту (СF3SО 3 Н) и камфорасульфоновую кислоту. Раствор органической кислоты наиболее часто может быть добавлен к раствору аминоспирта, тем не менее,газообразная кислота может быть барботирована в реакционную смесь. Растворителем, используемым для растворения кислоты, может быть вода или алканол, такой как метанол, этанол, изопропанол. Предпочтительными кислотами являются: НСl, HBr, H2SO4, 1,5 нафталиндисульфоновая кислота и птолуолсульфоновая кислота. Наиболее предпочтительными кислотами являются НСl и HBr. Примерами органических растворителей являются: изопропилацетат (IPAc), этилацетат(EtOAc), толуол, метилтретбутиловый простой эфир (МТВЕ), ацетонитрил (ACN), тетрагидрофуран (ТГФ), изопропанол (IPA) и углеводородные растворители, такие как гексаны, пентаны, гептаны и т.д. В определение органического растворителя включается также смесь упомянутых растворителей. Вариант способа повышения оптической чистоты R-аминоспирта где раствор кислоты или газообразная кислота и органический растворитель представляют собой: НСl и изопропилацетат, НВr и изо 002039 4 пропилацетат или НВr и смесь толуолтетрагидрофуран. Суспензию концентрируют и промывают дополнительным органическим растворителем для регулирования состава растворителя, чтобы снизить концентрацию аминоспирта от приблизительно 10% до приблизительно 2% Rаминоспирта в растворителе. Суспензию выдерживают приблизительно в течение от 2 до 36 ч. Влажный осадок кислотно-аддитивной соли аминоспирта промывают объемом органического растворителя, составляющим меньше чем 20% первоначального объема растворителя или равным ему. Понятно, что термин инертная атмосфера обозначает атмосферу аргона или азота, предпочтительно азота. Понятно, что температура окружающей среды представляет температурный интервал от 20 С до приблизительно 35 С.R-Аминоспирт (2R-[1-гидрокси-1-трифторметил-3-циклопропилпропин-2-ил]-4-хлоранилин) можно получить по методикам, описанным здесь, а также с использованием любых других известных способов для его получения. Данное изобретение представляет собой способ повышения оптической чистоты этого ключевого промежуточного продукта в синтезе (-)-6-хлор 4-циклопропилэтинил-4-трифторметил-1,4-дигидро-2 Н-3,1-бензоксазин-2-она. Предыдущие способы получения этого ключевого промежуточного продукта включали защиту амина аминозащитной группой, такой как п-нитробензильная, п-метоксибензильная и тритильная группа, и повышение оптической чистоты этого защищенного промежуточного продукта. См. схему 1. Методика сочетания с цинком, использованная для получения аминоспирта, исключала последовательность стадий защита-снятие защиты и требовала разработки способа повышения оптической чистоты R-аминоспирта. Однако эту методику, как указано ранее, можно использовать для повышения оптической чистоты этого соединения, независимо от того, как оно было получено. Соединения данного изобретения имеют асимметричные центры, и это изобретение включает все оптические изомеры и их смеси. Используемый здесь термин алкил включает алкильные группы с указанным числом атомов углерода и либо с неразветвленной,разветвленной, либо с циклической конфигурацией. Примеры алкила включают метил, этил,пропил, изопропил, бутил, втор- и трет-бутил,пентил, гексил, гептил, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил,норборнил и тому подобное. Алкокси представляет алкильную группу с указанным числом атомов углерода, присоединенную через кислородный мостик, такую как метокси, этокси,пропокси, бутокси и пентокси. Алкенил и алкинил предназначаются для включения углеводородных цепей с опреде 5 ленным числом атомов углерода и либо неразветвленной, либо разветвленной конфигурацией и, по меньшей мере, с одной двойной или тройной связью, которая может иметь место в любой точке цепи. Примеры алкенила включают этенил, пропенил, бутенил, пентенил, диметилпентенил и тому подобное и включают Е-и Zформы, где пригодно. Примеры алкинила включают этинил, пропинил, бутинил, пентинил и диметилпентинил. Используемый здесь термин галоген означает фтор, хлор, бром и иод. Термин арил определяют как кольцо фенила или нафтила, которое, необязательно, замещено заместителями, перечисленными выше,у любых доступных атомов углерода. Арил может быть замещен также конденсированным 5-,6- или 7-членным кольцом, содержащим один или два атома кислорода, причем остальные атомы кольца являются атомами углерода, конденсированное 5-, 6- или 7-членное кольцо выбирают из группы, состоящей из диоксоланила,дигидрофуранила, дигидропиранила и диоксанила. Термин гетероарил, используемый здесь,предназначается для включения следующего 5 или 6-членного кольца, замещенного одним или двумя гетероатомами, выбранными из О, S, N, и незамещенного или замещенного одним, двумя или тремя заместителями, выбранными из группы, состоящей из: Br, Cl, F, I, (С 1-С 6)-алкокси,циано, нитро, гидрокси, СНО, CO2H, CO-С 1-С 6 алкил, CO2-С 1-С 6-алкил, CONR1R2, NR1R2,NR1CO-С 1-С 6-алкил, любые два соседних заместителя могут быть соединены с образованием 5-, 6- или 7-членного конденсированного кольца, причем упомянутое кольцо содержит 1 или 2 атома кислорода и остальные атомы являются атомами углерода, или любые два соседних заместителя могут быть соединены вместе с образованием бензоконденсированного кольца. Гетероарильные группы в объеме этого изобретения включают, но не ограничиваются ими: акридинил, карбазолил, циннолинил, хиноксалинил, пиразолил, индолил, бензотриазолил, фуранил, тиенил, бензотиенил, бензофуранил, хинолинил, изохинолинил, пиразинил, пиридазинил, пиридинил, пиримидинил и пирролил, которые не замещены или замещены, как определено выше. Схема 1 изображает ключевые стадии в синтезе (-)-6-хлор-4-циклопропилэтинил-4-трифторметил-1,4-дигидро-2 Н-3,1-бензоксазин-2 она (DMP-266). Стадия хирального присоединения позволяет осуществить энантиоселективное присоединение циклопропилацетилида к трифторметилкетону 1. У полученного п-метоксибензил (РМВ) защищенного аминоспирта 2, затем снимают защиту, получая аминоспирт 3. Этот аминоспирт затем циклизуют с использованием хлорформиата и основания, получая Схема 2 изображает получение DMP-266 с использованием способа данного изобретения,который представляет собой реакцию хирального присоединения. Новая реакция хирального присоединения позволяет исключить последовательность защита-снятие защиты, как показано на схеме 1. Схема 2 Схема 3 описывает способ данного изобретения, когда он относится к синтезу хирального промежуточного соединения, использованного при получении DMP-266. Было показано, что эта реакция протекает с использованием приблизительно 1,2 эквивалента циклопропилацетилена и хиральной добавки, значительно в меньшем количестве, чем в предыдущих способах. В реакции применяли различные хиральные добавки и получали высокие выходы с коммерчески доступным хиральным лигандом, таким как N-пирролидинилнорэфедрин и N-метилэфедрин. Этот процесс обеспечивает эффективный способ введения хирального спирта желательной конфигурации, когда образуется соот 7 ветствующий хиральный цинкoрганичеcкий комплекс. Данное изобретение описывает способ образования хирального цинкорганического комплекса, который содержит выбранный нуклеофил, R6M. Этот реагент, который генерируетсяin situ, затем подвергают взаимодействию с прохиральным кетоном с образованием хирального спирта. Получение спирта 3 требовало использования приблизительно от 1,0 до 1,5 эквивалента хиральной добавки и нуклеофила или, предпочтительно, около 1,2 эквивалента хиральной добавки и около 1,0 эквивалента нуклеофила. Реакцию можно проводить при температуре приблизительно от -78 до 70 С и, предпочтительно, при температуре приблизительно от-20 до 60 С, в противоположность низкотемпературным условиям (-65 С), требуемым предыдущим способом. Диалкилцинк типично добавляют при температуре приблизительно от-20 до 0 С. Вторую добавку типично добавляют приблизительно при температуре окружающей среды, затем смесь нагревают до приблизительно 60 С для осуществления образования хирального цинкорганического комплекса. К хиральному цинкорганическому комплексу при приблизительно комнатной температуре добавляют металлорганический реагент (R6M). К этому хиральному нуклеофилцинкорганическому комплексу при комнатной температуре добавляют прохиральный кетон. Предпочтительная процедура включает медленное добавление раствора диалкилцинка к раствору растворенной хиральной добавки и второй добавки так, чтобы поддерживать температуру реакции между 0 и 30 С. Приблизительно через один час получают металлорганический реагент, такой как хлормагнийциклопропилацетилид, и добавляют к хиральному цинкорганическому комплексу. Затем, к этому раствору хирального нуклеофилцинкорганического комплекса приблизительно при -10 С добавляют кетоанилин. Реакционную смесь перемешивают в течение приблизительно 35 ч при температуре приблизительно от 0 до -10 С, нагревают до комнатной температуры, перемешивают в течение около 3 ч и затем гасят основанием. Кроме того, было показано, что этот способ обеспечивает каталитический способ получения целевого хирального спирта, где используют каталитическое количество хиральной добавки. Схема 3 8 Циклизация аминоспирта 3, для получения 1,4-дигидро-2 Н-3,1-бензоксазин-2-она, 4, описывается в приведенной ниже схеме 4. Реакцию можно проводить одностадийным способом или, альтернативно, двухстадийным способом с возможным, в зависимости от использованного хлорформиата, выделением промежуточного карбамата 5. Было показано, что арилхлорформиаты образуют менее стабильные карбаматы,так что, когда их обрабатывают водным основанием, они циклизуются в этот продукт в одностадийном способе. Aлкилхлорформиат, альтернативно, дает алкилкарбамат, ключевой промежуточный продукт, который можно выделить и очистить до проведения стадии циклизации. На основании стабильности алкилкарбаматов был разработан пригодный двустадийный способ получения DMP-266, который включает образование алкилкарбаматного промежуточного продукта 5, последующую циклизацию карбамата для получения целевого продукта 4. Кроме того, было показано, что можно также использовать фосген. Следует отметить, что использование материала, полученного способом данного изобретения, будет требовать дополнительный эквивалент основания. Аминоспирт с повышенной оптической чистотой выделяют в виде кислотно-аддитивной соли, до проведения стадии циклизации будет необходимо разрушение соли амина. Это было выполнено простым использованием дополнительного эквивалента основания в стадии циклизации. Схема 4 Имеется в виду, что следующие примеры являются пояснительными для данного изобретения. Эти примеры предоставлены для иллюстрации изобретения в примерах и не должны истолковываться как ограничение объема изобретения. В сухой толуол (40 мл) загружают (1R,2S)N-пирролидинилнорэфедрин (9,85 г, 48 ммоль) и диметилцинк (2,0 М в толуоле) в атмосфере азота. Смесь перемешивают в течение 1 ч. Добавляют метанол (9,72 мл, 48 ммоль). Через 0,5 ч смесь переносят в предварительно полученную суспензию н-бутиллития (2,5 М, 16 мл) и циклопропилацетилена (2,64 г, 40 ммоль) в толуоле (40 мл) через канюлю. Через 0,5 ч добавляют раствор кетона 1 а (4,48 г, 20 ммоль). Смесь перемешивают в течение 7 ч. Водная обработка и кристаллизация дает 4,8 г белого твердого продукта (выход выделенного продукта 83% и энантиомерный избыток 83%). Пример 2 По методике, описанной в приведенном выше примере 1, с использованием первой хиральной добавки, указанной ниже, вместо(1R,2S)-N-пирролидинилнорэфедрина были получены следующие выходы и энантиомерные избытки образцов. Первая хиральная добавка По методике, описанной в приведенном выше примере 1, с использованием в качестве первой хиральной добавки(1R,2S)-Nпирролидинилнорэфедрина со вторыми добав 10 ками, указанными ниже, вместо метанола, были получены следующие % энантиомерные избытки: Вторая добавка Энантиомерный избыток По методике, описанной в приведенном выше примере 1, с использованием первой хиральной добавки, (1R,2S)-N-пирролидинилнорэфедрина, н-бутилмагнийхлорида вместо нбутиллития и второй добавки, указанной ниже,с проведением реакции при комнатной температуре был получен хиральный аминоспирт со следующим % энантиомерным избытком: Вторая добавка Энантиомерный избыток МеОН 87 По методике, описанной в приведенном выше примере 4, с использованием (1S,2S)-Nметилэфедрина в качестве первой хиральной добавки вместо (1R,2S)-N-пирролидинилнорэфедрина и (СН 3)3 ССН 2OН в качестве второй добавки был получен хиральный аминоспирт с энантиомерным избытком 65,8%. Пример 6 По методике, описанной в приведенном выше примере 4, с использованием металла,указанного ниже, вместо лития, были получены следующие выходы и энантиомерные избытки образцов: М Выход образца Энантиомерный избыток МgСI 96 87 В высушенную сушильном шкафу колбу загружают высушенный ситами ТГФ (100 мл) и(1R,2S)-N-пирролидинилнорэфедрин (24,64 г,120 ммоль) в атмосфере азота. Смесь охлаждают до -20 С и достаточно медленно для поддержания температуры ниже 0 С добавляют диметилцинк (2,0 М в толуоле, 50 мл, 100 ммоль). Затем через 30 мин при комнатной температуре добавляют неопентиловый спирт (7,12 г, 80 ммоль). Смесь нагревают при 60 С в течение 1 ч и охлаждают до комнатной температуры. В другой сухой колбе раствор хлормагнийциклопропилацетилида получают реакцией циклопропилацетилена (6,70 г, 100 ммоль) и нбутилмагнийхлорида (2,0 М в ТГФ, 50 мл, 100 ммоль). Раствор затем переносят к цинковому реагенту через канюлю. Через 20 мин добавляют кетоанилин 1 а (18,63 г, 8,33 ммоль). Через 7 ч реакционную смесь разбавляют гексаном (100 мл) и гасят 1 н. лимонной кислотой (200 мл). Два слоя разделяют. Водный слой сохраняют для выделения норэфедрина. Органический слой концентрируют до 50 мл и добавляют толуол(100 мл). Раствор снова концентрируют до 50 мл для удаления всего ТГФ. Медленно добавляют гептан (80 мл). Твердый продукт собирают фильтрованием и промывают гептаном (30 мл),получая 22,62 г (выход 94%, 96% ее (энантиомерный избыток) соединения 3 в виде белого твердого продукта. Пример 8 В высушенную в сушильном шкафу колбу загружают высушенный ситами ТГФ (50 мл) и-20 С и достаточно медленно для поддержания температуры ниже 0 С добавляют диметилцинк(2,0 М в толуоле, 25 мл, 50 ммоль). Затем через 30 мин при температуре окружающей среды добавляют неопентиловый спирт (3,56 г, 40 ммоль). Смесь нагревают при 60 С в течение 1 ч и охлаждают до комнатной температуры. В другой сухой колбе раствор хлормагнийциклопропилацетилида получают реакцией циклопропилацетилена (3,31 г, 50 ммоль) и н-бутилмагнийхлорида (2,0 М в ТГФ, 25 мл, 50 ммоль). Раствор затем переносят к цинковому реагенту через канюлю. Через 20 мин раствор охлаждают до 0 С и добавляют кетоанилин 1 а (9,32 г, 41,7 ммоль). Реакционную смесь разбавляют гексаном (50 мл) и гасят 1 н. лимонной кислотой (100 мл) через 48 ч. Два слоя разделяют. Водный слой сохраняют для выделения норэфедрина. Органический слой концентрируют до 25 мл и добавляют толуол (50 мл). Раствор снова концентрируют до 25 мл для удаления всего ТГФ. Медленно добавляют гептан (35 мл). Твердый продукт собирают фильтрованием и промывают гептаном (10 мл), получая 11,3 г (выход 94%, 99% ее) соединения 3 в виде белого твердого продукта. 1ZnEt2 (0,892 М в гексане) ТГФ 30% К 2 СО 3 30% Лимонная кислота Толуол (для кристаллизации, 2 мл/г 4) Гептан (для кристаллизации, 4 мл/г 4) К раствору трифторэтанола и (1R,2S)-Nпирролидинилнорэфедрина в ТГФ (9 л) в атмосфере азота достаточно медленно для поддержания температуры ниже 30 С добавляют раствор диэтилцинка в гексане при 0 С. Смесь перемешивают при комнатной температуре в течение 0,51 ч. В другой сухой колбе раствор хлормагнийциклопропилацетилида получают следующим образом: к неразбавленному циклолропилацетилену при 0 С достаточно медленно для поддержания внутренней температуры 30 С добавляют раствор н-бутилмагнийхлорида. Раствор перемешивают при 0 С в течение 40 мин и переносят к цинковому реагенту через канюлю с применением 0,36 л ТГФ в качестве жидкости для промывания. Смесь охлаждают до -10 С и добавляют кетоанилин 1 а. Смесь перемешивают при температуре от -2 до-8 С в течение 35 ч, нагревают до комнатной температуры, перемешивают в течение 3 ч и гасят 30% карбонатом калия в течение 1,5 ч. Смесь перемешивают в течение 4 ч и твердую часть удаляют фильтрованием и промывают ТГФ (2 объема осадка). Влажная твердая часть все же содержит 18 мас.% пирролидинилнорэфедрина, ее оставляют для дальнейшего изучения. Фильтрат и промывочную жидкость объединяют и обрабатывают 30% лимонной кислотой. Два слоя разделяют. Органический слой промывают водой (1,5 л). Объединенные водные слои экстрагируют 2,5 л толуола и оставляют для выделения норэфедрина. Экстракт в толуоле объединяют с органическим раствором и концентрируют до 2,5 л. Непрерывно подают толуол и перегоняют до тех пор, пока ТГФ не будет поддаваться обнаружению ГХ. Конечный раствор устанавливают на уровне 3,9 л. В течение 1 ч добавляют гептан (5,2 л). Суспензию охлаждают до 0 С,выдерживают в течение 1 ч и фильтруют. Твердый продукт промывают гептаном (2 объема осадка) и сушат, получая 1,234 кг (выход 95,2%) аминоспирта 3 в виде белых кристаллов. Этот материал имеет чистоту 99,8% А и 99,3% ее. Пример 10 В сухой толуол загружают метанол и толуол. Смесь охлаждают до -78 С и в атмосфере 14 азота добавляют диметилцинк. Смеси дают нагреться до комнатной температуры и перемешивают в течение 1 ч. Добавляют (1R,2S)-Nпирролидинилнорэфедрин. Через 0,5 ч смесь смешивают с предварительно полученной суспензией н-бутиллития и циклопропилацетилена в толуоле (40 мл) через канюлю. Через 0,5 ч добавляют кетон 1. Смесь перемешивают в течение 7 ч и гасят избытком 1 М лимонной кислоты. Анализ органического раствора показал выход 83% и 20% ее. Пример 11 В трехгорлую круглодонную колбу, снабженную механической мешалкой, трубкой для азота и термопарой, загружают твердый аминоспирт 3, МТВЕ (500 мл) и водный КНСО 3 (45 г в 654 мл Н 2 О). При 25 С в виде четырех порций добавляют твердый 4-нитрофенилхлорформиат. Во время добавления проводят мониторинг рН раствора. Во время реакции рН поддерживают между 8,5 и 4 и в конце реакции смесь имеет рН 8,0. Смесь перемешивают при 20-25 С в течение двух часов. В течение 20 минут добавляют водный КОН (2 н.) до тех пор,пока рН водного слоя не достигнет 11,0. Слои разделяют и к слою МТВЕ добавляют 500 мл рассола. Добавляют 0,1 н. уксусную кислоту до тех пор, пока рН не будет 6-7. Слои разделяют и органическую фазу промывают рассолом (500 мл). В этой точке растворитель смеси заменяют на EtOH/IPA и продукт кристаллизуют, как описано в примерах 13 и 14. Пример 12 А В трехгорлую круглодонную колбу, снабженную механической мешалкой, трубкой для азота и термопарой, загружают твердый аминоспирт 3 а, толуол (500 мл) и водный КНСО 3(86,5 г в 500 мл H2O). При 25 С добавляют раствор фосгена в толуоле и смесь перемешивают при 20-25 С в течение двух часов. Слои разделяют и органический слой промывают рассолом (500 мл). В этой точке растворитель смеси заменяют на EtOH/IPA и продукт кристаллизуют, как описано в примерах 13 и 14. Пример 12 В В трехгорлую круглодонную колбу, снабженную механической мешалкой, трубкой для азота и термопарой, загружают твердый аминоспирт 3 а, МТВЕ (500 мл) и водный КНСО 3(86,5 г в 500 мл H2O). При 25 С в раствор медленно пропускают газообразный фосген до тех пор, пока не завершится реакция. Слои разделяют и органический слой промывают рассолом (500 мл). В этой точке растворитель смеси заменяют на EtOH/lPA и продукт кристаллизуют, как описано в примерах 13 и 14. Пример 13 Кристаллизация DMP-266 из 30% 2 пропанола в воде с использованием отношения 15 мл растворителя на грамм DMP-266 и с использованием регулируемого добавления антирастворителя при масштабе исходного DMP-266 400 г. 400 г DMP-266, исходного материала, растворяют в 1,8 л 2-пропанола. Раствор фильтруют для удаления постороннего вещества. К раствору на протяжении от 30 до 60 мин добавляют 1,95 л деионизированной (ДИ) воды. К раствору добавляют от 10 до 20 г затравочных кристаллов DMP-266 (влажный осадок формы II). Слой кристаллов выдерживают в течение 1 ч. Для перемешивания суспензии предпочтительно использование мeшалок Intermig. Если необходимо (из-за присутствия очень длинных кристаллов или густой суспензии), суспензию подвергают мокрому дроблению в течение 15-60 с. К суспензии в течение от 4 до 6 ч добавляют 2,25 л ДИ воды. Если необходимо (из-за присутствия очень длинных кристаллов или густой суспензии), суспензию подвергают мокрому дроблению в течение 15-60 с во время добавления. Суспензию выдерживают в течение от 2 до 16 ч до тех пор, пока концентрация продукта в отстоявшемся слое жидкости не останется постоянной. Суспензию фильтруют для выделения кристаллического влажного осадка. Влажный осадок промывают объемом 30% 2-пропанола в 16 воде, эквивалентным от 1 до 2 объемам осадка,и затем два раза 1 объемом ДИ воды каждый раз. Промытый влажный осадок сушат в вакууме при 50 С. Пример 14 Кристаллизация DMP-266 из 30% 2 пропанола в воде с использованием отношения 15 мл растворителя на грамм DMP-266 и с использованием полунепрерывного способа при масштабе исходного DMP-266 400 г. 400 г DMP-266, исходного материала, растворяют в 1,8 л 2-пропанола. Получают разбавленную (не густую) суспензию смешиванием 20 г DMP-266 формы II в 0,3 л 30% (об./об.) 2 пропанола в воде или оставшейся части суспензии из предыдущей кристаллизации в кристаллизаторе. Растворенную порцию и 4,2 л ДИ воды одновременно загружают в разбавленную суспензию при постоянной скорости в течение 6 часов, чтобы поддерживать постоянный состав растворителя в кристаллизаторе. Предпочтительно применение мешалок Intermig во время кристаллизации. Во время этого добавления суспензию подвергают мокрому дроблению,когда длина кристаллов становится чрезмерно большой или суспензия становится слишком густой. Суспензию выдерживают в течение от 2 до 16 ч до тех пор, пока концентрация продукта в отстоявшемся слое жидкости не останется постоянной. Суспензию фильтруют для выделения кристаллического влажного осадка. Влажный осадок промывают объемом 30% 2 пропанола в воде, эквивалентным от 1 до 2 объемам осадка, и затем два раза 1 объемом ДИ воды каждый раз. Промытый влажный осадок сушат в вакууме при 50 С. Пример 15 Гидрохлорид 2R-[1-гидрокси-1-трифторметил 3-циклопропилпропин-2-ил]-4-хлоранилина Материалы Количество Аминоспирт (98,4% ее) 10 г 4,25 н. НСl в IPA 8,5 мл К раствору аминоспирта IPAc (150 мл) при температуре окружающей среды загружают по каплям НСl в IPA, получая белую суспензию. Суспензию концентрируют в вакууме до 100 мл, во время концентрирования ее промывают 2 х 50 мл IPAc. Суспензию выдерживают при температуре окружающей среды в течение 18 ч и фильтруют. Сырой осадок промывают гептаном (10 мл) и сушат, получая 11/0 г (выделено 97,7%, 99,8% ее) соли аминоспирт НСl в виде белого твердого продукта. Пример 16 Гидрохлорид 2R-[1-гидрокси-1-трифторметил 3-циклопропилпропин-2-ил]-4-хлоранилина К раствору аминоспирта в IPAc (150 мл) при температуре окружающей среды добавляют по каплям водный НСl, получая белую суспензию. Суспензию концентрируют в вакууме до 100 мл, во время концентрирования ее промывают 2 х 50 мл IPAc. Суспензию выдерживают при температуре окружающей среды в течение 24 ч и фильтруют. Сырой осадок промывают холодным IPAc (30 мл) и сушат, получая 10,5 г(выделено 90%, 100% ее) соли аминоспирт НСl в виде белого твердого продукта. Пример 17 Гидробромид 2R-[1-гидрокси-1 трифторметил-3-циклопропилпропин-2-ил]-4 хлоранилина К раствору аминоспирта в толуоле (150 мл) и ТГФ (50 мл) при температуре окружающей среды добавляют по каплям водный НВr,получая прозрачный раствор. Раствор концентрируют в вакууме до 120 мл, получая суспензию. Объем суспензии устанавливают при помощи толуола приблизительно 140 мл и затем добавляют 15 мл ТГФ. Суспензию выдерживают при температуре окружающей среды в течение 10 ч и фильтруют. Сырой осадок промывают толуолом (30 мл) и сушат, получая 12,35 г(выделено 95%, 99,6% ее) соли аминоспирт НВr в виде белого твердого продукта. Пример 18 Гидробромид 2R-[1-гидрокси-1 трифторметил-3-циклопропилпропин-2-ил]-4 хлоранилина К раствору аминоспирта в IPAC (200 мл) при температуре окружающей среды добавляют по каплям водный НВr, получая прозрачный раствор. Раствор концентрируют в вакууме до 18 100 мл, получая суспензию. Суспензию выдерживают при температуре окружающей среды в течение 10 ч и фильтруют. Сырой осадок промывают холодным IPAC (30 мл) и сушат, получая 12,35 г (выделено 95%, 99,3% ее) соли аминоспирт НВr в виде белого твердого продукта. Пример 19 Гидрохлорид 2R-[1-гидрокси-1-трифторметил 3-циклопропилпропин-2-ил]-4-хлоранилина К раствору аминоспирта в IPAc (50 мл) при температуре окружающей среды загружают по каплям 6 н. НСl, получая раствор. Раствор концентрируют в вакууме до 50 мл, во время концентрирования его промывают 2 х 50 млIPAc. Получаемую суспензию выдерживают при температуре окружающей среды в течение 12 ч и фильтруют. Сырой осадок промывают 15 мл смеси IPAc/гептан (1/2) и сушат, получая 6,31 г(99,9% ее, выделено 97,5%) соли НСl в виде белого твердого продукта. Пример 20 Полусульфат 2R-[1-гидрокси-1-трифторметил 3-циклопропилпропин-2-ил]-4-хлоранилина К раствору аминоспирта в IPAc (100 мл) при температуре окружающей среды загружают по каплям 50 мас.% H2SO4, получая раствор. Раствор концентрируют в вакууме до 50 мл, во время концентрирования его промывают 2 х 50 мл IPAc. Получаемую суспензию выдерживают при температуре окружающей среды в течение 12 ч и фильтруют. Сырой осадок промывают 15 мл холодного IPAc и сушат, получая 4,20 г(99,9% ее, выделено 72%) полусульфатной соли в виде белого твердого продукта. Пример 21 Гидрохлорид 2R-[1-гидрокси-1-трифторметил 3-циклопропилпропин-2-ил]-4-хлоранилина Материалы Количество мМоль Аминоспирт (97,6% ее) 11,5 г 39,7 12 н. НСl 3,64 мл 43,7 К раствору аминоспирта в смеси ТГФ, гептана и толуола (150 мл) при температуре окружающей среды загружают по каплям 6 н. НСl,получая раствор. Раствор концентрируют в вакууме до 70 мл, во время концентрирования его промывают 2 х 50 мл IPAc. Получаемую суспензию выдерживают при температуре окружающей среды в течение 12 ч и фильтруют. Влажный осадок промывают 30 мл смесиIPAc/гептан (1/2) и сушат, получая 11,8 г (99,9% ее, выделено 92%) соли НСl в виде белого твердого продукта. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ повышения оптической чистоты(a) медленного добавления раствора кислоты или газообразной кислоты к раствору аминоспирта в органическом растворителе с образованием суспензии кислотно-аддитивной соли аминоспирта;(b) концентрирования суспензии кислотноаддитивной соли аминоспирта;(c) промывания концентрированной суспензии кислотно-аддитивной соли аминоспирта органическим растворителем для регулирования состава растворителя;(d) выдерживания суспензии кислотноаддитивной соли аминоспирта при температуре окружающей среды в течение приблизительно от 2 до 24 ч;(e) фильтрования выдержанной суспензии кислотно-аддитивной соли аминоспирта для выделения влажного осадка кислотно-аддитивной соли аминоспирта;(f) промывания влажного осадка кислотноаддитивной соли аминоспирта холодным органическим растворителем и(g) сушки влажного осадка кислотноаддитивной соли аминоспирта для выделения кислотно-аддитивной соли аминоспирта в виде твердого продукта с повышенной оптической чистотой. 2. Способ по п.1, где кислота имеет рКа меньше чем 3 или равный 3. 3. Способ по п.2, где органический растворитель выбирают из группы, состоящей из изопропилацетата, этилацетата, толуола, метилтрет-бутилового простого эфира, ацетонитрила,тетрагидрофурана, метанола, этанола, изопропанола, углеводородных растворителей и их смесей. 20 4. Способ по п.3, где кислота имеет рКа меньше чем 1 или равный 1. 5. Способ по п.4, где органический растворитель выбирают из группы, состоящей из изопропилацетата, этилацетата, толуола, метилтрет-бутилового простого эфира, ацетонитрила,тетрагидрофурана, метанола, этанола, изопропанола, углеводородного растворителя и их смесей. 6. Способ по п.5, где кислоту выбирают из группы, состоящей из НХ, где Х определяют как галогенид (Сl, Вr, I или F), H2SO4, трифторуксусной кислоты, трихлоруксусной кислоты,RSО 3 Н, где R представляет (С 2-С 6)-алкил, (С 2 С 6)-алкенил, (С 2-С 6)-алкинил, арил, который определяют как фенил или нафтил, и гетероарил, который определяют как 5- или 6-членное кольцо, замещенное одним или двумя гетероатомами, выбранными из О, S, N, и (С 1-С 6)алкил, (С 2-С 6)-алкенил, (С 1-С 6)-алкинил, арил или гетероарил может быть не замещен или замещен одним, двумя или тремя заместителями,выбранными из группы, состоящей из Br, Cl, F,I, (С 1-С 6)-алкила, (С 2-С 6)-алкенила, (С 2-С 6)алкинила, (С 1-С 6)-алкокси, циано, нитро, гидрокси, СНО, СO2 Н, SО 3 Н, CO-С 1-С 6-алкил, CO2 С 1-С 6-алкил, CONR1R2, NR1R2, NR1CО-С 1-С 6 алкил, где R1 и R2 независимо определяют как галоген (Cl, Br, F, I), СF3, CN, NO2, NH2, NH(С 1 С 6-алкил), N(С 1-С 6-алкил)2, CONH2, CONH(С 1CON(С 1-С 6-алкил)2,NHCONH2,С 6-алкил),NHCONH(С 1-С 6-алкил), NHCON(С 1-С 6-алкил)2,CO2-C1-С 6-алкил,(С 1-С 6)-алкил,(С 2-С 6)алкенил, (С 2-С 6)-алкинил, С 3-С 7-циклоалкил или(С 1-С 6)-алкокси, так что С 1-С 6-алкил не замещен или замещен арилом, арил определяют как фенил или нафтил, незамещенный или замещенный С 1-С 6-алкилом, С 1-С 6-алкокси, NO2 или галогеном (Cl, Br, F, I). 7. Способ по п.6, где органический растворитель выбирают из группы, состоящей из изопропилацетата, этилацетата, толуола, метилтрет-бутилового простого эфира, ацетонитрила,тетрагидрофурана, метанола, этанола, изопропанола и углеводородных растворителей и их смесей. 8. Способ по п.7, где раствор кислоты или газообразную кислоту выбирают из группы,состоящей из 1,5-нафталиндисульфоновой кислоты,п-толуолсульфоновой кислоты,СН 3SО 3 Н, трифторметансульфоновой кислоты и камфорасульфоновой кислоты, НСl, НВr и Н 2SO4. 9. Способ по п.8, где раствор кислоты или газообразная кислота и органический растворитель представляют собой НСl и изопропилацетат, НВr и изопропилацетат или НВr и смесь толуолтетрагидрофуран.
МПК / Метки
МПК: C07C 209/88
Метки: чистоты, способ, повышения, 2r-[1-гидрокси-1-трифторметил-3-циклопропилпропин-2-ил]-4-хлоранилина, оптической
Код ссылки
<a href="https://eas.patents.su/11-2039-sposob-povysheniya-opticheskojj-chistoty-2r-1-gidroksi-1-triftormetil-3-ciklopropilpropin-2-il-4-hloranilina.html" rel="bookmark" title="База патентов Евразийского Союза">Способ повышения оптической чистоты 2r-[1-гидрокси-1-трифторметил-3-циклопропилпропин-2-ил]-4-хлоранилина</a>
Предыдущий патент: Способ конверсии углеводородов и устройство для его осуществления
Следующий патент: Способ защиты биологических объектов от токсического действия вносимого активного вещества
Случайный патент: Способ изомеризаций легких бензиновых фракций












