Способ истощения аденозин 5′ – монофосфата в метилтиоаденозинфосфорилаза (мтаза)-недостаточных клетках млекопитающего-хозяина
Номер патента: 1988
Опубликовано: 22.10.2001
Авторы: Каррера Карлос Дж., Коттэм Говард Б., Карсон Деннис Э., Нобори Цумото
Формула / Реферат
1. Способ истощения аденозин 5'-монофосфата в метилтиоаденозинфосфорилаза (МТАза)-недостаточных клетках млекопитающего-хозяина, предусматривающий введение млекопитающему-хозяину, заведомо содержащему МТАза-недостаточные клетки, терапевтически эффективного количества ASS-ингибирующего агента, причем указанный агент ингибирует ASS и тем самым истощает аденозин 5'-монофосфат в МТАза-недостаточных клетках млекопитающего-хозяина.
2. Способ по п.1, отличающийся тем, что установление недостаточности клеток по МТАзе осуществляют следующим образом:
получают пригодный для анализа образец клеток от хозяина, которые предположительно являются МТАза-недостаточными, добавляют к образцу клеток один или более полинуклеотидных зондов, комплементарных нуклеиновой кислоте, кодирующей МТАзу в условиях, которые позволяют зондам гибридизоваться с любой указанной нуклеиновой кислотой, присутствующей в образце клеток, и затем определяют отсутствие кодирующей МТАзу нуклеиновой кислоты в образце клеток по неспособности зондов гибридизоваться с данной нуклеиновой кислотой.
3. Способ по п.1, отличающийся тем, что млекопитающее-хозяин является человеком.
4. Способ по п.1, отличающийся тем, что ASS-ингибирующий агент является L-аланозином.
5. Способ по п.1, отличающийся тем, что ASS-ингибирующий агент вводят, по меньшей мере, один раз ежедневно или непрерывно вплоть до 14 дней.
6. Способ по п.1, отличающийся тем, что МТАза-недостаточные клетки являются клетками первичной опухоли, выбранными из группы, состоящей из клеток немелкоклеточного рака легкого, клеток острого лимфобластного лейкоза, клеток глиомы и клеток опухоли мочевыводящей системы.
7. Способ по п.1, отличающийся тем, что после введения терапевтически эффективного количества ASS-ингибирующего агента хозяину дополнительно вводят субстрат для внутриклеточного образования АМФ.
8. Способ по п.6, отличающийся тем, что МТАза-недостаточные клетки уничтожаются при введении ASS-ингибирующего агента.
Текст
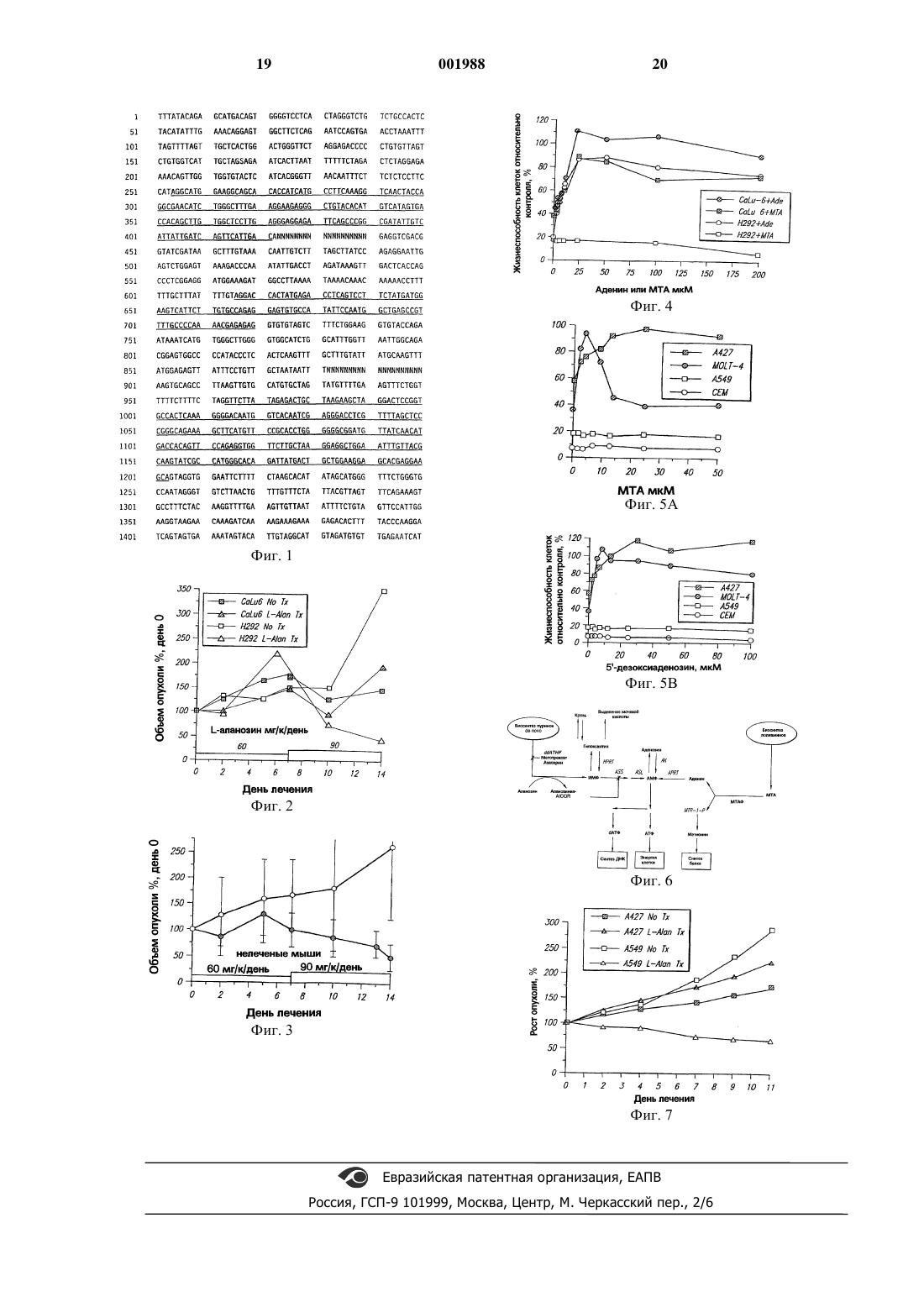
Область техники, к которой относится изобретение Изобретение относится к фармацевтическим агентам и способам, используемым в химиотерапии рака. Более специфично, изобретение относится к идентификации раковых клеток, которые не могут преобразовать метилтиоаденозинфосфорилазу до аденина для использования в синтезе адениновых нуклеотидов, и к использованию L-аланозина для ингибирования синтеза de novo аденозин 5'-монофосфата(АМФ) в таких раковых клетках. Предшествующий уровень техники Метилтиоаденозин (МТА) расщепляется в здоровых клетках млекопитающих метилтиоаденозинфосфорилазой (МТАзой) до аденина и метилтиорибозы-1-Р, последняя является субстратом для метаболического синтеза метионина. Аденин сохраняется в клеточном пуле аденозин 5'-монофосфата (АМФ), из которого клетки производят аденозин 5'-трифосфат(АТФ) для метаболической энергии и 2'дезоксиаденозин-5'-трифосфат (dАТФ) для синтеза ДНК. На основе ранних исследований in vivo Lизомер бактериального антибиотика аланозина"L-аланозин") представляется перспективным для применения в качестве антивирусного и противоопухолевого агента. В частности, считают, что L-аланозин ингибирует конверсию инозин 5'-монофосфата (ИМФ) до АМФ с помощью аденилсукцинатсинтетазы (ASS), истощая таким образом АМФ и АТФ в клеткахмишенях (при отсутствии аденина). Однако,клинические исследования терапевтической эффективности L-аланозина в отношении раковых пациентов не оправдали надежд (см., например, данные, собранные Tyagi and Cooney,Adv. Pharmacol. Chemotherapy, 20:69-120, 1984[результаты до настоящего времени были "мало обнадеживающими" в отношении эффективности L-аланозина для лечения рака человека];Creagan et al., Cancer, 52:615-618, 1993 [исследования стадии II имели общий уровень ответа только 4%]; Creagan et al., Am. J. Clin. Oncol.,7:543-544, 1984 [исследования пациентов с меланомой в стадии II; наблюдали незначительный терапевтический ответ]; VonHoff et al., Invest. New Drugs, 9:87-88, 1991 [объективные ответы не были отмечены у пациентов с раком молочной железы]). В конечном итоге все клинические свойства L-аланозина для применения при лечении рака были отвергнуты. Другим известным ингибитором активности ASS является гадацидин. Однако гадацидин считается более токсичным, чем L-аланозин для человека. Далее, активность других ингибиторов синтеза пуринов de novo (таких как мето 001988 2 трексат, 6-меркаптопурин, 6-тиогуанин и dидеазатетрагидрофолат), которые блокируют синтез ИМФ (и поэтому теоретически элиминируют ИМФ как источник образования АМФ) была устранена in vivo посредством сохранения гипоксантина, который в большом количестве содержится в плазме, для использования его в качестве субстрата для образования ИМФ. Вследствие этого к настоящему времени действие in vivo агентов, которые блокируют путь метаболизма аденина для внутриклеточного образования АМФ, было разочаровывающе слабым. Однако с разработкой достаточно чувствительного метода анализа для идентификации гомозиготных делеций гена, кодирующего МТАзу в ряде человеческих раковых клеток (см. переуступленную Патентную заявку США No 08/176855), теперь представляется, что опухоли,которые лечили при клинических исследованиях L-аланозина, образовывали МТАзу и вследствие этого были способны образовывать достаточно аденина для поддержания пула АМФ,несмотря на ингибирование образования АМФ из ИМФ. Поэтому данное изобретение представляет способ идентификации клеток, в которых отсутствует МТАза, и лечения таких клеток истощением в них АМФ. Сущность изобретения Было обнаружено, что клетки, в которых произошла делеция гена, кодирующего белок МТАзы, и которые вследствие этого неспособны метаболизировать метилтиоаденозин (МТА) до аденина ("МТАза-недостаточные клетки"),селективно уничтожаются in vivo при контакте с терапевтически эффективными дозами ингибитора синтеза АМФ de novo, такого как Lаланозин. Таким образом, хотя L-аланозин не является терапевтически эффективным в отношении всех раковых клеток, он терапевтически эффективен в отношении МТАазанедостаточных клеток. Способ ингибирования активности аденилсукцинатсинтетазы (ASS) в метилтиоаденозинфосфорилаза (МТАза)-недостаточных клетках предусматривает предварительное определение, являются ли раковые клетки МТАзанедостаточными, путем проведения анализа для установления, отсутствует ли в клетках белок МТАзы. Предпочтительным анализом для использования с этой целью является способ детекции гомозиготных делеций в клетках гена,который кодирует белок МТАзы. Изобретение представляет способ истощения аденозин 5'-монофосфата в метилтиоаденозинфосфорилаза (МТАза)-недостаточных клетках млекопитающего-хозяина, предусматривающий введение млекопитающему-хозяину терапевтически эффективного количества ASSингибирующего агента, причем указанный агент ингибирует АSS и тем самым истощает аденозин 5'-монофосфат в МТАза-недостаточных 3 клетках млекопитающего-хозяина. В частности,способ истощения аденозин 5'-монофосфата в МТАза-недостаточных клетках проводят в две стадии: на стадии (а) устанавливают, что популяция клеток, полученных от млекопитающегохозяина, является МТАза-недостаточной, и на стадии (b) осуществляют введение хозяину терапевтически эффективного количества ASSингибирующего агента, причем указанный агент обладает эффектом истощения аденозин 5'монофосфата в МТАза-недостаточных клетках. Стадию (а) проводят следующим образом:(1) получением пригодного для анализа образца клеток, которые предположительно являются МТАза-недостаточными;(2) добавлением к образцу клеток олигонуклеотидных зондов, комплементарных нуклеиновой кислоте, кодирующей МТАзу в условиях, которые позволяют зондам определяемо гибридизоваться с любой такой нуклеиновой кислотой, присутствующей в образце клеток, и(3) определением, присутствует ли кодирующая МТАзу нуклеиновая кислота в образце клеток. Отсутствие кодирующей МТАзу нуклеиновой кислоты в образце клеток определяют по неспособности зондов гибридизоваться с данной нуклеиновой кислотой. МТАза-недостаточные клетки являются клетками первичной опухоли,выбранными из группы, состоящей из клеток немелкоклеточного рака легкого, клеток острого лимфобластного лейкоза, клеток глиомы и клеток опухолей мочевыводящей системы. Изобретение представляет также способ лечения МТАза-недостаточных раков посредством контактирования МТАза-недостаточных клеток с терапевтически эффективным количеством ингибитора синтеза пуринов de novo, который ингибирует активность ASS, предпочтительно, с L-аланозином. Лечение проводят путем истощения аденозин 5'-монофосфата в метилтиоаденозинфосфорилаза(МТАза)-недостаточных клетках млекопитающего-хозяина и оно предусматривает введение млекопитающему-хозяину, заведомо содержащему МТАзанедостаточные клетки, терапевтически эффективного количества ASS-ингибирующего агента, причем указанный агент ингибирует ASS и тем самым истощает аденозин 5'-монофосфат в МТАза-недостаточных клетках млекопитающего-хозяина. При этом МТАза-недостаточные клетки являются клетками первичной опухоли,выбранными из группы, состоящей из клеток немелкоклеточного рака легкого, клеток острого лимфобластного лейкоза и клеток глиомы.ASS-ингибирующие агенты, соответствующие данному изобретению, могут вводиться клинически приемлемыми средствами, но предпочтительно вводятся непрерывным вливанием в концентрациях, меньших максимальной переносимой дозы для пролонгирования желательной ингибирующей активности и минимизации токсичности для тканей хозяина. После введе 001988 4 ния хозяину ASS-ингибирующего агента хозяину вводят субстрат для внутриклеточного образования АМФ. Предложены также наборы для применения в способах, соответствующих изобретению,которые включают реагенты, используемые при проведении анализа МТАза-недостаточности,соответствующего изобретению, а также фармацевтические композиции ингибитора ASS,предпочтительно L-аланозина и/или его активного метаболита, L-аланозинил-AICOR. Краткое описание чертежей На фиг. 1 представлена нуклеотидная последовательность геномной МТАзы (SEQ ID No 1), в которой подчеркнуты экзоны. На фиг. 2 представлен график, показывающий эффект in vivo L-аланозина после непрерывного вливания на стабилизированные человеческие МТАза-компетентные и МТАзанедостаточные ксенотрансплантаты опухолей немелкоклеточного рака легкого у голых мышей. На фиг. 3 представлен график, показывающий эффект in vivo L-аланозина после непрерывного вливания на стабилизированные человеческие МТАза-недостаточные ксенотрансплантаты острого лимфобластного лейкоза у голых мышей. На фиг. 4 и 5 представлены графики, показывающие эффект введения различных экзогенных субстратов МТАзы на МТАзакомпетентные или МТАза-недостаточные клеточные линии после лечения L-аланозином. На фиг. 6 схематически представлены внутриклеточные пути метаболизма для образования АМФ. На фиг. 7 представлен график, показывающий эффект in vivo L-аланозина после ежедневной инъекции на стабилизированные человеческие МТАза-недостаточные ксенотрансплантаты опухолей немелкоклеточного рака легкого у голых мышей. Сведения, подтверждающие возможность осуществления изобретенияI. Пути метаболизма для внутриклеточного образования АМФ. Для лучшего понимания изобретения схема, показывающая внутриклеточные пути метаболизма, при которых образуется АМФ, представлена на фиг. 6. Вообще говоря, существуют три основных источника субстратов для внутриклеточного образования АМФ. Первым является превращение метилтиоаденозина до аденина с помощью МТАзы. Этот путь блокирован в МТАза-недостаточных клетках. Второй путь представляет конверсию ИМФ в АМФ с помощью аденилсукцинатсинтетазы (АSS) или аденилсукцинатлиазы (ASL). В настоящее время ингибиторы активности ASL неизвестны. Однако при утрате активности ASS конверсия ИМФ-АМФ в значительной степени прекращается. 5 Третьим является использование гипоксантина для получения АМФ. Однако, поскольку конверсия ИМФ-АМФ происходит отдельно от использования гипоксантина, ингибирование катаболизма ИМФ-АМФ с помощью ASS блокирует путь использования гипоксантина.II. Способ определения, являются ли опухолевые клетки в анализируемом образце, полученном от млекопитающего-хозяина, МТАзанедостаточными. А. Полинуклеотидные реагенты для использования при идентификации МТАзанедостаточных клеток Предпочтительным способом определения,являются ли определенные популяции клеток МТАза-недостаточными является гибридизационный анализ с целью детекции гомозиготных делеций гена, который кодирует МТАзу в клетках. Процедуры скрининга, которые основаны на гибридизации нуклеиновых кислот, делают возможным определить любую полинуклеотидную последовательность (и в результате любой белок, кодируемый такой полинуклеотидной последовательностью) в любом организме, при условии наличия соответствующего зонда. Полное описание способов гибридизации,подходящих для использования в изобретении, а также описание гена, который кодирует МТАзу,представлены в одновременно рассматриваемой переуступленной Патентной заявке США SerialNo 08/176855 (поданной 29 декабря 1993 г.),описание которой введено здесь в виде данной ссылки вместе с любыми исправлениями, которые могут быть в ней сделаны. Для простоты ссылки полинуклеотидная последовательность гена, кодирующего МТАзу, описана здесь какSEQ ID No 1 в прилагаемом Списке последовательностей и на фиг. 1, где кодирующие участки гена выделены подчеркиванием. Полинуклеотид геномной МТАзы находится в хромосоме 9 на участке р 21. Интересно,что очень высокий процент клеток, имеющих гомозиготную делецию гена, который кодирует опухолевый супрессор р 16, также имеют гомозиготную делецию гена, который кодирует МТАзу. Таким образом, альтернативным средством детекции гомозиготных делеций последнего гена (МТАзы) является детекция гомозиготной делеции первого гена (р 16). Для дальнейшей ссылки по этому вопросу см. переуступленную одновременно рассматриваемую Патентную заявку США Serial No 08/227800, описание которой включено здесь в виде этой ссылки. Штамм Е. coli, содержащий полную геномную ДНК МТАзы крыс, депонирован вAmerican Type Culture Collection (Американская Коллекция Типовых Культур), Rockville, MD. по почте до 29 декабря 1993 г., и Идентификационные номера 55536, 55537, 55538, 55539 и 55540 присвоены в совокупности. Нет сомнений, что этот депозит необходим для того, что 001988 6 бы дать возможность специалисту осуществить ил и предполагать осуществление изобретения. Депозит будет, однако, поддерживаться в жизнеспособной форме в течение всего периода,который является или может являться необходимым по патентному праву, применимому к данному описанию. Для того, чтобы определить, имела ли место гомозиготная делеция гена МТАзы в клетках, представляющих интерес, пригодный для анализа образец клеток получают от хозяина. Например, образец может содержать жидкость или клетки тела, например, из ткани хозяина или опухоли. Такие образцы получают, используя способы, известные из клинической практики, например, опухолевые клетки могут быть получены биопсией или хирургической операцией. Предпочтительно, если клетки практически не содержат "примеси", т.е. клетки, белки и подобные компоненты, которые могут фальсифицировать результат анализа. Например, если солидные (плотные) опухоли являются источником анализируемого образца клеток, нормальные незлокачественные клетки и МТАза,которая может быть выделена из нормальных клеток во время процедуры, проводимой для получения биологического образца, рассматривались бы как примеси. Такие примеси могут быть удалены традиционными способами очистки, например, аффинной хроматографией с антителами против МТАзы. Поскольку изобретение направлено на определение наличия или отсутствия этого гена в образце клеток, которые предположительно являются МТАза-отрицательными, нуклеиновые кислоты в образце предпочтительно амплифицируют для повышения чувствительности способа детекции. Эту амплификацию предпочтительно выполняют с использованием полимеразной цепной реакции (ПЦР), хотя использование цепной реакции в стадии полимеризации не является абсолютно необходимым. Нуклеиновая кислота, предназначенная для амплификации в образце, может состоять из геномной или дикого типа ДНК, которая, как ожидалось бы в норме, кодирует МТАзу, если она присутствует в образце (см. SEQ ID No 1). Полагают, что кодирующая МТАзу ДНК (далее"ДНК-мишень") должна присутствовать во всех нормальных клетках млекопитающих, включая клетки человека. Для использования в качестве контроля или источника олигонуклеотидных зондов или праймеров ДНК, кодирующая геномную МТАзу, может быть выделена согласно способам,известным из уровня техники, таким как способ,описанный Maniatis et al. Molecular Cloning: ALaboratory Manual (Cold Spring Harbor Laboratory, 1982). Здесь приведен рабочий пример,демонстрирующий выделение геномного клона гена МТАзы человека, в котором скрининг библиотеки космидных генов проводят, используя 7 олигонуклеотидный зонд кДНК гена МТАзы(см. Пример III). Однако, специалист будет знать, что возможно применение других подходящих средств для получения ДНК МТАзы. Например, скрининг библиотеки кДНК,которая, как полагают, содержит полинуклеотид, представляющий интерес, может быть проведен инъекцией различных мРНК, выделенных из кДНК, в яйцеклетки, обеспечением достаточного времени для того, чтобы произошла экспрессия генных продуктов кДНК, и тестированием присутствия желаемого продукта экспрессии кДНК, например, с использованием антител,специфичных к пептиду, кодируемому полинуклеотидом, представляющим интерес, или с использованием зондов к повторяющимся фрагментам и образца тканевой экспрессии,характеризующего пептид, кодируемый полинуклеотидом, представляющим интерес. Альтернативно может быть проведен непрямой скрининг библиотеки кДНК на экспрессию представляющих интерес пептидов (например,белка МТАзы), имеющих, по меньшей мере,один эпитоп, с использованием антител, специфичных к пептидам. Такие антитела могут быть либо поликлонально, либо моноклонально выделены и использованы для детекции продукта экспрессии, указывающего на присутствие кДНК, представляющей интерес (см. для дальнейших ссылок Maniatis et al., Molecular Cloning: A Laboratory Manual (Cold Spring HarborLab., New York, 1982). Полинуклеотиды для использования в качестве контролей, зондов или праймеров в изобретении, могут быть также синтезированы с использованием способов и оборудования для синтеза нуклеиновых кислот, которые хорошо известны из уровня техники. В качестве ссылки по этому поводу см. Ausubel et al. Current Protocols in Molecular Biology, гл. 2 и 4 (Wiley Interscience, 1989). В. Амплификация кодирующей МТАзу геномной ДНК и ее гибридизационный анализ. Для повышения чувствительности гибридизационных анализов, соответствующих изобретению, анализируемый образец клеток предпочтительно подвергают воздействию условий,способствующих селективной амплификации нуклеиновой кислоты-мишени. Предпочтительно нуклеиновая кислота-мишень будет являться полинуклеотидной частью гена, который кодирует МТАзу"полинуклеотидоммишенью"). Предпочтительным средством амплификации полинуклеотида-мишени является ПЦР. ПЦР представляет собой способ in vitro ферментативного синтеза специфических последовательностей ДНК или РНК с использованием олигонуклеотидных праймеров, которые гибридизуются со специфическими последовательностями нуклеиновых кислот и фланкируют представляющий интерес участок нуклеиновой 8 кислоты-мишени. Повторяющаяся серия циклов денатурации матрицы, отжигания праймера и ферментного удлинения отжигаемых праймеров приводит к экспоненциальному накоплению фрагмента специфической нуклеиновой кислоты, ограниченного по его концам 5'-концами праймеров. Полученные продукты (продукты ПЦР), синтезированные в одном цикле, служат матрицами для следующего цикла, следовательно, число копий нуклеиновой кислоты-мишени приблизительно удваивается в каждом цикле. Основные способы ПЦР описаны в Патентах США 4 683 195 и 4 683 202 Mullis et al, описания которых включены здесь как примеры известных способов проведения ПЦР. Однако не предполагается ограничивать изобретение применением способов ПЦР, предложенных в патенте 4683202 Mullis et al. Co времени появления способа Mullis et al. было разработано много способов анализа на базе ПЦР, в которых использованы модификации этого способа. Эти модификации известны в уровне техники и поэтому здесь подробно не описываются. Однако с целью иллюстрации возможностей уровня техники в этой области ряд модификаций описывается ниже. Способ ПЦР, который обеспечивает получение внутреннего амплификационного стандарта при использовании конкурентной матрицы, которая отличается от нуклеиновой кислоты-мишени по последовательности и размеру,описан в Proc. Natl. Acad. Sci. USA (1990) 87: 2725-2729 (Gilliland et al., authors). Иной способ проведения конкурентной ПЦР, в котором используют матрицы, отличающиеся по последовательности, но не по размеру, описан Nuc. Acids. Res., 21: 3469-3472, (1993), (Kohsaka et al.,authors). Этот способ является предпочтительным, поскольку в нем используют способ твердофазного иммуноферментного анализа(ELISA) для определения амплифицированной нуклеиновой кислоты (кислот). Неконкурентный способ ПЦР, в котором используют сайт-специфические олигонуклеотиды для детекции мутаций или полиморфизмов в генах, который также может быть использован в способе, соответствующем изобретению, описан в Proc. Natl. Acad. Sci. USA (1989) 86:62306234 (Saiki et al., authors). Преимуществом каждого из этих способов является использование гибридизационных зондов, которые помогают избежать ложных положительных результатов,обусловленных неспецифической амплификацией, которая может происходить при ПЦР. Для дополнительного описания уровня техники специалисты могут обратиться к InnisGuide to Methods and Applications (Acad. Press,1990). Эта публикация представляет обзор способов, влияющих на специфичность, надежность и выход желаемых продуктов ПЦР.(по меньшей мере, одну пару праймеров), которые будут специфически гибридизоваться с маленьким участком пар оснований на любом конце (т.е. 5'- или 3'-конце) полинуклеотидамишени МТАзы (т.е. "фланкирующие последовательности"). Специалисты смогут легко выбрать подходящие праймеры без экспериментальных исследований на основе информации о полинуклеотидной последовательности, приведенной в прилагаемом Списке последовательностей как SEQ. ID. No 1 и на фиг. 1. При конструировании праймеров важно,чтобы праймеры не содержали комплементарные основания, чтобы они не могли бы гибридизоваться друг с другом. Для устранения амплификации примесного материала, который может присутствовать в образце, предпочтительно конструирование праймеров к определенному кругу экзонов (которые для гена МТАзы подчеркнуты на фиг. 1). Как указано выше, нет необходимости использовать цепную реакцию на этой стадии полимеризации с целью адекватной амплификации нуклеиновых кислот в образце. Например, когда используют способ, описанный Kohsaka et al.,supra, стадию полимеризации проводят на твердофазном носителе и за ней следует гибридизация с зондами, специфичными к полинуклеотиду-мишени, при этом чувствительность анализа будет такой, что может быть необходима только одна полимеризация полинуклеотида-мишени. После проведения стадии амплификации продукты ПЦР анализируют и определяют, присутствует ли в образце ген, кодирующий МТАзу. Предпочтительным будет связывание двунитевых продуктов ПЦР с твердой фазой, чтобы их нити могли быть разделены при денатурации, позволяя таким образом специфичным к последовательности зондам гибридизоваться со связанной антисмысловой нитью продукта ПЦР с целью детекции гена, в основном, как описаноKohsaka et al., supra. Альтернативно продукты ПЦР будут удалены из реакционной среды и отделены от амплификационной смеси перед добавлением зондов для гибридизации к двунитевым продуктам ПЦР. В этом последнем случае продукты ПЦР отделяют от амплификационной смеси известными из уровня техники способами, которые в отношении данного способа выбраны для детекции, например, гельфильтрация, электрофорез или аффинная хроматография. Детекция амплифицированного продукта может быть выполнена с использованием гибридизационных зондов, которые стабильно связаны с определяемой меткой. Метка является субстанцией, которая ковалентно связана или жестко ассоциирована с зондом нуклеиновой кислоты, что обеспечивает возможность детекции зонда. Например, метка может представлять собой радиоизотоп, ферментный субстрат или 10 ингибитор, фермент, контрастное вещество (в том числе коллоидные металлы), люминофоры,хемолюминесцентную молекулу, липосомы,содержащие любую из указанных меток или парный член специфического связывания. Подходящая метка не теряет качества, ответственного за определяемость, в течение амплификации. Специалистам в области диагностики известны подходящие определяемые метки для использования в детекционных анализах in vitro. Например, подходящие радиоизотопы для применения in vitro включают 3H, 125I, 131I, 32P, 14 С,35S. Амплифицированные фрагменты, меченные с помощью радиоизотопов, могут быть определены непосредственно с помощью счетчика гамма-излучения или денситометрией авторадиограмм посредством блоттинга по Southern амплифицированных фрагментов в сочетании с денситометрией. Примерами подходящих хемолюминесцентных молекул являются акридины или люминол. Последовательности-мишени,гибридизованные с зондами, дериватизированными акридиновым эфиром, защищены от гидролиза интеркаляцией. Примерами подходящих люминофоров служат флуоресцеин, фикобилипротеин, хелаты редкоземельных металлов, дансил или родамин. Примерами подходящих ферментных субстратов или ингибиторов являются соединения,которые будут специфически связывать пероксидазу хрена, глюкозооксидазу, глюкоза-6 фосфатдегидрогеназу, -галактозидазу, пируваткиназу или щелочную фосфатазуацетилхолинэстеразу. Примерами контрастных веществ служат коллоидное золото или магнитные частицы. Пара специфического связывания содержит две различные молекулы, при этом на поверхности или в полости одной из молекул имеется область, которая специфически связывает определенную пространственную или полярную организацию другой молекулы. Члены пары специфического связывания часто называются лиганд и рецептор или лиганд и антилиганд. Например, если рецептор представлен антителом, лигандом является соответствующий антиген. Иные пары специфического связывания включают пары гормон-рецептор, пары фермент-субстрат, пары биотин-авидин и пары гликопротеин-рецептор. Сюда относятся фрагменты и части пар специфического связывания, которые сохраняют специфичность связывания,такие как фрагменты иммуноглобулинов, включая фрагменты Fab и т.п. Антитела могут либо моноклональными, либо поликлональными. Если член пары специфического связывания используют в качестве метки, то предпочтительный способ разделения будет включать аффинную хроматографию. Если никакие амплифицированные продукты не могут быть определены в ходе опи 11 санного выше анализа, это указывает на МТАзанедостаточность в клетках, присутствующих в образце. Поскольку нормальные (т.е. незлокачественные) клетки всегда будут рассматриваться,как содержащие кодирующий МТАзу ген в определяемых количествах (даже при утрате одного аллеля), обнаружение того, что клетки не содержат ген, кодирующий МТАзу (т.е. имеют гомозиготную делецию гена), указывает на то,что анализируемые клетки не имеют обеих каталитически активной и каталитически неактивной МТАзы. Однако, при желании возможно предварительное исследование образца на каталитическую активность МТАзы с использованием способа, описанного Seidenfeld et al., Biochem. Biophys. Res. Commun., 95: 1861-1866 (1980), см. также Пример I infra. Способ, соответствующий изобретению, будет затем использован для определения, присутствует ли ген, кодирующий МТАзу, в клетках образца. Образец может быть также протестирован на присутствие каталитической активного или неактивного белка с целью скрининга клеточных примесей, т.е. незлокачественных клеток в анализируемом образце. Подходящий способ иммуноанализа для альтернативного применения с этой целью (т.е. в плане гибридизационного анализа) описан Nobori etal., Cancer Res. 53: 1098-1101 (1991) и в одновременно рассматриваемой переуступленной Патентной заявке США Serial No 08/177855,поданной 29 декабря 1993 гописание которой включено в данную заявку. С. МТАза-недостаточные клетки Используя вышеописанные способы анализа, следующие первичные опухоли человека были определены как МТАза-недостаточные. Следует понимать, что данный список типов рака, которые могут быть определены как МТАза-недостаточные с использованием описанных способов анализа, является репрезентативным,но не исчерпывающим. Острые лимфобластные лейкозы (приблизительно 80% случаев) Глиомы (приблизительно 67% случаев) Немелкоклеточные раки легких (приблизительно 18% случаев) Уротелиальные опухоли (например, рак мочевого пузыря, частота варьирует в зависимости от типа опухоли). Основываясь на этих данных, МТАзанедостаточность следует обоснованно предполагать у пациентов, страдающих от этих состояний. Таким образом, образцы клеток от таких пациентов следует рутинно анализировать на МТАза-недостаточность для определения, вероятно ли улучшение состояния пациента от терапии способом, соответствующим изобретению. Образцы клеток от пациентов с другими формами рака следует анализировать на МТАзанедостаточность при клинических показаниях. В частности, не было обнаружено, что образцы 12 первичных опухолей пациентов, страдающих от следующих состояний, являются МТАзанедостаточными (т.е. формы рака являются"МТАза-компетентными"): Рак молочной железы Рак толстой кишки Рак головы и шеи Меланома Рак почки Нелимфобластные лейкозы взрослых людей Определенные острые лейкозы (взрослых и подростков) Проведены клинические исследования применения L-аланозина для лечения вышеуказанных МТАза-компетентных форм рака, которые не привели к заметному успеху.II. Способ лечения МТАза-недостаточных клеток. А. Фармакологические и токсикологические параметры L-аланозина У приматов приблизительно 75% Lаланозина выделяется с мочой в течение приблизительно 24 ч в основном в виде нуклеозидных форм L-аланозил-ИМФ и L-аланозилАlСОR. Клиренс из плазмы после внутривенного введения человеку является двухфазным приt1/2=14 мин. и t1/2=99 мин. (где "t1/2" является периодом полужизни, а значения времени (t) являются приблизительными). В предшествующих клинических исследованиях токсичность была доза-лимитирующей,включая почечную токсичность, стоматит, эзофагит и (с меньшей частотой) миелосупрессию,головную боль, тошноту и гипо- или гипертензию. Почечная токсичность наблюдалась при однократной ударной дозе более 4 г/м 2 массы тела. Далее два педиатрических пациента, которые получали более высокие дозы, приблизительно 350 мг/м 2 массы тела в день, в раздельных дозах, страдали от нарушения функции печени. Стоматит и эзофагит появлялись после многократного введения. Другие отмеченные реакции были специфическими для пациентов. В одном из исследований фазы II использовали непрерывное вливание в дозе приблизительно 125 мг/м 2 массы тела в течение 5 дней для взрослых субъектов с острым нелимфобластным лейкозом. Доза-лимитирующая токсичность была представлена воспалением слизистой оболочки. В. Введение ингибиторов ASS хозяину Млекопитающих-хозяев (например, человека) с формами рака, определенными как МТАза-недостаточные согласно анализу МТАза-недостаточности в соответствии с изобретением, лечат терапевтически эффективными дозами ингибитора ASS, такого как L-аланозин, Lаланозил-AICOR или гадацидин, предпочтительно первого. В этом плане "терапевтически эффективная доза" является дозой, которая дает объективную реакцию опухоли у исследуемых пациентов, где реакция опухоли представляет 13 собой остановку или регрессию роста, определяемых по принятым в клинике стандартам (см.,например, Eagan et al., Cancer, 44, 1125-1128,1979 [описание которого введено здесь этой ссылкой] и доступные сообщения о параметрах,применяемых (в основном для Eagan et al.) в клинических исследованиях, проводимых подIND 14247 (Министерство лекарственных и пищевых продуктов. Определение терапевтически эффективных доз для ингибиторов ASS,используемых в изобретении для истощения внутриклеточной АМФ, по отношению к этим стандартам может быть легко выполнено специалистами в области онкологии. Вообще, ежедневное введение или непрерывное вливание ингибиторов ASS в меньших дозах, чем те, которые, как известно, вызывают токсические эффекты, будет предпочтительным терапевтическим способом усиления антиметаболической активности лекарственных веществ. Благодаря уникальной чувствительности МТАаза-недостаточных клеток к данному способу лечения, можно ожидать, что будут необходимы дозы, которые меньше доз, тестированных в клинических исследованиях L-аланозина при лечении МТАза-компетентных клеток, что снижает токсичность в отношении непролиферирующих клеток. Незлокачественные МТАза-компетентные клетки могут быть также защищены от любого эффекта воздействия ингибиторов ASS посредством введения МТА или подходящего субстратного аналога для использования в синтезе аденина. Подходящие соединения для использования с этой целью включают МТА, 2'-5'дидезоксиаденозин, 5'-дезоксиаденозин, 2'дезокси-5-дезокси-5'-метилтиоаденозин(см.,например, Пример II). Следует оценить, однако,что МТАза-компетентные клетки способны образовывать аденин при метаболизме метилтиоаденозина для восполнения клеточного пула АМФ, и поэтому не следовало бы ожидать в них истощения АМФ до той же степени, что в МТАза-недостаточных клетках. Поскольку изобретение полностью описано, его практическое применение иллюстрируют примерами, представленным ниже. Следует понимать, однако, что примеры не ограничивают объем изобретения, который определен прилагаемой формулой изобретения. Во всех примерах используются стандартные сокращения,такие как "мл" - миллилитр, "час." - часы и "мг"- миллиграмм. Пример 1. Эффект in vivo L-аланозина на МТАза-недостаточные и МТАза-компетентные ксенотрансплантаты опухолей человека после непрерывного вливания. Для оценки эффекта in vivo L-аланозина на известные человеческие МТАза-недостаточные опухоли после непрерывного вливания и сравнения данного эффекта с эффектом лекарственного препарата на известные человеческие 14 МТАза-компетентные опухоли, 2 х 106 МТАзанедостаточных клеток Н 292 NSCLC и МТАзакомпетентных опухолевых клеток Calu-6 (в 0,3 мл 50% носителя MATRIGEL) инъецируют в правый и левый бок, соответственно, восьми бестимусных голых мышей Balb/C. MATRIGEL сначала образует твердый матрикс invivo, который измеряют у каждой мыши на первый день после инфузии для контроля размера опухоли (которая рассасывается через 14 дней). Для дальнейшего сравнения 107 клеток СЕМ TALL (МТАза-недостаточного острого лимфобластного лейкоза) в 50% носителе MATRIGEL инъецируют в правый бок 8 другим голым мышам. Многие клетки получают из серийно выпускаемых клеточных линий, поставляемых АТСС и маркируемыми при продаже номерами CRL-1848 и НТВ-56, соответственно. На следующий день 4 мышам с билатеральным инокулятом NSCLC и 4 - с инокулятомT-ALL подкожно имплантируют осмотические инфузионные насосы ALZET 1007D в область спины на некотором расстоянии от областей инокулятов опухолевых клеток. Насосы наполняют L-аланозином в концентрации, рассчитанной для доставки 60 мг/кг ежедневно при непрерывном введении. Поскольку через 7 дней при дозе 60 мг/кг никакой токсичности не обнаруживается, насосы удаляют и замещают насосами, содержащими L-аланозин для доставки 90 мг/кг в день еще на 7 дней. Как показано на фиг. 2 и 3, введенный Lаланозин вызывает сморщивание инокулумов ксенотрансплантатов установленных МТАзанедостаточных NSCLC ("H292 L-alan Tx", фиг. 2) иT-ALL ("Леченые мыши"; фиг. 3) у иммунодефицитных мышей-хозяев и препятствует росту новых инокулумов ксенотрансплантатов МТАзанедостаточных NSCLC или T-ALL у иммунодефицитных мышей-хозяев по сравнению с лечеными МТАза-компетентными клетками NSCLC и нелечеными МТАза-недостаточным и клетками. В частности, стабилизированные МТАзакомпетентные опухоли быстро растут, несмотря на L-аланозин, также как и нелеченые МТАФнедостаточные ксенотрансплантаты NSCLC илиT-ALL. Пример 2. Защита здоровых МТАзакомпетентных клеток субстратами МТАзы. Селективную неспособность МТАзанедостаточных клеток NSCLC пролиферировать в присутствии 40 мкМ L-аланозина, несмотря на добавление к каждой культуре субстрата МТАзы метилтиоаденозина (МТА), подтверждают при сравнении двухклеточных линий - МТАзакомпетентной Calu-6 и МТАза-недостаточной Н 292 (фиг. 4). Контрольные культуры, содержащие аденин (tAde), пролиферируют несмотря на L-аланозин, подтверждая, что селективная токсичность обусловлена неспособностью МТАза-недостаточных клеток превращать МТА до аденина. 15 При дальнейшем сравнении добавление МТА или субстратного аналога МТА 5'дезоксиаденозина приводит к восстановлению роста только МТАза-компетентных клеток А 427 и клеток MOLT-4, тогда как у МТАзанедостаточных клеток А 549 и СЕМ сохраняется ингибирование роста (фиг. 5 А и В). Поскольку МТА является ингибитором сперминсинтетазы по типу обратной связи, некоторые клеточные линии, такие как MOLT-4, ингибируются при высоких концентрациях. Это приводит к восстановлению кривой двухфазного роста с повышением концентрации МТА (фиг. 5 А). Пример 3. Клонирование и частичная характеризация геномного клона МТАзы. Геномный клон МТАзы человека выделяют следующим образом. Космидную библиотеку генов, сконструированную из ДНК плаценты человека (Clontech), исследуют с помощью зонда кДНК генов МТАзы, представленного фрагментом Not I/EcoRi из субклона МТАР-7. Трансформированные клетки Е. coli из библиотеки помещают на чашки со средой LB, содержащей ампициллин (50 мг/л) при густоте колоний 1-2 х 104 на чашку размером 135 х 15 мм. Выполняют следующие процедуры. Из полумиллиона колоний выделяют и частично характеризуют анализом с помощью ПЦР и прямым секвенированием одну положительную колонию, обозначаемую МТАР-10. Два праймера, смысловой олигонуклеотид, расположенный на расстоянии 120 пар оснований слева от стопкодона, и антисмысловой олигонуклеотид, расположенный на расстоянии 20 пар оснований справа от стоп-кодона, синтезируют и используют в анализе с помощью ПЦР. Проводят 25 циклов ПЦР, каждый из циклов состоит из денатурации (92 С, 1 мин), отжига (50 С, 2 мин) и удлинения (72 С, 5 мин). Продукты ПЦР разделяют в 0,8% агарозном геле. Положение экзонов, идентифицированных в настоящее время в гене МТАзы с использованием вышеописанных способов, представлено на фиг. 1 (подчеркнуто). Пример 4. Применение обработки олигонуклеотидами, специфичными к последовательности МТАзы, злокачественных клеточных линий для определения присутствия или отсутствия в них МТАзы. Для оценки возможности применения олигонуклеотидных зондов, выделенных из МТАзы, геномный клон идентифицируют, как описывают в примере 4 (SEQ ID No 1), проводят ПЦР ряда клеточных линий рака легкого человека, которые заведомо содержат МТАзакомпетентные (Calu-6; ATCC РегистрационныйATCC Регистрационный No CCL-185). Геномную ДНК выделяют, как описано в Примере III,и для ПЦР используют 1 мкг этой ДНК. Проводят 40 циклов амплификации, как описано выше, при этом каждый цикл состоит 16 из денатурации (92 С, 1 мин), отжига (55 С, 1 мин) и удлинения (72 С, 1/2 мин). Продукты ПЦР анализируют в 1,5% агарозном геле. В заведомо МТАза-недостаточных клеточных линиях активность МТАзы не обнаруживают, тогда как в МТАза-компетентных клеточных линиях определяют МТАзу. Пример 5. Ингибирование L-аланозином МТАР-недостаточных опухолей после ежедневной инъекции голым мышам со стабилизированными опухолевыми ксенотрансплантатами. 107 клеток NSCLC A549 или А 427 инъецируют подкожно бестимусным голым мышамBalb/c 6-недельного возраста. Когда опухоли достигают диаметра приблизительно 0,4 см,начинают лечение L-аланозином или солевым раствором посредством внутрибрюшинной инъекции каждые 12 ч. Мыши получают 15 мг/кг с каждой инъекцией в течение 7 дней, затем 22,5 мг/кг в течение 5 дней. Размер опухоли измеряют по перпендикулярным диаметрам. Результаты для леченых (n=6 [размер образца] для каждого типа клеток) против контрольных (n=4 [размер образца] для каждого типа клеток), мышей представлены на фиг. 7. Ни для одного исследованного уровня дозировки не была отмечена токсичность (мыши имели стабильную массу во время тестирования). L-аланозин, вводимый инъекцией дважды в день в ударной дозе, вызывает уменьшение размера хорошо стабилизированных МТАзанедостаточных опухолей, но не обладает эффектом в отношении МТАР-положительных клеток. Краткое описание последовательностей Последовательность ID No 1 является геномным клоном метилтиоаденозинфосфорилазы(i) ЗАЯВИТЕЛИ: ЗЕ РИДЖЕНТС ОФ ЗИ ЮНИВЕСИТИ ОФ КЭЛИФОНЬЕ(ii) НАЗВАНИЕ ИЗОБРЕТЕНИЯ: СПОСОБ ИНГИБИРОВАНИЯ АКТИВНОСТИ АДЕНИЛСУКЦИНАТСИНТЕТАЗЫ МЕТИЛТИОАДЕНОЗИНФОСФОРИЛАЗАНЕДОСТАТОЧНЫХ КЛЕТКАХ 18 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ истощения аденозин 5'монофосфата в метилтиоаденозинфосфорилазаASSингибирующего агента, причем указанный агент ингибирует ASS и тем самым истощает аденозин 5'-монофосфат в МТАза-недостаточных клетках млекопитающего-хозяина. 2. Способ по п.1, отличающийся тем, что установление недостаточности клеток по МТАзе осуществляют следующим образом: получают пригодный для анализа образец клеток от хозяина, которые предположительно являются МТАза-недостаточными, добавляют к образцу клеток один или более полинуклеотидных зондов, комплементарных нуклеиновой кислоте, кодирующей МТАзу в условиях, которые позволяют зондам гибридизоваться с любой указанной нуклеиновой кислотой, присутствующей в образце клеток, и затем определяют отсутствие кодирующей МТАзу нуклеиновой кислоты в образце клеток по неспособности зондов гибридизоваться с данной нуклеиновой кислотой. 3. Способ по п.1, отличающийся тем, что млекопитающее-хозяин является человеком. 4. Способ по п.1, отличающийся тем, чтоASS-ингибирующий агент вводят, по меньшей мере, один раз ежедневно или непрерывно вплоть до 14 дней. 6. Способ по п.1, отличающийся тем, что МТАза-недостаточные клетки являются клетками первичной опухоли, выбранными из группы,состоящей из клеток немелкоклеточного рака легкого, клеток острого лимфобластного лейкоза, клеток глиомы и клеток опухоли мочевыводящей системы. 7. Способ по п.1, отличающийся тем, что после введения терапевтически эффективного количества ASS-ингибирующего агента хозяину дополнительно вводят субстрат для внутриклеточного образования АМФ. 8. Способ по п.6, отличающийся тем, что МТАза-недостаточные клетки уничтожаются при введении ASS-ингибирующего агента.
МПК / Метки
МПК: G01N 33/567, C12Q 1/02
Метки: клетках, монофосфата, истощения, метилтиоаденозинфосфорилаза, аденозин, мтаза)-недостаточных, млекопитающего-хозяина, способ
Код ссылки
<a href="https://eas.patents.su/11-1988-sposob-istoshheniya-adenozin-5-monofosfata-v-metiltioadenozinfosforilaza-mtaza-nedostatochnyh-kletkah-mlekopitayushhego-hozyaina.html" rel="bookmark" title="База патентов Евразийского Союза">Способ истощения аденозин 5′ – монофосфата в метилтиоаденозинфосфорилаза (мтаза)-недостаточных клетках млекопитающего-хозяина</a>
Предыдущий патент: Сопло
Следующий патент: Способ получения [is-[1a,2b,3b,4a(s*)]]-4-[7-[[1-(3-хлор-2-тиенил)метил]пропил]амино]-3н-имидазо[4,5-b]пиридин-3-ил]-n-этил-2,3-дигидроксициклопентанкарбоксамида.
Случайный патент: Способ получения полиамидной композиции с использованием карбоновых кислот и амидов