Способ получения 2-(2-хлорфенил)-2-гидроксиэтилового эфира (s)-карбаминовой кислоты
Формула / Реферат
1. Способ получения 2-(2-хлорфенил)-2-гидроксиэтилового эфира (S)-карбаминовой кислоты:
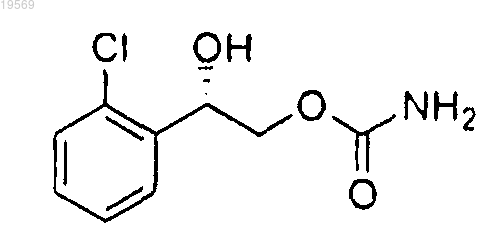
включающий следующие стадии:
а) этерификация (S)-(2-хлорфенил)гидроксиуксусной кислоты:
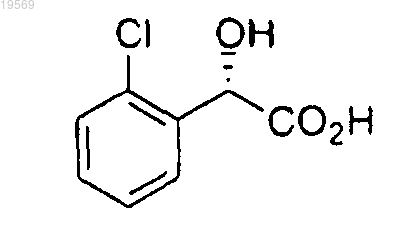
С(1-4)спиртом, выбранным из группы, состоящей из метанола, этанола, н-пропанола, изопропанола, н-бутанола, изобутанола, втор-бутанола и трет-бутанола; при этом указанная этерификация характеризуется использованием от 0,025 до 0,4 экв. хлорокиси фосфора, с получением сложного эфира формулы IV
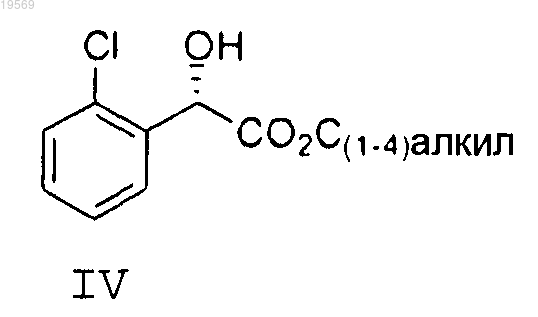
b) защита спиртовой группы в соединении формулы IV, при этом указанная защита характеризуется использованием кислотного катализа, регулируемого кислотой, оставшейся от хлорокиси фосфора в предыдущей реакции, и простого эфира, выбранного из группы, состоящей из 2-метокси-1-пропена, дигидропирана, метилвинилового эфира, этилвинилового эфира и 5,6-дигидро-4-метокси-2Н-пирана, с получением соединения формулы II, где PG означает защитную группу, полученную из простого эфира, при этом указанный простой эфир выбран из группы, состоящей из 2-метокси-1-пропена, дигидропирана, метилвинилового эфира, этилвинилового эфира и 5,6-дигидро-4-метокси-2Н-пирана
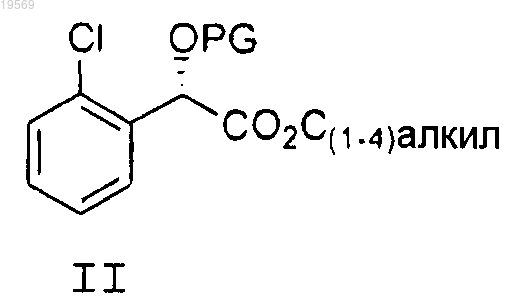
с) восстановление борогидридом лития промежуточного сложного эфира формулы II до спирта формулы III
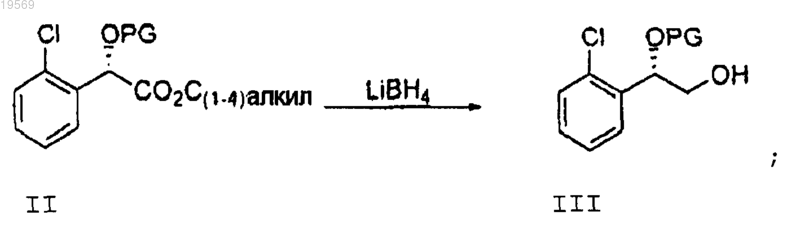
d) взаимодействие спирта формулы III
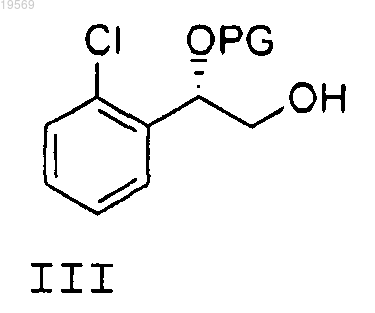
с карбонильным соединением
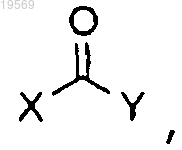
где X и Y означают уходящие группы, независимо выбранные из группы, состоящей из брома, хлора, имидазолила и феноксигруппы;
при этом указанное взаимодействие характеризуется температурой реакции от -10 до 65°С, с получением карбонильного соединения формулы V
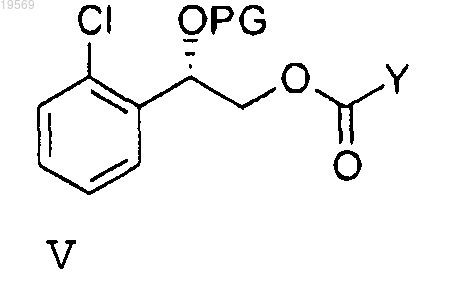
е) взаимодействие соединения формулы V с гидроксидом аммония или аммиаком при температуре реакции от 0 до 55°С с образованием карбамата формулы VI
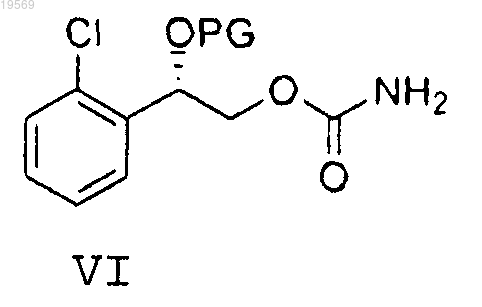
f) удаление защитной группы карбамата формулы VI, при этом указанное удаление защитной группы характеризуется использованием серной кислоты с образованием 2-(2-хлорфенил)-2-гидроксиэтилового эфира (S)-карбаминовой кислоты.
2. Способ по п.1, дополнительно включающий стадию перекристаллизации 2-(2-хлорфенил)-2-гидроксиэтилового эфира (S)-карбаминовой кислоты, при этом указанная перекристаллизация характеризуется регулируемым градиентом охлаждения.
3. Способ получения 2-(2-хлорфенил)-2-гидроксиэтилового эфира (S)-карбаминовой кислоты:
включающий следующие стадии:
а) этерификация метиловым спиртом (S)-(2-хлорфенил)гидроксиуксусной кислоты:
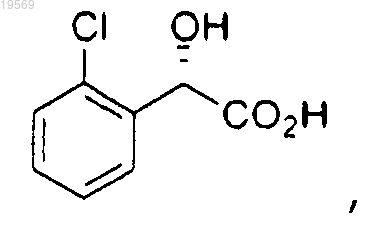
при этом указанная этерификация характеризуется использованием 0,1 экв. хлорокиси фосфора, с получением метилового эфира (S)-(2-хлорфенил)гидроксиуксусной кислоты:
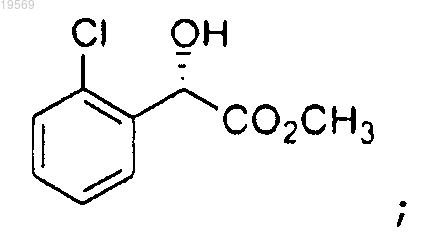
b) защита метилового эфира (S)-(2-хлорфенил)гидроксиуксусной кислоты, при этом указанная защита характеризуется использованием кислотного катализа, регулируемого кислотой, оставшейся от хлорокиси фосфора из предыдущей реакции, и 2-метокси-1-пропена, с получением метилового эфира (S)-(2-хлорфенил)-(1-метокси-1-метилэтокси)уксусной кислоты:
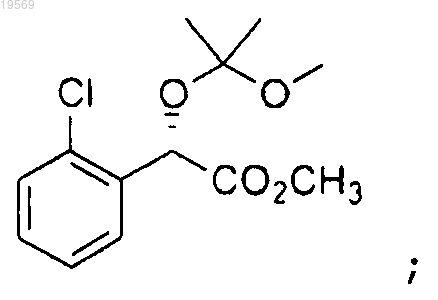
с) восстановление борогидридом лития метилового эфира (S)-(2-хлорфенил)-(1-метокси-1-метилэтокси)уксусной кислоты с получением (S)-2-(2-хлорфенил)-2-(1-метокси-1-метилэтокси)этанола:
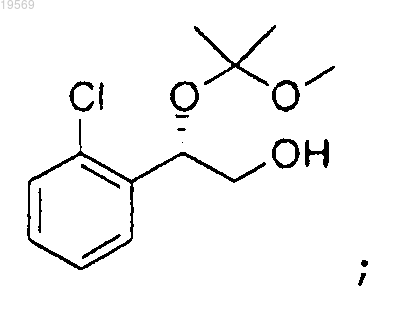
d) взаимодействие (S)-2-(2-хлорфенил)-2-(1-метокси-1-метилэтокси)этанола с 1,1'-карбонил-бис-1Н-имидазолом с получением 2-(2-хлорфенил)-2-(1-метокси-1-метилэтокси)этилового эфира (S)-имидазол-1-карбоновой кислоты:
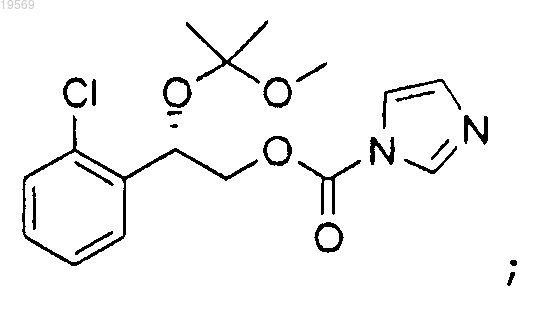
е) взаимодействие 2-(2-хлорфенил)-2-(1-метокси-1-метилэтокси)этилового эфира (S)-имидазол-1-карбоновой кислоты с гидроксидом аммония с образованием 2-(2-хлорфенил)-2-(1-метокси-1-метилэтокси)этилового эфира (S)-карбаминовой кислоты:
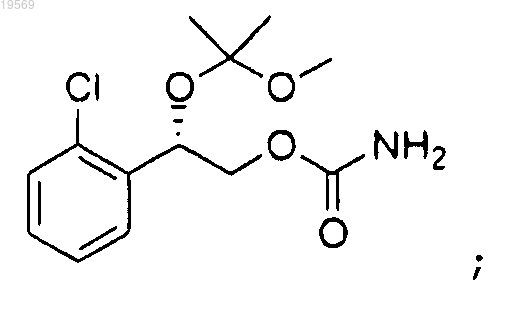
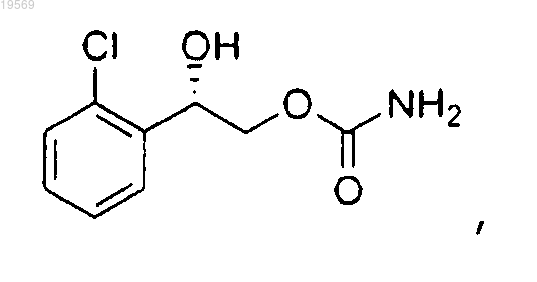
f) удаление защитной группы 2-(2-хлорфенил)-2-(1-метокси-1-метилэтокси)этилового эфира (S)-карбаминовой кислоты с применением серной кислоты с образованием 2-(2-хлорфенил)-2-гидроксиэтилового эфира (S)-карбаминовой кислоты.
4. Способ получения 2-(2-хлорфенил)-2-гидроксиэтилового эфира (S)-карбаминовой кислоты:
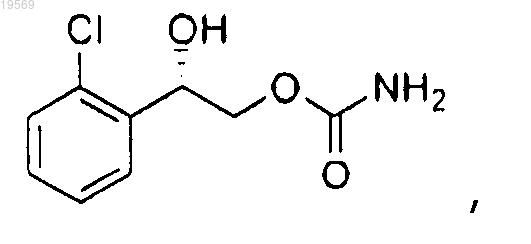
включающий следующие стадии:
а) этерификация метиловым спиртом (S)-(2-хлорфенил)гидроксиуксусной кислоты:
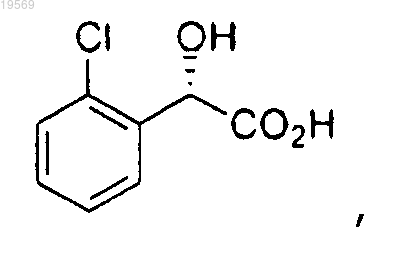
при этом указанная этерификация характеризуется использованием 10 экв. метанола, 0,1 экв. хлорокиси фосфора, температуры реакции от 40 до 50°С, частичного концентрирования и толуола в качестве сорастворителя с получением метилового эфира (S)-(2-хлорфенил)гидроксиуксусной кислоты:
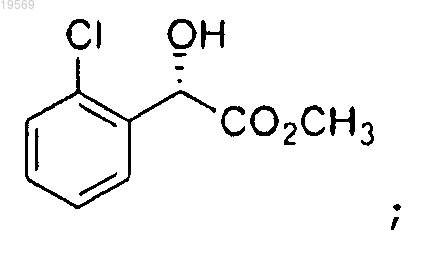
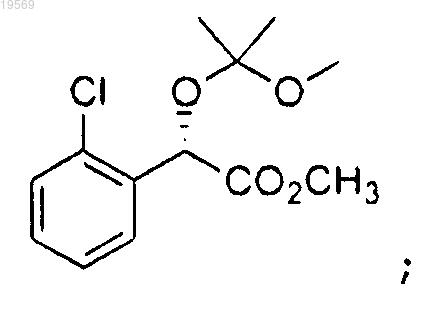
b) защита метилового эфира (S)-(2-хлорфенил)гидроксиуксусной кислоты, при этом указанная защита характеризуется использованием
кислотного катализа, регулируемого кислотой, оставшейся от хлорокиси фосфора с предыдущей стадии,
добавления к реакционной смеси 1,6 экв. изопропенилметилового эфира и
промывки реакционной смеси водой,
с получением метилового эфира (S)-(2-хлорфенил)-(1-метокси-1-метилэтокси)уксусной кислоты:
с) восстановление борогидридом лития метилового эфира (S)-(2-хлорфенил)-(1-метокси-1-метилэтокси)уксусной кислоты в тетрагидрофуране (ТГФ) в качестве растворителя при температуре реакции от 40 до 50°С с последующей
обработкой реакционной смеси ацетоном,
отгонкой ТГФ и ацетона и изопропанола (последний образуется во время обработки при восстановлении ацетона),
промывкой реакционной смеси раствором гидроксида натрия и раствором NaCl,
с получением (S)-2-(2-хлорфенил)-2-(1-метокси-1-метилэтокси)этанола:
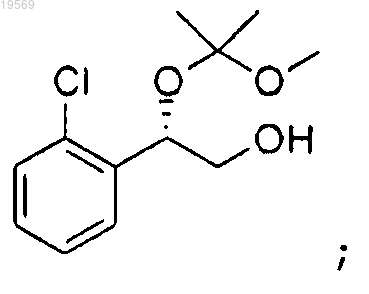
d) взаимодействие (S)-2-(2-хлорфенил)-2-(1-метокси-1-метилэтокси)этанола с 1,1'-карбонил-бис-1Н-имидазолом с получением 2-(2-хлорфенил)-2-(1-метокси-1-метилэтокси)этилового эфира (S)-имидазол-1-карбоновой кислоты:
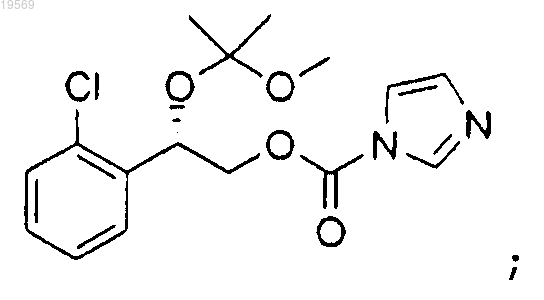
е) взаимодействие 2-(2-хлорфенил)-2-(1-метокси-1-метилэтокси)этилового эфира (S)-имидазол-1-карбоновой кислоты с гидроксидом аммония, при этом указанное взаимодействие характеризуется использованием 1,60 экв. гидроксида аммония и температуры реакции от 40 до 50°С, с образованием 2-(2-хлорфенил)-2-(1-метокси-1-метилэтокси)этилового эфира (S)-карбаминовой кислоты:
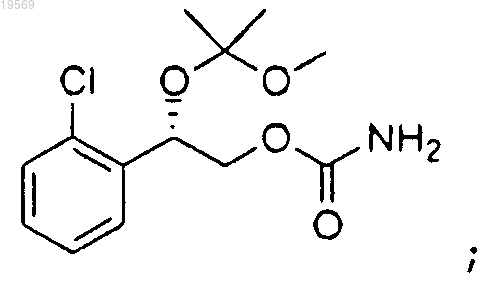
f) удаление защитной группы 2-(2-хлорфенил)-2-(1-метокси-1-метилэтокси)этилового эфира (S)-карбаминовой кислоты, при этом указанное удаление защитной группы характеризуется добавлением 2 экв. водного раствора серной кислоты и температурой реакции от 40 до 50°С, с образованием 2-(2-хлорфенил)-2-гидроксиэтилового эфира (S)-карбаминовой кислоты:
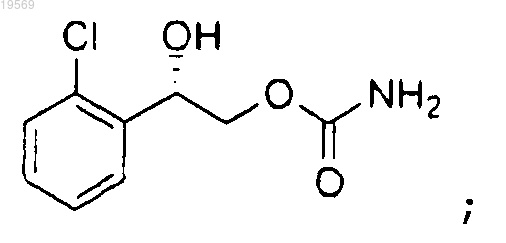
g) перекристаллизация 2-(2-хлорфенил)-2-гидроксиэтилового эфира (S)-карбаминовой кислоты, при этом указанная перекристаллизация характеризуется соотношением метанол/вода 1:4 и использованием регулируемого градиента температуры.
Текст
которая применима для лечения расстройств центральной нервной системы, включая эпилепсию. Способ включает новое применение борогидрида лития для восстановления промежуточного сложного эфира до спирта, который используют в следующих реакциях для получения 2-(2-хлорфенил)-2-гидроксиэтилового эфира (S)-карбаминовой кислоты. Краткое описание изобретения Настоящее изобретение относится к новому способу получения 2-(2-хлорфенил)-2 гидроксиэтилового эфира (S)-карбаминовой кислоты. Уровень техники 2-(Замещенный фенил)-2-гидроксиэтилкарбаматы и их изомеры описаны в US 5698588,US 5854283, US 6127412, US 6103759, WO 97/26241 и WO 03/053916 в качестве соединений, применимых для лечения расстройств центральной нервной системы. К указанным расстройствам относятся судороги, эпилепсия, удар, мышечные спазмы, невропатическая боль и мигрень. Предпочтительным расстройством является эпилепсия. Сущность изобретения Настоящее изобретение относится к способу получения 2-(2-хлорфенил)-2-гидроксиэтилового эфира (S)-карбаминовой кислоты: при этом указанный способ включает применение борогидрида лития для восстановления промежуточного сложного эфира формулы II до спирта формулы III, который используют в следующих реакциях для превращения в 2-(2-хлорфенил)-2-гидроксиэтиловый эфир (S)-карбаминовой кислоты: где PG означает защитную группу, полученную из простого эфира, при этом указанный простой эфир выбран из группы, состоящей из 2-метокси-1-пропена, дигидропирана, метилвинилового эфира,этилвинилового эфира и 5,6-дигидро-4-метокси-2 Н-пирана. Подробное описание изобретения Настоящее изобретение относится к способу получения 2-(2-хлорфенил)-2-гидроксиэтилового эфира (S)-карбаминовой кислоты:C1-4 спиртом, выбранным из группы, состоящей из метанола, этанола, н-пропанола, изопропанола,н-бутанола, изобутанола, втор-бутанола и трет-бутанола; при этом указанная этерификация характеризуется использованием от 0,025 до 0,4 экв. хлорокиси фосфора, с получением сложного эфира формулы IVb) защита спиртовой группы в соединении формулы IV, при этом указанная защита характеризуется использованием кислотного катализа, регулируемого кислотой, оставшейся от хлорокиси фосфора в предыдущей реакции, и простого эфира, выбранного из группы, состоящей из 2-метокси-1-пропена, дигидропирана, метилвинилового эфира, этилвинилового эфира и 5,6-дигидро-4-метокси-2 Н-пирана, с получением соединения формулы II, где PG означает защитную группу, полученную из простого эфира, при этом указанный простой эфир выбран из группы, состоящей из 2-метокси-1-пропена, дигидропирана,метилвинилового эфира, этилвинилового эфира и 5,6-дигидро-4-метокси-2 Н-пирана с) восстановление борогидридом лития промежуточного сложного эфира формулы II до спирта формулы IIId) взаимодействие спирта формулы III где X и Y означают уходящие группы, независимо выбранные из группы, состоящей из брома, хлора, имидазолила и феноксигруппы; при этом указанное взаимодействие характеризуется температурой реакции от -10 до 65 С, с получением карбонильного соединения формулы V е) взаимодействие соединения формулы V с гидроксидом аммония или аммиаком при температуре реакции от 0 до 55 С с образованием карбамата формулы VIf) удаление защитной группы карбамата формулы VI, при этом указанное удаление защитной группы характеризуется использованием серной кислоты с образованием 2-(2-хлорфенил)-2 гидроксиэтилового эфира (S)-карбаминовой кислоты. В одном из вариантов осуществления изобретения указанный способ дополнительно включает стадию перекристаллизации 2-(2-хлорфенил)-2-гидроксиэтилового эфира (S)-карбаминовой кислоты, при этом указанная перекристаллизация характеризуется регулируемым градиентом охлаждения. В другом варианте настоящее изобретение относится к способу получения 2-(2-хлорфенил)-2 гидроксиэтилового эфира (S)-карбаминовой кислоты: включающему следующие стадии: а) этерификация метиловым спиртом (S)-(2-хлорфенил)гидроксиуксусной кислоты: при этом указанная этерификация характеризуется использованием 0,1 экв. хлорокиси фосфора, с получением метилового эфира (S)-(2-хлорфенил)гидроксиуксусной кислоты:b) защита метилового эфира (S)-(2-хлорфенил)гидроксиуксусной кислоты, при этом указанная защита характеризуется использованием кислотного катализа, регулируемого кислотой, оставшейся от хлорокиси фосфора из предыдущей реакции, и 2-метокси-1-пропена, с получением метилового эфира с) восстановление борогидридом лития метилового эфира (S)-(2-хлорфенил)-(1-метокси-1 метилэтокси)уксусной кислоты с получением (S)-2-(2-хлорфенил)-2-(1-метокси-1-метилэтокси)этанола:f) удаление защитной группы 2-(2-хлорфенил)-2-(1-метокси-1-метилэтокси)этилового эфира(S)-карбаминовой кислоты с применением серной кислоты с образованием 2-(2-хлорфенил)-2 гидроксиэтилового эфира (S)-карбаминовой кислоты. В другом варианте настоящее изобретение относится к способу получения 2-(2-хлорфенил)-2 гидроксиэтилового эфира (S)-карбаминовой кислоты: включающему следующие стадии: а) этерификация метиловым спиртом (S)-(2-хлорфенил)гидроксиуксусной кислоты: при этом указанная этерификация характеризуется использованием 10 экв. метанола, 0,1 экв. хлорокиси фосфора, температуры реакции от 40 до 50 С, частичного концентрирования и толуола в качестве сорастворителя,с получением метилового эфира (S)-(2-хлорфенил)гидроксиуксусной кислоты:b) защита метилового эфира (S)-(2-хлорфенил)гидроксиуксусной кислоты, при этом указанная защита характеризуется использованием кислотного катализа, регулируемого кислотой, оставшейся от хлорокиси фосфора с предыдущей стадии,добавления к реакционной смеси 1,6 экв. изопропенилметилового эфира и промывки реакционной смеси водой,с получением метилового эфира (S)-(2-хлорфенил)-(1-метокси-1-метилэтокси)уксусной кислоты: с) восстановление борогидридом лития метилового эфира (S)-(2-хлорфенил)-(1-метокси-1 метилэтокси)уксусной кислоты в тетрагидрофуране (ТГФ) в качестве растворителя при температуре реакции от 40 до 50 С с последующей обработкой реакционной смеси ацетоном,отгонкой ТГФ и ацетона и изопропанола (последний образуется во время обработки при восстановлении ацетона),промывкой реакционной смеси раствором гидроксида натрия и раствором NaCl,с получением (S)-2-(2-хлорфенил)-2-(1-метокси-1-метилэтокси)этанола: е) взаимодействие 2-(2-хлорфенил)-2-(1-метокси-1-метилэтокси)этилового эфира (S)-имидазол-1 карбоновой кислоты с гидроксидом аммония, при этом указанное взаимодействие характеризуется использованием 1,60 экв. гидроксида аммония и температуры реакции от 40 до 50 С, с образованием 2-(2 хлорфенил)-2-(1-метокси-1-метилэтокси)этилового эфира (S)-карбаминовой кислоты:f) удаление защитной группы 2-(2-хлорфенил)-2-(1-метокси-1-метилэтокси)этилового эфира(S)-карбаминовой кислоты, при этом указанное удаление защитной группы характеризуется добавлением 2 экв. водного раствора серной кислоты и температурой реакции от 40 до 50 С, с образованием 2-(2-хлорфенил)-2-гидроксиэтилового эфира (S)-карбаминовой кислоты:g) перекристаллизация 2- (2-хлорфенил)-2-гидроксиэтилового эфира (S)-карбаминовой кислоты,при этом указанная перекристаллизация характеризуется соотношением метанол/вода 1:4 и использованием регулируемого градиента температуры. Примеры Следующие примеры иллюстрируют варианты осуществления изобретения, поскольку примеры распространяются на синтез то в тексте авторы могут использовать название "2-(2-хлорфенил)-2-(1-метокси-1-метилэтокси)этиловый эфир (S)-карбаминовой кислоты" вместо структурной формулы. Применение любого из приведенных ниже способов или его эквивалента дает неожиданные преимущества, которые описаны ниже. Нижеследующее описание приведено только в целях иллюстрации. Пример 1. В реакционный сосуд загружали 300 кг (1607,8 моль) (S)-2-хлорминдальной кислоты, 519 кг(16199 моль) метанола, 24,6 кг (160,4 моль) хлорокиси фосфора, 190 кг (1790,4 моль) триметоксиметана и 672 кг толуола и нагревали до 40-50 С, при этом происходило образование прозрачного раствора. Раствор частично концентрировали в вакууме до удаления примерно 708 кг растворителей. Дополнительно добавляли 708 кг толуола и дистилляцию в вакууме повторяли снова до удаления 708 кг растворителей. Сложный эфир IV использовали на следующей стадии реакции в виде раствора в толуоле. Частичное концентрирование раствора толуола в противоположность полному удалению метанола в качестве реагента/растворителя и толуола в качестве растворителя обеспечивает преимущество, которое позволяет избежать обратной реакции и тем самым увеличить выход реакции. Кроме того, было обнаружено, что в качестве кислоты можно использовать меньшее, чем эквимолярное, количество, например 0,025-0,4 экв., POCl3 вместо 2,8 экв. HCl. Использование субстехиометрических количеств POCl3 имеет преимущества, которые заключаются в повышенной безопасности в результате избегания необходимости нейтрализовать большое количество кислоты после дистилляции, в уменьшении времени цикла,в уменьшении использования реагентов и в общем упрощении способа (без добавления газообразного Реакционную смесь охлаждали до 5-15 С. Массу 184 кг (2552 моль) 2-метокси-1-пропена медленно добавляли при 5-30 С. Полученный раствор перемешивали в течение 30-120 мин при температуре от 20 до 30 С перед добавлением 24,6 кг (243,1 моль) безводного триэтиламина. После того как было проверено, что значение рН находится в диапазоне от 8 до 11, добавляли 270 кг воды, в результате чего образовывалась двухфазная смесь. Эмульсию перемешивали в течение 10-30 мин перед разделением слоев. Нижний водный слой отбрасывали (примерно 305 кг). Органический слой частично концентрировали в вакууме до удаления примерно 300 кг растворителей. Сложный эфир II использовали на следующей стадии в виде раствора. Обнаружение того, что контроль рН для кислотного катализа, регулируемого кислотой, оставшейся от хлорокиси фосфора с предыдущей стадии, можно применять вместо нового POCl3, привело к нескольким упрощениям способа, включая следующее: отмену необходимости в дополнительном добавлении хлорокиси фосфора, отмену необходимости контролировать и регулировать рН для оптимального образования кеталя и отмену необходимости в смене реактора, что приводило к уменьшению времени цикла. Кроме того, было обнаружено, что такая реакция не требует многократных промывок и сушки надNa2SO4; и было обнаружено, что достаточна одна промывка водой и сушка азеотропной перегонкой. Пример 3. В сухую емкость загружали 91,8 кг (1702,2 моль) борогидрида калия, 72,0 кг (1698,9 моль) хлорида лития и 516 кг тетрагидрофурана. Полученную суспензию перемешивали при 40-50 С в течение 1-2 ч,затем добавляли раствор сложного эфира II в течение 90-180 мин при 40-50 С. После добавления реакционную смесь перемешивали при 40-50 С еще в течение 2,5-3,5 ч. При такой же температуре медленно в течение 60-120 мин добавляли 271 кг ацетона, затем 240 кг толуола и смесь перемешивали еще в течение 30-60 мин при 40-50 С. Затем использовали перегонку в вакууме, чтобы удалить 786 кг растворителей. Добавляли раствор гидроксида натрия (примерно 30% (мас./мас.), 278 кг, 2085 моль), с последующим добавлением 557 кг очищенной воды. Полученную эмульсию перемешивали в течение 20-40 мин при 40-50 С и слои разделяли. Нижний водный слой отбрасывали (примерно 997 кг). Органический слой разбавляли 240 кг толуола, обрабатывали 300 кг очищенной воды и 30 кг хлорида натрия. Эмульсию перемешивали при 40-50 С в течение 10-30 мин и слои снова разделяли. Водный слой (примерно 360 кг) отбрасывали. Органический слой частично концентрировали в вакууме до удаления примерно 600 кг растворителей. Спирт III использовали на следующей стадии реакции в виде раствора. Использование LiBH4 либо в виде твердого реагента, либо в виде раствора в соответствующем растворителе или образованного in situ из борогидрида калия и хлорида лития в качестве восстановителя приводило к нескольким усовершенствованиям способа, включая исключение необходимости использования растворителя диметилового эфира тетраэтиленгликоля, который может быть трудноудаляемым,более низкую температуру реакции, больший выход по объему и исключение необходимости в сушке над Na2SO4 и фильтровании. Кроме того, использование LiBH4 приводило к превосходной и неожиданной селективности восстановления. Исключаемыми нежелательными побочными реакциями являются удаление защитной группы и/или дегалогенирование. В реакционный сосуд загружали 326 кг (2010,5 моль) 1,1'-карбонил-бис-1 Н-имидазола и 540 кг толуола. Суспензию энергично перемешивали в течение 10-30 мин, затем медленно добавляли раствор спирта III в течение 30 мин при 15-45 С с образованием почти прозрачного раствора. Имидазолид V использовали на следующей стадии реакции в виде раствора в толуоле. Использование диапазона температур от 15 до 45 С соответственно приводило к полному превращению и увеличению выхода по объему, по сравнению с такой же реакцией, проводимой в диапазоне температур от 0 до 20 С. Пример 5. Раствор с предыдущей стадии перемешивали при 35-45 С в течение 30-60 мин, затем медленно добавляли 175 кг раствора гидроксида аммония (25% (мас./об.), 1,6 экв.) в течение 90-180 мин при 35-45 С. Двухфазную реакционную смесь дополнительно перемешивали при 35-45 С в течение 45-75 мин. Карбамат VI использовали на следующей стадии в двухфазной реакционной смеси. Использование 1,6 (1,44-1,77) экв. гидроксида аммония, а не 10 экв. позволяло использовать реакционную смесь непосредственно на следующей стадии без водных экстракций. Новый способ имел преимущества, связанные с полным превращением и низким уровнем побочных реакций, отсутствием потерь продукта в водных слоях и повышенным объемным выходом. Пример 6. Двухфазную реакционную смесь, содержащую карбамат VI, обрабатывали 392 кг очищенной воды,затем добавляли 311 кг (3171,2 моль, 2 экв.) серной кислоты при 15-50 С с последующим добавлением дополнительно 43,5 кг очищенной воды. Эмульсию перемешивали при 40-50 С в течение 45-75 мин, при этом происходила преципитация неочищенного карбамата I. Суспензию охлаждали до 10-20 С с последующим центрифугированием. Влажный продукт (примерно 360 кг) промывали 360 кг очищенной воды,несколькими порциями, и сушили в сушилке (сушильной камере) на поддонах или механической сушилке в вакууме при 65-75 С в течение 0,5-24 ч. Использование 2 экв. серной кислоты позволяло сочетать образование карбамата, описанного в примере 5, со способом, описанным в примере 6. Кроме того, использование 2 экв. серной кислоты при 40-50 С, а не 0,73 экв. HCl при 20-30 С приводило к увеличению выхода от 83,7 до 91,6%. Объемный выход возрастал с 70 до 146 г/л, и время цикла уменьшалось. Пример 7. Карбамат I растворяли в метаноле при температуре образования флегмы (65 С) и фильтровали через картридж с фильтром 0,45 мкм в предварительно нагретый реактор. Раствор охлаждали, используя заданный градиент охлаждения, до 18-22 С, при этом в ходе охлаждения продукт начинал кристаллизоваться. К суспензии добавляли воду до получения соотношения метанол/вода 1:4. Затем суспензию охлаждали, используя заданный градиент, до 0-5 С. Суспензию фильтровали и полученный осадок на фильтре промывали водой. Влажный продукт сушили в вакууме при 48-52 С в сушильной камере или механической сушилке. Использование регулируемого градиента охлаждения приводило к небольшому увеличению объемного выхода от 118 до 123 г/л и контролю образования полиморфов. Хотя в приведенном выше описании изобретения описаны принципы настоящего изобретения и представлены примеры в целях иллюстрации, будет понятно, что практическое осуществление изобретения включает все обычные изменения, адаптации и/или модификации, которые входят в объем следующей формулы изобретения, и их эквиваленты. Все публикации, указанные в приведенном выше описании изобретения, включены в настоящее описание посредством ссылки в полном объеме. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения 2-(2-хлорфенил)-2-гидроксиэтилового эфира (S)-карбаминовой кислоты: С(1-4)спиртом, выбранным из группы, состоящей из метанола, этанола, н-пропанола, изопропанола,н-бутанола, изобутанола, втор-бутанола и трет-бутанола; при этом указанная этерификация характеризуется использованием от 0,025 до 0,4 экв. хлорокиси фосфора, с получением сложного эфира формулы IVb) защита спиртовой группы в соединении формулы IV, при этом указанная защита характеризуется использованием кислотного катализа, регулируемого кислотой, оставшейся от хлорокиси фосфора в предыдущей реакции, и простого эфира, выбранного из группы, состоящей из 2-метокси-1-пропена, дигидропирана, метилвинилового эфира, этилвинилового эфира и 5,6-дигидро-4-метокси-2 Н-пирана, с получением соединения формулы II, где PG означает защитную группу, полученную из простого эфира, при этом указанный простой эфир выбран из группы, состоящей из 2-метокси-1-пропена, дигидропирана,метилвинилового эфира, этилвинилового эфира и 5,6-дигидро-4-метокси-2 Н-пирана с) восстановление борогидридом лития промежуточного сложного эфира формулы II до спирта формулы IIId) взаимодействие спирта формулы III где X и Y означают уходящие группы, независимо выбранные из группы, состоящей из брома, хлора, имидазолила и феноксигруппы; при этом указанное взаимодействие характеризуется температурой реакции от -10 до 65 С, с получением карбонильного соединения формулы V е) взаимодействие соединения формулы V с гидроксидом аммония или аммиаком при температуре реакции от 0 до 55 С с образованием карбамата формулы VIf) удаление защитной группы карбамата формулы VI, при этом указанное удаление защитной группы характеризуется использованием серной кислоты с образованием 2-(2-хлорфенил)-2 гидроксиэтилового эфира (S)-карбаминовой кислоты. 2. Способ по п.1, дополнительно включающий стадию перекристаллизации 2-(2-хлорфенил)-2 гидроксиэтилового эфира (S)-карбаминовой кислоты, при этом указанная перекристаллизация характеризуется регулируемым градиентом охлаждения. 3. Способ получения 2-(2-хлорфенил)-2-гидроксиэтилового эфира (S)-карбаминовой кислоты: включающий следующие стадии: а) этерификация метиловым спиртом (S)-(2-хлорфенил)гидроксиуксусной кислоты: при этом указанная этерификация характеризуется использованием 0,1 экв. хлорокиси фосфора, с получением метилового эфира (S)-(2-хлорфенил)гидроксиуксусной кислоты:b) защита метилового эфира (S)-(2-хлорфенил)гидроксиуксусной кислоты, при этом указанная защита характеризуется использованием кислотного катализа, регулируемого кислотой, оставшейся от хлорокиси фосфора из предыдущей реакции, и 2-метокси-1-пропена, с получением метилового эфира с) восстановление борогидридом лития метилового эфира (S)-(2-хлорфенил)-(1-метокси-1 метилэтокси)уксусной кислоты с получением (S)-2-(2-хлорфенил)-2-(1-метокси-1-метилэтокси)этанола:f) удаление защитной группы 2-(2-хлорфенил)-2-(1-метокси-1-метилэтокси)этилового эфира(S)-карбаминовой кислоты с применением серной кислоты с образованием 2-(2-хлорфенил)-2 гидроксиэтилового эфира (S)-карбаминовой кислоты. 4. Способ получения 2-(2-хлорфенил)-2-гидроксиэтилового эфира (S)-карбаминовой кислоты: включающий следующие стадии: а) этерификация метиловым спиртом (S)-(2-хлорфенил)гидроксиуксусной кислоты: при этом указанная этерификация характеризуется использованием 10 экв. метанола, 0,1 экв. хлорокиси фосфора, температуры реакции от 40 до 50 С, частичного концентрирования и толуола в качестве сорастворителя с получением метилового эфира (S)-(2-хлорфенил)гидроксиуксусной кислоты:b) защита метилового эфира (S)-(2-хлорфенил)гидроксиуксусной кислоты, при этом указанная защита характеризуется использованием кислотного катализа, регулируемого кислотой, оставшейся от хлорокиси фосфора с предыдущей стадии,добавления к реакционной смеси 1,6 экв. изопропенилметилового эфира и промывки реакционной смеси водой,с получением метилового эфира (S)-(2-хлорфенил)-(1-метокси-1-метилэтокси)уксусной кислоты: с) восстановление борогидридом лития метилового эфира (S)-(2-хлорфенил)-(1-метокси-1 метилэтокси)уксусной кислоты в тетрагидрофуране (ТГФ) в качестве растворителя при температуре реакции от 40 до 50 С с последующей обработкой реакционной смеси ацетоном,отгонкой ТГФ и ацетона и изопропанола (последний образуется во время обработки при восстановлении ацетона),промывкой реакционной смеси раствором гидроксида натрия и раствором NaCl,с получением (S)-2-(2-хлорфенил)-2-(1-метокси-1-метилэтокси)этанола: е) взаимодействие 2-(2-хлорфенил)-2-(1-метокси-1-метилэтокси)этилового эфира (S)-имидазол-1 карбоновой кислоты с гидроксидом аммония, при этом указанное взаимодействие характеризуется использованием 1,60 экв. гидроксида аммония и температуры реакции от 40 до 50 С, с образованием 2-(2-хлорфенил)-2-(1-метокси-1-метилэтокси)этилового эфира (S)-карбаминовой кислоты:f) удаление защитной группы 2-(2-хлорфенил)-2-(1-метокси-1-метилэтокси)этилового эфира(S)-карбаминовой кислоты, при этом указанное удаление защитной группы характеризуется добавлением 2 экв. водного раствора серной кислоты и температурой реакции от 40 до 50 С, с образованием 2-(2-хлорфенил)-2-гидроксиэтилового эфира (S)-карбаминовой кислоты:g) перекристаллизация 2-(2-хлорфенил)-2-гидроксиэтилового эфира (S)-карбаминовой кислоты, при этом указанная перекристаллизация характеризуется соотношением метанол/вода 1:4 и использованием регулируемого градиента температуры.
МПК / Метки
МПК: C07C 29/147, C07C 271/12, C07C 33/46, C07C 269/00
Метки: способ, 2-(2-хлорфенил)-2-гидроксиэтилового, кислоты, s)-карбаминовой, получения, эфира
Код ссылки
<a href="https://eas.patents.su/11-19569-sposob-polucheniya-2-2-hlorfenil-2-gidroksietilovogo-efira-s-karbaminovojj-kisloty.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения 2-(2-хлорфенил)-2-гидроксиэтилового эфира (s)-карбаминовой кислоты</a>
Предыдущий патент: Прозрачная панель с рассеивателем
Следующий патент: Система мобильной связи, устройство базовой станции, устройство мобильной станции и способ мобильной связи
Случайный патент: Производные индола, обладающие противоопухолевой активностью















