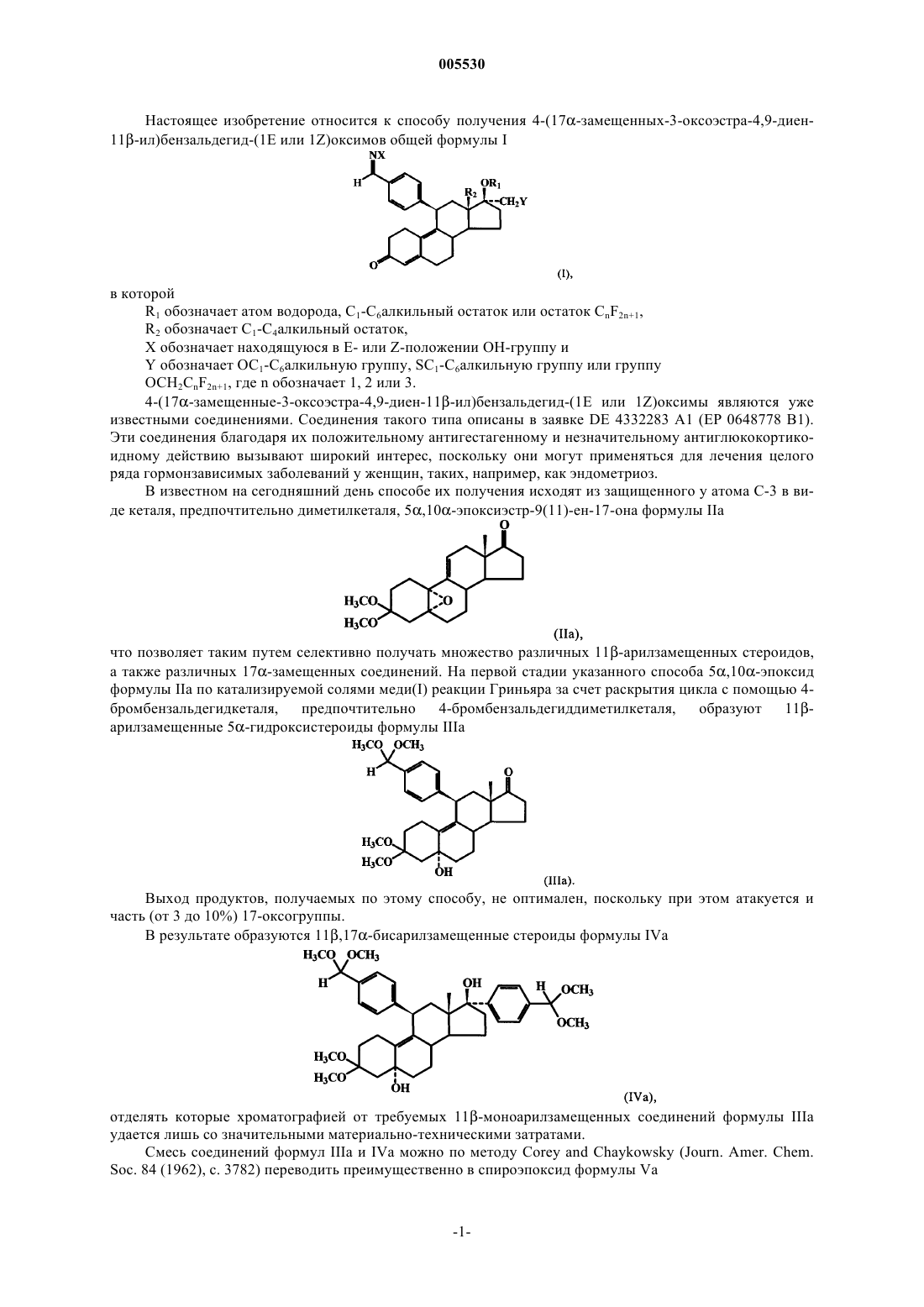
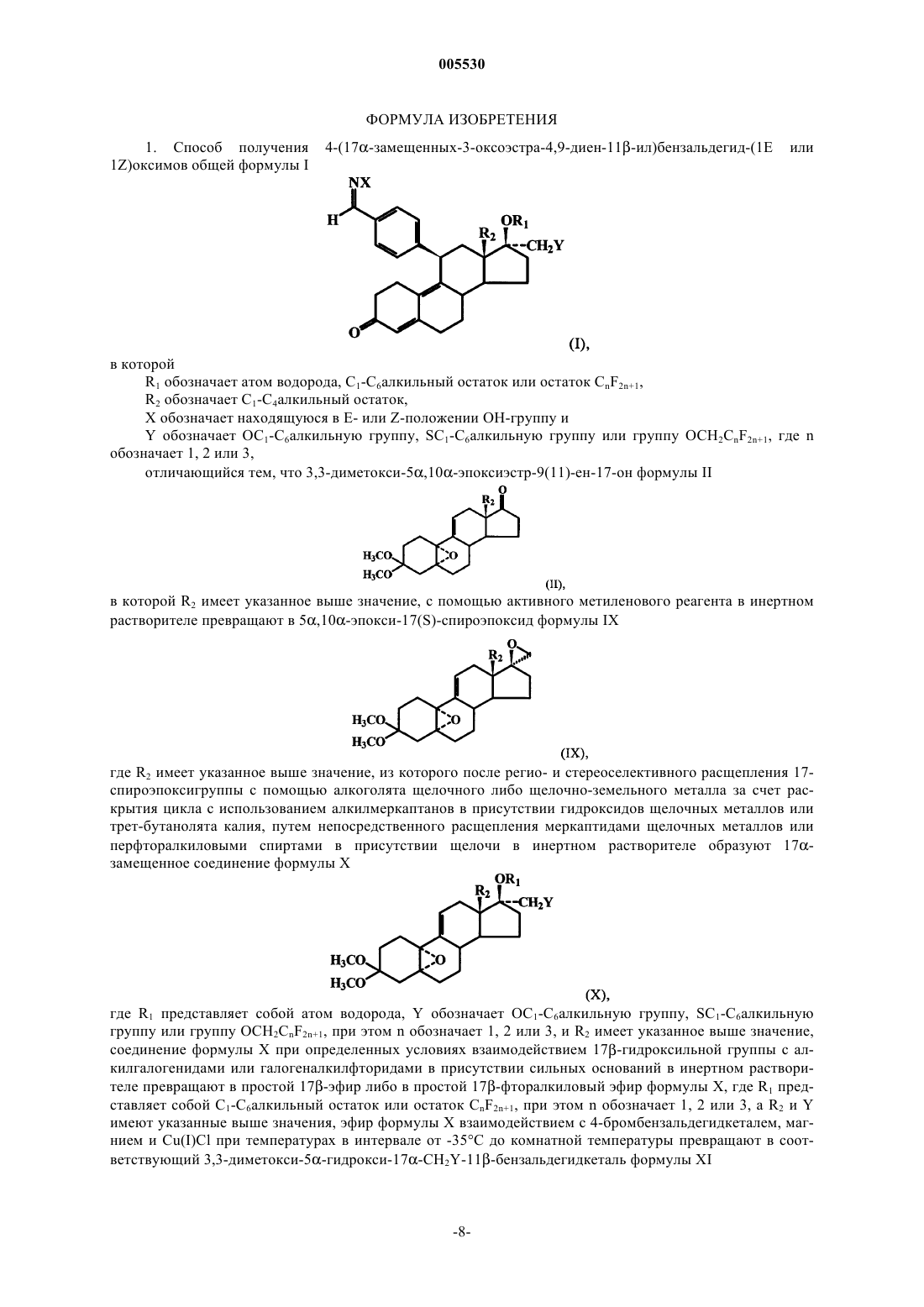
Способ получения 4-(17α-замещенных-3-оксоэстра-4,9-диен-11β-ил)бензальдегид-(1е или 1z)оксимов.
Формула / Реферат
1. Способ получения 4-(17a-замещенных-3-оксоэстра-4,9-диен-11b-ил)бензальдегид-(1E или 1Z)оксимов общей формулы I
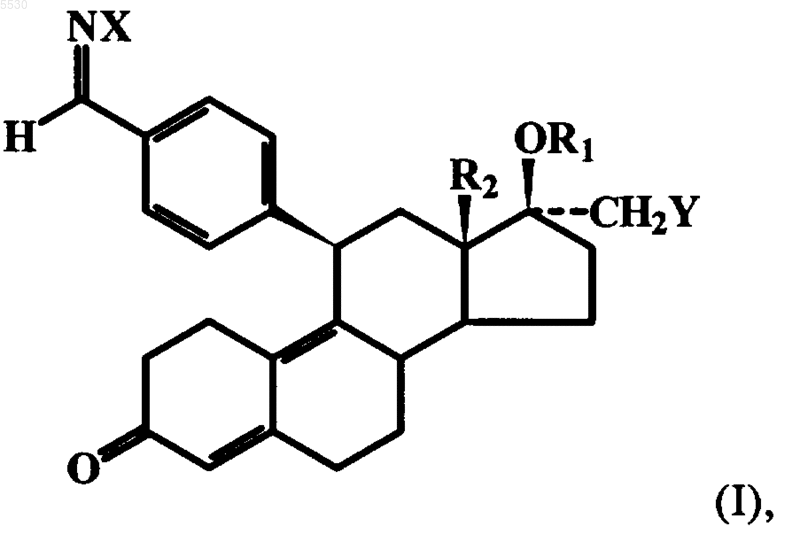
в которой
R1 обозначает атом водорода, C1-C6алкильный остаток или остаток CnF2n+1,
R2 обозначает C1-C4алкильный остаток,
X обозначает находящуюся в E- или Z-положении OH-группу и
Y обозначает OC1-C6алкильную группу, SC1-C6алкильную группу или группу OCH2CnF2n+1, где n обозначает 1, 2 или 3,
отличающийся тем, что 3,3-диметокси-5a,10a-эпоксиэстр-9(11)-ен-17-он формулы II
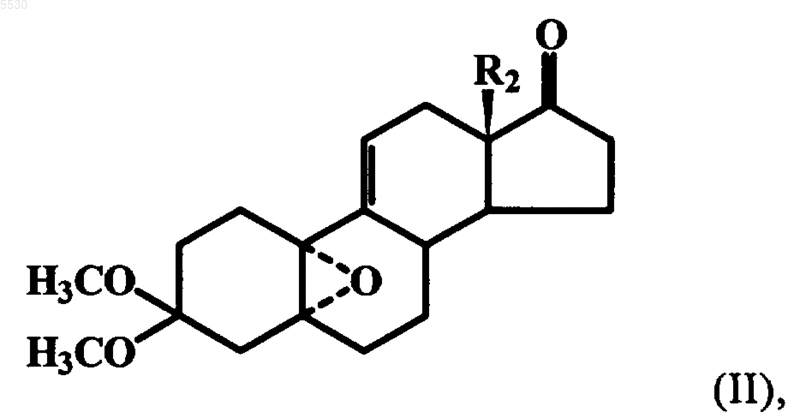
в которой R2 имеет указанное выше значение, с помощью активного метиленового реагента в инертном растворителе превращают в 5a,10a-эпокси-17(S)-спироэпоксид формулы IX
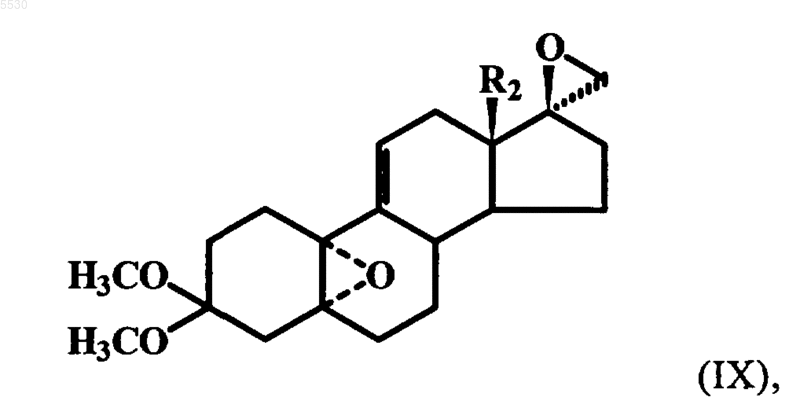
где R2 имеет указанное выше значение, из которого после регио- и стереоселективного расщепления 17-спироэпоксигруппы с помощью алкоголята щелочного либо щелочно-земельного металла за счет раскрытия цикла с использованием алкилмеркаптанов в присутствии гидроксидов щелочных металлов или трет-бутанолята калия, путем непосредственного расщепления меркаптидами щелочных металлов или перфторалкиловыми спиртами в присутствии щелочи в инертном растворителе образуют 17a-замещенное соединение формулы X
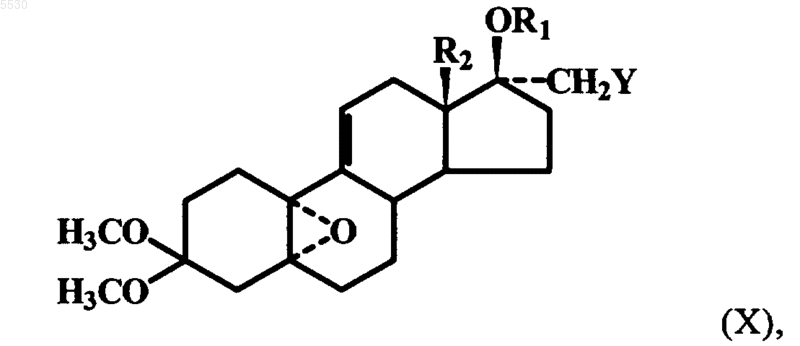
где R1 представляет собой атом водорода, Y обозначает OC1-C6алкильную группу, SC1-C6алкильную группу или группу OCH2CnF2n+1 при этом n обозначает 1, 2 или 3, и R2 имеет указанное выше значение, соединение формулы X при определенных условиях взаимодействием 17b-гидроксильной группы с алкилгалогенидами или галогеналкилфторидами в присутствии сильных оснований в инертном растворителе превращают в простой 17b-эфир либо в простой 17b-фторалкиловый эфир формулы X, где R1 представляет собой C1-C6алкильный остаток или остаток CnF2n+1, при этом n обозначает 1, 2 или 3, а R2 и Y имеют указанные выше значения, эфир формулы X взаимодействием с 4-бромбензальдегидкеталем, магнием и Cu(I)Cl при температурах в интервале от -35шC до комнатной температуры превращают в соответствующий 3,3-диметокси-5a-гидрокси-17a-CH2Y-11b-бензальдегидкеталь формулы XI
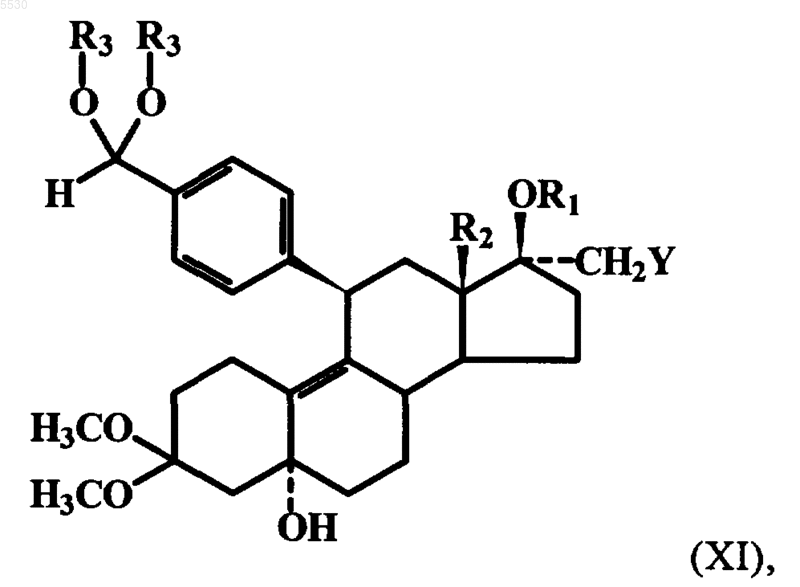
где R1 представляет собой атом водорода, C1-C6алкильный остаток или остаток CnF2n+1, при этом n обозначает 1, 2 или 3, R2 и Y имеют указанные выше значения, а R3 представляет собой метильную или этилиденовую группу, который путем кислотного гидролиза защитных групп переводят в производное 11b-бензальдегида формулы XII

где R1, R2 и Y имеют указанные выше значения, и альдегидную функцию селективно с использованием гидроксиламмониевых солей превращают в смесь E/Z-бензальдоксимов общей формулы I
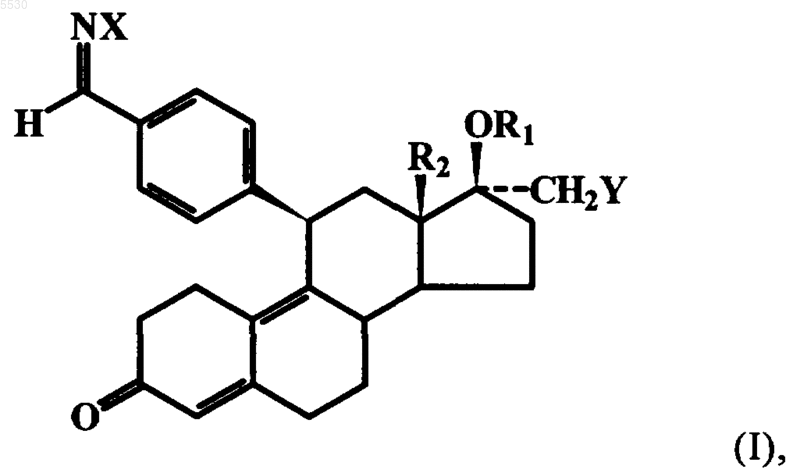
где X обозначает находящуюся в E- или Z-положении OH-группу.
2. Способ по п.1, отличающийся тем, что он включает дополнительную операцию по разделению смеси E/Z-бензальдоксимов общей формулы I на отдельные компоненты путем перекристаллизации или посредством хроматографии.
3. Способ по п.1 или 2, отличающийся тем, что R1 представляет собой C1-C3алкильный остаток, предпочтительно метильную группу или трифторметильную группу.
4. Способ по любому из пп.1-3, отличающийся тем, что R2 представляет собой C1-C3алкильный остаток, предпочтительно метильную группу или трифторметильную группу.
5. Способ по любому из пп.1-4, отличающийся тем, что Y обозначает OC1-C3алкильную или SC1-C3алкильную группу, предпочтительно метокси-, этокси-, изопропилокси-, метилтио- либо этилтиогруппу или трифторметоксигруппу.
6. Способ по любому из пп.3-5, отличающийся тем, что с его помощью получают следующие соединения:
4-[17b-гидрокси-17a-(метоксиметил)-3-оксоэстра-4,9-диен-11b-ил]бензальдегид-1E-оксим,
4-[17b-гидрокси-17a-(метоксиметил)-3-оксоэстра-4,9-диен-11b-ил]бензальдегид-1Z-оксим,
4-[17b-метокси-17a-(метоксиметил)-3-оксоэстра-4,9-диен-11b-ил]бензальдегид-1E-оксим,
4-[17b-метокси-17a-(метоксиметил)-3-оксоэстра-4,9-диен-11b-ил]бензальдегид-1Z-оксим,
4-[17b-этокси-17a-(метоксиметил)-3-оксоэстра-4,9-диен-11b-ил]бензальдегид-1E-оксим,
4-[17b-гидрокси-17a-(этоксиметил)-3-оксоэстра-4,9-диен-11b-ил]бензальдегид-1E-оксим,
4-[17b-метокси-17a-(этоксиметил)-3-оксоэстра-4,9-диен-11b-ил]бензальдегид-1E-оксим,
4-[17b-гидрокси-17a-(изопропилоксиметил)-3-оксоэстра-4,9-диен-11b-ил]бензальдегид-1E-оксим,
4-[17b-метокси-17a-(изопропилоксиметил)-3-оксоэстра-4,9-диен-11b-ил]бензальдегид-1E-оксим,
4-[17b-гидрокси-17a-(этилтиометил)-3-оксоэстра-4,9-диен-11b-ил]бензальдегид-1E-оксим и
4-[17b-гидрокси-17a-(1,1,1-трифторэтоксиметил)-3-оксоэстра-4,9-диен-11b-ил]бензальдегид-1E-оксим.
Текст
R1 обозначает атом водорода, C1-С 6 алкильный остаток или остаток CnF2n+1,R2 обозначает С 1-С 4 алкильный остаток,X обозначает находящуюся в Е- или Z-положении ОН-группу иY обозначает ОС 1-С 6 алкильную группу, SC1-С 6 алкильную группу или группуOCH2CnF2n+1, где n обозначает 1, 2 или 3. 4-(17-замещенные-3-оксоэстра-4,9-диен-11-ил)бензальдегид-(1 Е или 1Z)оксимы являются уже известными соединениями. Соединения такого типа описаны в заявке DE 4332283 А 1 (ЕР 0648778 В 1). Эти соединения благодаря их положительному антигестагенному и незначительному антиглюкокортикоидному действию вызывают широкий интерес, поскольку oни могут применяться для лечения целого ряда гормонзависимых заболеваний у женщин, таких, например, как эндометриоз. В известном на сегодняшний день способе их получения исходят из защищенного у атома С-3 в виде кеталя, предпочтительно диметилкеталя, 5,10-эпоксиэстр-9(11)-ен-17-она формулы IIа что позволяет таким путем селективно получать множество различных 11-арилзамещенных стероидов,а также различных 17-замещенных соединений. На первой стадии указанного способа 5,10-эпоксид формулы IIа по катализируемой солями меди(I) реакции Гриньяра за счет раскрытия цикла с помощью 4 бромбензальдегидкеталя, предпочтительно 4-бромбензальдегиддиметилкеталя, образуют 11 арилзамещенные 5-гидроксистероиды формулы IIIa Выход продуктов, получаемых по этому способу, не оптимален, поскольку при этом атакуется и часть (от 3 до 10%) 17-оксогруппы. В результате образуются 11,17-бисарилзамещенные стероиды формулы IVa отделять которые хроматографией от требуемых 11-моноарилзамещенных соединений формулы IIIа удается лишь со значительными материально-техническими затратами. Смесь соединений формул IIIа и IVa можно по методу Corey and Chaykowsky (Journ. Amer. Chem. который за счет раскрытия цикла с помощью метилата щелочного металла превращают в 17 метоксисоединение формулы VIa в котором R1 представляет собой атом водорода и которое либо непосредственно, либо после взаимодействия 17-гидроксила с алкилгалогенидами в присутствии оснований, таких как трет-бутанолят калия, в инертном растворителе, таком как тетрагидрофуран (ТГФ) или толуол, с получением сначала простых 17-эфиров формулы VIa, где R1 представляет собой C1-С 6 алкильный остаток, переводят затем путем кислотного гидролиза в бензальдегиды формулы VIIa где R1 представляет собой атом водорода или C1-С 6 алкильный остаток. Образующиеся при реакции Гриньяра в качестве побочных продуктов 11,17-бисарилстероиды формулы IVa в описанных условиях постоянно остаются в реакционной смеси и в итоге гидролизуются до 11,17-бисальдегидов формулы где R1 имеет указанные выше значения. Эти бисальдегиды формулы VIIIa по их кристаллизуемости и по их хроматографическим свойствам лишь незначительно отличаются от моноальдегидов формулы VIIa и лишь с трудом поддаются практически полному количественному отделению. Присутствие этих побочных продуктов существенно затрудняет получение соединений формулы I по изобретению. Исходя из вышеизложенного, в основу настоящего изобретения была положена задача разработать более эффективный и более простой в осуществлении способ получения 4-(17-замещенных-3 оксоэстра-4,9-диен-11-ил)бензальдегид-(1 Е или 1Z)оксимов общей формулы I, в котором исключалась бы атака соединения Гриньяра атома С-17 и который благодаря этому позволял бы получать соединения формулы I с более высоким выходом и более высокой чистотой. Указанная задача решается с помощью способа, охарактеризованного в п.1 формулы изобретения. Благодаря осуществляемому до реакции Гриньяра переводу 17-оксогруппы в требуемое 17 замещенное соединение удается предотвратить образование побочного продукта формулы VIIIa, что обеспечивает возможность получения целевых соединений с более высокими выходом и чистотой. Так,например, исходя из соединения формулы II, по способу согласно DE 4332283 А 1 альдегид формулыVIIb можно получать с выходом порядка 5,6%, а оксим формулы Iс - соответственно с выходом порядка 3,8%, тогда как с помощью предлагаемого в настоящем изобретении способа альдегид VIIb удается получать с выходом порядка 25%, соответственно оксим Iс - с выходом порядка 17% из олефина формулыIX без необходимости использовать при этом особые условия для хроматографической очистки.-2 005530 Предпочтительные варианты осуществления изобретения представлены в зависимых пунктах формулы изобретения. Другие преимущества настоящего изобретения представлены ниже в последующей части описания и в примерах. Согласно изобретению 3,3-диметокси-5,10-эпоксиэстр-9(11)-ен-17-оны формулы II в которой R2 обозначает С 1-С 4 алкильный остаток, с помощью активного метиленового реагента, полученного, например, из триметилсульфонийиодида и сильного основания, такого как трет-бутанолят калия или гидроксид калия, в растворителях, таких как диметилсульфоксид (ДМСО), диметилформамид где R2 имеет указанное выше значение, из которого после регио- и стереоселективного расщепления 17 спироэпоксигруппы с помощью алкоголята щелочного либо щелочно-земельного металла, предпочтительно метанолята натрия, за счет раскрытия цикла с использованием алкилмеркаптанов в присутствии гидроксидов щелочных металлов или трет-бутанолята калия, а в другом варианте - непосредственно взаимодействием с меркаптидами щелочных металлов или с перфторалкиловыми спиртами в присутствии щелочи, предпочтительно трет-бутанолята калия, в растворителях, таких как метанол, ДМФ или ДМСО, образуют 17-замещенные соединения формулы X в которой Y обозначает OC1-С 6 алкильную группу, SC1-С 6 алкильную группу или группу OCH2CnF2n+1, гдеn обозначает 1, 2 или 3, R1 представляет собой атом водорода, a R2 имеет указанное выше значение, которые (соединения формулы X) выборочно взаимодействием 17-гидроксильной группы с галогеналкильными соединениями или галогеналкилфторидами (галоген обозначает Сl, Вr либо I) в присутствии сильных оснований, таких как гидроксид калия, алкоголятов, таких как трет-бутанолят калия, фторидов серебра, щелочных металлов и нафталина или бифенила в инертных растворителях, таких как простые эфиры, ТГФ или толуол, превращают в простые 17-эфиры либо простые 17-фторалкиловые эфиры формулы X, в которой R1 представляет собой C1-С 6 алкильный остаток или группу CnF2n+1, где n обозначает 1, 2 или 3, а R2 и Y имеют указанные выше значения. Соединения формулы X взаимодействием с 4 бромбензальдегидкеталями, такими как 4-бромбензальдегид-1,1-этиленкеталь или 4-бромбензальдегид 1,1-диметилкеталь, магнием и Cu(I)Cl при температурах в интервале от -35 С до комнатной температуры превращают в соответствующие 3,3-диметокси-5-гидрокси-11-бензальдегидкетали формулы XI где R3 представляет собой метильную или этилиденовую группу, a R1, R2 и Y имеют указанные выше значения, которые путем кислотного гидролиза защитных групп, например с помощью разбавленной уксусной кислоты либо п-толуолсульфоновой кислоты в ацетоне, переводят в производные 11 бензальдегида формулы XII где R1, R2 и Y имеют указанные выше значения, и альдегидную функцию селективно с использованием гидроксиламмониевых солей, предпочтительно хлорида гидроксиламмония, в присутствии оснований,предпочтительно пиридина или триэтиламина, при комнатной температуре превращают в смесь E/Zбензальдоксимов общей формулы I где X обозначает находящуюся в Е- или Z-положении ОН-группу, a R1, R2 и Y имеют указанные выше значения, которые перекристаллизовывают или хроматографическими методами разделяют, очищают и выделяют в виде отдельных компонентов. Под алкильным остатком согласно настоящему изобретению подразумевается алкильный остаток с разветвленной либо прямой цепью. В качестве примера С 1-С 4-, соответственно C1-С 6 алкильных остатков можно назвать метил, этил, н-пропил, изопропил, н-бутил, изобутил либо трет-бутил, н-пентил, изопентил, н-гексил, 2-метилпентил, 3-метилпентил, 2,2-диметилбутил или 2,3-диметилбутил. Под остаткомCnF2n+1 подразумевается содержащий 1-3 атома углерода фторалкильный остаток с разветвленной либо прямой цепью, в качестве примера которого можно назвать трифторметил, пентафторэтил, гептафтор-нпропил или гептафторизопропил. Предпочтительно R1 и R2 обозначают C1-С 3 алкильный остаток, особенно предпочтительно метил или трифторметил.Y обозначает предпочтительно ОС 1-С 3 алкильную или SC1-С 3 алкильную группу, особенно предпочтительно метокси-, этокси-, изопропилокси-, метилтио либо этилтиогруппу или трифторэтоксигруппу. Соединения формулы I, в которых R1 представляет собой остаток CnF2n+1 и/или Y обозначает группуOCH2CnF2n+1, являются новыми. К наиболее предпочтительным соединениям формулы I относятся следующие соединения из группы, включающей 4-[17-гидрокси-17-(метоксиметил)-3-оксоэстра-4,9-диен-11-ил]бензальдегид-1 Е-оксим,4-[17-гидрокси-17-(метоксиметил)-3-оксоэстра-4,9-диен-11-ил]бензальдегид-1Z-оксим,4-[17-метокси-17-(метоксиметил)-3-оксоэстра-4,9-диен-11-ил]бензальдегид-1 Е-оксим,4-[17-метокси-17-(метоксиметил)-3-оксоэстра-4,9-диен-11-ил]бензальдегид-1Z-оксим,4-[17-этокси-17-(метоксиметил)-3-оксоэстра-4,9-диен-11-ил]бензальдегид-1 Е-оксим,4-[17-гидрокси-17-(этоксиметил)-3-оксоэстра-4,9-диен-11-ил]бензальдегид-1 Е-оксим,4-[17-метокси-17-(этоксиметил)-3-оксоэстра-4,9-диен-11-ил]бензальдегид-1 Е-оксим,4-[17-гидрокси-17-(изопропилоксиметил)-3-оксоэстра-4,9-диен-11-ил]бензальдегид-1 Е-оксим,4-[17-метокси-17-(изопропилоксиметил)-3-оксоэстра-4,9-диен-11-ил]бензальдегид-1 Е-оксим,4-[17-гидрокси-17-(этилтиометил)-3-оксоэстра-4,9-диен-11-ил]бензальдегид-1 Е-оксим и 4-[17-гидрокси-17-(1,1,1-трифторэтоксиметил)-3-оксоэстра-4,9-диен-11-ил]бензальдегид-1 Еоксим. Соединения эффективно связываются с гестагенным рецептором, проявляют в экспериментах на животных ярко выраженную антигестагенную активность, обладают частичной гестагенной активностью и лишь в незначительной степени способны связываться с глюкокортикоидным рецептором (см. DE 4332283 А 1 (ЕР 0648778 В 1. Ниже изобретение более подробно поясняется на примерах. Пример 1. 4-[17-Гидрокси-17-(метоксиметил)-3-оксоэстра-4,9-диен-11-ил]бензальдегид-1 Еоксим (Iа). Стадия а. 25 г 3,3-диметокси-5,10-эпоксиэстр-9(11)-ен-17-она (IIа) растворяют в 200 мл ДМСО и смешивают с 34 г иодида триметилсульфония. Затем добавляют 24 г твердого трет-бутанолята калия и в течение 3 ч перемешивают при комнатной температуре, после чего сливают в охлажденный льдом водный раствор хлорида аммония, экстрагируют этиловым эфиром уксусной кислоты, промывают до нейтральной реакции, органическую фазу сушат над сульфатом натрия и концентрируют под вакуумом. В результате получают 27 г 3,3-диметокси-5,10-эпоксиэстр-9(11)-ен-17(S)-спироэпоксида (IХа) в виде клейкого пенистого вещества, которое непосредственно используют на следующей стадии. Стадия б. 27 г 3,3-Диметокси-5,10-эпоксиэстр-9(11)-ен-17(S)-спироэпоксида (IХа) растворяют в 100 мл метанола, затем в атмосфере аргона добавляют 100 мл 3 н. раствора метилата натрия и смесь в течение 2 ч нагревают с обратным холодильником. После этого смесь охлаждают, половину метанола отгоняют, а остаток растворяют в этиловом эфире уксусной кислоты, этот раствор смешивают с водой и фазы разделяют. Органическую фазу промывают до нейтральной реакции, сушат над сульфатом натрия и концентрируют под вакуумом. В результате получают 29,5 г 3,3-диметокси-17-(метоксиметил)-5,10 эпоксиэстр-9(11)-ен-17-ола (Ха) в виде клейкого пенистого вещества, которое непосредственно используют на следующей стадии. Стадия в. 10 г 3,3-диметокси-17-(метоксиметил)-5,10-эпоксиэстр-9(11)-ен-17-ола (Ха) в 50 мл абсолютного ТГФ при -35 С добавляют по каплям к раствору Гриньяра, полученному из 2,7 г магния, 25 г 4-бромбензальдегидэтиленкеталя в 130 мл ТГФ и 0,65 г хлорида меди(I). В течение 2 ч дают нагреться до комнатной температуры, разлагают водным раствором хлорида аммония и раствор экстрагируют третбутилметиловым эфиром. Органическую фазу промывают до нейтральной реакции, сушат и упаривают под вакуумом. В результате получают 16 г сырого продукта, из которого после хроматографии на силикагеле выделяют 4-(3,3-диметокси-5,17-дигидрокси-17-метоксиметилэстр-9-ен-11-ил)бензальдегид 1,1 -этиленкеталь (ХIа).Tпл 111-116 С; D = -5 (СНСl3); 1 Н ЯМР: 7,36 (d, 2H, J=8,l, H3'), 7,24 (d, 2 Н, J=8,1, Н 2'), 5,76 (s,1H,PhCH), 4,67 (s, 1 Н, ОН), 4,27 (d, 1H, J= 8,1, H-11), 4,02-4,14 (m, 4H, этиленкеталь), 3,38 (s, 3H, OCH3),3,22 (s, 3H, OCH3), 3,21 (s, 3H, OCH3), 3,17 (d, 1H, J=9,0, CH2O), 2,55 (s, 1H, OH), 0,46 (s, 3H, H-18). Стадия г. 45 г 4-(3,3-диметокси-17-метоксиметил-5-гидроксиэстр-9-ен-11-ил)бензальдегид-1,1 этиленкеталя (ХIа) растворяют в 100 мл трет-бутилметилового эфира, смешивают с 1,2 г nтолуолсульфоновой кислоты и в течение 1 ч перемешивают при комнатной температуре. После добавления 15 мл раствора бикарбоната экстрагируют метиленхлоридом, органическую фазу промывают до нейтральной реакции, сушат и концентрируют под вакуумом. После добавления трет-бутилметилового эфира в осадок выпадает 4-[17-гидрокси-17-(метоксиметил)-3-оксоэстра-4,9-диен-11-ил]бензальдегид(VIIa) в виде сырого продукта, который очищают посредством хроматографии на силикагеле и перекристаллизовывают из этилового эфира уксусной кислоты.(VIIa) растворяют в атмосфере аргона в 250 мл пиридина и смешивают с 5,8 г гидроксиламингидрохлорида. По истечении 2 ч смесь вмешивают в ледяную воду, осадок отделяют вакуум-фильтрацией, промывают и сушат. Сырой продукт (40 г) очищают посредством хроматографии на силикагеле. Таким путем получают 20 г 4-[17-гидрокси-17-(метоксиметил)-3-оксоэстра-4,9-диен-11-ил]бензальдегид-1 Еоксима (Iа).+192; 1 Н-ЯМР: 8,56 (s, 1 Н, NOH), 7,86 (d, 2 Н, J = 8,4, Н-31), 7,33 (s, 1H, HC=N), 7,26 (d, 2 Н, J = 8,4, Н-2'),5,79 (s, 1 Н, Н-4), 4,41 (d, 1 Н, J = 7,2, Н-11), 3,57 (d, 1H, J = 9,1, СН 2 О), 3,42 (s, 3H, ОСН 3), 3,23 (d, 1H, J = 9,1, СН 2 О), 0,54 (s, 3 Н, Н-18)]. Пример 2. 4-[17-Метокси-17-(метоксиметил)-3-оксоэстра-4,9-диен-11-ил]бензальдегид-1 Еоксим (Iс). Стадия а. 29,5 г полученного в примере 1, стадия б, 3,3-диметокси-17-(метоксиметил)-5,10 эпоксиэстр-9(11)-ен-17-ола (Ха) растворяют в атмосфере аргона в 650 мл толуола, смешивают со 110 г трет-бутанолята калия и перемешивают при комнатной температуре. Затем в течение 2 ч по каплям добавляют 70 мл метилиодида в 30 мл толуола. После этого разбавляют водой, фазы разделяют, органическую фазу промывают до нейтральной реакции, сушат и упаривают под вакуумом. В результате получа-5 005530tпл 114-118C (гексан); D = +7 (CHCl3); 1 Н-ЯМР: 6,00 (m, 1H, H-11), 3,57 (d, 1H, J = 10,3, CH2O),3,36 (s, 3H, OCH3), 3,30 (d, 1H, J = 10,3, CH2O), 3,28 (s, 3 Н, ОСН 3), 3,19 (s, 3 Н, ОСН 3), 3,13 (s, 3 Н, ОСН 3),0,88 (s, 1H, H-18). Стадия б. К раствору Гриньяра, полученному из 24 г 4-бромбензальдегидэтиленкеталя и 2,0 г магния в 140 мл ТГФ, добавляют при -35 С 500 мг хлорида меди(I). После 20-минутного перемешивания при этой температуре по каплям добавляют раствор из 10 г 3,3,17-триметокси-5,10-эпоксиэстр-9(11)ен-17-метоксиметилового эфира (Хb) в 40 мл ТГФ. Затем реакционному раствору дают нагреться до комнатной температуры, смесь разлагают водным раствором хлорида аммония, раствор экстрагируют этиловым эфиром уксусной кислоты и органическую фазу промывают водой, сушат над сульфатом натрия и раствор концентрируют под вакуумом. Сырой 4-(3,3-диметокси-5-гидрокси-17-метокси-17 метоксиметилэстр-9-ен-11-ил)бензальдегид-1,1-этиленкеталь (XIb) (15 г) непосредственно используют на следующей стадии. Стадия в. 15 г сырого 4-(3,3-диметокси-5-гидрокси-17-метокси-17-метоксиметилэстр-9-ен-11 ил)бензальдегид-1,1-этиленкеталя (XIb) растворяют в 120 мл ацетона и смешивают с 1,3 г птолуолсульфоновой кислоты. По истечении 1 ч нейтрализуют и разбавляют водой. При этом выпадает в осадок 4-[17-метокси-17-(метоксиметил)-3-оксоэстра-4,9-диен-11-ил]бензальдегид (VIIb), который отделяют вакуум-фильтрацией и перекристаллизовывают в ацетоне.tпл 245-250 С (ацетон); D = +193 (CHCl3); 1 Н-ЯМР: 9,97 (s, 1H, СНО), 7,79 (d, 2 Н, J = 8,1, Н-3'),7,37 (d, 2H, J = 8,1, Н-2'), 5,79 (s, 1H, Н-4), 4,44 (d, 1H, J = 7,5, Н-11), 3,56 (d, 1H, J = 10,8, СН 2 О), 3,42 (d,1H, J = 10,8, -СН 2 О), 3,41 (s, 3 Н, ОСН 3), 3,25 (s, 3 Н, ОСН 3), 0,51 (s, 3 Н, Н-18). Стадия г. К раствору из 10 г 4-[17-метокси-17-(метоксиметил)-3-оксоэстра-4,9-диен-11 ил]бензальдегида (VIIb) в 100 мл пиридина добавляют при комнатной температуре 1,75 г гидроксиламингидрохлорида и смесь перемешивают в течение 2 ч. Затем ее сливают в ледяную воду, осадок отделяют вакуум-фильтрацией, сушат с помощью хлорида кальция и сырой продукт хроматографируют на силикагеле. Таким путем выделяют 7 г 4-[17-метокси-17-(метоксиметил)-3-оксоэстра-4,9-диен-11 ил]бензальдегид-1 Е-оксима (Iс).(Ie). Стадия а. 4,16 г полученного в примере 1, стадия б, 3,3-диметокси-17-(метоксиметил)-5,10 эпоксиэстр-9(11)-ен-17-ола (Ха) в течение 14 ч при 35 С подвергают порциями взаимодействию с используемыми в общей сложности 15,6 г трет-бутанолята калия и 76 мл иодэтана в 405 мл толуола. Для последующей переработки смесь охлаждают до комнатной температуры и добавляют воду, при этом соли растворяются. Затем фазы разделяют и водную фазу экстрагируют толуолом. В завершение раствор промывают, сушат и упаривают. В результате получают 4,2 г 3,3-диметокси-5,10-эпокси-17 этоксиэстр-9(11)-ен-17-метоксиметилового эфира (Хс) в виде сырого продукта, который непосредственно используют на следующей стадии. Стадия б. К раствору Гриньяра, полученному из 5 г 4-бромбензальдегидэтиленкеталя и 0,45 г магния в 60 мл ТГФ, добавляют при -35 С 0,1 г хлорида меди(I). После 30-минутного перемешивания при этой температуре по каплям добавляют раствор из 2,5 г 3,3-диметокси-5,10-эпокси-17-этоксиэстр 9(11)-ен-17-метоксиметилового эфира (Хс) в 15 мл ТГФ. Затем реакционному раствору дают нагреться до комнатной температуры, смесь разлагают водным раствором хлорида аммония и после обычной переработки выделяют 4-[3,3-диметокси-5-гидрокси-17-этокси-17-(метоксиметил)эстр-9-ен-11-ил]бензальдегид-1,1-этиленкеталь (ХIс) (4,5 г), который непосредственно используют на следующей стадии. Стадия в. 4,5 г 4-[3,3-диметокси-5-гидрокси-17-этокси-17-(метоксиметил)эстр-9-ен-11-ил] бензальдегид-1,1-этиленкеталя (ХIс) растворяют в 60 мл ацетона. Затем добавляют 1,6 г nтолуолсульфоновой кислоты и по истечении 1 ч сливают в ледяную воду. Выпадающий при этом в осадок 4-[17-этокси-17-(метоксиметил)-3-оксоэстра-4,9-диен-11-ил]бензальдегид (VIIc) отделяют вакуум-фильтрацией, сушат и перекристаллизовывают из ацетона/гексана и повторно из третбутилметилового эфира.= 8,1, Н-2'), 5,79 (s, 1H, Н-4), 4,43 (d, 1H, J = 7,5, Н-11), 3,58 (d, 1H, J = 10,8, СН 2 О), 3,41 (m, 2H, СН 2 О),3,40 (s, 3 Н, ОСН 3), 1,10 (t, 3 Н, этил), 0,51 (s, 3 Н, Н-18). Стадия г. 1,7 г 4-[17-этокси-17-(метоксиметил)-3-оксоэстра-4,9-диен-11-ил]бензальдегида (VIIc) в течение 1 ч перемешивают в 25 мл пиридина при комнатной температуре с 250 мг гидроксиламингидрохлорида. После этого смесь сливают в 100 мл ледяной воды, осадок отделяют вакуум-фильтрацией,промывают водой до нейтральной реакции и сушат с помощью хлорида кальция. Сырой продукт (1,7 г) очищают посредством хроматографии на силикагеле. Таким путем получают 890 мг 4-[17-этокси-17(метоксиметил)-3-оксоэстра-4,9-диен-11-ил]бензальдегид-1 Е-оксима (Iе).(If). Указанное в заголовке соединение (If) получают аналогично примеру 1, стадии 1 б, 1 в, 1 г и 1 д, с тем, однако, отличием, что на стадии 1 б вместо метилата натрия используют этилат натрия. Соединение(If) выделяют в виде бесцветного пенистого вещества.(Ig). Указанное в заголовке соединение (Ig) получают аналогично примеру 1, стадия б, при этом, однако,вместо метилата натрия используют этилат натрия, и аналогично примеру 2, стадии 2 а, 2 б, 2 в и 2 г.tпл 90-95 С (трет-бутилметиловый эфир); D = +177 (CHCl3); 1 Н-ЯМР: 8,10 (s, 1 Н, HC=N), 7,60 (s,1 Н, NOH), 7,47 (d, 2H, J = 8,1, H'), 7,24 (d, 2H, J = 8,1, H-2'), 5,79 (s, 1H, H-4), 4,37 (d, 1H, J = 7,3, H-11),3,63 (d, 1H, J = 10,8, CH2O), 3,55 (m, 2H, C2H5), 3,44 (d, 1H, J = 10,8, CH2O), 3,26, 3,22 (2s, je 3H, OCH3),1,27 (t, 3H, C2H5), 0,54 (s, 3H, H-18). Пример 6. 4-[17-гидрокси-17-(изопропилоксиметил)-3-оксоэстра-4,9-диен-11-ил]бензальдегид 1 Е-оксим (Ih). Указанное в заголовке соединение (Ih) получают аналогично примеру 1, стадии 1 б, 1 в, 1 г и 1 д, при этом, однако, на стадии 1 б вместо метилата натрия используют изопропилат натрия.(s, 1H, NOH), 7,48 (d, 2H, J = 8,1 , H-3'), 7,19 (d, 2H, J = 8,1 , H-2'), 5,79 (s, 1H, H-4), 4,38 (d, 1H, J = 6,6, H11), 3,6 (m, CH2), 3,59 (d, 1H, J = 9,3, CH2O), 3,23 (d, 1H, J = 9,3, CH2O), 3,02 (s, 1H, OH), 1,21 (m, 6H,2xCH3), 0,52 (s, 3H, H-18). Пример 7. 4-[17-Метокси-17-(изопропилоксиметил)-3-оксоэстра-4,9-диен-11-ил]бензальдегид 1 Е-оксим (Ii). Указанное в заголовке соединение (Ii) получают аналогично примеру 1, стадия б, при этом, однако,вместо метилата натрия используют этилат натрия, и аналогично примеру 2, стадии 2 а, 2 б, 2 в и 2 г.(d, 1H, J = 10,5, CH2O), 3,59 (m, 2H, OCH(CH3)2), 3,43 (d, 1H, J = 10,2, CH2O), 3,26 (s, 3H, OCH3), 1,22 (t,3H, C2H5), 0,54 (s, 3H, H-18). Пример 8. 4-[17-гидрокси-17-(этилтиометил)-3-оксоэстра-4,9-диен-11-ил]бензальдегид-1 Еоксим (Ij). Указанное в заголовке соединение (Ij) получают аналогично примеру 1, стадии 1 б, 1 в, 1 г и 1 д, при этом, однако, на стадии 1 б вместо метилата натрия используют тиоэтилат натрия.tпл 132-137 С; D = +165 (СНСl3); 1 Н- ЯМР: 8,10 (s, 1H, HC=N), 7,93 (s, 1H, NOH), 7,49 (d, 2H, J = 8,4 , H-3'), 7,19 (d, 2H, J = 8,4, H-2'), 5,79 (s, 1H, H-4), 4,42 (d, 1H, J = 7,2, H-11), 2,95 (d, 1H, J = 13,2,CH2S), 2,90 (s, 3H, OH), 2,71 (d, 1H, J = 12,9, CH2S), 2,6 (m, 2H, SCH2-), 1,29 (t, 3H, SCH2CH3), 0,56 (s, 3H,H-18). Пример 9. 4-[17-Гидрокси-17-(1,1,1-трифторэтоксиметил)-3-оксоэстра-4,9-диен-11-ил]бензальдегид-1 Е-оксим (Ik). Указанное в заголовке соединение (Ik) получают аналогично примеру 1, стадии 1 б, 1 в, 1 г и 1 д с тем,однако, с отличием, что на стадии 1 вместо метилата натрия используют 1,1,1-трифторэтанол и третбутанолят калия.R1 обозначает атом водорода, C1-С 6 алкильный остаток или остаток CnF2n+1,R2 обозначает С 1-С 4 алкильный остаток,X обозначает находящуюся в Е- или Z-положении ОН-группу иY обозначает OC1-С 6 алкильную группу, SC1-С 6 алкильную группу или группу OCH2CnF2n+1, где n обозначает 1, 2 или 3,отличающийся тем, что 3,3-диметокси-5,10-эпоксиэстр-9(11)-ен-17-он формулы II в которой R2 имеет указанное выше значение, с помощью активного метиленового реагента в инертном растворителе превращают в 5,10-эпокси-17(S)-спироэпоксид формулы IX где R2 имеет указанное выше значение, из которого после регио- и стереоселективного расщепления 17 спироэпоксигруппы с помощью алкоголята щелочного либо щелочно-земельного металла за счет раскрытия цикла с использованием алкилмеркаптанов в присутствии гидроксидов щелочных металлов или трет-бутанолята калия, путем непосредственного расщепления меркаптидами щелочных металлов или перфторалкиловыми спиртами в присутствии щелочи в инертном растворителе образуют 17 замещенное соединение формулы X где R1 представляет собой атом водорода, Y обозначает ОС 1-С 6 алкильную группу, SC1-С 6 алкильную группу или группу OCH2CnF2n+1, при этом n обозначает 1, 2 или 3, и R2 имеет указанное выше значение,соединение формулы Х при определенных условиях взаимодействием 17-гидроксильной группы с алкилгалогенидами или галогеналкилфторидами в присутствии сильных оснований в инертном растворителе превращают в простой 17-эфир либо в простой 17-фторалкиловый эфир формулы X, где R1 представляет собой C1-С 6 алкильный остаток или остаток CnF2n+1, при этом n обозначает 1, 2 или 3, а R2 и Y имеют указанные выше значения, эфир формулы X взаимодействием с 4-бромбензальдегидкеталем, магнием и Cu(I)Cl при температурах в интервале от -35 С до комнатной температуры превращают в соответствующий 3,3-диметокси-5-гидрокси-17-СН 2Y-11-бензальдегидкеталь формулы XI где R1 представляет собой атом водорода, C1-С 6 алкильный остаток или остаток CnF2n+1, при этом n обозначает 1, 2 или 3, R2 и Y имеют указанные выше значения, a R3 представляет собой метильную или этилиденовую группу, который путем кислотного гидролиза защитных групп переводят в производное 11 бензальдегида формулы XII где R1, R2 и Y имеют указанные выше значения, и альдегидную функцию селективно с использованием гидроксиламмониевых солей превращают в смесь E/Z-бензальдоксимов общей формулы I где X обозначает находящуюся в Е- или Z-положении ОН-группу. 2. Способ по п.1, отличающийся тем, что он включает дополнительную операцию по разделению смеси E/Z-бензальдоксимов общей формулы I на отдельные компоненты путем перекристаллизации или посредством хроматографии. 3. Способ по п.1 или 2, отличающийся тем, что R1 представляет собой C1-С 3 алкильный остаток,предпочтительно метильную группу или трифторметильную группу. 4. Способ по любому из пп.1-3, отличающийся тем, что R2 представляет собой С 1-С 3 алкильный остаток, предпочтительно метильную группу или трифторметильную группу. 5. Способ по любому из пп.1-4, отличающийся тем, что Y обозначает OC1-С 3 алкильную или SC1 С 3 алкильную группу, предпочтительно метокси-, этокси-, изопропилокси-, метилтио- либо этилтиогруппу или трифторметоксигруппу. 6. Способ по любому из пп.3-5, отличающийся тем, что с его помощью получают следующие соединения: 4-[17-гидрокси-17-(метоксиметил)-3-оксоэстра-4,9-диен-11-ил]бензальдегид-1 Е-оксим,4-[17-гидрокси-17-(метоксиметил)-3-оксоэстра-4,9-диен-11-ил]бензальдегид-1Z-оксим,4-[17-метокси-17-(метоксиметил)-3-оксоэстра-4,9-диен-11-ил]бензальдегид-1 Е-оксим,4-[17-метокси-17-(метоксиметил)-3-оксоэстра-4,9-диен-11-ил]бензальдегид-1Z-оксим,4-[17-этокси-17-(метоксиметил)-3-оксоэстра-4,9-диен-11-ил]бензальдегид-1 Е-оксим,4-[17-гидрокси-17-(этоксиметил)-3-оксоэстра-4,9-диен-11-ил]бензальдегид-1 Е-оксим,4-[17-метокси-17-(этоксиметил)-3-оксоэстра-4,9-диен-11-ил]бензальдегид-1 Е-оксим,4-[17-гидрокси-17-(изопропилоксиметил)-3-оксоэстра-4,9-диен-11-ил]бензальдегид-1 Е-оксим,4-[17-метокси-17-(изопропилоксиметил)-3-оксоэстра-4,9-диен-11-ил]бензальдегид-1 Е-оксим,4-[17-гидрокси-17-(этилтиометил)-3-оксоэстра-4,9-диен-11-ил]бензальдегид-1 Е-оксим и 4-[17-гидрокси-17-(1,1,1-трифторэтоксиметил)-3-оксоэстра-4,9-диен-11-ил]бензальдегид-1 Еоксим. Евразийская патентная организация, ЕАПВ Россия, 109012, Москва, Малый Черкасский пер., 2/6
МПК / Метки
МПК: C07J 41/00
Метки: способ, 1z)оксимов, 4-(17α-замещенных-3-оксоэстра-4,9-диен-11β-ил)бензальдегид-(1е, получения
Код ссылки
<a href="https://eas.patents.su/10-5530-sposob-polucheniya-4-17alpha-zameshhennyh-3-oksoestra-49-dien-11beta-ilbenzaldegid-1e-ili-1zoksimov.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения 4-(17α-замещенных-3-оксоэстра-4,9-диен-11β-ил)бензальдегид-(1е или 1z)оксимов.</a>
Предыдущий патент: Цитрат 5,8,14-триазатетрацикло-(10.3.1.02,11.04,9)-гексадека-2 (11),3,5,7,9-пентаена
Следующий патент: Неприлипающая сбивная кондитерская композиция мягкой консистенции
Случайный патент: Способ определения функционального состояния биологической ткани и применение этого способа для определения ее жизнеспособности и/или степени некротизации