Применение ингибиторов интерлейкина-18 для приготовления лекарственного средства для подавления метастазов опухолей
Формула / Реферат
1. Применение ингибиторов продуцирования и/или действия ИЛ-18 для приготовления лекарственного средства для подавления метастазов опухолей.
2. Применение по п.1, согласно которому ингибитором продуцирования ИЛ-18 является ингибитор каспазы-1.
3. Применение по п.1, согласно которому ингибитор действия ИЛ-18 выбран из антител к ИЛ-18, антител к любой из субъединиц рецептора ИЛ-18, ингибиторов сигнальных путей рецепторов ИЛ-18, антагонистов ИЛ-18, которые конкурируют с ИЛ-18 и блокируют рецепторы ИЛ-18, связывающих ИЛ-18 белков или их аналогов или фрагментов, обладающих той же самой активностью.
4. Применение по п.3, согласно которому ингибитором действия ИЛ-18 являются антитела к ИЛ-18.
5. Применение по п.3, согласно которому ингибитором действия ИЛ-18 является связывающий ИЛ-18 белок или его аналог или фрагмент, обладающие той же самой активностью.
6. Применение фармацевтической композиции, содержащей антитела к ИЛ-18, антитела к любой из субъединиц рецептора ИЛ-18, ингибиторы сигнальных путей рецепторов ИЛ-18, антагонисты ИЛ-18, которые конкурируют с ИЛ-18 и блокируют рецепторы ИЛ-18, связывающие ИЛ-18 белки, или их аналоги или фрагменты, обладающие той же самой активностью, для подавления продуцирования и/или действия ИЛ-18 с целью подавления метастазов опухолей.
7. Применение по п.6, согласно которому композиция содержит антитела к ИЛ-18.
8. Применение по п.6, согласно которому композиция содержит связывающий ИЛ-18 белок или его аналог или фрагмент, обладающие той же самой активностью.
9. Применение вектора экспрессии, кодирующего ингибитор продуцирования и/или действия ИЛ-18, для приготовления лекарственного средства для подавления метастазов опухолей.
Текст
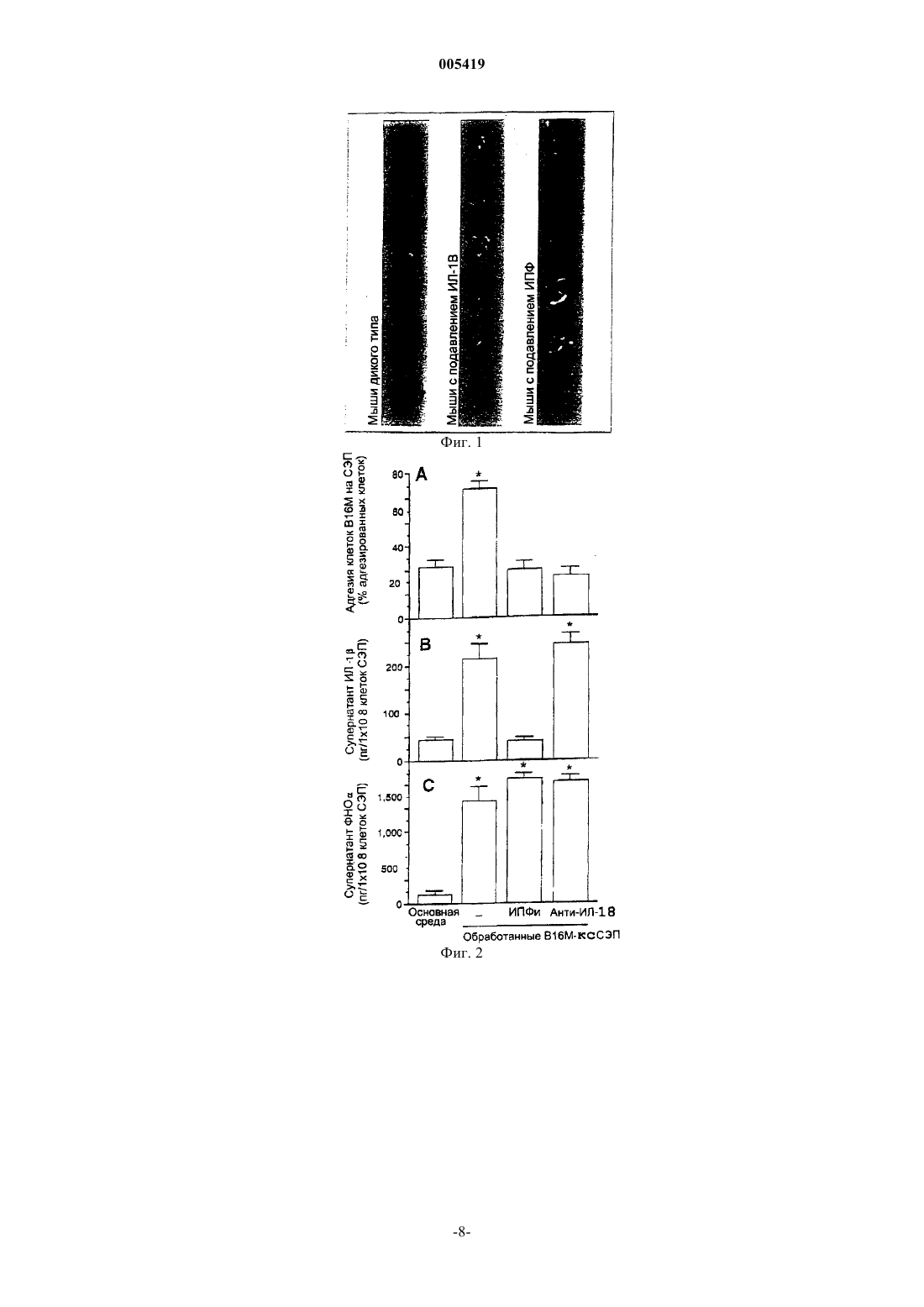
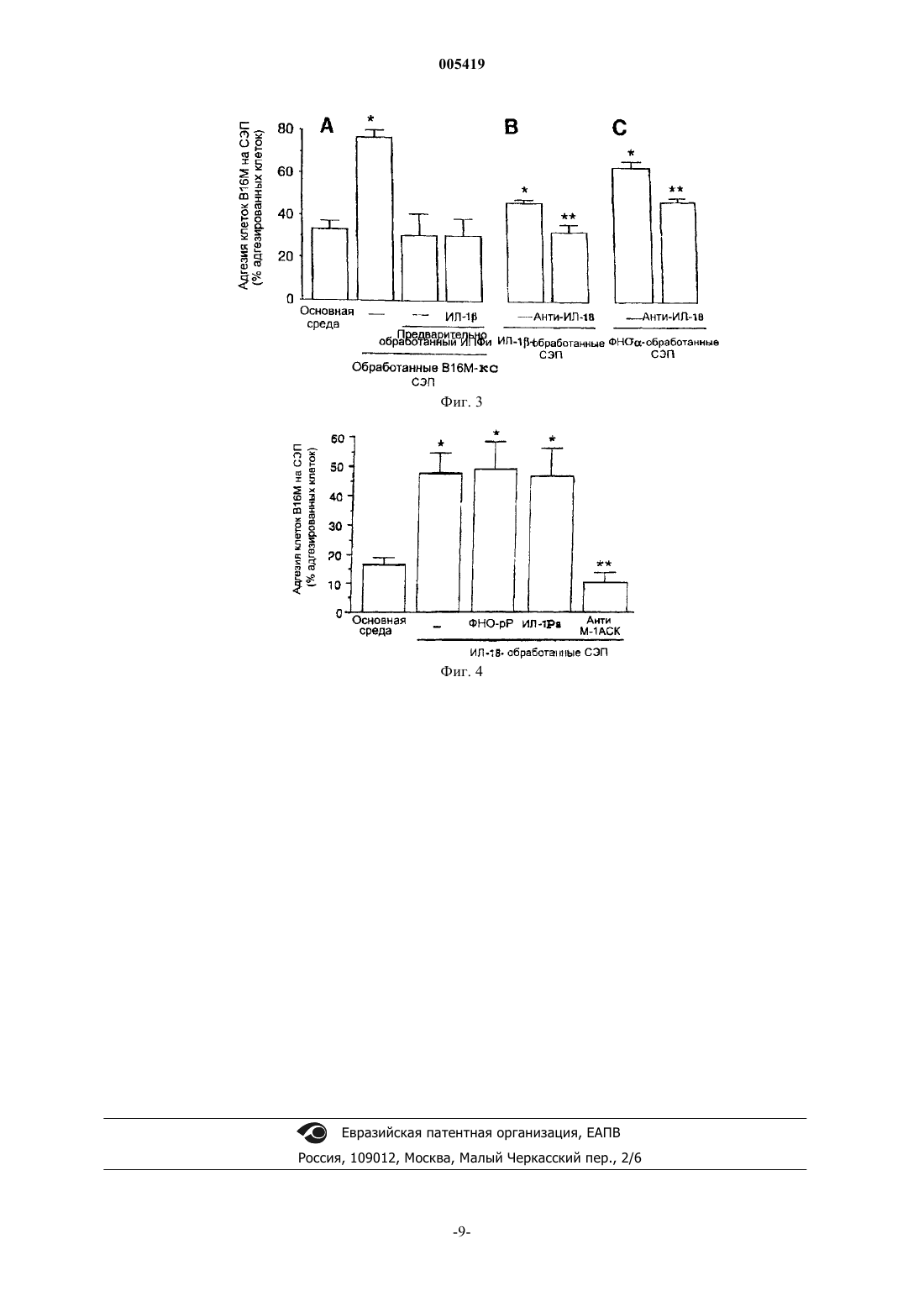
005419 Область изобретения Данное изобретение относится к средствам подавления метастазов опухолей. Более конкретно, данное изобретение относится к профилактике метастазов опухоли путем подавления продуцирования и/или действия интерлейкина-18 (IL-18, или ИЛ-18). Предпосылки создания изобретения Адгезия циркулирующих раковых клеток на эндотелии капилляров является решающей стадией возникновения метастазов (1,2). Молекула-1 адгезии на клетках сосудов (VCAM-1, или М-1 АСК), представитель суперсемейства иммуноглобулинов, опосредует адгезию гематопоэтических клеток и активированных лейкоцитов на активируемых цитокином провоспалительных эндотелиальных клетках (3-5). Однако адгезивная функция М-1 АСК может быть присвоена животным и человеческим раковым клеткам для усиления экспериментального распространения метастазов (6). Например, ИЛ-1 и ФНО-, как известно, усиливают метастазы клеток меланомы, экспрессирующих VLA-4, в ткани легких с помощью механизма, который включает активацию экспрессии М-1 АСК эндотелиальными клетками (7-9). Было также показано, что ИЛ-1 и ФНО- значительно способствуют колонизации печени клетками В 16 М как у нормальных мышей, так и у мышей, получавших липополисахариды (7, 8, 10-20). Кроме того, активация клеток синусоидального эндотелия печени (HSE, или СЭП),опосредуемая маннозными рецепторами, включает аутокринную опосредуемую ИЛ-1 экспрессию М 1 АСК клетками СЭП, приводящую к повышенной адгезии клеток В 16 М и метастазам (21). Было также показано, что активированные ИЛ-1 клетки СЭП выделяют VLA-4-стимулирующие факторы, которые усиливают адгезию В 16 М на клетках СЭП (11). Таким образом, ИЛ-1 индуцирует экспрессию М-1 АСК и выделение стимулирующего VLA-4 фактора клетками СЭП, что придает им способность создавать прометастазное микроокружение для некоторых интрасинусоидально задержавшихся экспрессирующихVLA-4 раковых клеток. Однако блокирование ИЛ-1 и ФНО- приводит только к частичному устранению метастазов, показывая, что в этом также участвуют и другие факторы, или компенсирующие их отсутствие, или действующие альтернативными метаболическими путями. Кроме того, большинство метастазирующих раковых клеток и тканей-мишеней не способны продуцировать эти провоспалительные цитокины. Более того,концентрация лигандов эндотоксиновых или маннозных рецепторов обычно повышается недостаточно для того, чтобы вызвать выделение провоспалительного цитокина. В результате многочисленные медиаторы, которые вызывают активацию М-1 АСК, и их участие во время прохода раковых клеток по капиллярам все ещ не полностью выяснены. ИЛ-18 (индуцирующий IFN (или -ИФН) фактор) является новым цитокином, который имеет общие структурные признаки с семейством белков ИЛ-1 (22) и общие функциональные свойства с ИЛ-12(23). Сообщалось, что продуцирование ИЛ-18 куппферовскими клетками активирует опосредуемые как ФНО- так и FAS лигандами гепатотоксические метаболические пути при поражении печени, вызываемом эндотоксинами (24). Совсем недавно было обнаружено, что ИЛ-18 также обладает провоспалительными свойствами посредством прямой стимуляции экспрессии гена и синтеза ФНО- из CD3+/CD4+ и естественных клеток-киллеров с последующим продуцированием ИЛ-1 и ИЛ-8 из популяции CD14+,тем самым выявляя неожиданное центральное положение ИЛ-18 в иерархии цитокинов (25). Однако его возможная роль в метастазировании рака еще не была выяснена. Связывающий интерлейкин-18 белок (IL-18BP, или ИЛ-18 СБ) был выделен из мочи и очищен хроматографией на бусинах с ИЛ-18, секвенирован, клонирован и экспрессирован в клетках COS7. ИЛ-18 СБ устранял индукцию интерферона- (ИФН-) ИЛ-18, ИЛ-8 и активацию NF-кВ in vitro. Введение ИЛ-18 СБ мышам прекращало циркуляцию ИФН- после ЛПС. Таким образом, ИЛ-18 СБ функционирует как ингибитор раннего Тh1 цитокинового ответа. ИЛ-18 СБ, в основном, экспрессируется в селезенке, принадлежит к суперсемейству иммуноглобулинов и обладает ограниченной гомологией к рецептору ИЛ-1 типаII. Его ген локализован на человеческой хромосоме 11ql3, но не обнаружено экзона, кодирующего трансмембранный домен, в 8,3 кb геномной последовательности. Некоторые поксвирусы кодируют предполагаемые высокогомологичные ИЛ-18 СБ белки, что наводит на мысль о том, что вирусные продукты могут ослаблять ИЛ-18 и мешать цитотоксическому Т-клеточному ответу (28 и WO 99/09063) . Как более подробно описано в WO 99/09063, ИЛ-18 СБ и мутеины, слитые белки, функциональные производные, активные фракции или циклически пермутированные производные и их смеси способны к связыванию с ИЛ-18 и/или способны к модулированию активности ИЛ-18, и/или способны к блокированию активности ИЛ-18. Краткое изложение изобретения Данное изобретение представляет применение ингибиторов продуцирования и/или действия ИЛ-18 для приготовления лекарственного средства для подавления метастазов опухолей. Ингибиторами продуцирования ИЛ-18 являются, например, ингибиторы каспазы-1. Ингибитор действия ИЛ-18 выбран из антител к ИЛ-18, антител к любой из субъединиц рецептора ИЛ-18, ингибиторов сигнальных путей рецепторов ИЛ-18, антагонистов ИЛ-18, которые конкурируют с-1 005419 ИЛ-18 и блокируют рецепторы ИЛ-18, связывающих ИЛ-18 белков или их аналогов или фрагментов,обладающих той же самой активностью. Предпочтительно, используемым ингибитором действия ИЛ-18 является связывающий ИЛ-18 белок или его аналог или фрагмент, обладающие той же самой активностью. Данным изобретением представлено также применение фармацевтической композиции, содержащей ингибитор продуцирования и/или действия ИЛ-18, с целью подавления метастазов опухолей. Другим путем подавления продуцирования ИЛ-18 и/или действия на подавление метастазов опухоли является введение в организм вектора экспрессии, содержащего последовательность, кодирующую ингибитор продуцирования и/или действия ИЛ-18, такого как ИЛ-18 СБ. Краткое описание рисунков Фиг. 1. Экспериментальная колонизация печени после внутриселезеночной инъекции клеток В 16 М мышам дикого типа, ИЛ-1-/- и ИПФ-/- (IСЕ-/-). Печень удаляли на 10 день после инъекции клеток В 16 М и фиксировали в фосфатно-буферном физиологическом растворе с 10% формальдегида. Почти все экспериментальные метастазы (черные меланотиновые узелки) устранялись из печени ИЛ-1-/- и ИПФ-/- мышей. Фиг. 2. Действие необратимого ингибитора ИПФ и антимышиных антител к ИЛ-18 на адгезию клеток В 16 М на клетках СЭП, и продуцирование ИЛ-1 и ФНО- необработанными и обработанными В 16 М-КС (В 16 М-СМ) клетками СЭП. Культивированные клетки СЭП инкубировали в присутствии В 16 М-КС в течение 10 ч. При некоторых экспериментах, как необработанные, так обработанные клетки СЭП подвергали действию 10 мкМ ИПФи или 10 мкг/мл антимышиных антител к ИЛ-18 перед В 16 МКС. Процент клеток В 16 М, адгезированных на СЭП субстрате, рассчитывали как относительное значение по отношению к первоначальному числу добавленных клеток. Кроме того, супернатанты культуры отбирали перед адгезией для определения концентрации ИЛ-1 и ФНО- с помощью ТИФА (ELISA). Данные представляют собой среднее значениеСО по четырем отдельным экспериментам, каждый в шести повторностях (n = 24). Увеличение адгезии клеток В 16 М на СЭП, обработанных В 16 М-КС, и продуцирования ИЛ-1 или ФНО- по отношению к необработанным СЭП (Р 0,01) было статистически значимым по двустороннему непарному t-критерию Стьюдента. Происходили статистически незначимые изменения продуцирования ИЛ-1 или ФНО- и в адгезии клеток В 16 М на клетках СЭП, когда их обрабатывали ИПФи или анти-ИЛ-18 антителами в отсутствие В 16 М-СМ (данные не показаны). Фиг. 3. Действие ИПФи на адгезию клеток В 16 М на обработанных В 16 М-КС клетках СЭП in vitro. Клетки СЭП инкубировали с основной средой или В 16 М-КС в течение 8 ч. Некоторые клетки СЭП подвергались действию 10 мкМ ИПФи в течение 18 ч перед В 16 М-СМ. Кроме того, к некоторым клеткам СЭП добавляли также ИЛ-1 вместе с В 16 М-КС на 8 ч. В других экспериментах клетки СЭП подвергали воздействию 1 нг/мл мышиного ИЛ-1 или 100 пг/мл ФНО- в течение 6 ч, и добавляли или нет 10 мкг/мл кроличьих поликлональных антител против мышиного ИЛ-18 за 1 ч перед обработкой цитокином. К необработанным и обработанным цитокином клеткам СЭП добавляли также неспецифическиеIgG поликлональные антитела. Затем клетки СЭП промывали и добавляли меченные BCEFCF-AM клетки В 16 М и затем снова промывали через 8 мин. Процент клеток В 16 М, адгезированных на субстрате СЭП, рассчитывали как относительное значение по отношению к первоначальному числу добавленных клеток. Результаты представляют среднее арифметическоеСО по трем отдельным экспериментам, каждый в шести повторностях (n = 18). Различия в степени адгезии по отношению к необработанным СЭП и обработанным ИЛ-1 или ФНО- СЭПбыли статистически значимыми (Р 0,01) по двустороннему непарному t-критерию Стьюдента. Статистически незначимыми были изменения адгезии клеток В 16 М на других обработанных ИПФи контрольных СЭП, на которые дополнительно воздействовали или не воздействовали 1 нг/мл мышиного ИЛ-1 в течение 8 ч (данные не показаны). Фиг. 4. Адгезия клеток В 16 М на обработанных ИЛ-18 СЭП in vitro. Клетки СЭП инкубировали с 1 нг/мл рекомбинантного мышиного ИЛ-18 в течение 6 ч. При некоторых экспериментах за 10 мин до ИЛ 18 добавляли 10 мкг/мл ФНО-рР р 55 (TNF-sRp55) или 100 нг/мл ИЛ-1 Ра. При других экспериментах за 30 мин перед добавлением клеток В 16 М к клеткам СЭП добавляли 10 мкг/мл анти-М-1 АСК антител или в такой же концентрации неспецифический антимышиный IgG. Затем определяли процент адгезии клеток В 16 М, как описано в примерах здесь, ниже. Результаты представлены средним арифметическимСО по трем отдельным экспериментам, каждый в шести повторностях (n = 18). Различия в степени адгезии по отношению к СЭП, обработанным основной средойи СЭП, обработанным ИЛ-18 были статистически значимыми (Р 0,01), по двустороннему непарному t-критерию Стьюдента. Детальное описание изобретения Некоторые провоспалительные цитокины, включая интерлейкин (ИЛ)-1 и фактор некроза опухоли-альфа (ФНО-), стимулируют адгезию раковых клеток на клетках эндотелия, приводя тем самым к метастатическому распространению опухолей. Эти провоспалительные цитокины способствуют адгезии и метастазированию, возможно, путем стимуляции молекул-1 адгезии сосудистых клеток (М-1 АСК). Данное изобретение демонстрирует, что обработка первичных культивированных мышиных клеток СЭП кондиционированной средой (КС) от культур клеток (В 16 М-КС, или В 16 М-СМ) меланомы В 16 (В 16 М)-2 005419 способствует адгезии между клетками В 16 М и СЭП in vitro. B16M-KC вызывает также продукцию ИЛ 13 и ФНО- клетками СЭП in vitro. B16M-KC индуцирует также продукцию ИЛ-1 и ФНО- клетками СЭП in vitro. Однако было четко продемонстрировано, что метастазирование опухоли несомненно опосредуется ИЛ-1 и ФНО-. Данное изобретение показывает, что В 16 М-КС индуцирует продуцирование ИЛ-18 клетками СЭП,и что ИЛ-18 является цитокином, способствующим повышенной адгезии клеток В 16 М на клетках СЭП. ИЛ-18 усиливает адгезию путем активации экспрессии М-1 АСК на клетках СЭП без участия ФНО- или ИЛ 1. Инкубация клеток СЭП со специфическим ингибитором каспазы-I (10 мкМ, 18 ч) полностью устраняет вызванную В 16 М-КС адгезивность без снижения продуцирования ФНО-, и эффект является необратимым при добавления мышиного ИЛ-1. Добавление антимышиных ИЛ-18 антител к клеткам СЭП предотвращает индуцированную В 16 М-КС адгезивность без вмешательства в индукцию В 16 М-КС выработки ИЛ-1 и ФНО-. Подобным же образом недавно клонированный связывающий ИЛ-18 белок (ИЛ 18 СБ) также предотвращает вызванную В 16 М-КС адгезивность В 16 М на клетках СЭП in vitro. Ингибиторы ФНО- и ИЛ-1, такие как растворимые рецепторы ФНО р 55 или антагонист рецепторов ИЛ-1,были неспособны устранять эту индуцированную ИЛ-18 адгезию. Таким образом, данное изобретение представляет ингибиторы продуцирования и действия ИЛ-18 в качестве средств для подавления метастазов опухоли. Ингибиторы продуцирования ИЛ-18 включают ингибиторы каспазы-1. Ингибиторы действия ИЛ-18 выбираются из группы, состоящей из антител, направленных против ИЛ-18, антител, направленных против одной из двух известных субъединиц рецептора ИЛ-18, ингибиторов сигнальных метаболических путей рецепторов ИЛ-18, антагонистов ИЛ-18, которые конкурируют с ИЛ-18 и блокируют рецепторы ИЛ-18 и связывающих ИЛ-18 белков, которые связывают ИЛ-18 и блокируют его биологическую активность. Данное изобретение относится к возможной роли ИЛ-18 в провоспалительной, опосредуемой цитокином активации экспрессии М-1 АСК, его возможному взаимодействию с другими цитокинами и средствам для предотвращения этой индукции М-1 АСК. В соответствии с данным изобретением было обнаружено, что ИЛ-18 действует при инициации провоспалительных явлений, приводящих к активации М 1 АСК в синусоидальной стенке в печени и, следовательно, содействию адгезии раковых клеток и метастазированию. В качестве модели зависимой от раковых клеток активации эндотелиальных клеток использовали первично культивированные мышиные клетки СЭП, обработанные В 16 М-КС для исследования роли индуцированного клетками В 16 М ИЛ-18 в механизме адгезии клеток В 16 М на клетках СЭП путем зависимого от М-1 АСК механизма. Специфическую роль ИЛ-18 изучали в условиях специфической блокады рецепторов ИЛ-1 с использованием подавления секреции ИЛ-1 Ра, зрелого ИЛ-1 и ИЛ-18,применяя необратимый ингибитор фермента превращающего ИЛ-1 (ИПФи, или ICEi), блокаду ФНО,применяя растворимые рецепторы ФНО р 55 (ФНО-рР р 55, или TNF-sR p55) и блокаду функции ИЛ-18,применяя анти-ИЛ-18 антитела и связывающий ИЛ-18 белок. Кроме того, клетки В 16 М вводили путем инъекции в селезенку ИПФ-/- и ИЛ-1-/- мышам. Низкая плотность метастазов, наблюдаемая у дефицитных мышей по сравнению с нормальными контролями, говорит об участии ИЛ-1 и, возможно, ИЛ-18 в прометастазной роли воспаления (табл. 1). Проведенные эксперименты in vitro демонстрируют, что продуцированная ИЛ-18 ответственна за эффекты, индуцированные супернатантами, полученными от клеток В 16 М. Так как активация М-1 АСК ответственна за всю стимулирующую адгезию активность СЭП, обработанных В 16 М-КС, данные показывают что ИЛ-18 опосредует экспрессию М-1 АСК индуцированными цитокином СЭП. Кроме того, антитела к ИЛ-18 снижали индуцированную В 16 М-КС адгезию клеток без влияния на продуцирование ФНО- и ИЛ-1 клетками СЭП. Следовательно, продуцированная ИЛ-1 и ФНО- клетками СЭП была независимой от ИЛ-18 и не способствовала адгезии. И наоборот, ни ФНО-рР р 55, ни ИЛ-1 Ра не были способны подавлять повышение адгезии у клеток СЭП, обработанных ИЛ-18, подтверждая, что ни аутокринный ФНО-, ни ИЛ-1 не ответственны за индуцированную ИЛ-18 адгезивность СЭП. Результаты для клеток СЭП контрастируют с результатами, полученными для других клеточных систем, таких как, например, не -CD14+ мононуклеарные клетки крови человека (25), где ИЛ-18 индуцировал ИЛ-1 через продуцирование ФНО-. Вероятно, существует специфическая для СЭП иерархия провоспалительных цитокинов, в которой ФНО- и ИЛ-1 являются независимыми от регуляции ИЛ-18,но ИЛ-18 используется в качестве прямого медиатора активации М-1 АСК. В отличие от мышиных клеток СЭП, клетки В 16 М не экспрессируют ген ИЛ-18, что проверено с помощью метода ПЦР с ревертированием (RT-PCR), и инкубация с ИПФн в течение 18 ч не устраняла стимулирующее продукцию цитокинов и адгезию действием В 16 М-КС на клетки СЭП. Однако локальное продуцирование ИЛ-18 может влиять на поведение клеток В 16 М во время их прохождения или остановки в микрососудах печени. Дополнительной находкой было то, что инкубация клеток В 16 М с 1 нг/мл мышиного ИЛ-18 в течение 6 ч двукратно повышала их адгезию на необработанных СЭП, а добавление к СЭП анти-М-1 АСК антител снижало опосредуемую ИЛ-18 адгезию на 80%, наводя на мысль о том, что здесь участвует взаимодействие M-1ACK/VLA-4. Подобным же образом, у клеток В 16 М, получивших воздействие супернатанта от СЭП, обработанных В 16 М-КС, в течение 6 ч также значительно (Р 0,01),-3 005419 двукратно, повышалась адгезия на СЭП путем зависимого от М-1 АСК механизма, а анти-ИЛ-18 антитела устраняли это стимулирующее адгезию действие. Данные, полученные по данному изобретению, говорят о том, что ИЛ-18 является новой связью между выделением в печени провоспалительных цитокинов и развитием метастазов. Их выработка активированными опухолью клетками СЭП определяется двумя комплементарными механизмами, участвующими в регуляции адгезии клеток меланомы на клетках СЭП: аутокринным механизмом в СЭП, который регулирует активацию М-1 АСК, опосредованную ФНО-/ИЛ-1, и паракринным механизмом в клетках В 16 М, который активирует VLA-4 меланомной клетки, потенцируя е зависимую от М-1 АСК способность к адгезии. Эта одновременная молекулярная активация обоих дубликатов клеточной адгезии делает высоко значимыми метаболические пути взаимодействия раковых и эндотелиальных клеток капилляров. Вызванная ИЛ-18 адгезия клеток В 16 М устраняется ингибиторами продуцирования и/или действия ИЛ-18. Ингибиторы продуцирования ИЛ-18 включают ингибиторы каспазы-1. Ингибиторы действия ИЛ 18 выбираются из группы, состоящей из антител, направленных против ИЛ-18, антител, направленных против любого одной из двух известных субъединиц рецептора ИЛ-18, ингибиторов сигнальных путей рецепторов ИЛ-18, антагонистов ИЛ-18, которые конкурируют с ИЛ-18 и блокируют рецепторы ИЛ-18, и белков, связывающих ИЛ-18, которые связывают ИЛ-18 и блокируют его биологическую активность. В дополнение к прямому использованию ингибиторов продуцирования и/или действия ИЛ-18 в данном изобретении рассматривается также интродукция в клетки, где желателен эффект подавления продуцирования и/или действия ИЛ-18. Для этой цели необходима система для специфической интродукции, например, ДНК, кодирующей ИЛ-18 СБ в клетки. Например, в клетки может быть введен подходящий вектор, несущий вышеуказанную ДНК, причем данный вектор способен влиять на встраивание ДНК в клетки таким образом, что ДНК экспрессируется в данных клетках. Способы доставки в клетки описаны, среди прочих, например, в патенте США 5910487, WO 99/29349 и других. Фармацевтические композиции по данному изобретению для подавления продуцирования и/или действия ИЛ-18 являются теми, которые включают в качестве активного ингредиента ингибитор, выбранный из ингибитора каспазы-1, антител к ИЛ-18, антител к любой из субъединиц рецептора ИЛ-18,ингибитора сигнальных путей рецепторов ИЛ-18, антагониста ИЛ-18, который конкурирует с ИЛ-18 и блокирует рецепторы ИЛ-18, ИЛ-18 СБ или их аналоги или фрагменты, обладающие той же самой активностью. Антитела к ИЛ-18 и ИЛ-18 СБ являются предпочтительными активными ингредиентами фармацевтических композиций. Фармацевтические композиции могут также включать обычные носители, наполнители и другие ингредиенты, известные в данной области, зависящие от их способа применения, т.е. инъекцией, пероральным или любым другим путем, известным специалистам. Конкретная дозировка будет зависеть от способа применения, веса тела пациента и других факторов и будет, в любом случае, определяться врачом. Теперь после описания изобретения его будет более легко понять посредством обращения к следующим примерам, которые представлены для иллюстрации и не предназначены для ограничения данного изобретения. Примеры Реагенты: Крысиные против мышиного IgG и крысиные против мышиного М-1 АСК моноклональные антитела были получены от Serotec Ltd. (Oxford, England). Рекомбинантный мышиный ИЛ-1 был получен отRD System Inc. (Minneapolis, MN). Антагонист рецепторов рекомбинантного человеческого ИЛ-1 (ИЛ 1 Ра, или IL-1Ra) был любезно предоставлен Upjohn Co., Kalamazoo, MI и растворимые рецепторы для человеческого ФНО р 55 (ФНОрР р 55, или TNFsR p55) были любезно представлены от Serono Inc., Norwell, MA. Ингибитор фермента, превращающего ИЛ-1 (ИПФи, или ICEi) был получен от Alexis Co. (SanDiego, CA). Рекомбинантный мышиный ИЛ-18 и кроличьи против мышиного ИЛ-18 поликлональные антитела IgG были закуплены у PeptoTech EC Ltd. (London, UK) . Белок, связывающий ИЛ-18 (ИЛ-18 СБ),был получен, как описано (28). Культура клеток В 16 М. Клетки В 16 М культивировали, сохраняли и пассировали, как описано ранее(11). Кондиционированную к В 16 М среду (В 16 М-КС) готовили следующим образом: 5 х 105 клеток помещали в 25 см 2 Т-образную колбу и культивировали в течение 24 ч. После чего клетки культивировали в течение дополнительного периода, равного 24 ч в 5 мл бессывороточной среды (конечная плотность клеток равна 6 х 104 клеток/см 2). Супернатанты собирали, разбавляли 3:1 свежей бессывороточной средой и пропускали через фильтр 0,22 мкм. Анализ цитокинов. Выделение цитокинов из первичных культивированных клеток СЭП и клеток В 16 М оценивали, используя специфические наборы для ТФИФА (твердофазный иммуно-ферментный анализ) (ELISA) на основе антимышиных IL-1 и ФНО- моноклональных антител, как предложено производителем (RD Systems, Minneapolis, MN).-4 005419 Пример 1. Количественная адгезия клеток В 16 М на первичных культурах СЭП. СЭП выделяли от сингенных мышей, идентифицировали и культивировали, как описано ранее (26). Клетки В 16 М метили раствором 2',7'-бис(2-карбоксиэтил)-5,6-карбоксифлуоресцеинацетоксиметилового сложного эфира (БКЭКФ-АМ (BCECF-АМ), Molecular Probes, Eugene, OR), как сообщалось (16). Затем добавляли 2 х 105 клеток на ячейку культивированных СЭП в 24-ячеечную планшету и через 8 мин ячейки промывали три раза свежей средой. Число адгезированных клеток определяли, применяя количественный метод на основе описанной ранее системы для флуоресцентного определения (16) . При некоторых экспериментах клетки СЭП предварительно инкубировали с В 16 М-КС в течение нескольких часов перед добавлением клеток В 16 М. Пример 2. Определение метастазов в печени. Мышей-самцов C57BL/6J дикого типа IL-1/- и ИПФ/-получали, как описано ранее (27). Использовали шести-восьминедельных мышей, размещенных по пять штук на клетку. Метастазы в печени получали путем инъекции в селезенку мышам под анестезией (нембутал, 50 мг/кг, внутрибрюшинно) 3 х 105 живых клеток меланомы В 16, суспендированных в 0,1 мл сбалансированного солевого раствора Хэнкса. Мышей забивали под анестезией на 10-й день после инъекции раковых клеток. Ткани печени обрабатывали для гистологии. Денситометрический анализ переведенных в цифровую форму микроскопических изображений использовали для дифференциации метастазов В 16 М от нормальной ткани печени и плотность метастазов в печени, которая является числом метастазов на 100 мм 3 печени (по среднему числу центров формирования, обнаруженных в пятнадцати срезах 10x10 мм 2 на печень), рассчитывали, применяя ранее описанные стереологические процедуры (17). Пример 3. Сниженное метастазирование и рост В 16 М клеток, инъецированных мышам с дефицитомIL-1 и ИПФ. Было выполнено два независимых эксперимента с интервалом в один год с использованием двух разных серий одних и тех же клеток В 16 М, которые вводили с помощью инъекции в селезенку взрослых мышей C57B1/6J дикого типа, ИПФ/ и ИЛ-1/. Исследование после вскрытия показало видимые меланотические опухоли в селезенках от всех исследованных мышей без значительных различий в размере,что оценивалось по весу селезенки (табл. 1). В противоположность этому заметное снижение метастазов происходило у IL-1/ и, особенно, ИПФ-/-выживших мышей по сравнению с выжившими мышами дикого типа (фиг. 1). Производили количественный гистологический анализ по числу и размеру очагов метастазов для определения плотности метастазов (как число очагов/100 мм 3) и параметров объема (процент поражения органа) в исследованной печени мышей. По сравнению с мышами дикого типа (табл. 1),плотность метастазов в печени значительно снижалась (Р 0,01) в печени мышей ИПФ/ и ИЛ-1/, на от 84 до 90%, показывая, что большая часть инъецированных клеток В 16 М были неспособны имплантироваться в ткань печени этих мышей. К тому же объем метастазов также значительно снижался (Р 0,01) в печени мышей ИЛ-1/ и ИПФ/, 6-7-кратно по сравнению со значениями для печени мышей дикого типа, показывая, что клетки В 16 М успешно колонизирующие печень, имели также сниженную скорость роста. Мы также наблюдали различие в параметрах для этих метастазов между печенью мышей IL-l/ и ИПФ/, приводящее к подавлению метастазов в печени почти всех мышей ИПФ-/- из эксперимента I(фиг. 1). Таблица 1. Количественный гистологический анализ по экспериментальной колонизации печени у мышей IL-1-/- и ИПФ-/-после инъекции в селезенку клеток В 16 М. Данные представляют средние значенияСО по двум независимым экспериментам (использовали 7-15 мышей на экспериментальную группу).Показаны различия, которые были статистически значимыми (двусторонние, р 0,01), в отношении дикого типа мышей при применении дисперсионного анализа (ANOVA) и F-критерия Шеффе. Пример 4. Аутокринный ИЛ-18 опосредует индуцированную ФНО- и ИЛ-1 адгезивность у активированных В 16 М-КС СЭП. В 16 М-КС значительно (Р 0,01) повышал продукцию ФНО- и ИЛ-1 клетками СЭП и их адгезивность в отношении других клеток В 16 М in vitro (фиг. 2). Инкубация СЭП с 10 мкМ ИПФи в течение 18 ч полностью устраняла индуцированную В 16 М-КС адгезивность без снижения продуцирования ФНО- у СЭП. Экзогенно добавленный мышиный ИЛ-1 не компенсировал блокирующий эффект ИПФи на СЭП,что контрастирует со значительным повышением адгезии клеток В 16 М у обработанных ИЛ-1 контрольных СЭП (фиг. 3). Тот факт, что индуцированное В 16 М-КС повышение адгезии устранялось в присутствии повышенных концентраций эндогенно продуцируемого ФНО- и экзогенно добавляемого ИЛ 1, показывает что ни один из этих цитокинов прямо не активирует адгезивность СЭП. Важно, что наличие антител против мышиного ИЛ-18, добавленных к СЭП перед стимуляцией В 16 М-КС, предотвращало индуцируемую В 16 М-КС адгезивность без влияния на продуцирование индуцированных ИЛ-1 и ФНО клетками СЭП (фиг. 2). Кроме того, антитела против ИЛ-18 также предотвращали стимулирующее адгезию действие мышиных ИЛ-1 и ФНО- на СЭП (фиг. 3), указывая на то, что проадгезивное действие этих цитокинов на СЭП, в обоих случаях, опосредуется ИЛ-18. RT-PCR подтверждала, что клетки СЭП экспрессировали ген ИЛ-18 (данные не показаны). И наоборот, мышиный ИЛ-18 значительно (Р 0,01) повышал адгезию клеток В 16 М на СЭП (фиг. 4), и ни ФНО-рР р 55, ни ИЛ-1 Ра не были способны подавить его, подтверждая, что ни аутокринный ФНО, ни ИЛ-1 не отвечают за индуцированную ИЛ-18 адгезивность СЭП. Однако, как показано на фиг. 4, антитела к М-1 АСК полностью подавляли адгезию клеток В 16 М к обработанным ИЛ-18 клеткам СЭП. Контрольный неспецифический IgG не влиял на усиление адгезии В 16 М клеток на обработанных ИЛ-18 СЭП. Пример 5. ИЛ-18 СБ предотвращает адгезию клеток меланомы В 16, индуцированную кондиционированной В 16 средой. Как показано в табл. 2, добавление ИЛ-18 СБ к СЭП, стимулированными В 16 М-КС, снижало процент адгезированных клеток с 35% до 8,70% (р 0,01). Это представляет 100% подавление, так как уровень адгезии был ниже уровня адгезированных клеток при использовании основной среды. Этот результат наводит на мысль о том, что эндогенный ИЛ-18 из СЭП может быть эндогенным источником ИЛ-18 в дополнение к тому, который присутствует в В 16 М-КС. Таблица 2. Подавляющее действие ИЛ-1 СБ на индуцированную кондиционированной В 16 средой адгезию клеток меланомы В 16 на синусоидальных эндотелиальных клетках печени (СЭП) Данные представляют средние значенияСО по 2 независимым экспериментам, сделанным в шести повторностях (N=12)Показаны различия, которые были статистически значимыми (двустороннее, р 0,01) в отношении В 16 М-КС при применении дисперсионного анализа (ANOVA) и F-критерия Шеффе. Библиография 1. Kohn, E. С, and Liotta, L. A. (1995) Cancer Res 55(9), 1856-62. 2. Nicolson, G. L., and Winkelhake, J. L. (1975) Nature 255, 230-232. 3. Freedman, A., Munro, M., Rice, G. E., Bevilacqua, M. P., Morimoto, C, McIntyre, B. W., Rhynhart, K.,Pober, J. S., and Nadler, L. M. (1990) Science 249, 1030-1033. 4. Miyake, M., Fuchimoto, S., Iwagaki, H., Matsubara, N., Edamatsu, R., Hiramatsu, M., and Orita, K.(1999) Immunity 10, 127-136. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Применение ингибиторов продуцирования и/или действия ИЛ-18 для приготовления лекарственного средства для подавления метастазов опухолей. 2. Применение по п.1, согласно которому ингибитором продуцирования ИЛ-18 является ингибитор каспазы-1. 3. Применение по п.1, согласно которому ингибитор действия ИЛ-18 выбран из антител к ИЛ-18,антител к любой из субъединиц рецептора ИЛ-18, ингибиторов сигнальных путей рецепторов ИЛ-18,антагонистов ИЛ-18, которые конкурируют с ИЛ-18 и блокируют рецепторы ИЛ-18, связывающих ИЛ-18 белков или их аналогов или фрагментов, обладающих той же самой активностью. 4. Применение по п.3, согласно которому ингибитором действия ИЛ-18 являются антитела к ИЛ-18. 5. Применение по п.3, согласно которому ингибитором действия ИЛ-18 является связывающий ИЛ 18 белок или его аналог или фрагмент, обладающие той же самой активностью. 6. Применение фармацевтической композиции, содержащей антитела к ИЛ-18, антитела к любой из субъединиц рецептора ИЛ-18, ингибиторы сигнальных путей рецепторов ИЛ-18, антагонисты ИЛ-18,которые конкурируют с ИЛ-18 и блокируют рецепторы ИЛ-18, связывающие ИЛ-18 белки, или их аналоги или фрагменты, обладающие той же самой активностью, для подавления продуцирования и/или действия ИЛ-18 с целью подавления метастазов опухолей. 7. Применение по п.6, согласно которому композиция содержит антитела к ИЛ-18. 8. Применение по п.6, согласно которому композиция содержит связывающий ИЛ-18 белок или его аналог или фрагмент, обладающие той же самой активностью. 9. Применение вектора экспрессии, кодирующего ингибитор продуцирования и/или действия ИЛ-18, для приготовления лекарственного средства для подавления метастазов опухолей.
МПК / Метки
МПК: A61P 35/00, A61K 38/17
Метки: опухолей, лекарственного, подавления, метастазов, средства, интерлейкина-18, применение, приготовления, ингибиторов
Код ссылки
<a href="https://eas.patents.su/10-5419-primenenie-ingibitorov-interlejjkina-18-dlya-prigotovleniya-lekarstvennogo-sredstva-dlya-podavleniya-metastazov-opuholejj.html" rel="bookmark" title="База патентов Евразийского Союза">Применение ингибиторов интерлейкина-18 для приготовления лекарственного средства для подавления метастазов опухолей</a>
Предыдущий патент: Фосфорорганические композиции
Следующий патент: Катализаторы с большой площадью поверхности кобальта
Случайный патент: Применение аминоизотиазолов в качестве микробицидов