Новые цианоиндольные соединения, являющиеся ингибиторами повторного захвата серотонина, способ их получения и фармацевтические композиции, содержащие их
Номер патента: 3146
Опубликовано: 27.02.2003
Авторы: Риве Жан-Мишель, Миллан Марк, Гобер Ален, Лавиелль Жильбер, Мюллер Оливье, Симетьер Бернар
Формула / Реферат
1. Соединения формулы (I)
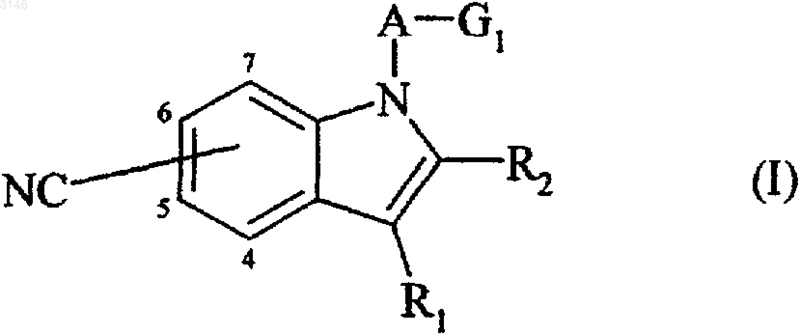
в которой R1 и R2, независимо друг от друга, каждый представляет атом водорода или линейную или разветвленную (C1-C6)-алкильную группу;
A представляет линейную или разветвленную (C1-C6)-алкиленовую группу, линейную или разветвленную (C2-C6)-алкениленовую группу или линейную или разветвленную (C2-C6)-алкиниленовую группу;
G1 представляет группу
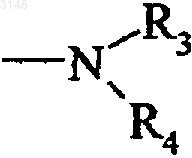
в которой R3 и R4, независимо друг от друга, каждый представляет атом водорода, линейную или разветвленную (C1-C6)-алкильную группу, (C3-C8)-циклоалкильную группу, (C3-C8)-циклоалкил-(C1-C6)-алкильную группу, в которой алкильный фрагмент является линейным или разветвленным, необязательно замещенную арильную группу, необязательно замещенную арил-(C1-C6)-алкильную группу, в которой алкильный фрагмент является линейным или разветвленным, необязательно замещенную гетероарильную группу или необязательно замещенную гетероарил-(C1-C6)-алкильную группу, в которой алкильный фрагмент является линейным или разветвленным;
или G1 представляет гетероциклоалкильную группу, присоединенную к A по любому из положений кольца и необязательно замещенную в любом одном из положений кольца линейной или разветвленной (C1-C6)-алкильной группой, (C3-C8)-циклоалкильной группой, (C3-C8)-циклоалкил-(C1-C6)-алкильной группой, в которой алкильный фрагмент является линейным или разветвленным, нитрильной группой, карбоксигруппой, линейной или разветвленной (C1-C6)-алкоксикарбонильной группой, карбамоильной группой (необязательно замещенной одним или двумя заместителями: линейным или разветвленным (C1-C6)-алкилом, (C3-C8)-циклоалкилом, необязательно замещенным фенилом и/или необязательно замещенным бензилом), необязательно замещенной арильной группой, необязательно замещенной арил-(C1-C6)-алкильной группой, в которой алкильный фрагмент является линейным или разветвленным, необязательно замещенной гетероарильной группой или необязательно замещенной гетероарил (C1-C6)-алкильной группой, в которой алкильный фрагмент является линейным или разветвленным;
их энантиомеров, диастереоизомеров и их аддитивные соли с фармацевтически приемлемыми кислотами или основаниями.
2. Соединения формулы (I) по п.1, в которых цианогруппа присоединена в 6-ом положении индольной группы, их энантиомеры, диастереоизомеры и их аддитивные соли с фармацевтически приемлемыми кислотами или основаниями.
3. Соединения формулы (I) по п.1, в которых цианогруппа присоединена в 5-ом положении индольной группы, их энантиомеры, диастереоизомеры и их аддитивные соли с фармацевтически приемлемыми кислотами или основаниями.
4. Соединения формулы (I) по п.1, в которых A является линейной или разветвленной (C1-C6)-алкиленовой группой, их энантиомеры, диастереоизомеры и их аддитивные соли с фармацевтически приемлемыми кислотами или основаниями.
5. Соединения формулы (I) по п.1, в которых группа G1 представляет группу
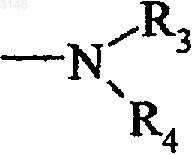
их энантиомеры, диастереоизомеры и их аддитивные соли с фармацевтически приемлемыми кислотами или основаниями.
6. Соединения формулы (I) по п.1, в которых G1 является необязательно замещенной гетероциклоалкильной группой, их энантиомеры, диастереоизомеры и их аддитивные соли с фармацевтически приемлемыми кислотами или основаниями.
7. Соединения формулы (I) по п.1, в которых цианогруппа присоединена в 5-ом или 6-ом положении индольной группы, R1 и R2 - атомы водорода, A - линейная или разветвленная (C1-C6)-алкиленовая группа, а G1 является группой
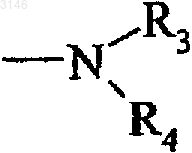
в которой R3 и R4, независимо друг от друга, каждый выбран из атома водорода, линейной или разветвленной (C1-C6)-алкильной группы, арильной группы и арил-(C1-C6)-алкильной группы, в которой алкильный фрагмент является линейным или разветвленным, или G1 является необязательно замещенной гетероциклоалкильной группой, выбранной из пиперазина, пирролидина, пиперидина и 1,4-диазепана, их энантиомеры, диастереоизомеры и их аддитивные соли с фармацевтически приемлемыми кислотами или основаниями.
8. Соединение формулы (I) по п.1, которое является 1-{3-[4-(5-метокси-4-пиримидинил)-1-пиперазинил]пропил}-1H-индол-6-карбонитрилдигидрохлоридом, и его аддитивные соли с фармацевтически приемлемыми кислотами.
9. Соединение формулы (I) по п.1, которое является 1-[3-(диметиламино)пропил]-1H-индол-6-карбонитрилгидрохлоридом, и его аддитивные соли с фармацевтически приемлемыми кислотами.
10. Соединение формулы (I) по п.1, которое является 1-{[1-(2-хлорфенетил)-3-пирролидинил]метил}-1H-индол-6-карбонитрилом, и его аддитивные соли с фармацевтически приемлемыми кислотами.
11. Способ получения соединений формулы (I) по п.1, отличающийся тем, что в качестве исходного материала используют соединение формулы (II)
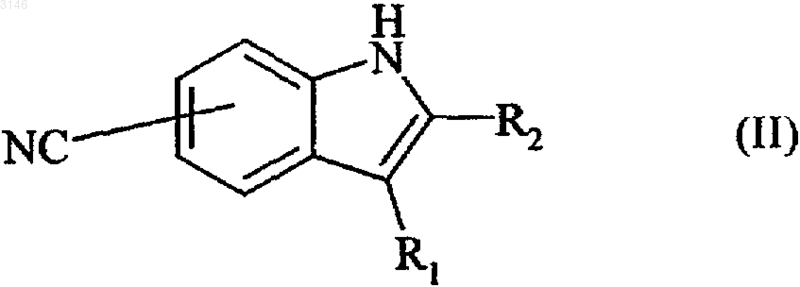
в которой R1 и R2 имеют значения, определенные для формулы (I), которое после обработки в основной среде может быть подвергнуто
действию соединения формулы (III)
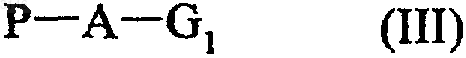
в которой A и G1 имеют значения, определенные для формулы (I), a P является отщепляемой группой,
с получением соединения формулы (I), или
действию соединения формулы (IV)

в которой A имеет значения, определенные для формулы (I), a Hal представляет атом галогена,
с получением соединения формулы (V)
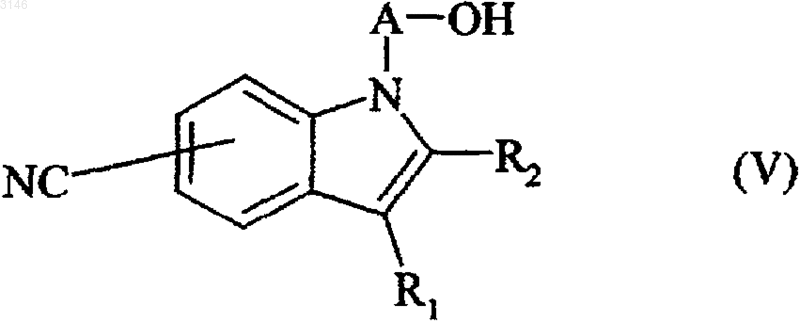
в которой R1, R2 и A имеют значения, определенные выше;
которое после бромирования гидроксильной группы или превращения последней в отщепляемую группу подвергают в основной среде действию соединения формулы (VI)
![]()
в которой G1 имеет значения, определенные для формулы (I), с получением соединения формулы (I); причем должно быть понятно, что группа G1, когда она является аминогруппой или незамещенной гетероциклоалкильной группой, может быть замещена на конечной стадии для введения заместителей, определенных для формулы (I), с использованием стандартных реакций органической химии, соединение формулы (I) может быть очищено, если необходимо, в соответствии со стандартными процедурами очистки, разделено в соответствующем случае на его изомеры в соответствии со стандартными процедурами разделения, превращено, при желании, в его аддитивные соли с фармацевтически приемлемыми кислотами или основаниями.
12. Фармацевтическая композиция, включающая в качестве активного компонента, по крайней мере, одно соединение по любому из пп.1-10 само по себе или в сочетании с одним или несколькими инертными нетоксичными фармацевтически приемлемыми эксципиентами или носителями.
13. Применение, по крайней мере, одного из соединений, охарактеризованных в любом из пп.1-10, в качестве активного компонента лекарственного средства, ингибирующего обратный захват серотонина при лечении депрессий, обсессивно-компульсивных расстройств, фобий, импульсивных расстройств, связанных с лекарственэющ зависимостью, нервной булимией и состояниями тревоги.
Текст
1 Настоящее изобретение касается новых цианоиндольных соединений, являющихся ингибиторами повторного захвата серотонина,способа их получения и фармацевтических композиций, содержащих их. Соединения, характеризующиеся комбинированием индольного кольца и 2,3-дигидро 1,4-бензодиоксинового кольца, описаны как обладающие свойствами ингибирования повторного захвата серотонина (заявка WO 97/17343). Индолы, замещенные в ароматическом кольце, также заявлены в заявке ЕР 814084 в связи с их действием на уровне сайтов повторного захвата серотонина. Другие соединения, обладающие сходными свойствами, заявлены в заявке WO 96/33710 и имеют бензопирановую структуру. Ингибиторы повторного захвата серотонина составляют разнородную группу терапевтических агентов. Они используются при лечении патологий, связанных с дефицитом серотонина на уровне синапсов нейтронов центральной нервной системы. Ингибирование повторного захвата серотонина за счет связывания с переносчиками или пресинаптическими рецепторами является средством восстановления передачи нервного импульса. Применение соединений, обладающих такими свойствами ингибиторов, может обеспечить альтернативу применению трициклических антидепрессантов или ингибиторов моноаминоксидазы при лечении депрессии и связанных с ней расстройств (Ann. Pharmacotherapy, 1994,28, 1359), приступов навязчивого страха и обсессивно-компульсивных расстройств (HumanPsychopharmacol., 1995, 10, 5199). Эффективность соединений, обладающих такими фармакологическими параметрамиPsychopharmacol, 1994, 8, 238), подкрепляется еще и тем фактом, что они легче переносятся(Intern. Clin. Psychopharmacol., 1995, 9, suppl. 4,33) и что они являются более безопасными в применении (Ann. Pharmacol., цит. выше). Соединения настоящего изобретения характеризуются наличием индольного кольца,замещенного в ароматическом фрагменте цианогруппой, и у азота индола - аминоалкильной цепью. Такая новая структура обеспечивает в дополнение к высокому уровню аффинности по отношению к рецепторам 5-НТ 2c сильную активность по ингибированию повторного захвата серотонина. Они, следовательно, являются терапевтически полезными при лечении депрессий,приступов паники, обсессивно-компульсивных расстройств, фобии или навязчивого страха импульсивных расстройств, связанных с лекарственной зависимостью, нервной булимией и чувством тревоги и страха. Настоящее изобретение касается соединений, имеющих формулу (I)R1 и R2, каждый независимо друг от друга,представляет атом водорода или линейную или разветвленную (C1-C6)-алкильную группу; А представляет линейную или разветвленную (C1-C6)-алкиленовую группу, линейную или разветвленную (C2-C6)-алкениленовую группу или линейную или разветвленную (С 2-С 6)алкиниленовую группу;, в которой R3 и R4, каждый независимо друг от друга, представляет атом водорода, линейную или разветвленную (C1-С 6)-алкильную группу, (С 3-С 8)циклоалкильную группу, (С 3-C8)-циклоалкил(C1-C6)-алкильную группу, в которой алкильный фрагмент является линейным или разветвленным, необязательно замещенную арильную группу, необязательно замещенную арил-(C1 С 6)-алкильную группу, в которой алкильный фрагмент является линейным или разветвленным, необязательно замещенную гетероарильную группу или необязательно замещенную гетероарил-(C1-C6)-алкильную группу, в которой алкильный фрагмент является линейным или разветвленным; или G1 представляет гетероциклоалкильную группу, присоединенную к А по любому из положений кольца и необязательно замещенную в любом из положений кольца линейной или разветвленной (C1-C6)-алкильной группой, (С 3 С 8)-циклоалкильной группой, (С 3-C8)-циклоалкил-(C1-С 6)-алкильной группой, в которой алкильный фрагмент является линейным или разветвленным, нитрильной группой, карбоксигруппой, линейной или разветвленной (C1-C6)алкоксикарбонильной группой, карбамоильной группой (необязательно замещенной одним или двумя заместителями: линейный или разветвленный (C1-C6)-алкил, (С 3-С 8)-циклоалкил, необязательно замещенный фенил и/или необязательно замещенный бензил), необязательно замещенной арильной группой, необязательно замещенной арил-(C1-C6)-алкильной группой, в которой алкильный фрагмент является линейным или разветвленным, необязательно замещенной гетероарильной группой или необязательно замещенной гетероарил(C1-С 6)-алкильной группой, в которой алкильный фрагмент является линейным или разветвленным; их энантиомеров, диастереоизомеров и их аддитивных солей с фармацевтически приемлемыми кислотами или основаниями. Под "гетероциклоалкильной группой" понимается насыщенная циклическая группа,имеющая от 4 до 8 кольцевых членов, содержащих 1 или 2 атома азота и/или кислорода. Более конкретно могут быть упомянуты такие группы, 3 как пиперидин, пиперазин, 1,4-диазепин, пирролидин и морфолин и т.д. Под "арильной группой" понимается группа, выбранная из фенила и нафтила. Под "гетероарильной группой" понимается моноциклическая или полициклическая, ненасыщенная или частично ненасыщенная группа,имеющая от 4 до 22 кольцевых членов и содержащая от 1 до 10 гетероатомов, выбранных из азота, кислорода и серы. Выражение "необязательно замещенный" по отношению к терминам "фенил", "бензил","арил", "арилалкил", "гетероарил" и "гетероарилалкил" означает, что обсуждаемые группы замещены в своем цикличиском фрагменте одним или несколькими атомами галогенов и/или линейными или разветвленными (C1C6)-алкильными группами, линейными или разветвленными (С 1-С 6)-алкоксигруппами, гидроксигруппами, пергалоген-(C1-С 6)-алкильными группами, в которых алкильный фрагмент является линейным или разветвленным, аминогруппами (необязательно замещенными одной или двумя линейными или разветвленными (C1-C6)алкильными группами), и/или нитрогруппами; причем должно быть понятно, что гетероарильные и гетероарилалкильные группы также могут быть замещены оксогруппой. Среди фармацевтически приемлемых кислот могут быть упомянуты в качестве неограничивающих примеров соляная кислота, бромисто-водородная кислота, серная кислота, фосфоновая кислота, уксусная кислота, трифторуксусная кислота, молочная, виноградная, малоновая, янтарная, глутаровая, фумаровая, винная,малеиновая, лимонная, аскорбиновая, метансульфоновая, камфорная кислота и т.д. Среди фармацевтически приемлемых оснований можно упомянуть, например, не ограничивая ими, едкий натр, едкое кали, триэтиламин, трет-бутил амин и т.п. Преимущественно изобретение касается соединений формулы (I), в которых цианогруппа присоединена в 5-положении индольной группы. Другой предпочтительный аспект изобретения касается соединений формулы (I), в которых цианогруппа присоединена в 6-положении индольной группы. Предпочтительно, в соединениях формулы(I) каждый из R1 и R2 является атомом водорода. Предпочтительными соединениями формулы (I) являются те, в которых А является линейной или разветвленной (C1-С 6)-алкиленовой группой. В предпочтительных соединениях формулы (I) G1 является группойR4, предпочтительно, выбраны из атома водорода, линейной или разветвленной (C1-C6)алкильной группы, арильной группы и арил-(C1C6)-алкильной группы, в которой алкильный 4 фрагмент является линейным или разветвленным. В других предпочтительных соединениях изобретения G1 является необязательно замещенной гетероциклоалкильной группой. Предпочтительными гетероциклоалкильными группами являются группы: пиперазин,1,4-диазепан, пирролидин (3-пирролидинил) и пиперидин. Эти группы, предпочтительно, замещены группой, выбранной из арила (например, фенила), который является необязательно замещенным, арил-(C1-C6)-алкила, в котором алкильный фрагмент является линейным или разветвленным (например, бензил, фенетил или фенилпропил), и который является необязательно замещенным, и гетероарила (например, пиперазина, пиридина, 2-оксо-2,3-дигидро-1Hиндола, 5-оксо-5H-[1,3]триазоло[3,2-а]пиримидина или 2,4-диоксо-1,4-дигидро-3-(2H)-хиназолина), который является необязательно замещенным. Особенно предпочтительный аспект изобретения касается соединений формулы (I), в которых цианогруппа присоединена в 5-или 6 положении индольной группы, R1 и R2 каждый является атомом водорода, А представляет линейную или разветвленную (C1-С 6)-алкиленовую группу, и G1 является группой, в которой R3 и R4 каждый независимо друг от друга выбран из атома водорода, линейной или разветвленной(C1-С 6)-алкильной группы,арильной группы и арил-(C1-С 6)-алкильной группы, в которой алкильный фрагмент является линейным или разветвленным, или G1 является необязательно замещенной гетероциклоалкильной группой, выбранной из пиперазина,пирролидина (3-пирролидинила), пиперидина и 1,4-диазепана. Среди предпочтительных соединений изобретения можно более конкретно упомянуть следующие: 1-3[4-(5-метокси-4-пиримидинил)-1-пиперазинил]пропил-1H-индол-6-карбонитрил,1-[1-(2-хлорфенил)-3-пирролидинил]метил-1H-индол-6-карбонитрил,1-[3-(диметиламино)пропил]-1H-индол-6 карбонитрил. Изобретение касается также способа получения соединений формулы (I), характеризующегося тем, что в качестве исходного материала используется соединение формулы (II) в которой R1 и R2 имеют значения, определенные для формулы(I), которое, после обработки в основной среде, может быть подвергнуто действию соединения формулы (III) 5 в которой А и G1 имеют значения, определенные для формулы (I), a Р является отщепляемой группой (например, тозильной группой),с получением соединения формулы (I),или действию соединения формулы (IV) в которой А имеет значения, определенные для формулы (I), a Hal представляет атом галогена,с получением соединения формулы (V) в которой R1, R2 и А имеют значения, определенные выше; которое после бромирования гидроксильной группы или превращения последней в отщепляемую группу, подвергается в основной среде действию соединения формулы (VI) в которой G1 имеет значения, определенные для формулы (I), давая соединение формулы (I); причем должно быть понятно, что группа G1,когда она является аминогруппой или незамещенной гетероциклоалкильной группой, может замещаться на конечной стадии для введения заместителей, определенных для формулы (I), с использованием обычных реакций органической химии,при этом соединение формулы (I) может быть очищено, если необходимо, в соответствии со стандартными процедурами очистки,разделено в соответствующем случае на его изомеры с применением стандартных процедур разделения,превращено, если это желательно, в их аддитивные соли с фармацевтически приемлемыми кислотами или основаниями. Настоящее изобретение также касается фармацевтических композиций, включающих в качестве активного компонента, по крайней мере, одно соединение формулы (I) само по себе или в сочетании с одним или несколькими инертными нетоксичными фармацевтически приемлемыми эксципиентами или носителями. Среди фармацевтических композиций в соответствии с изобретением более конкретно могут быть упомянуты те, которые пригодны для перорального, паретерального или назального введения, таблетки или драже, подъязычные таблетки, желатиновые капсулы, лепешки,суппозитории, кремы, мази, кожные гели и т.п. Применимые дозировки варьируются в зависимости от возраста и веса тела пациента,природы и тяжести расстройства и типа введения препарата, который может быть пероральным, назальным, ректальным или парентеральным. Единичные дозы обычно варьируют от 0,1 до 500 мг для лечения при 1-3-кратном суточном введении. 6 Следующие примеры иллюстрируют настоящее изобретение и никоим образом не ограничивают его. Используемые материалы являются известными продуктами или получаются в соответствии с известными процедурами. Пример 1. 1-3-[4-(5-метокси-4-пиримидинил)-1-пиперазинил]пропил-1H-индол-6-карбонитрилдигидрохлорид. Стадия а. 1-(3-гидроксипропил)-1H-индол 6-карбонитрил 0,776 моль (87 г) трет-бутилата калия добавляют к раствору 0,703 моль (100 г) 6-цианоиндола в 2500 мл тетрагидрофурана при 20 С. После 15-минутного перемешивания добавляют 1,41 моль (196 г) 3-бром-1-пропанола и реакционную смесь перемешивают в течение 24 ч при комнатной температуре. После концентрирования остаток берут в 1000 мл дихлорметана и органическую фазу промывают 500 мл воды и затем 500 мл насыщенного раствора хлорида натрия. Затем органическую фазу сушат и концентрируют, получая ожидаемое соединение. Стадия b. 1-(3-бромпропил)-1H-6-карбонитрил. Раствор 0,78 моль (204 г) трифенилфосфина в 600 мл ацетонитрила добавляют при 20 С к раствору 0,7 моль (140 г) соединения предыдущей стадии и 0,85 моль (280 г) тетрабромметана в 2000 мл ацетонитрила. После 4-часового перемешивания реакционную смесь очищают с помощью хроматографии на силикагеле с использованием в качестве элюента смеси циклогексана и этилацетата (90:10), получая ожидаемое соединение. Стадия с. 1-3-[4-(5-метокси-4-пиримидинил)-1-пиперазинил]-пропил-1H-индол-6-карбонитрилдигидрохлорид. Смесь 11,4 ммоль (3 г) соединения предыдущей стадии 12,5 ммоль (2,43 г) 5-метокси-4(1-пиперазин)пиримидина и 1,3 г карбоната натрия в 60 мл ацетонитрила нагревают с обратным холодильником в течение 3 ч. После охлаждения и концентрирования остаток берут в 100 мл дихлорметана и органическую фазу промывают водой, сушат и концентрируют. Полученный остаток очищают с помощью хроматографии на силикагеле с использованием в качестве элюента смеси дихлорметана, метанола и аммиака (90:10:1). Соответствующий дигидрохлорид получают обработкой титрованным раствором НСl в этаноле. Точка плавления - 178-180 С. Элементный микроанализ: рила нагревают при 70 С в течение 1 ч. После охлаждения реакционную смесь концентрируют и полученный остаток берут в 100 мл дихлорметана. Органическую фазу промывают водой,сушат и концентрируют, получая ожидаемый продукт. Соответствующий гидрохлорид получают обработкой титрованным раствором НСl в этаноле. Точка плавления - 168-170 С. Элементный микроанализ: Пример 3. 1-3-[бензил(метил)амино]пропил-1H-индол-6-карбонитрил. Ожидаемое соединение получают в соответствии со способом, описанным на стадии (с) примера 1, заменяя 5-метокси-4-(1-пиперазинил)пиримидин N-метилбензиламином. Точка плавления - 68-70 С. Элементный микроанализ: Пример 4. 1-(3-пиролидинилметил)-1H-индол-6-карбонитрилгидрохлорид. Стадия а. Трет-бутил-3-[(6-циано-1H-индол-1-ил)метил]-1-пирролидинкарбоксилат. 77 ммоль трет-бутилата калия добавляют к раствору 70 ммоль 6-цианоиндола в 400 мл тетрагидрофурана. После 10-минутного перемешивания при комнатной температуре добавляют 70 ммоль трет-бутил 3[(метилфенил)сульфонилоксиметил]-1-пирролидинкарбоксилата в 60 мл тетрагидрофурана. Полученную в результате смесь нагревают с обратным холодильником в течение 12 ч. После охлаждения и разбавления водой растворитель удаляют выпариванием. Остаток экстрагируют дихлорметаном и органическую фазу промывают водой, сушат и концентрируют, получая ожидаемый продукт. Стадия b. 1-(3-пирролидинилметил)-1Hиндол-6-карбонитрилгидрохлорид. 40 мл трифторуксусной кислоты добавляют к раствору 70 ммоль соединения предыдущей стадии в 290 мл дихлорметана. Реакционную смесь перемешивают при комнатной температуре в течение 2,5 ч. После удаления растворителя путем выпаривания остаток берут в дихлорметан и промывают 1 М раствором карбоната натрия. Органическую фазу сушат, концентрируют и очищают с помощью хроматографии на силикагеле с использованием в качестве элюента смеси дихлорметана, метанола и аммиака (85:15:1), получая ожидаемый продукт. Соответствующий гидрохлорид получают обработкой титрованным раствором НСl в этаноле. Элементный микроанализ: 8 Пример 5. 1-[(1-бензил-3-пирролидинил)метил]-1H-индол-6-карбонитрилгидрохлорид. 4,4 ммоль карбоната калия и затем 4,4 ммоль бензилбромида добавляют к раствору 4,4 ммоль соединения, описанного в примере 4, в 20 мл ацетонитрила. После перемешивания в условиях дефлегмации в течение 2,5 ч реакционную смесь охлаждают и разбавляют смесью дихлорметана и воды. Органическую фазу отделяют,сушат и концентрируют. Полученный в результате остаток очищают с помощью хроматографии на силикагеле с использованием в качестве элюента смеси этилацетата и циклогексана(50:50), получая ожидаемый продукт. Соответствующий гидрохлорид получают обработкой титрованным раствором НСl в этаноле. Элементный микроанализ: Пример 6. 1-[1-(3-хлорбензил)-3-пирролидинил]метил-1H-индол-6-карбонитрилгидрохлорид. Ожидаемый продукт получают в соответствии со способом, описанным в примере 5, заменяя бензилбромид 3-хлорбензилбромидом. Элементный микроанализ: Пример 7. 1-[(1-фенетил-3-пирролидинил)метил]-1H-индол-6-карбонитрилгидрохлорид. Ожидаемый продукт получают в соответствии со способом, описанным в примере 5, заменяя бензилбромид фенетилбромидом. Элементный микроанализ: Пример 8. 1-[1-(2-хлорбензил)-3-пирролидинил]метил-1H-индол-6-карбонитрилгидрохлорид. Ожидаемый продукт получают в соответствии со способом, описанным в примере 5, заменяя бензилбромид 2-хлорбензилбромидом. Элементный микроанализ: Пример 9. 1-(3-пирролидинилметил)-1Hиндол-5-карбонитрилгидрохлорид. Ожидаемый продукт получают в соответствии со способом, описанным в примере 4, заменяя 6-цианоиндол 5-цианоиндолом. Элементный микроанализ: Пример 10. 1-[(1-бензил-3-пирролидинил)метил]-1H-индол-5-карбонитрилгидрохлорид. Ожидаемый продукт получают в соответствии со способом, описанным в примере 5, заменяя соединение, описанное в примере 4, соединением, описанным в примере 9. Элементный микроанализ: Пример 11. 1-[1-(3-хлорбензил)-3-пирролидинил]метил-1H-индол-5-карбонитрилгидрохлорид. Ожидаемый продукт получают в соответствии со способом, описанным в примере 5, заменяя соединение, описанное в примере 4, соединением, описанным в примере 9, а также заменяя бензилбромид 3-хлорбензилбромидом. Элементный микроанализ: Пример 12. 1-[(1-фенетил-3-пирролидинил)метил]-1H-индол-5-карбонитрилгидрохлорид. Ожидаемый продукт получают в соответствии со способом, описанным в примере 5, заменяя соединение, описанное в примере 4, соединением, описанным в примере 9, а также заменяя бензилбромид фенетилбромидом. Элементный микроанализ: Пример 13. 1-[1-(2-хлорбензил)-3-пирролидинил]метил-1H-индол-5-карбонитрилгидрохлорид. Ожидаемый продукт получают в соответствии со способом, описанным в примере 5, заменяя соединение, описанное в примере 4, соединением, описанным в примере 9, а также заменяя бензилбромид 2-хлорбензилбромидом. Элементный микроанализ: Пример 14. 1-(3-4-[4-(трифторметил)-2 пиридинил]-1-пиперазинилпропил)-1H-индол 6-карбонитрилдигидрохлорид. Ожидаемое соединение получают в соответствии со способом, описанным в примере 1,заменяя 5-метокси-4-(1-пиперазинил)пиримидин 4-трифторметил-2-(1-пиперазинил)-пиридином стадии (с). Элементный микроанализ: 10 Пример 15. 1-3-[4-(5-метокси-4-пиримидинил)-1,4-диазепан-1-ил]пропил-1H-индол-6 карбонитрилдигидрохлорид. Ожидаемое соединение получают в соответствии со способом, описанным в примере 1,заменяя 5-метокси-4-(1-пиперазинил)пиримидин 4-(1,4-диазепан-1-ил)-5-метоксипиримидином на стадии (с). Элементный микроанализ: Пример 16. 1-3-[4-(2-метоксифенил)-1 пиперазинил]пропил-1H-индол-6-карбонитрилдигидрохлорид. Ожидаемое соединение получают в соответствии со способом, описанным в примере 1,заменяя 5-метокси-4-(1-пиперазинил)пиримидин 1-(2-метоксифенил)пиперазином на стадии Пример 17. 1-[1-(3-фенилпропил)-3 пирролидинил]метил-1H-индол-6-карбонитрилгидрохлорид. Ожидаемый продукт получают в соответствии со способом, описанным в примере 5, заменяя бензилбромид 1-(3-бромпропил)бензолом. Элементный микроанализ: Пример 18. 1-[1-(3-фенилпропил)-3 пирролидинил]метил-1H-индол-5-карбонитрилгидрохлорид. Ожидаемый продукт получают в соответствии со способом, описанным в примере 5, заменяя соединение, описанное в примере 4, соединением, описанным в примере 9, а также заменяя бензилбромид 1-(3-бромпропил)бензолом. Элементный микроанализ: Пример 19. 1-(1-[2-(1-нафтил)этил]-3 пирролидинилметил)-1H-индол-6-карбонитрилгидрохлорид. Ожидаемый продукт получают в соответствии со способом, описанным в примере 5, заменяя бензилбромид 1-(2-бромэтил)нафталином. Элементный микроанализ: Пример 20. 1-[1-(3-хлорфенетил)-3 пирролидинил]метил-1 Н-индол-6-карбонитрилгидрохлорид. Ожидаемый продукт получают в соответствии со способом, описанным в примере 5, заменяя бензилбромид 1-(2-бромэтил)-3-хлорбензолом. Элементный микроанализ: Пример 21. 1-[1-(4-метоксифенетил)-3 пирролидинил]метил-1H-индол-6-карбонитрилгидрохлорид. Ожидаемый продукт получают в соответствии со способом, описанным в примере 5, заменяя бензилбромид 1-(2-бромэтил)-4-метоксибензолом. Элементный микроанализ: Пример 22. 1-[1-(3-фторфенетил)-3 пирролидинил]метил-1H-индол-6-карбонитрилгидрохлорид. Ожидаемый продукт получают в соответствии со способом, описанным в примере 5, заменяя бензилбромид 1-(2-бромэтил)-3-фторбензолом. Элементный микроанализ: Пример 23. 1-(1-[2-(2-нафтил)этил]-3 пирролидинилметил)-1H-индол-6-карбонитрилгидрохлорид. Ожидаемый продукт получают в соответствии со способом, описанным в примере 5, заменяя бензилбромид 2-(2-бромэтил)нафталином. Элементный микроанализ: Пример 24. 1-[1-(2-хлорфенетил)-3-пирролидинил]метил-1H-индол-6-карбонитрилгидрохлорид. Ожидаемый продукт получают в соответствии со способом, описанным в примере 5, заменяя бензилбромид 1-(2-бромэтил)-2-хлорбензолом. Элементный микроанализ: 12 Ожидаемый продукт получают в соответствии со способом, описанным в примере 5, заменяя бензилбромид 1-(2-бромэтил)-4-фторбензолом. Элементный микроанализ: Пример 26. 1-(1-[2-(6-хлор-2-оксо-2,3 дигидро-1H-индол-5-ил)этил]-3-пирролидинилметил)-1H-индол-6-карбонитрилгидрохлорид. Ожидаемый продукт получают в соответствии со способом, описанным в примере 5, заменяя бензилбромид 6-хлор-5-(2-хлорэтил)-1,3 дигидроиндол-2-оном. Элементный микроанализ: Пример 27. 1-(1-[2-(7-метил-5-оксо-5H[1,3]тиазоло[3,2-а]пиримидин-6-ил)этил]-3-пирролидинилметил)-1H-индол-6-карбонитрилгидрохлорид. Ожидаемый продукт получают в соответствии со способом, описанным в примере 5, заменяя бензилбромид 6-(2-хлорэтил)-7-метил[1,3]тиазоло[3,2-а]пиримидин-5-оном. Элементный микроанализ: Пример 28. 1-(1-[2-(2,4-диоксо-1,4 дигидро-3-(2 Н)-хиназолинил)этил]-3-пирролидинилметил)-1H-индол-6-карбонитрилгидрохлорид. Ожидаемый продукт получают в соответствии со способом, описанным в примере 5, заменяя бензилбромид 3-(2-хлорэтил)-(1H)хиназолин-2,4-дионом. Элементный микроанализ: Пример 29. 1-3-[циклогексил(метил)амино]пропил-1H-индол-6-карбонитрил. Ожидаемое соединение получают в соответствии со способом, описанным на стадии (с) примера 1, заменяя 5-метокси-4-(1-пиперазинил)пиримидин N-метилциклогексиламином. Пример 30. 1-[3-(бензиламино)пропил]1H-индол-6-карбонитрил. Ожидаемое соединение получают в соответствии со способом, описанным на стадии (с) примера 1, заменяя 5-метокси-4-(1-пиперазинил)пиримидин N-бензиламином. Пример 31. 1-3-[фенил(метил)амино]пропил-1H-индол-6-карбонитрил. 13 Ожидаемое соединение получают в соответствии со способом, описанным на стадии (с) примера 1, заменяя 5-метокси-4-(1-пиперазинил)пиримидин N-метиланилином. Пример 32. 1-(3-[2-(1-пиперидинил)этил]аминопропил)-1H-индол-6-карбонитрил. Ожидаемое соединение получают в соответствии со способом, описанным на стадии (с) примера 1, заменяя 5-метокси-4-(1-пиперазинил)пиримидин N-(2-аминоэтил)пиперидином. Пример 33. 1-(3-[2-(1-пирролидинил)этил]аминопропил)-1H-индол-6-карбонитрил. Ожидаемое соединение получают в соответствии со способом, описанным на стадии (с) примера 1, заменяя 5-метокси-4-(1-пиперазинил)пиримидин N-(2-аминоэтил)пирролидином. Пример 34. 1-[3-(4-морфолинил)пропил]1H-индол-6-карбонитрил. Ожидаемое соединение получают в соответствии со способом, описанным на стадии (с) примера 1, заменяя 5-метокси-4-(1-пиперазинил)пиримидин морфолином. Пример 35. 1-2-[4-(5-метокси-4-пиримидинил)-1-пиперазинил]этил-1H-индол-6-карбонитрилдигидрохлорид. Ожидаемое соединение получают в соответствии со способом, описанным в примере 1,заменяя 3-бром-1-пропанол 2-бром-1-этанолом на стадии а. Пример 36. 1-2-[4-(2-метоксифенил-1 пиперазинил]этил)-1H-индол-6-карбонитрилдигидрохлорид. Ожидаемое соединение получают в соответствии со способом, описанным в примере 1,заменяя 3-бром-1-пропанол 2-бром-1-этанолом на стадии а, а на стадии (с) заменяя 5-метокси-4(1-пиперазинил)пиримидин 1-(2-метоксифенил)-пиперазином. Фармакологическое исследование Пример А. Определение аффинности сайтов повторного захвата серотонина у крыс. Аффинность соединений изобретения определялась в конкурентных экспериментах с меченным 3H-пароксетином. Мембраны готовят из коры головного мозга крыс и инкубируют в трех повторностях с 0,25 нМ 3H-пароксетина и охлажденным лигандом при конечном объеме 0,4 мл в течение 2 ч при 25 С. Инкубационный буфер содержит 50 мМ Трис-НСl (рН=7,4), 120 мМ NaCl и 5 мМ КCl. Неспецифическое связывание определяют с использованием 10 мкМ циталопрама. По окончании инкубации смесь фильтруют через фильтры и промывают трижды 5 мл охлажденного буфера. Оставшуюся на фильтрах радиоактивность определяют методом жидкостного сцинтилляционного подсчета. Изотермы связывания анализируют методом нелинейной регрессии для определения значений IC50. Последние переводят в константу дис 003146L - концентрация 3H-пароксетина, а Кd - константа диссоциации (0,13 нМ). Соединения изобретения проявляют очень высокий уровень аффинности по отношению к сайтам повторного захвата серотонина. В качестве примера, соединение по примеру 1 характеризуется константой диссоциацииKi = 9,8 х 10-9 М. Пример В. Определение аффинности в отношении рецепторов 5-НТ 2 с. Аффинность соединений изобретения определялась в экспериментах по конкурентному связыванию с 3H-мезулергином в инкубационном буфере, содержащем 20 мМ HEPES, 2 мМEDTA, 0,1% аскорбиновой кислоты (рН=7,7) при 22 С. Константа диссоциации Кd 3H-мезулергина составляет 0,54 мМ. Неспецифическое связывание определяют с использованием 1 мкМ миансерина, также являющегося ссылочным продуктом для каждого эксперимента. По окончании инкубирования смесь фильтруют через фильтры GF/B-Unifilter (обработанные 0,1% PEI) и промывают трижды инкубационным буфером. Оставшуюся на фильтрах радиоактивность определяют методом жидкостного сцинтилляционного подсчета. Изотермы связывания анализируют методом нелинейной регрессии для определения значений IC50. Эти величины переводят в константу диссоциации Ki. Соединения изобретения проявляют очень высокий уровень аффинности в отношении рецепторов 5-НТ 2c, причем, их константа диссоциации находится в интервале 10-8-10-9 М. Пример С. Фармацевтическая композиция Состав для приготовления 1000 таблеток,каждая из которых содержит дозу по 10 мг: Соединение примера 1 Гидроксипропилцеллюлоза Пшеничный крахмал Лактоза Стеарат магния ТалькR1 и R2, независимо друг от друга, каждый представляет атом водорода или линейную или разветвленную (C1-C6)-алкильную группу; А представляет линейную или разветвленную (C1-С 6)-алкиленовую группу, линейную или разветвленную (С 2-С 6)-алкениленовую группу 15 или линейную или разветвленную (С 2-С 6)алкиниленовую группу;G1 представляет группу в которой R3 и R4, независимо друг от друга, каждый представляет атом водорода, линейную или разветвленную (C1-C6)-алкильную группу, (С 3-С 8)циклоалкильную группу, (С 3-С 8)-циклоалкил(C1-C6)-алкильную группу, в которой алкильный фрагмент является линейным или разветвленным, необязательно замещенную арильную группу, необязательно замещенную арил-(C1C6)-алкильную группу, в которой алкильный фрагмент является линейным или разветвленным, необязательно замещенную гетероарильную группу или необязательно замещенную гетероарил-(C1-C6)-алкильную группу, в которой алкильный фрагмент является линейным или разветвленным; или G1 представляет гетероциклоалкильную группу, присоединенную к А по любому из положений кольца и необязательно замещенную в любом одном из положений кольца линейной или разветвленной (C1-С 6)-алкильной группой,(С 3-С 8)-циклоалкильной группой,(С 3-С 8)циклоалкил-(C1-C6)-алкильной группой, в которой алкильный фрагмент является линейным или разветвленным, нитрильной группой, карбоксигруппой, линейной или разветвленной (C1 С 6)-алкоксикарбонильной группой, карбамоильной группой (необязательно замещенной одним или двумя заместителями: линейным или разветвленным(C1-C6)-алкилом,(С 3-С 8)-циклоалкилом, необязательно замещенным фенилом и/или необязательно замещенным бензилом), необязательно замещенной арильной группой, необязательно замещенной арил-(C1C6)-алкильной группой, в которой алкильный фрагмент является линейным или разветвленным, необязательно замещенной гетероарильной группой или необязательно замещенной гетероарил (C1-С 6)-алкильной группой, в которой алкильный фрагмент является линейным или разветвленным; их энантиомеров, диастереоизомеров и их аддитивные соли с фармацевтически приемлемыми кислотами или основаниями. 2. Соединения формулы (I) по п.1, в которых цианогруппа присоединена в 6-ом положении индольной группы, их энантиомеры, диастереоизомеры и их аддитивные соли с фармацевтически приемлемыми кислотами или основаниями. 3. Соединения формулы (I) по п.1, в которых цианогруппа присоединена в 5- положении индольной группы, их энантиомеры, диастереоизомеры и их аддитивные соли с фармацевтически приемлемыми кислотами или основаниями. 4. Соединения формулы (I) по п.1, в которых А является линейной или разветвленной(C1-C6)-алкиленовой группой, их энантиомеры,диастереоизомеры и их аддитивные соли с фар 003146 16 мацевтически приемлемыми кислотами или основаниями. 5. Соединения формулы (I) по п.1, в которых группа G1 представляет группу, их энантиомеры, диастереоизомеры и их аддитивные соли с фармацевтически приемлемыми кислотами или основаниями. 6. Соединения формулы (I) по п.1, в которых G1 является необязательно замещенной гетероциклоалкильной группой, их энантиомеры,диастереоизомеры и их аддитивные соли с фармацевтически приемлемыми кислотами или основаниями. 7. Соединения формулы (I) по п.1, в которых цианогруппа присоединена в 5-ом или 6-ом положении индольной группы, R1 и R2 - атомы водорода, А - линейная или разветвленная (C1C6)-алкиленовая группа, а G1 является группой, в которой R3 и R4, независимо друг от друга, каждый выбран из атома водорода, линейной или разветвленной (C1-С 6)-алкильной группы, арильной группы и арил-(С 1-С 6)алкильной группы, в которой алкильный фрагмент является линейным или разветвленным,или G1 является необязательно замещенной гетероциклоалкильной группой, выбранной из пиперазина, пирролидина, пиперидина и 1,4 диазепана, их энантиомеры, диастереоизомеры и их аддитивные соли с фармацевтически приемлемыми кислотами или основаниями. 8. Соединение формулы (I) по п.1, которое является 1-3-[4-(5-метокси-4-пиримидинил)-1 пиперазинил]пропил-1H-индол-6-карбонитрилдигидрохлоридом, и его аддитивные соли с фармацевтически приемлемыми кислотами. 9. Соединение формулы (I) по п.1, которое является 1-[3-(диметиламино)-пропил]-1H-индол-6-карбонитрилгидрохлоридом, и его аддитивные соли с фармацевтически приемлемыми кислотами. 10. Соединение формулы (I) по п.1, которое является 1-[1-(2-хлорфенетил)-3-пирролидинил]метил-1H-индол-6-карбонитрилом, и его аддитивные соли с фармацевтически приемлемыми кислотами. 11. Способ получения соединений формулы (I) по п.1, отличающийся тем, что в качестве исходного материала используют соединение формулы (II) в которой R1 и R2 имеют значения, определенные для формулы (I), которое, после обработки в основной среде, может быть подвергнуто действию соединения формулы (III) в которой А и G1 имеют значения, определенные для формулы (I), a Р является отщепляемой группой,с получением соединения формулы (I), или действию соединения формулы (IV) в которой А имеет значения, определенные для формулы (I), a Hal представляет атом галогена,с получением соединения формулы (V) в которой R1, R2 и А имеют значения, определенные выше; которое после бромирования гидроксильной группы или превращения последней в отщепляемую группу, подвергают в основной среде действию соединения формулы (VI) в которой G1 имеет значения, определенные для формулы (I), с получением соединения формулы (I); причем должно быть понятно, что группаG1, когда она является аминогруппой или незамещенной гетероциклоалкильной группой, может быть замещена на конечной стадии для введения заместителей, определенных для формулы (I), с использованием стандартных реакций органической химии, соединение формулы (I) 18 может быть очищено, если необходимо, в соответствии со стандартными процедурами очистки,разделено в соответствующем случае на его изомеры в соответствии со стандартными процедурами разделения,превращено, при желании, в его аддитивные соли с фармацевтически приемлемыми кислотами или основаниями. 12. Фармацевтическая композиция, включающая в качестве активного компонента, по крайней мере, одно соединение по любому из пп.1-10 само по себе или в сочетании с одним или несколькими инертными нетоксичными фармацевтически приемлемыми эксципиентами или носителями. 13. Применение, по крайней мере, одного из соединений, охарактеризованных в любом из пп.1-10, в качестве активного компонента лекарственного средства, ингибирующего обратный захват серотонина при лечении депрессий,обсессивно-компульсивных расстройств, фобий,импульсивных расстройств, связанных с лекарственной зависимостью, нервной булимией и состояниями тревоги.
МПК / Метки
МПК: C07D 209/04, A61K 31/404
Метки: соединения, захвата, способ, цианоиндольные, являющиеся, фармацевтические, серотонина, повторного, ингибиторами, композиции, новые, содержащие, получения
Код ссылки
<a href="https://eas.patents.su/10-3146-novye-cianoindolnye-soedineniya-yavlyayushhiesya-ingibitorami-povtornogo-zahvata-serotonina-sposob-ih-polucheniya-i-farmacevticheskie-kompozicii-soderzhashhie-ih.html" rel="bookmark" title="База патентов Евразийского Союза">Новые цианоиндольные соединения, являющиеся ингибиторами повторного захвата серотонина, способ их получения и фармацевтические композиции, содержащие их</a>














