Способ солюбилизации фармацевтически активных ингредиентов в воде и в водных носителях
Номер патента: 2326
Опубликовано: 25.04.2002
Авторы: Больдрини Энрико, Джанначчини Борис, Бьянкини Пьетро, Саэттоне Марко Фабрицио
Формула / Реферат
1. Способ повышения растворимости в воде и водных носителях слабо растворимых в воде фармакологически активных веществ, включающий последовательно следующие операции:
1) образование комплекса такого фармакологически активного вещества с фармацевтически приемлемым неионным полимером, способным к образованию комплексов с указанным фармакологически активным веществом, и выделения комплекса в твердом виде;
2) повторное растворение полученного таким образом комплекса в водной среде с помощью фармацевтически приемлемого неионного поверхностно-активного вещества.
2. Способ по п.1, при котором указанная операция 1) осуществляется путем растворения в одном или более из органических растворителей, отдельно или вместе указанного фармакологически активного вещества и указанного неионного полимера с последующим объединением двух растворов вместе в случае, когда растворение производились отдельно, и соосаждения полученного комплекса путем выпаривания указанных, одного или более, растворителей.
3. Способ по п.1, при котором указанная операция 1) включает следующие стадии:
1а) объединение и смешивание до растворения, отдельно или вместе, указанного фармакологически активного вещества и указанного неионного полимера с указанными, одним или более, органических растворителей таким образом, что композиция полученного общего раствора представляет собой следующее
от 0,05 до 10% фармацевтически активного вещества;
от 1 до 50% неионного полимера и
от 5 до 50% одного органического растворителя или смеси органических растворителей,
причем все вышеуказанные процентные количества являются весовыми, и
1b) выпаривание одного или более растворителей с получением указанного комплекса в твердом виде.
4. Способ по п.2 или 3, при котором указанная операция 2) включает следующую стадию:
2а) добавление воды или водного носителя и от 1 до 50% неионного поверхностно-активного вещества к указанному комплексу в твердом виде.
5. Способ по любому из предшествующих пунктов, где указанный фармацевтически приемлемый неионный полимер, способный к образованию комплексов, выбирается из группы, состоящей из поливинилпирролидона (ПВП), циклодекстринов, полиэтиленгликоля (ПЭГ), полипропиленгликоля (ППГ), простых эфиров целлюлозы и декстрана.
6. Способ по п.5, где указанный неионный полимер является растворимым ПВП, имеющим средний молекулярный вес, находящийся в интервале от 2000 до 1500000.
7. Способ по любому из предшествующих пунктов, где указанное неионное поверхностно-активное вещество выбирается из группы, состоящей из сложных эфиров жирных кислот и сахарозы, простых эфиров жирных спиртов и олигогликозидов, сложных эфиров жирных кислот и глицерина, сложных эфиров жирных кислот и сорбитана, сложных эфиров полиэтоксилированных жирных кислот и сорбитана, сложных эфиров жирных кислот и поли(этиленоксида), простых эфиров жирных спиртов и поли(этиленоксида), простых эфиров алкилфенола и поли(этиленоксида), простых эфиров алкилфенола и поли(этиленоксида), блоксополимеров полиоксиэтиленаполиоксипропилена, этоксилированных жиров и масел.
8. Способ по п.7, где указанное поверхностно-активное вещество является полиэтиленгликоль-глицерилтририцинолеатом (ПЭГ-ГТР).
9. Способ по любому из пп.2-8, где указанные один или более органических растворителей выбираются из группы, состоящей из одноатомных спиртов из 1-4 атомов углерода, кетонов, хлорированных растворителей.
10. Способ по любому из предшествующих пунктов, где указанное фармакологически активное вещество выбирается из группы, состоящей из форсколина, дапипразола, толрестата, пироксикама, формокортала, рутина, руфлоксацина, амфотерицина В.
Текст
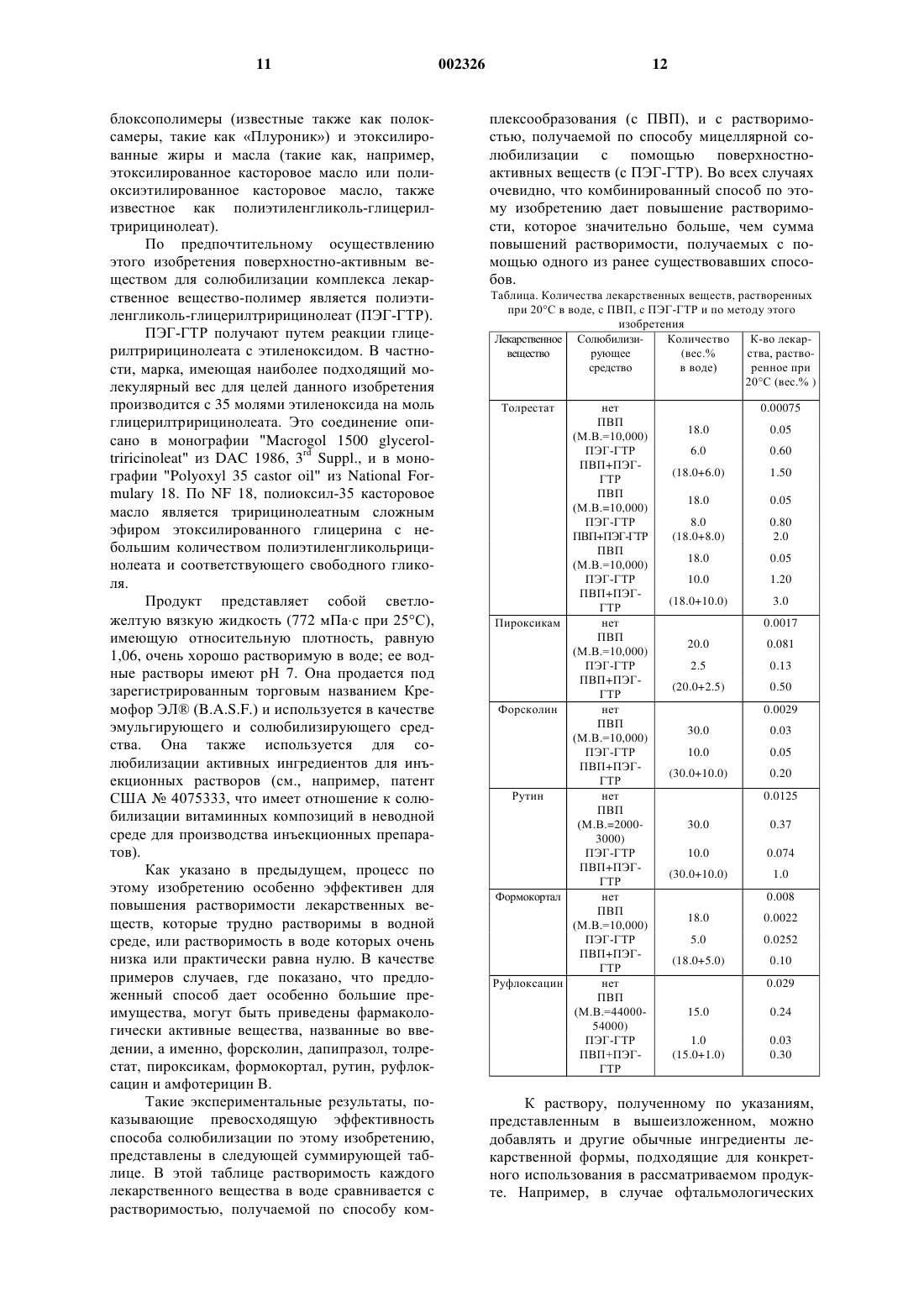
1 Данное изобретение относится к способу солюбилизации фармакологически активных ингредиентов в воде и в водных носителях. Более конкретно, это изобретение относится к методике работы, с помощью которой возможно заметно повысить растворимость в воде фармакологически активных органических соединений, которые по своей природе мало или почти не растворимы в воде, так, чтобы получить препараты, стабильные в водном растворе, имеющем терапевтически и коммерчески приемлемые концентрации активного ингредиента. Как известно, плохая растворимость в воде, которой отличаются многие фармакологически активные вещества, часто приводит к большим трудностям при изготовлении лекарственной формы, в частности в случаях, когда желательны стерилизуемые и применимые гомогенные водные растворы. Это, в частности, происходит в области изготовления жидких препаратов для местного применения в офтальмологии,ринологии, отологии, гинекологии, дерматологии и для использования на слизистых оболочках полости рта, но с этим можно столкнуться и в области получения композиций для системного введения, в частности, парентерального введения (т.е. инъекционных растворов). Обращаясь к области офтальмологии, известно, что существует много активных ингредиентов, слабо растворимых в воде, которые были бы чрезвычайно полезны и эффективны,если бы они могли применяться местно, в виде глазных капель, или эффективность или удобство применения которых были бы увеличены,если бы концентрация существующих препаратов могла бы быть повышена. В качестве примера здесь могут быть приведены антиглаукомные средства (форсколин, дапипразол), средства от катаракты (толрестат), нестероидные противовоспалительные лекарственные средства (пироксикам), стероидные противовоспалительные лекарственные средства (формокортал), гликозидные вазопротективные средства (рутин),фторхинолоновые антибактериальные лекарственные средства (руфлоксацин), антибиотики(амфотерицин В). Во всех приведенных выше случаях растворимость в воде активного ингредиента настолько слаба, что появление на рынке офтальмологических растворов на основе указанных активных веществ становится невозможным или нерентабельным, или что концентрации производимых препаратов сильно ограничены. Например, как было показано, толрестат чрезвычайно активен в отношении подавления альдозредуктазы, и это делает его достаточно интересным в качестве средства от катаракты. Толрестат был бы чрезвычайно полезным, если бы он мог применяться в офтальмологических препаратах для местного применения, а не путем системного введения, так как это значительно снижало бы его побочные эффекты. На последние, напротив, нельзя не об 002326 2 ращать внимания, когда этот продукт вводят системно. Кроме того, лекарственная форма для местного применения повышала бы распределение лекарственного средства в тканях глаза. Однако лекарственных форм толрестата в виде глазных капель в настоящее время нет на рынке,что, весьма вероятно, связано с тем фактом, что активное вещество практически не растворимо в воде (0,75 мг/100 г воды при 20 С). За многие годы были изучены и предложены различные методы повышения растворимости и, соответственно, удобства лекарственной формы и биодоступности плохо растворимых в воде лекарственных веществ. Все указанные способы могут быть отнесены к той или другой из следующих групп:A) химическая модификация: 1) введение ионной или ионизируемой группы; 2) введение группы, которая снижает температуру плавления;B) физико-химические методы солюбилизации: 1) мицеллярная солюбилизация с помощью поверхностно-активных веществ; 2) комплексообразование и образование твердых растворов и суспензий с помощью полимеров. Трансформация активного ингредиента в ионное или ионизируемое производное (как в А 1, выше) является весьма обычным способом солюбилизации (см., например, S. Yalkowsky etHarper, J. Med. Pharm. Chem., 1. 467, (1959 Если лекарственное вещество имеет свободные гидроксильные группы, могут образовываться гемисукцинатные, фосфатные, диметиламиноацетатные сложные эфиры и эфиры с аминокислотами, если, с другой стороны, имеется карбоксильная группа, также могут быть сложные эфиры (с аминокислотами, холином, диметиламиноэтиловым спиртом и т.д.). В основе этого метода лежит взаимосвязь между растворимостью и рН у слабых кислот и оснований. Метод на указанной основе, по существу, является ценным только тогда, когда общая растворимость достигает растворимости в ионном видеPharm. Sci., 61, 1896 (1972. Способ снижения температуры плавления(см. А 2, выше) основан на той идее, что чтобы быть растворенными, молекулы должны покинуть кристаллическую решетку. Любая модификация молекулы, которая снижает температуру плавления и, таким образом, снижает энергию кристаллической решетки, служит повышению ее растворимости в каком-либо раствори 3 теле (см., например, N.J. Harper, Progr. DrugRes., 4, 221 (1962. Темой более 3000 научных публикаций за последние двадцать лет была мицеллярная солюбилизация лекарственных веществ с помощью поверхностно-активных соединений (как в В 1, выше) (см., например, A.T. Florence, "DrugEd., Vol. 12, Marcel Dekker, New York, 1981, pp. 15-89; P.H. Elworthy et al., "Solubilization by Surface-Active Agents", Chapman and Hall, London,1968). Эта методика имеет некоторые ограничивающие факторы, такие как, например: 1) ограниченная способность мицелл к солюбилизации; 2) возможная краткосрочная или долгосрочная токсичность сурфактантов и 3) одновременная солюбилизация других компонентов лекарственной формы, таких как консерванты,улучшающие вкус и запах вещества, и красители, с получением изменения стабильности и активности. Возвращаясь опять к примеру толрестата, единственная возможность которая, повидимому, найдена на экспериментальном уровне для применения этого лекарственного средства в виде глазных капель, состоит в получении суспензии (1% по весу) толрестата в водном растворе, содержащем неионный сурфактант, например Твин 80 (или полисорбат 80). Такая композиция могла бы храниться (при 4 С) в течение только ограниченного срока и которую нужно было бы повторно суспендировать путем ее встряхивания каждый раз перед применением. Очевидно, что такой раствор не может быть предложен для разработки на промышленном и коммерческом уровне. Еще одним видом широко используемых методов повышения растворимости в воде фармакологически активных веществ является образование комплексов, твердых растворов и твердых дисперсий с помощью использования соответствующих полимеров (как в В 2, выше). Что касается образования твердых растворов, известно, что в некоторых случаях возможно повысить растворимость вещества даже с помощью простой физической смеси. В таком случае активный ингредиент включается в соответствующий гидрофильный носитель, который повышает его растворимость и биодоступность без какой-либо конкретной химической связи,происходящей между лекарственным веществом и полимерной матрицей. Различие между твердым раствором и твердой дисперсией может быть определено по форме активного ингредиента: в твердом растворе активное вещество присутствует в аморфной молекулярной форме, тогда как в дисперсии указанное активное вещество присутствует в кристаллической форме, как можно более тонко измельченной. Еще более широко распространенным и изученным является случай, где взаимодействие 4 между полимером и лекарственным веществом таково, что вызывает образование действительного комплекса, в котором участвуют химические связи нековалентной природы. В качестве примеров комплексообразующих полимеров,используемых в фармацевтической области,могут быть приведены, среди прочих, полиэтиленгликоли, полипропиленгликоли, циклодекстрины, карбоксиметилцеллюлоза, поливинилпирролидон (ПВП) (см., например, T. Higuchi et(1976. Соосаждение является одним из наиболее широко распространенных методов получения комплексов с повышенной растворимостью. По этому методу вещество и полимер растворяют в органическом растворителе, в котором они оба растворимы, и раствор затем выпаривают при атмосферном давлении, под пониженным давлением, с помощью распылительной сушки или путем лиофилизации с получением сухого продукта, действительно состоящего из комплекса обработанного лекарственного вещества. Такие комплексы могут быть также получены путем применения следующих методов, таких как размол и смешивание ингредиентов в мельнице,или путем экструзии пасты, содержащей два продукта вместе с незначительным количеством воды и т.д. При разработке рабочего метода солюбилизации лекарственных веществ путем комплексообраэования необходимо принимать во внимание молекулярный вес полимера, так как растворимость активного ингредиента непосредственно от него зависит. В основном более подходит низкий молекулярный вес, чем средний и высокий молекулярный вес. Стабильность растворов обычно бывает хорошей для большого числа веществ, с максимумом, равным двум годам, для фенитоина, соосажденного с ПВП,имеющим М.В. = 50000 (R. Jachowicz, Int. J.Pharm., 35, 7-12 (1987. Среди полимеров, которые используются для образования лекарственных форм со слабо растворимыми в воде активными ингредиентами, ПВП демонстрирует вполне выраженные свойства комплексообразования и повышения растворимости (см., например, S. Keipert et al.,Pharmazie, 28, 145-183 (1973); W. Scholtan, Makromol. Chem., 11, 131-230 (1953); A.A. Kassem et(1983. Типичным примером является ПВПйодный комплекс, получение которого восходит, по крайней мере, к 1955 (патенты США 2706701,2826532 и 2900305, все из GAFChemical Corporation). Все количество йода,присутствующее в указанных препаратах, находится в комплексах, за исключением очень небольшого количества част./тыс. свободного йода (H.U. Schenck et al., J. Pharm. Sci., 68, 15051509 (1979. Ограничивающими факторами этого метода в отношении солюбилизации йода являются кислая реакция в водных растворах(рН=2) и тот факт, что эти комплексы склонны к разложению при повышении рН. Один из первых примеров солюбилизации фармакологически активных молекул путем комплексообразования с ПВП раскрыт в патенте США 3089818, опубликованном в 1963 (принадлежащем Baxter Laboratories, Inc.). В указанном документе раскрывается использование поливинилпирролидонов в качестве комплексообразующих веществ для полипептидных антибиотиков, по существу не растворимых в воде, и способ включает следующие стадии: растворение как антибиотика, так и полимера в неводных органических растворителях, в которых растворимы оба продукта, и затем удаление растворителя, посредством чего получается сухой комплекс. По сравнению с исходным антибиотиком указанный комплекс демонстрирует существенно повышенную растворимость в воде. К тому же, в рамках раскрытых выше методов, в патенте США 4900775, опубликованном в 1990 (принадлежащем GAF ChemicalCorp.), предлагается способ солюбилизации органических соединений с низкой растворимостью в воде посредством комплексообразования с ПВП, и при этом способе вся операция образования комплекса проводится в водной среде. Конкретно, нерастворимый активный ингредиент суспендируют в водном растворе ПВП и затем суспензию нагревают при перемешивании при температуре ниже 100 С (предпочтительно,при 6-85 С) в течение периода времени, достаточного для образования прозрачного раствора(предпочтительно, составляющего от 1 до 1,5 ч). Раствор может использоваться как таковой или его можно выпаривать с получением порошка комплекса. Хотя вышеуказанный способ обладает, по мнению авторов, тем преимуществом, что не используются органические растворители, при этом неизбежно требуется нагревание активных веществ в течение периодов времени, которые нельзя не принимать в расчет. Кроме того, достигаемое повышение растворимости, повидимому, имеет тот же порядок изменения,который предлагается и при общепринятых процессах осуществления комплексообразования в неорганическом растворителе. Для многих фармацевтических веществ,перечисленных в вышеизложенном, уровни рас 002326 6 творимости, которые могут быть достигнуты с помощью одного или другого из методов, раскрытых выше, являются еще недостаточными,чтобы сделать их использование в коммерческих продуктах в водном растворе возможными для предложения. В качестве примера достаточно рассмотреть то, что у толрестата, когда его обрабатывают методом солюбилизации с использованием комплексообразования с ПВП,его первоначальная растворимость 0,00075 вес.% может повышаться до значения, равного 0,05 вес.%. Этот количественный результат не может быть предложен для коммерческого применения этого продукта в виде глазных капель. Более хорошие результаты, хотя еще недостаточные для промышленной разработки, получаются при солюбилизации с помощью поверхностно-активных веществ. Путем оптимизации выбора поверхностно-активного вещества и необходимых количеств может быть получена растворимость порядка 1,2 вес.%. Поэтому объект данного изобретения состоит в том, чтобы разработать способ обработки фармакологически активных веществ, плохо растворимых в воде, способа, который даст результаты в отношении общего повышения количества активного вещества, которое может быть устойчиво растворено в воде, превосходящие результаты, которые могут быть в настоящее время достигнуты с помощью известных методов. В этом контексте, мало (или плохо,слабо, почти не) растворимые фармакологически активные вещества означают все те соединения, которые обладают биологической активностью, растворимость в воде которых при комнатной температуре слишком низка, чтобы изготовить достаточно активные или полезные какие-либо водные препараты, содержащие указанные соединения в качестве активных ингредиентов, которые можно предложить для коммерческих целей. С этой целью сначала проработали информацию, накопленную в течение длительного времени, по взаимодействию между поверхностно-активными веществами и другими компонентами фармацевтической композиции. В частности, были рассмотрены взаимодействия между поверхностно-активными веществами и теми полимерными молекулами, которые обычно присутствуют в жидких лекарственных формах в качестве реологических модификаторов или стабилизаторов суспензии. На деле известно, что такие взаимодействия могут влиять на способность поверхностно-активных веществ солюбилизировать активные ингредиенты. В частности, взаимодействия между поверхностно-активными веществами и полимерами, такими как полиэтиленгликоль, уже были изучены(1967, а также взаимодействия между сурфактантами и полипропиленгликолем (М.J.Schwuger, J. Colloid Interface Sci., 43, 491 (1973, по 7 ливинилпирролидоном (M.L. Fishman, Ph.D.Thesis, Polytechnic Inst. of Brooklyn), поливиниловым спиртом (M.N. Breuer and I.D. Robb,Chem. Ind., 530 (1972. Было обнаружено, что такие взаимодействия увеличиваются с гидрофобными свойствами макромолекулы (H. Arai(1969); T. Isemura et A. Imanishi, J. Polymer Sci.,33, 337 (1958. В таких исследованиях, однако,исключительно рассматриваются ситуации, где поверхностно-активное вещество и органический полимер присутствуют в то же самое время в растворе в водной среде, где, возможно,присутствует также активный ингредиент, и не сделано никакого предположения о разработке рабочих методов солюбилизации, отличных от уже известных способов. В настоящее время обнаружено, что возможно резко увеличить растворимость в воде фармацевтических соединений, которые слабо растворимы в воде, путем применения процедуры, состоящей из двух последовательных стадий, на первой из которых фармацевтическое соединение соосаждается с неионным комплексообразующим полимером, и полученный комплекс затем сушат, и на втоpой из которых этот комплекс снова солюбилизируют с помощью неионного поверхностно-активного вещества. Путем применения указанной процедуры, которая, по существу, состоит из комбинации двух способов, раскрытых выше в В 1 и В 2, возможно солюбилизировать фармацевтические активные вещества в количествах, значительно превышающих количества, обеспечиваемые использованием отдельно каждого из указанных методов, а также значительно выше, часто более чем вдвое, сумму указанных количеств. Соответственно, данное изобретение, конкретно, представляет процесс солюбилизации в воде и в водных носителях мало растворимых в воде фармакологически активных веществ,включающий последовательно следующие операции: 1) образование комплекса такого фармакологически активного вещества с фармацевтически приемлемым неионным полимером, способным к образованию комплексов с указанным фармакологически активным веществом, и выделение комплекса в твердой форме; 2) повторного растворения полученного таким образом комплекса в водной среде с помощью фармацевтически приемлемого неионного поверхностно-активного вещества. Предпочтительно, операция 1) производится растворением в одном или более из органических растворителей, отдельно или вместе,указанного фармакологически активного вещества и указанного неионного полимера, затем объединения двух растворов вместе в случае,когда растворение производилось отдельно, и соосаждением полученного комплекса путем выпаривания указанных, одного или более, рас 002326 8 творителей. Конкретно, относительные количества вышеуказанных ингредиентов являются,предпочтительно, такими, что состав полученного общего раствора является следующим: от 0,05 до 10% фармакологически активного вещества; от 1 до 50% неионного полимера и от 5 до 50% одного органического растворителя или смеси органических растворителей,причем все вышеуказанные количества представлены в весовых процентах. Затем растворитель или смесь растворителей выпаривают путем применения одного из известных методов, упомянутых выше, вместе с образованием комплексов фармакологически активных веществ, тем самым переводя комплексный продукт в сухую форму. Часть процесса по этому изобретению,обозначаемая 2), предпочтительно, проводится путем добавления воды или водного носителя и от 1 до 50% неионного поверхностно-активного вещества к указанному комплексу в твердом виде, получая тем самым стабильный и неожиданно концентрированный раствор активного ингредиента. Неионные полимеры, которые могут использоваться в качестве комплексообразующих веществ, в первой части предлагаемого процесса выбираются, соответственно, из поливинилпирролидона (ПВП), циклодекстринов, полиэтиленгликоля (ПЭГ), полипропиленгликоля(ППГ), эфиров целлюлозы (таких как метилцеллюлоза, этилцеллюлоза, гидроксипропилцеллюлоза, гидроксипропилметилцеллюлоза и т.д.) и декстран. Особенно предпочтительным является ПВП, и конкретно, растворимый ПВП, имеющий средний молекулярный вес, находящийся в интервале от 2000 до 1500000 с предпочтением,отдаваемым препарату с более низким молекулярным весом, находящимся в интервале между 2000 и 55000. Как известно, поливинилпирролидон является поливиниловым полимером N-винил-2 пирролидона, полученного путем радикальной полимеризации винилпирролидона в воде или изопропиловом спирте (R. Vieweg et al.,Kunststoff-Handbuch XI, Carl-Hanser-Verlag. Munich, 1971, pp. 558-569; Ullmann's Encyclopediaof Industrial Chemistry, 5th ed., Vol, 21, VCH,1992, pp. 752-754). В форме прямых цепей (которая называется также повидоном) ПВП легко растворим в воде и также растворим во многих органических растворителях. Форма полимера с перекрестными связями (также называемая кросповидоном) не растворима практически во всех обычных растворителях. ПВП описан в соответствующих монографиях Поливидонам и Повидон последних изданий Европейской фармакопеи и Итальянской фармакопеи, фармакопеи США 23 и т.д. В этих фармакопеях молекулярный вес растворимого ПВП выражен значением параметра К (Н.(1932, который рассчитывается по относительной вязкости в воде и образует часть коммерческого названия. Например, как на линии плаздона GAF Chemicals Company, так и линии коллидона B.A.S.F., можно получить несколько марок ПВП с разными значениями К(такие как 12, 17, 25, 30 и 90 для коллидона). Такие значения соответствуют различным интервалам среднего молекулярного веса (на практике, от М.В., равного примерно 2000-3000 для коллидона 12 PF до М.В., равного 10000001500000 для коллидона 90F). Важно принять во внимание, что полимеры, такие как ПВП, образуются не из молекул,имеющих одинаковый молекулярный вес, а они являются смесями, состоящими из молекул с разным молекулярным весом в различных пропорциях. В идеальном случае молекулярные веса имеют гауссово распределение. Эти смеси могут быть подтверждены и охарактеризованы с помощью гельпроникающей хроматографии. В основном подобные смеси могут содержать по максимуму 15-20% фракций с низким молекулярным весом и примерно 20% фракций с высоким молекулярным весом. Для выяснения указанного соотношения могут также служить ультрафильтрация через точно откалиброванные мембраны, а также электрофорез (М. de Voset al., Proceedings of the 2nd Int. Symp. on Povidone, University of Kentucky, Lexington, 1987,pp.10-23). Водные растворы ПВП можно стерилизовать в автоклаве (20 мин при 120 С) без модификаций их молекулярного веса в результате этой обработки. Другим замечательным свойством ПВП является его способность сильно снижать раздражающее действие многих активных ингредиентов. Такое раздражающее действие может быть достаточно значительным, например, у офтальмологических лекарств. Молярные отношения между активным ингредиентом и комплексообразующим полимером могут быть выбраны предпочтительно в достаточно широком интервале: от примерно 1:0,1 до примерно 1:100, в зависимости от молекулярного веса лекарственного вещества, от его строения, от типа и среднего молекулярного веса использованного неионного полимера. В случае конкретного ПВП и в границах представленных далее рабочих примеров молярное отношение варьирует - от 1:0,25 до 1:7,5, но очевидно, что возможны различные значения с соединениями, отличающимися от представленных в этих примерах. Что касается органических растворителей,пригодных для растворения и операции соосаждения, приведенных в 1), то такие растворители,предпочтительно, выбираются из группы, состоящей из одноатомных спиртов с 1-4 атомами углерода, кетонов (таких как ацетон), хлорированных растворителей (таких как хлороформ и метиленхлорид).S.A. Botha et A.P. Lоtter, Drug Dev. Ind. Pharm.,15, 1843-1853, (1989), 16, 673-683 (1990. Последние два автора использовали для определения комплекса ПВП-лекарственное вещество метод дифференциальной сканирующей калориметрии (ДСК). Этот метод также применялся в экспериментах, связанных с данным изобретением. Конкретно, как показано путем примера в прилагаемой фигуре со ссылками на случай комплекса ПВП-толрестат, комплексы, полученные после операции 1) процесса по этому изобретению, подвергали анализу дифференциальной сканирующей калориметрии, и их поведение сравнивали с поведением толрестата и ПВП по отдельности. Для анализа точно взвешенные образцы материалов нагревали со скоростью 5 ккал/мин в температурном интервале от 100 до 250 С. Как можно установить по полученным таким образом термограммам, показанным на фигуре, образование этого комплекса подтверждается тем фактом, что в соответствующей термограмме (кривая с) пик эндотермального плавления толрестата (кривая а) исчезает. Неионные поверхностно-активные вещества, пригодные для проведения процесса данного изобретения, включают, в общем, все неионные поверхностно-активные вещества, известные как использующиеся в фармацевтической области, и конкретно: сложные эфиры жирных кислот и сахарозы, простые эфиры жирных спиртов и олигогликозидов (такие как,например, алкилполигликозиды, известные под названием Тритон) , сложные эфиры жирных кислот и глицерина (такие как, например, моно/дистеарат или монолаурат глицерина), сложные эфиры жирных кислот и сорбитана (такие как Спаны), а также этоксилированные неионные поверхностно-активные вещества, содержащие полиоксиэтиленовые цепи в их молекуле (причем эти последние имеют много названий, общих и зарегистрированных, таких как полиэтиленгликоль, полиэтиленоксид, ПОЭ,ПЭГ, ПЭО, Макроголь, Карбовакс, Полиокс или Полиоксил). Последний содержит, в частности,полиэтоксилированные сложные эфиры жирных кислот и сорбитана (а именно, полисорбаты,такие как, например, Твины), сложные эфиры жирной кислоты и поли (этиленоксида) (такие как, например, полиоксиэтиленстеараты), простые эфиры жирных спиртов и поли(этиленоксида) (например, полиэтоксилированный лауриловый простой эфир), алкилфенольные простые эфиры поли(этиленоксида) 11 блоксополимеры (известные также как полоксамеры, такие как Плуроник) и этоксилированные жиры и масла (такие как, например,этоксилированное касторовое масло или полиоксиэтилированное касторовое масло, также известное как полиэтиленгликоль-глицерилтририцинолеат). По предпочтительному осуществлению этого изобретения поверхностно-активным веществом для солюбилизации комплекса лекарственное вещество-полимер является полиэтиленгликоль-глицерилтририцинолеат (ПЭГ-ГТР). ПЭГ-ГТР получают путем реакции глицерилтририцинолеата с этиленоксидом. В частности, марка, имеющая наиболее подходящий молекулярный вес для целей данного изобретения производится с 35 молями этиленоксида на моль глицерилтририцинолеата. Это соединение описано в монографии "Macrogol 1500 glyceroltriricinoleat" из DAC 1986, 3rd Suppl., и в монографии "Polyoxyl 35 castor oil" из National Formulary 18. По NF 18, полиоксил-35 касторовое масло является тририцинолеатным сложным эфиром этоксилированного глицерина с небольшим количеством полиэтиленгликольрицинолеата и соответствующего свободного гликоля. Продукт представляет собой светложелтую вязкую жидкость (772 мПас при 25 С),имеющую относительную плотность, равную 1,06, очень хорошо растворимую в воде; ее водные растворы имеют рН 7. Она продается под зарегистрированным торговым названием Кремофор ЭЛ (B.A.S.F.) и используется в качестве эмульгирующего и солюбилизирующего средства. Она также используется для солюбилизации активных ингредиентов для инъекционных растворов (см., например, патент США 4075333, что имеет отношение к солюбилизации витаминных композиций в неводной среде для производства инъекционных препаратов). Как указано в предыдущем, процесс по этому изобретению особенно эффективен для повышения растворимости лекарственных веществ, которые трудно растворимы в водной среде, или растворимость в воде которых очень низка или практически равна нулю. В качестве примеров случаев, где показано, что предложенный способ дает особенно большие преимущества, могут быть приведены фармакологически активные вещества, названные во введении, а именно, форсколин, дапипразол, толрестат, пироксикам, формокортал, рутин, руфлоксацин и амфотерицин В. Такие экспериментальные результаты, показывающие превосходящую эффективность способа солюбилизации по этому изобретению,представлены в следующей суммирующей таблице. В этой таблице растворимость каждого лекарственного вещества в воде сравнивается с растворимостью, получаемой по способу ком 002326 12 плексообразования (с ПВП), и с растворимостью, получаемой по способу мицеллярной солюбилизации с помощью поверхностноактивных веществ (с ПЭГ-ГТР). Во всех случаях очевидно, что комбинированный способ по этому изобретению дает повышение растворимости, которое значительно больше, чем сумма повышений растворимости, получаемых с помощью одного из ранее существовавших способов. Таблица. Количества лекарственных веществ, растворенных при 20 С в воде, с ПВП, с ПЭГ-ГТР и по методу этого изобретения Лекарственное СолюбилизиКоличество К-во лекарвещество рующее К раствору, полученному по указаниям,представленным в вышеизложенном, можно добавлять и другие обычные ингредиенты лекарственной формы, подходящие для конкретного использования в рассматриваемом продукте. Например, в случае офтальмологических растворов могут быть добавлены одно или более создающих изотоничность веществ, и для этой цели можно использовать известные в области фармации продукты, такие как, например,хлорид натрия, хлорид калия, маннит, декстроза, борная кислота, пропиленгликоль. Кроме того, могут добавляться кислоты или основания в качестве регулирующих рН веществ, а также буферы, такие как фосфатный буфер Сренсена или система из ацетата натрия-уксусной кислоты. Композиция может также включать консерванты и антимикробные препараты, такие как бензалкония хлорид, мертиолат натрия, сложные эфиры п-оксибензойной кислоты, хлорбутанол и т.д., и наконец, хелатирующие вещества, такие как натриевые соли этилендиаминтетрауксусной кислоты (ЭДТУ). Некоторые примеры получения композиций водных растворов с помощью способа этого изобретения представлены ниже только в иллюстративных целях с конкретным обращением к области офтальмологии. Очевидно, однако, что опытные специалисты легко изготовят растворы, пригодные для использования в других областях путем добавления соответствующих вспомогательных веществ. Пример 1. Толрестат ПВП (М.В.=10000) Кремофор ЭЛ Бензалкония хлорид Фосфатный буфер Сренсена рН 7,4 Раствор готовят по следующей методике: 3 г (8,4 ммоля) толрестата растворяют в 50 мл ацетона. Отдельно 18 г (1,8 ммоля) ПВП(М.В.=10000) растворяют в 50 мл ацетона. Два раствора, слитые вместе, выпаривают до сухого остатка в роторном испарителе при комнатной температуре и полученный таким образом комплекс выдерживают в течение ночи под пониженным давлением, чтобы полностью удалить остаток растворителей. Затем комплекс смешивают с 10,0 г ПЭГГТР и при перемешивании добавляют фосфатный буфер, содержащий бензалкония хлорид,предварительно растворенный в нем. Полученный таким образом раствор фильтруют и упаковывают. Пример 2. Лекарственная форма: как в примере 1. Изготовление: 3 г (8,4 ммоля) толрестата растворяют в 50 мл ацетона. К раствору добавляют 18 г (1,8 ммоля) ПВП (М.В.=10000). После получения прозрачного раствора смесь сушат в роторном испарителе при комнатной температуре. Комплекс, созданный таким образом, обрабатывают как в предыдущем примере, и затем добавляют 10,0 г ПЭГ-ГТР, завершая получение препарата, как описано в указанном примере. Пример 3. Лекарственная форма: как в примере 1. 14 Изготовление: 3 г (8,4 ммоля) толрестата и 18,0 г (1,8 ммоля) ПВП (М.В.=10000) растворяют по методу из примера 1 или по методу из примера 2, и затем раствор выпаривают с помощью распылительной сушки. Полученный комплекс затем смешивают с 10,0 г ПЭГ-ГТР, завершая изготовление, как описано в примере 1. Пример 4. Лекарственная форма: как в примере 1. Изготовление: следуют той же самой методике, как и в примере 1 (первый вариант) или такой же методике, как и в примере 2 (второй вариант), заменяя ацетон метиловым спиртом. Пример 5. Лекарственная форма: как в примере 1. Изготовление: следуют той же самой методике, как и в примере 1 (первый вариант) или такой же методике, как и в примере 2 (второй вариант), заменяя ацетон хлороформом. Пример 6. Лекарственная форма: как в примере 1. Изготовление: следуют той же самой методике, как и в примере 1 (первый вариант) или такой же методике, как и в примере 2 (второй вариант), заменяя ацетон смесью хлороформа и метилового спирта. Пример 7. Толрестат ПВП (М.В.=10000) Кремофор ЭЛ Бензалкония хлорид Фосфатный буфер Сренсена рН 7,4 Раствор готовят по той же самой методике,что и в примере 1, за исключением того, что используемые количества являются такими,которые указаны выше. Пример 8. Лекарственная форма: как в примере 7, за исключением буфера. Изготовление: следуют той же самой методике, как и в примере 1, заменяя фосфатный буфер Сренсена дистиллированной водой. Пример 9. Толрестат ПВП (М.В.=10000) Сахарозы монолаурат Метил-п-оксибензоат Фосфатный буфер Сренсена рН 7,4 Раствор готовят по той же самой методике,что и в примере 1, заменяя неионное поверхностно-активное вещество Кремофор ЭЛ монолауратом сахарозы и консервант хлорид бензалкония метил-п-оксибензоатом. Пример 10. Пироксикам 0,50 г ПВП (М.В. = 10000) 20,0 г Кремофор ЭЛ 2,5 г Бензалкония хлорид 0,01 г Изотонический фосфатный буфер рН 7,4 q.s. до 100,00 г Раствор изготавливают по следующей методике: 0,50 г (1,5 ммоля) пироксикама и 20,0 г (2 ммоля) ПВП (М.В.=10000) обрабатывают, следуя той же самой процедуре, что и в первой части из примера 1. Комплекс, полученный таким образом, затем смешивают с 2,5 г ПЭГ-ГТР,завершая изготовление, как описано во второй части примера 1. Пример 11. Пироксикам ПВП (М.В.=10000) Кремофор ЭЛ Натрия мертиолат Дистиллированная вода Раствор изготавливают по следующей методике: 0,50 г (1,5 ммоля) пироксикама и 20,0 г (2 ммоля) ПВП (М.В.=10000) обрабатывают, следуя той же самой процедуре, что и в первой части примера 1. Комплекс, полученный таким образом, затем смешивают с 2,5 г ПЭГ-ГТР, завершая изготовление, как описано во второй части примера 1, но заменяя консервант бензалкония хлорид мертиолатом натрия, а буферный раствор дистиллированной водой. Пример 12. Форсколин ПВП (М.В.=10000) Кремофор ЭЛ Бензалкония хлорид Дистиллированная вода Раствор изготавливают по следующей методике: 0,20 г (0,48 ммоля) форсколина и 30,0 г (3 ммоля) ПВП (М.В.=10000) обрабатывают, следуя той же самой процедуре, что и в первой части примера 1. Комплекс, полученный таким образом, затем смешивают с 10,0 г ПЭГ-ГТР, завершая изготовление, как описано во второй части примера 1. Пример 13. Рутин ПВП (М.В.=2000-3000 ) Кремофор ЭЛ Бензалкония хлорид Дистиллированная вода Раствор изготавливают по следующей методике: 1,0 г (1,63 ммоля) рутина и 30,0 г (12 ммолей) ПВП (М.В.=2000-3000) обрабатывают, следуя той же процедуре, что и в первой части примера 1. Полученный таким образом комплекс затем смешивают с 10,0 г ПЭГ-ГТР, завершая изготовление, как описано во второй части примера 1. Данное изобретение было описано с особым обращением к некоторым его конкретным осуществлениям, но должно быть понятно, что опытными специалистами могут быть сделаны 16 модификации и замены без выхода из объема этого изобретения, что определено прилагаемой формулой изобретения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ повышения растворимости в воде и водных носителях слабо растворимых в воде фармакологически активных веществ,включающий последовательно следующие операции: 1) образование комплекса такого фармакологически активного вещества с фармацевтически приемлемым неионным полимером, способным к образованию комплексов с указанным фармакологически активным веществом, и выделения комплекса в твердом виде; 2) повторное растворение полученного таким образом комплекса в водной среде с помощью фармацевтически приемлемого неионного поверхностно-активного вещества. 2. Способ по п.1, при котором указанная операция 1) осуществляется путем растворения в одном или более из органических растворителей, отдельно или вместе указанного фармакологически активного вещества и указанного неионного полимера с последующим объединением двух растворов вместе в случае, когда растворение производились отдельно, и соосаждения полученного комплекса путем выпаривания указанных, одного или более, растворителей. 3. Способ по п.2, при котором указанная операция 1) включает следующие стадии: 1 а) объединение и смешивание до растворения, отдельно или вместе, указанного фармакологически активного вещества и указанного неионного полимера с указанными, одним или более, органических растворителей таким образом, что композиция полученного общего раствора представляет собой следующее: от 0,05 до 10% фармацевтически активного вещества; от 1 до 50% неионного полимера и от 5 до 50% одного органического растворителя или смеси органических растворителей,причем все вышеуказанные процентные количества являются весовыми, и 1b) выпаривание одного или более растворителей с получением указанного комплекса в твердом виде. 4. Способ по п.2 или 3, при котором указанная операция 2) включает следующую стадию: 2 а) добавление воды или водного носителя и от 1 до 50% неионного поверхностноактивного вещества к указанному комплексу в твердом виде. 5. Способ по любому из предшествующих пунктов, где указанный фармацевтически приемлемый неионный полимер, способный к образованию комплексов, выбирается из группы,состоящей из поливинилпирролидона (ПВП), 17 циклодекстринов, полиэтиленгликоля (ПЭГ),полипропиленгликоля (ППГ), простых эфиров целлюлозы и декстрана. 6. Способ по п.5, где указанный неионный полимер является растворимым ПВП, имеющим средний молекулярный вес, находящийся в интервале от 2000 до 1500000. 7. Способ по любому из предшествующих пунктов, где указанное неионное поверхностноактивное вещество выбирается из группы, состоящей из сложных эфиров жирных кислот и сахарозы, простых эфиров жирных спиртов и олигогликозидов, сложных эфиров жирных кислот и глицерина, сложных эфиров жирных кислот и сорбитана, сложных эфиров полиэтоксилированных жирных кислот и сорбитана, сложных эфиров жирных кислот и поли(этиленоксида), простых эфиров жирных спиртов и поли(этиленоксида), простых эфиров 18 алкилфенола и поли(этиленоксида), простых эфиров алкилфенола и поли(этиленоксида),блоксополимеров полиоксиэтиленаполиоксипропилена, этоксилированных жиров и масел. 8. Способ по п.7, где указанное поверхностно-активное вещество является полиэтиленгликоль-глицерилтририцинолеатом (ПЭГ-ГТР). 9. Способ по любому из пп.2-8, где указанные один или более органических растворителей выбираются из группы, состоящей из одноатомных спиртов из 1-4 атомов углерода, кетонов, хлорированных растворителей. 10. Способ по любому из предшествующих пунктов, где указанное фармакологически активное вещество выбирается из группы, состоящей из форсколина, дапипразола, толрестата, пироксикама, формокортала, рутина, руфлоксацина, амфотерицина В.
МПК / Метки
МПК: A61K 47/48
Метки: фармацевтически, солюбилизации, активных, ингредиентов, водных, носителях, способ, воде
Код ссылки
<a href="https://eas.patents.su/10-2326-sposob-solyubilizacii-farmacevticheski-aktivnyh-ingredientov-v-vode-i-v-vodnyh-nositelyah.html" rel="bookmark" title="База патентов Евразийского Союза">Способ солюбилизации фармацевтически активных ингредиентов в воде и в водных носителях</a>
Предыдущий патент: Устройство и способ связи с указанием маршрута
Следующий патент: Способ производства химически высокоактивной извести в печи
Случайный патент: Производное гидрокси-6-гетероарилфенантридина и его применение в качестве ингибитора pde4