Способы лечения комбинированных лучевых и тепловых поражений
Формула / Реферат
1. Способ лечения индивида, подвергшегося комбинированному поражению: (i) воздействию на весь организм ионизирующего излучения и (ii) ожогам, включающий введение указанному индивиду в количестве, эффективном для лечения последствий облучения и/или термического воздействия, пептида, содержащего по меньшей мере 5 аминокислот пептида с последовательностью SEQ ID NO:1 (Asp-Arg-Nle-Tyr-Ile-His-Pro) или его фармацевтической соли.
2. Способ по п.1, который приводит к улучшению выживания пациента по сравнению с контролем.
3. Способ по п.1 или 2, который приводит к ускоренному заживанию ожога по сравнению с контролем.
4. Способ по любому из пп.1-3, в котором индивид получил ожоги второй степени одной или более частей тела: туловища, спины, головы, руки или ноги.
5. Способ по любому из пп.1-4, в котором индивид подвергся воздействию на весь организм ионизирующего излучения в дозе от 0,2 до 10 Гр.
6. Способ по любому из пп.1-4, в котором индивид подвергся воздействию на весь организм ионизирующего излучения в дозе от 1 до 10 Гр.
7. Способ по любому из пп.1-4, в котором индивид подвергся воздействию на весь организм ионизирующего излучения в дозе от 2 до 10 Гр.
8. Способ по любому из пп.1-7, в котором индивид подвергся воздействию на весь организм ионизирующего излучения в суммарной дозе по меньшей мере 20 Гр.
9. Способ по любому из пп.1-8, в котором воздействие на весь организм ионизирующего излучения выбирают из группы, состоящей из бета-излучения, гамма-излучения и рентгеновского излучения.
10. Способ по любому из пп.1-9, в котором воздействие на весь организм ионизирующего излучения производится в результате облучения источником радиации, выбираемым из группы, состоящей из ядерного оружия, атомных энергетических станций, оборудования для компьютерной томографии, оборудования для получения рентгеновского излучения, излучателей, используемых при пересадке костного мозга, средств доставки ядерных боеприпасов, окружающей среды, загрязненной радиоактивными веществами.
11. Способ по любому из пп.1-10, в котором указанный пептид вводят в организм пациента не позднее трех суток с момента воздействия на весь организм ионизирующей радиации.
12. Способ по любому из пп.1-11, в котором указанный пептид содержит пептид с последовательностью SEQ ID NO:1 (Asp-Arg-Nle-Tyr-Ile-His-Pro) или его фармацевтическую соль.
13. Способ по любому из пп.1-11, в котором указанный пептид состоит из пептида с последовательностью SEQ ID NO:1 (Asp-Arg-Nle-Tyr-Ile-His-Pro) или его фармацевтической соли.
Текст
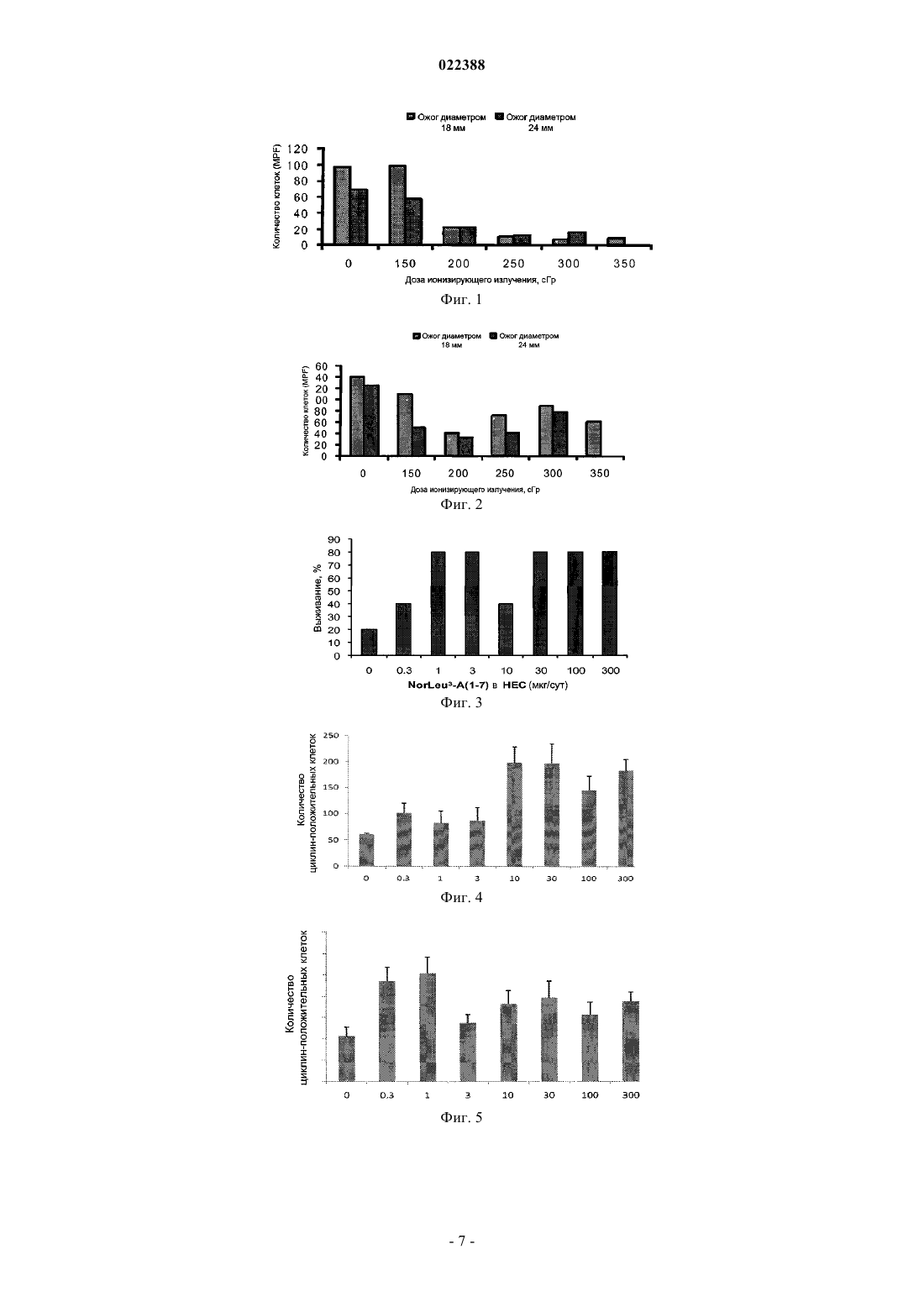
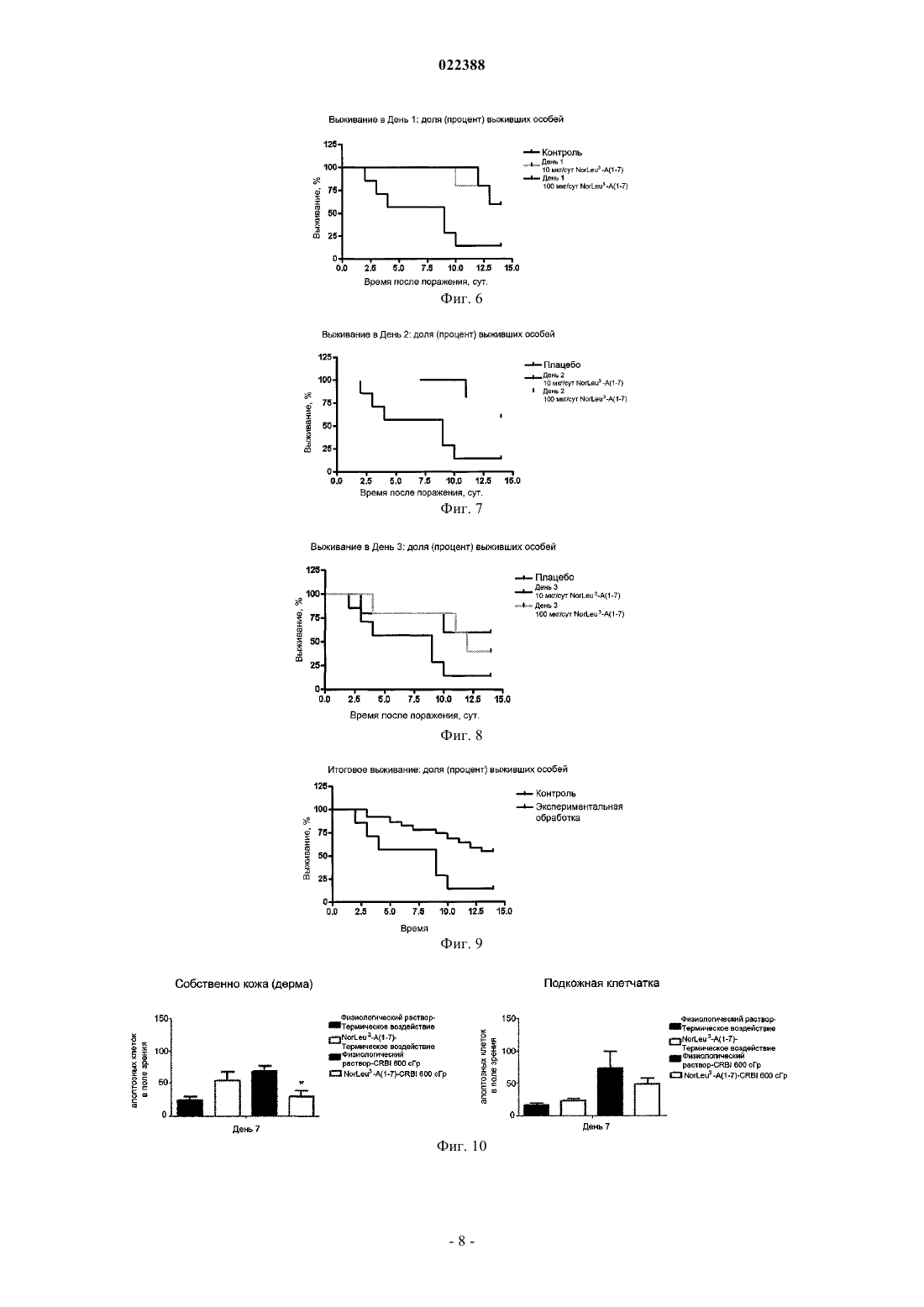
СПОСОБЫ ЛЕЧЕНИЯ КОМБИНИРОВАННЫХ ЛУЧЕВЫХ И ТЕПЛОВЫХ ПОРАЖЕНИЙ Изобретение предлагает способы лечения лиц, подвергшихся комбинированному поражению,сочетающему воздействие на весь организм ионизирующей радиации и ожоги.(71)(73) Заявитель и патентовладелец: УНИВЕРСИТИ ОФ САТЕРН КАЛИФОРНИЯ (US) Родственные заявки Данная заявка претендует на приоритет относительно предварительной заявки на патент США 61/317897, поданной 26 марта 2010 г. и полностью включаемой в настоящий документ путем отсылки. Декларация поддержки правительства США Настоящее изобретение осуществлено при поддержке правительства США по грантам под номерами RC1AI080976 и 3RC1AI080976S1, предоставленных Национальным институтом аллергических и инфекционных заболеваний. Правительство США имеет определенные права на данное изобретение. Уровень техники Известно, что воздействие излучения замедляет заживление ран. Этот эффект наблюдается у людей,подвергшихся интенсивному облучению, как, например, у тех, кто находился в Хиросиме и Нагасаки во время атомной бомбардировки и в Чернобыле или его окрестностях во время аварии на Чернобыльской атомной электростанции. У лиц, подвергшихся сильному воздействию ионизирующего излучения, вероятны не только лучевая болезнь, но также поражения, вызванные тепловым воздействием вследствие взрывов и пожаров. Таким образом, нужны методы лечения больных с комбинированными радиационнотермическими поражениями. Раскрытие изобретения В настоящем изобретении предлагаются способы лечения индивидов, страдающих от комбинированного (i) воздействия на весь организм ионизирующего излучения (TBI) и (ii) ожогов, включающие введение больному в количестве, эффективном для купирования эффектов облучения и/или лечения ожогов, пептида, содержащего по меньшей мере 5 аминокислот из пептида с последовательностью SEQID NO:1 (Asp-Arg-Nle-Tyr-Ile-His-Pro) или его фармацевтической соли. В одном из воплощений настоящего изобретения предлагаемый способ приводит к улучшению выживаемости указанных индивидов по сравнению с контрольными. В другом воплощении данного изобретения предлагаемый способ ускоряет заживление ожогов у указанных индивидов по сравнению с контрольными. В еще одном воплощении настоящего изобретения указанный индивид имел ожоги второй степени тяжести в одном или более местах туловища, спины, головы, рук или ног. В другом воплощении настоящего изобретения весь организм указанного индивида подвергался воздействию ионизирующего излучения в поглощенной дозе от 0,3 до 10 Гр; в еще одном воплощении настоящего изобретения весь организм указанного индивида подвергался воздействию ионизирующего излучения в поглощенной дозе от 1 до 10 Гр или от 2 до 10 Гр. В другом воплощении суммарная доза облучения всего организма индивида составляла по меньшей мере 20 Гр. В еще одном воплощении настоящего изобретения воздействие ионизирующего излучения на весь организм индивида выбирают из группы, состоящей из бета-излучения, гамма-излучения и рентгеновского излучения. В другом воплощении настоящего изобретения воздействие ионизирующего излучения на весь организм индивида происходит по причине присутствия источника радиации, выбираемого из группы, состоящей из ядерного оружия, атомных энергетических станций, оборудования для компьютерной томографии, оборудования для получения рентгеновского излучения, излучателей, используемых при пересадке костного мозга, средств доставки ядерных боеприпасов, окружающей среды, загрязненной радиоактивными веществами. В другом воплощении настоящего изобретения предлагаемый пептид вводится в пределах трех суток после воздействия ионизирующего излучения на весь организм индивида. В следующих воплощениях настоящего изобретения указанный пептид содержит пептид с последовательностью SEQ ID NO:1 (Asp-Arg-Nle-Tyr-Ile-His-Pro) или его фармацевтическую соль либо состоит из пептида с последовательностью SEQ ID NO:1 (Asp-Arg-Nle-Tyr-Ile-His-Pro) или его фармацевтической соли. Краткое описание рисунков Фиг. 1 - влияние дозы TBI и размеров ожоговой раны на циклин-положительные клетки в области поражения у морских свинок. Фиг. 2 - влияние дозы TBI и размеров ожоговой раны на циклин-положительные клетки по краям области термического поражения у морских свинок. Фиг. 3 - влияние NorLeu3-A(1-7) на выживание морских свинок с комбинированным лучевым и тепловым поражением (CRBI) после воздействия ионизирующего излучения на весь организм (TBI) в дозе 200 сГр. Фиг. 4 - NorLeu3-A(1-7) увеличивает число пролиферирующих клеток среди кератиноцитов базального слоя кожи по краям ожоговой раны. Фиг. 5. NorLeu3-A(1-7) увеличивает число пролиферирующих клеток в волосяных фолликулах по краям ожоговой раны. Фиг. 6 - влияние NorLeu3-A(1-7) на выживание морских свинок с комбинированным лучевым и тепловым поражением (CRBI) после воздействия ионизирующего излучения на весь организм (TBI) в дозе 200 сГр. Фиг. 7 - влияние NorLeu3-A(1-7) на выживание морских свинок с комбинированным лучевым и тепловым поражением (CRBI) после воздействия ионизирующего излучения на весь организм (TBI) в дозе 200 сГр. Фиг. 8 - влияние NorLeu3-A(1-7) на выживание морских свинок с комбинированным лучевым и тепловым поражением (CRBI) после воздействия ионизирующего излучения на весь организм (TBI) в дозе 200 сГр. Фиг. 9 - влияние NorLeu3-A(1-7) на выживание морских свинок с комбинированным лучевым и тепловым поражением (CRBI) после воздействия ионизирующего излучения на весь организм (TBI) в дозе 200 сГр. Фиг. 10 - NorLeu3-A(1-7) уменьшает апоптоз в собственно коже (дерме) и подкожной клетчатке в месте термического поражения у мышей после комбинированного поражения (CRBI) (воздействие температуры 70 С в течение 10 с после облучения всего организма в дозе 600 сГр), но не имеет такого эффекта при одном только термическом поражении. Осуществление изобретения В настоящем изобретении предлагаются способы лечения индивида, пострадавшего от комбинированного поражения, включающего (i) воздействие на весь организм ионизирующего излучения и (ii) ожогов; эти способы включают введение индивиду пептида, содержащего по меньшей мере 5 аминокислот пептида с последовательностью SEQ ID NO:1 (Asp-Arg-Nle-Tyr-Ile-His-Pro), в количестве, эффективном для лечения последствий облучения и/или ожога. Известно, что из-за воздействия ионизирующего излучения заживление ран замедляется; этот эффект наблюдается у лиц, подвергшихся высокому уровню облучения. Поэтому вещества, способствующие заживлению ран, могут оказаться неэффективными для лечения ран или ожогов, полученных в сочетании с воздействием на весь организм ионизирующей радиации. Авторы настоящего изобретения обнаружили, что введение больным с комбинированным радиационно-термическим поражением вещества,обозначаемого Nle A(1-7), дает неожиданный положительный эффект, а именно улучшает заживление ожогов и увеличивает общую выживаемость больных с такими поражениями. Как известно в данной области техники, "Nle A(1-7)" представляет собой пептид с аминокислотной последовательностью Asp-Arg-Nle-Tyr-Ile-His-Pro. В различных воплощениях настоящего изобретения этот пептид содержит аминокислотные последовательности Asp-Arg-Nle-Tyr-Ile (Nle A(1-5 (SEQ IDNO:3), Asp-Arg-Nle-Tyr-Ile-His (Nle A(1-6 (SEQ ID NO:2) или Nle A(1-7) или же состоит из них. Настоящее изобретение применимо при воздействии любого ионизирующего излучения, сопровождающегося ожогами, например, при лечебном или случайном воздействии рентгеновского излучения,гамма- или бета-излучения. Примеры воздействия ионизирующего излучения, в которых применимы способы по настоящему изобретению, включают (не ограничиваясь перечисленным ниже): лучевую терапию в клинических условиях; медицинскую диагностику с использованием радиоактивных маркеров; воздействие природных источников ионизирующего излучения, как, например, урана или радона; воздействие радиации во время военных действий (например, при применении ядерного оружия); случайное воздействие, связанное с профессиональной деятельностью (работой на атомных станциях, научными или медицинскими исследованиями, обслуживанием оборудования для компьютерной томографии,рентгенографии, излучателей, применяемых при пересадке костного мозга, носителей ядерного оружия),или загрязнением окружающей среды радиоактивными веществами. Пациентом по данному изобретению может быть любой индивид, которому принесут пользу способы по данному изобретению. В одном из воплощений данного изобретения пациентом является млекопитающее, например человек; пациентами могут быть также домашние животные (питомцы) и сельскохозяйственные животные, включая (но не ограничиваясь перечисленным здесь) крупный рогатый скот,овец, коз, свиней и кур. В настоящем документе выражение "воздействие ионизирующего излучения на весь организм" означает облучение источником радиации, повлиявшее на многие системы органов. В одном из воплощений данного изобретения пациент подвергался воздействию ионизирующего излучения на весь организм в дозе от 0,2 до 12 Гр или более; в другом воплощении пациент подвергался воздействию ионизирующего излучения на весь организм в дозе от 1 до 12 Гр или более; от 2 до 12 Гр или более; от 0,2 до 10 Гр или более; от 1 до 10 Гр или более; от 2 до 10 Гр или более; от 2,5 до 10 Гр или более; от 3 до 10 Гр или более; от 3,5 до 10 Гр или более; от 4 до 10 Гр или более; от 4,5 до 10 Гр или более; от 5 до 10 Гр или более; от 5,5 до 10 Гр или более; от 6 до 10 Гр или более; от 6,5 до 10 Гр или более; от 7 до 10 Гр или более; от 7,5 до 10 Гр или более; от 8 до 10 Гр или более; от 8,5 до 10 Гр или более; от 9 до 10 Гр или более; более 10 или более 12 Гр. В другом воплощении данного изобретения пациент подвергался воздействию ионизирующего излучения на весь организм в суммарной дозе по меньшей мере 20 сГр. В различных иных воплощениях данного изобретения пациент подвергался воздействию ионизирующего излучения на весь организм в суммарной дозе по меньшей мере 25, 30, 35, 40,45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100 сГр или более. Ожог по данному изобретению может быть любой степени тяжести, предпочтительно затрагивающий часть толщи кожи (например, второй степени) в любом месте тела, включая (но не ограничиваясь перечисленным ниже) туловище, спину, голову, руки или ноги. Ожог по данному изобретению может быть любого размера, предпочтительно, по меньшей мере, площадью 3 см 2, более предпочтительно по меньшей мере 4, 5, 6, 7, 8, 9 или 10 см 2. В одном из дальнейших воплощений настоящего изобретения пациент имеет ожоги (например, второй степени тяжести), охватывающие по меньшей мере 10, 20, 30,40, 50, 60, 79% или более общей площади поверхности тела. В одном предпочтительном воплощении настоящего изобретения введение предлагаемого пептида осуществляется в пределах 0, 1, 2 или 3 суток после воздействия ионизирующего излучения. В другом предпочтительном воплощении настоящего изобретения указанный пептид вводят в количестве 1 мкг на рану или более; более предпочтительно в количестве 10 мкг на рану или более. В различных предпочтительных воплощениях настоящего изобретения предлагаемый пептид вводят в дозировке 10 мкг/см 2, 50 мкг/сут, 100 мкг/сут, 200 мкг/см 2, 250 мкг/сут, 300 мкг/см 2, 350 мкг/см 2, 400 мкг/см 2, 450 мкг/см 2, 500 мкг/сут или более. В настоящем документе слова "лечить", "лечение" означают осуществление одного или более из следующего: (а) снижение степени тяжести ожогов или эффектов воздействия ионизирующего излучения; (b) ограничение или предотвращение развития симптомов, характерных для лучевого поражения; (с) торможение усугубления симптомов, характерных для лучевого поражения; (d) ускорение заживания ожога по сравнению с контролем; (е) улучшение выживания. Биологические эффекты воздействия излучения зависят от ряда факторов, как, например, от полученной дозы радиации, продолжительности воздействия излучения, а также от того, какие конкретно органы поражены. Не ограничивающие объема изобретения примеры эффектов воздействия ионизирующей радиации на все тело включают тошноту,рвоту, понос, нарушение функций центральной нервной системы (например, нарушение умственной деятельности, судороги, дрожь, атаксию), лейкопению, деструктивные изменения костного мозга, деструктивные изменения кишечника, инфекции (бактериальные, вирусные, грибковые и проч.), шок, гипотензию, геморрагические явления и смерть. В различных воплощениях настоящего изобретения вводимое пациенту количество предлагаемого пептида или его фармацевтической соли достаточно для обеспечения дозировок, указанных выше. В репрезентативных воплощениях настоящего изобретения, количество предлагаемого пептида или его фармацевтической соли достаточно для обеспечения дозы от 0,01 мкг на 1 кг массы тела индивида до 10 мг/кг; от 0,1 до 5 мг/кг; от 0,1 до 1000 мкг/кг; от 0,1 до 900 мкг/кг; от 0,1 до 900 мкг/кг; от 0,1 до 800 мкг/кг; от 0,1 до 700 мкг/кг; от 0,1 до 600 мкг/кг; от 0,1 до 500 мкг/кг или от 0,1 до 400 мкг/кг. Подходящие кислоты, способные образовывать соли с пептидом по данному изобретению, включают неорганические кислоты, например соляную, бромисто-водородную, хлорную, азотную, тиоциановую (роданисто-водородную), серную, фосфорную кислоты и т.п.; органические кислоты, например муравьиную, уксусную, пропионовую, гликолевую, молочную, пировиноградную, щавелевую, малоновую,янтарную, малеиновую, фумаровую, антраниловую, коричную, нафталинсульфоновую, сульфаниловую кислоты и т.п. Подходящие основания, способные образовывать соли с пептидом по данному изобретению, включают неорганические основания, например гидроксид натрия, гидроксид аммония, гидроксид калия и т.п.; органические основания, например моно-, ди- и триаклил- и ариламины (например, триэтиламин, диизопропиламин, метиламин, диметиламин и т.п.) и при необходимости замещенные этаноламины (например, этаноламин, диэтаноламин и т.п.) Фармацевтические композиции для применения в способах по данному изобретению могут быть представлены твердыми формами (включая гранулы, порошки или суппозитории) или жидкими формами(например, растворами, суспензиями или эмульсиями). Фармацевтические композиции по данному изобретению могут применяться в различных растворах. Для применения по данному изобретению пригодны стерильные растворы, содержащие в растворенном виде достаточное количество Nle A(1-7) и не вредные при предлагаемом применении. В этой связи отметим, что соединения по данному изобретению являются весьма стабильными, но подвергаются гидролизу под действием сильных кислот и оснований. Соединения по данному изобретению растворимы в органических растворителях и в водных растворах при рн 5-8. Фармацевтические композиции по данному изобретению могут подвергаться обычным фармацевтическим обработкам, как, например, стерилизации, и/или могут содержать обычные вспомогательные ингредиенты. В одном из воплощений настоящего изобретения получают фармацевтическую композицию для местного подкожного применения, причем пептид по данному изобретению или его соль могут содержаться в ней в количестве от 0,0001 до 10% (мас./мас.); в одном воплощении - не более 5%(мас./мас.), а в другом - от 0,01 до 2% (мас./мас.) от общей массы композиции. В другом воплощении настоящего изобретения предлагаемый пептид или его соль представлены стабильной лиофилизованной формой, которую можно превратить в жидкую форму разведением в подходящем для этого растворителе, в результате чего получается восстановленная фармацевтическая композиция по данному изобретению, пригодная для подкожного введения. При восстановлении при помощи растворителя, содержащего консервант (например, бактериостатической воды для инъекций), восстановленная композиция может использоваться как многоцелевой препарат. Такой препарат полезен, например, когда пациенту требуется часто подкожно вводить пептид по данному изобретению. Преимущество многоцелевого препарата в том, что его легче применять, а также потому, что благодаря полному использованию содержимого емкости сокращаются отходы и это существенно уменьшает расходы производителя, поскольку несколько доз находятся в одной емкости (меньшие затраты на расфасовку и транспортировку). Такие восстановленные композиции также удобны для применения в случаях других парентеральных способов введения. Пептид или его соли по данному изобретению можно вводить пациенту любым подходящим путем,включая (но не ограничиваясь этим перечислением) кожное, подкожное, интрадермальное и трансдермальное (например, с помощью полимеров, обеспечивающих медленное высвобождение активного вещества), внутримышечное, интраперитонеальное, внутривенное, пероральное, внутриушное, эпидуральное, ректальное или вагинальное (например, при помощи суппозиториев), интраназальное введение, капельное или струйное вливание, поглощение через эпителий или слизистые. В одном из предпочтительных воплощений настоящего изобретения пептид или его соли вводят пациенту через кожу, причем они входят в состав местного препарата, например с гидроксиэтилцеллюлозой (НЕС). В одном воплощении настоящего изобретения этот препарат защищен от разрушения в процессе хранения. Фармацевтические композиции по данному изобретению обычно объединены с одним или более вспомогательным компонентом, подходящим для указанного пути введения. Эти соединения могут быть смешаны с лактозой, сахарозой, крахмалом (порошком), эфирами целлюлозы и карбоновых кислот, стеариновой кислотой, тальком, стеаратом магния, оксидом магния, натриевыми и кальциевыми солями фосфорной и серной кислот, аравийской камедью, желатином, альгинатом натрия, поливинилпирролидоном и/или поливиниловым спиртом, а также они могут быть изготовлены в форме таблеток или капсул для удобства введения. Или же соединения по данному изобретению можно растворить в физиологическом растворе, воде, полиэтиленгликоле, пропиленгликоле, коллоидных растворах карбоксиметилцеллюлозы, коллоидных растворах гидроксиэтилцеллюлозы, этиловом спирте, кукурузном масле, арахисовом масле, льняном масле, кунжутном масле, трагакантовой камеди и/или различных буферных растворах. В фармацевтике известны и другие вспомогательные вещества и способы введения препарата. Носитель или разбавитель в препарате по данному изобретению может включать задерживающие агенты, например глицерилмоностеарат или глицерилдистеарат сами по себе либо с воском, или иные агенты, известные в данной области техники. В одном из предпочтительных воплощений настоящего изобретения предлагаемый пептид или фармацевтическая композиция применятся местно. При этом можно использовать любые средства местного применения, обеспечивающие поступление указанного пептида или фармацевтической композиции в обожженные ткани в течение какого-то периода времени. Например, участок ожога можно обработать водным раствором через повязку (марлю, бинт и т.п.); этот раствор можно составить таким образом, чтобы происходила медленная перфузия пораженных тканей (с помощью липосом, линиментов, мицелл и т. п.). Специалистам в данной области техники известны способы получения подобных препаратов с пептидами или фармацевтическими композициями по данному изобретению. Пептид по данному изобретению или его соли можно далее модифицировать, чтобы увеличить период полураспада препарата, например путем связывания с полиэтиленгликолем. Указанный пептид или его соли может содержать L-аминокислоты, D-аминокислоты (устойчивые к протеазам, расщепляющимL-аминокислоты в живом организме), комбинации L- и D-аминокислот, различные "целевые" (т.е. используемые для того, чтобы придать пептиду нужные свойства) аминокислоты (например, бетаметиламинокислоты, С-альфа-метиламинокислоты, N-альфа-метиламинокислоты и др.). Синтетические аминокислоты включают норлейцин вместо изолейцина. Кроме того, пептид по данному изобретению или его соли может содержать пептидомиметические связи. Так, можно создать пептид, содержащий редуцированную пептидную связь, например R1-CH2-NHR2, где R1 и R2 представляют аминокислотные остатки или последовательности. Редуцированная пептидная связь может быть включена в нужное соединение в виде дипептидной субъединицы. Такие полипептиды устойчивы к расщеплению протеазами и обладают увеличенным периодом полураспада in vivo. Пептид по данному изобретению или его соли может быть синтезирован или получен с помощью методов рекомбинантной ДНК; эти подходы могут быть осуществлены стандартными, известными в данной области техники способами. Соединение Nle A(1-7) или его соли можно вводить пациенту в порядке самостоятельного лечебного мероприятия или в сочетании с другими медикаментозными или иными методами лечения, показанными при данном состоянии пациента, включая (но не ограничиваясь перечисленным ниже) гидрогели,коллагеновые губки и бекаплермин. Пример 1. Животная модель (морские свинки) комбинированного лучевого поражения всего организма (CRBI). Для модельного изучения комбинированного поражения использовали морских свинок. Разработка модели включала определение пяти уровней облучения всего организма (TBI) в сочетании с термическими поражениями двух размеров с целью установить комбинацию, оптимальную для задержки заживления с минимальной смертностью. Имел место неприемлемый уровень смертности, в частности при обширных ожогах в сочетании с облучением в двух наивысших дозах. Задерживающий заживление эффект TBI количественно определяли по числу циклин-положительных клеток в базальном слое эпидермиса и нижней части волосяных фолликулов. На фиг. 1 и 2 представлены данные о пролиферации указанных клеток у подопытных животных на 14-е сутки. При облучении всего организма в дозе 200 сГр и выше наблюдалось соответствующее уменьшение числа делящихся клеток в волосяных фолликулах в области прикрепления мышцы, поднимающей волос, к наружному эпителиальному влагалищу корня волоса и среди кератиноцитов базального слоя как в центральной части ожоговой раны, так и по ее кра-4 022388 ям. Поскольку и те, и другие клетки участвуют в эпителизации ран от термических поражений, при облучении в дозе 200 сГр в сочетании с термическим поражением увеличивалась смертность и сокращалось заживление. Пример 2. Эффективность NorLeu3-A(1-7) на модели CRBI. В следующем эксперименте облучение в дозе 200 сГр сочетали с ожогами размером 18 мм и определяли реакцию на обработку NorLeu3-A(1-7). В тот день, когда животное получало термическое поражение, и ежедневно на протяжении последующих 14 суток на место поражения наносили NorLeu3-A(1-7) в различных концентрациях (0-300 мкг/сут) (см. фиг. 3). Применение NorLeu3-A(1-7) в дозировке 1 мкг/рану/сут и более снижал смертность, связанную с комбинированным поражением у морских свинок. При дозировке NorLeu3-A(1-7) 10 мкг/сут и более не наблюдалось увеличения числа клеток среди кератиноцитов базального слоя кожи по краям ожоговой раны (фиг. 4). При всех дозировках (кроме 3 мкг/рану/сут) NorLeu3-A(1-7) вызывал увеличение числа пролиферирующих клеток в волосяных фолликулах в области прикрепления мышцы, поднимающей волос, к наружному эпителиальному влагалищу корня волоса по краям ожоговой раны (фиг. 5). Пример 3. Определение времени начала применения NorLeu3-A(1-7) у морских свинок. Второй эксперимент на этой модели проводили с целью определить, как долго можно не начинать обработку ожоговой раны NorLeu3-A(1-7) без потери снижения смертности. В этом эксперименте животных подвергали облучению (TBI) в дозе 200 сГр и через 2 ч термическому поражению. В день 0 начинали применять плацебо. Обработку NorLeu3-A(1-7) в дозировке 10 или 100 мкг/сут начинали в день 0, 1, 2,3 либо 4. Когда обработку начинали в день 0, 1, 2 или 3, выживало приблизительно 40-60% особей, тогда как среди особей, получавших плацебо, выживало 14% (фиг. 6-9). Однако, если применение пептида начинали не ранее 4-го дня после нанесения поражения, его эффективность снижалась. Методы Для этих экспериментов брали самцов морской свинки линии Hartley с массой тела приблизительно 500 г, предоставленных Charles Rivers Laboratory (Чарльз-Риверз, шт. Массачусетс, США). Животных содержали при стандартном световом режиме (12 ч свет/12 ч темнота) в вивариях USC. Животных облучали (TBI) в дозе 200 сГр при помощи излучателя цезий-137. Через 1-2 ч животные получали термическое поражение. Термическое поражение и послеоперационную обработку осуществляли, как описано в работе Rodgers et al., 1997a,b, 2001, что вкратце состояло в следующем. Каждой из подопытных особей делали анестезию и наносили два ожога при помощи медной палочки диаметром 18 мм, которую нагревали в водяной бане с температурой 75 С и затем прикладывали ее торцом к спинке животного на 50 с. Ожоговую рану обрабатывали 2%-ной гидроксиэтилцеллюлозой (НЕС) в качестве носителя для местного применения препарата, в которую добавляли (либо не добавляли) NorLeu3-A(1-7) в 0,05-молярном фосфатном буферном растворе с рН 6,5, и накладывали повязку. Эту обработку начинали в различные моменты времени после TBI и термического поражения, как указано ниже. На 14-й день после термического поражения животных умерщвляли, область ожога иссекали целиком и тканевый лоскут помещали в 10%-ный забуференный раствор формальдегида, оставляя там на ночь. Заживление количественно оценивали по числу делящихся клеток в участке поражения. Иммуногистохимическое окрашивание проводили с использованием комплекса авидин-биотинпероксидаза. После окончательного промывания в фосфатном буферном растворе (PBS) срезы ткани инкубировали в 0,06%-ном растворе 3,3'-диаминобензидина в PBS с 0,03% перекиси водорода в течение 5 минут. После противоокрашивания с модифицированным гематоксилином Гарриса и эозином срезы обезвоживали и заключали под покровное стекло в среде Permount. С помощью препаровального стереомикроскопа Olympus Vanox-S AH-2 при увеличении 100 каждый срез биоптатов разделяли на зоны - края ожоговой раны и центральная ее часть. Всю область ожоговой раны и ее краев заливали и исследовали гистологически. В каждом срезе анализировали 4-6 последовательных полей зрения при среднем увеличении (mpf, 100). Клетки, которые окрашивались антителами MIB-1, были отчетливо коричневого цвета. Подсчитывали все окрашенные клетки, расположенные в волосяных фолликулах срезов биоптатов. Чтобы подсчитать окрашенные MIB-1 клетки, каждый срез на предметном стекле разделяли на отдельные поля зрения при среднем увеличении (mpf). Каждое поле затем определяли как принадлежащее краевой зоне ожоговой раны либо ее центральной части. Краевая зона указывалась положительным окрашиванием, демонстрирующим коричневые эпителиальные клетки вдоль края среза. Центральная часть ожоговой раны указывалась отсутствием коричневых окрашивающихся клеток вдоль края. Коричневые клетки, расположенные в пределах каждого волосяного фолликула, подсчитывали по одной при среднем (mpf) увеличении. Чтобы перейти к следующему полю зрения,делали отметку и предметное стекло сдвигали к следующему полю. Результаты Второй эксперимент проводили на этой модели с целью определить продолжительность задержки лечения, при которой смертность все еще снижается. В этом эксперименте морские свинки подвергались облучению всего организма (TBI) в дозе 200 сГр и через 2 ч - термическому поражению. Обработку плацебо начинали в день 0. Обработку NorLeu3-A(1-7) в дозировке 10 или 100 мкг/сут начинали в день 0, 1,-5 022388 2, 3 или 4. Когда эту обработку начинали в день 0, 1, 2 или 3 после CRBI, выживание возрастало приблизительно до 40-60% по сравнению с 14% у особей, получавших плацебо (фиг. 7). Но если обработку не начинали ранее 4-го дня, ее эффективность снижалась. Пример 4. Термическое поражение состояло в том, что мышам обжигали 7% поверхности тела воздействием температуры 70 С в течение 10 с (с обезболиванием кетамином/ксилазином). Комбинированное поражение состояло в том, что мышей облучали (TBI) с помощью цезиевого излучателя в дозе 6 Гр и через 2 часа после этого подвергали термическому воздействию, как указано выше. Лечебную обработку по данному изобретению начинали сразу после термического поражения и на ожоговую рану накладывали пленочную повязку Tegaderm. Обработку проводили ежедневно раствором концентрацией 1 мг/мл из расчета 100 мкл на рану. На 7-й день животных умерщвляли. Определяли апоптоз в коже методом мечения концов фрагментов ДНК (TUNEL). Полученные данные представлены на фиг. 10. ИспользованиеNorLeu3-A(1-7) обеспечивает дополнительные возможности для улучшения заживления поражений, полученных на фоне эффекта воздействия ионизирующего излучения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ лечения индивида, подвергшегося комбинированному поражению: (i) воздействию на весь организм ионизирующего излучения и (ii) ожогам, включающий введение указанному индивиду в количестве, эффективном для лечения последствий облучения и/или термического воздействия, пептида,содержащего по меньшей мере 5 аминокислот пептида с последовательностью SEQ ID NO:1(Asp-Arg-Nle-Tyr-Ile-His-Pro) или его фармацевтической соли. 2. Способ по п.1, который приводит к улучшению выживания пациента по сравнению с контролем. 3. Способ по п.1 или 2, который приводит к ускоренному заживанию ожога по сравнению с контролем. 4. Способ по любому из пп.1-3, в котором индивид получил ожоги второй степени одной или более частей тела: туловища, спины, головы, руки или ноги. 5. Способ по любому из пп.1-4, в котором индивид подвергся воздействию на весь организм ионизирующего излучения в дозе от 0,2 до 10 Гр. 6. Способ по любому из пп.1-4, в котором индивид подвергся воздействию на весь организм ионизирующего излучения в дозе от 1 до 10 Гр. 7. Способ по любому из пп.1-4, в котором индивид подвергся воздействию на весь организм ионизирующего излучения в дозе от 2 до 10 Гр. 8. Способ по любому из пп.1-7, в котором индивид подвергся воздействию на весь организм ионизирующего излучения в суммарной дозе по меньшей мере 20 Гр. 9. Способ по любому из пп.1-8, в котором воздействие на весь организм ионизирующего излучения выбирают из группы, состоящей из бета-излучения, гамма-излучения и рентгеновского излучения. 10. Способ по любому из пп.1-9, в котором воздействие на весь организм ионизирующего излучения производится в результате облучения источником радиации, выбираемым из группы, состоящей из ядерного оружия, атомных энергетических станций, оборудования для компьютерной томографии, оборудования для получения рентгеновского излучения, излучателей, используемых при пересадке костного мозга, средств доставки ядерных боеприпасов, окружающей среды, загрязненной радиоактивными веществами. 11. Способ по любому из пп.1-10, в котором указанный пептид вводят в организм пациента не позднее трех суток с момента воздействия на весь организм ионизирующей радиации. 12. Способ по любому из пп.1-11, в котором указанный пептид содержит пептид с последовательностью SEQ ID NO:1 (Asp-Arg-Nle-Tyr-Ile-His-Pro) или его фармацевтическую соль. 13. Способ по любому из пп.1-11, в котором указанный пептид состоит из пептида с последовательностью SEQ ID NO:1 (Asp-Arg-Nle-Tyr-Ile-His-Pro) или его фармацевтической соли.
МПК / Метки
МПК: A61K 38/08, A61P 17/02
Метки: комбинированных, лучевых, тепловых, лечения, способы, поражений
Код ссылки
<a href="https://eas.patents.su/10-22388-sposoby-lecheniya-kombinirovannyh-luchevyh-i-teplovyh-porazhenijj.html" rel="bookmark" title="База патентов Евразийского Союза">Способы лечения комбинированных лучевых и тепловых поражений</a>
Предыдущий патент: Диализный раствор, содержащий соединение креатина, набор и твердый препарат для его приготовления
Следующий патент: Способ и система упаковывания влажных или сухих твердых веществ
Случайный патент: Твердые амфотерные поверхностно-активные вещества