Способ получения феррохина конвергентным восстановительным аминированием
Номер патента: 20392
Опубликовано: 30.10.2014
Авторы: Матеос-Каро Хулия, Ферей Венсан, Вайрон Филипп, Винь Сильви, Мондьер Режи
Формула / Реферат
1. Способ получения феррохина формулы (F) или его метаболита формулы (Fm)
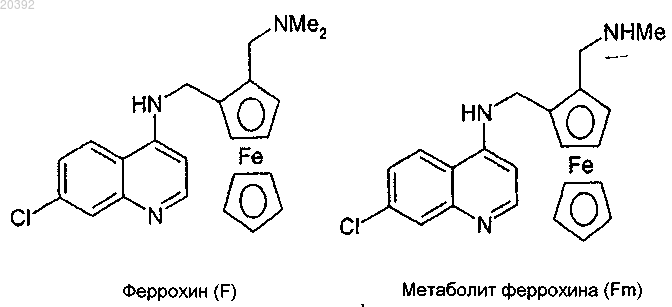
включающий реакцию восстановительного аминирования, в котором:
(i) альдегидаминоферроцен формулы (III)
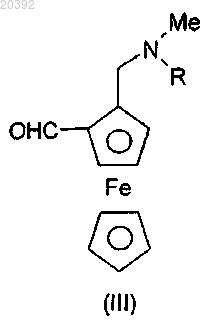
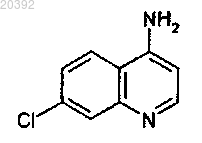
где R представляет собой атом водорода или метильную группу, конденсируют с 7-хлорхинолин-4-амином
(ii) полученный таким образом продукт конденсации формулы (II)
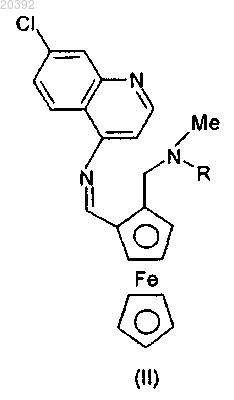
где R представляет собой атом водорода или метильную группу, восстанавливают,
(iii) реакционную смесь гидролизуют перед выделением феррохина формулы (F) или его метаболита формулы (Fm).
2. Способ по п.1, где указанные соединения 7-хлорхинолин-4-амин и альдегидаминоферроцен формулы (III) берут в стехиометрическом соотношении.
3. Способ по п.1 или 2, где реакцию восстановительного аминирования проводят в присутствии по крайней мере одного растворителя, выбранного из этанола, изопропанола, толуола, ТГФ, дихлорметана и их смесей.
4. Способ по любому одному из пп.1-3, где стадию конденсации 7-хлорхинолин-4-амина с альдегидаминоферроценом формулы (III) проводят в присутствии по крайней мере одной кислоты Льюиса, или по крайней мере одного основания, или кислоты Бренстеда.
5. Способ по любому одному из пп.1-4, где стадию конденсации 7-хлорхинолин-4-амина с альдегидаминоферроценом формулы (III) проводят при азеотропной отгонке растворителя реакции указанной стадии конденсации или в присутствии по крайней мере одного осушающего агента.
6. Способ по п.4, где кислоту Льюиса выбирают из Ti(OiPr)4, TiCl4, FeCl3, ZnCl2, AlCl3, BF3, BF3.OEt2 и BF3.S(Me)2.
7. Способ по п.6, где кислота Льюиса представляет собой Ti(OiPr)4.
8. Способ по любому одному из пп.4-7, где кислоту Льюиса используют в стехиометрическом соотношении или в избытке.
9. Способ по любому одному из пп.4-8, где кислоту Льюиса используют в количестве от 1 до 2 экв.
10. Способ по п.4, где стадию конденсации проводят в присутствии по крайней мере одной кислоты Бренстеда или основания Бренстеда, выбранных из уксусной кислоты, трифторуксусной кислоты, метансульфоновой кислоты, паратолуолсульфоновой кислоты, H2SO4, H3PO4, HNO3, пиперидина и пролина.
11. Способ по п.10, где стадию конденсации проводят в присутствии паратолуолсульфоновой кислоты или пиперидина.
12. Способ по п.5, где осушающий агент выбирают из оксида алюминия, молекулярного сита 3Å, MgSO4 и Na2SO4.
13. Способ по любому одному из пп.1-12, где стадию восстановления проводят в присутствии гидридов металлов, выбранных из боргидридов натрия, калия, лития или цинка, необязательно связанных по крайней мере с одной добавкой, выбранной из LiCl, CaCl2, MgCl2, ZnCl2 и NEt3.
14. Способ по п.13, где боргидриды натрия, калия, лития или цинка выбирают из NaBH(OAc)3, NaBH3CN, NaBH4, KBH4, LiBH4 и Zn (BH4)2, необязательно связанных с указанной добавкой.
15. Способ по п.14, где реакцию восстановления проводят в присутствии NaBH4, KBH4 и LiBH4, необязательно связанных с указанной добавкой.
16. Способ по любому одному из пп.1-5, где стадию конденсации проводят в присутствии паратолуолсульфоновой кислоты, при азеотропной отгонке растворителя реакции.
17. Способ по п.16, где стадию конденсации проводят в присутствии толуола.
18. Способ по п.16 или 17, где стадию восстановления проводят в присутствии NaBH4.
19. Способ по любому одному из пп.1-5, где стадию конденсации проводят в присутствии тетраизопропилата титана и изопропанола в качестве растворителя реакции.
20. Способ по любому одному из пп.1-5, где стадию конденсации проводят в присутствии 1 экв. Ti(OiPr)4 в этаноле и/или изопропаноле в качестве растворителя реакции, а стадия восстановления происходит в присутствии LiBH4 и/или KBH4.
21. Способ по любому одному из пп.1-5, где стадию гидролиза проводят в присутствии водного раствора лимонной кислоты.
Текст
СПОСОБ ПОЛУЧЕНИЯ ФЕРРОХИНА КОНВЕРГЕНТНЫМ ВОССТАНОВИТЕЛЬНЫМ АМИНИРОВАНИЕМ Данное изобретение относится к способу получения феррохина формулы (F) или его метаболита формулы (Fm), включающему реакцию восстановительного аминирования, при этом указанная реакция включает: (i) стадию конденсации альдегидаминоферроцена формулы (1), в которой R представляет собой атом водорода или метильную группу, с 7-хлорхинолинамином формулы (2),как показано ниже, после которой следует (ii) стадия восстановления продукта конденсации,полученного в предыдущей стадии, затем (iii) стадия гидролиза реакционной смеси в присутствии водного раствора аммиака или лимонной кислоты Настоящее изобретение относится к новому способу получения феррохина, применяемого, в частности, для лечения и/или профилактики малярии. Малярия является одной из преимущественных инфекционных причин смертности в мире и поражает ежегодно более 500 миллионов людей, из которых 3 миллиона умирает каждый год. Четыре типа паразитов рода Plasmodium, которые переносятся малярийными комарами, распространяют малярию. Plasmodium falciparum, широко распространенный в Африке, является самым вирулентным паразитом из них и является ответственным за смертельные формы заболевания. Среди активных препаратов против Plasmodium falciparum хлорохин представляет собой противомалярийное средство семейства 4-аминохинолинов, которое широко применяется, но к которому уже выработалась резистентность с 1960-х гг. Затем появился артемизинин и оказался эффективным против видов плазмодиев, резистентных к хлорохину. Однако с 2006 г. ВОЗ зафиксировала опасность возникновения резистентности к данной молекуле. Именно в том же самом 2006 г. была открыта новая молекула,феррохин, проявляющая эффективность против штаммов Plasmodium falciparum, резистентных к хлорохину, описанная в Malaria Journal 2006, 5:11 и Malaria Journal 2007, 6:81. Феррохин представляет собой органометаллический комплекс железа. В частности, он представляет собой производное 4-аминохинолина, соединенное с ферроценовым ядром. Феррохин, также называемый ферроцен-хлорохин или феррохлорохин, представляет собой 7-хлор 4-[(2-N,N-диметиламинометил)ферроценилметиламино]хинолин. Он может быть в форме свободного основания, а также в форме соли, гидрата или сольвата (последние определяются как совмещения или комбинации феррохина, соответственно, с одной или более молекулами воды или растворителя). Преимущественно феррохин применяется в форме свободного основания. Феррохин формулы (F) в форме свободного основания и его основного метаболита (Fm) представлены ниже в схеме 1. Феррохин описывается в патенте WO 96/35698, а также в научных статьях, как, например, J. Med. Известный способ получения феррохина, частично представленный в схеме 2 ниже, состоит сначала из синтеза 1-[(диметиламино)метил]-2-формилферроцена из (диметиламино)метилферроцена с выходом около 85%, затем получения соответствующего промежуточного оксима и, наконец, проведения восстановления данного оксима, которое приводит к получению 1-(аминометил)-2-[(диметиламино)метил] ферроцена, который может быть выделен в форме дигидрохлорида. Выход синтеза дигидрохлорида 1(аминометил)-2-[(диметиламино)метил]ферроцена относительно 1-[(диметиламино)метил]-2-формилферроцена составляет 55-65%. Схема 2 Последняя реакционная последовательность включает сначала реакцию конденсации 1[(диметиламино)метил]-2-формилферроцена с гидроксиламином с получением соответствующего оксима. Затем восстановление функциональной группы оксима до амина гидридом металла LiAlH4 проводится в строго безводной среде с образованием после гидролиза 1-(аминометил)-2-[(диметиламино)метил] ферроцена, выделенного в форме дигидрохлорида. Последний здесь и далее также называют дигидрохлорид диаминоферроцена, который представляет собой соль 1-(аминометил)-2-[(диметиламино)метил] ферроцена, который сам по себе здесь и далее называется диаминоферроцен или диаминоферроцен в форме свободного основания. Если получается диаминоферроцен в форме свободного основания или его соль дигидрохлорид, то последний может подвергаться реакции в присутствии (i) основания, такого как, например, карбонат натрия или триэтиламин, и (ii) 4,7-дихлорхинолина, для того чтобы синтезировать феррохин ароматическим нуклеофильным замещением. Данная стадия синтеза феррохина, известная и описанная, может быть заменена на диаминоферроцен в виде свободного основания. Полученный таким образом феррохин затем может подвергаться очистке с получением чистого феррохина. Однако у данного способа есть множество недостатков. Фактически, риски, связанные с применением реагентов, таких как гидроксиламин (нестабильный и взрывоопасный) и LiAlH4 (воспламеняемый и очень реакционноспособный во влажных условиях), а также применением промежуточного вещества,такого как оксим (термически нестабильный), не позволяет предусмотреть получение феррохина в адекватных условиях гигиены и безопасности с промышленной точки зрения. Более того, применение особенно дорогих реагентов, таких как, например, LiAlH4, и низкая производительность данного способа (большое количество стадий, разбавлений) вносят значительный вклад в стоимость производства феррохина. В настоящее время, с целью обеспечения доступа к феррохину большому количеству людей в бедных странах, которые при этом имеют самую большую необходимость в нем, необходимым является минимизировать стоимость производства активного вещества, такого как данное, чтобы существенно уменьшить себестоимость лечения малярии. Автор заявки разработал новый способ получения феррохина формулы (F) или его метаболита формулы (Fm), делающую возможным получение указанного феррохина или указанного метаболита непосредственно из альдегидаминоферроцена формулы (III), в которой R представляет собой атом водорода или метильную группу (Me), и из 7-хлорхинолин-4-амина. Следовательно, способ согласно данному изобретению состоит из соединения альдегидаминоферроцена формулы (III) с 7-хлорхинолин-4-амином по реакции восстановительного аминирования, называемого конвергентным, представленного на схеме 3. Схема 3 Следовательно, реакция восстановительного аминирования происходит в одну стадию, но в несколько шагов. Во-первых, 7-хлорхинолин-4-амин реагирует с карбонильной функциональной группой альдегидаминоферроцена формулы (III) с образованием иминовой функциональной группы (которая может протонироваться до иминия, если реакционная смесь является кислой) по реакции конденсации с высвобождением молекулы воды. Во-вторых, затем иминовая функциональная группа иминоферроценового промежуточного продукта формулы (II) или, если необходимо, иминий восстанавливается гидридным донором. В-третьих, полученная реакционная смесь гидролизуется в присутствии водного раствора аммиака или же лимонной кислоты, чтобы удалить избыток применяемого гидрида и позволить выделение феррохина (F) или его метаболита (Fm). Иминоферроценовое промежуточное вещество формулы (II) или соответствующий иминий, не показано, не нужно выделять в отличие от оксимаминоферроцена предыдущего уровня техники, представленного выше. Следовательно, реакция конвергентного восстановительного аминирования согласно настоящему изобретению может проводиться в ходе так называемого однореакторного процесса. Более того, иминоферроценовое промежуточное вещество формулы (II) не является стабильным в условиях анализа жидкофазной хроматографией, его образование можно отследить качественно тонкослойной хроматографией или in situ анализом методом инфракрасной спектроскопии. Следовательно, данное изобретение относится к способу получения феррохина формулы (F) или его метаболита формулы (Fm) включающей реакцию восстановительного аминирования, в которой: в которой R представляет собой атом водорода или метильную группу, конденсируется с 7-хлорхинолин 4-амином(ii) полученный таким образом продукт конденсации формулы (II) в которой R представляет собой атом водорода или метильную группу, восстанавливается,(iii) реакционная смесь гидролизуется. После гидролиза феррохин формулы (F) и его метаболит формулы (Fm) выделяются. Согласно настоящему изобретению указанные соединения 7-хлорхинолин-4-амин и альдегидаминоферроцен формулы (III) присутствуют преимущественно в стехиометрическом соотношении. Реакция восстановительного аминирования согласно данному изобретению происходит в присутствии по крайней мере одного растворителя реакции, подходящего как для указанной стадии конденсации,так и для указанной стадии восстановления. Данный растворитель реакции выбирается из протонных и апротонных растворителей, таких как, например, этанол, изопропанол, толуол, ТГФ, дихлорметан и их смеси. Протонные растворители являются особенно предпочтительными. Таким образом, мы можем также отметить этанол и/или изопропанол, преимущественно изопропанол, в качестве растворителя реакции, обеспечивающего получение особенно предпочтительных выходов восстановительного аминирования. Стадия конденсации. Стадия конденсации 7-хлорхинолин-4-амина с альдегидаминоферроценом формулы (III) происходит в присутствии по крайней мере одной кислоты Льюиса, или по крайней мере одного основания Бренстеда, или кислоты Бренстеда. Данная стадия может предпочтительно происходить при азеотропной отгонке растворителя реакции указанной стадии конденсации или в присутствии по крайней мере одного осушающего агента. Стадия конденсации 7-хлорхинолин-4-амина с альдегидаминоферроцена формулы (III) может происходить в присутствии по крайней мере одной кислоты Льюиса, такой как Ti(OiPr)4, TiCl4, FeCl3, ZnCl2,-3 020392AlCl3 и BF3. Кислота Льюиса BF3 может присутствовать в форме комплекса, такого как, например,BF3.OEt2 и BF3.S(Me)2. Таким образом, в способе согласно данному изобретению кислота Льюиса выбирается из Ti(OiPr)4,TiCl4, FeCl3, ZnCl2, AlCl3, BF3, BF3.OEt2 и BF3.S(Me)2. В соответствии с особенно предпочтительным вариантом осуществления кислота Льюиса представляет собой Ti(OiPr)4. Кислота Льюиса может применяться в стехиометрическом количестве или в избытке. Преимущественно кислота Льюиса применяется в количестве от 1 до 2 экв., даже более предпочтительно кислота Льюиса присутствует в количестве 1 экв. В соответствии с особенно предпочтительным вариантом осуществления стадии конденсации в присутствии кислоты Льюиса Ti(OiPr)4, 7-хлорхинолин-4-амин, альдегидаминоферроцен формулы (III) и указанная кислота Льюиса присутствуют в количестве 1 экв. каждый. В данном случае растворителем реакции предпочтительно является изопропанол. Стадия конденсации 7-хлорхинолин-4-амина с альдегидаминоферроценом формулы (III) может происходить в присутствии по крайней мере одной кислоты Бренстеда или основания Бренстеда, выбранных из уксусной кислоты, трифторуксусной кислоты, метансульфоновой кислоты, паратолуолсульфоновой кислоты, H2SO4, H3PO4, HNO3, пиперидина и пролина. Преимущественной является паратолуолсульфоновая кислота или пиперидин, даже более предпочтительной паратолуолсульфоновая кислота. В соответствии с вариантом осуществления, в частности, относящимся к стадии конденсации в присутствии кислоты Бренстеда, преимущественно паратолуолсульфоновой кислоты, указанная стадия конденсации происходит при азеотропной отгонке растворителя реакции. В данном случае растворитель реакции представляет собой предпочтительно толуол. Поскольку стадия конденсации эквивалента 7-хлорхинолин-4-амина с эквивалентом альдегидаминоферроцена формулы (III) сопровождается высвобождением одного эквивалента воды, то потенциально возможно удалять воду, образовавшуюся таким образом, при помощи осушающего агента или отгонять эту воду из реакционной смеси проведением азеотропной перегонки с подходящим растворителем реакции, таким как, например, протонный или апротонный растворители, перечисленные выше. Подобная азеотропная перегонка может осуществляться, например, при помощи насадки Дина-Старка в ходе указанной стадии конденсации с целью смещения равновесия реакции в сторону образования иминоферроценового промежуточного вещества (II) или иминия, если необходимо. Указанная азеотропная перегонка может необязательно происходить при пониженном давлении, например, при давлении в диапазоне от 100 до 300 мбар. Следовательно, стадия конденсации 7-хлорхинолин-4-амина с альдегидаминоферроценом формулы(III) может происходить в присутствии по крайней мере одного осушающего агента или может происходить при азеотропной отгонке растворителя реакции из указанной реакции конденсации. В качестве осушающего агента можно отметить оксид алюминия, молекулярное сито 3, MgSO4 иNa2SO4. Преимущественным является молекулярное сито 3. Стадия восстановления. Стадия восстановления промежуточного вещества, полученного в конце стадии конденсации между 7-хлорхинолин-4-амином и альдегидаминоферроценом формулы (III), осуществляется в присутствии по крайней мере одного гидридного донора. Гидридные доноры, известные на данном уровне техники, особенно предпочтительные для указанной реакции восстановления, представляют собой водород в присутствии катализатора (переходные металлы, необязательно в виде комплекса) и гидридов металлов. Гидриды металлов выбираются из боргидридов натрия, калия, лития или цинка и необязательно связываются по крайней мере с одной добавкой,выбранной из LiCl, CaCl2, MgCl2, ZnCl2 и NEt3. Указанные боргидриды натрия, калия, лития или цинка выбираются из NaBH(OAc)3, NaBH3CN, NaBH4, KBH4, LiBH4 и Zn(BH4)2, связанных или нет с указанной добавкой.NaBH4, KBH4 и LiBH4, связанные или нет с указанной добавкой, оказываются особенно предпочтительными для проведения реакции восстановления иминоферроценового промежуточного вещества формулы (II), при необходимости соответствующего иминия, не показан. Гидролиз. Стадия гидролиза происходит в присутствии водного раствора аммиака или лимонной кислоты. Если в качестве кислоты Льюиса на стадии конденсации применяется Ti(OiPr)4, то гидролиз реакционной смеси в присутствии водного раствора лимонной кислоты представляет собой особенно предпочтительный вариант осуществления, поскольку он позволяет удаление солей титана на уровне водных фаз и, таким образом, позволяет избежать крайне затруднительного фильтрования данных солей. Согласно одному варианту осуществления способа данного изобретения стадия конденсации происходит в присутствии толуола в качестве растворителя реакции, необязательно при азеотропной отгонке, например при помощи насадки Дина-Старка. В данном варианте осуществления стадия восстановле-4 020392 ния предпочтительно происходит в присутствии NaBH4. Согласно одному варианту осуществления способа данного изобретения стадия конденсации происходит в присутствии молекулярного сита 3 в качестве осушающего агента. В данном варианте осуществления стадия восстановления предпочтительно происходит в присутствии NaBH4. Согласно одному варианту осуществления способа данного изобретения, касающемуся стадии конденсации в присутствии кислоты Бренстеда, преимущественно паратолуолсульфоновой кислоты, указанная стадия конденсации происходит при азеотропной отгонке растворителя реакции. Данный растворитель представляет собой преимущественно толуол. В данном варианте осуществления реакция восстановления предпочтительно происходит в присутствии NaBH4. Согласно одному варианту осуществления способа данного изобретения, касающемуся стадии конденсации в присутствии толуола в качестве растворителя реакции, указанная стадия конденсации происходит при азеотропной отгонке. В данном варианте осуществления стадия восстановления предпочтительно происходит в присутствии NaBH4. Согласно одному варианту осуществления способа данного изобретения, касающемуся стадии конденсации в присутствии кислоты Льюиса, преимущественно тетраизопропилата титана, растворитель реакции предпочтительно представляет собой изопропанол. Согласно одному варианту осуществления способа данного изобретения стадия конденсации происходит в присутствии от 1 до 2 экв. Ti(OiPr)4 в этаноле и/или изопропаноле в качестве растворителя реакции. В данном варианте осуществления стадия восстановления предпочтительно происходит в присутствии LiBH4, и/или NaBH4, и/или KBH4, а стадия гидролиза предпочтительно происходит в присутствии водного раствора лимонной кислоты. Согласно одному варианту осуществления способа данного изобретения стадия конденсации происходит в присутствии 1 экв. Ti(OiPr)4 в этаноле и/или изопропаноле в качестве растворителя реакции, и стадия восстановления предпочтительно происходит в присутствии LiBH4 и/или КВН 4. В конце данной реакции восстановительного аминирования образуется феррохин (F) или его метаболит (Fm) в виде свободного основания или соли, например соли дигидрохлорида. Феррохин в неочищенной форме может быть выделен и очищен по способам, известным специалисту в данной области техники. Выделение неочищенного феррохина в конце способа получения данного изобретения может осуществляться кристаллизацией в подходящем растворителе. Можно отметить ацетон, толуол, изопропанол или метилэтилкетон. Предпочтительным является ацетон или толуол, даже более предпочтительным является толуол. Способ получения согласно данному изобретению имеет преимущество относительно предыдущего уровня техники, в том, что она короче, если мы учитываем количество стадий реакции, и имеет более хорошие характеристики по показателям выхода и производительности. Соответственно, это делает возможным понижение конечной себестоимости феррохина, обусловленное применением недорогих реагентов, уменьшением количества стадий реакции относительно способа синтеза, применяемого в настоящее время и представленного на схеме 1 выше, и получением особенно предпочтительных выходов реакции: выход выделенного неочищенного феррохина составляет около 70-75 мол.% относительно исходного альдегидаминоферроцена формулы (III). Более того, данный способ предлагает преимущество, которое заключается в его безопасности, поскольку отсутствуют реагенты или промежуточные вещества, которые могут оказаться опасными в эксплуатации. Изобретение будет далее описано более подробно. Приведенные ниже способы и примеры описывают получение промежуточных веществ феррохина и феррохина данного изобретения. Данные способы и примеры не являются ограничивающими, и их единственной целью является иллюстрация настоящего изобретения. В способах и примерах, приведенных ниже ЯМР (ядерный магнитный резонанс) спектры получают при помощи Фурье-спектрометра КВН 4 - боргидрид калия,Ti(OiPr)4 - тетраизопропоксититан,ДМФ - N,N-диметилформамид,4,7-ДХХ - 7-хлорхинолин-4-амин,МеОН - метанол,EtOH - этанол,МЭК - метилэтилкетон,tBuLi - трет-бутиллитий,ДХМ - дихлорметан,КТ - комнатная температура,ПТСК - паратолуолсульфоновая кислота,ТП - температура плавления в С. Смеси растворителей количественно выражаются в объемных соотношениях, при этом мл обозначает миллилитр. В приведенных ниже способах исходные соединения и реагенты, если не описан их способ получения, являются коммерчески доступными, или описаны в литературе, или еще могут быть получены способами, описанными или известными специалисту в данной области техники. Получения. 1. Получение соединений формулы (III). Получение 1-[(диметиламино)метил]-2-формилферроцена. Загрузить в инертизированный реактор 39,6 г 1-[(диметиламино)метил]ферроцен и 360 мл ТБМЭ. Перегнать около 160 мл ТБМЭ (4V) при атмосферном давлении. Охладить раствор до -10 С и медленно добавить 98,2 мл раствора t-BuLi в гептане (титровать 16%). Перемешивать реакционную смесь при-10 С в течение 2 ч, а затем при 0 С, медленно добавлять 25,2 мл ДМФ. Продолжать перемешивание реакционной смеси при 20 С в течение 2 ч, затем при 5 С, медленно добавлять 135 мл 1,5 н. водной HCl. Продолжать перемешивание реакционной смеси при 5 С в течение 30 мин, затем при 20 С в течение 30 мин. Оставить реакционную смесь для образования осадка и удалить водную фазу, затем фазу ТБМЭ. Экстрагировать водную фазу 125 мл ТБМЭ. Отфильтровать объединенные фазы ТБМЭ через активированный уголь, затем сконцентрировать до 120 мл в вакууме. Добавить 80 мл изопропанола, затем отогнать 420 мл растворителя до постоянного объема в вакууме, при регулярном добавлении изопропанола. В конце перегонки разбавить реакционную смесь до 280 мл изопропанолом. 39,9 г ожидаемого соединения получается в растворе в изопропаноле. 2. Получение 7-хлорхинолин-4-амина. 2.1. Получение 7-хлорхинолин-4-амина. Перемешивать смесь 100 г 4,7-ДХХ и 1 л 5% раствора аммиака в метаноле при 160 С в течение по крайней мере 15 ч. После полного превращения 4,7-ДХХ сконцентрировать реакционную смесь до 300 мл, затем медленно добавлять 400 мл разбавленного водного раствора (3,2%) карбоната натрия. Фильтровать полученную суспензию через воронку Бюхнера и промыть фильтрационный осадок 100 мл смеси вода/МеОН (70/30, по объему), затем 100 мл воды. Высушить бежевое твердое вещество в печи при 100 С в вакууме. Получается 85,5 г ожидаемого соединения. ТП = 187 С (с разложением). 2.2. Очистка 7-хлорхинолин-4-амина. Нагревать смесь 85 г соединения, полученного на предшествующей стадии, и 550 мл толуола при температуре кипения до полного растворения, затем медленно охлаждать до 20 С. Фильтровать суспензию через воронку Бюхнера. Промывать фильтрационный осадок 85 мл толуола, затем высушивать в печи при 100 С в вакууме. Получается 76,8 г ожидаемого продукта. Примеры Приведенные ниже способы и примеры описывают получение неочищенного феррохина из 7 хлорхинолин-4-амина и 1-[(диметиламино)метил]-2-формилферроцена (пример с 1 по 6), а также очистку указанного неочищенного феррохина (пример 7). Пример 1. Нагревать смесь 0,5 г соединения из получения 2.2, 0,76 г соединения из получения 1, 25 мг ПТСК и 5 мл толуола при температуре кипения и удалять воду азеотропной отгонкой в течение 16 ч. Концентрировать реакционную смесь в вакууме и поместить в 10 мл абсолютного EtOH. Добавить 0,21 г NaBH4 и перемешивать полученную реакционную смесь в течение 16 ч. Концентрировать реакционную смесь в вакууме, затем поместить в 40 мл ДХМ и смесь 20 мл воды и 2 мл аммиака 25%. Оставить полученную смесь до образования осадка, затем экстрагировать водную фазу 4 раза в 20 мл ДХМ. Объединить и концентрировать органические фазы в вакууме, и кристаллизовать осадок в 20 мл ацетона. Отфильтровать охлажденное твердое вещество через воронку Бюхнера, промыть 2 раза 5 мл холодного ацетона, затем сушить в печи в вакууме. Получается 0,37 г ожидаемого соединения. Вторая фракция кристаллизации восстанавливается из маточного раствора и промывного раствора, из которых получается 0,11 г ожидаемого соединения. ТП = 197 С. 1(d, CH, 1H), 7,48 (dd, CH, 1H), 7,75 (dd, NH, 1H), 7,78 (d, CH, 1H), 7,85 (d, CH, 1H), 8,42 (d, CH, 1H). Пример 2. Поместить 3,3 г соединения из получения 2.2, 5 г соединения из получения 1 и 50 мл изопропанола в колбу. Добавить 10,9 мл Ti(OiPr)4. Перемешивать реакционную смесь при КТ в течение 24 ч. Охладить полученную реакционную смесь до 0 С и добавить 0,4 г LiBH4 порциями при 0 С. Перемешивать реакционную смесь, позволяя температуре подняться до КТ в течение 16 ч, затем разбавить 50 мл ДХМ. Прилить полученный раствор в 40 мл водного раствора аммиака 12,5%. После 30 мин перемешивания отфильтровать полученную суспензию через Clarcel. Затем промыть фильтрационный осадок 6 раз 20 мл ДХМ. Промыть органическую фазу 30 мл 1 н. раствора карбоната натрия, затем концентрировать в вакууме до 40 мл. Провести замену растворителя ДХМ/ацетон перегонкой при постоянном объеме. Охладить полученную при температуре кипения суспензию кетона до 5 С. Отфильтровать твердое вещество через воронку Бюхнера, промыть 2 раза 9 мл холодного ацетона и сушить в печи в вакууме. Получается 4,2 г ожидаемого соединения. Пример 3. Поместить 13,4 г соединения из получения 2.2 и 152,2 г соединения из получения 1 при 13,5% в изопропаноле в реактор. Добавить 42,8 г Ti(OiPr)4. Перемешивать реакционную смесь при 25 С в течение по крайней мере 20 ч. Затем поместить 5,7 г тонкодисперсного NaBH4 и 60 мл изопропанола во второй реактор и охладить до 0 С. Медленно прилить полученный раствор иминового промежуточного вещества к данной суспензии NaBH4 при 0 С. Перемешивать реакционную смесь при 25 С в течение по крайней мере 20 ч, концентрировать в вакууме, затем разбавить 150 мл ДХМ. Охладить полученный раствор до 0 С, затем гидролизовать при 0 С с 60 мл водного раствора аммиака при 25%. Снова поднять температуру суспензии до 20 С, затем фильтровать через Clartex. Промывать фильтрационный осадок 5 раз 20 мл ДХМ. Концентрировать органическую фазу в вакууме до 200 мл. Провести замену растворителя ДХМ/ацетон перегонкой при постоянном объеме. Охладить полученную при температуре кипения суспензию кетона до 5 С. Отфильтровать твердое вещество через воронку Бюхнера, промыть 2 раза 20 мл холодного ацетона и сушить в печи в вакууме. Получается 23,1 г ожидаемого соединения. Пример 4. Поместить 13,2 г соединения из получения 2.2 и 125 г 16% раствора соединения из получения 1 в изопропаноле в реактор. Добавить 42,0 г Ti(OiPr)4. Перемешивать реакционную смесь при 25 С в течение по крайней мере 20 ч. Поместить 8,0 г КВН 4 и 60 мл изопропанола во второй реактор и охладить до 0 С. Медленно прилить полученный раствор иминового промежуточного вещества к данной суспензииKBH4 при 0 С. Перемешивать реакционную смесь при 25 С в течение по крайней мере 20 ч, концентрировать в вакууме, затем разбавить 130 мл ДХМ. Охладить полученный раствор до 0 С, затем гидролизовать при 0 С с 60 мл водного раствора аммиака при 25%. Позволить температуре суспензии подняться до 20 С, затем фильтровать через текстильное волокно, промывать фильтрационный осадок 5 раз 20 мл ДХМ. Концентрировать органическую фазу в вакууме до 100 мл. Провести замену растворителя ДХМ/ацетон перегонкой при постоянном объеме. Охладить полученную при температуре кипения суспензию кетона до 5 С. Отфильтровать твердое вещество через воронку Бюхнера, промыть 2 раза 20 мл холодного ацетона и сушить в печи в вакууме. Получается 23,1 г ожидаемого соединения. Пример 5. Поместить 26,3 г соединения из получения 2.2 и 227 г раствора соединения из получения 1 при 17,4% в изопропаноле в реактор. Добавить 83,8 г Ti(OiPr)4. Перемешивать реакционную смесь при 40 С в течение по крайней мере 5 ч. Поместить 15,9 г КВН 4 и 120 мл изопропанола во второй реактор и охладить до 0 С. Медленно прилить полученный раствор иминового промежуточного вещества к данной суспензии КВН 4 при 0 С. Затем перемешивать реакционную смесь при 25 С в течение по крайней мере 20 ч, затем нагревать до 50 С в течение по крайней мере 3 ч. Гидролизовать полученную реакционную смесь при 20 С, медленно добавляя 500 г водного раствора лимонной кислоты при 11,3%, затем 75 г водного раствора аммиака при 20%. Добавить 400 мл толуола, перемешивать полученную реакционную смесь при 50 С в течение 30 мин. Оставить органическую фазу до образования осадка при 50 С, промывать при 50 С 3 раза 120 мл воды, затем фильтровать через активированный уголь. Концентрировать органическую фазу в вакууме до 400 мл, затем перегонять в вакууме с постоянным объемом, добавляя 1 л толуола. Нагревать толуоловую фазу при 90 С до полного растворения, затем охлаждать до 5 С. Отфильтровать твердое вещество через воронку Бюхнера, промывать 40 мл холодного МЭК и сушить в печи в вакууме. Получается 47,5 г ожидаемого соединения. Пример 6. Поместить 26,3 г соединения из получения 2.2 и 217 г раствора соединения из получения 1 при 18,4% в изопропаноле в реактор. Добавить 41,9 г Ti(OiPr)4. Перемешивать реакционную смесь при 40 С в течение по крайней мере 8 ч. Поместить 15,9 г КВН 4 и 120 мл изопропанола во второй реактор и охладить до 0 С. Медленно прилить полученный раствор иминового промежуточного вещества к данной суспензии KBH4 при 0 С. Перемешивать реакционную смесь при 20 С в течение по крайней мере 20 ч,затем нагревать до 50 С в течение по крайней мере 3 ч. Гидролизовать полученную реакционную смесь при 20 С, медленно добавляя 320 г водного раствора лимонной кислоты при 13,2%, затем 56 г водного раствора аммиака при 20%. Добавить 400 мл толуола, затем перемешивать полученную реакционную смесь при 50 С в течение 30 мин. Оставить органическую фазу до образования осадка при 50 С, промывать при 50 С 3 раза 120 мл воды, затем фильтровать через активированный уголь. Концентрировать органическую фазу в вакууме до 400 мл, затем перегонять в вакууме с постоянным объемом, добавляя 1 л толуола. Нагревать толуоловую фазу при 90 С до полного растворения, затем охлаждать до 5 С. Отфильтровать твердое вещество через воронку Бюхнера, промывать 2 раза 40 мл холодного МЭК и сушить в печи в вакууме. Получается 50,7 г ожидаемого соединения. Пример 7. Поместить 24,0 г неочищенного феррохина и 345 мл МЭК в реактор и нагревать до 78 С. Охладить полученный раствор до 67 С и инициировать добавлением 0,24 г феррохина в суспензии в 1,2 мл МЭК. Перемешивать полученную смесь в течение 1 ч при 67 С, затем охладить до 10 С. Фильтровать суспензию при 10 С через воронку Бюхнера, затем промывать фильтрационный осадок 48 мл МЭК. Сушить полученное твердое вещество в печи в вакууме. Получается 20,2 г ожидаемого соединения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения феррохина формулы (F) или его метаболита формулы (Fm) включающий реакцию восстановительного аминирования, в котором: где R представляет собой атом водорода или метильную группу, конденсируют с 7-хлорхинолин-4 амином(ii) полученный таким образом продукт конденсации формулы (II) где R представляет собой атом водорода или метильную группу, восстанавливают,(iii) реакционную смесь гидролизуют перед выделением феррохина формулы (F) или его метаболита формулы (Fm). 2. Способ по п.1, где указанные соединения 7-хлорхинолин-4-амин и альдегидаминоферроцен формулы (III) берут в стехиометрическом соотношении. 3. Способ по п.1 или 2, где реакцию восстановительного аминирования проводят в присутствии по крайней мере одного растворителя, выбранного из этанола, изопропанола, толуола, ТГФ, дихлорметана и их смесей. 4. Способ по любому одному из пп.1-3, где стадию конденсации 7-хлорхинолин-4-амина с альдегидаминоферроценом формулы (III) проводят в присутствии по крайней мере одной кислоты Льюиса, или по крайней мере одного основания, или кислоты Бренстеда. 5. Способ по любому одному из пп.1-4, где стадию конденсации 7-хлорхинолин-4-амина с альдегидаминоферроценом формулы (III) проводят при азеотропной отгонке растворителя реакции указанной стадии конденсации или в присутствии по крайней мере одного осушающего агента. 6. Способ по п.4, где кислоту Льюиса выбирают из Ti(OiPr)4, TiCl4, FeCl3, ZnCl2, AlCl3, BF3,BF3.OEt2 и BF3.S(Me)2. 7. Способ по п.6, где кислота Льюиса представляет собой Ti(OiPr)4. 8. Способ по любому одному из пп.4-7, где кислоту Льюиса используют в стехиометрическом соотношении или в избытке. 9. Способ по любому одному из пп.4-8, где кислоту Льюиса используют в количестве от 1 до 2 экв. 10. Способ по п.4, где стадию конденсации проводят в присутствии по крайней мере одной кислоты Бренстеда или основания Бренстеда, выбранных из уксусной кислоты, трифторуксусной кислоты, метансульфоновой кислоты, паратолуолсульфоновой кислоты, H2SO4, H3PO4, HNO3, пиперидина и пролина. 11. Способ по п.10, где стадию конденсации проводят в присутствии паратолуолсульфоновой кислоты или пиперидина. 12. Способ по п.5, где осушающий агент выбирают из оксида алюминия, молекулярного сита 3,MgSO4 и Na2SO4. 13. Способ по любому одному из пп.1-12, где стадию восстановления проводят в присутствии гидридов металлов, выбранных из боргидридов натрия, калия, лития или цинка, необязательно связанных по крайней мере с одной добавкой, выбранной из LiCl, CaCl2, MgCl2, ZnCl2 и NEt3. 14. Способ по п.13, где боргидриды натрия, калия, лития или цинка выбирают из NaBH(OAc)3,NaBH3CN, NaBH4, KBH4, LiBH4 и Zn (BH4)2, необязательно связанных с указанной добавкой. 15. Способ по п.14, где реакцию восстановления проводят в присутствии NaBH4, KBH4 и LiBH4, необязательно связанных с указанной добавкой. 16. Способ по любому одному из пп.1-5, где стадию конденсации проводят в присутствии паратолуолсульфоновой кислоты, при азеотропной отгонке растворителя реакции. 17. Способ по п.16, где стадию конденсации проводят в присутствии толуола. 18. Способ по п.16 или 17, где стадию восстановления проводят в присутствии NaBH4. 19. Способ по любому одному из пп.1-5, где стадию конденсации проводят в присутствии тетраизопропилата титана и изопропанола в качестве растворителя реакции. 20. Способ по любому одному из пп.1-5, где стадию конденсации проводят в присутствии 1 экв.Ti(OiPr)4 в этаноле и/или изопропаноле в качестве растворителя реакции, а стадия восстановления происходит в присутствии LiBH4 и/или KBH4. 21. Способ по любому одному из пп.1-5, где стадию гидролиза проводят в присутствии водного раствора лимонной кислоты. Евразийская патентная организация, ЕАПВ Россия, 109012, Москва, Малый Черкасский пер., 2
МПК / Метки
МПК: C07F 17/02
Метки: способ, конвергентным, восстановительным, аминированием, феррохина, получения
Код ссылки
<a href="https://eas.patents.su/10-20392-sposob-polucheniya-ferrohina-konvergentnym-vosstanovitelnym-aminirovaniem.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения феррохина конвергентным восстановительным аминированием</a>
Предыдущий патент: Спиропиперидиновые соединения в качестве антагонистов рецептора orl-1
Следующий патент: Система и способ обогрева помещений железнодорожного пассажирского вагона
Случайный патент: Система поглощения энергии












