Тиазолилпиразолопиримидины в качестве синтетических промежуточных соединений и связанные с ними способы синтеза
Номер патента: 18807
Опубликовано: 30.10.2013
Авторы: Ваид Радхе Кришан, Боини Сатхиш Кумар, Риззо Джон Роберт
Формула / Реферат
1. Соединение формулы
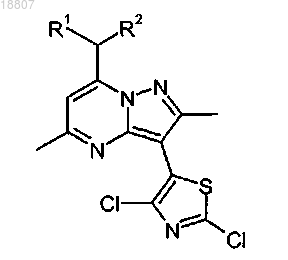
где R1 и R2 независимо представляют собой этил или н-пропил;
или соль указанного соединения.
2. Соединение по п.1 или соль указанного соединения, отличающиеся тем, что каждый из R1 и R2 представляет собой этил.
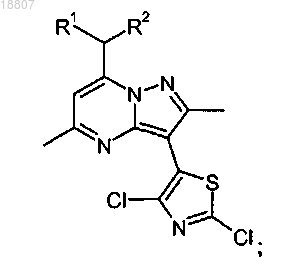
3. Способ получения соединения формулы
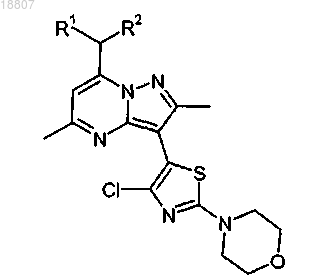
где R1 и R2 независимо представляют собой этил или н-пропил, включающий стадии:
i) взаимодействия соединения формулы
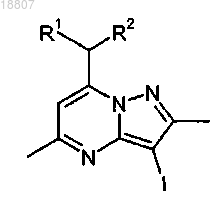
или соли указанного соединения с 2,4-дихлортиазолом или его солью в присутствии катализатора на основе галогенида меди, лиганда, выбранного из 1,10-фенантролина и бипиридина, и основания, выбранного из K3PO4 и Cs2CO3, с образованием соединения формулы
ii) взаимодействия продукта со стадии i) с морфолином или его солью в присутствии подходящего неорганического основания.
4. Способ по п.3, отличающийся тем, что каждый из R1 и R2 представляет собой этил.
5. Способ по любому из пп.3 или 4, отличающийся тем, что галогенид меди представляет собой CuCl.
6. Способ по любому из пп.3-5, отличающийся тем, что лиганд представляет собой 1,10-фенантролин.
7. Способ по любому из пп.3-6, отличающийся тем, что основание на стадии i) представляет собой Cs2CO3.
8. Способ по любому из пп.3-7, отличающийся тем, что основание на стадии ii) представляет собой K2CO3.
9. Способ по п.3, отличающийся тем, что каждый из R1 и R2 представляет собой этил, галогенид меди представляет собой CuCl, лиганд представляет собой 1,10-фенантролин, основание на стадии i) представляет собой Cs2CO3, а основание на стадии ii) представляет собой K2CO3.
10. Способ по п.9, отличающийся тем, что растворитель на стадии i) представляет собой 1,4-диоксан или 2-метилтетрагидрофуран/N,N-диметилацетамид, а растворитель на стадии ii) представляет собой морфолин, 2-метилтетрагидрофуран или 2-пропанол.
11. Способ получения соединения формулы
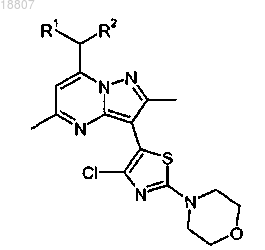
где R1 и R2 независимо представляют собой этил или н-пропил, включающий взаимодействие соединения формулы
или соли указанного соединения с избытком морфолина или его соли в подходящем растворителе.
12. Способ по п.11, отличающийся тем, что растворитель представляет собой 2-метилтетрагидрофуран.
13. Способ по п.11, отличающийся тем, что растворитель представляет собой 2-пропанол.
14. Способ по любому из пп.11-13, отличающийся тем, что каждый из R1 и R2 представляет собой этил.
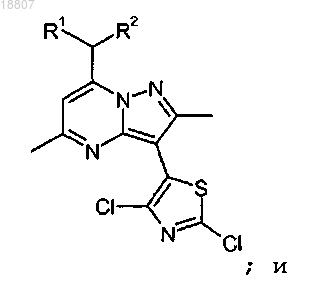
15. Способ получения соединения формулы

где R1 и R2 независимо представляют собой этил или н-пропил, включающий стадии:
i) взаимодействия соединения формулы
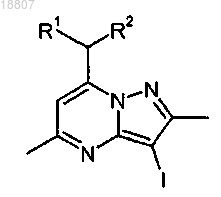
или соли указанного соединения с 2,4-дихлортиазолом или его солью в присутствии катализатора на основе галогенида меди, лиганда, выбранного из 1,10-фенантролина и бипиридина, и основания, выбранного из K3PO4 и Cs2CO3, с образованием соединения формулы

ii) взаимодействия продукта со стадии i) с избытком морфолина или его соли в подходящем растворителе.
16. Способ по п.15, отличающийся тем, что растворитель на стадии ii) представляет собой 2-метилтетрагидрофуран.
17. Способ по п.15, отличающийся тем, что растворитель на стадии ii) представляет собой 2-пропанол.
18. Способ по любому из пп.15-17, отличающийся тем, что каждый из R1 и R2 представляет собой этил.
Текст
ТИАЗОЛИЛПИРАЗОЛОПИРИМИДИНЫ В КАЧЕСТВЕ СИНТЕТИЧЕСКИХ ПРОМЕЖУТОЧНЫХ СОЕДИНЕНИЙ И СВЯЗАННЫЕ С НИМИ СПОСОБЫ СИНТЕЗА Риззо Джон Роберт, Боини Сатхиш Кумар, Ваид Радхе Кришан (US) Медведев В.Н. (RU) и его применению в способе синтеза для получения соединений формулы(71)(73) Заявитель и патентовладелец: ЭЛИ ЛИЛЛИ ЭНД КОМПАНИ (US) Изобретение относится к новым промежуточным соединениям и способам синтеза тиазолилпиразолопиримидинов, при этом полученные конечные соединения подходят для применения в качестве антагонистов рецепторов CRF-1 для лечения некоторых психических и нейроэндокринных нарушений. Рилизинг-фактор кортикотропина (CRF) представляет собой гипоталамический пептидный гормон,обладающий также физиологическим действием широкого спектра, определяемым его ролью нейромедиатора или нейромодулятора в мозге. CRF связывают с целым рядом психических расстройств и нейроэндокринных заболеваний, включая злоупотребление алкоголем и психоактивными веществами и сопутствующие абстинентные синдромы, а также депрессию и тревожность. В частности, было показано применение антагонистов рецепторов CRF-1 для лечения алкогольной зависимости и депрессии. Было обнаружено, что некоторые тиазолилпиразоло[1,5-a]пиримидины являются особенно подходящими в качестве антагонистов CRF-1, такие как, например, 7-(1-этилпропил)-3-(4-хлор-2-морфолин-4 илтиазол-5-ил)-2,5-диметилпиразоло[1,5-a]пиримидин и 7-(1-пропилбутил)-3-(4-хлор-2-морфолин-4 илтиазол-5-ил)-2,5-диметилпиразоло[1,5-a]пиримидин, предложенные в WO 2008/036579. Последние достижения в области катализируемых медью реакций арилирования, проводимых с применением различных исходных веществ, приведены в J. Am. Chem. Soc, vol. 130, pg. 1128-1129 (2008). В настоящем изобретении предложены новые синтетические промежуточные соединения и способы синтеза, проводимые с использованием указанных промежуточных соединений, направленные на получение тиазолилпиразоло[1,5-a]пиримидиновых антагонистов рецепторов CRF-1 с меньшими денежными затратами и более высокими выходами продукта. Некоторые варианты реализации заявленных в настоящем изобретении способов также позволяют избежать применения мутагенных материалов и катализаторов, токсичных для окружающей среды, по сравнению с известными ранее способами синтеза,такими как, например, предложенные в WO 2008/036579. В одном из аспектов настоящего изобретения предложено соединение формулы I где R1 и R2 независимо представляют собой этил или н-пропил. В одном из предпочтительных вариантов реализации каждый из R1 и R2 представляет собой этил. Во втором предпочтительном варианте реализации каждый из R1 и R2 представляет собой н-пропил. В другом аспекте настоящего изобретения предложен синтетический способ получения соединения формулы II где R1 и R2 независимо представляют собой этил или н-пропил, включающий стадии 1) взаимодействия соединения формулы III или соли указанного соединения с 2,4-дихлортиазолом или его солью в присутствии катализатора на основе галогенида меди, лиганда, выбранного из 1,10-фенантролина и бипиридина, и основания, выбранного из K3PO4 и Cs2CO3, с образованием соединения формулы I (выше); и 2) взаимодействия соединения формулы I с морфолином или его солью в присутствии подходящего неорганического основания. В одном из предпочтительных вариантов реализации данного аспекта настоящего изобретения каждый из R1 и R2 представляет собой этил. Во втором предпочтительном варианте реализации данного аспекта настоящего изобретения каждый из R1 и R2 представляет собой н-пропил. Подходящие катализаторы на основе галогенида меди включают CuI, CuBr и CuCl. Предпочтительным катализатором является CuCl. Применение лиганда меди способствует эффективному катализу ионом меди. Как 1,10 фенантролин, так и бипиридин являются эффективными лигандами в способе согласно изобретению. 1,10-фенантролин является предпочтительным. При использовании бипиридина для обеспечения более высоких выходов продукта требуются более высокие молярные концентрации бипиридина и меди, такие как, например, от примерно 0,9 до примерно 1,1 эквивалента, допустим, примерно 1 эквивалент бипиридина и от примерно 0,5 до примерно 1,1 эквивалента источника меди, допустим, примерно 1 эквивалент источника меди, причем предпочтительным источником меди является CuCl. При применении 1,10-фенантролина для эффективного протекания реакции достаточно каталитических концентраций указанного вещества и каталитических концентраций источника меди, например, от примерно 5-50 мол.% каждого вещества (0,05-0,50 эквивалента), причем предпочтительным источником меди является CuCl. В одном варианте реализации 1,10-фенантролин и медный катализатор, напримерCuCl, используют в концентрации примерно 5-50 молярных процентов (0,05-0,50 эквивалента). В другом варианте реализации 1,10-фенантролин и медный катализатор, например CuCl, используют в концентрации примерно 101 молярных процентов (0,10 эквивалента). В еще одном варианте реализации 1,10 фенантролин и медный катализатор, например CuCl, используют в концентрации примерно 301 молярных процентов (0,30 эквивалента). Реакция согласно стадии 1) протекает под действием основания и является чувствительной к выбору основания. Дихлортиазольный реагент чувствителен к применяемым основанию и температуре и склонен к разложению в случае, если выбранное основание является слишком сильным и/или температура проведения реакции является слишком высокой, например, при использовании трет-бутоксилития или трет-бутоксикалия и/или при температурах выше примерно 120C. В связи с этим подходящими основаниями для применения на стадии 1) являются K3PO4 и Cs2CO3, причем Cs2CO3 является предпочтительным. Аналогичным образом, предпочтительным также является проведение реакции на стадии 1) при температуре от примерно 80 до 120C. Реакция согласно стадии 1) менее чувствительна к выбору растворителя, причем подходящими растворителями являются апротонные растворители, такие как, например, 1,4-диоксан, 2-МеТГФ, DMAC,СРМЕ, пропионитрил, 2-МеТГФ/ОМАС, н-BuOAc и ДМФ. Система применяемых совместно растворителей 2-МеТГФ/БМАС с соотношениями в пределах от 70/30 до 80/20 является предпочтительной, например, 2-МеТГФ/ПМАС в соотношении 80/20. Реакция согласно стадии 2) менее чувствительна к выбору неорганического основания и растворителя. Подходящие основания включают K2CO3, Cs2CO3, Na2CO3, K3PO4, NaOH и подобные. Предпочтительными являются K2CO3 и K3PO4, при этом K2CO3 является наиболее предпочтительным. Подходящие растворители для проведения реакции согласно стадии 2) включают большинство полярных растворителей, таких как метанол, этанол, н-пропанол, 2-пропанол, н-бутанол, ацетонитрил, 2 МеТГФ и морфолин. Предпочтительным является морфолин, так как он является превосходным растворителем и реагентом в реакции согласно стадии 2). Предпочтительные температуры проведения реакции на стадии 2) составляют от 60 до 120C. В одном из предпочтительных вариантов реализации настоящего изобретения способ синтеза включает стадии 1) взаимодействия соединения формулы III или соли указанного соединения, где R1 и R2 независимо представляют собой этил или н-пропил, с 2,4-дихлортиазолом или его солью в присутствии CuCl, 1,10-фенантролина и основания, выбранного изK3PO4 и Cs2CO3, с образованием соединения формулы I (выше); и 2) взаимодействия соединения формулы I с морфолином или его солью в присутствии K2CO3. Далее, согласно данному варианту реализации способа является предпочтительным, чтобы в реакции согласно стадии 1) использовали от примерно 5-50 мол.%, более конкретно примерно 30 мол.% CuCl и от примерно 5-50 мол.%, более конкретно примерно 30 мол.% 1,10-фенантролина с применением 2 МеТГФ/DMAC (в частности, примерно 80/20 2-МеТГФ/DMAC) в качестве системы растворителей, а также чтобы реакцию проводили при температуре от 80 до 120C и применяли в реакции согласно стадии 2) в качестве растворителя морфолин, а в качестве основания K2CO3. Согласно другому аспекту настоящего изобретения предложен синтетический способ получения соединения формулы где R1 и R2 независимо представляют собой этил или н-пропил, включающий стадии 1) взаимодействия соединения формулы или соли указанного соединения с избытком морфолина или его соли в присутствии подходящего растворителя. Согласно одному варианту реализации данного аспекта настоящего изобретения предложен синтетический способ получения соединения формулы где R1 и R2 независимо представляют собой этил или н-пропил, включающий стадии 1) взаимодействия соединения формулы или соли указанного соединения с 2,4-дихлортиазолом или его солью в присутствии катализатора на основе галогенида меди, лиганда, выбранного из 1,10-фенантролина и бипиридина, и основания, выбранного из K3PO4 и Cs2CO3, с образованием соединения формулы 2) взаимодействия продукта со стадии 1) с избытком морфолина или его соли в подходящем растворителе. Согласно данному аспекту настоящего изобретения можно применять различные апротонные растворители, но предпочтительными являются 2-МеТГФ и 2-пропанол. В предпочтительном варианте реализации настоящего изобретения в качестве растворителя используют 2-пропанол. Неожиданно было обнаружено, что применение 2-пропанола уменьшает время протекания реакции примерно в 3 раза по сравнению с исследованными системами растворителей, известными из уровня техники. Также было неожиданно обнаружено, что применение 2-пропанола обеспечивает получение целевого продукта аминирования с высокой степенью чистоты даже в присутствии конкурирующего нуклеофильного спирта. Применение 2-пропанола также облегчает выделение конечного продукта за счет обеспечения возможности проведения кристаллизации непосредственно из данного растворителя, что позволяет избежать дальнейшей замены растворителей перед кристаллизацией. В данном аспекте настоящего изобретения также было неожиданно обнаружено, что морфолин может выступать в качестве подходящего основания для проведения реакции аминирования, тем самым устраняя необходимость введения дополнительного основания для обеспечения протекания реакции. Кроме того, увеличиваются выходы продукта при сохранении его качества. Уменьшение количества используемого морфолина также благоприятно сказывается на конечном выходе продукта. В одном из вариантов реализации настоящего изобретения, где в качестве растворителя используют 2-МеТГФ, реакцию проводят с использованием от примерно 4,0 до примерно 6,0 эквивалентов, допустим, примерно 5,35 эквивалента морфолина или его соли. В другом варианте реализации настоящего изобретения, где в качестве растворителя используют 2-пропанол, реакцию проводят с использованием от примерно 3,0 до примерно 4,0 эквивалентов, допустим, примерно 3,3 эквивалента морфолина или его соли. Таким образом, согласно одному из вариантов реализации настоящего изобретения предложен синтетический способ получения соединения формулы или соли указанного соединения с 2,4-дихлортиазолом или его солью в присутствии хлорида меди,1,10-фенантролина и Cs2CO3 с образованием соединения формулы 2) взаимодействия продукта со стадии 1) с избытком морфолина или его соли в 2-пропаноле в качестве растворителя. В настоящем описании использованы следующие аббревиатуры: СРМЕ - циклопентилметиловый эфир;EtOAc - этилацетат; 2-МеТГФ - 2-метилтетрагидрофуран; система 2-МеТГФ/DMAC означает 2-метилтетрагидрофуран и N,N-диметилацетамид в системе совместно применяемых растворителей в соотношении от примерно 70/30 до примерно 80/20;DSC - дифференциальная сканирующая калориметрия. Дополнительные предпочтительные варианты реализации способа синтеза согласно настоящему изобретению описаны в нижеследующих примерах. Примеры Пример 1. 7-(1-Этилпропил)-3-(2,4-дихлортиазол-5-ил)-2,5-диметилпиразоло[1,5-a]пиримидин(1,95 г, 9,00 ммоль), 2,4-дихлортиазол (0,58 г, 3,75 ммоль), 1,10-фенантролин (0,05 г, 0,30 ммоль) и безводный DMAC (5 мл) в круглодонную колбу, снабженную магнитной мешалкой, термопарой и входным отверстием для N2. Дегазировали желтую гетерогенную реакционную смесь N2 (газ) в течение 30 мин,затем добавляли одну порцию CuI (0,06 г, 0,30 ммоль), после чего в течение еще 30 мин дегазировали N2(газ). Реакционную смесь перемешивали в течение примерно 6 ч при 120C. Затем реакционную смесь охлаждали до комнатной температуры в течение ночи, добавляли толуол (10 мл) и перемешивали в течение 1 ч. Смесь очищали на силикагеле, элюируя толуолом (10 мл), затем экстрагировали 1 М HCl (10 мл),водой (10 мл), солевым раствором (10 мл) и концентрировали при пониженном давлении с образованием желтого твердого вещества. Перекристаллизовывали твердое вещество из метанола (5 мл) с получением соединения, указанного в заголовке, в виде желтого твердого кристаллического вещества. (0,78 г, 70% выход, чистота 99% по данным ЖХ) МС(ЭР)= 369 (М+1). 1 Н ЯМР (CDCl3)= 6,5 (1 Н, с); 3,6 (1 Н, м); 2,6(0,37 г, 1,00 ммоль), K2CO3 (0,28 г, 2,00 ммоль) и безводный морфолин (3 мл) в круглодонную колбу,снабженную магнитной мешалкой и входным отверстием для N2. Перемешивали желтую смесь в течение примерно 4 ч при 100C, по прошествии этого времени реакционная смесь становилась гомогенной. Затем реакционную смесь охлаждали до комнатной температуры, добавляли воду (10 мл) и перемешивали гетерогенную реакционную смесь в течение ночи при комнатной температуре. Желтое твердое вещество собирали с помощью фильтрования, промывали водой и оставляли сушиться на воздухе на ночь с получением неочищенного вещества, указанного в заголовке (391 мг). Затем проводили его перекристаллизацию из изопропилового спирта (3 мл), получая указанное в заголовке светло-желтое твердое кристаллическое вещество (380 мг, 90,6% выход, 99% по данным ЖХ). МС(ЭР)= 420 (М+1). 1 Н ЯМР (CDCl3) = 6,45 (1 Н, с); 3,81 (м, 4 Н); 3,62 (1 Н, м); 3,50 (м, 4 Н); 2,6 (3H, с); 2,45 (3H, с); 1,85 (4 Н, м); 0,9 (6 Н, т). Пример 3. Реакции согласно примеру 1 проводили с использованием различных других катализаторов, лигандов, оснований и растворителей, которые, как было обнаружено, оказывают следующее влияние на выход 7-(1-этилпропил)-3-(2,4-дихлортиазол-5-ил)-2,5-диметилпиразоло[1,5-a]пиримидина. (См. табл. 1-4). Таблица 1. Оценка различных лигандов(Реакции проводили параллельно в нескольких реакторах с применением 1,2 ммоль 2,4 дихлортиазола, 1 ммоль 7-(1-этилпропил)-3-йод-2,5-диметилпиразоло[1,5-a]пиримидина, 0,5 ммоль CuI,0,5 ммоль лиганда и 2,1 ммоль Cs2CO3 в 4 мл DMAC. Проводили дегазирование реакционных смесей с помощью N2 в течение 30 мин, затем смеси нагревали при температуре от 80 до 100C в течение ночи в атмосфере N2. Процентный выход продукта рассчитывали как общую площадь под кривой ВЭЖХ в процентах для пика продукта. Более длительное время реакции указано в скобках). Таблица 2. Оценка различных растворителей(Реакции проводили параллельно в нескольких реакторах с применением 1,2 ммоль 2,4 дихлортиазола, 1 ммоль 7-(1-этилпропил)-3-йод-2,5-диметилпиразоло[1,5-a]пиримидина, 0,25 ммоль CuI,0,25 ммоль 1,10-фенантролина и 2,1 ммоль Cs2CO3 в 3 мл указанного растворителя. Проводили дегазирование реакционных смесей в атмосфере N2 в течение 30 мин, затем смеси нагревали при 100C в течение ночи в атмосфере N2. Процентный выход продукта рассчитывали как общую площадь под кривой ВЭЖХ в процентах для пика продукта). Таблица 3. Оценка различных источников меди(Реакции проводили параллельно в нескольких реакторах с применением 1 ммоль 2,4-дихлортиазола, 1 ммоль 7-(1-этилпропил)-3-йод-2,5-диметилпиразоло[1,5-a]пиримидина, 0, 05 ммоль CuX, 0,01 ммоль 1,10-фенантролина и 3 эквивалентов K3PO4 в 3 мл DMAC. Проводили дегазирование реакционных смесей в атмосфере N2 в течение 30 мин, затем смеси нагревали при 100C в течение ночи в атмосфереN2. Процентный выход продукта рассчитывали как общую площадь под кривой ВЭЖХ в процентах для пика продукта). Таблица 4. Оценка различных неорганических оснований(Реакции проводили параллельно в нескольких реакторах с применением 1 ммоль 2,4-дихлортиазола, 1 ммоль 7-(1-этилпропил)-3-йод-2,5-диметилпиразоло[1,5-a]пиримидина, 0,1 ммоль CuI, 0,01 ммоль 1,10-фенантролина и 2,1 ммоль основания, при этом проводили дегазирование в течение 30 мин с последующим добавлением 3 мл DMAC. Затем смеси дегазировали в атмосфере N2 в течение 10 мин, после чего нагревали при 100C в течение ночи в атмосфере N2. Процентный выход продукта рассчитывали как общую площадь под кривой ВЭЖХ в процентах для пика продукта). Пример 4. Применение морфолина одновременно в качестве реагента и основания в 2-МеТГФ в качестве растворителя 7-(1-этилпропил)-3-(2,4-дихлортиазол-5-ил)-2,5-диметилпиразоло[1,5-a]пиримидин (15,2 г, 41,16 ммоль) помещали в трехгорлую круглодонную колбу объемом 250 мл, затем добавляли 2-МеТГФ (61 мл,4,0 объема) и перемешивали полученную желтовато-коричневую смесь в течение 5 мин при температуре примерно 20C. Затем в течение 2-5 мин добавляли морфолин (19 г, 218,18 ммоль). Содержимое нагревали до кипения и кипятили с обратным холодильником в течение 12 ч. Затем смесь охлаждали до 25C,после чего добавляли 2-МеТГФ (53 мл, 3,5 объема) и воду (38 мл, 2,5 объема). Реакционную смесь нагревали до 40C, при этом происходило образование гомогенного раствора с двумя выраженными слоями. Слои разделяли, органический слой фильтровали и концентрировали до 3 объемов при атмосферном давлении. Добавляли 4 объема 2-пропанола (61 мл), проводили повторное концентрирование до 3 объемов, затем добавляли 4 объема 2-пропанола (61 мл), снова концентрировали до 3 объемов, добавляли еще 6 объемов 2-пропанола (91 мл) и кипятили с обратным холодильником в течение 15 мин. Прозрачный раствор постепенно охлаждали до 75C, вносили затравку в виде 0,45 г 7-(1-этилпропил)-3-(4-хлор 2-морфолин-4-илтиазол-5-ил)-2,5-диметилпиразоло[1,5-a]пиримидина, суспендированного в 2 мл 2 пропанола, промывали еще 2 мл 2-пропанола и переносили в кристаллизатор. Суспензию охлаждали до примерно 0-5C, выдерживали в течение 1 ч, фильтровали и промывали продукт 2-пропанолом (30 мл, 2 объема). Твердое вещество сушили в вакуум-сушильном шкафу при температуре 60C, получая 16,92 г 7(1-этилпропил)-3-(4-хлор-2-морфолин-4-илтиазол-5-ил)-2,5-диметилпиразоло[1,5-a]пиримидина. Чистота продукта согласно оценке методом ВЭЖХ составляла 100,00%. Данные по продукту, полученные при помощи порошковой рентгеновской дифрации и дифференциальной сканирующей калориметрии, совпадают с контрольным образцом. МС(ЭР)=420(М+1). Пример 5. Применение морфолина одновременно в качестве реагента и основания в 2-пропаноле в качестве растворителя. 7-(1-этилпропил)-3-(2,4-дихлортиазол-5-ил)-2,5-диметилпиразоло[1,5-a]пиримидин (11,64 ммоль) помещали в трехгорлую круглодонную колбу объемом 100 мл, затем добавляли 2-пропанол (16 мл, 3,72 объема). Желтовато-коричневую суспензию перемешивали в течение 5 минут при примерно 20C. Затем в течение 2-5 мин добавляли морфолин (3,3 г, 37,84 ммоль). Содержимое колбы кипятили с обратным холодильником в течение 6 часов. Суспензию охлаждали до 25C. Добавляли 2-пропанол (32 мл, 7,44 объема) и воду (8,6 мл, 2,0 объема), после чего смесь нагревали до 70-75C, фильтровали и концентрировали до 9 объемов при атмосферном давлении. Прозрачный раствор постепенно охлаждали до 55C,вносили в качестве затравки 0,06 г кристаллического 7-(1-этилпропил)-3-(4-хлор-2-морфолин-4 илтиазол-5-ил)-2,5-диметилпиразоло[1,5-a]пиримидина, суспендированного в 0,5 мл 2-пропанола, промывали еще 0,5 мл 2-пропанола и переносили в кристаллизатор. Смесь охлаждали до 0-5C, выдерживали в течение 1 часа, фильтровали и промывали продукт 2-пропанолом (9 мл, 2,1 объема). Затем сушили с помощью вакуум-фильтра при 60C с получением 4,6 г сухого 7-(1-этилпропил)-3-(4-хлор-2-морфолин 4-илтиазол-5-ил)-2,5-диметилпиразоло[1,5-a]пиримидина (88,8% выход, чистота согласно данным ВЭЖХ 99,88%) МС(ЭР) = 420 (М+1). Пример 6. 7-(1-Этилпропил)-3-(2,4-дихлортиазол-5-ил)-2,5-диметилпиразоло[1,5-a]пиримидин. 7-(1-этилпропил)-3-йод-2,5-диметилпиразоло[1,5-a]пиримидин (10 г, 29,17 ммоль), 2,4-дихлортиазол (5,2 г, 33,76 ммоль), карбонат цезия (19,9 г, 61,07 ммоль) и 1,10-фенантролин (1 г, 5,5 моль) помещали в трехгорлую круглодонную колбу объемом 250 мл с последующим добавлением 2-МеТГФ (36 мл, 3,6 объема). Реакционную смесь дегазировали азотом, затем создавали разрежение. Последовательно добавляли хлорид меди(I) (0,57 г, 5,7 ммоль), DMAC (10 мл, 1 объем) и 2-МеТГФ (4 мл, 0,4 объема). Затем реакционную смесь дегазировали азотом и создавали разрежение. Содержимое кипятили с обратным холодильником в течение 20 ч. Реакционную смесь охлаждали до 70C и добавляли 2-МеТГФ (100 мл,10 объемов). Содержимое фильтровали при 70C, и осадок на фильтре промывали 2-МеТГФ (80 мл, 8 объемов) при примерно 65-72C. Фильтрат переносили в делительную воронку и экстрагировали водой. Органический слой отделяли и промывали разбавленной соляной кислотой. Полученный органический слой обрабатывали углем Дарко G60 и подвергали горячему фильтрованию (60C). Фильтрат концентрировали при атмосферном давлении до -2,8 объемов. Добавляли 25 мл 2-пропанола, затем повторно концентрировали до 2,8 объемов. Добавляли еще 25 мл 2-пропанола и снова проводили концентрирование до 2,8 объемов. Наконец, добавляли 48 мл 2-пропанола, охлаждали содержимое до -7C и выдерживали при -7C в течение 1 ч, фильтровали и промывали 20 мл охлажденного 2-пропанола. Продукт сушили с помощью вакуум-фильтра, а затем под вакуумом при 60C с получением 9,41 г 7-(1-этилпропил)-3-(2,4 дихлортиазол-5-ил)-2,5-диметилпиразоло[1,5-a]пиримидина (чистота продукта согласно ВЭЖХ составляла 95,88%). МС(ЭР) = 369 (М+1). Пример 7. Синтез 7-(1-этилпропил)-3-(2,4-дихлортиазол-5-ил)-2,5-диметилпиразоло[1,5-a]пиримидина с использованием 1,4-диоксана в качестве растворителя и CuCl в качестве катализатора(1,0 эквивалент), 2,4-дихлортиазол (0,54 эквивалента) добавляли в реактор в атмосфере N2. Реактор продували N2 три раза, затем дегазировали N2 в течение 0,5-1 ч, после чего добавляли 1,10-фенантролин (0,3 эквивалента) и CuCl (0,3 эквивалента) в атмосфере N2, дегазировали N2 в течение 0,5-1 ч. Нагревали реактор до 100-110C в атмосфере N2. Смесь перемешивали в течение 22-24 ч при 100-110C. Охлаждали до 10-20C, добавляли воду (10 объемов) и СН 3 ОН (5 объемов), перемешивали смесь в течение 1-1,5 ч при 10-20C. Суспензию фильтровали, ресуспендировали влажный осадок в воде, перемешивали в течение 1-1,5 ч при 10-20C и снова фильтровали суспензию. Влажный осадок помещали в н-гептан (16 объемов) и EtOAc (2 объема) в атмосфере N2. Нагревали реактор до 40-50C в атмосфере N2. При 40-50C добавляли активированный уголь (0,1 Х). Реактор нагревали до 55-65C в атмосфере N2 и перемешивали при 55-65C в течение 1-1,5 ч. Суспензию фильтровали при 40-55C через диатомитEtOAc (10 объемов), органический слой промывали три раза 2 N HCl (10 объемов), затем два раза водой(10 Х, 10 объемов). Органический слой концентрировали до 3-4 объемов при температуре ниже 50C. Смесь нагревали до 80-90C, затем перемешивали при данной температуре в течение 40-60 мин. Смесь охлаждали до 0-5C, перемешивали в течение 1-1,5 ч при 0-5C и фильтровали. Осадок на фильтре промывали н-гептаном (1 объем) и сушили под вакуумом при 45-50C в течение 8-10 ч. Неочищенный продукт растворяли в 2-пропаноле (7,5 объема) в атмосфере N2 и перекристаллизовывали из 2-пропанола. Осадок сушили в вакуум-сушильном шкафу при 45-50C в течение 10-12 ч (55-80% выход). 1 Н ЯМР 6,537 (с, 1 Н) 3,591-3,659 (м, 1 Н, J=6,8 Гц), 2,593 (с, 3H), 2,512 (с, 3H), 1,793-1,921 (м, 4 Н), 0,885-0,903 (м,6 Н). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы где R1 и R2 независимо представляют собой этил или н-пропил; или соль указанного соединения. 2. Соединение по п.1 или соль указанного соединения, отличающиеся тем, что каждый из R1 и R2 представляет собой этил. 3. Способ получения соединения формулы где R1 и R2 независимо представляют собой этил или н-пропил, включающий стадии: или соли указанного соединения с 2,4-дихлортиазолом или его солью в присутствии катализатора на основе галогенида меди, лиганда, выбранного из 1,10-фенантролина и бипиридина, и основания, выбранного из K3PO4 и Cs2CO3, с образованием соединения формулыii) взаимодействия продукта со стадии i) с морфолином или его солью в присутствии подходящего неорганического основания. 4. Способ по п.3, отличающийся тем, что каждый из R1 и R2 представляет собой этил. 5. Способ по любому из пп.3 или 4, отличающийся тем, что галогенид меди представляет собойCuCl. 6. Способ по любому из пп.3-5, отличающийся тем, что лиганд представляет собой 1,10 фенантролин. 7. Способ по любому из пп.3-6, отличающийся тем, что основание на стадии i) представляет собойCs2CO3. 8. Способ по любому из пп.3-7, отличающийся тем, что основание на стадии ii) представляет собойK2CO3. 9. Способ по п.3, отличающийся тем, что каждый из R1 и R2 представляет собой этил, галогенид меди представляет собой CuCl, лиганд представляет собой 1,10-фенантролин, основание на стадии i) представляет собой Cs2CO3, а основание на стадии ii) представляет собой K2CO3. 10. Способ по п.9, отличающийся тем, что растворитель на стадии i) представляет собой 1,4-диоксан или 2-метилтетрагидрофуран/N,N-диметилацетамид, а растворитель на стадии ii) представляет собой морфолин, 2-метилтетрагидрофуран или 2-пропанол. 11. Способ получения соединения формулы где R1 и R2 независимо представляют собой этил или н-пропил, включающий взаимодействие соединения формулы или соли указанного соединения с избытком морфолина или его соли в подходящем растворителе. 12. Способ по п.11, отличающийся тем, что растворитель представляет собой 2-метилтетрагидрофуран. 13. Способ по п.11, отличающийся тем, что растворитель представляет собой 2-пропанол.-8 018807 14. Способ по любому из пп.11-13, отличающийся тем, что каждый из R1 и R2 представляет собой этил. 15. Способ получения соединения формулы где R1 и R2 независимо представляют собой этил или н-пропил, включающий стадии: или соли указанного соединения с 2,4-дихлортиазолом или его солью в присутствии катализатора на основе галогенида меди, лиганда, выбранного из 1,10-фенантролина и бипиридина, и основания, выбранного из K3PO4 и Cs2CO3, с образованием соединения формулыii) взаимодействия продукта со стадии i) с избытком морфолина или его соли в подходящем растворителе. 16. Способ по п.15, отличающийся тем, что растворитель на стадии ii) представляет собой 2-метилтетрагидрофуран. 17. Способ по п.15, отличающийся тем, что растворитель на стадии ii) представляет собой 2-пропанол. 18. Способ по любому из пп.15-17, отличающийся тем, что каждый из R1 и R2 представляет собой этил.
МПК / Метки
МПК: C07D 487/04
Метки: промежуточных, тиазолилпиразолопиримидины, качестве, ними, синтеза, способы, синтетических, соединений, связанные
Код ссылки
<a href="https://eas.patents.su/10-18807-tiazolilpirazolopirimidiny-v-kachestve-sinteticheskih-promezhutochnyh-soedinenijj-i-svyazannye-s-nimi-sposoby-sinteza.html" rel="bookmark" title="База патентов Евразийского Союза">Тиазолилпиразолопиримидины в качестве синтетических промежуточных соединений и связанные с ними способы синтеза</a>
Предыдущий патент: Композиции для осветления цвета кожи
Следующий патент: Ингибиторы протеинкиназы, фармацевтический состав на их основе и применение в терапии
Случайный патент: Устройство для измерения деформаций грунта














