Новые 2-замещённые d-гомо-эстра-1,3,5(10)-триены в качестве ингибиторов 17β-гидроксистероиддегидрогеназы типа 1
Номер патента: 11455
Опубликовано: 28.04.2009
Авторы: Петерс Олаф, Мёллер Габриела, Шнайдер Биргитт, Хиллиш Александер, Делюка Доминга, Элгер Вальтер, Адамски Ежи, Геге Кристиан, Регенхардт Вилько
Формула / Реферат
1. 2-Замещенные D-гомо-эстратриены общей формулы I
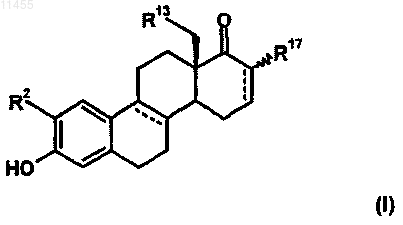
в которой
R2 означает C1-C8-алкильную группу, С2-С3-алкенильную группу, которые необязательно могут быть замещены фенилом, остатком 1- или 2-нафтила, C1-C8-алкоксигруппу или атом галогена,
R13 означает атом водорода или метильную группу,
R17 означает атом водорода или атом фтора,
причем пунктирные линии в кольце В и D молекулы стероида могут быть дополнительными двойными связями, а также их фармацевтически приемлемыми солями.
2. 2-Замещенный D-гомо-эстра-1,3,5(10)-триен по п.1, который отличается тем, что R2 представляет собой С1-С5-алкокси, C1-C5-алкил, или С2-С3-алкенил, или бром, или хлор.
3. 2-Замещенный D-гомо-эстра-1,3,5(10)-триен по п.1, который отличается тем, что R2 представляет собой остаток метокси или этокси, метильный, этильный или пропильный, а также аллильный остаток.
4. 2-Замещенный D-гомо-эстра-1,3,5(10)-триен по п.1, который отличается тем, что R13 представляет собой атом водорода.
5. 2-Замещенный D гомо-эстра-1,3,5(10)-триен по п.1, а именно:
1) 2-метокси-17а-оксо-17а-гомо-эстра-1,3,5(10)-триен-3-ол 1,
2) 2-этокси-17а-оксо-17а-гомо-эстра-1,3,5(10)-триен-3-ол,
3) 2-хлор-17а-оксо-17а-гомо-эстра-1,3,5(10)-триен-3-ол 2,
4) 2-бром-17а-оксо-17а-гомо-эстра-1,3,5(10)-триен-3-ол 3,
5) 2-йод-17а-оксо-17а-гомо-эстра-1,3,5(10)-триен-3-ол 4,
6) 2-хлор-17a-фтор-17а-оксо-17а-гомо-эстра-1,3,5(10)-триен-3-ол 5a,
7) 2-хлор-17b-фтор-17а-оксо-17а-гомо-эстра-1,3,5(10)-триен-3-ол 5b,
8) 2-бром-17a-фтор-17а-оксо-17а-гомо-эстра-1,3,5(10)-триен-3-ол,
9) 2-бром-17b-фтор-17а-оксо-17а-гомо-эстра-1,3,5(10)-триен-3-ол,
10) 2-(2-фенилэтил)-17а-оксо-17а-гомо-эстра-1,3,5(10)-триен-3-ол 6,
11) 2-аллил-17а-оксо-17а-гомо-эстра-1,3,5(10)-триен-3-ол 7,
12) 2-аллил-17a-фтор-17а-оксо-17а-гомо-эстра-1,3,5(10)-триен-3-ол,
13) 2-аллил-17b-фтор-17а-оксо-17а-гомо-эстра-1,3,5(10)-триен-3-ол,
14) 2-хлор-17а-оксо-17а-гомо-эстра-1,3,5(10),16-тетраен-3-ол,
15) 2-бром-17а-оксо-17а-гомо-эстра-1,3,5(10),16-тетраен-3-ол 8,
16) 2-аллил-17а-оксо-17а-гомо-эстра-1,3,5(10),16-тетраен-3-ол,
17) 2-пропил-17а-оксо-17а-гомо-эстра-1,3,5(10)-триен-3-ол,
18) 2-метокси-17а-оксо-17а-гомо-18а-гомо-эстра-1,3,5(10)-триен-3-ол,
19) 2-этокси-17а-оксо-17а-гомо-18а-гомо-эстра-1,3,5(10)-триен-3-ол,
20) 2-хлор-17а-оксо-17а-гомо-18а-гомо-эстра-1,3,5(10)-триен-3-ол,
21) 2-бром-17а-оксо-17а-гомо-18а-гомо-эстра-1,3,5(10)-триен-3-ол,
22) 2-йод-17а-оксо-17а-гомо-18а-гомо-эстра-1,3,5(10)-триен-3-ол,
23) 2-хлор-17a-фтор-17а-оксо-17а-гомо-18а-гомо-эстра-1,3,5(10)-триен-3-ол,
24) 2-хлор-17b-фтор-17а-оксо-17а-гомо-18а-гомо-эстра-1,3,5(10)-триен-3-ол,
25) 2-бром- 17a-фтор-17а-оксо-17а-гомо-18а-гомо-эстра-1,3,5(10)-триен-3-ол,
26) 2-бром-17b-фтор-17а-оксо-17а-гомо-18а-гомо-эстра-1,3,5(10)-триен-3-ол,
27) 2-аллил-17а-оксо-17а-гомо-18а-гомо-эстра-1,3,5(10)-триен-3-ол,
28) 2-аллил-17a-фтор-17а-оксо-17а-гомо-18а-гомо-эстра-1,3,5(10)-триен-3-ол,
29) 2-аллил-17b-фтор-17а-оксо-17а-гомо-18а-гомо-эстра-1,3,5(10)-триен-3-ол,
30) 2-хлор-17а-оксо-17а-гомо-18а-гомо-эстра-1,3,5(10),16-тетраен-3-ол,
31) 2-бром-17а-оксо-17а-гомо-18а-гомо-эстра-1,3,5(10),16-тетраен-3-ол,
32) 2-аллил-17а-оксо-17а-гомо-18а-гомо-эстра-1,3,5(10),16-тетраен-3-ол,
33) 2-пропил-17а-оксо-17а-гомо-18а-гомо-эстра-1,3,5(10)-триен-3-ол.
6. Применение 2-замещенных D-гомо-эстра-1,3,5(10)-триенов по одному из пп.1-5 для получения лекарственного средства, предназначенного для лечения эстрогензависимых заболеваний.
7. Применение 2-замещенных D-гомо-эстра-1,3,5(10)-триенов по п.6 для получения лекарственного средства для профилактики и лечения эстрогензависимых заболеваний, на которые можно оказать положительное влияние путем ингибирования 17b гидроксистероиддегидрогеназы.
8. Применение 2-замещенных D-гомо-эстра-1,3,5(10)-триенов по п.6 или 7 в качестве активного компонента комбинации, причем в комбинации используется по меньшей мере одно дополнительное активное вещество для получения лекарственного средства.
9. Применение 2-замещенных D-гомо-эстра-1,3,5(10)-триенов по п.8, причем дополнительное активное вещество представляет собой антиандроген, антигестаген, ингибитор ароматазы или антиэстроген.
10. Применение 2-замещенных D-гомо-эстра-1,3,5(10)-триенов по одному из пп.6-9 для получения лекарственного средства для профилактики и лечения гормонозависимых опухолевых заболеваний мужских и женских половых желез, мужских и женских половых органов, включая молочные железы.
11. Применение 2-замещенных D-гомо-эстра-1,3,5(10)-триенов по п.10 для получения лекарственного средства для профилактики и лечения рака молочной железы.
12. Применение 2-замещенных D-гомо-эстра-1,3,5(10)-триенов по п.10 для получения лекарственного средства для профилактики и лечения рака предстательной железы.
13. Применение 2-замещенных D-гомо-эстра-1,3,5(10)-триенов по п.10 для получения лекарственного средства для лечения эндометриоза.
14. Фармацевтические композиции, обладающие ингибирующим действием на 17b-гидроксистероиддегидрогеназу, включающие по меньшей мере одно соединение общей формулы I по одному из пп.1-5 и необязательно по меньшей мере одно дополнительное активное вещество вместе с фармацевтически приемлемыми вспомогательными веществами и/или носителями, причем дополнительное активное вещество представляет собой антиандроген, антигестаген, ингибитор ароматазы или антиэстроген.
Текст
011455 Данное изобретение касается новых 2-замещенных D-гомо-эстра-1,3,5(10)-триенов, их получения и применения в качестве лекарственного средства для лечения эстрогенозависимых заболеваний, на которые можно оказать влияние путем ингибирования 17-гидроксистероиддегидрогеназы типа 1, а также фармацевтических композиций, содержащих эти соединения. Половые гормоны контролируют пролиферацию и функцию чувствительной к стероидам нормальной,а также злокачественной ткани (Е.Е. Baulieu, Hormones, a complex communication network. In Hormones,eds. E.E. Baulieu and P.A. Kelly, Herman Publisher Paris and Chapman and Hall New York, 1990, стр. 147149; D.D. Thomas, Cancer 53 (1984) 595-601). Эстрадиол является самым активным женским половым гормоном, который, в дополнение к известным воздействиям на репродуктивную систему, оказывает влияние на дополнительные функции при метаболизме костной ткани и липида, в кардиоваскулярной системе, а также на регулирующие действия в центральной нервной системе. У женщин преклимактерического возраста это происходит сначала в яичниках. Следующая большая часть активного эстрогена образуется в периферической ткани из неактивных предшественников стероидов, которые у человека в большом количестве выделяются в кровь надпочечниками. После менопаузы уровень эстрадиола в крови снижается примерно на 1/10 от содержания у женщин преклимактерического возраста (T. Thorsten, M. Tangen, K.F. Stoa, Eur. J. Cancer Clin. Oncol. 18 (1982) 333-337; A.A. van Landeghem et al., Cancer Res. 45 (1985) в 2900-2906). Начиная с этого момента эстрогены, главным образом, доступны в периферической ткани путем биосинтеза (F. Labrie, Intracrinology. Mol.Cell. Endocrinol. 78 (1991) C113-C118). Эстрогены переносятся кровью от опухолевой ткани и стимулируют ее рост. Тем не менее, после менопаузы концентрация внутриопухолевого эстрадиола также сохраняется на высоком уровне по сравнению с женщинами преклимактерического возраста (A.A. van Landeghem et al.,Cancer Res. 45 (1985) 2900-2906). Высокая концентрация эстрадиола в опухолевой ткани у женщин постменопаузального возраста вызывается биосинтезом эстрогенов в опухолевой ткани. В ткани молочной железы, пораженной раком, эстрадиол (Е 2) образуется или путем ароматазы, или путем сульфатазы (Y.J. Abul-Hajj, R. Iverson, D.Т. Kiang, Steroids 33 (1979) 205-222; A. Lipton et al., Cancer 59 (1987), 779-782; E. Perel et al., J. Steroid Biochem. 29 (1988) 393-399). Андростендион переносится кровью от опухолевой ткани, ароматизируется в эстрон (Е 1) и затем восстанавливается в эстрадиол (Е 2)(путь ароматазы). При пути сульфатазы эстронсульфат посредством стероидсульфатазы превращается в Е 1 и снова восстанавливается в Е 2. Последняя решающая стадия синтеза стероидов катализируется 17-гидроксистероиддегидрогеназой (17-HSD), относящейся к семейству 17-гидроксистероиддегидрогеназ/17-кетостероидредуктаз. Эти ферменты не так активно превращают 17-кетостероиды в их активные 17-гидроксистероиды и наоборот. Как эстрогены, так и андрогены проявляют наивысшее сродство к соответствующим рецепторам в форме 17-гидрокси, т.е. ферменты 17-HSD управляют биологической активностью половых гормонов(Н. Peltoketo et al., J. Mol. Endocrinol. 23 (1999), 1-11; P. Vihko et al., Mol. Cell. Endocrinol. 171 (2001) 71-76). Некоторые внегонадные ткани, такие как ткани молочной железы и предстательной железы, выделяют редуктивные 17-HSD's и таким образом превращают предшественников циркулирующих в крови с более низкой активностью в целевых тканях в более активные формы (F. Labrie et al., Steroids 62 (1997) 148-158; H. Peltoketo et al., Horm. 55 (1999) 353-398). На сегодняшний день известно 11 различных 17-HSD's. Они отличаются своим тканевым распределением, каталитической активностью, своей субстратной специфичностью, субклеточной локализацией и механизмом регулирования. Для большого количества гидроксистероиддегидрогеназ можно было показать их участие в патогенезе заболеваний человека, например, для псевдогермафродитизма (17HSD 3, W.M. Geissler et al., Nat. Genet. 7 (1994) 34-39), бифункционального дефицита ферментов (17HSD 4, Е.G. van Grunsven et al., Proc. Natl. Acad. Sci. USA 95 (1998) 2128-2133), поликистозной болезни почек (17-HSD 8, M. Maxwell et al., J. Biol. Chem. 270 (1995) 25213-25219) и болезни Альцгеймера (17HSD 10, S.D. Yan et al., Nature 389 (1997) 689-695; X.Y. He et al., J. Biol. Chem. 274 (1999) 15014-15019). Человеческие плацентарные 17-гидроксистероиддегидрогеназы типа 1 и типа 2 относятся к тому же семейству протеинов стероиддегидрогеназы-редуктазы (SDR). Помимо всего прочего, они отличаются друг от друга направлением реакции, которое катализируется ферментами. 17-HSD 1 управляет, прежде всего, превращением эстрона в эстрадиол (Т. Puranen et al., Endocrinology 138 (1997) 3532-3539) при участии NADPH в качестве кофактора (J.Z. Jin, S.X. Lin, Biochem. Biophys.Res. Commun. 259 (1999) 489-493). В культивированных клетках HSD 1 частично поддерживает превращение андростендиона и андростандиона. Однако можно было однозначно обнаружить, что предпочтение отдается фенольным субстратам (М. Poutanen et al., Endocrinology 133 (1993) 2639-2644). По сравнению с 17-HSD 1, 17-HSD 2, напротив, катализирует обратную реакцию, а именно превращение эстрадиола в эстрон и андростендиона и дигидротестостерона в андростандион (L. Wu et al., J. Biol. Chem. 268(1993) 12964-12969) и действует предпочтительно в присутствии не фосфорилированной формы кофактора NAD (F. Labrie et al., Steroids 62 (1997) 148-158).-1 011455 17-HSD 1 и 2 выделяются в нормальной ткани молочных желез (G. Sderqvist, J. Clin. Endocrinol.Metab. 83 (1998) в 1190-1193; M. Miettinen, Breast Cancer Res. Treat. 57 (1999) 175-182). В противоположность нормальной ткани молочной железы, в злокачественных клетках эпителия молочной железы обнаруживают увеличение восстановительной активности (посредством 17-HSD 1) по сравнению с окислительной активностью (посредством 17-HSD 2) (М.М. Miettinen et al., Biochem. J. 314(1996) 839-845; V. Speirs, J. Steroid Biochem. Mol. Biol. 67 (1998) 267-274). Было замечено, что эстрадиол накапливается в злокачественных клетках молочной железы, что также указывает на активность 17HSD 1 (А. Vermeulen et al., Eur. J. Cancer Clin. Oncol. 22 (1986) 515-525). Кроме того, было обнаружено,что в присутствии 17-HSD 1 введение эстрона равным образом ведет к увеличению клеток рака молочной железы, как и введение одного эстрадиола. В противоположность этому, введение одного эстрона без 17-HSD 1 не вызывает подобного эффекта (М.М. Miettinen et al., Int. J. Cancer 68 (1996) 600-604). Преобладание 17-HSD 1 в злокачественной ткани ведет к усиленному эстрогенозависимому росту и прогрессу опухолей, в то время как окислительные 17-HSD 2 защищают нормальные клетки ткани молочной железы от чрезмерного воздействия эстрадиола (P. Vihko et al. Mol. Cell. Endocrinol. 171 (2000) 71-76). В случае эндометриоза имеет значение равновесие между 17-HSD 1 и 2. 17-HSD 1 выражается в эутопической ткани, тем не менее, гормоноинактивирующий фермент 176-HSD 2 отсутствует полностью(S.Е. Bulun et al. J. Mol. Endocrinol. 25 (2000) 35-42). Также при карциномах предстательной железы 17-HSD 2 понижается (J.P. Elo et al., Endocrinol.Metab. 88 (2003) 705-712). Среди выявленных на данный момент ингибиторов 17-HSD 1 различают необратимые и обратимые ингибиторы. Необратимые ингибиторы содержат реактивную функциональную группу, которая посредством образования ковалентной связи с остатком аминокислоты фермента инактивирует последний. Известными представителями указанной группы являются 16-метиленэстрадиолы, ацетилензамещенный 16-секоэстрадиол (R.J. Auchus, D.F. Covey, Biochemistry 25 (1983) 7295-7300; J.L. Thomas et al., J. Biol.Steroid Biochem. Mol. Biol. 66 (1998) 179-191). К обратимым ингибиторам относятся производные 16,17 пиразол- или 16,17-изоксазолэстроны (F. Sweet et al. Biochem. Biophys. Res. Commun. 180 (1991), 10571063), производные эстрадиола с длинной 7-ундеканаминой (С. Labrie et al. Cancer Res. 52 (1992), 610615; S.J. Santner, R.J. Santen, J. Steroid Biochem. Mol. Biol. 45 (1993) 383-390) или с 6-тиагептанамидной боковой цепью (D. Poirier, P. Dionne, S. Auger, J. Steroid Biochem. Mol. Biol. 64 (1998), 83-90). Особый случай составяляет, когда ингибитор 17-HSD 1 является 16-оксоэстроном: при нейтральном значении рН 7,2 он относится к обратимым ингибиторам, при основных условиях с рН 8,5 он относится к необратимым ингибиторам (Н. Inano, В. Tamaoki, Eur. J. Biochem. 129 (1983) 691-695). До сих пор известные как обратимые, так и необратимые ингибиторы обладают только умеренной активностью в качестве ингибиторов 17-HSD 1. Первый гибридный ингибитор был найден недавно с помощью моделирующих исследований (М.Tremblay, D. Poirier et al., FASEB 13 (2002) 1829-1831). Гибридный ингибитор, в котором эстрадиол связан с аденозином посредством спейсера, состоящего из 8 метиленовых групп в положении 16, ингибирует 17-HSD 1 как лучший на сегодняшний день ингибитор со значением IC50 в 52 нмоль. Исходя из размера этой молекулы такое соединение может быть биодоступным перорально весьма затруднительно. Не является маловероятным и то, что молекула вступает в перекрестную реакцию с другими NAD(P)(H) зависимыми ферментами. Из известного уровня техники 17-HSD 1 является мишенью для локального ингибирования биосинтеза эстрадиола. Сопутствующие лечению антигормонами, которые должны препятствовать связыванию активного стероида в соответствующем рецепторе, ингибиторы 17-HSD 1 могут использоваться для поддерживающей терапии эстрогенозависимых заболеваний. Поэтому задачей данного изобретения является предоставить дополнительные соединения, которые выборочно ингибируют 17-HSD 1. Эти соединения должны быть предназначены для лечения эстрогенозависимых заболеваний, а также гормонозависимых опухолевых заболеваний, на которые можно оказать влияние путем ингибирования 17-гидроксистероиддегидрогеназы типа 1. Дополнительными задачами данного изобретения являются получение и применение этих соединений в качестве лекарственного средства для лечения эстрогенозависимых заболеваний, а также гормонозависимых опухолевых заболеваний, на которые можно повлиять с помощью ингибирования 17 гидроксистероиддегидрогеназы типа 1. Согласно данному изобретению задача решается путем обеспечения новых 2-замещенных D-гомоэстра-1,3,5(10)-триенов общей формулы IR2 означает насыщенную или ненасыщенную С 1-С 8-алкильную группу, аралкил или остаток алкиларила, C1-C8-алкилоксигруппу или атом галогена,R13 означает атом водорода или метильную группу,R17 означает атом водорода или атом фтора,причем пунктирные линии в кольце В и D молекулы стероида могут быть дополнительными двойными связями, а также их фармацевтически приемлемыми солями. Далее данное изобретение охватывает новые соединения в качестве фармацевтически активных веществ, их получение, их терапевтическое применение и фармацевтические формы применения, которые содержат новые вещества. Согласно изобретению соединения общей формулы (I) или их фармацевтически приемлемые соли могут использоваться для получения лекарственного средства, в частности для лечения эстрогенозависимых заболеваний, а также гормонозависимых опухолевых заболеваний, на которые можно повлиять с помощью ингибирования 17-гидроксистероиддегидрогеназы типа 1. Было установлено, что в соответствии с изобретением низкомолекулярные 2-замещенные D-гомоэстра-1,3,5(10)-триены производят выборочное ингибирование 17-HSD 1-ферментной активности invitro сильнее, чем известные на сегодняшний день ингибиторы 17-HSD 1. Если не указано более подробно, согласно данному изобретению речь идет об остатке арила, который необязательно может быть замещен фенилом, остатком 1- или 2-нафтила, причем предпочтительным является остаток фенила. Если категорически не оговорено противное, то также всегда арил включает остаток гетероарила. Примерами гетероарила являются остаток 2-, 3- или 4-пиридинила, остаток 2- или 3-фурила, остаток 2- или 3-тиенила, остаток 2- или 3-пирролила, остаток 2-, 4- или 5-имидазолила, остаток пиразинила, остаток 2-, 4-, или 5-пиримидинила или остаток 3- или 4-пиридазинила. В качестве заместителей остатка арила или гетероарила могут быть указаны, например, метил, этил, трифторметил, пентафторэтил, трифторметилтио, метокси, этокси, нитро, циано, галоген (фтор, хлор, бром, йод), гидрокси, амино, моно(C1-8-алкил) или ди(С 1-8-алкил)амино, причем обе алкильные группы являются идентичными или различными, ди(аралкил)амино, причем обе аралкильные группы являются идентичными или различными. С 1-С 8-Алкильные группы для R2 могут быть насыщенными или ненасыщенными и быть замещенными частично или полностью. В качестве представителей насыщенных или ненасыщенных остатков алкила следует указать метильную, этильную, н-пропильную, изопропильную, н-, изо- или трет.-бутильную, н-, изоили неопентильную группу, гексил, гептил или октил. Метил, этил и пропил являются предпочтительными. Представителями ненасыщенных остатков алкила являются аллил и винил. В качестве C1-C5-алкокси остатка R2 может быть метокси, этокси, n-пропокси, изопропокси, n-, изоили трет.-бутокси, n-, изо- или неопентоксигруппа. В случае R2 в качестве галогена может быть хлор, йод или атом брома. Согласно данному изобретению предпочтительными являются соединения общей формулы I, в которых R2 является C1-C5-алкокси, C1-C5-алкилом, или С 2-С 3-алкенилом, или бромом, или хлором и R13 является атомом водорода. Указанные ниже соединения, а также их применение являются предпочтительными согласно изобретению: 1) 2-метокси-17 а-оксо-17 а-гомо-эстра-1,3,5(10)-триен-3-ол 1; 2) 2-этокси-17 а-оксо-17 а-гомо-эстра-1,3,5(10)-триен-3-ол; 3) 2-хлор-17 а-оксо-17 а-гомо-эстра-1,3,5(10)-триен-3-ол 2; 4) 2-бром-17 а-оксо-17 а-гомо-эстра-1,3,5(10)-триен-3-ол 3; 5) 2-йод-17 а-оксо-17 а-гомо-эстра-1,3,5(10)-триен-3-ол 4; 6) 2-хлор-17-фтор-17 а-оксо-17 а-гомо-эстра-1,3,5(10)-триен-3-ол 5a; 7) 2-хлор-17-фтор-17 а-оксо-17 а-гомо-эстра-1,3,5(10)-триен-3-ол 5 б; 8) 2-бром-17-фтор-17 а-оксо-17 а-гомо-эстра-1,3,5(10)-триен-3-ол; 9) 2-бром-17-фтор-17 а-оксо-17 а-гомо-эстра-1,3,5(10)-триен-3-ол; 10) 2-(2-фенилэтил)-17 а-оксо-17 а-гомо-эстра-1,3,5(10)-триен-3-ол 6; 11) 2-аллил-17 а-оксо-17 а-гомо-эстра-1,3,5(10)-триен-3-ол 7; 12) 2-аллил-17-фтор-17 а-оксо-17 а-гомо-эстра-1,3,5(10)-триен-3-ол; 13) 2-аллил-17-фтор-17 а-оксо-17 а-гомо-эстра-1,3,5(10)-триен-3-ол; 14) 2-хлор-17 а-оксо-17 а-гомо-эстра-1,3,5(10),16-тетраен-3-ол; 15) 2-бром-17 а-оксо-17 а-гомо-эстра-1,3,5(10),16-тетраен-3-ол 8;-3 011455 16) 2-аллил-17 а-оксо-17 а-гомо-эстра-1,3,5(10), 16-тетраен-3-ол; 17) 2-пропил-17 а-оксо-17 а-гомо-эстра-1,3,5(10)-триен-3-ол; 18) 2-метокси-17 а-оксо-17 а-гомо-18 а-гомо-эстра-1,3,5(10)-триен-3-ол; 19) 2-этокси-17 а-оксо-17 а-гомо-18 а-гомо-эстра-1,3,5(10)-триен-3-ол; 20) 2-хлор-17 а-оксо-17 а-гомо-18 а-гомо-эстра-1,3,5(10)-триен-3-ол; 21) 2-бром-17 а-оксо-17 а-гомо-18 а-гомо-эстра-1,3,5(10)-триен-3-ол; 22) 2-йод-17 а-оксо-17 а-гомо-18 а-гомо-эстра-1,3,5(10)-триен-3-ол; 23) 2-хлор-17-фтор-17 а-оксо-17 а-гомо-18 а-гомо-эстра-1,3,5(10)-триен-3-ол; 24) 2-хлор-17-фтор-17 а-оксо-17 а-гомо-18 а-гомо-эстра-1,3,5(10)-триен-3-ол; 25) 2-бром-17-фтор-17 а-оксо-17 а-гомо-18 а-гомо-эстра-1,3,5(10)-триен-3-ол; 26) 2-бром-17-фтор-17 а-оксо-17 а-гомо-18 а-гомо-эстра-1,3,5(10)-триен-3-ол; 27) 2-аллил-17 а-оксо-17 а-гомо-18 а-гомо-эстра-1,3,5(10)-триен-3-ол; 28) 2-аллил-17-фтор-17 а-оксо-17 а-гомо-18 а-гомо-эстра-1,3,5(10)-триен-3-ол; 29) 2-аллил-17-фтор-17 а-оксо-17 а-гомо-18 а-гомо-эстра-1,3,5(10)-триен-3-ол; 30) 2-хлор-17 а-оксо-17 а-гомо-18 а-гомо-эстра-1,3,5(10),16-тетраен-3-ол; 31) 2-бром-17 а-оксо-17 а-гомо-18 а-гомо-эстра-1,3,5(10),16-тетраен-3-ол; 32) 2-аллил-17 а-оксо-17 а-гомо-18 а-гомо-эстра-1,3,5(10),16-тетраен-3-ол; 33) 2-пропил-17 а-оксо-17 а-гомо-18 а-гомо-эстра-1,3,5 (10)-триен-3-ол. Фармакологические данные Ингибирование активности человеческой 17-гидроксистероиддегидрогеназы типа 1. Метод исследования хорошо описан в литературе (Adamski J., Sierralta W.D., Jungblut P.W., ActaEndocrinol. (Copenh.) 121 (2) (1989), 161-7) и представлен ниже. Человеческие 17-гидроксистероиддегидрогеназы (17-HSDs) выделяются чрезмерно в бактериях Е. coli в качестве His-Tag протеинов или GST-fusion протеинов. Суспензии бактериальных гранул в изотопном растворе поваренной соли используются для определения ферментной активности 17-HSDs и, соответственно, для исследования ее влияния посредством потенциальных ингибиторов (производных эстрогена). Измерения происходят в двойном определении и при необходимости в различных концентрациях потенциальных ингибиторов (например, при определении значений IC50). Наряду с ферментом-мишенью 17-HSD1, в испытание включены другие метаболизирующие стероиды ферменты, чтобы исследовать перекрестную реактивность производных эстрогена. 3 Н-меченный субстрат, бактериальные суспензии, ДМСО (в контрольном составе; конечный 1%) или потенциальные ингибиторы (производные эстрона в ДМСО) а также соответствующие кофакторы (NADP(H) или NAD(H); 5 мг/мл в Н 2 О) добавляют к определенному объему 100 ммоль буфера фосфата натрия. Инкубирование образцов происходит при 37 С в водяной бане при встряхивании, так что при проверке (без испытываемых веществ) достигают превращения примерно в 30%. Затем происходит разделение радиоактивно меченного субстрата и продукта, после извлечения 1 мл(RP-18)-кассет обратной фазы, с помощью ВЭЖХ (высокоэффективная жидкостная хроматография) на колонке RP18 с ацетонитрил:вода 1:1 (v/v) в качестве подвижной фазы. Радиоактивность обнаруживается с помощью проточного сцинтилляционного счетчика. Оценка превращения субстрата с и без испытываемых веществ проводится посредством интеграции пиков субстрата и продукта. Контроль нормализуется на 100% превращения. Таблица 1 Ингибирование человеческой 17-гидроксистероиддегидрогеназы-4 011455 Дозировка. В общем, следует ожидать удовлетворительных результатов при лечении эстрогенозависимых заболеваний, а также гормонозависимых опухолевых заболеваний, если суточные дозы находятся в пределах от 5 мкг до 50 мг соединения согласно изобретению на килограмм массы тела. Для более крупных млекопитающих животных, к примеру человека, рекомендованная суточная доза находится в пределах от 10 мкг до 30 мг на килограмм массы тела. Приемлемые дозировки для соединений согласно изобретению составляют от 0,005 до 50 мг в день на килограмм массы тела, в зависимости от возраста и телосложения пациента, причем необходимая суточная доза может быть принята однократно или за несколько приемов. Композицию фармацевтических препаратов на основе новых соединений получают известным способом, который состоит в том, что активное вещество обрабатывают с носителями, наполнителями, веществами, способствующими распаду, вяжущими средствами, увлажнителями, смазками, абсорбентами,разбавителями, улучшителями вкуса, красящими веществами и т.д., которые обычно используются в галеновых препаратах, и преобразовывают в желаемую форму введения. При этом делается ссылка наRemington's Pharmaceutical Science, 15-е изд-е Mack Publishing Company East Pennsylvania (1980). Для перорального применения подходят, в частности, таблетки, драже, капсулы, пилюли, порошки,грануляты, таблетки, пастилки, эмульсии или растворы. Для парентерального применения возможно использование препаратов для инъекций и вливаний. Для внутрисуставных инъекций могут использоваться приготовленные соответствующим образом кристаллические суспензии. Для внутримышечных инъекций могут применяться водные и масляные растворы для инъекций или суспензии и соответствующие препараты с эффектом депо. Для ректального применения новые соединения могут использоваться в форме суппозиториев, капсул, растворов (например, в виде клизм) и мазей, как для системной, так и для местной терапии. Для пульмонального применения новых соединений возможно их использование в форме аэрозолей и средств для ингаляций. Для местного нанесения подходят композиции в форме гелей, мазей, жирных мазей, кремов, паст,порошков, молочка и настоек. Дозировка соединений общей формулы I в этих композициях должна составлять 0,01-20% для того, чтобы достичь достаточного фармакологического действия. Данное изобретение включает соединения общей формулы I, а также их применение для изготовления лекарственного средства, в частности, для лечения эстрогенозависимых заболеваний, на которые возможно оказать положительное влияние путем ингибирования 17-гидроксистероиддегидрогеназы. Согласно изобретению соединения общей формулы I предпочтительно используются для изготовления лекарственного средства для лечения гормонозависимых опухолевых заболеваний мужских и женских половых желез, мужских и женских половых органов, включая молочные железы, в особенности рака предстательной железы или рака молочной железы. К тому же соединения согласно изобретению являются предпочтительными для изготовления лекарственного средства для лечения эндометриоза. Кроме того, данное изобретение касается фармацевтических композиций, которые содержат по меньшей мере одно соединение согласно изобретению, необязательно в форме фармацевтически/фармакологически приемлемой соли, без или вместе с фармацевтически приемлемыми вспомогательными веществами и/или носителями. Для этих фармацевтических композиций и лекарственных средств может быть предусмотрено пероральное, ректальное, вагинальное, подкожное, чрескожное, внутривенное или внутримышечное введение. Наряду с обычными носителями и/или разбавителями они содержат по меньшей мере одно соединение согласно изобретению. Лекарственные средства в соответствии с изобретением изготавливаются по известной технологии в соответствующей дозировке с помощью обычных твердых или жидких носителей или разбавителей и,как правило, использующихся фармацевтически-технических вспомогательных материалов в соответствии с желаемой методикой введения. Предпочтительно композиции представляют собой лекарственные формы, предназначенные для перорального введения. Такими лекарственными формами являются, к примеру, таблетки, таблетки с пленочным покрытием, драже, капсулы, пилюли, порошки, растворы или суспензии или также формы с эффектом депо. Фармацевтические композиции, которые содержат по меньшей мере одно из соединений согласно изобретению, предпочтительно вводятся пероральным путем. Также принимаются во внимание и препараты для парентерального введения, такие как растворы для инъекций. Далее могут быть указаны, например, суппозитории и средства для вагинального применения. Соответствующие таблетки могут быть получены, например, путем смешивания активного вещества с известными вспомогательными веществами, например инертными разбавителями, такими как декстроза, сахар, сорбит, маннит, поливинилпирролидон, с разрыхлителями, такими как кукурузный крахмал или альгиновая кислота, со связующими средствами, такими как крахмал или желатин, со смазывающи-5 011455 ми веществами, такими как стеарат магния или тальк, и/или средствами, обеспечивающими эффект депо,такими как карбоксилполиметилен, карбоксилметилцеллюлоза, ацетатфталат целлюлозы или поливинилацетат. Таблетки могут также состоять из нескольких слоев. Соответствующим образом также могут производиться драже путем нанесения на полученные аналогично таблеткам ядра покрытия из обычно используемых для таких целей веществ, например поливинилпирролидола или шеллака, аравийской камеди, талька, оксида титана или сахара. При этом оболочка драже также может состоять из нескольких слоев, в которых могут использоваться такие же вспомогательные вещества, что и указанные выше для таблеток. Растворы или суспензии соединений общей формулы I согласно изобретению дополнительно могут содержать средства улучшающие вкус, такие как сахарин, цикламат или сахар, а также, например, ароматические вещества, такие как ванилин или апельсиновый экстракт. Кроме того, они могут содержать вспомогательные суспендирующие вещества, такие как натриумкарбоксиметилцелюллоза, или консерванты, как n-гидроксибензоаты. Капсулы, которые содержат соединения общей формулы I, могут производиться, например, путем смешивания соединения(й) общей формулы I с инертным носителем, таким как лактоза или сорбит, и последующего инкапсулирования в желатиновые капсулы. Подходящие суппозитории можно изготавливать, например, путем смешивания с предусмотренными для этой цели носителями, такими как нейтральные жиры или полиэтиленгликоль, или с их производными. В соответствии с изобретением соединения могут применяться для профилактики и лечения карцином молочной железы или предстательной железы, а также эндометриоза в комбинации с одним или несколькими из следующих активных веществ: 1) антиандрогены, такие как ципротеронацетат, флутамид, казодекс и т.д.,2) агонисты гонадотропного гормона (GnRH), такие как синарел, лупрон, бусрелин,3) ингибиторы ароматазы, такие как анастрозол, форместан, летрозол, эксеместан,4) ингибиторы 5-редуктазы, такие как финастерид,5) цитостатики, такие как винбластин, даунорубицин,6) ингибиторы VEGF киназы,7) антигестагены, такие как онапристон, мифепристон,8) антиэстрогены, такие как тамоксифен,9) антисенсовые олигонуклеотиды,10) антитела EGF. Исходя из этого, соединения общей формулы I согласно изобретению не могут назначаться для терапии и профилактики других патологических состояний, не указанных выше. Нижеследующие примеры служат для более детального объяснения объекта изобретения, но, тем самым, не ограничивают его. Исходя из 17-кето производных, могут быть изготовлены 17-оксираны (М. Hbner, I. Noack, J. Prakt.Chem. 1972, 314, 667) и из них соответствующие производные 17 а-гомо (М. Hbner, K. Ponsold, Z. Chem. 1982, 22, 186). Вышеуказанные стадии реакции могут проводиться до или после функцианализации позиции 2. Введение галогенов в позицию 2 происходит посредством ортоталлирования, как это описано в литературе для производных 17-кето (Р.С. Bulman Page et al., Tetrahedron 1990, 46, 2059). Функционализация С атома 2 производного эстра-1,3,5(10)-триен-17-она происходит преимущественно посредством Фридель-Крафтс ацилирования, как это описано в литературе (Т. Nambara et al.,Chem. Pharm. Bull. 1979, 18, 474). После изменения защитной группы в 3 позиции 2-карбоксиэстра 1,3,5(10)-триен-17-он вырабатывается окислением Байер-Виллигер (М.В. Smith, J. March, March's AdvancedOrganic Chemistry, 5-е издание, Wiley Sons 2001, 1417-1418). Сложный эфир омыляется и превращается с соответствующим алкилгалогенидом при основных условиях в 2-алкил простой эфир. Разрыв защитной группы в 3 позиции происходит, как описано в литературе (T.W. Greene, P.G.M. Wuts, Protective Groupsin Organic Synthesis, WileySons, 1999, 249-275). Этот или другой способ (P.N. Rao, J.W. Cessac, Steroids 2002, 67, 1065) может быть применим, соответственно, и к производным 17 а-гомо. Соответствующие производные 2-алкила могут быть получены из производных 2-ацил посредством восстановления с боргидридом натрия, гидрирования и последующего окисления по Оппенауэру (С.Djerassi, Org. React. 1951, 6, 207). Введение 2-аллил группы может происходить посредством перегруппировки Клайзена, как это описано в литературе (L. Troisi et al., Tetrahedron Lett. 1999, 40, 1771). В дальнейшем это может функционализировать аналогично методам описанным далее Т. Buskas et al. (J. Org. Chem. 2000, 65, 958). Более длинные, также ненасыщенные или функциональные остатки алкила в позиции 2 могут быть получены путем сочетания Соногашира или, желательнее, необязательно подходящим образом защищенных алкинов и последующего (частичного) гидрирования. 17-Фторирование 17 а-кетона может быть проведено, как это описано А.С. Stalford et al. (Steroids 1997, 62, 750) или также S. Stavber et al. (Synthesis 2002, 2609).-6 011455 Синтез 16,17-дегидропроизводных может также проводиться аналогично известным процессам (см.,например, P.N. Rao et al., Steroids, 2002, 67, 1079). Способы получения Пример 1. 2-Метокси-17 а-оксо-17 а-гомо-эстра-1,3,5(10)-триен-3-ол 1. 3,61 г 17 а-азидометил-3,17-дигидрокси-2-метоксиэстра-1,3,5(10)-триена и 7,5 г йодида натрия были взвешены в 250 мл ацетонитрила, и их медленно перемешивали при комнатной температуре с 15 мл триметилсилилхлорида. Через 4 ч добавили еще 4 мл триметилсилилхлорида и по истечении еще 2,5 ч смешали с насыщенным раствором тиосульфата натрия и водой и экстрагировали с дихлорметаном (3). Объединенные органические фазы были промыты водным раствором бикарбоната натрия, высушены и сконцентрированы путем упаривания в ротационном выпарном аппарате. Флеш-хроматография (циклогексан/этилацетат=10:17:15:1) дала 2,12 г (67%) 2-метокси-17 а-оксо-17 а-гомо-эстра-1,3,5(10)-триен 3-ола 1 в виде бесцветных кристаллов. 1 Н-NMR (CDCl3): =1,13 (s, 3H; 18-CH3), 2,62-2,71 (m, 1H; 17-H), 2,77 (dd, 2H; 6-CH2), 3,86 (s, 3H; 2OCH3), 5,48 (s, 1H; 3-OH), 6,63, 6,78 (2s, 2H; 1-H, 4-H). Пример 2. 2-Хлор-17 а-оксо-17 а-гомо-эстра-1,3,5(10)-триен-3-ол 2. 307 мг (851 мкмоль) 3-ацетокси-2-хлор-17 а-оксо-17 а-гомо-эстра-1,3,5(10)-триена растворяли в 24 мл дихлорметана/метанола (2:1) и смешивали с 45 мг натриевого метанолата. Через 1,5 ч смесь нейтрализовали с амберлитом IR120 (Н+), отфильтровывали и концентрировали путем упаривания в ротационном выпарном аппарате. Флеш-хроматография (толуол/этилацетат=25:1) дала 173 мг (64%) 2-хлор-17 а-оксо 17 а-гомо-эстра-1,3,5(10)-триен-3-ола 2 в виде бесцветных кристаллов. 1H-NMR (CDCl3): =1,12 (s, 3H; 18-CH3), 2,62-2,71 (ddd, J=6,8, 14,1, 14,1 Гц, 1H; 17-H), 2,77-2,81 (m,2H; 6-CH2), 5,29 (s, 1H; 3-OH), 6,71, 7,52 (2s, 2H; 1-H, 4-H). Пример 5. 2-Хлор-17-фтор-17 а-оксо-17 а-гомо-эстра-1,3,5(10)-триен-3-ол 5a и 2-хлор-17-фтор 17 а-оксо-17 а-гомо-эстра-1,3,5(10)-триен-3-ол 5b. 60 мг (188 мкмоль) 2-хлор-17 а-оксо-17 а-гомо-эстра-1,3,5(10)-триен-3-ола 2 нагревали с примерно 190 мг 1-фтор-4-гидрокси-1,4-диазониябицикло[2,2,2]октан-бис(тетрафторбората) на оксиде алюминия в 10 мл метанола в течение 5 ч, охлаждали при комнатной температуре, смешивали с 1 н. соляной кислотой и экстрагировали с помощью дихлорметана. Органические фазы высушивали и концентрировали путем упаривания в ротационном выпарном аппарате. Очищение с помощью ВЭЖХ (Chiracel OJ-H, н-гептан/2 пропанол=6:4) дало примерно 10 мг 2-хлор-17 а-фтор-17 а-оксо-17 а-гомо-эстра-1,3,5(10)-триен-3-ола 5a и 2-хлор-17-фтор-17 а-оксо-17 а-гомо-эстра-1,3,5(10)-триен-3-ола 5b в виде бесцветного твердого вещества. 5a: 1H-NMR (CDCl3): =1,13 (s, 3H; 18-СН 3), 5,32 (ddd, JHF=48,8, JHH=7,4, 12,5 Гц, 1 Н; 17-Н), 6,72,7,21 (2s, 2H; 1-H, 4-Н)-19F-NMR (CDCl3): =-192,20 (dd, J=48,9, 12,8 Гц). 5b: 1H-NMR (CDCl3): =1,21 (d, J=3,1 Гц, 3 Н; 18-СН 3), 4,86 (, JHF=49,2, JHH=3,9, 6,6 Гц, 1H; 17a-H),6,73, 7,20 (2 s, 2H; 1-H, 4-H)-19F-NMR (CDCl3): =-183,02-183,28 (m). Пример 6. 2-(2-Фенилэтил)-17 а-оксо-17 а-гомо-эстра-1,3,5(10)-триен-3-ол 6. 56 мг (123 мкмоль) 3-ацетокси-2-йод-17 а-оксо-17 а-гомо-эстра-1,3,5(10)-триена растворяли в 8 мл третиламин/ТГФ (3:1), смешивали с 3 мг ацетата палладиума II, 5 мг йодида меди I, 6,5 мг трифенилфосфина и 26 мкл фенилацетилена и перемешивали в течение 45 мин при комнатной температуре под аргоном. Затем разбавляли этилацетатом, промывали 1 н. соляной кислотой, ненасыщенным раствором гидрокарбоната натрия и раствором поваренной соли, высушивали, концентрировали путем упаривания в ротационном выпарном аппарате и очищали с помощью флеш-хроматографии (циклогексан/этилацетат 10:15:1). Было получено 42 мг (80%) 3-ацетокси-2-(2-фенилэтинил)-17 а-оксо-17 а-гомо-эстра-1,3,5(10)триена в виде коричнево-черных кристаллов. 1(m, 5H; Ph)-13C-NMR (CDCl3): =16,79, 20,84, 22,87, 25,59, 25,80, 26,22, 29,75, 32,33, 37,08, 38,14, 42,89,48,17, 50,17, 84,58, 92,92, 114,101, 121,64, 122,91, 128,12, 129,82, 131,24, 137,92, 138,52, 148,90, 168,97,215,83. 27 мг (63 мкмоль) 3-ацетокси-2-(2-фенилэтинил)-17 а-оксо-17 а-гомо-эстра-1,3,5(10)-триена растворяли в 10 мл этилацетата/ТГФ (9:1), смешивали с 3 каплями уксусной кислоты и 55 мг палладиума на-7 011455 активированном угле (10%) и гидрировали в течение 3 ч. Затем катализатор отфильтровывали, концентрировали в ротационном выпарном аппарате и соконденсировали несколько раз с толуолом. Остаток растворяли в 6 мл дихлорметана, смешивали с 20 мл метанола и 100 мг натриевого метанолата и перемешивали в течение 2 ч. Затем нейтрализовали с амберлитом IR120 (Н+), отфильтровывали и концентрировали в ротационном выпарном аппарате. Флеш-хроматография (циклогексан/этилацетат=5:1) дала 16 мг (65%) 2-(2-фенилэтил)-17 а-оксо-17 а-гомо-эстра-1,3,5(10)-триен-3-ола 6 в виде бесцветных игольчатых кристаллов. 1H-NMR (CDCl3): =1,13 (s, 3 Н; 18-СН 3), 2,85-2,89 (m, 4H, PhCH2), 4,46 (s, 1H; ОН), 6,48, 7,02 (2s,2 Н; 1-Н, 4-Н), 7,19-7,30 (m, 5 Н; Ph). Пример 7. 2-Аллил-17 а-оксо-17 а-гомо-эстра-1,3,5(10)-триен-3-ол 7. 315 мг (1.11 ммоль) 17 а-оксо-17 а-гомо-эстра-1,3,5(10)-триен-3-ола растворяли в 5 мл абсолютного ДМФА, смешивали с 1,8 г карбоната цезия и 1 мл аллилбромида и нагревали в течение 3 ч до 60 С. Затем смешивали с этилацетатом и промывали водой и раствором поваренной соли. Органическая фаза была отделена, высушена и сконцентрирована в ротационном выпарном аппарате. Флеш-хроматография (циклогексан/этилацетат=40:120:110:1) дала 322 мг (89%) 3-аллилокси 17 а-оксо-17 а-гомо-эстра-1,3,5(10)-триена в виде бесцветных кристаллов. 1H-NMR (CDCl3): =1,12 (d, 3 Н; 18-СН 3), 2,62-2,71 (m, 1H; 17-Н), 2,83-2,86 (m, 2 Н; 6-Н), 4,50 (d,J=5,0 Гц, 2 Н; ОСН 2), 5,26 (dd, J=1,2, 10,5 Гц, 1H, =СНН), 5,37 (dd, J=1,2, 17,2 Гц, 1H; =СНН), 5,99-6,07 (m,1H; СН=СН 2), 6,63 (d, J=2,3 Гц, 1H; 4-Н), 6,72 (dd, J=2,3, 8,2 Гц, 1 Н; 2-Н), 7,20 (d, J=8,6 Гц, 1H; 1-Н). 315 мг (971 мкмоль) 3-аллилокси-17 а-оксо-17 а-гомо-эстра-1,3,5(10)-триена растворяли в 25 мл диэтиланилина под аргоном и подогревали в течение 8 ч. Затем смешивали с этилацетатом и промывали 1 н. соляной кислотой и раствором поваренной соли. Органическая фаза была отделена, высушена и сконцентрирована в ротационном выпарном аппарате. Флеш-хроматография (циклогексан/этилацетат=9:1) дала 312 мг (99%) смеси обоих региоизомеров в виде бесцветной пены. Отделение с помощью ВЭЖХR2 означает C1-C8-алкильную группу, С 2-С 3-алкенильную группу, которые необязательно могут быть замещены фенилом, остатком 1- или 2-нафтила, C1-C8-алкоксигруппу или атом галогена,R13 означает атом водорода или метильную группу,R17 означает атом водорода или атом фтора,причем пунктирные линии в кольце В и D молекулы стероида могут быть дополнительными двойными связями, а также их фармацевтически приемлемыми солями. 2. 2-Замещенный D-гомо-эстра-1,3,5(10)-триен по п.1, который отличается тем, что R2 представляет собой С 1-С 5-алкокси, C1-C5-алкил, или С 2-С 3-алкенил, или бром, или хлор. 3. 2-Замещенный D-гомо-эстра-1,3,5(10)-триен по п.1, который отличается тем, что R2 представляет собой остаток метокси или этокси, метильный, этильный или пропильный, а также аллильный остаток. 4. 2-Замещенный D-гомо-эстра-1,3,5(10)-триен по п.1, который отличается тем, что R13 представляет собой атом водорода. 5. 2-Замещенный D гомо-эстра-1,3,5(10)-триен по п.1, а именно: 1) 2-метокси-17 а-оксо-17 а-гомо-эстра-1,3,5(10)-триен-3-ол 1,2) 2-этокси-17 а-оксо-17 а-гомо-эстра-1,3,5(10)-триен-3-ол,3) 2-хлор-17 а-оксо-17 а-гомо-эстра-1,3,5(10)-триен-3-ол 2,-8 011455 4) 2-бром-17 а-оксо-17 а-гомо-эстра-1,3,5(10)-триен-3-ол 3,5) 2-йод-17 а-оксо-17 а-гомо-эстра-1,3,5(10)-триен-3-ол 4,6) 2-хлор-17-фтор-17 а-оксо-17 а-гомо-эстра-1,3,5(10)-триен-3-ол 5a,7) 2-хлор-17-фтор-17 а-оксо-17 а-гомо-эстра-1,3,5(10)-триен-3-ол 5b,8) 2-бром-17-фтор-17 а-оксо-17 а-гомо-эстра-1,3,5(10)-триен-3-ол,9) 2-бром-17-фтор-17 а-оксо-17 а-гомо-эстра-1,3,5(10)-триен-3-ол,10) 2-(2-фенилэтил)-17 а-оксо-17 а-гомо-эстра-1,3,5(10)-триен-3-ол 6,11) 2-аллил-17 а-оксо-17 а-гомо-эстра-1,3,5(10)-триен-3-ол 7,12) 2-аллил-17-фтор-17 а-оксо-17 а-гомо-эстра-1,3,5(10)-триен-3-ол,13) 2-аллил-17-фтор-17 а-оксо-17 а-гомо-эстра-1,3,5(10)-триен-3-ол,14) 2-хлор-17 а-оксо-17 а-гомо-эстра-1,3,5(10),16-тетраен-3-ол,15) 2-бром-17 а-оксо-17 а-гомо-эстра-1,3,5(10),16-тетраен-3-ол 8,16) 2-аллил-17 а-оксо-17 а-гомо-эстра-1,3,5(10),16-тетраен-3-ол,17) 2-пропил-17 а-оксо-17 а-гомо-эстра-1,3,5(10)-триен-3-ол,18) 2-метокси-17 а-оксо-17 а-гомо-18 а-гомо-эстра-1,3,5(10)-триен-3-ол,19) 2-этокси-17 а-оксо-17 а-гомо-18 а-гомо-эстра-1,3,5(10)-триен-3-ол,20) 2-хлор-17 а-оксо-17 а-гомо-18 а-гомо-эстра-1,3,5(10)-триен-3-ол,21) 2-бром-17 а-оксо-17 а-гомо-18 а-гомо-эстра-1,3,5(10)-триен-3-ол,22) 2-йод-17 а-оксо-17 а-гомо-18 а-гомо-эстра-1,3,5(10)-триен-3-ол,23) 2-хлор-17-фтор-17 а-оксо-17 а-гомо-18 а-гомо-эстра-1,3,5(10)-триен-3-ол,24) 2-хлор-17-фтор-17 а-оксо-17 а-гомо-18 а-гомо-эстра-1,3,5(10)-триен-3-ол,25) 2-бром- 17-фтор-17 а-оксо-17 а-гомо-18 а-гомо-эстра-1,3,5(10)-триен-3-ол,26) 2-бром-17-фтор-17 а-оксо-17 а-гомо-18 а-гомо-эстра-1,3,5(10)-триен-3-ол,27) 2-аллил-17 а-оксо-17 а-гомо-18 а-гомо-эстра-1,3,5(10)-триен-3-ол,28) 2-аллил-17-фтор-17 а-оксо-17 а-гомо-18 а-гомо-эстра-1,3,5(10)-триен-3-ол,29) 2-аллил-17-фтор-17 а-оксо-17 а-гомо-18 а-гомо-эстра-1,3,5(10)-триен-3-ол,30) 2-хлор-17 а-оксо-17 а-гомо-18 а-гомо-эстра-1,3,5(10),16-тетраен-3-ол,31) 2-бром-17 а-оксо-17 а-гомо-18 а-гомо-эстра-1,3,5(10),16-тетраен-3-ол,32) 2-аллил-17 а-оксо-17 а-гомо-18 а-гомо-эстра-1,3,5(10),16-тетраен-3-ол,33) 2-пропил-17 а-оксо-17 а-гомо-18 а-гомо-эстра-1,3,5(10)-триен-3-ол. 6. Применение 2-замещенных D-гомо-эстра-1,3,5(10)-триенов по одному из пп.1-5 для получения лекарственного средства, предназначенного для лечения эстрогензависимых заболеваний. 7. Применение 2-замещенных D-гомо-эстра-1,3,5(10)-триенов по п.6 для получения лекарственного средства для профилактики и лечения эстрогензависимых заболеваний, на которые можно оказать положительное влияние путем ингибирования 17 гидроксистероиддегидрогеназы. 8. Применение 2-замещенных D-гомо-эстра-1,3,5(10)-триенов по п.6 или 7 в качестве активного компонента комбинации, причем в комбинации используется по меньшей мере одно дополнительное активное вещество для получения лекарственного средства. 9. Применение 2-замещенных D-гомо-эстра-1,3,5(10)-триенов по п.8, причем дополнительное активное вещество представляет собой антиандроген, антигестаген, ингибитор ароматазы или антиэстроген. 10. Применение 2-замещенных D-гомо-эстра-1,3,5(10)-триенов по одному из пп.6-9 для получения лекарственного средства для профилактики и лечения гормонозависимых опухолевых заболеваний мужских и женских половых желез, мужских и женских половых органов, включая молочные железы. 11. Применение 2-замещенных D-гомо-эстра-1,3,5(10)-триенов по п.10 для получения лекарственного средства для профилактики и лечения рака молочной железы. 12. Применение 2-замещенных D-гомо-эстра-1,3,5(10)-триенов по п.10 для получения лекарственного средства для профилактики и лечения рака предстательной железы. 13. Применение 2-замещенных D-гомо-эстра-1,3,5(10)-триенов по п.10 для получения лекарственного средства для лечения эндометриоза. 14. Фармацевтические композиции, обладающие ингибирующим действием на 17-гидроксистероиддегидрогеназу, включающие по меньшей мере одно соединение общей формулы I по одному из пп.1-5 и необязательно по меньшей мере одно дополнительное активное вещество вместе с фармацевтически приемлемыми вспомогательными веществами и/или носителями, причем дополнительное активное вещество представляет собой антиандроген, антигестаген, ингибитор ароматазы или антиэстроген.
МПК / Метки
МПК: A61K 31/56, C07J 63/00, A61P 5/32
Метки: качестве, 17β-гидроксистероиддегидрогеназы, 2-замещённые, новые, типа, ингибиторов, d-гомо-эстра-1,3,5(10)-триены
Код ссылки
<a href="https://eas.patents.su/10-11455-novye-2-zameshhyonnye-d-gomo-estra-13510-trieny-v-kachestve-ingibitorov-17beta-gidroksisteroiddegidrogenazy-tipa-1.html" rel="bookmark" title="База патентов Евразийского Союза">Новые 2-замещённые d-гомо-эстра-1,3,5(10)-триены в качестве ингибиторов 17β-гидроксистероиддегидрогеназы типа 1</a>
Предыдущий патент: Применение гидроксиароматических соединений в качестве защитных веществ
Следующий патент: Кристаллизированный полиэтилентерефталат, содержащий кремний, способ его получения, его применение и способ получения аморфного полиэтилентерефталата
Случайный патент: Искусственная трава с упругим гранулированным верхним поверхностным слоем