Производные 6-(4-фенилбутокси)гексиламина и способ получения сальметерола
Номер патента: 3397
Опубликовано: 24.04.2003
Авторы: Маркильяс Олондрис Франциско, Далмасес Бархуан Пере, Бесса Бельмунт Хорди
Формула / Реферат
1. Производные 6-(4-фенилбутокси)гексиламина общей формулы (I)
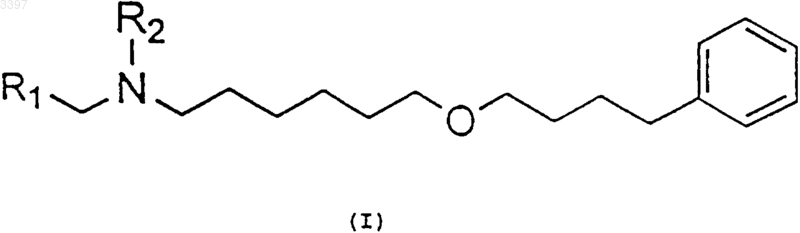
где R1 - CHO или CHOR3OR4-группа, где R3 и R4 независимо являются C1-C6алкил, аралкилгруппами или они образуют 5- или 6-членные циклические ацетали, и
R2 - атом водорода, бензил- или алкилоксикарбонил-, арилоксикарбонил-, аралкилоксикарбонил- или ацилгруппа.
2. Соединение по п.1, отличающееся тем, что R1-CHO-группа, R2 - алкилоксикарбонил-, арилоксикарбонил-, аралкилоксикарбонил- или ацилгруппа.
3. Соединение по п.1, отличающееся тем, что R3 и R4 независимо являются метил-, этил-, бензилгруппами или они образуют 1,3-диоксоланы или 1,3-диоксаны.
4. Соединение по п.1 или 2, отличающееся тем, что R2 является трет-бутоксикарбонил-, бензилоксикарбонил-, этоксикарбонил-, ацетил-, бензоил- или трифторацетилгруппой.
5. Способ получения сальметерола или его фармацевтически приемлемых солей, отличающийся тем, что осуществляют реакцию металлоорганического соединения общей формулы (13)
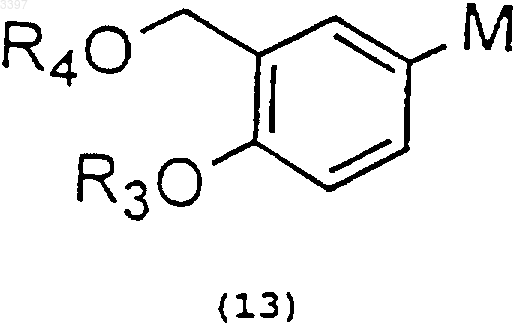
где M - группа, содержащая металл, выбранный из лития, магния или меди, с полупродуктом общей формулы (I) по п.1 в инертном растворителе при температуре в пределах от -40 до 40шC с последующим гидролизом и удалением защитных групп.
6. Способ по п.5, отличающийся тем, что инертный растворитель представляет собой простой эфир, как например этиловый эфир, или тетрагидрофуран.
7. Способ по п.5, отличающийся тем, что данную реакцию проводят при температуре в интервале от -40 до 10шC.
8. Способ по п.5, отличающийся тем, что R3 и R4 независимо являются метил-, этил-, бензилгрупами, 2,2-диметил-1,3-диоксаном или 2-метил-1,3-диоксаном.
9. Способ по п.5, отличающийся тем, что M является литием, MgBr или MgCl.
10. Способ получения производного 6-(4-фенилбутокси)гексиламина общей формулы (I) по любому из пп.1-4, отличающийся тем, что осуществляют следующие стадии:
1) алкилирование амина взаимодействием соединения формулы (11) с соединением формулы (12)

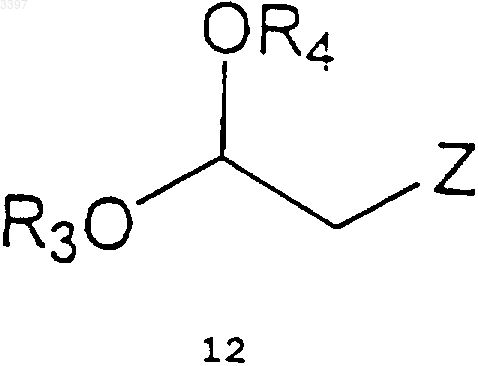
где R3 и R4 независимо являются C1-C6алкил-, аралкилгруппами или они образуют 5- или 6-членные циклические ацетали, и
Z1 и Z2 каждая группа различна или одинакова с L или NHR2, причем L-отщепляемая группа, как например, хлор, бром, йод метансульфонилокси- или n-толуолсульфонилоксигруппа, и R2 атом водорода или бензилгруппа,
в инертном растворителе в присутствии органического или неорганического основания при температуре в пределах от 25 до 110шC с получением соединения общей формулы (I)

где R1 - CHOR3OR4-группа и R3 - атом водорода или бензилгруппа,
2) защиту аминогруппы соединения, полученного в стадии (1), подходящим реагентом с предварительным гидрированием, если R2 является бензилгруппой в инертном растворителе, возможно в присутствии органического или неорганического основания при температуре в интервале от 0 до 50шC для получения соединений формулы (I), где R1=CHOR3OR4-группа и R2=алкилоксикарбонил-, арилоксикарбонил-, аралкилоксикарбонил- или ацилгруппа,
3) превращение соединения, полученного в стадии (2), в соответствующий альдегид гидролизом, перецетализацией или гидрогенолизом ацетальной группы для получения соединения общей формулы (I), где R1=CHO-группa и R2=алкилоксикарбонил-, арилоксикарбонил-, аралкилоксикарбонил- или ацилгруппа.
11. Способ по п.10, отличающийся тем, что в стадии (1) инертный растворитель выбирают из апротонного растворителя, как например, N,N-диметилформамида, N-метилпирролидона или диметилсульфоксида, или галогенированного растворителя, как например хлористого метилена или хлороформа, или простого эфира, как например тетрагидрофурана или диоксана, или ароматичекого углеводорода, как например бензола, толуола или ксилола.
12. Способ по п.10, отличающийся тем, что в стадии (1) и (2) органическое основание выбирают из третичного амина, как например триэтиламина или диизопропиламина, ароматического амина, как например N,N-диметиланилина, или гетероциклического амина, как например пиридина или карбоната или бикарбоната.
13. Способ по п.10, отличающийся тем, что в стадии (2) указанный реагент выбирают из хлорформиата, как например этилхлорформиата, трет-бутилхлорформиата или бензилхлорформиата, дикарбоната, как например ди-трет-бутилдикарбоната или дибензилдикарбоната, или специфического реагента, как например N-(бензилоксикарбонилокси)сукцинимида, или хлорангидрида или ангидрида кислоты.
14. Способ по п.10, отличающийся тем, что в стадии (2) инертный растворитель выбирают из кетона, например ацетона, галогенированного производного, как например хлористого метилена или хлороформа, сложного эфира, как например этилацетата, простого эфира, как например тетрагидрофурана или диоксана, или апротонного растворителя, как например N,N-диметилацетамида или N,N-диметилформамида.
15. Способ по п.10, отличающийся тем, что в стадии (3) реакцию гидролиза проводят в органическом растворителе в присутствии, по крайней мере, стехиометрического количества воды и органической или неогранической кислоты.
16. Способ по п.10, отличающийся тем, что в стадии (3) переацетализацию проводят в присутствии кетона и органической или неорганической кислоты.
17. Способ по пп.15 или 16, отличающийся тем, что реакцию осуществляют в присутствии соляной, серной кислот, метансульфокислоты, n-толуолсульфокислоты или трифторуксусной кислоты при температуре в интервале от 15 до 50шC.
18. Способ по п.10, отличающийся тем, что в стадии (3) реакцию гидрогенолиза проводят в присутствии катализатора в инертном растворителе в температурном интервале от 10 до 50шC.
19. Способ по п.18, отличающийся тем, что катализатором является палладий.
20. Способ по п.18, отличающийся тем, что растворитель выбирают из C1-C4 алифатического спирта, как например метанола, этанола, изопропанола или бутанола, сложного эфира, как например этилацетата, или простого эфира, как например тетрагидрофурана.
Текст
1 Область изобретения Данное изобретение относится к новым производным 6-(4-фенилбутокси)гексиламина общей формулы (I), а также к способу их получения. Изобретение также относится к способу получения сальметерола из этих новых производных. Новые производные 6-(4-фенилбутокси) гексиламина отвечают общей формуле (I) где R1-СНО или СНОR3 ОR4-группа, где R3 и R4 независимо являются C1-С 6 алкил, аралкилгруппами или они образуют 5- или 6-членные циклические ацетали, иR2 - атом водорода, бензил- или алкилоксикарбонил-, арилоксикарбонил-, аралкилоксикарбонил- или ацилгруппа. Данные производные пригодны в качестве промежуточных продуктов в синтезе сальметерола. Предпосылки изобретения Известно применение сальметерола в терапии и особенно для лечения астмы вследствие его свойств в качестве бронхолитического средства. В литературе можно найти несколько ссылок, в которых описан способ получения сальметерола. Таким образом, французский патент FR 2545482 описывает следующую методику получения сальметерола. Алкилированием амина общей формулы(1) алкилирующим агентом общей формулы 2 где каждая R3, R5 и R6-группа обозначает атом водорода или защитную группу и L обозначает замещаемую группу, как например, атом хлора,брома, йода, метансульфонилокси- или птолуолсульфонилоксигруппу, с последующим удалением возможно присутствующих защитных групп. Алкилирование можно проводить восстановительным аминированием альдегида 3 амином 1 (R3=Н или группа, способная превращаться в условиях реакции в атом водорода) Восстановлением соединения общей формулы 4 где R5 - атом водорода или защитная группа и,по крайней мере, одна из X, X1, X2, X3 и X4 является восстанавливаемой группой,с последующим удалением возможно присутствующих защитных групп. Подходящими восстанавливающимися группами являютсяX2: CH2NY-гpyппа (где Y-группа, способная при гидрировании превращаться в атом водорода), CH=N и CONH-группы;X4: СН=СН(СН 2)2, СН 2 СН=СНСН 2-группы и т.д. При взаимодействии эпоксида 5 или галогенгидрида 6 с амином 7 где Y1 - атом водорода или группа, превращаемая при гидрировании в атом водорода,с последующим удалением возможно присутствующих защитных групп. С другой стороны, в патенте WO 9824753 описан асимметрический синтез амина 10 и применение его в синтезе оптически активного сальметерола. Асимметрическое присоединение нитрометана к альдегиду 8 дает оптически активное нитропроизводное 9, восстановление которого приводит к амину 10 где R и R2 - соответствующие защитные группы. Однако данные способы, описанные в литературе, имеют некоторые недостатки. Исходные вещества представляют собой низкомолекулярные интермедиаты с большим количеством функциональных групп, тем самым их получение включает достаточно сложные реакции,особенно на промышленном уровне, главным 3 образом, вследствие образования нежелательных побочных продуктов, которые, кроме того,уменьшают выход реакции. Таким образом, например, способ получения данного соединения 1 (GB 1200886) включает много стадий, среди которых бромирование и хлорметилирование с последующей возможностью образования дибромпроизводных и изомеров. С другой стороны, галогенгидрин 6 является малостабильным соединением и его трудно выделить вследствие тенденции превращаться в эпоксид 5 в щелочных условиях. Реакции получения эпоксидов также являются непростыми,использование эпоксида 5 также создает дополнительную трудность, заключающуюся в том,что получение сальметерола осуществляется раскрытием эпоксида, эта реакция нежелательна из-за получения большого количества побочных продуктов (Randall et al., Tetrahedron Letters,(1986), 2451-2454). С другой стороны ES-A-2065269 относится к способу получения сальметерола. Данная патентная заявка также относится к полупродуктам, используемым для получения сальметерола, и способам их получения. Однако в ES-A-2065269 описан синтез сальметерола, включающий образование связи углерод-азот между амином и бромацетилпроизводным фенольного фрагмента (см. схема 3 данного документа, "С 9 О 3+С 16NО"). Гидроксигруппу получат посредством восстановления имеющегося кетона. Данное изобретение предполагает новые производные 6-(4-фенилбутокси)гексиламина,которые пригодны в качестве исходных веществ для нового способа получения сальметерола. Эти новые производные легко получают из промышленно доступных соединений посредством простых реакций, таких как гидролиз или алкилирование спиртов или аминов. Описание изобретения Данное изобретение относится к новым производным 6-(4-фенилбутокси)гексиламина общей формулы (I) где R1 - СНО- или СНОR3 ОR4-группа, R3 и R4 независимо представляют C1-С 6 алкил-, аралкилгруппы или они образуют 5- или 6-членные циклические ацетали, и 4 этоксикарбонил-, ацетил-, бензоил- или трифторацетилгруппой; и R3 и R4 независимо представляют метил-, этил-, бензилгруппы или они образуют 1,2-диоксоланы или 1,3-диоксаны. Целью данного изобретения также является способ получения производных 6-(4 фенилбутокси)гексиламина. Данный процесс описывается схемой, приведенной ниже. где R3 и R4 имеют такие же значения, как описано выше;Z1 и Z2 различны и такие же как L илиNHR2-группa, причем L-замещаемая группа,например, хлор, бром, йод, метансульфонилокси- или п-толуолсульфонилоксигруппа, предпочтительно бром; и R2 - атом водорода или бензилгруппа. Способ получения данных производных 6(4-фенилбутокси)гексиламина общей формулы(I) проводят согласно следующей схеме: 1) алкилирование амина при взаимодействии соединения формулы (11) с соединением формулы (12) с получением соединения формулы (I) с R1=СНОR3 ОR4-группой, R2=H или бензилгруппой 5 где R3 и R4 независимо являются C1-С 6 алкил,аралкилгруппами или они образуют 5- или 6 членные циклические ацетали;Z1 и Z2 различны и такие же как L илиNHR2-группa, где L-замещаемая группа, например, хлор, бром, йод, метансульфонилокси- или п-толуолсульфонилоксигруппа; и R2 представляет атом водорода или бензилгруппу; в инертном растворителе в присутствии органического или неорганического основания при температуре в пределах от 25 до 110 С,предпочтительно от 80 до 100 С с получением соединения общей формулы (I) где R1=CHOR3OR4-группa и R2=H или бензилгруппа. Инертный растворитель может быть апротонным растворителем, таким как N,Nдиметилформамид; N-метилпирролидон или диметилсульфоксид; галогенированным растворителем, таким как хлористый метилен или хлороформ; простым эфиром, например, тетрагидрофураном или диоксаном; или ароматичеким углеводородом, таким как бензол, толуол или ксилол. Органическое основание может быть третичным амином, например триэтиламином или диизопропилэтиламином; ароматическим амином, например N,N-диметиланилином; или гетероциклическим амином, например пиридином. Неорганическое основание может быть карбонатом или бикарбонатом; 2) защита аминогруппы соединения (I),полученного в стадии (1), соответствующим реагентом до гидрирования; еслиR2 бензилгруппа, которая приводит к получению соединений формулы (I), с R1=CHOR3OR4,арилоксикарбонил-,R2=алкилоксикарбонил-,аралкилоксикарбонил- или ацилгруппой. Возвращаясь к соединению формулы (I)(где R1=CHOR3OR4-группa, R2=алкилоксикарбонил-, арилоксикарбонил-, аралкилоксикарбонил- или ацилгруппа), R2, R3 и R4 должны выбираться так, чтобы существовала возможность удаления R3 и R4-групп без затрагивания R2 группы. Защиту аминогруппы алкилоксикарбонил-,арилоксикарбонил- и аралкилоксикарбонильными остатками выполняют при взаимодействии соединения формулыR1=CHOR3OR4, R2=H, с хлорформиатом, как например, этилхлорформиатом, трет-бутилхлорформиатом или бензилхлорформиатом; дикарбонатом, таким как ди-трет-бутилдикарбонат или дибензилдикарбонат или специфическими реагентами,например,N(бензилоксикарбонил)сукцинимидом. Защиту ацильных групп осуществляют стандартными 6 реагентами, например, хлорангидридами или ангидридами кислот. Защитную реакцию проводят в инертном растворителе, обычно в присутствии органического или неорганического основания при температуре в пределах от 0 до 50 С. Инертным растворителем может быть кетон, например ацетон; галогенированное производное, такое как хлористый метилен или хлороформ; сложный эфир, например, этилацетат; простой эфир, например, тетрагидрофуран или диоксан; или растворитель как, например, N,Nдиметилацетамид или N,N-диметилформамид. Основания, применяемые в данной реакции, могут быть аналогичными тем, о которых упоминалось выше, когда рассматривали стадию (1); 3) превращение соединения формулы (I),полученного в стадии (2), в соответствующий альдегид гидролизом, переацетализацией или гидрогенолизом ацетальной группы, принимая во внимание при выборе методики совместимость с R2-группой. Такое превращение приводит к получению соединений формулы (I) сR1=CHO, R2=алкилоксикарбонил-, арилоксикарбонил-, аралкилоксикарбонил- или ацилгруппой. Гидролиз проводят в органическом растворителе в присутствии, по крайней мере, стехиометрического количества воды и органической или неогранической кислоты, например,соляной, серной, метансульфокислоты, птолуолсульфокислоты или трифторуксусной кислоты при температуре предпочтительно в пределах от 15 до 50 С. Растворитель может быть кетоном, например ацетоном, спиртом, таким как метанол, этанол или изопропанол, амидом, например N,Nдиметилформамидом или N,N-диметилацетамидом. Переацетализацию осуществляют в присутствии кетона, например ацетона, который в то же самое время действует как растворитель, и органической или неорганической кислот, например метансульфокислоты, п-толуолсульфокислоты, соляной или серной кислоты при температуре предпочтительно в пределах от 15 до 50 С. Гидрогенолиз проводят при типичных условиях дебензилирования в присутствии катализатора в инертном растворителе при температуре в пределах от 10 до 50 С. Катализатор предпочтительно представляет собой палладий,адсорбированный на угле. Растворителем может быть С 1-С 4 алифатический спирт, например, метанол, этанол, изопропанол или бутанол; сложный эфир, например этилацетат; или простой эфир, например тетрагидрофуран. Температура реакции предпочтительно составляет 15-25 С. Соединения формулы (I), полученные согласно вышеприведенной методике, пригодны в качестве полупродуктов в синтезе сальметерола. Целью данного изобретения также является разработка способа получения сальметерола или его фармацевтически приемлемых солей из соединения общей формулы (I). Данная методика характеризуется тем, что реакцию органометаллического соединения общей формулы (13) проводят с соединением общей формулы (I) где R3 и R4 независимо являются C1-С 6 алкил-,аралкилгруппами или они образуют циклические ацетали 1,3-диоксоланового типа,М является группой, содержащей металл,например литий, магний или медь, предпочтительно М является литием, МgВr или MgCl, иR2 является алкилоксикарбонил-, арилоксикарбонил-, аралкилоксикарбонил- или ацилгруппой. Предпочтительно R3 и R4 независимо являются метил-, этил- или бензилгруппами, или они образуют циклические ацетали, например 2,2-диметил-1,3-диоксан или 2-метил-1,3-диоксан.R2 предпочтительно является трет-бутоксикарбонил-, бензилоксикарбонил-, этоксикарбонил-, ацетил-, бензоил- или трифторацетилгруппой. Реакцию проводят в инертном растворителе типа простого эфира, предпочтительно в этиловом эфире или тетрагидрофуране при низких температурах, предпочтительно в температурном интервале от -40 до 40 С и более предпочтительно от -40 до 10 С. Органометаллическое соединение формулы 13 можно получить по способам, описанным в литературе (Effenberger, F.; Jger, J., J. Org.Chem. (1977), 62, 3867-3873. Seebach D., Neumann. H., Chem. Ber. (1974), 107, 874-853). Как показано на схеме II, при взаимодействии соединения (I) с органометаллическим соединением 13 получают после дальнейшего гидролиза спирт 14, который при последующем удалении защитных групп R2, R3 и R4 дает сальметерол где R3 и R4 независимо представляют С 1 С 6 алкил-, аралкилгруппы или они образуют циклические ацетали 1,3-диоксанового типа,например 2,2-диметил-1,3-диоксан или 2-метил 1,3-диоксан, иR2 является алкилоксикарбонил-, арилоксикарбонилом-, аралкилоксикарбонил- или ацилгруппой. Выделение спирта 14 из реакционной массы включает обработку водой в кислой среде технического продукта и удаление ранее указанных защитных групп R2, R3 и R4 из соединения формулы (14) приводит к сальметеролу. Данную стадию можно осуществить в одну или несколько ступеней. Условия реакции зависят от природы различных защитных групп и могут осуществляться кислым или щелочным гидролизом или гидрогенолизом согласно обычным методам (см., например, "Protective Groups inOganic Synthesis", 2nd ed. John WileySons Ed.,Inc. 1991). Сальметерол можно превратить в их фармацевтически приемлемые соли присоединения,например гидрохлориды, фумараты, малеаты или ксинафоаты, после принятых методик. Экспериментальная часть Пример 1. 4-(6-Бромгексилокси)бутилбензол. К смеси 5 мл (32,75 ммоль) 4 фенилбутанола с 10,1 мл (65,66 ммоль) 1,6 дибромгексана прибавляют 8 г (121,2 ммоль) порошкообразного КОН и 1,112 г (3,28 ммоль) тетрабутиламмоний гидросульфата. После перемешивания суспензии в течение 20 ч при комнатной температуре ее фильтруют и фильтрат растворяют в 50 мл Et2O. Полученный раствор промывают водой, сушат безводным сульфатом натрия, Et2O упаривают и остаток перегоняют в вакууме (0,1 мм рт.ст.), собирают первую фракцию до 100 С смеси исходных веществ и вторую фракцию при 150 С 4-(6 9 бромгексилокси)бутилбензола весом 7,60 г(м, 12 Н), 2,6 (т, 2 Н, -CH2-C6H5), 3,4 (м, 6 Н, -СН 2O-СН 2- + -СН 2 Вr), 7,1-7,4 (м, 5 Н, -C6H5). Пример 2. N-Диметоксиэтил-6-(4-фенилбутокси)гексиламина гидробромид. К раствору 8,7 мл (79,85 ммоль диметилацеталя аминоацетальдегида в 60 мл толуола при кипении прибавляют по каплям раствор 10 г(31,94 ммоль) 4-(6-бромгексилокси)бутилбензола в 40 мл толуола. После кипячения реакционной смеси в течение 4 ч толуол упаривают под уменьшенным давлением и прибавляют 50 мл СН 2 Сl2. Полученный раствор перемешивают в течение 15 мин вместе с раствором 20 мл 47% НВr, разбавленной 20 мл Н 2O. Реакционную смесь декантируют и полученный в результате упаривания СН 2 Сl2 досуха технический продукт затирают с Et2O и фильтруют, тем самым получая 4,31 г (32,3%) гидробромида 4-диметоксиэтил-6-(4-фенилбутокси)гексиламина. Спектр ЯМР 1H (CDCl3),(ррm): 1,3 (м,4 Н), 1,6 (м, 6 Н), 1,9 (м, 2 Н), 2,6 (т, 2 Н, -CH2C6H5), 3,0 (м, 4 Н, -СН 2-NН-СН 2-), 3,4 (к, 4 Н,-СН 2-O-СН 2-), 3,45 (с, 6 Н, 2 СН 3), 4,95 (т, 1 Н,-СН(ОСН 3)2), 7,1-7,3 (м, 5 Н, -С 6 Н 5). Пример 3. N-Бензил-6-(4-фенилбутокси) гексиламина гидробромид. Смесь, содержащую 7,34 г (25,53 ммоль) 4(6-бромгексилокси)бутилбензола и 10,3 мл(94,30 ммоль) бензиламина, нагревают при 125 С в течение 8 ч. Избыток бензиламина отгоняют и остаток растворяют в 30 мл метилэтилкетона. К полученному раствору, нагретому до 50 С, прибавляют раствор 7,43 мл 47% НВr в 50 мл Н 2O, далее его перемешивают в течение 15 мин и декантируют. Органическую фазу упаривают досуха и таким образом полученный остаток затирают с Et2O и фильтруют с получением 5,9 г (59,8%) N-бензил-6-(4-фенилбутокси) гексиламина гидробромида. Спектр ЯМР 1H (CDCl3),(ppm): 1,2-2,0(м, 12 Н), 2,6 (т, 2 Н, -CH2-C6H5), 2,8 (м, 2 Н, -NHCH2-CH2-), 3,35 (м, 4 Н, -СН 2-O-СН 2-), 4,05 (т,2 Н, -NH-CH2-C6H5-), 7,1-7,7 (м, 10 Н, 2 С 6 Н 5),9,35 (с, 2 Н). ИК спектр (КВr, см-1): 2930, 2830, 2785,1430, 1105, 750, 690. Пример 4. 6-(4-Фенилбутокси)гексиламин. Раствор 4,02 г (11,86 ммоль) N-бензил-6(4-фенилбутокси)гексиламина в 40 мл ЕtOН гидрируют при комнатной температуре и атмосферном давлении в присутствии 0,4 г 5% Pd/C. После поглощения 300 мл Н 2 смесь фильтруют на декалите и фильтрат концентрируют с получением 2,89 г (97,9%) 6-(4-фенилбутокси) гексиламина в виде масла. Спектр ЯМР 1H (СDСl3),(ррm): 1,2-1,8N-бензил-6-(4-фенилбутокси)гексиламина, 1,85 мл (11,93 ммоль) бромацетальдегида диэтилацеталя и 3,29 г (23,84 ммоль) К 2 СО 3. Суспензию нагревают при 80 С в течение 22 ч,после чего DMF отгоняют под вакуумом. К техническому продукту прибавляют 30 мл CH2Cl2 и смесь промывают 30 мл Н 2 О. После отделенияCH2Cl2, сушки безводным Nа 2SО 4, концентрированием досуха и очисткой на хроматографической колонке с силикагелем (градиент СН 2 Сl2 до CH2Cl2/AcOEt 9:1), получают 2,25 г (51%) Nбензил-N-диэтилоксиэтил-6-(4-фенилбутокси) гексиламина в виде масла. Спектр ЯМР 1H (CDCl3),(ррm): 1,2 (т,6 Н, 2-СН 3), 1,2-1,8 (м, 12 Н), 2,45 (т, 2 Н, -СН 2 С 6 Н 5), 2,6 (м, 4 Н, -CH2-N-CH2-), 3,3-3,7 (м, 8 Н,-СН 2-O-СН 2- + 2-СН 2-СН 3), 4,55 (т, 1 Н,-СН(ОСН 2 СН 3)2, 7,1-7,4 (м, 10 Н, 2-С 6 Н 5). Пример 6. N-Диэтоксиэтил-5-(4-фенилбутокси)гексиламин. К раствору 2,77 г (11,12 ммоль) 6-(4 фенилбутокси)гексиламина в 20 мл DMF прибавляют 1,54 г (11,16 ммоль) K2 СО 3 и 1,68 г(11,17 ммоль) бромацетальдегида диэтилацеталя. После выдерживания смеси в течение 20 ч при 80 С, DMF отгоняют в вакууме и полученный технический продукт в 30 мл СН 2 Сl2 промывают 30 мл Н 2O. Раствор хлористого метилена сушат над безводным Na2SO4, концентрируют досуха и остаток очищают с помощью колоночной хроматографии на силикагеле (градиентCH2Cl2/AcOEt 1:1 до AcOEt), тем самым получая 1,73 г (42,6%) N-диэтоксиэтил-6-(4 фенилбутокси)гексиламина в виде масла. Наоборот, 2,39 г (90,3%) N-диэтоксиэтил 6-(4-фенилбутокси)гексиламина также получали гидрированием смеси 3,24 г (7,53 ммоль) Nбензилдиэтоксиэтил-6-(4-фенилбутокси)гексиламина и 0,32 г 5% Pd/C в 35 мл ЕtOН, при комнатной температуре и атмосферном давлении. Спектр ЯМР 1H (CDCl3),(ppm): 1,2 (т,6 Н, 2-СН 3), 1,25-1,8 (м, 12 Н), 2,6 (к, 2 Н, -СН 2 С 6 Н 5), 2,7 (д, 1 Н, -NH), 3,4 (с, 4 Н, 2-ОСН 2 СН 3),3,5-3,8 (м, 4 Н, -CH2OCH2-), 4,6 (т, 1 Н,-СН(ОСН 2 СН 3)2), 7,1-7,3 (м, 5 Н, -С 6 Н 5). Пример 7.N-Бензилоксикарбонил-Nдиметоксиэтил-6-(4-фенилбутокси)гексиламин. К раствору 4,15 г (9,93 ммоль) Nдиметоксиэтил-6-(4-фенилбутокси)гексиламина гидробромида в 40 мл ацетона прибавляют 1,4 мл триэтиламина и 2,41 г (10,71 ммоль) N(бензилоксикарбонилокси)сукцинимида. После перемешивания смеси в течение 2 ч при комнатной температуре ацетон упаривают и прибавляют 40 мл Et2O. Полученную смесь промывают 3 раза 40 мл H2O. После разделения эфирный слой сушат над безводным Na2SO4 и упаривают досуха с получением 4,46 г (95,3%) N 11 бензилоксикарбонил-N-диметоксиэтил-6-(4 фенилбутокси)гексиламина в виде масла. Спектр ЯМР 1H (СDСl3),(ррm): 1,2-1,8N-Бензилоксикарбонил-Nдиэтоксиэтил-6-(4-фенилбутокси)гексиламин. К раствору 2,39 г (6,55 ммоль) Nдиэтоксиэтил-6-(4-фенилбутокси)гексиламина в 25 мл ацетона прибавляют 1,59 г (7,07 ммоль)N-(бензилоксикарбонилокси)сукцинимида. После перемешивания смеси в течение 2 ч при комнатной температуре ацетон удаляют упариванием и к остатку прибавляют 30 мл AcOEt. Полученную смесь промывают 3 раза 30 мл Н 2O. После разделения AcOEt фазу сушат над безводным Nа 2SO4 и упаривают досуха, тем самым получая 3,28 г (99%) N-бензилоксикарбонил-N-диэтоксиэтил-6-(фенилбутокси)гексиламина в виде масла. Спектр ЯМР 1H (CDCl3),(ррm): 1,1-1,8(м, 18 Н), 2,65 (т, 2 Н, -CH2-C6H5), 3,3-3,8 (м, 12 Н,2 -ОСН 2 СН 3 + -CH2-N-CH2- + -СН 2-O-СН 2-),4,4-4,7 (дт, 1 Н, -СН(ОСН 2OСН 3)2), 5,15 (с, 2 Н,-O-CH2-C6H5), 7,1-7,4 (м, 10 Н, 2 -С 6 Н 5). Пример 9. N-Бензилоксикарбонил-N-(2 оксоэтил-6-(4-фенилбутокси)гексиламин. К раствору 3,89 г (8,26 ммоль) Nбензилоксикарбонил-N-диметоксиэтил-6-(4 фенилбутокси)гексиламина в 50 мл ацетона прибавляют моногидрат п-толуолсульфокислоты 0,786 г (4,13 ммоль). После выдерживания раствора в течение 4 ч при комнатной температуре ацетон упаривают и неочищенный продукт растворяют в 50 мл Et2O и промывают один раз 50 мл Н 2O, Et2O фазу отделяют, сушат над безводным Na2SO4, упаривают досуха, и таким образом полученный остаток очищают с помощью хроматографии на колонке с силикагелем (градиент CH2Cl2 до CH2Cl2/AcOEt 4:1),тем самым получая 2,66 г (75,7%) Nбензилоксикарбонил-N-(2-оксоэтил)-6-(4 фенилбутокси)гексиламина в виде масла. Наоборот, 1,66 г (72,3%) N-бензилоксикарбонил-N-(2-оксоэтил)-6-(4-фенилбутокси) гексиламина также можно получить из 2,70 г 12 раствор 1,15 г (8,62 ммоль) АlСl3 в 20 мл Et2O. Полученную смесь выдерживают при комнатной температуре в течение 1 ч, затем охлаждают до 0 С и прибавляют 50 мл 10% водного раствора гидроокиси натрия, предварительно охлажденного до 5 С. Отделенную эфирную фазу промывают дважды 20 мл Н 2O, сушат над безводным Na2SO4, упаривают досуха и перегоняют в вакууме с получением 4,85 г (81%) 2,2 диметил-6-бромбензо-1,3-диоксана в виде масла. Спектр ЯМР 1H (CDCl3),(ppm): 1,5 (с,6 Н, 2 СН 3), 4,8 (с, 2 Н, -O-СН 2-), 6,7 (д, 1 Н), 7,1[1,3]диоксин-6-ил)-2-гидроксиэтил]-N-бензилоксикарбонил-6-(4-фенилбутокси)гексиламин. К 0,166 г (6,83 ммоль) Мg в 1 мл THF прибавляют по каплям несколько капель раствора,содержащего 1,51 г (6,21 ммоль) 2,2-диметил-6 бромбензо-1,3-диоксана в 20 мл THF и каталитическое количество 1,2-дибромэтана. Если реакция началась, прибавляли оставшийся раствор 2,2-диметил-6-бромбензо-1,3-диоксана, поддерживая температуру 40 С. После завершения прибавления раствора (15 мин), реакцию выдерживают дополнительно 30 мин при 40 С. Смесь далее охлаждают до -7 С и прибавляют раствор 2,64 г (6,21 ммоль) N-бензилоксикарбонил-N-2-оксоэтил-6-(4-фенилбутокси) гексиламина в 5 мл THF. После выдерживания при 0 С в течение 1 ч температуру реакционной смеси повышают до комнатной температуры,прибавляют 30 мл насыщенного раствора NH4Cl и смесь перемешивают в течение 15 мин. Наконец, прибавляют 30 мл AcOEt, EtOAc фазу отделяют, промывают 30 мл Н 2O, сушат над безводным Nа 2SО 4, концентрируют досуха и остаток очищают хроматографией на колонке с силикагелем (градиент СН 2 Сl2 до СН 2 Сl2/ЕtOАс 4:1) с получением 1,50 г (40,9%) N-[2-(2,2 диметил-4 Н-бензо[1,3]диоксин-6-ил)-2-гидроксиэтил]-N-бензилоксикарбонил-6-(4-фенилбутокси)гексиламина. Спектр ЯМР 1H (CDCl3),(ррm): 1,4-1,8[1,3]диоксин-6-ил)-2-гидроксиэтил]-6-(4 фенилбутокси)гексиламин. 0,9 г (1,53 ммоль) N-[2-(2,2-диметил-4 Нбензо[1,3]диоксин-6-ил)-2-гидроксиэтил]-Nбензилоксикарбонил-6-(4-фенилбутокси)гексиламина гидрируют в присутствии 0,1 г 5% Pd/C в 30 мл МеОН при атмосферном давлении и комнатной температуре. После поглощения 50 мл Н 2 катализатор отфильтровывают на декалите и фильтрат концентрируют досуха с получением(м, 12 Н), 1,55 (с, 6 Н, 2 -СН 3), 2,6 (т, 2 Н, -CH2C6H5), 2,9-3,2 (м, 4 Н, -CH2-N-CH2-), 3,35 (к, 4 Н,-СН 2-O-СН 2-), 4,8 (с, 2 Н, -СН 2-O-), 5,25 (дд, 1 Н,-СН(ОН)-), 6,75 (д, 1 Н), 7,05 (д, 1 Н), 7,1-7,3 (м,6 Н). ИК спектр (KBr, см-1): 3355, 2930, 2855,1630, 1595, 1490, 1260, 1120. Пример 13. 4-Гидрокси 6-(4 фенилбутокси)гексил]амино]метил]-1,3-бензолдиметанол. К раствору 0,6 г (1,32 ммоль) [2-(2,2 диметил-4H-бензо[1,3]диоксин-6-ил)-2-гидроксиэтил]-6-(4-фенилбутокси)гексиламина в 20 мл 1:1 Н 2O/МеОН смеси прибавляют 0,15 мл (1,75 ммоль) 35% HCl. После перемешивания реакционной смеси в течение 48 ч при комнатной температуре МеОН упаривают в вакууме. Полученную водосодержащую смесь экстрагируют 20 мл CH2Cl2. Органическую фазу промывают последовательно 20 мл насыщенного раствораNаНСО 3, и далее 20 мл H2O, сушат над безводным Na2SO4 и упаривают досуха с образованием 0,24 г (43,9%) 2-гидроксиметил-4-1-гидрокси 2-[6-(4-фенилбутокси)гексиламино]этилфенола. Спектр ЯМР 1H (CDCl3),(ppm): 1,2-1,8 14 бензилоксикарбонил-, этоксикарбонил-, ацетил-,бензоил- или трифторацетилгруппой. 5. Способ получения сальметерола или его фармацевтически приемлемых солей, отличающийся тем, что осуществляют реакцию металлоорганического соединения общей формулы где М - группа, содержащая металл, выбранный из лития, магния или меди, с полупродуктом общей формулы (I) по п.1 в инертном растворителе при температуре в пределах от -40 до 40 С с последующим гидролизом и удалением защитных групп. 6. Способ по п.5, отличающийся тем, что инертный растворитель представляет собой простой эфир, как, например, этиловый эфир,или тетрагидрофуран. 7. Способ по п.5, отличающийся тем, что данную реакцию проводят при температуре в интервале от -40 до 10 С. 8. Способ по п.5, отличающийся тем, чтоR3 и R4 независимо являются метил-, этил-, бензилгрупами, 2,2-диметил-1,3-диоксаном или 2 метил-1,3-диоксаном. 9. Способ по п.5, отличающийся тем, что М является литием, МgВr или MgCl. 10. Способ получения производного 6-(4 фенилбутокси)гексиламина общей формулы (I) по любому из пп.1-4, отличающийся тем, что осуществляют следующие стадии: 1) алкилирование амина взаимодействием соединения формулы (11) с соединением формулы (12) где R1 - СНО или СНОR3 ОR4-группа, где R3 и R4 независимо являются C1-С 6 алкил, аралкилгруппами или они образуют 5- или 6-членные циклические ацетали, иR2 - атом водорода, бензил- или алкилоксикарбонил-, арилоксикарбонил-, аралкилоксикарбонил- или ацилгруппа. 2. Соединение по п.1, отличающееся тем,что R1-СНО-группа, R2 - алкилоксикарбонил-,арилоксикарбонил-, аралкилоксикарбонил- или ацилгруппа. 3. Соединение по п.1, отличающееся тем,что R3 и R4 независимо являются метил-, этил-,бензилгруппами или они образуют 1,3 диоксоланы или 1,3-диоксаны. 4. Соединение по п.1 или 2, отличающееся тем, что R2 является трет-бутоксикарбонил-, где R3 и R4 независимо являются C1-С 6 алкил-,аралкилгруппами или они образуют 5- или 6 членные циклические ацетали, иZ1 и Z2 каждая группа различна или одинакова с L или NHR2, причем L-отщепляемая группа, как например, хлор, бром, йод метансульфонилоксиилиn-толуолсульфонилоксигруппа, и R2 атом водорода или бензилгруппа,в инертном растворителе в присутствии органического или неорганического основания при температуре в пределах от 25 до 110 С с получением соединения общей формулы (I) где R1 - СНОR3 ОR4-группа и R3 - атом водорода или бензилгруппа,2) защиту аминогруппы соединения, полученного в стадии (1), подходящим реагентом с предварительным гидрированием, если R2 является бензилгруппой в инертном растворителе,возможно в присутствии органического или неорганического основания при температуре в интервале от 0 до 50 С для получения соединений формулы (I), где R1=CHOR3OR4-группa и арилоксикарбонил-,R2=алкилоксикарбонил-,аралкилоксикарбонил- или ацилгруппа,3) превращение соединения, полученного в стадии (2), в соответствующий альдегид гидролизом, перецетализацией или гидрогенолизом ацетальной группы для получения соединения общей формулы (I), где R1=CHO-группa и арилоксикарбонил-,R2=алкилоксикарбонил-,аралкилоксикарбонил- или ацилгруппа. 11. Способ по п.10, отличающийся тем, что в стадии (1) инертный растворитель выбирают из апротонного растворителя, как например,N,N-диметилформамида, N-метилпирролидона или диметилсульфоксида, или галогенированного растворителя, как например хлористого метилена или хлороформа, или простого эфира,как например тетрагидрофурана или диоксана,или ароматичекого углеводорода, как например бензола, толуола или ксилола. 12. Способ по п.10, отличающийся тем, что в стадии (1) и (2) органическое основание выбирают из третичного амина, как например триэтиламина или диизопропиламина, ароматического амина,как напримерN,Nдиметиланилина, или гетероциклического амина, как например пиридина или карбоната или бикарбоната. 13. Способ по п.10, отличающийся тем, что в стадии (2) указанный реагент выбирают из хлорформиата, как например этилхлорформиата, трет-бутилхлорформиата или бензилхлорформиата, дикарбоната, как например ди-трет 16 бутилдикарбоната или дибензилдикарбоната,или специфического реагента, как например N(бензилоксикарбонилокси)сукцинимида,или хлорангидрида или ангидрида кислоты. 14. Способ по п.10, отличающийся тем, что в стадии (2) инертный растворитель выбирают из кетона, например ацетона, галогенированного производного, как например хлористого метилена или хлороформа, сложного эфира, как например этилацетата, простого эфира, как например тетрагидрофурана или диоксана, или апротонного растворителя, как например N,Nдиметилацетамида или N,N-диметилформамида. 15. Способ по п.10, отличающийся тем, что в стадии (3) реакцию гидролиза проводят в органическом растворителе в присутствии, по крайней мере, стехиометрического количества воды и органической или неогранической кислоты. 16. Способ по п.10, отличающийся тем, что в стадии (3) переацетализацию проводят в присутствии кетона и органической или неорганической кислоты. 17. Способ по пп.15 или 16, отличающийся тем, что реакцию осуществляют в присутствии соляной, серной кислот, метансульфокислоты,n-толуолсульфокислоты или трифторуксусной кислоты при температуре в интервале от 15 до 50 С. 18. Способ по п.10, отличающийся тем, что в стадии (3) реакцию гидрогенолиза проводят в присутствии катализатора в инертном растворителе в температурном интервале от 10 до 50 С. 19. Способ по п.18, отличающийся тем, что катализатором является палладий. 20. Способ по п.18, отличающийся тем, что растворитель выбирают из C1-C4 алифатического спирта, как например метанола, этанола, изопропанола или бутанола, сложного эфира, как например этилацетата, или простого эфира, как например тетрагидрофурана.
МПК / Метки
МПК: C07C 217/44, A61K 31/135, C07D 319/06
Метки: способ, производные, получения, салметерола, 6-(4-фенилбутокси)гексиламина
Код ссылки
<a href="https://eas.patents.su/9-3397-proizvodnye-6-4-fenilbutoksigeksilamina-i-sposob-polucheniya-salmeterola.html" rel="bookmark" title="База патентов Евразийского Союза">Производные 6-(4-фенилбутокси)гексиламина и способ получения сальметерола</a>
Предыдущий патент: Агонисты простагландинов и их применение для лечения заболеваний костей
Следующий патент: Лекарственный комплекс c полимерным носителем
Случайный патент: Способ загрузки мелкозернистых металлов в электрическую дуговую печь












