Терапевтическая композиция для введения толтеродина с контролируемым высвобождением и способ лечения мочевого пузыря с её использованием
Номер патента: 2720
Опубликовано: 29.08.2002
Авторы: Крейльгор Бо, Викберг Мартин, Кристенсен Хелле, Оруп Якобсен Лене, Рингберг Андерс, Халлен Бенгт, Стрембом Ян, Ольссон Биргитта, Нильвебрант Лисбет, Грен Торкель, Хокк Улла
Формула / Реферат
1. Способ лечения нестабильного или гиперактивного мочевого пузыря, включающий в себя введение больному, нуждающемуся в подобном лечении, толтеродина или родственного толтеродину соединения или его фармацевтически приемлемой соли в фармацевтически эффективном количестве в составе композиции с контролируемым высвобождением, способной поддерживать в сыворотке существенно постоянную концентрацию активного фрагмента или фрагментов в течение, по меньшей мере, 24 ч и имеющей средний индекс колебаний указанной концентрации активного фрагмента или фрагментов в сыворотке, составляющий приблизительно не выше чем 2,0, причем вышеуказанный индекс колебаний, FI, определяется как
FI = (Сmах - Cmin) /AUCt/t,
где Сmах и Сmin означают соответственно максимальную и минимальную концентрации активного фрагмента или фрагментов, АUСt означает площадь под кривой зависимости концентрации от t в сыворотке, а t означает длительность интервала действия дозировки.
2. Способ по п.1, в котором указанный средний индекс колебаний не выше чем 1,0.
3. Способ по п.1 или 2, при котором вводят толтеродин, его 5-гидроксиметильный метаболит или рацемат, соответствующий толтеродину, и профиль вышеуказанной кривой зависимости концентрации, регистрируемый в сыворотке в течение 24 ч, выраженный как AUC несвязанного толтеродина и 5-гидроксиметильного метаболита, устанавливается в диапазоне приблизительно от 5 до 150 нМЧч, предпочтительно в диапазоне приблизительно от 10 до 120 нМЧч.
4. Способ по п.1, 2 или 3, при котором вводят толтеродин, его 5-гидроксиметильный метаболит или рацемат, соответствующий толтеродину, и концентрация в сыворотке несвязанного толтеродина и 5-гидроксиметильного метаболита устанавливается в диапазоне приблизительно от 0,2 до 6,3 нМ, предпочтительно в диапазоне приблизительно от 0,4 до 5,0 нМ.
5. Способ по любому из пп.1-4, при котором композиция контролируемого высвобождения представляет собой капсулу или таблетку для перорального введения один раз в день.
6. Способ по любому из пп.1-4, при котором композиция контролируемого высвобождения представляет собой трансдермальный препарат, предпочтительно трансдермальный пластырь.
7. Способ по любому из пп.1-6, при котором вводят толтеродин.
8. Способ по любому из пп.1-6, при котором лечат недержание мочи.
9. Фармацевтическая композиция, содержащая толтеродин, или родственное толтеродину соединение, или его фармацевтически приемлемую соль, отличающаяся тем, что при введении этой композиции больному обеспечивается контролируемое высвобождение толтеродина, или вышеуказанного родственного толтеродину соединения, или его соли таким образом, что в сыворотке поддерживается существенно постоянная концентрация активного фрагмента или фрагментов в течение, по меньшей мере, 24 ч, и средний индекс колебаний указанной концентрации в сыворотке активного фрагмента или фрагментов составляет приблизительно не выше чем 2,0, причем вышеуказанный индекс колебаний, FI, определяется как FI = (Сmах-Cmin)/AUCt/t, где Сmах и Cmin означают соответственно максимальную и минимальную концентрации активного фрагмента или фрагментов, AUCt означает площадь под концентрационной кривой в сыворотке, а t означает длительность интервала действия дозировки.
10. Композиция по п.9, в которой средний индекс колебаний не выше чем приблизительно 1,0.
11. Композиция по п.9 или 10, при которой вводят толтеродин, его 5-гидроксиметильный метаболит или рацемат, соответствующий толтеродину, и профиль концентрационной кривой, регистрируемый в сыворотке в течение 24 ч, выраженный как AUC несвязанного толтеродина и 5-гидроксиметильного метаболита, устанавливается в диапазоне приблизительно от 5 до 150. нМЧч, предпочтительно в диапазоне приблизительно от 10 до 120 нМЧч.
12. Композиция по п.9 или 10, характеризующаяся тем, что вводят толтеродин, его 5-гидроксиметильный метаболит или рацемат, соответствующий толтеродину, и концентрация в сыворотке несвязанного толтеродина и 5-гидроксиметильного метаболита устанавливается в диапазоне приблизительно от 0,2 до 6,3 нМ, предпочтительно в диапазоне приблизительно от 0,4 до 5,0 нМ.
13. Композиция по любому из пп.9-12, которая представляет собой капсулу или таблетку для перорального введения единожды в день.
14. Композиция по любому из пп.1-12, которая представляет собой трансдермальный препарат, предпочтительно трансдермальный пластырь.
15. Композиция по любому из пп.9-14, которая обеспечивает контролируемое высвобождение толтеродина.
16. Применение толтеродина, или родственного толтеродину соединения, или его фармацевтически приемлемой соли для производства терапевтической композиции для лечения нестабильного или гиперактивного мочевого пузыря, причем указанная композиция обеспечивает контролируемое высвобождение толтеродина, или родственного толтеродину соединения, или его соли таким образом, что в сыворотке поддерживается существенно постоянная концентрация активного фрагмента или фрагментов в течение, по меньшей мере, 24 ч, и средний индекс колебаний указанной концентрации в сыворотке активного фрагмента или фрагментов составляет приблизительно не выше чем 2,0, причем вышеуказанный индекс колебаний, FI, определяется как FI = (Cmax-Cmin)/AUCt/t, где Cmax и Cmin означают соответственно максимальную и минимальную концентрации активного фрагмента или фрагментов, АUСt означает площадь под кривой зависимости концентрации от t в сыворотке, а t означает длительность интервала действия дозировки.
17. Применение по п.16, при котором производят композицию по любому из пп.10-15.
Текст
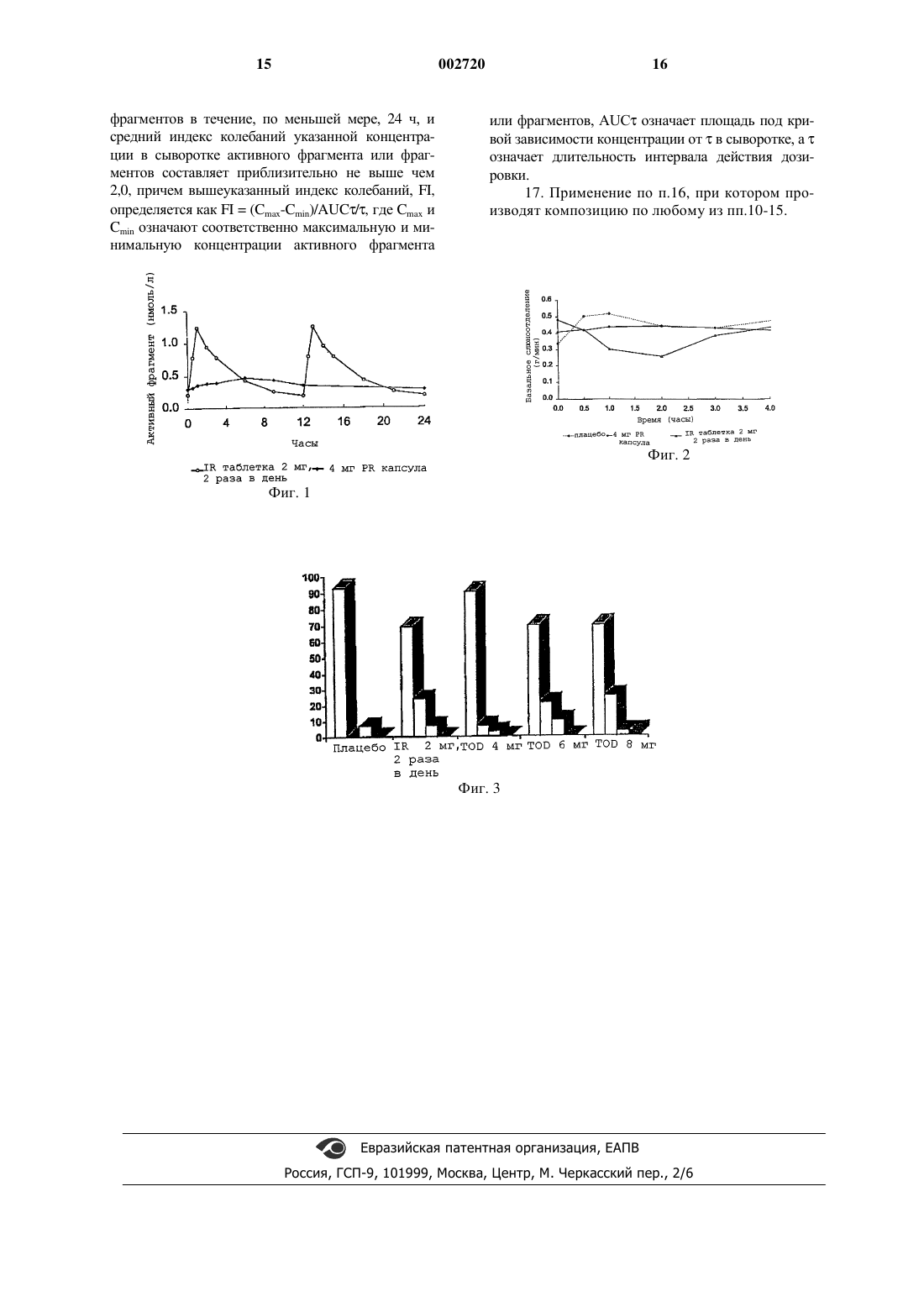
1 Настоящее изобретение относится к усовершенствованному способу лечения нестабильного или гиперактивного мочевого пузыря,а также к композиции для такого лечения. Значительная часть (5-10%) взрослого населения страдает от недержания мочи, и частота случаев особенно так называемого непроизвольного мочеиспускания увеличивается с возрастом. Симптомы нестабильного или гиперактивного мочевого пузыря включают в себя непроизвольное мочеиспускание, сильные позывы к мочеиспусканию и учащенное мочеиспускание. Полагают, что нестабильный или гиперактивный мочевой пузырь становится таковым вследствие неконтролируемых сокращений пучка волокон гладких мышц, образующих мышечную оболочку мочевого пузыря (сжимающая мышца, эвакуирующая при сокращении мочу),во время фазы наполнения пузыря. Эти сокращения контролируются главным образом холинергическими мускариновыми рецепторами, и фармакологическое лечение нестабильного гиперактивного мочевого пузыря основано на антагонистах мускариновых рецепторов. В течение длительного времени подобранным лекарственным средством являлся оксибутинин. Оксибутинин, который химически являетсяDL-рацемической формой 4-диэтиламино-2 бутинил-фенилциклогексилгликолата, дается перорально, обычно в виде таблетки или сиропа. Оксибутинин, который обычно вводят в виде хлорида, метаболизирует до активного метаболита Nдесетилоксибутинина. Лекарственное средство после введения быстро всасывается из желудочнокишечного тракта и имеет продолжительное действие от 3 до 6 ч. В то время как эффективность оксибутинина хорошо установлена, тем не менее, его пригодность ограничивается из-за классических антимускариновых побочных эффектов, особенно сухости во рту, что часто приводит к прерыванию лечения. В международной заявке WO 96/12477 описана система доставки с контролируемым высвобождением оксибутинина, которая не только представляет удобство для больного ввиду снижения приема до одного раза в день,но также снижает отрицательные побочные эффекты путем ограничения первоначальных максимальных концентраций оксибутинина и активного метаболита в крови больного. Обнаруженное ослабление побочных эффектов, достигаемое снижением или исключением максимальных концентраций благодаря введению системы доставки с контролируемым высвобождением, противоречит, однако, опубликованному позже сообщению Nilsson C.G., etal., Neurourology and Urodynamics 16 (1997) 533542, в котором описаны клинические испытания, выполненные с помощью системы доставки с контролируемым высвобождением, раскрытой в указанной выше международной публикации 2 испытаниях прием 10 мг таблетки оксибутинина с контролируемым высвобождением сравнивают с введением обычной (немедленного высвобождения) 5 мг таблетки, которую дают больным с непроизвольным мочеиспусканием два раза в день. В то время как высокие максимальные уровни лекарственного средства явно были исключены из таблетки оксибутинина с контролируемым высвобождением, никакой разницы в побочных эффектах между таблеткой с контролируемым высвобождением и обычной таблеткой не наблюдали. Таким образом, преимущество таблетки с контролируемым высвобождением заключается только в улучшении режима лечения благодаря введению одноразовой дозы,а не в снижении побочных эффектов, как это утверждалось в международной публикацииWO 96/12477. За последнее время появился в продаже улучшенный антагонист мускариновых рецепторов, толтеродин, (R)-N,N-диизопропил-3-(2 гидрокси-5-метилфенил)-3-фенилпропанамин для лечения непроизвольного мочеиспускания и других симптомов нестабильного или гиперактивного мочевого пузыря. Как толтеродин, так и его основной активный метаболит, 5-гидроксиметильное производное толтеродина, который вносит значительный вклад в терапевтическое действие, имеют значительно меньшие побочные эффекты, чем оксибутинин, особенно в отношении склонности вызывать сухость во рту. В то время как толтеродин обладает равным оксибутинину действием на мочевой пузырь, его сродство к мускариновым рецепторам слюнной железы в восемь раз ниже, чем сродство оксибутинина; см., например, Nilberbant L., etal., European Journal of Pharmacology 327 (1997) 195-207. Избирательное действие толтеродина у человека описано авторами Stahl M.M.S., et al.,Neurourologe and Urodynamics 14 (1995) 647-655,и Bryne N., International Journal of Clinical Pharmacology and Therapeutics, Vol. 35, No. 7 (1995) 287-295. Используемая в настоящее время коммерческая форма толтеродина представляет собой таблетки с пленочным покрытием, содержащие 1 мг или 2 мг L-тартрата толтеродина для немедленного высвобождения в желудочнокишечном тракте, причем рекомендуемая дозировка обычно составляете по 2 мг два раза в день. Хотя, как упоминалось выше, побочные эффекты, как, например, сухость во рту, становятся намного ниже, чем в случае оксибутинина, тем не менее, они все еще существуют, особенно при высоких дозировках. Согласно настоящему изобретению неожиданно было обнаружено, что в противоположность оксибутинину элиминация максимального уровня толтеродина и его активного метаболита в сыворотке благодаря контролируемому высвобождению толтеродина в течение продолжительного периода времени, как, на 3 пример, при однократном введении суточной дозы, с сохранением желаемого действия на мочевой пузырь, действительно в значительной степени снижает (уже низкие) побочные эффекты, особенно сухость во рту, по сравнению с побочными эффектами, имеющими место при применении такой же общей дозы в таблетке с немедленным высвобождением в течение такого же периода времени. Другими словами, если избежать достижения максимального уровня активного фрагмента в сыворотке, снижаются побочные отрицательные эффекты, в частности сухость во рту, в большей степени, чем желаемое воздействие на активность сжимающей мышцы, равно как и выравнивание концентрации в сыворотке не приводит к потере активности или учащению случаев задержки мочи или другим явлениям. Таким образом, вдобавок к преимуществам введения препарата с контролируемым высвобождением можно либо (i) для данной общей дозировки толтеродина снизить побочные эффекты, такие как сухость во рту,либо (ii) для данного уровня приемлемых побочных эффектов увеличить дозировку толтеродина для усиления воздействия на мочевой пузырь, если это необходимо. В одном аспекте настоящее изобретение обеспечивает способ лечения нестабильного или гиперактивного мочевого пузыря, причем способ заключается во введении (млекопитающему) больному, нуждающемуся в подобном лечении, толтеродина, или родственного толтеродину соединения, или его фармацевтически приемлемой соли в составе композиции с контролируемым высвобождением, с помощью которой толтеродин или вышеуказанное родственное толтеродину соединение вводится с контролируемой скоростью в течение, по меньшей мере, 24 ч. Предпочтительно, чтобы композиция,содержащая дозированную форму, была способна в основном поддерживать в сыворотке постоянный уровень активного фрагмента или фрагментов вышеуказанного соединения в течение, по меньшей мере, 24 ч. Под гиперактивным мочевым пузырем подразумевают нестабильность сжимающей мышцы, гиперрефлексию этой мышцы, непроизвольное мочеиспускание, сильные позывы к мочеиспусканию и учащенное мочеиспускание. Как упоминалось выше, химическим названием толтеродина является (R)-N,N-диизопропил-3-(2-гидрокси-5-метилфенил)-3-фенилпропанамин. Название "родственное толтеродину соединение" означает основной, активный метаболит толтеродина, т.е. (R)-N,N-диизопропил-3-(2-гидрокси-5-гидроксиметилфенил)3-фенилпропанамин; соответствующий толтеродину (S)-энантиомер, т.е. (S)-N,N-диизопропил-3-(2-гидрокси-5-метилфенил)-3-фенилпропанамин; 5-гидроксиметильный метаболит 4 пропанамин; а также соответствующий рацемат толтеродина, т.е. (RS)-N,N-диизопропил-3-(2 гидрокси-5-метилфенил)-3-фенилпропанамин и их пролекарственные формы. Термином "активный фрагмент или фрагменты" обозначена сумма свободных или несвязанных (т.е. не связанных с белком) концентраций (i) толтеродина и его активного метаболита,когда вводится толтеродин (или пролекарственная форма); или (ii) толтеродина и его активного метаболита и/или (S)-энантиомера толтеродина и его активного метаболита, когда вводится соответствующий рацемат (или пролекарственная форма); или (iii) активного метаболита, когда вводится (R)-5-гидроксиметильный метаболит толтеродина (или пролекарственная форма); или(или пролекарственная форма); или (v) активного (S)-метаболита, когда вводится (S)-5 гидроксиметильный метаболит. Термин "в основном постоянный" в отношении уровня в сыворотке активного фрагмента или фрагментов означает, что характер высвобождения композиции с контролируемым высвобождением не должен, по существу, сопровождаться экспрессией каких-либо экстремальных значений. Это может быть выражено также с помощью "индекса колебаний" (FI) концентрации в сыворотке (несвязанного) активного фрагмента (или суммы активных фрагментов, если это уместно), где индекс колебаний FI рассчитывают какFI=(Cmax-Cmin)/AUC/,где Сmах и Сmin означают соответственно максимальную и минимальную концентрации активного фрагмента, AUC означает площадь под концентрационной кривой в сыворотке (кривая изменения концентрации во времени) в интервале действия дозировки , гдеозначает длительность интервала действия дозировки. Таким образом, согласно настоящему изобретению,композиция с контролируемым высвобождением должна обеспечивать средний индекс колебаний (для n, равного, по меньшей мере, 30),который обычно составляет приблизительно не выше 2,0, более предпочтительно не выше чем приблизительно 1,5, особенно не выше чем приблизительно 1,0, например, не выше чем приблизительно 0,8. 24-часовая экспозиция толтеродина и его 5-гидроксиметильного метаболита, выраженная в виде AUC несвязанного активного фрагмента(толтеродина плюс метаболита), обычно заключена в диапазоне приблизительно от 5 до 150 нМч, предпочтительно от 10 до 120 нМч в зависимости от дозировки, требуемой для индивидуального больного. Указанные пределы основаны на расчете несвязанных концентраций активного фрагмента, с учетом того, что несвязанная фракция составляет 3,7% в случае толтеродина и 36% в случае 5-гидроксиметильного 5 метаболита (Nilverbant L., et al., Life Science,Vol. 60, Nos. 13/14 (1997) 1129-1136). Соответственно для толтеродина и его 5 гидроксиметильного метаболита средний уровень в сыворотке (крови) или плазме обычно составляет приблизительно от 0,2 до 6,3 нМ,предпочтительно от 0,4 до 5,0 нМ. Толтеродин, его соответствующий (S)энантиомер и рацемат и их получение описаны,например, в международной заявке WO 89/06644. Характеристика активного (R)-5 гидроксиметильного метаболита толтеродина (а также (S)-5-гидроксиметильного метаболита) приведена в международной заявке WO 94/11337. (S)-энантиомер и его применение в лечении мочевых и желудочно-кишечных нарушений описаны в международной заявке WO 98/03067. В другом аспекте настоящее изобретение обеспечивает фармакологическую композицию,содержащую толтеродин, родственное толтеродину соединение или его фармакологически приемлемую соль, причем композиция при введении больному обеспечивает контролируемое высвобождение толтеродина, или вышеуказанного родственного толтеродину соединения, или его соли в течение, по меньшей мере, 24 ч,предпочтительно таким образом, чтобы в сыворотке поддерживался в основном постоянный уровень активного фрагмента или фрагментов в течение, по меньшей мере, вышеуказанных 24 ч. В другом аспекте настоящее изобретение относится к применению толтеродина, или родственного толтеродину соединения, или его фармацевтически приемлемой соли для производства терапевтической композиции с целью лечения нестабильного или гиперактивного мочевого пузыря, причем с помощью композиции обеспечивается контролируемое высвобождение толтеродина, или вышеуказанного родственного толтеродину соединения, или его соли с контролируемой скоростью в течение, по меньшей мере, 24 ч, предпочтительно таким образом, чтобы в сыворотке поддерживался в основном постоянный уровень активного фрагмента или фрагментов в течение, по меньшей мере, вышеуказанных 24 ч. Композиция с контролируемым высвобождением предпочтительно представляет собой пероральную систему доставки или трансдермальный препарат, как например, трансдермальный пластырь, кроме того, конечно, могут быть рассмотрены и другие формы с контролируемым высвобождением, как например, трансбуккальные таблетки, ректальные суппозитории, подкожные имплантаты, композиции для внутримышечного введения. Типичным примером пероральной композиции с контролируемым высвобождением,особый аспект которой описан в примере 1 ниже, является поликомпонентная композиция,содержащая гранулы с контролируемым высвобождением. Каждая гранула содержит (i) основу из водорастворимого, набухаемого в воде или(имеющая размер приблизительно от 0,05 до 2,приблизительно 2 мм), как например, шарик из сахара; (ii) первый слой, покрывающий основу,в основном водорастворимого (часто гидрофильного) полимера (этот слой может быть исключен в случае нерастворимой основы, такой,например, как двуокись кремния), (iii) второй слой водорастворимого полимера, имеющего активный ингредиент, растворенный или диспергированный в нем, и (iv) третий полимерный слой, эффективный для контролируемого высвобождения активного ингредиента (например,водонерастворимый полимер в комбинации с водорастворимым полимером). В случае пероральной композиции с контролируемым высвобождением для одноразового введения дозировка толтеродина (или родственного толтеродину соединения) составляет,например, 4 или 6 мг. Трансдермальный пластырь для толтеродина или родственного толтеродину соединения описан в нашей совместно представленной международной заявке "Трансдермально вводимый толтеродин как антимускариновый агент для лечения гиперактивного мочевого пузыря"(на основании шведской патентной заявки 9802864-0, зарегистрированной 27 августа 1998 г.), полное описание которой включено в данный текст в виде ссылки. Иллюстративные композиции в виде пластыря описаны в примере 2 ниже. Руководствуясь данным описанием, специалист может либо приспособить формы для введения с контролируемым высвобождением,как, например, таблетки, капсулы, пластыри и т.д., известные в данной области, которые являются целью настоящего изобретения, либо разработать модифицированные или новые формы введения с контролируемым высвобождением. Изобретение иллюстрируется следующими примерами, которые, однако, не ограничивают область притязаний изобретения. Проценты даны по весу, если не указано особо. В тексте содержатся ссылки на сопровождающие описание фигуры, в которых: фиг. 1 представляет собой диаграмму, показывающую изменение в сыворотке концентрации (нмоль/л) (несвязанного) активного фрагмента во времени (ч) в течение 24 ч, когда введение предопределяет общую дозировку толтеродина (4 мг) посредством (i) таблетки (2 мг) с немедленным освобождением, принимаемой дважды в день, как в предыдущей практике,и (ii) капсулы (4 мг) с контролируемым высвобождением, принимаемой раз в день, в соответствии с настоящим изобретением; фиг. 2 представляет собой диаграмму, показывающую изменение базального слюноотделения (г/мин) во времени (ч) в течение 4 ч после введения (i) капсулы с контролируемым высвобождением, содержащей 4 мг толтеродина, в 7 соответствии с настоящим изобретением, (ii) таблетки с немедленным высвобождением, содержащей толтеродин, как в предыдущей практике, и (iii) плацебо; фиг. 3 представляет собой гистограмму,показывающую оценку полученного в опыте побочного эффекта для индивидуальных больных в виде сухости во рту ("не сухой рот", "слабая", "средняя", "сильная" сухость) после введения толтеродина посредством (i) обычной 2 мг таблетки с немедленным высвобождением, (ii) 4, 6 и 8 мг капсулы с контролируемым высвобождением соответственно согласно настоящему изобретению, и (iii) плацебо. Пример 1. Пероральные CR-капсула и IRтаблетка, содержащие толтеродин. Приготовление CR-капсул, содержащих 2 и 4 мг толтеродина. Капсулу с контролируемым высвобождением (CR), содержащую особые гранулы, покрытые (i) этилцеллюлозным слоем,(ii) слоем из толтеродина/НРМС (гидроксипропилметилцеллюлоза) и (iii) слоем из этилцеллюлозы/НРМС с пролонгированным действием,получают следующим образом: 1200 г (крахмалсодержащих) шариков из сахара, 20-25 меш, помещают в "кипящий" слойWurster и последовательно покрывают следующими тремя покрывающими растворами:- (1) Surelease-pacтвоpoм для изолирующего слоя, полученным путем смешивания 788 гSurelease с 563 г очищенной воды (Surelease является водной дисперсией для пленочного покрытия, содержащей приблизительно 25% твердых частиц, состоящих главным образом из этилцеллюлозы, пластифицированной в присутствии фракционированного кокосового масла,которая произведена Color-con, Inc., West Point,PA, U.S.A.);- (2) суспензией, полученной сначала с помощью растворения 35,0 г L-тартрата толтеродина в 2190 г очищенной воды и затем смешивания раствора с 6,6 г гипромеллозы, 5 сР (гидроксипропилметилцеллюлозы (НРМС; иSurelease. После высушивания шарики с покрытием помещают в твердые желатиновые капсулы(размер 3, белый/белый) с получением 2 мг и 4 мг капсул соответственно следующего состава(наполнительная масса для 2 мг капсулы, 169207 мг/капсулу): 2 мг 4 мг Состав капсула капсулаL-тартрат толтеродина 2,0 мг 4,0 мг Шарики из сахара, 20- 69 мг 137 мг 25 мешIR-таблетки, содержащие 2 мг L-тартрата толтеродина. Используют коммерчески доступные таблетки, содержащие 2 мг L-тартрата толтеродина, для немедленного высвобождения(IR) (Detrusitol, PharmaciaUpjohn AB, Sweden). Таблетки имеют следующий состав: ОсноваL-Тартрат толтеродина Целлюлоза микрокристаллическая Дигидрат вторичного кислого фосфата кальция Натриевая соль крахмалгликолевой кислоты Стеарат магния Коллоидный безводный кремний Покрытие Метилгидроксипропилцеллюлоза Целлюлоза микрокристаллическая Стеариновая кислота Двуокись титана Е 171 Фармакодинамические и фармакокинетические исследования. На больных с гиперактивным мочевым пузырем проводили клинические испытания для определения фармакодинамических и фармакокинетических эффектов от различных суточных доз (i) вышеописанной содержащей толтеродин капсулы с контролируемым высвобождением(ниже упоминается как TOD) в сравнении с (ii) вышеуказанной содержащей толтеродин таблеткой с немедленным высвобождением (ниже упоминается как TIR) и (iii) капсулой плацебо(содержащей только шарики из сахара). Опыт,включавший в себя две слепые пробы, две пробы с применением плацебо, проводили как перекрестное испытание на 60 больных в течение трех однонедельных периодов, во время которых проводили шесть введений (2, 4, 6 и 8 мгTOD один раз в день, 2 мг TIR два раза в день и плацебо). Всех больных рандомизируют по трем из шести введений, что означает, что 30 больных подвергают каждому из введений. Фармакодинамические и фармакокинетические измерения выполняют на седьмой день в каждом периоде введения. Определения включают в себя измерение (i) концентрации толтеродина и его основного 5-гидроксиметильного метаболита в сыворотке (ниже упоминается как 5-НМ) во времени, (ii) слюноотделения (сухости во рту) и 9 Концентрации толтеродина и основного метаболита в сыворотке Образцы крови отбирают непосредственно до принятия дозировки и через 0,5, 1, 2, 3, 6, 9,12, 24 и 25 ч и измеряют в сыворотке концентрацию свободного (несвязанного) толтеродина и его 5-НМ метаболита с помощью газовой хроматографии/масс-спектрометрии. Несвязанные концентрации рассчитывают, принимая во внимание, что фракция несвязанного толтеродина составляет 3,7% и 5-НМ составляет 36%,которые получают на основании исследований связывания с белком на сыворотке человека(Nilvebrant L., et al., Life Sciences, Vol. 60, Nos. 13/14 (1997) 1129-1136). Фиг. 1 показывает полученные во времени изменения суммы несвязанных концентраций толтеродина и 5-НМ (эта сумма означает "активный фрагмент"), с одной стороны, при введении 4 мг TOD-капсулы один раз в день и, с другой стороны, при введении 2 мг TIR-таблетки два раза в день (т.е. эквивалентные дозы капсулы и таблетки в течение 24 ч). Как показано на фигуре, наблюдаемые с TIR таблеткой пики отсутствуют в случае с TODкапсулой, что свидетельствует о том, что последняя поддерживает в основном постоянный уровень активного фрагмента в сыворотке в течение 24 ч. Различия в колебаниях концентраций в сыворотке между TIR таблеткой и ТОDкапсулой можно продемонстрировать также путем расчета "индекса колебаний". Индекс колебаний, FI, рассчитывают как FI = (Сmах Cmin)/AUC/, гдепредставляет собой длительность интервала действия дозировки и АUС означает площадь под кривой концентрации в сыворотке в течение интервала действия дозировки. Таким образом, средний подсчитанный индекс колебаний для активного фрагмента составляет 2,40 (95% CI 1,95-2,63) для TIRтаблетки (на основании n = 28) и 0,68 (95% CI 0,59-0,78) для TOD-капсулы. Слюноотделение (сухость во рту) Слюноотделение измеряют с использованием зубных ватных валиков, которые помещают в рот на две минуты по три раза. Измерения выполняют до завтрака и с этого времени после каждого взятия образца крови на седьмой день каждого периода обработки. На основании всех измерений, произведенных после введения дозировки, подсчитывают среднее значение слюноотделения в течение 12 ч. Базальное слюноотделение в стабильном состоянии измеряют после введения (i) 4 мг TOD-капсулы, (ii) 2 мгTIP-таблетки и (iii) плацебо. Результаты представлены на фиг. 2. Как видно из этой фигуры,степень слюноотделения в основном является константой в течение отслеживаемого периода в случае TOD-капсулы, в то время как в случаеTIR-таблетки наблюдается значительное сниже 002720 10 ние слюноотделения (т.е. увеличение сухости во рту). Хотя на фиг. 2 показано измеренное общее слюноотделение, степень слюноотделения или сухости во рту также определяли на основании оценки интенсивности этого явления самим больным по его ощущениям. Результаты действия 2 мг TIR-таблетки, даваемой дважды в день, 4 мг TOD-капсулы, 6 мг TOD-капсулы и 8 мг TOD-капсулы представлены на фиг. 3 в виде гистограммы. Четыре столбца для каждой дозировки представляют собой на этой фигуре слева направо степень слюноотделения: нет сухости во рту, слабая сухость, средняя сухость и сильная сухость соответственно. Как видно из фиг. 2, степень сухости во рту при действии 2 мг TIR-таблетки, даваемой дважды в день, выше чем степень сухости во рту в случае 4 мг TOD-капсулы и приблизительно в два раза более высокая, т.е. 8 мг TOD,требуется для того, чтобы получить отрицательные эффекты, т.е. сухость во рту, соответствующую таковой в случае 2 мг TIR-таблетки,даваемой дважды в день. Таким образом, результаты определений слюноотделения показывают, что выравнивание пиков концентрации "активного фрагмента" (т.е толтеродина плюс 5-НМ) приводит к существенному снижению нежелательного эффекта,такого как сухость во рту. Остаточный объем мочи Остаточный объем является объемом мочи, остающимся в мочевом пузыре немедленно после мочевыделения. Измерение остаточного объема представляет собой способ оценки эффективности лечения мочевого пузыря антимускариновыми препаратами. Фактически этот способ обеспечивает оценку эффективности(изменение остаточного объема), а также безопасности (задержка мочи, т.е. неспособность мочеиспускания). Таким образом, эффективность может быть измерена как средний остаточный объем в единицу времени, а безопасность связана с контролированием случаев, когда остаточная моча превышает фиксированный уровень. Средний остаточный объем на мочеиспускание измеряли с помощью неинвазивного(ультразвукового) метода для случая плацебо, 2 мг TIR-таблетки, даваемой дважды в день, и капсулы TOD 2 мг, TOD 4 мг, TOD 6 мг и TOD 8 мг. Результаты представлены в табл. 1 и 2 ниже. В табл.1 приведен средний остаточный объем на мочеиспускание, а в табл. 2 показан максимальный остаточный объем в течение 12 ч. Таблица 1. Средний остаточный объем на мочеиспускание, млTIR Пла- 2 мг, TOD цебо 2 раза 2 мг в день Среднее значение 95% доверительный интервал Отличие от IR Таблица 2. Максимальный остаточный объем в течение 12 ч Плацебо Среднее 46 72 45 55 87 77 значение минимум макси 5-267 10-316 0-192 0-349 0-360 0-390 мум Представленные результаты четко показывают, что дозировки TOD-капсулы являются такими же эффективными, как и соответствующие дозировки TIR-таблетки, даваемые дважды в день, и что дозировка TOD-капсулы может быть увеличена вплоть до 8 мг ежедневно и все еще оставаться безопасной в отношении задержки мочи. Результаты описанных выше клинических испытаний свидетельствуют о том, что выравнивание концентраций в сыворотке активного фрагмента (толтеродина плюс 5-НМ) не только не приводит к потере эффективности или к неблагоприятным побочным эффектам, главным образом к задержке мочи, но что самое важное,также способствует снижению эффекта сухости во рту (не воздействует или меньше снижает слюноотделение). Пример 2. Композиция в виде трансдермального пластыря, содержащего толтеродин. Пластыри, высвобождающие толтеродин,получают следующим образом. Система 1 (лекарственное средство в адгезивном материале, акрилат). 5 г основания толтеродина растворяют в 11 г этанола и добавляют к 20 г Durotak 387- 2287(National StarchChemical, U.S.A.). Гель, содержащий лекарственное средство, покрывают мембраной для подложки (Scotchpak 1012; 3 МCorp., U.S.A.) с использованием оборудования для покрытия (RK Print Coat Instr. Ltd, TypeKCC 202 control coater). Толщина влажного слоя составляет 400 мкм. Слоистый материал высушивают в течение 20 мин при RT и затем в течение 30 мин при 40 С. Полиэфирную прокладку для высвобождения (S 2016; Rexam Release) наслаивают на высушенный гель, содержащий лекарственное средство, пластину разрезают на пластыри и хранят при 2-8 С до использования(упакованными в Barex мешки). Концентрация основания толтеродина в пластырях составляет 2,5 мг/см 2. Система 2 (многослойный материал, полиакрилат). 5 г основания толтеродина растворяют в 10 мл этанола. Смесь из 6,4 г Eudragit RL 100(Rohm Gmbh Chemische Fabrik, Germany) и 6,4 г этанола и смесь из 2,6 г Polyvidone 90 (BASF,Germany) и 10,2 г этанола добавляют к раствору основания толтеродина в этаноле. В конце добавляют 4 г пропиленгликоля. Гель, содержащий лекарственное средство, покрывают мембраной для подложки (Scotchpak 1109; 3 МCorp., U.S.А.) с использованием указанного выше оборудования для покрытия. Толщина влажного слоя составляет 400 мкм. Затем слоистый материал высушивают при 40 С в течение 2 ч. Адгезивный слой, состоящий из Plastoid E35H,покрывают полиэфирной пленкой (S 2016;Rexam Release) и высушивают при 80 С в течение 10 мин. Затем два слоя наслаивают. Пластину разрезают на пластыри и до использования хранят при 2-8 С (упакованными в мешкиBarex). Концентрация основания толтеродина в пластырях составляет 2,0 мг/см 2. Система 3 (многослойный материал,водоосновный полиакрилат). 1 г основания толтеродина смешивают сTween 80 (Merck) путем нагревания до 60-70 С. 1,8 г триэтилацетата и 1,3 г деминерализованной воды добавляют к смеси. Затем конечную смесь добавляют к 25 г Eudragit RL 30D (Rohm Gmbh Chemische Fabrik, Germany). И,наконец, добавляют 180 мг 1 N NaOH. Гель,содержащий лекарственное средство, покрывают мембраной для подложки (Scotchpak 1109; 3 М Corp., U.S.A.) с использованием оборудования для покрытия. Толщина влажного слоя составляет 400 мкм. Слоистый материал высушивают при 40 С в течение 2 ч. Адгезивный слой,состоящий из Plastoid E35H, покрывают полиэфирной пленкой (S 2016; Rexam Release) и высушивают при 80 С в течение 10 мин. Затем два слоя наслаивают. Пластину разрезают на пластыри и до использования хранят при 2-8 С(упакованными в Ваrех мешки). Концентрация основания толтеродина в пластырях составляет 0,5 мг/см 2. 13 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ лечения нестабильного или гиперактивного мочевого пузыря, включающий в себя введение больному, нуждающемуся в подобном лечении, толтеродина или родственного толтеродину соединения или его фармацевтически приемлемой соли в фармацевтически эффективном количестве в составе композиции с контролируемым высвобождением, способной поддерживать в сыворотке существенно постоянную концентрацию активного фрагмента или фрагментов в течение, по меньшей мере, 24 ч и имеющей средний индекс колебаний указанной концентрации активного фрагмента или фрагментов в сыворотке, составляющий приблизительно не выше чем 2,0, причем вышеуказанный индекс колебаний, FI, определяется какFI = (Сmах - Cmin) /AUC/,где Сmах и Сmin означают соответственно максимальную и минимальную концентрации активного фрагмента или фрагментов, АUС означает площадь под кривой зависимости концентрации отв сыворотке, аозначает длительность интервала действия дозировки. 2. Способ по п.1, в котором указанный средний индекс колебаний не выше чем 1,0. 3. Способ по п.1 или 2, при котором вводят толтеродин, его 5-гидроксиметильный метаболит или рацемат, соответствующий толтеродину, и профиль вышеуказанной кривой зависимости концентрации, регистрируемый в сыворотке в течение 24 ч, выраженный как AUC несвязанного толтеродина и 5-гидроксиметильного метаболита, устанавливается в диапазоне приблизительно от 5 до 150 нМч, предпочтительно в диапазоне приблизительно от 10 до 120 нМч. 4. Способ по п.1, 2 или 3, при котором вводят толтеродин, его 5-гидроксиметильный метаболит или рацемат, соответствующий толтеродину, и концентрация в сыворотке несвязанного толтеродина и 5-гидроксиметильного метаболита устанавливается в диапазоне приблизительно от 0,2 до 6,3 нМ, предпочтительно в диапазоне приблизительно от 0,4 до 5,0 нМ. 5. Способ по любому из пп.1-4, при котором композиция контролируемого высвобождения представляет собой капсулу или таблетку для перорального введения один раз в день. 6. Способ по любому из пп.1-4, при котором композиция контролируемого высвобождения представляет собой трансдермальный препарат, предпочтительно трансдермальный пластырь. 7. Способ по любому из пп.1-6, при котором вводят толтеродин. 8. Способ по любому из пп.1-6, при котором лечат недержание мочи. 9. Фармацевтическая композиция, содержащая толтеродин, или родственное толтеродину соединение, или его фармацевтически при 002720 14 емлемую соль, отличающаяся тем, что при введении этой композиции больному обеспечивается контролируемое высвобождение толтеродина, или вышеуказанного родственного толтеродину соединения, или его соли таким образом, что в сыворотке поддерживается существенно постоянная концентрация активного фрагмента или фрагментов в течение, по меньшей мере, 24 ч, и средний индекс колебаний указанной концентрации в сыворотке активного фрагмента или фрагментов составляет приблизительно не выше чем 2,0, причем вышеуказанный индекс колебаний, FI, определяется как FI =(Сmах-Cmin)/AUC/, где Сmах и Cmin означают соответственно максимальную и минимальную концентрации активного фрагмента или фрагментов, AUC означает площадь под концентрационной кривой в сыворотке, аозначает длительность интервала действия дозировки. 10. Композиция по п.9, в которой средний индекс колебаний не выше чем приблизительно 1,0. 11. Композиция по п.9 или 10, при которой вводят толтеродин, его 5-гидроксиметильный метаболит или рацемат, соответствующий толтеродину, и профиль концентрационной кривой,регистрируемый в сыворотке в течение 24 ч,выраженный как AUC несвязанного толтеродина и 5-гидроксиметильного метаболита, устанавливается в диапазоне приблизительно от 5 до 150 нМч, предпочтительно в диапазоне приблизительно от 10 до 120 нМч. 12. Композиция по п.9 или 10, характеризующаяся тем, что вводят толтеродин, его 5 гидроксиметильный метаболит или рацемат,соответствующий толтеродину, и концентрация в сыворотке несвязанного толтеродина и 5 гидроксиметильного метаболита устанавливается в диапазоне приблизительно от 0,2 до 6,3 нМ,предпочтительно в диапазоне приблизительно от 0,4 до 5,0 нМ. 13. Композиция по любому из пп.9-12, которая представляет собой капсулу или таблетку для перорального введения единожды в день. 14. Композиция по любому из пп.1-12, которая представляет собой трансдермальный препарат, предпочтительно трансдермальный пластырь. 15. Композиция по любому из пп.9-14, которая обеспечивает контролируемое высвобождение толтеродина. 16. Применение толтеродина, или родственного толтеродину соединения, или его фармацевтически приемлемой соли для производства терапевтической композиции для лечения нестабильного или гиперактивного мочевого пузыря, причем указанная композиция обеспечивает контролируемое высвобождение толтеродина, или родственного толтеродину соединения, или его соли таким образом, что в сыворотке поддерживается существенно постоянная концентрация активного фрагмента или фрагментов в течение, по меньшей мере, 24 ч, и средний индекс колебаний указанной концентрации в сыворотке активного фрагмента или фрагментов составляет приблизительно не выше чем 2,0, причем вышеуказанный индекс колебаний, FI,определяется как FI = (Cmax-Cmin)/AUC/, где Cmax иCmin означают соответственно максимальную и минимальную концентрации активного фрагмента или фрагментов, АUС означает площадь под кривой зависимости концентрации отв сыворотке, аозначает длительность интервала действия дозировки. 17. Применение по п.16, при котором производят композицию по любому из пп.10-15.
МПК / Метки
МПК: A61K 9/22, A61P 13/10
Метки: композиция, введения, контролируемым, лечения, терапевтическая, толтеродина, высвобождением, пузыря, способ, мочевого, использованием
Код ссылки
<a href="https://eas.patents.su/9-2720-terapevticheskaya-kompoziciya-dlya-vvedeniya-tolterodina-s-kontroliruemym-vysvobozhdeniem-i-sposob-lecheniya-mochevogo-puzyrya-s-eyo-ispolzovaniem.html" rel="bookmark" title="База патентов Евразийского Союза">Терапевтическая композиция для введения толтеродина с контролируемым высвобождением и способ лечения мочевого пузыря с её использованием</a>
Предыдущий патент: Новые соли с полезными органолептическими свойствами
Случайный патент: Защитная крышка с предохранительным кольцом и индикацией вскрытия