Способ получения ингаляционной липосомальной формы рифабутина
Номер патента: 23080
Опубликовано: 29.04.2016
Авторы: Швец Виталий Иванович, Ульянов Андрей Михайлович, Краснопольский Юрий Михайлович, Тарасов Вадим Владимирович, Шоболов Дмитрий Львович, Натыкан Алексей Андреевич, Балабаньян Вадим Юрьевич
Формула / Реферат
Способ получения липосомального препарата, включающий создание композиции фосфолипидов и рифабутина, высушивание смеси, ее эмульгирование в водной среде, диспергирование эмульсии, гомогенизацию, дробное добавление криопротектора, стерилизующую фильтрацию и лиофильное высушивание, при этом гомогенизацию проводят по меньшей мере в два этапа: первоначальный при 500 атм, последующий при 800-1000 атм, добавление криопротектора трегалозы проводят первоначально при эмульгировании, а затем в процессе или после гомогенизации, при этом массовое соотношение компонентов в полученном препарате рифабутин : фосфолипиды : криопротектор находится в пределах 7:(10,0-700,0):(28-120), соответственно, а в качестве фосфолипида используют фосфатидилхолин или смесь фосфатидилхолина и отрицательно заряженного фосфолипида (дифосфатидилглицерина или фосфатидилглицерина) в соотношении 1:1.
Текст
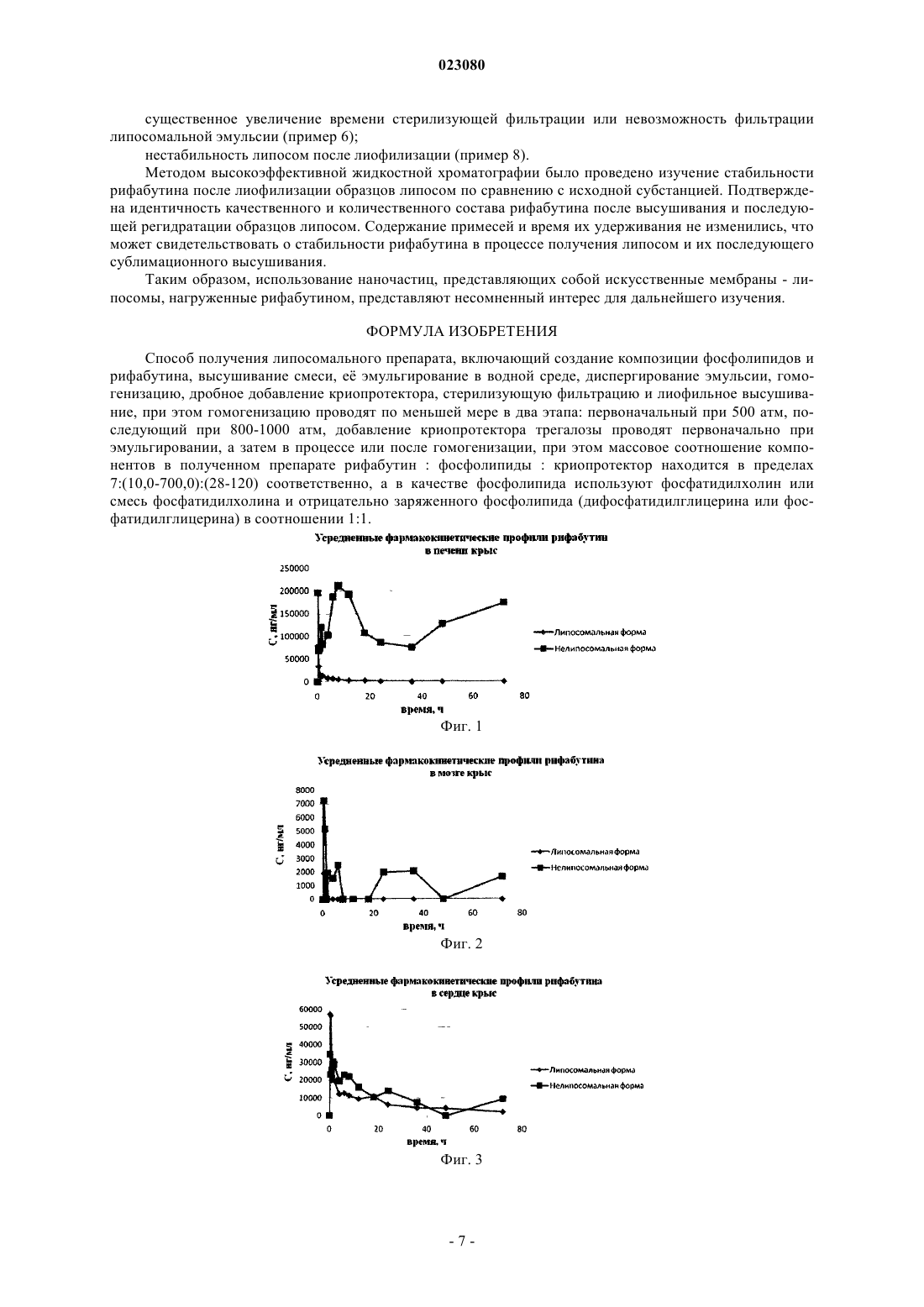
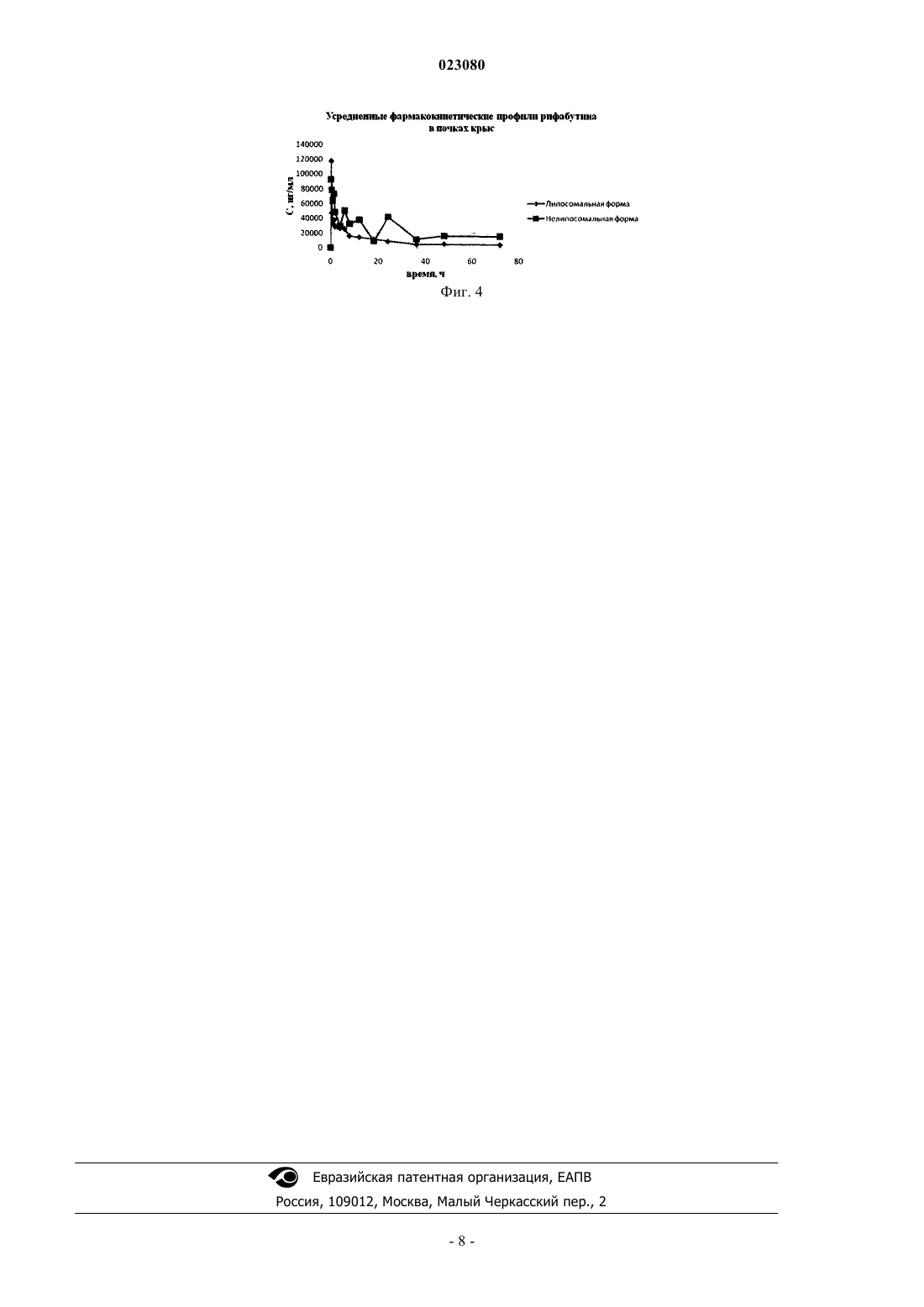
СПОСОБ ПОЛУЧЕНИЯ ИНГАЛЯЦИОННОЙ ЛИПОСОМАЛЬНОЙ ФОРМЫ РИФАБУТИНА(56) RU-C1-2391966 СЕЛИЩЕВА Алла Анатольевна. Принципы создания новых форм лекарственных препаратов и биологически активных соединений солюбилизацией липосомами. Автореферат диссертации на соискание ученой степени доктора химических наук. Москва, 2007, с. 29-34 Изобретение относится к фармацевтике, а именно к получению липосом, содержащих антибиотик рифабутин, для ингаляционного введения при лечении туберкулеза. Способ включает создание композиции фосфолипидов и рифабутина, высушивание смеси, е эмульгирование в водной среде,диспергирование эмульсии, гомогенизацию, дробное добавление криопротектора, стерилизующую фильтрацию и лиофильное высушивание. Способ позволяет достигнуть стандартности и стабильности содержащих рифабутин липосом (размер липосом представлен в узком диапазоне),высокой инкапсуляции рифабутина в липосомы, стабильности рифабутина в процессе хранения и снижении токсического действия липосомального рифабутина (в частности, более чем в три раза по сравнению с нелипосомальным аналогом). Шоболов Дмитрий Львович (RU),Краснопольский Юрий Михайлович(UA), Ульянов Андрей Михайлович,Натыкан Алексей Андреевич, Тарасов Вадим Владимирович, Балабаньян Вадим Юрьевич, Швец Виталий Иванович (RU) Ермакова Е.А. (RU) Изобретение относится к фармацевтике, а именно к получению липосом, содержащих антибиотик рифабутин, для ингаляционного введения при лечении туберкулеза. Туберкулез (ТБ) - инфекционное заболевание с высоким уровнем смертности (10%), от которого умирает ежегодно более миллиона человек. В настоящее время наиболее распространен туберкулез легких, т.к. заражение человека туберкулезом происходит в большинстве случаев (в 95%) через дыхательные пути. Для лечения туберкулеза разработана схема терапии, согласно которой лечение проводят длительно в течение 4-6 мес., в сочетании приема (внутривенным введением и пероральным путем) нескольких препаратов первого ряда, в том числе рифампицином (РМ) или его производным рифабутином. Эффективность лечения больных ТБ может быть увеличена при использовании наиболее короткого пути попадания антибиотики в очаг поражения - легкие при ингаляционном введении. Рифабутин (РБ) или 4-дезоксо-3,4-[2-спиро-N-изобутил-4-пиперидил] 2,5-дигидро-1 Н-имидазол]рифамицин S (C46H62N4O11)-полусинтетический антибиотик рифамицинового ряда, гидрофобное соединение, плохо растворимое в воде (растворимость равна 0,19 мг/мл) со следующей химической формулой: Длительное применение рифабутина в виде капсул или инъекций оказывает выраженные побочные эффекты (тошнота, рвота, нарушение функции печени). Разработка новой лекарственной формы препарата, обеспечивающей повышенную растворимость рифабутина в воде, и направленное введение в легкие снизит его гепатотоксичность. В следующих источниках описаны липосомальные композиции на основе рифабутина. В частности, известна работа Шакиной Ю.Н., Вострикова В.В., Сорокоумовой Г.М., Селищевой А.А., Швеца В.И. Зависимость свойств рифабутина и его включения в липосомы от рН среды // Антибиотики и химиотерапия, 2005, т. 50,7, стр. 3-7, в которой проведено систематическое изучение физико-химических свойств рифабутина и показано, что включение РБ в липосомы является максимальным в кислой среде. В данной работе не приводятся значения эффективности включения рифабутина в липосомы, а рассчитывается связывание его с липосомальным фосфатидилхолином. Известен патент RU 2420287 "Способ получения капсулированной формы противотуберкулезных препаратов рифамицинового ряда" (опубликован 10.06.2011). Авторы для получения липосом использовали смесь липидов следующего состава: гликосфинголипиды 60%; фосфолипиды - 37% холестерин и триацилглицериды - 3%. Липосомы получали путем наслаивания порошка смеси липидов на поверхность водного раствора антибиотика с последующим диспергированием при слабом перемешивании магнитной мешалкой при комнатной температуре в течении 30 мин. Эффективность включения РБ в липосомы составляла 33%. В работе не определялась стабильность данного препарата при хранении и не предлагался путь их дальнейшего введения в организм при лечении. Известна работа Gaspar M.M., Cruz A., Penha A.F.,Reymao J., Sousa A.C., Eleuterio C.V., DominguesAgents, 2008, 31, pp. 37-45. Авторами работы была создана и изучена in vivo модель диссеминированного туберкулеза на мышах, органами-мишенями которого являются в основном печень, селезенка и легкие. Популяция мышей была инфицирована 5104 КОЕ штамма М. tuberculosis H37Rv. Были приготовлены и охарактеризованы липосомальные препараты с РБ, различающиеся липидным составом. Получали и исследовали действие РБ в составе липосом из фосфатидилхолина и фосфатидилглицерина (ФХ:ФГ), димиристоилфосфатидилхолина и димиристоилфосфатидилглицерина (ДМФХ:ДМФГ), дипальмитоилфосфатидилхолина и дипальмитоилфосфатидилглицерина (ДПФХ:ДПФГ) и пегелированного дипальмитоифосфатидилхолина (ДПФХ:ПЭГ). Сравнительный анализ профилей распределения свободного РБ и различных липосомальных препаратов в организме мышей при внутривенном введении показал, что главными органами-мишенями липосом являются печень, легкие и особенно селезенка. Оказалось, что наиболее эффективную доставку препарата в ткани-мишени обеспечивали липосомы с РБ состава ДПФХ:ДПФГ. Оказалось, что в рассмотренной модели лечения диссеминированного туберкулеза липосомальным РБ большее снижение бактериальной нагрузки наблюдалось в селезенке и печени, а не в легких. Было показано, что для лече-1 023080 ния легочного туберкулеза внутривенный путь введения липосомального препарата не имеет больших преимуществ перед свободным РБ. По мнению авторов, в качестве наиболее близкого аналога данного изобретения возможно рассматривать исследования, описанные в работе Gaspar MM, Neves S, Portaels F, Pedrosa J, Silva MT, Cruz MEChemother. 2000 Sep;44(9):24,) в которой получение липосом с инкапсулированным в них РБ проводили в две стадии: вначале получали дисперсию мультиламмелярных везикул (МЛВ) путм диспергирования плнки высушенных липидов в физиологическом или буферном растворах, а затем получали липосомы путм продавливания образцов через ядерный фильтр. Содержание РБ в липосомах определяли во фракции липосом после отделения свободного РБ от фракции липосом методом гель-фильтрации. Включение РБ в липосомы рассчитывали как отношение включенного РБ к фосфолипидам липосом, в которых он находился. Было показано, что отрицательно заряженные фосфолипиды увеличивают включение РБ. Установлено, что при внутривенном введении липосомы с РБ преимущественно накапливаются в печени и селезенке, а их накопление в легких незначительно. Это происходит потому, что липосомы легко фагоцитируются клетками ретикулоэндотелиальной системы (например, клетками Купфера), из-за чего эффективность их действия резко снижается. В данном исследовании нашли незначительное повышение эффективности действия липосом с РБ по сравнению с водным раствором РБ. Оценку стабильности компонентов, входящих в состав препарата (фосфолипидов и рифампицина), не проводили. Вместе с тем, при заражении туберкулезом клетки микобактерий туберкулеза после попадания в легкие и закрепления на сурфактанте способны проникать по механизму фагоцитоза в альвеолярные макрофаги, где происходит их размножение. Липосомы размером более 0,1 мкм также легко фагоцитируются альвеолярными макрофагами, и таким образом может быть осуществлена направленная доставка в макрофаги лекарственного препарата, находящегося в липосомах. Размер липосом важен для эффективности действия препарата. С одной стороны, чем больше размер частиц, тем эффективнее они захватываются альвеолярными макрофагами. С другой стороны, крупные частицы (около микрона в диаметре) осаждаются в носоглотке, и только небольшие частицы (не более 0,3-0,5 мкм) достигают альвеол. Кроме того, при лечении туберкулеза легких возможно местное применение препарата липосом с антибиотиком в виде ингаляций, при котором лекарственный препарат сразу попадет в место поражения. Исходя из сказанного, для терапии легочного туберкулеза предпочтителен ингаляционный путь введения липосомального РБ, в следствии чего существует потребность в создании липосомального препарата РБ, обладающего высоким включением активного ингредиента в липосомы и стабильностью при хранении, который можно было бы применять местно для лечения туберкулеза легких. Результат, полученный при создании заявленного способа, состоит в возможности получения липосомального препарата рифабутина (РБ), характеризующегося максимально возможной степенью включения РБ в липосомы (до 73-75%), стабильным при хранением (не менее одного года) и пригодным для ингаляционной формы введения. В качестве такой лекарственной формы в данном изобретении предложена липосомальная форма рифабутина, т.к. на одной из начальных стадий получения липосом происходит солюбилизация малорастворимого РБ, за счет чего можно значительно (в десятки раз) повысить содержание антибиотика в водной фазе. Задачей заявленного способа является упрощение процесса получения и повышение качества липосомального препарата по показателям стабильности как липосомальной структуры так и стабильности фармакологически активной субстанции рифабутина, при этом результат, полученный при решении поставленной задачи, состоит в достижении стандартности и стабильности содержащих рифабутин липосом (размер липосом представлен в узком диапазоне), высокой инкапсуляции рифабутина в липосомы,стабильности рифабутина в процессе хранения и снижении токсического действия липосомального рифабутина (в частности, более, чем в три раза по сравнению с нелипосомальным аналогом). Для достижения поставленного результата предлагается способ получения липосомального препарата, включающий создание композиции фосфатидилхолина и рифабутина, высушивание смеси, е эмульгирование в водной среде, диспергирование эмульсии, гомогенизацию, добавление криопротектора, стерилизующую фильтрацию и лиофильное высушивание, при этом эмульгирование проводят в водной среде, гомогенизацию проводили в два этапа: первоначальный при 500 атм, последующий при 8001000 атм, добавление криопротектора (лактозы, трегалозы, сахарозы или маннита) проводили первоначально при эмульгировании, а затем в процессе или после гомогенизации, при этом соотношение компонентов в полученном препарате рифабутин : фосфолипиды : криопротектор находится в переделах 7 :(10,0-700,0) : (28-120), соответственно, а в качестве фосфолипида используют фосфатидилхолин или фосфатидилхолин : отрицательно заряженные фосфолипиды в соотношении 1:1. В общем виде процессе практической реализации способ предусматривает использование яичного фосфатидилхолина и рифабутина в органических растворителях, удаление растворителя упариванием в вакууме, диспергирование полученной массы в водной среде с рН 6,3-7,3, диспергирование многослойных липосом при возрастающем давлении, добавление криопротектора до, во время или после гомогенизации, получение липосом размером 80-140 нм, стерилизующую фильтрацию полученной липосомальной эмульсии, разлив во флаконы, лиофилизацию и герметизацию в атмосфере инертного газа (или азо-2 023080 та). Способ иллюстрируется графиками фармакокинетических профилей рифабутина в печени, мозге,почках и сердце крыс (рис. 1-4, соответственно). Эффективность заявляемого способа по качественной и количественной идентификации в готовом продукте липидного компонента - фосфатидилхолина оцененивали методом тонкослойной хроматографии на пластинках по хроматограмме раствора целевого продукта в метаноле, на которой основное пятно желтого цвета находится на уровне основного пятна раствора стандартного образца фосфатидилхолина; индекс окисленности липидов проводили УФ-спектроскопией при двух длинах волн: 233 нм и 215 нм. Эффективность заявляемого способа по качественной и количественной идентификации в готовом продукте рифабутина оцененивали методом высокоэффективной жидкостной хроматографии, которую проводили для количественного определения посторонних примесей и содержания рифабутина в образцах препарата. Использовали хроматограф "Shimadzu", колонка 11,0 см 4,6 мм octylsilyl silica gel for chromatography R (5 m) или аналогичная, подвижные фазы: раные объемы ацетонитрила и калия дигидрофосфата; скорость подвижной фазы - 1,0 мл/мин; детектирование при длине волны 254 нм. Оценивали физико-химические свойства полученного липосомального препарата. Определением величины частиц липосом проводили на наносайзере Zetasizer Nano ZS, Malvern методом фотонной корреляционной спектроскопии. Размер частиц измеряли при помощи полупроводникового лазера при длине волны 375 нм. Нижеследующие примеры иллюстрируют способ получения липосомального препарата Рифабутина, а также варианты получения. Подразумевается, что хотя в подробном описании и конкретных примерах раскрыты предпочтительные варианты осуществления изобретения, они приведены лишь для наглядности, поскольку из описания, а также формулы изобретения для специалиста в данной области техники станут очевидными различные изменения и усовершенствования, не выходящие за пределы существа и объема изобретения. Пример 1. Рифабутин в количестве 700 мг растворяли в 100 мл этанола. Фосфатидилхолин яичного желтка в количестве 4000 мг растворяли в 100 мл этанола. Этанольные растворы объединяли, фильтровали через мембраны 0,22 мкм и концентрировали в вакууме на роторном испарителе при 37-40 С. Затем полученную липидную пленку обрабатывали газообразным азотом при перемешивании (60-80 об/мин) до полного удаления этанола. К липидной пленке, содержащей фосфатидилхолин и рифабутин добавляли 100 мл буферной смеси с рН 6,6, в которой находилось 3,5 г трегалозы (из 10 необходимых). Емкость с эмульсией перемешивали при 130-150 об/мин в до полного эмульгирования липидной пленки. Эмульсию переносили в гомогенизатор высокого давления и проводили гомогенизацию при температуре 38-43 С. Первоначальное давление (всего два цикла) составляло 500 атм. Затем продолжали гомогенизацию при 900-1000 атм до размера частиц не более 150 нм. При достижении заданного размера частиц в эмульсию добавляли оставшийся стерильный раствор трегалозы (6,5 г). Эмульсию фильтровали через каскад фильтров, с финишным фильтром 0,2 мкм. Фильтрация проходила удовлетворительно: 100 мл фильтровали не более 10 мин. Размер частиц после стерилизующей фильтрации 148,4 нм - 100%. Включение антибиотика после стерилизующей фильтрации 77,4%. Объем стерильной эмульсии 90 мл. Проводили розлив во флаконы и лиофилизацию. Флаконы герметизировали в атмосфере инертного газа (азота). По результатам контроля продукта, полученного по предлагаемому способу, после лиофилизации установлено, что препарат представлен в виде легкой аморфной массы фиолетового цвета с характерным запахом; размер частиц сохранен в нанодиапазоне рН 6,65. Включение рифабутина не менее 75,4%. Количество примесей в липосомальном продукте на уровне исходной субстанции рифабутина. Массовое соотношение компонентов в препарате: Соотношение компонентов в препарате: рифабутин : фосфатидилхолин: трегалоза - (7:40:100). Полученные образцы хранят при температуре +4 С в течение 1 года. Установлена стабильность липосомальной формы рифабутина: размер частиц, степень включения рифабутина в липосомы, продукты деструкции липидов. Пример 2. Рифабутин в количестве 700 мг растворяли в 100 мл этанола. Фосфатидилхолин сои в количестве 2000 мг растворяли в 100 мл этанола. Кардиолипин в количестве 2000 мг растворяли в 100 мл хлороформа. Хлороформный раствор и этанольные растворы объединяли, фильтровали через мембраны 0,22 мкм и концентрировали в вакууме на роторном испарителе при 37-40 С. Затем полученную липидную пленку обрабатывали газообразным азотом при перемешивании (60-80 об/мин) до полного удаления растворителя. К липидной пленке, содержащей фосфатидилхолин, кардиолипин и рифабутин добавляли 100 мл буферной смеси с рН 6,0, в которой находилось 7,0 г трегалозы. Емкость с эмульсией перемешивали при 130-150 об/мин в до полного эмульгирования липидной пленки. Эмульсию переносили в гомогенизатор высокого давления и проводили гомогенизацию при температуре 38-43 С. Первоначальное давление (всего два цикла) составляло 500 атм. Затем продолжали гомо-3 023080 генизацию при 800 атм до размера частиц не более 150 нм. Эмульсию фильтровали через каскад фильтров, с финишным фильтром 0,2 мкм. Фильтрация проходила удовлетворительно: 100 мл фильтровали не более 10 мин. Размер частиц после стерилизующей фильтрации 138,0 нм - 100%. Включение рифабутина после стерилизующей фильтрации 87,4%. Объем стерильной эмульсии 90 мл. Проводили розлив во флаконы и лиофилизацию. Флаконы герметизировали в атмосфере инертного газа (азота). По результатам контроля продукта, полученного по предлагаемому способу, после лиофилизации установлено, что препарат представлен в виде легкой аморфной массы фиолетового цвета с характерным запахом; размер частиц сохранен в нанодиапазоне рН-6,15. Включение антибиотика не менее 87,0%. Количество примесей в липосомальном продукте на уровне исходной субстанции рифабутина. Массовое соотношение компонентов в препарате: Соотношение компонентов в препарате: рифабутин : фосфатидилхолин: кардиолипин : трегалоза - (7:20:20:70). Полученные образцы хранят при температуре+4 С в течение 1 года. Установлена стабильность липосомальной формы рифабутина: размер частиц,степень включения рифабутина в липосомы, продукты деструкции липидов. Пример 3. Рифабутин в количестве 700 мг растворяли в 100 мл этанола. Фосфатидилхолин яичного желтка в количестве 2000 мг растворяли в 100 мл этанола. Фосфатидилглицерин в количестве 2000 мг растворяли в 100 мл хлороформа. Хлороформный раствор и этанольные растворы объединяли, фильтровали через мембраны 0,22 мкм и концентрировали в вакууме на роторном испарителе при 37-40 С. Затем полученную липидную пленку обрабатывали газообразным азотом при перемешивании (60-80 об/мин) до полного удаления растворителя. К липидной пленке, содержащей фосфатидилхолин, фосфатидилглицерин и рифабутин, добавляли 100 мл буферной смеси с рН 7,5, в которой находилось 12,0 г трегалозы. Емкость с эмульсией перемешивали при 130-150 об/мин в до полного эмульгирования липидной пленки. Эмульсию переносили в гомогенизатор высокого давления и проводили гомогенизацию при температуре 38-43 С. Первоначальное давление (всего два цикла) составляло 500 атм. Затем продолжали гомогенизацию при 900 атм до размера частиц не более 150 нм. Эмульсию фильтровали через каскад фильтров, с финишным фильтром 0,2 мкм. Фильтрация проходила удовлетворительно: 100 мл фильтровали не более 10 мин. Размер частиц после стерилизующей фильтрации 141,8, нм - 100%. Включение рифабутина после стерилизующей фильтрации 83,4%. Объем стерильной эмульсии 90 мл. Проводили розлив во флаконы и лиофилизацию. Флаконы герметизировали в атмосфере инертного газа (азота). По результатам контроля продукта, полученного по предлагаемому способу, после лиофилизации установлено, что препарат представлен в виде легкой аморфной массы фиолетового цвета с характерным запахом; размер частиц сохранен в нанодиапазоне рН 6,65. Включение рифабутина не менее 82,5%. Количество примесей в липосомальном продукте на уровне исходной субстанции рифабутина. Массовое соотношение компонентов в препарате: Соотношение компонентов в препарате: рифабутин : фосфатидилхолин: кардиолипин : трегалоза - (7:20:20:120). Полученные образцы хранят при температуре+4 С в течение 1 года. Установлена стабильность липосомальной формы рифабутина: размер частиц,степень включения рифабутина в липосомы, продукты деструкции липидов. Пример 4. Рифабутин в количестве 700 мг растворяли в 100 мл этанола. Фосфатидилхолин сои в количестве 70000 мг растворяли в 200 мл этанола. Этанольные растворы объединяли, фильтровали через мембраны 0,22 мкм и концентрировали в вакууме на роторном испарителе при 37-40 С. Затем полученную липидную пленку обрабатывали газообразным азотом при перемешивании (60-80 об/мин) до полного удаления этанола. К липидной пленке, содержащей фосфатидилхолин и рифабутин добавляли 100 мл буферной смеси с рН 7,0, в которой находилось 12,0 г трегалозы. Емкость с эмульсией перемешивали при 130-150 об/мин в до полного эмульгирования липидной пленки. Эмульсию переносили в гомогенизатор высокого давления и проводили гомогенизацию при температуре 38-43 С. Первоначальное давление (всего два цикла) составляло 500 атм. Затем продолжали гомогенизацию при 1000 атм до размера частиц не более 220 нм. Эмульсию фильтровали через каскад фильтров, с финишным фильтром 0,2 мкм. Фильтрация проходила удовлетворительно: 100 мл фильтровали не более 20 мин (с заменой фильтров). Размер частиц после стерилизующей фильтрации 198,4 нм - 100%. Включение рифабутина после стерилизующей фильтрации 80,4%. Объем стерильной эмульсии 79 мл. Проводили розлив во флаконы и лиофилизацию. Флаконы герметизировали в атмосфере инертного газа (азота). По результатам контроля продукта, полученного по предлагаемому способу, после лиофилизации установлено, что препарат представлен в виде легкой аморфной массы фиолетового цвета с характерным запахом; размер частиц сохранен в нанодиапазоне рН 6,65. Включение не менее 80,0%. Количество примесей в липосомальном продукте на уровне исходной субстанции рифабутина. Массовое соотношение компонентов в препарате: Соотношение компонентов в препарате: рифабутин : фосфатидилхолин: трегалоза - (7:700:120). Полученные образцы хранят при температуре +4 С в течение 1 года. Установлена стабильность липосомальной формы рифабутина: размер частиц, степень включения рифабутина в липосомы, продукты деструкции липидов. Пример 5. Рифабутин в количестве 700 мг растворяли в 100 мл этанола. Фосфатидилхолин яичного желтка в количестве 1000 мг растворяли в 100 мл этанола. Этанольные растворы объединяли, фильтро-4 023080 вали через мембраны 0,22 мкм и концентрировали в вакууме на роторном испарителе при 37-40 С. Затем полученную липидную пленку обрабатывали газообразным азотом при перемешивании (60-80 об/мин) до полного удаления этанола. К липидной пленке, содержащей фосфатидилхолин и рифабутин добавляли 100 мл буферной смеси с рН 7,2, в которой находилось 2,8 трегалозы. Емкость с эмульсией перемешивали при 130-150 об/мин в до полного эмульгирования липидной пленки. Эмульсию переносили в гомогенизатор высокого давления и проводили гомогенизацию при температуре 38-43 С. Первоначальное давление (всего два цикла) составляло 500 атм. Затем продолжали гомогенизацию при 800 атм до размера частиц не более 150 нм. Эмульсию фильтровали через каскад фильтров, с финишным фильтром 0,2 мкм. Фильтрация проходила удовлетворительно: 100 мл фильтровали не более 10 мин. Размер частиц после стерилизующей фильтрации 143,4 нм - 100%. Включение после стерилизующей фильтрации 72,4%. Объем стерильной эмульсии 90 мл. Проводили розлив во флаконы и лиофилизацию. Флаконы герметизировали в атмосфере инертного газа (азота). По результатам контроля продукта, полученного по предлагаемому способу, после лиофилизации установлено, что препарат представлен в виде легкой аморфной массы фиолетового цвета с характерным запахом; размер частиц сохранен в нанодиапазоне рН 7,05. Включение не менее 70,0%. Количество примесей в липосомальном продукте на уровне исходной субстанции рифабутина. Массовое соотношение компонентов в препарате: Соотношение компонентов в препарате: рифабутин : фосфатидилхолин: трегалоза - (7:7:28). Полученные образцы хранят при температуре +4 С в течение 1 года. Установлена стабильность липосомальной формы рифабутина: размер частиц, степень включения рифабутина в липосомы, продукты деструкции липидов. Пример 6. Рифабутин в количестве 700 мг растворяли в 100 мл этанола. Фосфатидилхолин яичного желтка в количестве 600 мг растворяли в 100 мл этанола. Этанольные растворы объединяли, фильтровали через мембраны 0,22 мкм и концентрировали в вакууме на роторном испарителе при 37-40 С. Затем полученную липидную пленку обрабатывали газообразным азотом при перемешивании (60-80 об/мин) до полного удаления этанола. К липидной пленке, содержащей фосфатидилхолин и рифабутин добавляли 100 мл буферной смеси с рН 6,6, в которой находилось 10 трегалозы. Емкость с эмульсией перемешивали при 130-150 об/мин в до полного эмульгирования липидной пленки. Эмульсию переносили в гомогенизатор высокого давления и проводили гомогенизацию при температуре 38-43 С. Первоначальное давление (всего два цикла) составляло 500 атм. Затем продолжали гомогенизацию при 900 атм до размера частиц не более 130 нм. Эмульсию фильтровали через каскад фильтров с финишным фильтром 0,2 мкм. Фильтрация проходила не удовлетворительно: 100 мл фильтровали не более 20 мин. Размер частиц после стерилизующей фильтрации 118,4 нм - 100%. Включение после стерилизующей фильтрации 47,4%. Объем стерильной эмульсии 65,0 мл (потери за счет необходимости замены фильтров для отделения не включенного антибиотика). Проводили розлив во флаконы и лиофилизацию. Флаконы герметизировали в атмосфере инертного газа (азота). По результатам контроля продукта, полученного по предлагаемому способу, после лиофилизации установлено, что препарат представлен в виде легкой аморфной массы фиолетового цвета с характерным запахом; размер частиц сохранен в нанодиапазоне рН 6,55. Включение рифабутина не менее 48,0%. Количество примесей в липосомальном продукте на уровне исходной субстанции рифабутина. Массовое соотношение компонентов в препарате: соотношение компонентов в препарате: рифабутин : фосфатидилхолин : трегалоза - (7:5:100). Полученные образцы хранят при температуре +4 С в течение 1 года. Установлена стабильность липосомальной формы рифабутина: размер частиц, степень включения рифабутина в липосомы, продукты деструкции липидов. Как видно из приведенных ланных снижение в составе липосом фосфатидилхолина приводит к снижению включения рифабутина в липосомы, к трудностям при проведении стерилизующей фильтрации из-за присутствия в образцах свободного антибиотика. Пример 7. Рифабутин в количестве 700 мг растворяли в 100 мл этанола. Фосфатидилхолин яичного желтка в количестве 85000 мг растворяли в 200 мл этанола. Этанольные растворы объединяли, фильтровали через мембраны 0,22 мкм и концентрировали в вакууме на роторном испарителе при 37-40 С. Затем полученную липидную пленку обрабатывали газообразным азотом при перемешивании (60-80 об/мин) до полного удаления этанола. К липидной пленке, содержащей фосфатидилхолин и рифабутин добавляли 100 мл буферной смеси с рН 6,6, в которой находилось 10 трегалозы. Емкость с эмульсией перемешивали при 130-150 об/мин в до полного эмульгирования липидной пленки. Эмульсию переносили в гомогенизатор высокого давления и проводили гомогенизацию при температуре 38-43 С. Первоначальное давление (всего два цикла) составляло 500 атм. Затем продолжали гомогенизацию при 1000 атм до размера частиц не более 150 нм. При содержании в 1 мл эмульсии 800 мг фосфатидилхолина нам не удалось получить липосомы размером менее 400 нм. Эмульсию не удалось профильтровать через 0,22 мкм. Таким образом, увеличение соотношения рифабутин : фосфатидилхолин до 7 : 850 не позволило получить липосомы размером менее 200 нм. Пример 8. Рифабутин в количестве 700 мг растворяли в 100 мл этанола. Фосфатидилхолин яичного желтка в количестве 4000 мг растворяли в 100 мл этанола. Этанольные растворы объединяли, фильтровали через мембраны 0,22 мкм и концентрировали в вакууме на роторном испарителе при 37-40 С в течение 90 мин. Затем полученную липидную пленку обрабатывали газообразным азотом при перемешивании (60-80 об/мин) в течение 0,5 ч до полного удаления этанола. К липидной пленке, содержащей фосфатидилхолин и рифабутин добавляли 100 мл буферной смеси с рН 6,6, в которой находилось 2,0 г трегалозы. Емкость с эмульсией перемешивали при 130-150 об/мин в до полного эмульгирования липидной пленки. Эмульсию переносили в гомогенизатор высокого давления и проводили гомогенизацию при температуре 38-43 С. Первоначальное давление (всего два цикла) составляло 500 атм. Затем продолжали гомогенизацию при 900 атм до размера частиц не более 150 нм. Эмульсию фильтровали через каскад фильтров, с финишным фильтром 0,2 мкм. Фильтрация проходила удовлетворительно: 100 мл фильтровали не более 10 мин. Размер частиц после стерилизующей фильтрации 148,4 нм - 100%. Включение после стерилизующей фильтрации 79,4%. Объем стерильной эмульсии 90 мл. Проводили розлив во флаконы и лиофилизацию. Флаконы герметизировали в атмосфере инертного газа (азота). По результатам контроля продукта, полученного по предлагаемому способу, после лиофилизации установлено, что препарат представлен в виде легкой аморфной массы фиолетового цвета с характерным запахом; размер частиц сохранен в нанодиапазоне рН 6,65. Включение не менее 75,4%. Количество примесей в липосомальном продукте на уровне исходной субстанции рифабутина. Массовое соотношение компонентов в препарате: Соотношение компонентов в препарате: рифабутин : фосфатидилхолин: трегалоза - (7:40:20). Полученные образцы хранят при температуре +4 С в течение 1 года. Установлено, что после лиофилизации размер частиц значительно увеличился до 250 нм, обнаружено также нестабильность стабильность липосомальной формы рифабутина, что может быть сязано с уменьшением содержания в препарате криопоотектора лактозы. Пример 9. При исследовании фармакокинетики липосомального и нелипосомального рифабутина при однократном инъекционном введении крысам наблюдается его быстрое выведение из плазмы крови с максимальной концентрацией около 375 нг/мл, что согласуется с данными инструкции по медицинскому применению оригинального препарата рифабутина. Существенные различия наблюдались при определении рифабутина в печени крыс. Cmax для липосомальной формы составляла около 77,5 мкг/г (Tmax - 0,25 ч), для нелипосомальной - около 217 мкг/г(Tmax - 8 ч). Липосомальный рифабутин практически полностью выводился из печени к 72 ч, в отличие от нелипосомального, который сохраняется в печени к 72 ч после введения на уровне 173,6 мкг/г, причем наблюдается тенденция к его кумуляции. Для липосомальной лекарственной формы величина AUC(72) составила 183 мкгч/мл, период полувыведения - 11,1 ч, MRT - 16 ч. Для нелипосомальной лекарственной формы величина AUC(72) составила 9173 мкгч/мл. Также различия наблюдались для мозга - липосомальный рифабутин практически не проникал через ГЭБ и обнаруживался в небольших (до 1900 нг/г) не позднее 1,5 ч после введения. Нелипосомальный рифабутин обнаруживался в мозге крыс даже спустя 72 ч после введения в диапазоне концентраций 1600-7200 нг/г). Схожие фармакокинетические профили наблюдались для почек: для липосомального рифабутинаCmax составила около 118 мкг/г, для нелипосомального - 93 мкг/г (Tmax - 0,25 ч в обоих случаях). Для липосомальной лекарственной формы величина AUC(72) составила 210 мкгч/мл, период полувыведения 18,1 ч, MRT - 31,2 ч. Для нелипосомальной лекарственной формы величина AUC(72) составила 651 мкгч/мл. Аналогичная как и для почек картина наблюдалась и для сердца. Для липосомального рифабутинаCmax составила около 56 мкг/г, для нелипосомального - 34,1 мкг/г (Tmax - 0,25 ч в обоих случаях). Для липосомальной лекарственной формы величина AUC(72) составила 487 мкгч/мл, период полувыведения 27,4 ч, MRT - 36,9 ч. Для нелипосомальной лекарственной формы величина AUC(72) составила 700 мкгч/мл, период полувыведения - 19,9 ч, MRT - 46,4 ч. Таким образом, в связи с низким проникновением липосомального рифабутина в печень и мозг,можно предположить о его потенциально низкой гепатотоксичности и нейротоксичности. Подытоживая, полученные результаты исследований свидетельствуют о том, что продукт, полученный согласно заявленному способу - гомогенизация в два цикла: первоначально при 500 атм и последующая при 800-900 атм до указанного размера; и соотношение компонентов в итоговом препарате: рифабутин : фосфолипиды : трегалоза - 7 : (10,0-700,0) : (28-120) (см. примеры 1-5), обеспечивают стабильность композиции липосом с включенным в них рифабутином и обладают низкой гепатотоксичностью и нейротоксичностью. Воспроизведение заявленного способа при изменении параметров влечет трудности в реализации собственно способа и снижение качества целевого продукта, а именно увеличение размера и неоднородность дисперсионного состава липосом (пример 7); уменьшение включения рифабутина в липосомы и нестабильность размеров липосом (пример 6); существенное увеличение времени стерилизующей фильтрации или невозможность фильтрации липосомальной эмульсии (пример 6); нестабильность липосом после лиофилизации (пример 8). Методом высокоэффективной жидкостной хроматографии было проведено изучение стабильности рифабутина после лиофилизации образцов липосом по сравнению с исходной субстанцией. Подтверждена идентичность качественного и количественного состава рифабутина после высушивания и последующей регидратации образцов липосом. Содержание примесей и время их удерживания не изменились, что может свидетельствовать о стабильности рифабутина в процессе получения липосом и их последующего сублимационного высушивания. Таким образом, использование наночастиц, представляющих собой искусственные мембраны - липосомы, нагруженные рифабутином, представляют несомненный интерес для дальнейшего изучения. ФОРМУЛА ИЗОБРЕТЕНИЯ Способ получения липосомального препарата, включающий создание композиции фосфолипидов и рифабутина, высушивание смеси, е эмульгирование в водной среде, диспергирование эмульсии, гомогенизацию, дробное добавление криопротектора, стерилизующую фильтрацию и лиофильное высушивание, при этом гомогенизацию проводят по меньшей мере в два этапа: первоначальный при 500 атм, последующий при 800-1000 атм, добавление криопротектора трегалозы проводят первоначально при эмульгировании, а затем в процессе или после гомогенизации, при этом массовое соотношение компонентов в полученном препарате рифабутин : фосфолипиды : криопротектор находится в пределах 7:(10,0-700,0):(28-120) соответственно, а в качестве фосфолипида используют фосфатидилхолин или смесь фосфатидилхолина и отрицательно заряженного фосфолипида (дифосфатидилглицерина или фосфатидилглицерина) в соотношении 1:1.
МПК / Метки
МПК: A61K 9/127, A61K 47/24, A61K 31/496, A61K 47/26, A61P 31/06
Метки: ингаляционной, рифабутина, формы, получения, способ, липосомальной
Код ссылки
<a href="https://eas.patents.su/9-23080-sposob-polucheniya-ingalyacionnojj-liposomalnojj-formy-rifabutina.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения ингаляционной липосомальной формы рифабутина</a>
Предыдущий патент: Способ получения липосомальной формы иринотекана (варианты)
Следующий патент: Инъекционная лекарственная форма флупиртина
Случайный патент: Исполнительный механизм газового клапана